SINTESIS MONOBENZIL KRISIN DARI FLOROGLUSINOL
MELALUI ZAT ANTARA KALKON PINOSEMBRIN
SEBAGAI PREKURSOR KRISIN
MUHAMAD ALIF HAMIMDAL
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis Monobenzil Krisin dari Floroglusinol melalui Zat Antara Kalkon Pinosembrin sebagai Prekursor Krisin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
MUHAMAD ALIF HAMIMDAL. Sintesis Monobenzil Krisin dari Floroglusinol melalui Zat Antara Kalkon Pinosembrin sebagai Prekursor Krisin. Dibimbing oleh PURWANTININGSIH SUGITA dan BUDI ARIFIN.
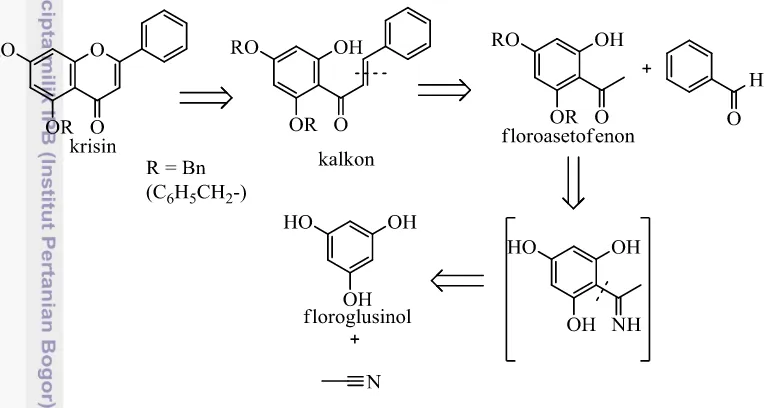
Dalam penelitian ini, monobenzil krisin (7-benziloksi-5-hidroksiflavon) telah berhasil disintesis dari bahan awal floroglusinol melalui siklisasi oksidatif kalkon pinosembrin. Tahapan sintesis diawali dengan asetilasi floroglusinol dan benzilasi floroasetofenon menggunakan 2 ekuivalen benzil bromida selama 24 jam. Rendemen kedua tahap tersebut berturut-turut adalah 70% dan 21%.
Kondensasi produk 4’,6’-bisbenziloksi-2’-hidroksiasetofenon dengan benzaldehida membentuk kalkon terlindung-benzil yang kemudian disiklisasi oksidatif dengan 1 ekuivalen I2 dalam dimetil sulfoksida. Dihasilkan campuran produk, yang 9% di antaranya adalah monobenzil krisin berdasarkan hasil pencirian spektrum resonans magnet inti proton. Rendemen keseluruhan produk ini hanya 1% dari floroglusinol. Optimalisasi waktu benzilasi dan ekuivalen I2 yang digunakan perlu diteliti lebih lanjut untuk meningkatkan rendemen, sebelum dilakukan deproteksi menjadi krisin.
Kata kunci: flavonoid, flavon, kalkon, krisin
ABSTRACT
MUHAMAD ALIF HAMIMDAL. Synthesis of Monobenzyl Chrysin from Phloroglucinol Through Pinocembrin Chalcone Intermediate as a Precursor of Chrysin. Supervised by PURWANTININGSIH SUGITA and BUDI ARIFIN.
In this experiment, monobenzyl chrysin (7-benzyloxy5-hydroxyflavone) was synthesized from phloroglucinol as its starting material through oxidative cyclization route of pinocembrin chalcone. The synthesis was started with acetylation of phloroglucinol and benzylation of phloroacetophenone using 2 equivalents of benzyl bromide for 24 hours. The yield of those two steps were 70% and 21%, respectively. The condensation of 4’,6’-benzyloxy-2’ -hydroxyacetophenone obtained with benzaldehyde produced a benzyl-protected chalcone which is then cyclisized oxidatively with 1 equivalent of I2 in dimethyl sulfoxide. About 9% of the product of this reaction was a monobenzyl chrysin according to characterization using proton nuclear magnetic resonance spectrum. The overall yield of this product was 1% with respect to phloroglucinol. The optimization of benzylation time of reaction and amount of added I2 should be studied further in order to increase the yield before the benzyl deprotection process conducted.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
SINTESIS MONOBENZIL KRISIN DARI FLOROGLUSINOL
MELALUI ZAT ANTARA KALKON PINOSEMBRIN
SEBAGAI PREKURSOR KRISIN
MUHAMAD ALIF HAMIMDAL
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi: Sintesis Monobenzil Krisin dari Floroglusinol melalui Zat Antara Kalkon Pinosembrin Sebagai Prekursor Krisin
Nama : Muhamad Alif Hamimdal NIM : G44100088
Disetujui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Pembimbing I
Budi Arifin, SSi, MSi Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Alhamdulillaahirabbil’alamiin. Puji dan syukur penulis panjatkan kepada
Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Sintesis flavonoid dipilih sebagai tema dalam penelitian yang Sintesis Monobenzil Krisin dari Floroglusinol melalui Zat Antara Kalkon Pinosembrin sebagai Prekursor Krisin.
Penulis mengucapkan terima kasih kepada Ibu Purwantiningsih Sugita dan Bapak Budi Arifin selaku pembimbing, serta Bapak Sabur yang telah banyak memberi saran dalam melaksanakan penelitian ini. Di samping itu, penulis menyampaikan terima kasih kepada Ihsan Anggara, Dicky Annas, Ferra Dwiangga Noviadinni, Ika Nurmeilia, Hasna Tazkia Nikmawahda, Kak Febrina Miharti, Kak Ichsan Irwanto, Kak Luthfan Irfana, teman-teman, kakak-kakak dari Laboratorium Kimia Organik, serta rekan-rekan Activator Chemists 47 yang mendampingi penulis dalam mengerjakan penelitian ini. Ungkapan terima kasih juga disampaikan kepada Ayah, Ibu, Alinnindya, serta seluruh keluarga atas segala doa, dukungan, dan kasih sayangnya sehingga penelitian ini dapat diselesaikan.
Semoga karya ilmiah ini dapat memberikan manfaat bagi penulis maupun pembaca.
ii
DAFTAR ISI
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
BAHAN DAN METODE 3
Bahan dan Alat 3
Langkah Kerja 3
HASIL DAN PEMBAHASAN 5
Floroasetofenon 5
4’,6’-Bisbenziloksifloroasetofenon 6
Kalkon Pinosembrin (4’,6’-Bisbenziloksi-2’-Hidroksikalkon) 7
Monobenzil Krisin 10
SIMPULAN DAN SARAN 14
iii
DAFTAR GAMBAR
1 Struktur krisin 1
2 Analisis retrosintetik krisin terbenzilasi melalui rute siklisasi oksidatif 2 3 Endapan produk floroasetofenon (a) dan kromatogramnya (p)
dibandingkan dengan floroasetofenon hasil sintesis Utami (2012) (s). Eluen n-heksana-etil asetat 8:3, diamati pada 254 nm (b). 5
4 Tahapan reaksi Houben-Hoesch 5
5 4’,6’-Bisbenziloksi-2’-hidroksifloroasetofenon hasil sintesis Miharti (2013) (a), hasil penelitian ini (b), dan kromatogram produk kasar benzilasi floroasetofenon hasil penelitian ini (hs) dibandingkan
dengan 4’,6’-bisbenziloksi-2’-hidroksifloroasetofenon Miharti (2013) (s). Eluen n-heksana-DCM 1:2, diamati pada 254 nm (c) 6 6 Mekanisme reaksi Claisen-Schmidt antara 4’,6’-bisbenziloksi-2’
-hidroksiasetofenon terbenzilasi dan benzaldehida 8 7 Endapan 4’,6’-bisbenziloksi-2’-hidroksikalkon hasil sintesis (a),
kromatogramnya (k) dibandingkan dengan bahan awal (4’,6’ -bisbenziloksi-2’-hidroksifloroasetofenon) (d), diamati pada 254 nm
(a) dan 366 nm (b) 9
8 Endapan hasil siklisasi oksidatif (a) dan kromatogramnya pada eluen
DCM, diamati di bawah lampu UV 254 nm (b) 10
9 Kerangka struktur benziloksi-5'-hidroksiflavon (R = H) dan
4'-benziloksi-5'-hidroksiflavonol (R = -OH) 12
10 Mekanisme siklisasi 4',6'-bisbenziloksikalkon menjadi dibenzil krisin dan deproteksi gugus benzil di posisi orto menjadi monobenzil krisin 13
DAFTAR LAMPIRAN
1 Bagan alir penelitian 17
2 Rangkaian radas sintesis floroasetofenon metode Utami (2012) 18
3 Perhitungan rendemen sintesis 18
4 Elusidasi struktur senyawa Rf ~0.70 hasil siklisasi 4’,6’
-bisbenziloksi-2’-hidroksikalkon dengan I2-DMSO 21
5 Elusidasi struktur senyawa Rf ~0.73 hasil siklisasi 4’,6’-bisbenziloksi-2’
PENDAHULUAN
Flavonoid adalah suatu golongan senyawa metabolit sekunder tumbuhan yang dapat ditemukan di bagian daun, batang, dan bunga. Senyawa ini dicirikan dengan 2 gugus aril yang dihubungkan oleh rantai 3 atom karbon (Cushnie dan Lamb 2005). Senyawa flavonoid pada tumbuhan memiliki banyak kegunaan, antara lain berfungsi sebagai antioksidan yang mampu menyerap radiasi sinar ultraviolet (UV) serta menangkal radikal bebas yang berbahaya bagi kesehatan manusia (Mendes et al. 2012; Al-Busafi 2013).
Krisin (5,7-dihidroksi-2-fenil-4H-kromen-4-on) (Gambar 1) dan turunannya merupakan salah satu senyawa flavon sederhana yang banyak diteliti. Beberapa manfaat krisin dan turunannya yang telah dilaporkan di antaranya adalah sebagai antimikrob (Cushnie dan Lamb 2005; Murthy et al. 2010), antikanker (Fu et al. 2007; Khoo et al. 2010), antioksidan (Al-Busafi 2013), antiradang (Do et al. 2009; Theja et al. 2011), dan antikarsinogenik (Stapel et al.2013).
Gambar 1 Struktur krisin
Krisin telah diisolasi dari bahan alam, di antaranya dari tanaman Calycotome villosa dalam bentuk terikat gula dengan rendemen total 1.05% (El Antri et al. 2004), dari propolis dengan rendemen kering 2.3% (Markiewicz-Zukowka et al. 2012), tanaman Cytisus multiflorus dengan rendemen krisin terikat gula dari tanaman kering 1.59% (Pereira et al. 2012), serta Potentilla evestita dengan rendemen 6.6×10-4% (Rauf et al. 2013). Isolasi krisin tersebut menghasilkan rendemen yang relatif rendah. Oleh karena itu, pendekatan sintesis dikembangkan agar krisin dapat diperoleh dengan jumlah yang lebih memadai sehingga pemanfaatannya dapat diperluas. Keberhasilan sintesis krisin juga dapat menjadi acuan untuk sintesis kombinatorial flavon lainnya yang lebih tersubstitusi atau untuk merancang modifikasi lain turunan krisin sintetik dengan bioaktivitas yang lebih tinggi.
2
yang diperoleh selalu bercampur dengan pengotor dan belum dapat dipisahkan dengan berbagai eluen.
Pendekatan lain untuk sintesis flavon ialah melalui siklisasi oksidatif 2’ -hidroksikalkon. Pereaksi I2 dalam dimetil sulfoksida adalah yang paling banyak digunakan, seperti telah dilaporkan oleh Ghodile et al. (2012) untuk menyintesis turunan senyawa 2-hidroksikalkon bersifat antibakteri dari 2’-hidroksiasetofenon (rendemen akhir 49%), dan Susanti et al. (2014) untuk menyintesis 5-hidroksi-3',4'-dimetoksiflavon dari bahan dasar 2’,4’-dihidroksiasetofenon dengan metode grinding (rendemen akhir 43%). Selain itu, beeberapa pereaksi alternatif juga telah dilaporkan seperti NH4I sebagai pengganti I2 dengan rendemen akhir 81% (Kulkarni 2013).
Gambar 2 Analisis retrosintetik krisin terbenzilasi melalui rute siklisasi oksidatif Penelitian ini bertujuan menyintesis krisin terbenzilasi dari floroglusinol, sebagai prekursor krisin. Jalur siklisasi oksidatif kalkon pinosembrin digunakan dengan analisis retrosintetik seperti yang ditunjukkan oleh Gambar 2. Krisin terbenzilasi didapat dari siklisasi kalkon pinosembrin (2’,4’,6’-trihidroksikalkon) terbenzilasi, yang merupakan produk reaksi kondensasi aldol-silang antara floroasetofenon terlbenzilasi dan benzaldehida. Floroasetofenon lebih lanjut diperoleh dari reaksi Hoeben-Hoesch antara floroglusinol dan asetonitril dalam suasana asam. Secara alamiah, tumbuhan juga menyintesis turunan flavonoid melalui senyawa antara kalkon (Saito et al. 2013).
3
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan bermutu p.a. yang digunakan adalah floroglusinol, dietil eter, NaCl, ZnCl2, K2CO3, H2SO4 95–97%, asetonitril, I2, DMSO, KOH, piridina kering (kadar air <0.0075%), asam asetat glasial, metanol, dan etanol. Digunakan pula akuades, gas N2, serta beberapa pelarut organik teknis, yaitu diklorometana (DCM), etil asetat, n-heksana, dan aseton yang telah didistilasi sebanyak 2 kali.
Peralatan yang digunakan pada penelitian ini antara lain spektrofotometer ultraviolet-tampak (UV-Vis) Shimadzu UV-1601 di Laboratorium Bersama, Departemen Kimia IPB, radas distilasi, dan radas penentuan titik leleh Mel Temp Model 1202D Barnstead® (tanpa koreksi). Digunakan pula spektrometer resonans magnet inti (NMR) JEOL ECA 500 yang dioperasikan pada frekuensi 500 MHz (1H) di Pusat Penelitian Kimia LIPI, Pusat Penelitian Ilmu Pengetahuan dan Teknologi (Puspiptek), Serpong.
Langkah Kerja
Penelitian ini dilaksanakan di Laboratorium Kimia Organik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor dari bulan Januari hingga Agustus 2014. Pekerjaan dibagi menjadi beberapa tahap sesuai dengan diagram alir pada Lampiran 1, yaitu (1) sintesis floroasetofenon dari floroglusinol (Utami 2012), (2) benzilasi floroasetofenon (modifikasi Miharti 2013), (3) kondensasi floroasetofenon terbenzilasi dengan benzaldehida menjadi kalkon pinosembrin (Maftuhah 2013), dan (4) siklisasi kalkon tersebut menjadi monobenzil krisin menurut modifikasi Vibhute et al. (2010) dan Ghodile et al. (2012). Beberapa produk siklisasi yang diperoleh dicirikan dengan menggunakan titik leleh, spektrum UV-Vis dan NMR.
Sintesis Floroasetofenon dari Floroglusinol (Utami 2012)
Radas sintesis dirangkai seperti ditunjukkan pada Lampiran 2. Sebanyak 5 mmol floroglusinol (telah dioven pada suhu 120 ºC selama 24 jam), 3 mL dietil eter, 1 mmol ZnCl2, dan 10 mmol asetonitril dimasukkan ke dalam labu leher 3. Sementara itu, labu leher 2 diisi dengan 1.5 g NaCl, dan corong pisah diisi dengan 30 mL H2SO4 pekat dalam keadaan cerat tertutup. Sebelum cerat dibuka, udara di dalam rangkaian dijenuhkan dengan gas N2. Reaksi dimulai saat cerat dibuka dan dibiarkan selama 2 jam. Selama reaksi berlangsung, isi kedua labu diaduk dengan pengaduk magnetik dan suhu labu leher 3 dijaga tetap di bawah 5 ºC hingga reaksi dihentikan. Setelah 2 jam, labu leher 3 ditutup dengan parafilm dan didiamkan di dalam freezer selama semalam. Setelah itu, labu leher 3 dirangkaikan kembali, lalu dialiri gas HCl seperti prosedur sebelumnya selama 2 jam. Labu kemudian didiamkan di dalam freezer selama 3 hari.
4
akuades panas dan dipindahkan ke labu bulat secara kuantitatif dan direfluks selama 2 jam. Setelah 2 jam, isi labu disaring gravitasi panas-panas, filtratnya dikumpulkan, dan didiamkan selama semalam. Endapan yang terbentuk disaring sambil dibilas air dingin, kemudian dikeringkan dalam oven bersuhu 70 °C. Terbentuknya floroasetofenon dikonfirmasi dengan kromatografi lapis tipis (KLT) berdasarkan kesamaan nilai Rfdengan hasil sintesis Utami (2012).
Benzilasi Floroasetofenon Modifikasi Miharti (2013)
Ke dalam labu leher 2 dimasukkan 2 mmol floroasetofenon, 4 mmol K2CO3, dan 5 mL DMF. Campuran tersebut diaduk dengan pengaduk magnetik, lalu gas nitrogen mulai dialirkan. Dua mmol benzil bromida ditambahkan dan reaksi dijalankan pada suhu 90–93 ºC dengan atmosfer gas nitrogen selama 24 jam. Ke dalam campuran hasil reaksi ditambahkan 10 mL akuades dingin tetes demi tetes, lalu diatur pH-nya menjadi 4 dengan cara menambahkan HCl pekat tetes demi tetes. Campuran kemudian direfluks selama 1 jam pada suhu 60–70 °C dan diekstraksi dengan diklorometana hingga semua produk terekstraksi (dipantau dengan KLT). Fase organik dikeringkan dengan Na2SO4 anhidrat dan dipekatkan dengan penguap putar. Hasil pemekatan dimurnikan dengan kromatografi kolom menggunakan elusi gradien dengan eluen n-heksana hingga DCM. Produk 4’,6’ -bisbenziloksi-2’-hidroksiasetofenon yang terbentuk dikonfirmasi dari kesamaan nilai Rf dengan hasil sintesis Miharti (2013). Eluat yang hanya mengandung produk tersebut dikumpulkan dan eluat yang mengandung campuran produk tersebut dengan noda lain dimurnikan lebih lanjut dengan KLT preparatif.
Kondensasi 4’,6’-Bisbenziloksi-2’-hidroksiasetofenon dengan Benzaldehida (modifikasi Maftuhah 2013)
Ke dalam gelas piala dimasukkan 2.5 mmol 4’,6’-bisbenziloksi-2’ -hidroksiasetofenon dan 10 mL etanol, lalu diaduk selama 5 menit. Kemudian dimasukkan benzaldehida sebanyak 2.5 mmol dan campuran kembali diaduk. Setelah itu, dimasukkan KOH 60% (b/v) tetes demi tetes hingga 6 mL sambil diaduk pada suhu 0 °C, lalu dilanjutkan selama 24 jam pada suhu kamar. Campuran hasil reaksi dituang ke dalam wadah berisi 10 mL air dingin dan ditambahkan HCl 1 N hingga pH 4. Padatan kuning yang terbentuk disaring dan dikeringkan dalam oven bersuhu 40 °C dengan sirkulasi udara.
Siklisasi 4’,6’-Bisbenziloksi-2’-hidroksikalkon Menjadi Krisin Terbenzilasi (modifikasi Vibhute et al. 2010 dan Ghodile et al. 2012)
5
HASIL DAN PEMBAHASAN
Floroasetofenon
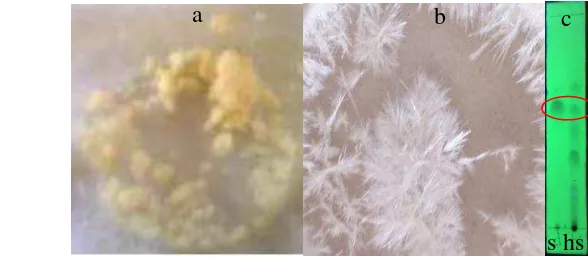
Sintesis krisin diawali dengan pembentukan floroasetofenon melalui asetilasi floroglusinol. Metode Houben-Hoesch digunakan sesuai dengan prosedur yang dilaporkan oleh Utami (2012). Rendemen yang diperoleh adalah 73% dari 50 mmol floroglusinol (Lampiran 3a). Floroasetofenon yang didapat berupa endapan berwarna kuning pucat dengan titik leleh 218–220 °C (Gambar 3a). Nilai titik leleh ini sama dengan hasil sintesis Utami (2012) dan tidak berbeda jauh dengan hasil sintesis Miharti (2013) (217–218 °C). Nilai Rf floroasetofenon yang didapat sekitar 0.75 dengan eluen n-heksana-etil asetat 8:3 (Gambar 3b). Gambar 3 menunjukkan wujud endapan floroasetofenon yang terbentuk serta kromatogram KLT yang membandingkan hasil sintesis ini dengan hasil sintesis Utami (2012).
Gambar 3 Endapan produk floroasetofenon (a) dan kromatogramnya (p) dibandingkan dengan floroasetofenon hasil sintesis Utami (2012) (s). Eluen n-heksana-etil asetat 8:3, diamati pada 254 nm (b).
Metode Houben-Hoesch merupakan asilasi Friedel-Crafts secara taklangsung. Floroasetofenon direaksikan dengan asetonitril yang dengan bantuan ZnCl2 dan HCl akan membentuk garam ketimina klorida. Garam ini kemudian dihidrolisis sehingga gugus imina akan berubah menjadi karbonil (Gulati et al. 1943). Tahapan reaksi ini dapat dilihat pada Gambar 4.
Gambar 4 Tahapan reaksi Houben-Hoesch
a b
6
4’,6’-Bisbenziloksifloroasetofenon
Benzilasi floroasetofenon dilakukan dengan pendekatan substitusi nukleofilik bimolekular (SN2) mengikuti metode Miharti (2013) yang dimodifikasi. Hasil sintesis kasar memiliki pola noda serupa dengan yang dilaporkan oleh Miharti (2013). Noda dengan Rf ~0.73 diduga 4’,6’
-bisbenziloksi-2’-hidroksiasetofenon (Gambar 5c). Noda lain di atasnya (Rf ~0.75) telah dilaporkan sebagai pengotor, sedangkan produk monobenzilasi, yaitu 4’ -benziloksi-2,6-dihidroksiasetofenon merupakan salah satu noda yang tetap di garis awal (Miharti 2013). Noda-noda lainnya yang belum diidentifikasi diduga adalah produk tribenzilasi (2’,4’,6’-tribenziloksiasetofenon), benzil alkohol, atau produk benzilasi pada karbon aromatik. Benzilasi pada karbon aromatik mungkin terjadi karena cincin benzena sangat teraktifkan oleh keberadaan 3 gugus –OH yang merupakan donor elektron. Pemisahan produk dibenzilasi dari produk samping atau pengotor tersebut menjadi kendala utama yang dijumpai dalam upaya menyintesis krisin pada penelitian ini.
Gambar 5 4’,6’-Bisbenziloksi-2’-hidroksifloroasetofenon hasil sintesis Miharti (2013) (a), hasil penelitian ini (b), dan kromatogram produk kasar benzilasi floroasetofenon hasil penelitian ini (hs) dibandingkan
dengan 4’,6’-bisbenziloksi-2’-hidroksifloroasetofenon Miharti (2013) (s). Eluen n-heksana-DCM 1:2, diamati pada 254 nm (c)
Berbeda dari pekerjaan Miharti (2013), teknik kromatografi kolom digunakan menggantikan teknik KLT preparatif untuk memurnikan produk dibenzilasi. Miharti (2013) memperoleh 4’,6’-dibenziloksi-2’-hidroksiasetofenon berupa endapan kuning (Gambar 5a) dan belum berhasil melakukan kondensasi Claisen-Schmidt produk tersebut dengan 3,4-bisbenziloksibenzaldehida dalam upayanya menyintesis kuersetin. Zhang et al. (2013) melaporkan bahwa senyawa
4’,6’-bisbenziloksi-2’-hidroksiasetofenon berbentuk kristal putih serupa dengan hasil penelitian ini (Gambar 5b).
Elusi gradien dari n-heksana hingga DCM berhasil mendapatkan produk dibenzilasi pada elusi dengan eluen n-heksana-DCM 8:2. Eluen ini mengelusi hanya 2 noda teratas (Rf ~0.75 dan Rf ~0.73) dan menahan noda-noda di bawahnya. Eluat mulai mengandung 4’,6’-bisbenziloksi-2’-hidroksiasetofenon setelah sebanyak 1.6471 g produk kasar dielusi berturut-turut dengan 200 mL n -heksana, 200 mL n-heksana-DCM 9:1, dan 2.4 L n-heksana-DCM 8:2. Awalnya, produk ini masih sedikit bercampur dengan noda pengotor di atasnya. Produk
s hs
7
murni mulai terelusi pada 100 mL n-heksana-DCM 8:2 ke-26. Pada 100 mL n -heksana-DCM 8:2 ke-58, produk tersebut mulai bercampur dengan noda-noda pengotor di bawahnya sehingga dibilas dengan eluen DCM. Fraksi yang mengandung 4’,6’-bisbenziloksi-2’-asetofenon murni diperoleh sebanyak 19%. Dari fraksi campuran, tambahan 2% diperoleh setelah pemurnian lebih lanjut dengan KLT preparatif.
4’,6’-Bisbenziloksi-2’-hidroksiasetofenon teramati hanya sedikit larut dalam n-heksana. Sifat ini dimanfaatkan untuk membersihkan kristal yang masih bercampur dengan noda Rf ~0.75. Setelah ditambahkan sedikit n-heksana, kristal putih hanya menunjukkan 1 noda dengan Rf ~0.73, sedangkan n-heksana hasil bilasan menunjukkan 2 noda dengan noda Rf ~0.73 yang makin berkurang pendarannya seiring dengan pengulangan proses pencucian.
Tsukayama et al. (1989) melaporkan metode pemurnian kristal 4’,6’ -bisbenziloksi-2’-hidroksiasetofenon dengan cara rekristalisasi menggunakan aseton-metanol. Dalam penelitian ini, menambahkan aseton pada hasil sintesis kasar yang telah dipekatkan memunculkan endapan putih. Analisis dengan KLT masih menunjukkan noda dengan Rf ~0.75 selain produk 4’,6’-bisbenziloksi-2’ -hidroksiasetofenon, sehingga masih perlu dipisahkan lebih lanjut. Sebagian produk dibenzilasi juga masih tertinggal dalam filtrat, sehingga perlu diekstraksi kembali dengan DCM dan dipisahkan. Oleh karena itu, metode rekristalisasi didapati belum efektif untuk pemisahan produk dibenzilasi dalam penelitian ini. Zhang et al. (2013) memurnikan hasil sintesis 4’,6’-bisbenziloksi-2’ -hidroksiasetofenon juga dengan teknik kromatografi kolom sebanyak 2 kali, yaitu dengan eluen DCM, kemudian dengan eluen n-heptana-DCM 1:1.
Dari seluruh rangkaian proses pemurnian, diperoleh rendemen keseluruhan produk dibenzilasi sebesar 21% (Lampiran 3b). Hasil ini lebih rendah daripada rendemen yang dilaporkan oleh Miharti (2013), yaitu 48%. Titik lelehnya 98–100 °C, sedikit di bawah hasil yang dilaporkan Miharti (2013) (105–107 °C) dan Zhang et al. (2013) (103–105 °C). Optimalisasi waktu reaksi dibenzilasi masih diperlukan guna mengurangi terbentuknya produk samping akibat reaksi yang terlalu lama. Demikian pula, prosedur pemurnian yang lebih efisien dari segi waktu kerja masih perlu diteliti.
Kalkon Pinosembrin (4’,6’-Bisbenziloksi-2’-Hidroksikalkon)
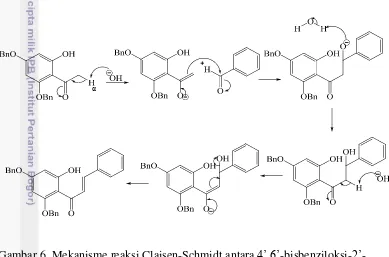
Pembentukan kalkon berlangsung melalui reaksi kondensasi Claisen-Schmidt antara 4’,6’-bisbenziloksi-2’-hidroksiasetofenon dan benzaldehida, yang menghasilkan suatu sistem α,β-takjenuh. Basa kuat diperlukan agar proton-α pada gugus asetil dapat dilepaskan, sehingga terbentuk ion enolat yang akan mengadisi gugus karbonil benzaldehida (Gambar 6). Dalam penelitian ini, digunakan larutan KOH 60% (b/v) seperti yang digunakan oleh Elsa (2012) untuk menyintesis 2’ -hidroksikalkon dan Maftuhah (2013) untuk menyintesis 4’
8
KOH dengan konsentrasi lebih rendah (50%) telah dilaporkan penggunaannya oleh Zangade et al. (2010) dan menghasilkan kalkon dengan rendemen ~79%. Susanti et al. (2014) menggunakan metode grinding dengan konsentrasi KOH 10% dengan rendemen 70%. Gugus –OH bebas yang tidak terlindungi benzil diduga tidak bereaksi dengan basa kuat karena membentuk ikatan hidrogen dengan gugus karbonil. Ikatan hidrogen tersebut juga menyebabkan atom oksigen karbonil menjadi bermuatan parsial positif, sehingga tarikan-elektron atom oksigen tersebut pada proton-α menguat, yang pada akhirnya akan meningkatkan keasaman proton-α tersebut. Oleh karena itu, basa kuat dengan konsentrasi lebih rendah masih mungkin digunakan dalam sintesis ini.
Gambar 6 Mekanisme reaksi Claisen-Schmidt antara 4’,6’-bisbenziloksi-2’ -hidroksiasetofenon terbenzilasi dan benzaldehida
Setelah reaksi dihentikan dan campuran diasamkan hingga pH 4, terbentuk endapan kuning (Gambar 7a). Analisis KLT dengan eluen n-heksana-DCM 1:2 menghasilkan 2 noda. Noda pertama memiliki nilai Rf ~0.73, yang berpendar pada panjang gelombang 366 dan 254 nm, dan noda kedua dengan Rf ~0.35, berpendar pada panjang gelombang 366 nm. Nilai Rf noda pertama sejajar dengan bahan awal, tetapi bahan awal tidak berpendar pada 366 nm (Gambar 7b dan 7c). Pendaran kalkon pada 254 dan 366 nm juga dilaporkan oleh Elsa (2012) dan Maftuhah (2013). Oleh karena itu, produk kalkon diyakini telah terbentuk dalam penelitian ini, tetapi belum dapat dipastikan apakah sisa bahan awal masih bercampur dengan produk tersebut. Upaya pemurnian lebih lanjut tidak dilakukan pada tahap ini, karena belum diperoleh kombinasi eluen n-heksana, DCM, dan etil asetat yang dapat membedakan Rf kalkon dengan bahan awal.
9
Gambar 7 Endapan 4’,6’-bisbenziloksi-2’-hidroksikalkon hasil sintesis (a), kromatogramnya (k) dibandingkan dengan bahan awal (4’,6’ -bisbenziloksi-2’-hidroksifloroasetofenon) (d), diamati pada 254 nm (a) dan 366 nm (b)
Gugus pelindung benzil berperan cukup signifikan dalam mengurangi produk samping pada sintesis kalkon. Hal ini tercermin dari jumlah noda hasil sintesis yang lebih sedikit daripada yang dilaporkan oleh Elsa (2012) dan Maftuhah (2013). Sintesis 2’-hidroksikalkon dari 2’-hidroksiasetofenon oleh Elsa (2012) menghasilkan lebih dari 5 noda. Sementara itu, Maftuhah (2013) melaporkan bahwa 2’-hidroksikalkon hasil sintesis dari bahan awal 2’,4’ -dihidroksiasetofenon dengan gugus hidroksil di C-4’ terlindungi oleh gugus tetrahidropiranil (THP) mengandung 3 noda. Kalkon tersebut tidak stabil ketika disimpan beberapa hari, yang diduga karena gugus pelindung THP tidak tahan asam dan tidak stabil selama penyimpanan.
Gugus pelindung benzil umumnya bersifat lembam terhadap kondisi asam maupun basa. Deproteksi gugus benzil lazim dilakukan dengan hidrogenasi berkataliskan paladium baik dengan secara langsung mengalirkan gas H2 (Schelhaas dan Waldmann 1996) atau dengan membentuk gas H2 secara in situ, misalnya dengan menambahkan 1,4-sikloheksadiena (Yoo et al. 2005). Akan tetapi, beberapa penelitian juga menyebutkan kemungkinan deproteksi gugus benzil dengan asam berkonsentrasi tinggi. Menurut Malik et al. (2011), deproteksi gugus benzil dapat terjadi dengan menggunakan HCl 32%. Oleh karena itu, pada kondisi basa kuat (KOH 60% (b/v)) selama reaksi sintesis kalkon maupun dengan konsentrasi HCl yang rendah (1 N) dalam tahap work up, peluang terlepasnya gugus benzil sangat rendah.
Penggunaan gugus pelindung benzil dalam sintesis flavonoid lainnya telah dilaporkan oleh Zhang et al. (2013), tetapi belum sebanyak pemakaian gugus pelindung metil (Zheng et al. 2003) atau metoksimetil (MOM) (Hossain 1999). Gugus pelindung metil tidak digunakan dalam penelitian ini karena pereaksi metil iodida maupun dimetil sulfat yang lazim digunakan untuk metilasi, sulit didapatkan secara komersial di Indonesia. Sementara itu, gugus pelindung MOM tidak dipilih karena diduga bersifat karsinogenik.
Pada saat reaksi berlangsung, campuran berwarna jingga. Setelah dinetralkan, warna campuran berubah menjadi kuning cerah. Perubahan warna ini terjadi sebagai akibat dari perubahan pH campuran. Selama reaksi, campuran berada dalam suasana basa, sehingga gugus –OH fenolik yang tidak terlindungi oleh benzil akan terdeprotonasi membentuk ion fenolat. Pasangan elektron bebas
d k d k
10
pada atom O dalam ion ini lebih mudah beresonans ke dalam cincin aromatik daripada dalam molekul fenol, sehingga terjadi pergeseran batokromik. Setelah dinetralkan, gugus –OH fenolik terbentuk kembali, dan warna yang tampak adalah kuning sebagai akibat dari pergeseran hipsokromik.
Monobenzil Krisin
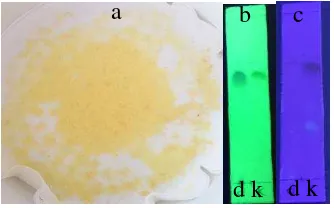
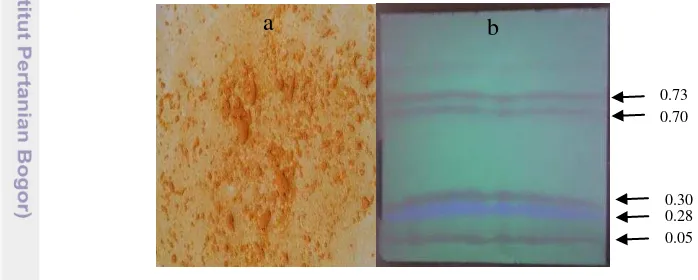
Campuran produk kalkon terbenzilasi selanjutnya disiklisasi oksidatif dengan menggunakan 1 ekuivalen I2 dalam pelarut DMSO pada suhu 140 °C. Produk reaksi berupa cairan kental berwarna jingga, yang diduga berasal dari sisa I2. Endapan halus terbentuk ketika ditambahkan akuades dingin, lalu ketika ditambahkan Na2S2O3 20% tetes demi tetes, perlahan-lahan warna jingga memudar dan muncul endapan kuning. Menurut Vibhute et al. (2010) dan Godhile et al. (2012), kemunculan endapan menandakan bahwa flavon telah terbentuk. Endapan kuning tersebut berubah warna menjadi jingga setelah kering. Analisis dengan KLT menggunakan eluen DCM menghasilkan 5 noda yang terpisah pada 254 nm (Gambar 8).
Gambar 8 Endapan hasil siklisasi oksidatif (a) dan kromatogramnya pada eluen DCM, diamati di bawah lampu UV 254 nm (b)
Noda dengan Rf ~0.70 dan ~0.73 dipilih berdasarkan asumsi bahwa produk yang diharapkan, yaitu dibenzil krisin bersifat nonpolar dan akan terelusi lebih jauh dengan DCM yang relatif bersifat nonpolar. Keduanya lalu dimurnikan dan dianalisis dengan spektrofotometer UV-Vis. Noda dengan Rf ~0.70 (Lampiran 4a) memunculkan 2 puncak serapan, yaitu di panjang gelombang 214 dan 270 nm. Ketika ditambahkan NaOH, hanya terjadi pergeseran batokromik lemah berturut-turut ke 218 dan 282.5 nm. Pergeseran batokromik sejauh 17–20 nm menunjukkan bahwa terdapat gugus –OH fenolik bebas yang tidak terlindungi benzil (Pavia et al. 2001). Pergeseran ini disebabkan oleh menjadi lebih efektifnya delokalisasi pasangan elektron bebas atom O setelah gugus –OH fenolik terdeprotonasi oleh basa NaOH menjadi ion fenolat. Pada penelitian ini, pergeseran batokromik yang terjadi kurang dari 15 nm, sehingga disimpulkan bahwa gugus –OH tersebut tidak betul-betul bebas, tetapi mengalami ikatan hidrogen intramolekul dengan gugus karbonil di posisi orto.
Analisis ini diperkuat dengan fakta bahwa ketika sampel ditambahkan AlCl3, terjadi pula pergeseran batokromik yang stabil setelah penambahan HCl.
11
Pergeseran tersebut menandakan adanya ikatan hidrogen intramolekul yang digantikan oleh pembentukan kompleks dengan Al3+. Kompleks Al3+ dengan gugus –OH dan karbonil yang saling orto cukup kuat sehingga tidak terurai oleh penambahan HCl. Sementara jika kompleks terbentuk dengan 2 gugus –OH yang saling orto, HCl akan mampu mengurainya (Markham 1998).
Noda dengan Rf ~0.73 (Lampiran 5a) memunculkan 2 puncak serapan pada 216.5 dan 276.5 nm. Ketika ditambahkan NaOH, puncak-puncak tersebut tidak muncul. Ketika ditambahkan AlCl3, terjadi pergeseran batokromik lemah berturut-turut ke 222.5 dan 285.5 nm, dan tetap demikian ketika HCl ditambahkan. Hasil dengan AlCl3 menunjukkan dugaan bahwa gugus –OH pada posisi orto dari gugus asetil telah terdeproteksi dan membentuk ikatan hidrogen dengan karbonil asetil, sedangkan gugus –OH di posisi para masih belum terdeproteksi. Namun, hasil dengan NaOH tidak mendukung dugaan tersebut.
Tabel 1 Hasil analisis 1H NMR noda dengan Rf ~0.70 dan Rf ~0.73 dalam pelarut wilayah nilai tetapan kopling meta. Oleh karena itu, kedua sinyal tersebut diduga berasal dari proton-proton yang saling meta pada C6 dan C8 daricincin A flavon. Sinyal singlet 1 proton pada 6.67 ppm diduga milik H vinilik pada cincin C. Proton vinilik umumnya memunculkan sinyal di 5–6 ppm. Geseran ke medan bawah yang teramati di sini disebabkan oleh gabungan efek anisotropi dan tarikan-elektron oleh karbonil. Sinyal-sinyal tersebut mengonfirmasi kerangka flavon krisin pada senyawa dengan Rf ~0.70.
12
gugus karbonil. Ikatan hidrogen intramolekul akan melemahkan ikatan O–H sehingga atom H tersebut menjadi sangat asam dan kurang terperisai. Akibatnya, nilai geseran kimia menjadi sangat besar dan melebihi 10 ppm.
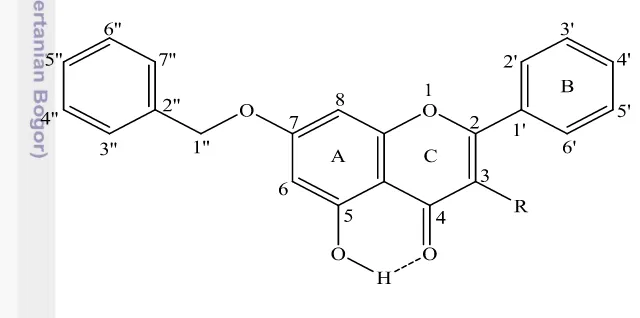
Adanya geseran kimia di 12.72 ppm ini sejalan dengan data spektrum UV-Vis yang diperoleh. Gugus –OH di C5 tidak terlindungi oleh gugus benzil dan berikatan hidrogen intramolekul dengan gugus karonil sehingga menimbulkan pergeseran batokromik lemah pada penambahan NaOH maupun AlCl3. Hasil ini juga sekaligus menyatakan bahwa gugus benzil terikat pada atom oksigen di C-7. Dengan demikian, noda dengan Rf ~0.70 adalah 7-benziloksi-5-hidroksiflavon atau monobenzil krisin (Gambar 9). Rendemen produk ini adalah 7% dari 4’,6’ -bisbenziloksi-2’-hidroksiasetofenon (Lampiran 3c).
Spektrum 1H NMR senyawa dengan Rf~0.73 ditunjukkan pada Lampiran 5b dan sinyal-sinyalnya dirangkum pada Tabel 2. Adanya sinyal –OH yang berikatan hidrogen intramolekul di 12.97 ppm, serta tidak adanya sinyal H-vinilik memunculkan dugaan bahwa senyawa tersebut adalah 7-benziloksi-5-hidroksiflavonol (Gambar 9). Namun, tidak ditemukan sinyal 3-OH, dan pola pembelahan sinyal di 6.48 dan 6.74 ppm singlet sehingga tidak sesuai dengan proton H8 dan H8 yang saling meta. Oleh karena itu, struktur senyawa ini belum dapat dielusidasi. Senyawa ini diperoleh dengan rendemen 13% dari 4’,6’ -bisbenziloksi-2’-hidroksiasetofenon (Lampiran 3d).
Gambar 9 Kerangka struktur benziloksi-5'-hidroksiflavon (R = H) dan 4'-benziloksi-5'-hidroksiflavonol (R = -OH)
13
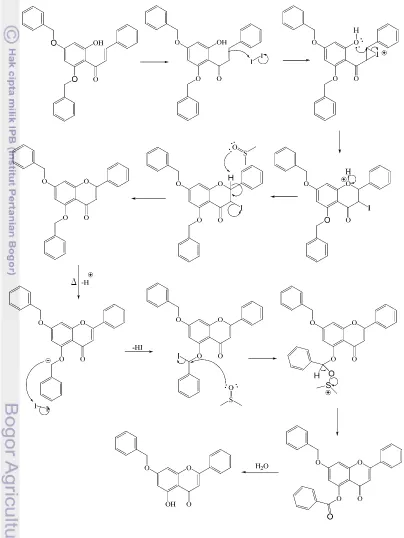
benzil pada –OH fenolik di posisi orto dari gugus asetil lebih mudah terjadi daripada –OH fenolik di posisi para. Penyebabnya, setelah gugus benzil terputus, gugus –OH orto yang terbentuk dapat segera berikatan hidrogen dengan gugus karbonil. Ikatan hidrogen tersebut akan menstabilkan produk deproteksi pada posisi orto sehingga kecenderungan pemutusan ikatan benzil pada posisi orto akan lebih tinggi.
Gambar 10 Mekanisme siklisasi 4',6'-bisbenziloksikalkon menjadi dibenzil krisin dan deproteksi gugus benzil di posisi orto menjadi monobenzil krisin
14
SIMPULAN DAN SARAN
Monobenzil krisin sebagai prekursor untuk krisin telah berhasil disintesis dari bahan dasar floroglusinol. Sintesis ini dilakukan dengan aplikasi gugus pelindung benzil melalui rute siklisasi oksidatif. Rendemen keseluruhan sintesis ini adalah 1%. Masih perlu dilakukan optimasi dalam proses proteksi floroasetofenon dengan 2 gugus benzil. Selain itu, tiap senyawa yang terbentuk pada tahap sintesis kalkon dan siklisasi oksidatif perlu dielusidasi agar mekanisme reaksi dan terbentuknya produk samping dapat ditelaah lebih jauh.
DAFTAR PUSTAKA
Al-Busafi S. 2013. Convenient synthesis of a novel flavonoid with extended π -system: active agent of UVA protection. J Chem. 2013:1-4.
Cushnie TPT, Lamb AJ. 2005. Antimicrobial activity of flavonoids. Int Jur of Antimicrobial Agents. 26:343-356.
Do TH, Vo PN, Tran TD. 2009. Synthesis and comparison of anti-inflammatory activity of chrysin derivatives. Di dalam: Seijas JA, Tato MPV, editor. The 13th International Electronic Conference on Synthetic Organic Chemistry [internet]. 2009 Nov 1-30; [tempat tidak diketahui]. Basel (CH):MDPI. hlm
1-6; [diunduh 2014 Jan 12] Tersedia pada:
www.sciforum.net/conference/ecsoc-13/paper/219.
El Antri A, Messouri I, Tlemçani RC, Bouktaib M, El Alami R, El Bali B, and Lachkar M. Flavone glycosides from calycotome villosa subsp. intermedia. Molecules. 9:568-573.
Elsa L. 2012. Sintesis flavonol melalui 2’-hidroksikalkon [skripsi]. Bogor(ID): Institut Pertanian Bogor.
Fu B, Xue J, Li Z, Shi X, Jiang B-H, Fang J. 2007. Chrysin inhibits expression of hypoxia-inducible factor-1α through reducing hypoxia-inducible factor-1α stability and inhibiting its protein synthesis. Mol Cancer Ther. 6(1):220-226.
Ghodile NG, Rajput PR, Banewar VW, Raut AA. 2012. Synthesis and antimicrobial activity of some chalcones and flavones having 2-hydroxy acetophenone moiety. Int J Pharm Bio Sci. 3(3):389 – 395.
Gulati KC, Seth SR, Venkataraman K. 1943. Phloroacetophenone. Org Synth Coll 2:522.
Hossain MA. 1999. Synthesis of 3’,5,7-trihydroxy-6”,6”
-dimethylpyrano[2”,3”:4’,5’]flavanone. Ind J Chem. 38B:427-430.
Jarowicki K dan kocienski P. 1998. Protecting groups. J Chem Soc., Perkin Trans. 1:4005-4037.
Khoo BY, Chua SL, dan Balaram P. 2010. Apoptotic effects of Chrysin in Human cancer cell lines. Int Jur Mol Sci. 11:2188-2199.
Ksathrya RB, Shaikh YI, Nazeruddin GM. 2013. Synthesis of flavone skeleton by different methods. Or J Chem. 29(4):1475-1487.
15
Kulkarni PS, Kondhare DSD, Varala R, Zubaidha PK. 2013. Cyclization of 2’ -hydroxychalcones to flavones using ammonium iodide as an iodine source - an eco-friendly approach. J Serb Chem Soc. 78(7):909-916.
Lokhande PD, Nawghare BR. 2012. Mild, efficient, and economical oxidative deprotection of allyl aryl ethers. IJC. 51B:328-333.
Maftuhah N. 2013. Sintesis 7-hidroksiflavonol dan fisetin [skripsi]. Bogor(ID): Institut Pertanian Bogor.
Malik N, Zlatopolsky BD, Solbach C, Voelter W, Reske SN, Machulla H-J. 2011. Mono- and dimethylbenzyls as new protecting groups for no-carrier-added nucleophilic aromatic radiofluorination. J Radioanal Nucl Chem. 288:563– 569. doi:10.1007/s10967-010-0966-x.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K, Soediro I, penerjemah. Bandung(ID):ITB. Terjemahan dari:Techniques of Flavonoid Identification.
Miharti F. 2013. Efektivitas gugus pelindung –OH fenolik pada floroasetofenon dan 3,4-dihidroksibenzaldehida dalam upaya menyintesis kuersetin [skripsi]. Bogor(ID): Institut Pertanian Bogor.
Murthy YLN, Kasi Visvanath IV, Nageswar Pandit E. 2010. Synthesis,
caracterization, & antibacterial activity of 7,4’-dihydroxy, 3’-methoxy flavones. IJCR. 2(2):1097-1101.
Ndoile MM, van Herdeen FR. 2013. Totall synthesis of ochnaflavone. BJOC. 9:1346-1351. doi:10.3762/bjoc.9.152.
Panda AK. 2010. Simple synthetic processes for chrysin, norwogonin, and their derivatives. IJRAP. 1(1):225-233.
Pavia DL, Lampman GM, Kriz GS. 2001. Introduction of Spectroscopy: A Guide fo Students of Organic Chemistry. Stamford (US): Brooks/Cole.
Pereira OR, Silva AMS, Domingues MRM, Cardoso SM. 2012. Identification of phenolic constituents of Cytisus multiflorus. Food Chemistry. 131:652-659. Ramkumar N, Nagarajan R. 2013. Total synthesis of calothrixin A and B via C-H
activation. J Org Chem. 78:2802-2807.doi:10.1021/JO302821V.
Rauf A, Khan R, Muhammad N. 2013. Antioxidant studies of various solvent fractions and chemical constituents of Potentilla evestita Th. Wolf. AJPP. 7(40):2710-2713. doi:10.5897/AJPP2013.3795.
Saito K, Yonekura-Sakakibara K, Nakabayashi R, Higashi Y, Yamazaki M, Tohge T, Fernie AR. 2013. The flavonoid biosynthetic pathway in Arabidopsis: structural and genetic diversity. Plant Phys and Biochem. 72:21-34. doi:dx.doi.org/10.1016/j.plaphy.2013.02.001.
Schelhaas M, Waldmann H. 1996. Protecting group strategies in organic synthesis. Angew Chem Int Ed Engl. 35:2056-2083.
16
chrysin (flavon), kaempferol (flavanol), naringenin (flavanon), and hesperidin (flavanoid) on in vitro breast cancer. JMPR. 7(29):2187-2196. Susanti E, Mastjeh S, Mustofa, Wahyuningsih TD. 2014. Improved synthesis of
2',6'-dihydroxy-3,4-dimethoxychalcone by grinding technique to synthesize 5-hydroxy-3',4'-dimethoxyflavone. Indo J Chem. 14(2):174 – 178.
Theja DN, Choudary TP, Reddy MI, Gupta AVSS, Reddy KU. 2011. A facile synthesis of flavone derivatives used as potent anti-inflammatory agents. IJPPS. 3(2):51-54.
Tsukayama M, Kawamura Y, Tamaki H, Kubo T, Horie T. 1989. Synthesis of pyranoisoflavones from pyrochalcone: synthesis of elongatin and its angular isomer. Bull Chem Soc Jpn. 62:826-832. doi:10.1080/00397910500514121. Utami D. 2012. Sintesis krisin dari floroglusinol [skripsi]. Bogor(ID): Fakultas
Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Vibhute YB, Dawane BS, Lalpod, Jadhav JD, SB Zangade. 2010. Synthesis and microbial activity of some new chalcones and flavones containing substituted napthalene moiety. J. Chem Pharm Res. 2(1):310-314.
Yoo H, Kim SH, Lee J, Kim HJ, Seo SH, Chung BY, Jin C, Lee YS. 2005. Synthesis and antioxidant ability of 3-methoxyflavones. Bull Korean Chem Soc. 26(12):2057-2060.
Zangade SB, Navale VA, Shinde RS, Patil SG. 2010. Synthesis of some new chalcones, flavones and screening for their antimicrobial activity. Der Pharmacia Lettre. 2(5):245-250.
Zhang M, Jagdmann Jr GE, van Zandt M, Beckett P, Schroeter H. 2013. Enantioselective synthesis of orthogonally protected (2R,3R)-(–)-epicatechin derivatives, key intermediates in the de novo chemical synthesis of (– )-epicatechin glucuronides and sulfates. Tetrahedron: Asymmetry. 24:362-373.
17
Lampiran 1 Bagan alir penelitian
Keterangan
a. Floroglusinol b. Floroasetofenon c. 4’,6’
-bisbenziloksi-2’-hidroksiasetofenon d. 4’,6’
18
Lampiran 2 Rangkaian radas sintesis floroasetofenon Utami (2012)
19
Lampiran 3 Perhitungan rendemen sintesis a. Sintesis Floroasetofenon
Reaksi:
Bobot floroglusinol: 6.3055 g Bobot floroasetofenon: 6.1075 g
b. Sintesis 4’,6’-bisbenziloksi-2’-hidroksiasetofenon Reaksi:
Bobot floroasetofenon: 0.8425 g
20
lanjutan Lampiran 3
c. Sintesis Monobenzil Krisin Reaksi:
Bobot 4’,6’,-bisbenziloksikalkon (diasumsikan murni): 0.0898 g Bobot monobenzil krisin: 0.0234 g
d. Sintesis 4’-benziloksi-2’-hidroksiflavonol Reaksi:
21
Lampiran 4 Elusidasi struktur senyawa Rf ~0.70 hasil siklisasi 4’,6’ -bisbenziloksi-2’-hidroksikalkon dengan I2-DMSO
Puncak Serapan (nm)
4-benziloksi-2,6-dihidroksiflavon
+NaOH +AlCl3 +AlCl3 dan HCl
λmaks 270 282.5 282.5 282.5
214 218 216 218
a) Spektrum UV-Vis (Pelarut metanol)
Noda dengan Rf ~0.70 +NaOH
+AlCl3
22
lanjutan Lampiran 4
23
Lampiran 5 Elusidasi struktur senyawa Rf ~0.73 hasil siklisasi 4’,6’ -bisbenziloksi-2’-hidroksikalkon dengan I2-DMSO
Puncak Serapan (nm)
4-benziloksi-2,6-dihidroksiflavon
+NaOH + AlCl3 + AlCl3 dan HCl
λmaks 270 - 285.5 294
214 - 222 221
a) Spektrum UV-Vis (Pelarut metanol)
Noda dengan Rf ~0.73 + AlCl3
24
lanjutan Lampiran 5
25
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 22 Juni 1992, merupakan putra ketiga dari tiga bersaudara dari pasangan Baharuddin dan Tince Gafoer.
Penulis menyelesaikan pendidikan di Sekolah Menengah Atas Negeri 2, Kota Tangerang pada tahun 2010 dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor melalui jalur Undangan Seleksi Mahasiswa IPB (USMI).
Selama mengikuti perkuliahan, penulis pernah aktif di Ikatan Mahasiswa Kimia (Imasika) IPB periode 2011/2012 dan Dewan Pengawas Imasika (DPI) pada tahun 2012/2013. Penulis pernah pula menjadi asisten praktikum di berbagai mata kuliah di antaranya Kimia Organik Layanan S1 ITP (2013/2014), Kimia Polimer (2013, 2014), Kimia Organik D3 IPB (2013, 2014), dan Praktikum Kimia Organik Berbasis Kompetensi (2013, 2014). Selain itu, penulis juga aktif menjadi asisten responsi Kimia Organik I (2013, 2014) dan Kimia Organik II (2014).