EVALUASI PENAMBAHAN RAGI LIMBAH PRODUKSI BIR DALAM PAKAN TERHADAP KINERJA PERTUMBUHAN DAN DAYA TAHAN TUBUH IKAN LELE Clarias sp. AKIBAT INFEKSI Aeromonas hydrophila
NETTY DWI CHANDRAWATI
DEPARTEMEN BUDIDAYAPERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi dengan judul “Evaluasi Penambahan Ragi Limbah Produksi Bir dalam Pakan terhadap Kinerja Pertumbuhan dan Daya Tahan Ikan Lele Clarias sp. akibat Infeksi Aeromonas hydrophila” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
ABSTRAK
NETTY DWI CHANDRAWATI. Evaluasi Penambahan Ragi Limbah Produksi Bir dalam Pakan terhadap Kinerja Pertumbuhan dan Daya Tahan Ikan Lele Clarias sp. akibat Infeksi Aeromonas hydrophila. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan DEDI JUSADI.
Penelitian ini bertujuan untuk menguji pada skala lapangan penambahan ragi bir Saccharomyces cerevisiae yang merupakan limbah produksi bir pada pakan terhadap kinerja pertumbuhan dan daya tahan ikan lele akibat infeksi bakteri Aeromonas hydrophila. Ikan lele dengan bobot 2,09 ± 0,01 g dan panjang 6,42 ± 0,07 cm ditebar ke kolam terpal 200 x 200 x 80 cm3 sebanyak 1.000 ekor/kolam dengan 2 perlakuan dan 3 ulangan. Ikan dipelihara dengan pemberian pakan komersial tanpa penambahan ragi bir (K), serta pakan komersial ditambah ragi bir (RB) selama 30 hari untuk dilihat respons pertumbuhannya. Setelah itu, ikan diuji tantang pada akuarium 60 x 30 x 25 cm3 menggunakan 3 perlakuan dan 3 ulangan meliputi perlakuan K- (ikan disuntik PBS), K+ (ikan disuntik A. hydrophila), dan RB (ikan disuntik A. hydrophila). Setelah disuntik, seluruh ikan diberi pakan K selama 10 hari serta diamati tingkat kematiannya. Hasil penelitian menunjukkan pemberian pakan RB dapat meningkatkan laju pertumbuhan harian ikan dan menurunkan nilai konversi pakan. Analisis biaya menunjukkan bahwa perlakuan RB dapat menurunkan harga produksi pakan menjadi Rp 33.917 dari sebelumnya Rp 39.418 (kontrol). Daya tahan tubuh ikan meningkat dengan meningkatnya total leukosit darah, menekan infeksi A.hydrophila dengan gejala klinis lebih ringan, dan menekan persentase kematian (71,67%) dibandingkan K+ (95,00%).
Kata kunci: Aeromonas hydrophila, daya tahan tubuh, ikan lele, pertumbuhan, ragi bir, Saccharomyces cerevisiae.
ABSTRACT
NETTY DWI CHANDRAWATI. Evaluation of Brewery Yeast Addition in Feed on Growth Performance and Immunity of Catfish Clarias sp. against Aeromonas hydrophila Infection. Supervised by DINAMELLA WAHJUNINGRUM and DEDI JUSADI.
The purpose of the study was to test on field-scale the addition of brewer’s yeast Saccharomyces cerevisiae which was considered as brewery by-product in feed on growth performance and immunity of catfish against the infection of Aeromonas hydrophila. Catfish weighed 2.09 ± 0.01 g with average length of 6.42 ± 0.07 cm were stocked in tarpaulin ponds 200 x 200 x 80 cm3 as much as 1.000 fish/pond with 2 treatments and 3 replications. Fish were fed commercial feed without brewer’s yeast addition (K), and brewer’s yeast added feed (RB) for 30 days and the growth response were observed. Fish were challenged in aquariums 60 x 30 x 25 cm3 using 3 treatments and 3 replications which consisted of K- (PBS injected fish), K+ (A. hydrophila injected fish), and RB (A. hydrophila injected fish). After injection, fish were fed K feed for 10 days and the mortality rate were observed. The results showed that feeding with RB feed increased the growth rate of the fish and decreased the feed conversion ratio. Cost analysis showed that RB treatment could decrease feed production cost toRp 33917 from Rp 39418 (control). Fish immunity were increased with increasing total blood leukocytes, suppressed A. hydrophila infection indicated by lighter clinical symptoms showed, and suppressed mortality rate (71.67%) compared to K+ (95.00%).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
EVALUASI PENAMBAHAN RAGI LIMBAH PRODUKSI BIR DALAM PAKAN TERHADAP KINERJA PERTUMBUHAN DAN DAYA TAHAN TUBUH IKAN LELE Clarias sp. AKIBAT INFEKSI Aeromonas hydrophila
DEPARTEMEN BUDIDAYAPERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Evaluasi Penambahan Ragi Limbah Produksi Bir dalam Pakan terhadap Kinerja Pertumbuhan dan Daya Tahan Ikan Lele Clarias sp. akibat Infeksi Aeromonas hydrophila
Nama : Netty Dwi Chandrawati
NIM : C14100063
Program Studi : Teknologi dan Manajemen Perikanan Budidaya
Disetujui oleh
Dr. Dinamella Wahjuningrum, S.Si, M.Si. Pembimbing I
Dr.Ir. Dedi Jusadi, M.Sc. Pembimbing II
Diketahui oleh
Dr.Ir. Sukenda, M.Sc. Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penyusunan skripsi yang berjudul “Evaluasi Penambahan Ragi Limbah Produksi Bir dalam Pakan terhadap Kinerja Pertumbuhan dan Daya Tahan Ikan Lele Clarias sp. akibat Infeksi Aeromonas hydrophila” ini berhasil diselesaikan. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Orang tua tercinta, Bapak Sukarno, Ibu Sriyani, Nenek Uti, Kakak Anisa, Adik Trinanda dan Chicka, serta seluruh keluarga atas segala doa dan dukungan semangat kepada penulis,
2. Ibu Dr. Dinamella Wahjuningrum dan Bapak Dr. Dedi Jusadi selaku pembimbing skripsi yang telah memberikan banyak saran dan dukungan dalam pelaksanaan penelitian dan penyusunan tugas akhir ini,
3. Ibu Dr. Widanarni selaku Dosen penguji tamu dan Bapak Dr. Alimuddin yang telah memberikan banyak saran dan dukungan dalam pelaksanaan penelitian dan penyusunan tugas akhir ini,
4. Bapak Aditya Prima Yudha serta para staf yang telah mengizinkan kepada penulis untuk dapat melakukan penelitian di kolam budidaya milik Lele Satya Mina Tani,
5. Ferdiyanto S.Pi, Ikhsan S.Pi, Bapak Ranta, Ka Rahman, Dendi S.Pi, Bapak Wasjan, Mba Retno, dan Kang Abe yang telah banyak membantu pelaksanaan penelitian,
6. Teman-teman seperjuangan LKI 47 dan Pascasarjana terutama Evy, Dede, Ibu Osa, Enrika, dan Akbar,
7. Sahabat-sahabat terdekat : Maljow, Linly, Aini, Maya, teman-teman BDP
47, 101’mates, tim basket putri FPIK atas semangat, motivasi, kebersamaan, dan kenangannya, serta semua pihak yang tidak bisa disebutkan satu persatu atas segala bantuan yang telah diberikan kepada penulis.
Semoga skripsi ini bermanfaat bagi penulis, ilmu pengetahuan, masyarakat, dan seluruh pihak yang membutuhkan.
DAFTAR ISI
DAFTAR TABEL... ix
DAFTAR GAMBAR... ix
DAFTAR LAMPIRAN... ix
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 1
METODE ... 2
Rancangan Percobaan ... 2
Prosedur Penelitian ... 2
Pakan Uji ... 2
Uji Kinerja Pertumbuhan ... 2
Bakteri Uji ... 3
Uji Daya Tahan Tubuh Ikan ... 4
Analisis Data ... 5
HASIL DAN PEMBAHASAN ... 5
Hasil ... 5
Kinerja Pertumbuhan Ikan Lele ... 5
Parameter Hematologi Ikan ... 6
Uji Tantang terhadap Bakteri Aeromonas hydrophila ... 10
Pembahasan ... 10
KESIMPULAN DAN SARAN ... 14
Kesimpulan ... 14
Saran ... 15
DAFTAR PUSTAKA ... 15
LAMPIRAN... 17
DAFTAR TABEL
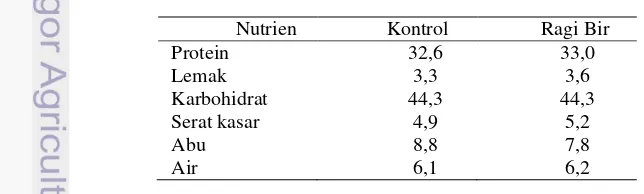
Komposisi proksimat pakan percobaan (%) ... 2
Pengukuran kualitas air selama 30 hari pemeliharaan ikan lele ... 3
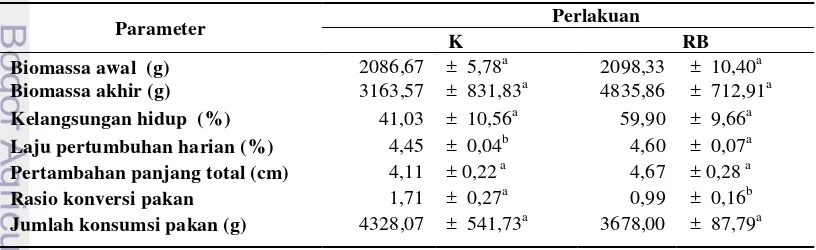
Kinerja pertumbuhan ikan lele setelah dipelihara selama 30 hari ... 5
Nilai efisiensi ekonomi pakan ... 6
Gejala klinis yang ditimbulkan pascainfeksi Aeromonas hydrophila ... 6
DAFTAR GAMBAR
1 Persentase kadar hematokrit (%) ikan lele Clarias sp. selama penelitian ... 72 Persentase kadar hemoglobin (g%) ikan lele Clarias sp. selama penelitian ... 7
3 Rata-rata jumlah sel darah merah (sel/mm3) ikan lele Clarias sp. selama penelitian ... 8
4 Rata-rata jumlah sel darah putih (sel/mm3) ikan lele Clarias sp. selama penelitian ... 8
5 Persentase monosit, neutrofil, dan limfosit ikan lele Clarias sp. selama penelitian ... 9
6 Persentase aktivitas fagositik ikan lele Clarias sp. selama penelitian... 9
7 Persentase mortalitas (kematian) ikan lele Clarias sp. setelah penyuntikan dengan bakteri A.hydrophila ... 10
DAFTAR LAMPIRAN
1 Prosedur parameter penelitian... 172 Perhitungan nilai LD50... 19
PENDAHULUAN
Latar Belakang
Pengembangan budidaya ikan lele di Indonesia seringkali dihadapkan oleh terus meningkatnya biaya bahan baku pakan dan rendahnya kelangsungan hidup, terutama di tingkat pembenihan. Bahan baku pakan yang baik akan mendukung kinerja pertumbuhan ikan, sehingga terhindar dari serangan penyakit yang merupakan salah satu faktor pemicu kematian ikan yang tinggi. Penyakit ikan yang disebabkan oleh Aeromonas hydrophila dikenal sebagai penyakit MAS (motile aeromonad septicaemia) merupakan kendala budidaya ikan air tawar termasuk ikan lele. Penyakit tersebut mewabah terutama di Asia Tenggara sejak 1980 (Angka et al. 1982).
Tindakan pencegahan diduga merupakan langkah efektif dan aman untuk meningkatkan respons kekebalan pada ikan sehingga ketahanan tubuh ikan terhadap infeksi alamiah meningkat. Salah satu bahan baku yang merupakan sumber immunostimulan adalah ragi bir Saccharomyces cerevisiae merupakan limbah dari produksi bir. Silvianti (2013) menyatakan bahwa ragi bir yang merupakan limbah dari industri pembuatan bir, memiliki potensi sebagai bahan baku pakan ikan karena ketersediaannya di salah satu produsen bir mencapai lebih dari 12 ton basah perhari. Selain itu, ragi bir mengandung kadar protein yang tinggi (56,37%), serat kasar rendah, yaitu 0,44%, dan mengandung asam nukleat dan polisakarida non pati termasuk ß-glukan. ß-glukan merupakan salah satu imunostimulan yang potensial yang dapat merangsang mekanisme pertahanan pada organisme.
Hasil analisis kimia menunjukkan bahwa ragi bir dengan kadar air 83,8% mengandung -glukan 0,94%. Yoshida et al. (1995) menyebutkan bahwa penambahan glukan dan oligosakarida masing-masing sebanyak 1g/kg pakan terbukti efektif meningkatkan aktivitas fagositik, mengeliminasi infeksi bakteri pada African catfish (Clarias gariepinus). Penelitian Puteri (2013) menunjukkan penambahan ragi bir 3-6% pada pakan lele dapat meningkatkan efisiensi pakan, yang diduga sebagai akibat dari meningkatnya status kesehatan ikan sehingga metabolisme tubuh lebih baik. Ragi bir juga dapat diberikan dalam jangka waktu yang relatif lama tanpa adanya imunosupresi menurut hasil uji respons imun yang dilakukan oleh Li et al. (2003). Peneliti sebelumnya telah melakukan studi tentang pengaruh ragi bir dalam meningkatkan kekebalan pada ikan lele ukuran tebar 9-10 cm yang dipelihara di akuarium. Oleh karena itu, penelitian ini merupakan implementasi hasil Puteri (2013) untuk menguji efektivitas ragi bir pada skala lapangan di tingkat pendederan milik pembudidaya ikan lele.
Tujuan Penelitian
2
METODE
Rancangan Percobaan
Penelitian ini terdiri atas dua tahap, yakni uji kinerja pertumbuhan dan uji daya tahan tubuh terhadap infeksi bakteri A. hydrophila. Uji kinerja pertumbuhan digunakan dua perlakuan dengan tiga ulangan menggunakan Uji T. Perlakuan tersebut adalah ikan dipelihara dengan pemberian pakan komersial tanpa penambahan ragi bir (Kontrol), serta pakan komersial yang ditambah ragi bir (RB).
Uji daya tahan tubuh dilakukan setelah uji kinerja pertumbuhan. Ikan yang telah dipelihara selama 30 hari pada uji kinerja pertumbuhan, diinfeksi dengan bakteri A.hydrophila, lalu diamati tingkat kematiannya selama 10 hari. Penelitian ini menggunakan rancangan acak lengkap dengan tiga perlakuan dan tiga ulangan. Perlakuan yang digunakan adalah sebagai berikut:
1. Perlakuan K- : Ikan kontrol disuntik phosphate buffer saline (PBS) 2. Perlakuan K+ : Ikan kontrol disuntik bakteri A.hydrophila
3. Perlakuan RB : Ikan perlakuan RB disuntik bakteri A.hydrophila Prosedur Penelitian
Pakan Uji
Pakan yang digunakan berupa pakan komersial apung seperti yang biasa digunakan pembudidaya. Diameter pakan sebesar 1 mm dengan kadar protein 33%. Pakan kontrol, yaitu pakan komersial tidak mendapat perlakuan dan langsung diberikan ke ikan selama masa pemeliharaan. Pakan RB, pakan komersial dicampur ragi birbasah sebanyak 30%. Hasil analisis kimia menunjukkan bahwa ragi bir basah mengandung kadar -glukan 0,94%, air 83,8%, protein 7,4%, abu 1,3%, lemak 0,3%, dan serat kasar 0,4%. Penambahan ragi bir basah sebanyak 30% setara dengan 4,9% kering. Nilai ini masih dalam kisaran yang baik untuk ikan lele sesuai hasil penelitian Puteri (2013). Penambahan ragi bir diharapkan akan menyumbangkan -glukan sebanyak 0,75% di dalam pakan. Proses pencampuran pakan dengan ragi bir sebagai berikut: 1) Ragi bir dicampur dengan putih telur sebagai perekat (1 butir/kg pakan), kemudian dihomogenkan dengan blender; 2) Ragi bir dicampurkan ke pakan, lalu diaduk hingga rata; 3) Pakan dikeringkan dengan oven bersuhu 70 °C; 4) Setelah kering dan dingin, pakan disimpan dalam plastik kedap udara. Hasil analisis proksimat pakan yang digunakan dalam penelitian ini disajikan pada Tabel 1.
Uji Kinerja Pertumbuhan
Penelitian ini dilaksanakan di Kolam Budidaya Ikan Lele Satya Mina Tani Bogor. Pemeliharaan ikan lele dilakukan di dalam kolam terpal berukuran
Tabel 1 Komposisi proksimat pakan percobaan (%)
Nutrien Kontrol Ragi Bir
3 200x200x80 cm3. Sebelum ikan ditebar, kolam disikat dindingnya dan dikeringkan selama 24 jam. Setelah itu, setiap bak diisi air setinggi 50 cm dari dasar kolam. Benih ikan lele yang telah beradaptasi dengan pakan penelitian, memiliki bobot 2,09 ± 0,01 g dan panjang 6,42 ± 0,07 cm, ditebar dengan kepadatan 1.000 ekor/kolam. Selama masa budidaya, ikan diberi pakan sesuai perlakuan. Pakan diberikan secara at satiation dengan frekuensi pemberian pakan sebanyak tiga kali sehari, yaitu pada pukul 07.00-07.30, 12.30-13.00, 17.00-17.30 WIB. Jumlah pakan yang diberikan selama masa budidaya dicatat untuk mengetahui jumlah konsumsi pakan dan konversi pakan. Untuk mengurangi terjadinya kanibalisme, padahari ke-15 ikan disortir menjadi dua ukuran. Ikan ukuran besar dipindahkan ke dalam jaring hapa ukuran 100x100x50 cm3 yang ditempatkan di dalam kolam yang sama.
Pengelolaan kualitas air dilakukan dengan cara pergantian air secara total ketika sortir dan dilakukan pengambilan sampel air setiap minggunya untuk dianalisis kualitas airnya. Pengukuran parameter suhu dilakukan di pagi, siang, dan sore hari ketika pemberian pakan. Pengukuran pH, oksigen terlarut (DO), dan total amonia (TAN) dilakukan setiap minggunya. Kondisi kualitas air selama penelitian pemeliharaan ikan ditampilkan pada Tabel 2.
Setelah dipelihara selama 30 hari, ikan di hapa dan di kolam terpal disatukan, lalu dipanen. Sebelum proses panen dilaksanakan, 3 ekor ikan dari setiap ulangan diambil darahnya dengan menggunakan syringe 1 ml untuk keperluan pengamatan gambaran darah sebelum ikan diinfeksi bakteri A.hydrophila di penelitian selanjutnya. Pada saat panen, dihitung jumlah ikan yang hidup, panjang total ikan, serta bobot biomas ikan. Panjang total diukur dengan menggunakan mistar dengan ketelitian satu desimal. Panjang total rata-rata diperoleh dari pengukuran sebanyak 30 ekor ikan di setiap kolam. Biomassa ikan dihitung dengan menimbang 30 ekor ikan yang hidup dengan menggunakan timbangan digital satuan terkecil gram, dengan ketelitian dua desimal. Bobot biomas ikan dihitung dengan mengalikan bobot individu dengan jumlah ikan yang hidup.
Untuk mengevaluasi keberhasilan perlakuan terhadap kinerja pertumbuhan ikan, parameter uji yang digunakan meliputi kelangsungan hidup, pertumbuhan panjang total ikan, laju pertumbuhan harian ikan (Huisman 1987), konversi pakan, dan pertambahan panjang total (Lampiran 1).
Bakteri Uji
Isolat bakteri A.hydrophila awal sebelum digunakan, dilakukan pengembalian virulensi. Bakteri diisolasi dari hasil virulensi dan dikarakterisasi, diperoleh sesuai dengan bakteri A.hydrophila. Karakter bakteri yang didapatkan
Tabel 2 Pengukuran kualitas air selama 30 hari pemeliharaan ikan lele Parameter kualitas air Satuan Rentang nilai
Suhu ⁰C 26 – 34
pH - 6,07 – 7,96
DO mg/l 3,7 – 6,7
4
antara lain berbentuk batang, pewarnaan gram negatif, bersifat oksidatif fermentatif, bersifat motil, positif pada uji oksidase dan katalase. Kemudian, dilakukan uji lethal dosage 50 (LD 50) bakteri A.hydrophila untuk mengetahui kepadatan bakteri yang dapat mematikan setengah dari populasi ikan uji. Kepadatan yang digunakan adalah 104, 105, 106, 107, dan 108 cfu/ml secara intramuskular pada 10 ekor ikan lele dengan dua kali ulangan pada setiap kepadatannya. Pengamatan tingkat kelangsungan hidup dilakukan selama 10 hari. Kemudian dilakukan perhitungan LD50 (Lampiran 2).
Uji Daya Tahan Tubuh Ikan
Ikan yang telah dipanen pada penelitian uji kinerja pertumbuhan di Kolam terpal diangkut ke Teaching Farm Departemen Budidaya Perairan IPB. Ikan ditebar ke dalam 12 buah akuarium berukuran 60x30x25 cm3. Ikan ditebar ke setiap akuarium dengan kepadatan 20 ekor. Ikan diadaptasikan di akuarium selama tiga hari. Selama masa adaptasi, ikan diberi pakan kontrol. Pada hari ke-3, ikan di perlakuan K- diinjeksi dengan larutan PBS sebanyak 0,1 ml/ekor, sedangkan ikan di perlakuan K+ dan RB disuntik dengan A.hydrophila 106 cfu/ml dengan dosis 0,1 ml/ekor. Setelah disuntik, seluruh ikan perlakuan diberi pakan kontrol dan dipelihara selama 10 hari. Selama masa budidaya dilakukan pengamatan gejala klinis yang timbul, analisis gambaran darah, serta tingkat kematian ikan. Pengamatan gejala klinis dan kematian dilakukan pada tiga buah akuarium di setap perlakuan. Satu akuarium lainnya dipakai untuk pengamatan gambaran darah ikan. Gambaran darah pascainfeksi diamati pada hari ke-1, hari ke-3, dan hari ke-10.
Evaluasi daya tahan tubuh ikan terhadap infeksi A. hydrophila, parameter uji gambaran darah, gejala klinis dan tingkat kematian ikan. Gambaran darah yang diamati meliputi hematokrit, nilai hemoglobin, jumlah sel darah merah, jumlah sel darah putih, persentase diferensial leukosit, dan persentase aktivitas fagosit.
Kadar Hematokrit
Kadar hematokrit dihitung dengan cara persentase perbandingan panjang endapan dan panjang volume darah dalam tabung (Anderson dan Siwicki 1993).
Kadar Hemoglobin
Kadar hemoglobin didapat dengan membaca skala pada tabung dengan kondisi permukaan cairan yang dicocokan dengan skala tabung sahli pada jalur g% berwarna kuning (Wedemeyer dan Yasutake 1977).
Sel Darah Merah (SDM)
Sel darah merah diamati dan dihitung dengan bantuan mikroskop perbesaran 400x dan hasil perhitungan dimasukkan pada rumus berikut (Nabib dan Pasaribu 1989) (Lampiran 1):
Total SDM (sel/mm3) = � ℎ � � ℎ melalui bantuan mikroskop perbesaran 400x dan hasil perhitungan dimasukkan pada rumus berikut (Nabib dan Pasaribu 1989) (Lampiran 1):
Total SDP (sel/mm3) = � ℎ � � ℎ
� ℎ � � x 25 x
1
5
Diferensial Leukosit
Diferensial leukosit diamati dengan cara membandingkan persentase masing-masing tipe leukosit (monosit, neutrofil, dan limfosit) yang dihitung dalam suatu sampel kotak dibagi total sel darah putih yang ada (Lampiran 1).
Aktivitas fagositik
Aktivitas fagositik diamati dengan cara dihitung jumlah sel yang menunjukkan proses fagositosis dari 100 sel fagosit yang teramati (Anderson dan Siwicki 1993) (Lampiran 1).
Analisis Data
Data yang telah diperoleh dianalisis menggunakan analisis uji T untuk uji pertumbuhan pada selang kepercayaan 95% dari program SPSS 16.0 dan analisis ragam (ANOVA) dengan uji F untuk uji daya tahan tubuh pada selang kepercayaan 95% dari program statistical analysis system (SAS) 9.1 serta dilakukan uji Duncan sebagai uji lanjut beda nyata. Parameter yang dianalisis statistik kuantitatif adalah biomassa awal dan akhir, pertambahan panjang total, laju pertumbuhan harian, konversi pakan, jumlah konsumsi pakan, tingkat kelangsungan hidup, tingkat kematian setelah uji tantang, nilai hematokrit, nilai hemoglobin, jumlah sel darah merah, jumlah sel darah putih, persentase diferensial leukosit, dan persentase aktivitas fagosit. Parameter yang dianalisis secara deskriptif adalah efisiensi ekonomi pakan dan gejala klinis ikan.
HASIL DAN PEMBAHASAN
Hasil Kinerja Pertumbuhan Ikan Lele
Penambahan ragi bir dalam pakan yang diberikan selama 30 hari pemeliharaan menunjukkan peningkatan laju pertumbuhan harian dan menurunkan rasio konversi pakan yang berbeda nyata terhadap kontrol (P<0,05). Kinerja pertumbuhan ikan lele dapat dilihat pada Tabel 3.
* Nilai yang tertera merupakan nilai rata-rata ± standar deviasidan huruf superskrip di belakang nilai standar deviasi yang berbeda pada setiap baris menunjukkan pengaruh beda nyata (P<0,05)
** Perlakuan K (Kontrol) dan RB (Ragi bir)
Tabel 3 Kinerja pertumbuhan ikan lele setelah dipelihara selama 30 hari
Parameter Perlakuan
K RB
Biomassa awal (g) 2086,67 ± 5,78a 2098,33 ± 10,40a
Biomassa akhir (g) 3163,57 ± 831,83a 4835,86 ± 712,91a
Kelangsungan hidup (%) 41,03 ± 10,56a 59,90 ± 9,66a
Laju pertumbuhan harian (%) 4,45 ± 0,04b 4,60 ± 0,07a
Pertambahan panjang total (cm) 4,11 ± 0,22 a 4,67 ± 0,28 a
Rasio konversi pakan 1,71 ± 0,27a 0,99 ± 0,16b
6
Nilai Efisiensi Ekonomi Pakan
Nilai efisiensi ekonomi pakan perlakuan RB lebih tinggi (Rp 33.917) dibandingkan dengan pakan K (Rp 39.418). Nilai efisiensi ekonomi pakan ditunjukkan pada Tabel 4.
Parameter Hematologi Ikan
Gejala Klinis
Pengamatan gejala klinis dilakukan pada hari ke-1, ke-3, dan ke-10 pascainjeksi. Tabel 5 menunjukkan gejala klinis berupa tukak pada perlakuan K+ berkembang lebih cepat dibandingkan dengan perlakuan RB. Hasil pengamatan gejala klinis yang timbul akibat A.hydrophila dapat dilihat pada Tabel 5.
*( ) kelainan klinis berupa tukak, ( ) kelainan klinis berupa nekrosis, ( ) kelainan klinis berupa sirip geripis, dan ( ) kelainan klinis berupa tukak yang mulai menutup Tabel 4 Nilai efisiensi ekonomi pakan
Parameter Perlakuan
K RB
Jumlah ikan tebar (ekor) 1000 1000
Kebutuhan Pakan (kg) 4,3 3,7
Harga pakan (Rp/kg)* 9.167 9.167
Biaya pakan (Rp/1000 ikan tebar) 39.418 33.917
* Pakan Comfeed Rp 275.000 per 30 kg ** Perlakuan K (Kontrol) dan RB (Ragi bir)
Tabel 5 Gejala klinis yang ditimbulkan pascainfeksi Aeromonas hydrophila Hari ke-1 Hari ke-3 Hari ke-10 K-
Tidak ada kelainan klinis Tidak ada kelainan klinis Tidak ada kelainan klinis K+
7
Kadar Hematokrit
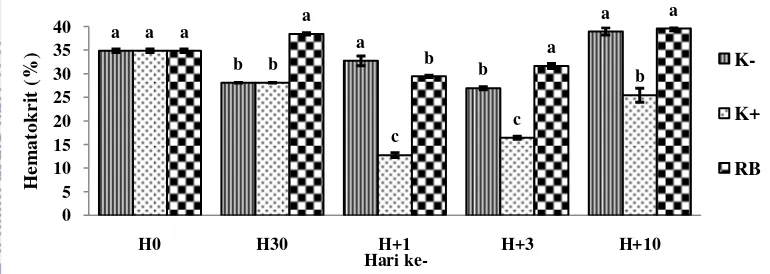
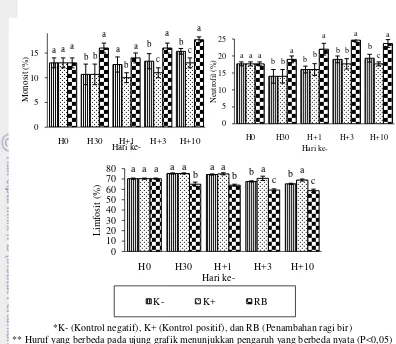
Kadar hematokrit pada hari ke-1 pascainfeksi, perlakuan K-, K+, dan RB memberikan pengaruh beda nyata (P<0,05) dengan terjadinya penurunan pada perlakuan K+ dan RB. Kadar hematokrit terendah pada K+ (12,75%) terjadi pada hari ke-1 pascainfeksi. Nilai rata–rata kadar hematokrit (%) ikan lele pada berbagai perlakuan ditunjukkan pada Gambar 1.
Kadar Hemoglobin
Persentase kadar hemoglobin terendah berada pada hari ke-1 pascainfeksi A.hydrophila. Perlakuan K+ memiliki persentase kadar hemoglobin terendah (5,27 g%) dibandingkan perlakuan K- (6,07 g%), dan RB (7,00 g%). Nilai rata–
*K- (Kontrol negatif), K+ (Kontrol positif), dan RB (Penambahan ragi bir)
** Huruf yang berbeda pada ujung grafik menunjukkan pengaruh yang berbeda nyata (P<0,05) Gambar 1 Persentase kadar hematokrit (%) ikan lele Clarias sp. selama penelitian
a
*K- (Kontrol negatif), K+ (Kontrol positif), dan RB (Penambahan ragi bir)
** Huruf yang berbeda pada ujung grafik menunjukkan pengaruh yang berbeda nyata (P<0,05) Gambar 2 Persentase kadar hemoglobin (g%) ikan lele Clarias sp. selama penelitian
8
(P<0,05) disetiap perlakuan. Nilai rata–rata jumlah sel darah merah ikan lele pada berbagai perlakuan ditunjukkan pada Gambar 3.
Sel Darah Putih
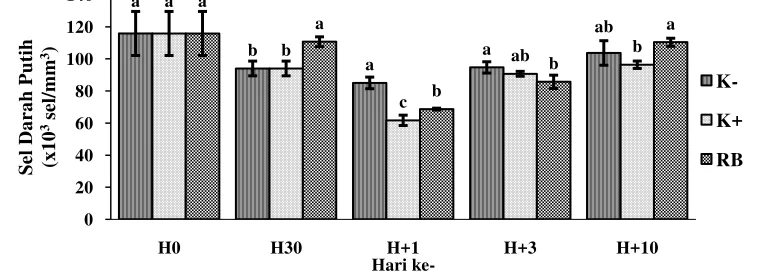
Hari ke-1 pascainjeksi A.hydrophila dimasing-masing perlakuan K- (85,00x 103 sel/mm3), K+ (61,67 x 103 sel/mm3), dan RB (68,67 x 103 sel/mm3) mengalami penurunan dengan pengaruh berbeda nyata (P<0,05) disetiap perlakuan. Nilai rata–rata jumlah sel darah putih ditunjukkan pada Gambar 4.
Diferensial Leukosit
Perlakuan RB memiliki jumlah monosit dan neutrofil tertinggi ketika hari ke-1 pascainjeksi dan menunjukkan pengaruh bedanyata (P<0,05) terhadap perlakuan kontrol. Sedangkan persentase limfosit, perlakuan RB terus mengalami penurunan sejak hari ke-1 pascainjeksi. Persentase diferensial dapat dilihat pada Gambar 5.
*K- (Kontrol negatif), K+ (Kontrol positif), dan RB (Penambahan ragi bir)
** Huruf yang berbeda pada ujung grafik menunjukkan pengaruh yang berbeda nyata (P<0,05) Gambar 3 Rata-rata jumlah sel darah merah (sel/mm3) ikan lele Clarias sp. selama
penelitian
*K- (Kontrol negatif), K+ (Kontrol positif), dan RB (Penambahan ragi bir)
9
*K- (Kontrol negatif), K+ (Kontrol positif), dan RB (Penambahan ragi bir)
** Huruf yang berbeda pada ujung grafik menunjukkan pengaruh yang berbeda nyata (P<0,05) Gambar 5 Persentase monosit, neutrofil, dan limfosit ikan lele Clarias sp. selama
Persentase aktivitas fagositik tertinggi terdapat pada perlakuan RB (31,33%) hari ke-1 pascainjeksi dibandingkan perlakuan K- (23,00%) dan K+ (16,33%). Kemudian memberikan pengaruh beda nyata (P<0,05) disetiap perlakuan. Rata-rata nilai aktivitas fagositik tersaji pada Gambar 6.
*K- (Kontrol negatif), K+ (Kontrol positif), dan RB (Penambahan ragi bir)
** Huruf yang berbeda pada ujung grafik menunjukkan pengaruh yang berbeda nyata (P<0,05) Gambar 6 Persentase aktivitas fagositik ikan lele Clarias sp. selama penelitian
10
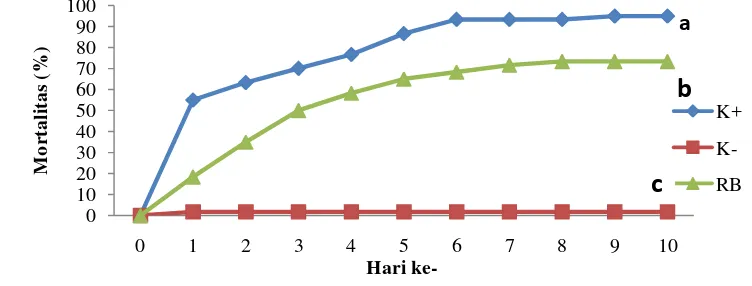
Uji Tantang terhadap Bakteri Aeromonas hydrophila
Mortalitas ikan lele pada K- (1,70%), K+ (95,00%), dan RB (73,30%). Hal ini menunjukkan tingkat mortalitas tertinggi secara berturut-turut terdapat pada perlakuan K+, RB, dan K-. Mortalitas ikan uji dapat dilihat pada Gambar 7.
Pembahasan
Penambahan ragi bir dalam pakan yang diberikan selama 30 hari pemeliharaan menunjukkan peningkatan laju pertumbuhan harian dan menurunkan rasio konversi pakan. Peningkatan laju pertumbuhan diikuti dengan jumlah biomassa akhir yang lebih tinggi dan pertambahan panjang total perlakuan RB yang lebih baik dibandingkan kontrol. Hal ini diduga karena kondisi status kesehatan ikan pada perlakuan RB lebih baik dibandingkan kontrol, sehingga mendukung pertumbuhan ikan. Pemeriksaan hematologi gambaran darah penting artinya untuk memperkuat diagnosa suatu penyakit karena perubahan gambaran darah yang terjadi secara kuantitatif maupun kualitatif dapat menentukan kondisi atau status kesehatan ikan (Wedemeyer dan Yasutake 1977). Diperkuat berdasarkan hasil yang diperoleh, kadar hematokrit, kadar hemoglobin, dan jumlah sel darah merah perlakuan RB selama 30 hari menunjukkan hasil yang lebih baik dibandingkan kontrol. Rata-rata nilai hematokrit ikan perlakuan RB (38,44%) lebih tinggi dibandingkan kontrol (28,09%), sedangkan ikan lele sehat mempunyai nilai hematokrit sebesar 30,8 – 45,5 %. Hasil ini berkorelasi dengan rata-rata nilai hemoglobin perlakuan RB (9,60 g%) yang lebih tinggi dibandingkan kontrol (6,33 g%) dan menguatkan bahwa kondisi ikan lele perlakuan RB lebih baik dibandingkan dengan kontrol. Hemoglobin berfungsi mengikat oksigen secara maksimal, kemudian digunakan untuk proses katabolisme sehingga dihasilkan energi, dan oksigen dilepas untuk metabolisme sel-sel jaringan tubuh. Jumlah sel darah merah perlakuan RB (3,60 x106 sel/mm3) yang lebih tinggi dibandingkan kontrol (3,43x106 sel/mm3) menunjukkan bahwa
*K- (Kontrol negatif), K+ (Kontrol positif), dan RB (Penambahan ragi bir)
** Huruf yang berbeda pada ujung grafik menunjukkan pengaruh yang berbeda nyata (P<0,05) Gambar 7 Persentase mortalitas (kematian) ikan lele Clarias sp. setelah penyuntikan
11 konsentasi hemoglobin dalam darah berkorelasi kuat dengan jumlah sel darah merah, yaitu semakin rendah jumlah sel darah merah (Gambar 3) akan semakin rendah pula konsentrasi hemoglobin di dalam darah (Nabib dan Pasaribu 1989). Rendahnya jumlah eritrosit mengakibatkan suplai makanan ke sel, jaringan dan organ akan berkurang sehingga proses metabolisme ikan akan terhambat (Alamanda et al. 2007). Metabolisme yang berjalan baik akan mendukung penyebaran dan penyerapan nutrisi makanan oleh tubuh yang baik pula. Hal inilah yang diduga menyebabkan laju pertumbuhan dan efisiensi pakan perlakuaan RB lebih baik dibandingkan kontrol.
Penelitian Puteri (2013) menunjukkan penambahan ragi bir 3-6% pada pakan lele dapat meningkatkan efisiensi pakan, yang diduga sebagai akibat dari meningkatnya status kesehatan ikan sehingga metabolisme tubuh lebih baik. Penelitian Rumsey et al. (1991) menyatakan dengan 25% Brewer’s dried yeast yang diberikan pada rainbow trout Oncorhynchus mykiss memberikan hasil pertumbuhan lebih baik. Rasio konversi pakan perlakuan RB yang lebih baik didukung oleh beberapa hasil penelitian yang menyebutkan bahwa Saccharomyces cerevisiae yang terdapat pada limbah ragi bir berpengaruh positif terhadap efisiensi pakan pada juvenil ikan hybrid stripped bass Morone chrysops dalam penelitian Li et al. (2003). Kemudian dalam penelitian Puteri (2013) menunjukkan bahwa penambahan ragi bir memiliki tingkat efisiensi pakan yang lebih baik dibandingkan dengan perlakuan kontrol.
Nilai efisiensi ekonomi pakan yang didapat dengan menghitung kebutuhan pakan ketika menebar 1.000 ekor ikan per kolam dengan harga pakan. Tabel 4 menunjukkan bahwa pakan perlakuan RB memiliki nilai efisiensi ekonomi pakan lebih tinggi (Rp 33.917) dibandingkan dengan pakan K (Rp 39.418). Hal ini menunjukkan penambahan ragi bir dalam pakan dinilai menguntungkan dari sisi ekonomi. Selain itu, penggunaan ragi limbah produsi bir juga menjadi salah satu alternatif pemanfaatan limbah proses produksi bir yang ketersediaanya banyak dan memiliki potensi imunostimulan (ß-glukan) untuk ikan. Sejalan dengan pada penelitian Puteri (2013) yang menunjukkan bahwa penambahan ragi bir dalam pakan memiliki nilai estimasi biaya produksi yang lebih rendah dibandingkan dengan pakan kontrol.
Pengamatan terhadap gejala klinis dilakukan sejak ikan lele diinfeksi bakteri A.hydrophila hingga hari ke-10 pascainfeksi. Hasil pengamatan terhadap gejala klinis perlakuan K- pada hari ke-1 hingga ke-10 menunjukkan ikan tidak mengalami adanya kelainan klinis (Tabel 5). Perlakuan K+ menunjukkan perkembangan gejala klinis infeksi A.hydrophila pada hari ke-1 pascainfeksi dan kematian ikan yang tinggi dengan kondisi nekrosis pada ikan dan tukak dibagian tubuhnya. Nekrosis merupakan tanda klinis yang pertama kali timbul setelah penginfeksian, kemudian berkembang menjadi tukak. Nekrosis pada perlakuan RBterjadi pada hari ke-1 pascainfeksi. Kemudian, nekrosis berkembang menjadi tukak dihari ke-3 pascainfeksi dan tukak yang telah timbul semakin membesar dihampir semua ikan perlakuan K+ hingga kematian masih terus terjadi (Gambar 7).
12
berbeda dengan ikan pada perlakuan RB yang mulai menunjukkan penutupan luka. Hal ini diduga, pada perlakuan RB terdapat imunostimulan (β-glukan) yang membantu proses pertahanan dan perlawanan bakteri sehingga penyebaran infeksinya tidak semakin parah.
Kadar hematokrit terendah pada hari ke-1 pasca penyuntikan terjadi pada K+ (12,75%) diduga akibat tingkat virulensi bakteri menyebabkan hemolisis dalam darah sehingga ikan mengalami anemia. Nilai hematokrit lebih kecil dari 22% menunjukkan ikan mengalami anemia (Gallaugher et al. 1995 dalam Abdullah 2008). Hal ini terjadi karena terjadi kerusakan pada jaringan. Kondisi ini mengakibatkan sel-sel darah banyak keluar melalui luka dan terjadi terhambatnya pembentukan respons imun. Kadar hematokrit mulai naik di hari ke- 3 perlakuan K+ (16,47%), dan RB (31,65%), kecuali K- (26,94%) mengalami penurunan, namun semua perlakuan memberikan pengaruh berbeda nyata (P<0,05). Hari ke-10 pasca penyuntikan perlakuan kadar hematokrit mengalami peningkatan menuju kadar normal di semua perlakuan dengan perlakuan RB (39,57%) dan K- (38,98%) memberikan pengaruh berbeda nyata dibandingkan dengan K+ (25,46%). Secara kualitatif, kadar hematokrit pada ikan kontrol positif selalu lebih rendah dibanding perlakuan lainnya mulai dari awal pascainfeksiA.hydrophila hingga akhir pengamatan dan ini mengindikasikan bahwa penambahan ragi bir pada pakan mampu mempercepat proses penyembuhan infeksi, dibandingkan ikan yang tidak diberikan immunostimulan pada pakan.
Kadar hematokrit berkorelasi dengan kondisi hemoglobin, ditunjukkan dengan perlakuan K+ yang memiliki kadar hemoglobin terendah dibandingkan perlakuan lainnya.Pada hari ke-1 pascainfeksi mengalami penurunan kadar hemoglobin dengan memberikan pengaruh berbeda nyata (P<0,05) disetiap perlakuan. Kadar hemoglobin terendah terdapat pada perlakuan kontrol positif (5,27%). Penurunan yang terjadi diduga akibat banyaknya gejala klinis berupa tukak yang timbul pada K+ sehingga darah banyak keluar dan menyebabkan anemia. Kondisi hemoglobin bekorelasi dengan kondisi sel darah merah. Hal ini dapat dilihat dari penurunan jumlah sel darah merah yang terjadi pula pada hari ke-1 pascainfeksi A.hydrophila pada perlakuan K- (3,4 x 106 sel/mm3), K+ (2,18 x 106 sel/mm3), dan RB (2,93 x 106 sel/mm3) memberikan pengaruh berbeda nyata (P<0,05) disetiap perlakuan. Astuti (2003) menyatakan penurunan kadar hemoglobin dalam darah ikan berkaitan dengan eritrosit darah karena hemoglobin dihasilkan oleh sel darah merah dan kondisi inipun terjadi pada ikan uji.
13 Jumlah sel darah putih perlu diketahui berkaitan dengan fungsinya berupa sel yang berperan penting dalam sistem pertahanan seluler tubuh, sehingga dapat diketahui perubahan yang terjadi akibat penambahan ragi bir dalam pakan komersial selama 30 hari ketika di uji tantang dengan bakteri A.hydrophila. Penurunan kadar sel darah putih ketika hari ke-1 pascainjeksi menunjukkan ikan mengalami infeksi, sehingga leukosit yang berfungsi sebagai pertahanan nonspesifik digunakan untuk melokalisasi dan mengeliminir patogen melalui fagositosis.
Jenis leukosit yang diamati pada perhitungan diferensial leukosit ikan uji, antara lain monosit, neutrofil, dan limfosit. Monosit merupakan sel fagosit yang menelan antigen penyakit (Moyle dan Cech 1988). Monosit dapat berubah menjadi makrofag ketika meninggalkan darah bersama-sama dengan neutrofil. Perlakuan RB (14%) memiliki jumlah monosit tertinggi dibandingkan dengan perlakuan K- (12.67%), dan K+ (10%) pada hari ke-1 pasca penyuntikan dengan bakteri A.hydrophila. Neutrofil adalah salah satu leukosit yang mengandung enzim lisosim yang dapat mengancurkan organisme yang dimakannya (Irianto 2005). Hasil uji statistik menunjukkan perlakuan RB memiliki pengaruh bedanyata terhadap perlakuan lainnya sejak hari ke-1 pascainfeksi dengan kondisi terus mengalami peningkatan. Peningkatan neutrofil dalam darah diduga karena meningkatnya produksi sel fagosit pada pusat organ limfoid. Infeksi menyebabkan jumlah limfosit dalam darah meningkat karena limfoid melepas leukosit untuk melawan infeksi (Dellman dan Brown 1989). Penelitian Dewanti (2010) menunjukkan dengan pemberian beta glukan dari ragi yang berasal Saccharomyces cerevisiae pada mencit dapat menstimulasi sistem imun seluler kualitatif, perlakuan penambahan ragi bir selama penelitian memiliki jumlah neutrofil tertinggi dibandingkan perlakuan lainnya yang menunjukkan perlakuan RB memiliki sistem imun yang lebih tinggi terhadap infeksi oleh bakteri.
Perlakuan K+ yang tidak memiliki tambahan immunostimulan dalam pakannya memiliki kadar limfosit yang tinggi pascainfeksi bakteri A.hydrophila. Hal ini diduga terjadinya mekanisme respons seluler produksi sel limfosit dalam jumlah besar terhadap antigen asing. Persentase limfosit ditemukan lebih tinggi dari neutrofil dan monosit dari awal sampai akhir pengamatan. Limfosit tidak bersifat fagositik, tetapi memegang peranan penting dalam pembentukan antibodi. Hari ke-3 pascainfeksi menunjukkan perlakuan RB mengalami penurunan. Penurunan limfosit juga diduga karena sel-sel limfosit beroliferasi membentuk sel T dan sel B yang didistribusikan ke situs luka dan infeksi untuk melisis dan menetralkan toksin dari antigen.
Salah satu faktor yang menunjukkan respons imun pada ikan uji adalah aktivitas fagositik. Hal ini karena fagositik merupakan proses yang memberikan perlindungan segera terhadap infeksi.Secara keseluruhan setelah terinfeksi bakteri A.hydrophila menunjukkan bahwa perlakuan RB yang memiliki kandungan senyawa imunostimulan berupa ß-glukan dalam pakan mampu meningkatkan aktivitas fagositik. Peningkatan sel makrofag (monosit dan neutrofil) dan aktivitas fagosit merupakan reaksi peningkatan tanggap kebal (kekebalan) ikan terhadap A.hydrophila melaui imunostimulan (Alifuddin 1999).
14
menekan infeksi patogen yang menyerang ikan. Penelitian Pratama (2013) menunjukkan bahwa dengan penambahan ragi bir 3% pada pakan ikan lele selama 10 hari mampu menekan angka kematian akibat infeksi A.hydrophila (76,7%) dibandingkan dengan perlakuan kontrol. Nilai kematian yang berbeda disebabkan oleh perbedaan teknik pemberian ragi bir pada penelitian ini berupa pencegahan, sedangkan pada penelitian Pratama (2013) berupa pengendalian dimana ketika uji tantang tetap diberikan pakan perlakuan. Senyawa imunostimulan tambahan tetap dihasilkan ketika terinfeksi bakteri, sehingga nilai kematian akibat infeksi bateri dapat lebih besar ditekan. Uji tantang dilakukan setelah 30 hari pemeliharaan pertumbuhan.
Ikan lele perlakuan kontrol positif mengalami kematian terbanyak pada hari ke-1 pascainfeksi sebesar 55,00% dan terus meningkat hingga hari ke-9 pasca penyuntikan menjadi 95,00%. Kondisi ini berbeda dengan perlakuan pencegahan dengan penambahan ragi bir hanya mengalami kematian sebesar 18,00%. Berdasarkan Gambar 7, tingkat kematian ikan pada perlakuan RB (71,67 ± 5,77%) lebih rendah dibandingkan dengan K+ (95,00 ± 5,00%). Tingkat kematian ikan didukung oleh hasil gejala klinis yang timbul. Pada akhir pengamatan gejala klinis, menunjukkan ikan perlakuan RB yang hidup dalam keadaan penyembuhan luka yang mulai menutup, sedangkan pada ikan perlakuan K+ yang masih hidup dalam keadaan tukak yang besar. Hal ini menunjukkan bahwa penambahan ragi limbah produksi bir dalam pakan yang mengandung ß-glukan selama 30 hari pemeliharaan dapat meningkatkan daya tahan ikan uji dengan menghambat infeksi penyakit MAS yang disebabkan oleh bakteri A.hydrophila.
Tingkat kematian ikan perlakuan RB yang lebih rendah dibandingkan K+ disebabkan adanya peningkatan daya tahan tubuh ikan yang ditandai dengan meningkatnya jumlah total leukosit yang berperan sebagai pertahanan nonspesifik dan adanya peningkatan indeks fagositosis. Bila telah terjadi infeksi oleh bakteri A.hydrophila maka pertumbuhan bakteri didalam tubuh ikan akan berlangsung sangat cepat dan produk toksin yang dihasilkan dapat menyebabkan kerusakan yang tidak pulih, sehingga dapat menyebabkan kematian pada ikan uji (Brenden dan Huizinga 1986). Perlakuan K+ hanya dapat mengandalkan kekebalan tubuh yang terdapat dalam tubuhnya sendiri sehingga proses penyembuhan luka akan membutuhkan waktu yang lebih lama dibandingkan dengan perlakuan pencegahan.
KESIMPULAN DAN SARAN
Kesimpulan
15
Saran
Perlu dilakukan penelitian lebih lanjut untuk memaksimalkan pemanfaatan ragi bir di lapang berupa tindakan pengendalian. Tindakan ini berupa pemberian pakan RB yang diberikan selama proses pemeliharaan dan setelah uji tantang Aeromonas hydrophila.
DAFTAR PUSTAKA
Abdullah Y. 2008. Efektivitas ekstrak daun paci-paci Leucas lavandulaefolia untuk pencegahan dan pengobatan infeksi penyakit MAS Motile Aeromonad Septicaemia ditinjau dari patologi makro dan hematologi ikan lele dumbo Clarias sp [skripsi]. Bogor (ID): Institut Pertanian Bogor. Alamanda IE, Noor SH, Agung B. 2007. Penggunaan metode hematologi dan
pengamatan endoparasit darah untuk penetapan kesehatan ikan lele dumbo (Clarias gariepinus) di Kolam Budidaya Desa Mangkubumen Boyolali. Biodiversitas. 8(1): 34-38.
Alifuddin M. 1999. Peran imunostimulan (Lipopolisakarida, Saccharomyces cerevisiae dan levamisol) pada gambaran darah respon imunitas ikan jambal siam (Pangasius hypophthalmus Fowler) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Anderson DP, SiwickiAK. 1993. Basic Haematology and Serology for Fish Health Programs. Paper Presented in Second Symposium on Diseases in
Asian Aquaculture “Aquatic Animal Health and the Environment”.
Phuket, Thailand. 25-29 th Oktober 1993. 185-202.
Angka SL, SU Pramono, F Pasaribu, M Alifuddin. 1982. Isolasi dan identifikasi jasad renik penyebab epidemic penyakit bercak merah pada ikan di Jawa Barat. Buletin Perikanan. 1:1-14.
Astuti AB. 2003. Interaksi pestisida dan infeksi bakteri Aeromonas hydrophila pada ikan lele dumbo Clarias sp. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Brenden RA, HuizingaHW. 1986. Pathophysiology of experimental Aeromonas hydrophila infection in goldfish Carasius auratus.L. J Fish Diseases. 9:156-167.
Cipriano R. 2001. Aeromonas hydrophila and motile aeromonad septicaemia of fish. Fish Disease Leaflet. 68: 1-25.
Dellman HD, BrownEM. 1989. Buku Teks Histologi Veteriner I. Hartono (Penerjemah). Jakarta : UI Press.
Dewanti ATD. 2010. Isolasi beta glukan dari berbagai ragi dan pemanfaatannya sebagai imunostimulan pada tikus (Sprahugur-Dawley) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Effendie M.I. 1997. Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara.
Effendi I. 2004. Pengantar Akuakultur. Depok (ID): Penebar Swadaya.
16
Irianto A. 2005. Patologi Ikan Teleostei. Yogyakarta (ID): Gajah Mada University Press.
Li P, Delbert M, Gatlin III. 2003. Evaluation of brewers yeast (Saccharomyces cerevisiae) as a feed supplement for hybrid striped bass (Morone chrysops M. Saxatils). Aquaculture. 219: 681-692.
Marthen DP. 2005. Gambaran Darah Ikan Nila Oreochromis sp. yang diberi pakan lemak patin sebagai sumber lemak dalam pakan [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Nabib R, PasaribuFH. 1989. Patologi dan Penyakit Ikan, Departemen Pendidikan dan Kebudayaan. Direktorat Jendral Pendidikan Tinggi. Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor. UPT Produksi Media Informasi LSI-IPB. Bogor.
Pratama FA. 2013. Pengaruh penambahan ragi bir dalam pakan terhadap daya tahan tubuh ikan lele Clarias. sp dari infeksi bakteri Aeromonas hydrophila [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Puteri ATED. 2013. Pengaruh penambahan ragi bir dalam pakan pada dosis yang berbeda terhadap kinerja pertumuhan dan daya tahan tubuh ikan lele Clarias. sp terhadap infeksi bakteri Aeromonas hydrophila [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rumsey GL, Kinsella JE, Shetty KJ, Hughes S.G. 1991. Effect of high dietary
concentrations of brewer’s dried yeast on growth performance and liver uricase in rainbow trout (Oncorhynchus mykiss). Animal Feed Science and Technology. 33: 177-183.
Selvaraj J, Sampath K, Vaithilingam S. 2006. Adjuvant and immunostimulatory effects of ß-glucan administration in combination with lipopolysaccharide enhances survival and some immune parameters in carp challenged with Aeromonas hydrophila. Veterinary Immunology and Immunopathology. 114: 15-24.
Silvianti T. 2013. Evaluasi penambahan ragi bir Saccharomyces cerevisiae dalam pakan terhadap kinerja pertumbuhan dan daya tahan tubuh ikan mas Cyprinus carpio terhadap infeksi bakteri Aeromonas hydrophila [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Soltanian S, Stuyven E, Cox E, Sorgeloos P, Bossier P. 2009. Beta-glucans as immunostimulant in vertebrates and invertebrates. Critical Reviews in Microbiology. 35(2): 109-138.
Takeuchi. T. 1988. LaboratoryWork – Chemical Evaluation of Dietary Nutrients. In Watanabe T. ed. Fish Nutrition and Mariculture. JICA Textbook the General Aquaculture Course. Tokyo (JP): Kanagawa internat. Fish.
Wedemeyer GA, YasutakeWT. 1977. Clinical Methods for the Assessment of the Effect Environment Stress on the Fish Health. Technical Papers of the US Fish and Wildlife Service. US Depart of the Interior Fish and Wildlife Service. 89:1-17.
17
Kelangsungan Hidup
Kelangsungan hidup merupakan persentase jumlah ikan yang hidup pada akhir pemeliharaan dibandingkan dengan jumlah ikan yang ditebar. Kelangsungan hidup ini dapat dihitung dengan menggunakan rumus, yaitu
��= ��
�� � %
Keterangan :
KH = Kelangsungan hidup (%)
Nt = Jumlah ikan akhir (saat pemanenan) (ekor) N0 = Jumlah ikan awal (saat penebaran) (ekor) Laju Pertumbuhan Harian (LPH)
Laju pertumbuhan harian menunjukkan persentase pertumbuhan bobot harian ikan selama masa pemeliharaan. Bobot rata-rata awal ditimbang sebelum perlakuan dan diukur pula bobot rata-rata saat sampling dan panen. Laju pertumbuhan harian ikan yang dapat dihitung dengan menggunakan rumus Huisman (1987):
LPH = Laju pertumbuhan harian (%/hari)
�
Pertambahan panjang total menunjukan pertambahan panjang ikan selama waktu pemeliharaan. panjang rata-rata ikan awal diukur sebelum perlakuan dan diukur panjang rata-rata ikan saat sampling dan panen dengan pengambilan ikan sebanyak 30 ekor. Pertumbuhan panjang dapat dihitung menggunakan rumus, yaitu
� � = � − �
Keterangan :
Lt = Rata-rata panjang ikan pada hari ke-t (cm) Lo = Rata-rata panjang ikan pada hari ke-o (cm)
Lampiran 1 Prosedur parameter penelitian Biomassa Panen
Biomassa dihitung menggunakan rumus sebagai berikut (Effendi 2004).
� = ���
Keterangan :
�
18
Konversi Pakan
Konversi pakan didefinisikan sebagai peningkatan berat basah daging per unit berat pakan kering. Konversi pakan (KP) dianalisis berdasarkan rumus Takeuchi (1988) :
��= �
(� + � ) – � �100
Jumlah Konsumsi Pakan (JKP)
Pengukuran JKP ditentukan dengan menimbang jumlah pakan yang diberikan dikurangi jumlah pakan yang tidak dimakan selama 30 hari pemberian pakan uji.
Kadar Hematokrit
Ujung tabung hematokrit dicelupkan kedalam tabung yang telah berisi darah sehingga tabung terisi darah sebanyak ¾ bagian. Ujung tabung ditutup dengan crytoceal, kemudian tabung disentrifugasi dengan kecepatan 3000rpm selama 5 menit. Nilai kadar hematokrit dihitung dengan cara persentase perbandingan panjang bagian endapan dan panjang volume darah dalam tabung (Anderson dan Siwicki 1993).
Kadar Hemoglobin
Darah dihisap dengan pipet sahli hingga skala 0,2 ml, kemudian darah dipindahkan kedalam tabung hemoglobin meter yang telah berisi HCl 0,1N hingga skala 10. Campuran diaduk selama 3-5 menit dan ditambahkan akuades hingga warna darah pada tabung serupa dengan warna standar. Skala dapat dibaca dengan kondisi permukaan cairan yang dicocokan dengan skala tabung sahli pada jalur g% berwarna kuning dan banyaknya hemoglobin ditunjukkan dalam gram per 100 ml darah (Wedemeyer dan Yasutake 1977).
Sel Darah Merah (SDM)
Darah dihisap dengan pipet sahli hingga skala 0,5 ditambah larutan
Hayem’s hingga skala 101. Ujung atas pipet diikat simpul dan pipet diayunkan selama 3-5 menit. Sebanyak 2 tetes pertama larutan dibuang, danlarutan berikutnya diteteskan pada permukaan Haemocytometer, tutup gelas penutup (cover glass). Jumlah sel darah merah diamati dan dihitung dengan bantuan mikroskop perbesaran 400x dan hasil perhitungan dimasukkan pada rumus.
Sel Darah Putih (SDP)
Darah dihisap dengan pipet sahli hingga skala 0,5 ditambah larutan Turk’s
hingga skala 11. Ujung atas pipet diikat simpul dan diayunkan selama 3-5 menit. Sebanyak 2 tetes pertama larutan dibuang, dan larutan berikutnya diteteskan pada permukaan Haemocytometer dan ditutup cover glass. Jumlah sel darah putih Keterangan : Bt = Biomassa ikan pada akhir pemeliharaan (gram)
B0 = Biomassa ikan pada awal pemeliharaan(gram)
Bd = Biomassa ikan yang mati selama pemeliharaan (gram)
19 diamati dan dihitung melalui bantuan mikroskop perbesaran 400x dan hasil perhitungan dimasukkan pada rumus.
Diferensial Leukosit
Gelas objek dipegang dengan ibu jari dan telunjuk. Darah diteteskan diatas gelas objek bagian kanan. Gelas objek lain diletakkan dsisi kiri dengan posisi 30odan ditarik kearah kanan hingga darah tersentuh dan tersebar rata. Gelas objek dikeringk udara dan difiksasi dalam larutan metanol selama 10 menit. Setelah itu, preparat ulas direndam larutan giemsa selama 60 menit. Preparat dicuci dengan akuades. Preparat diamati dan dihitung jumlahnya dengan bantuan mikroskop dengan cara persentasekan masing-masing tipe sel darah putih yang dihitung dalam suatu sampel kotak dibagi total sel darah putih yang ada.
Aktivitas fagositik
Darah sebanyak 50 μl dimasukkan ke dalam tabung mikro, ditambahkan
50 μl suspensi Staphylococcus aureus (108 cfu/ml). Kemudian dihomogenkan dan
diinkubasi dalam suhu ruang selama 20 menit. Sebanyak 5 μl dibuat sediaan ulas dan dikering udara. Preparat difiksasi dengan metanol selama 5 menit dan dikeringkan. Setelah itu, direndam pewarna Giemsa selama 15 menit, lalu dicuci dengan air mengalir. Preparat diamati dengan dengan cara dihitung jumlah sel yang menunjukkan proses fagositosis dari 100 sel fagosit yang teramati.
Lampiran 2 Perhitungan nilai LD50
Kepadatan
bakteri Mati Hidup
Akumulasi
Mati Hidup Rasio
Kematian Persentase
104 5 15 5 41 5/46 12.19
105 6 14 11 26 11/37 29.72
106 11 9 22 12 22/34 64.7
107 17 3 39 3 39/42 92.85
108 20 0 59 0 59/59 100
� = % kematian pada > 50−50%
% kematian pada > 50− kematian pada < 50%
= 64.7%−50% 64.7% − 27.5%
= 14.7%
34.98%
= 0,42
Log Negatif kematian 50% = -6
SP x faktor pengenceran (log 10) = 0,42-6 = -5,57 Jadi, nilai LD50 yang didapat adalah 106
20
HEMATOKRIT H0
Sumber keragaman Db R2 Jumlah Kuadrat Kuadrat Tengah P> F
Model 2 0.00000000 0.00000000 0.00 1.0000
Galat 6 0.84140000 0.14023333
Total terkoreksi 8 0.84140000
HEMATOKRIT H30
Sumber Db R2 JK KT P> F
Perlakuan 2 214.1070222 107.0535111 4923.26 <.0001
Galat 6 0.1304667 0.0217444
Total terkoreksi
8 214.2374889
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan Lampiran 3Hasil analisis statistik
Group Statistics
PERLAKUAN N Mean Std.
Deviation PERLAKUAN N Mean
Std.
Deviation
PP Control 3 4.1133 .22368 FCR kontrol 3 1.5296E3 184.01685
ragi bir 3 4.6667 .28095 ragi bir 3 1.0486E3 61.47911
Bo Control 3 2.0867E3 5.77350 EPP kontrol 3 41.0333 10.55667
ragi bir 3 2.0983E3 10.40833 ragi bir 3 59.9000 9.65971
Bt Control 3 3.1636E3 831.82970 LPH kontrol 3 4.4500 .04000
ragi bir 3 4.8359E3 712.90659 ragi bir 3 4.6000 .06557
SR Control 3 7.7000 .10536 JKP kontrol 3 4.3281E3 541.73463
ragi bir 3 8.0867 .12503 ragi bir 3 3.6780E3 87.79231
Independent Samples Test
Levene's Test for Equality of
Variances t-test for Equality of Means
F Sig. t df Sig. (2-tailed)
PP Equal variances assumed .065 .812 -2.669 4 .056
Bo Equal variances assumed 1.565 .279 -1.698 4 .165
Bt Equal variances assumed .001 .978 -2.644 4 .057
SR Equal variances assumed .298 .614 -4.096 4 .015
FCR Equal variances assumed 3.785 .124 4.294 4 .013
EPP Equal variances assumed .003 .957 -2.284 4 .084
LPH Equal variances assumed .766 .431 -3.382 4 .028
21
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Rerata N perlakuan
A 38.4367 3 RB
B 28.0900 3 K-
B 28.0900 3 K+
HEMATOKRIT H1 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 689.2484667 344.6242333 766.13 <.0001
Galat 6 2.6989333 0.4498222
Total 8 691.9474000
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N perlakuan
A 32.7400 3 K-
B 29.4567 3 RB
C 12.7533 3 K+
HEMATOKRIT H3 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 362.2374000 181.1187000 1122.17 <.0001
Galat 6 0.9684000 0.1614000
Total 8 363.2058000
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
HEMATOKRIT H10 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 382.0464222 191.0232111 188.14 <.0001
Galat 6 6.0919333 1.0153222
Total 8 388.1383556
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 39.5667 3 RB
A 38.9767 3 K-
B 25.4600 3 K+
HEMOGLOBIN H0
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 0.00000000 0.00000000 0.00 1.0000
Galat 6 1.34000000 0.22333333
Total 8 1.34000000
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N perlakuan
A 31.6467 3 RB
B 26.9367 3 K-
22
HEMOGLOBIN H30
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 10.27555556 5.13777778 50.26 0.0002
Galat 6 0.61333333 0.10222222
Total 8 10.88888889
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
HEMOGLOBIN H1 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 4.51555556 2.25777778 17.52 0.0031
Galat 6 0.77333333 0.12888889
Total 8 5.28888889
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
HEMOGLOBIN H3 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 6.99555556 3.49777778 16.74 0.0035
Galat 6 1.25333333 0.20888889
Total 8 8.24888889
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
HEMOGLOBIN H10 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 2.41555556 1.20777778 31.06 0.0007
Galat 6 0.23333333 0.03888889
Total 8 2.64888889
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 8.4000 3 RB
B 7.8333 3 K-
C 7.1333 3 K+
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 9.6000 3 RB
B 7.3333 3 K-
B 7.3333 3 K+
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 7.0000 3 RB
B 6.0667 3 K-
C 5.2667 3 K+
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 7.6000 3 K-
A 7.4667 3 RB
23
SEL DARAH MERAH H0
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 0.00000000 0.00000000 0.00 1.0000
Galat 6 0.66320000 0.11053333
Total 8 0.66320000
SEL DARAH MERAH H30
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Vlue Pr > F
Perlakuan 2 0.00020000 0.00010000 0.00 0.9983
Galat 6 0.35480000 0.05913333
Total 8 0.35500000
SEL DARAH MERAH H1 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Vlue Pr > F
Perlakuan 2 2.25828889 1.12914444 69.70 <.0001
Galat 6 0.09720000 0.01620000
Total 8 2.35548889
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 3.3967 3 K-
B 2.6733 3 RB
C 2.1767 3 K+
SEL DARAH MERAH H3 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 1.60762222 0.80381111 11.82 0.0083
Galat 6 0.40813333 0.06802222
Total 8 2.01575556
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 3.7433 3 K-
B 2.9333 3 RB
B 2.7800 3 K+
SEL DARAH MERAH H10 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 0.56726667 0.28363333 61.36 0.0001
Galat 6 0.02773333 0.00462222
Total 8 0.59500000
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 3.64000 3 K-
B 3.20333 3 RB
24
SEL DARAH PUTIH H0
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 0.000000 0.000000 0.00 1.0000
Galat 6 1131.500000 188.583333
Total 8 1131.500000
SEL DARAH PUTIH H30
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 555.5555556 277.7777778 16.23 0.0038
Galat 6 102.6666667 17.1111111
Total 8 658.2222222
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N perlakuan
A 110.667 3 RB
B 94.000 3 K-
B 94.000 3 K+
SEL DARAH PUTIH H1 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 860.2222222 430.1111111 54.52 0.0001
Galat 6 47.3333333 7.8888889
Total 8 907.5555556
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N perlakuan
A 85.000 3 K-
B 68.667 3 RB
C 61.667 3 K+
SEL DARAH PUTIH H3 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 122.0000000 61.0000000 5.72 0.0407
Galat 6 64.0000000 10.6666667
Total 8 186.0000000
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N perlakuan
A 94.667 3 K-
B A 90.667 3 K+
B 85.667 3 RB
SEL DARAH PUTIH H10 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 294.2222222 147.1111111 6.30 0.0335
Galat 6 140.0000000 23.3333333
Total 8 434.2222222
25
Hasil Uji Duncan
MONOSIT H0
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 0.00000000 0.00000000 0.00 1.0000
Galat 6 6.00000000 1.00000000
Total 8 6.00000000
MONOSIT H30
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
MONOSIT H1 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 24.88888889 12.44444444 8.62 0.0172
Galat 6 8.66666667 1.44444444
Total 8 33.55555556
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
MONOSIT H3 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 37.55555556 18.77777778 13.00 0.0066
Galat 6 8.66666667 1.44444444
Total 8 46.22222222
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 16.0000 3 RB
B 13.3333 3 K-
B 11.0000 3 K+
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N perlakuan
A 110.333 3 RB
B A 103.667 3 K-
B 96.333 3 K+
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 56.88888889 28.44444444 8.83 0.0163
Galat 6 19.33333333 3.22222222
Total 8 76.22222222
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 16.000 3 RB
B 10.667 3 K-
B 10.667 3 K+
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 14.0000 3 RB
A 12.6667 3 K-
26
MONOSIT H10 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 32.66666667 16.33333333 29.40 0.0008
Galat 6 3.33333333 0.55555556
Total 8 36.00000000
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
NEUTROFIL H0
NEUTROFIL H30
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 50.00000000 25.00000000 8.33 0.0185
Galat 6 18.00000000 3.00000000
Total 8 68.00000000
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N Perlakuan
A 19.000 3 RB
B 14.000 3 K-
B 14.000 3 K+
NEUTROFIL H1 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 72.00000000 36.00000000 15.43 0.0043
Galat 6 14.00000000 2.33333333
Total 8 86.00000000
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan
Hasil Uji Duncan
Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N perlakuan
A 22.000 3 RB
B 16.000 3 K-
B 16.000 3 K+
NEUTROFIL H3 PASCA
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 82.88888889 41.44444444 33.91 0.0005
Galat 6 7.33333333 1.22222222
Total 8 90.22222222
Karena p>f menunjukkan p<0.05 maka dilanjut dengan memakai uji Duncan Huruf yang sama menunjukkan hasil tidak berbeda nyata
Duncan Grup Mean N perlakuan
A 17.6667 3 RB
B 15.3333 3 K-
C 13.0000 3 K+
Sumber Keragaman Db Jumlah Kuadrat Kuadrat Tengah F Value Pr > F
Perlakuan 2 0.00000000 0.00000000 0.00 1.0000
Galat 6 2.00000000 0.33333333