CHANDRA NUR KHALAM. Identifikasi Kandungan Hemolimf Ulat
Sutera (
) sebagai Suplemen
dalam Kultur
Sel Serangga. Dibimbing oleh IRMA H. SUPARTO dan DONDIN
SAJUTHI.
Penggunaan
(FBS) sebagai suplemen nutrisi dalam
kultur sel sangat penting untuk mendapatkan pertumbuhan sel yang baik.
Ketergantungan yang sangat tinggi dan masalah bioetika dalam penggunaan FBS
perlu mendapat perhatian khusus. Oleh karena itu, berbagai upaya untuk mencari
pengganti atau suplemen FBS terus dilakukan. Hemolimf ulat sutera dilaporkan
mengandung banyak nutrien yang dibutuhkan untuk proses metamorfosis. Hal ini
merupakan dapat digunakan sebagai alternatif suplemen nutrisi kultur sel,
sehingga
diharapkan
dapat
mengurangi
penggunaan
FBS.
Analisis
makrokomponen hemolimf, pemisahan fraksi protein, dan pengujian hemolimf
pada kultur sel
(Sf9) dilakukan untuk menggali informasi
kandungan dan kemampuan hemolimf sebagai suplemen nutrisi kultur sel. Hasil
analisis menunjukkan kandungan air pada hemolimf 89,76% air; 2,52 mg/mL
karbohidrat; 2,35% lemak; dan 55,61 mg/mL protein. Protein hemolimf terdiri
atas 15 fraksi yang mengandung bobot molekul dari 22 kDa sampai 152 kDa.
Penggunaan hemolimf pada kultur sel Sf9 secara langsung belum menghasilkan
pertumbuhan sel yang baik. Perlakuan tanpa adaptasi dan teroksidasinya
hemolimf pada saat kultur sel diduga merupakan penyebab buruknya
pertumbuhan sel Sf9.
CHANDRA NUR KHALAM. Identification of Silkworm (
)
Hemolymph Content as Fetal Bovine Serum Supplement in Insect Cell
Culture
.
Under direction of IRMA H. SUPARTO and DONDIN SAJUTHI.
The use of fetal bovine serum (FBS) as nutritional supplement in cell
culture is very important for cell growth. High dependence and bioethical issues
on the use of FBS needs special attention. Therefore, continuous effort to search
for its replacement or supplement is still needed. Hemolymph silkworm has been
reported that it contains many nutrients needed for the process of metamorphosis.
This can be used as an alternative nutritional supplement for cell culture, so it can
reduce the use of FBS. Hemolymph macrocomponent analysis, separation of
protein fractions, and tested as medium supplement for
Skripsi
Sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Judul
: Identifikasi Kandungan Hemolimf Ulat Sutera (
) sebagai
Suplemen
dalam Kultur Sel Serangga
Nama
: Chandra Nur Khalam
NRP
: G44062689
Menyetujui,
Pembimbing I Pembimbing II
Mengetahui,
Ketua Departemen Kimia
Prof. Dr. Ir. Tun Tedja Irawadi, MS NIP 19501227 197603 2 002
Tanggal lulus:
Dr. dr. Irma H. Suparto, MS
Prof. drh. Dondin Sajuthi, MST, PhD
Puji syukur penulis panjatkan kepada Allah SWT yang telah melimpahkan
karuniaNya sehingga karya tulis ini berhasil diselesaikan. Karya tulis ini
merupakan hasil penelitian yang penulis lakukan sejak bulan Agustus 2010 hingga
Desember 2010 dengan tema hemolimf sebagai suplemen kultur sel sebagai syarat
kelulusan program sarjana kimia.
Penulis mengucapkan terima kasih sebanyak@banyaknya kepada Dr. Irma
H. Suparto, MS dan Prof. drh. Dondin Sajuthi, MST, PhD yang telah
membimbing penulis dalam kegiatan penelitian hingga pelaporan. Ucapan terima
kasih kepada Willy Praira, SSi yang telah membantu dalam teknis penelitian.
Ungkapan terima kasih penulis ucapkan kepada alm. Bapak, Ibu, seluruh
keluarga, serta teman@teman kimia atas doa dan dukungannya. Akhir kata, semoga
karya tulis ini bermanfaat.
Penulis dilahirkan di Jakarta pada tanggal 1 Juni 1988 sebagai anak ke@4
dari pasangan alm. Saman Syarif dan Sunarti. Pada tahun 2006, penulis lulus dari
SMAN 27 Jakarta dan pada tahun yang sama diterima masuk IPB melalui jalur
Undangan Seleksi Masuk IPB. Penulis memilih jurusan Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
DAFTAR GAMBAR ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Ulat Sutera ... 1
Hemolimf ... 2
Fetal Bovine Serum ... 2
Kultur Sel ... 2
SDS@PAGE ... 3
BAHAN DAN METODE
Bahan dan Alat ... 3
Lingkup Kerja ... 4
Metode ... 4
HASIL DAN PEMBAHASAN
Hemolimf ... 5
Kadar Air Hemolimf ... 6
Kadar Karbohidrat Hemolimf ... 6
Kadar Protein Hemolimf ... 6
Kadar Lemak Hemolimf ... 6
Fraksinasi Protein dengan SDS@PAGE ... 7
Pengaruh Hemolimf terhadap Pertumbuhan Sel Sf9 ... 7
SIMPULAN DAN SARAN
Simpulan ... 8
Saran ... 9
1 Ulat sutera………... 1
2 Siklus hidup ulat sutera …... 1
3 Hemolimf hasil sentrifugasi... 6
4 Hasil SDS@PAGE……...…... 7
5 Perkembangan jumlah sel pada berbagai perlakuan... 8
Kultur sel atau kultur jaringan adalah
perbanyakan sel atau jaringan secara .
Kondisi lingkungan pada kultur sel harus disesuaikan dengan kondisi pada tempat asalnya. Kondisi dan pengaturan lingkungan kultur terdiri atas media, komposisi udara, dan suhu. Media tempat pertumbuhan sel memiliki peran penting sebagai salah satu syarat kultur sel dan mengandung komponen@komponen
yang dibutuhkan dalam kultur. Media
ditambahkan dengan serum yang berperan sebagai suplemen nutrisi dalam kultur sel.
Serum berfungsi sebagai perangsang terjadinya proliferasi sel. Serum yang sering digunakan sebagai suplemen kultur sel adalah serum janin sapi atau
(FBS). Harga FBS cukup mahal sehingga biaya untuk mengultur suatu sel menjadi tinggi. Pembuatan FBS sintetik dengan menggabungkan berbagai komponen yang dibutuhkan juga sangat mahal dan tidak mudah dalam proses pembuatannya (Muniaraj
2007).
Beberapa produksi FBS kurang baik dalam prosesnya dan mendapat pertentangan dari berbagai pihak terutama pencinta binatang. Akan tetapi, kebutuhan terhadap FBS akan semakin tinggi dengan semakin banyaknya penggunaan atau kegiatan kultur sel. Serum yang diproduksi untuk setiap tahunnya diperkirakan sekitar 500.000 liter dan lebih dari 1.000.000 janin sapi harus digunakan setiap tahunnya (Gstraunthaler 2003, Jochems
2003).
Hemolimf ulat sutera mengandung protein yang cukup tinggi sehingga dapat menjadi alternatif dalam mengurangi jumlah pe@ makaian FBS. Park dan Kim (1999) telah membuktikan bahwa hemolimf ulat sutera dapat menjadi campuran FBS dalam kultur sel serangga. Hal ini merupakan suatu peluang dalam mengurangi pemakaian FBS.
Kajian lebih lanjut pada protein perlu dilakukan untuk mengetahui keberhasilan hemolimf sebagai campuran FBS pada kultur sel serangga. Hal ini dikarenakan zat per@ tumbuhan umumnya terdapat dalam bentuk protein. Melalui pemahaman kandungan atau komposisi hemolimf diharapkan dapat di@ peroleh informasi dalam pendugaan mengenai sebab hemolimf dapat berfungsi sebagai suplemen FBS dalam kultur sel serangga. Oleh karena itu, pada penelitian ini dilakukan identifikasi komponen atau kan@dungan pada hemolimf dan menguji hemolimf sebagai suplemen nutrisi dalam kultur sel serangga.
! "#!$%
Ulat sutera ( ) adalah larva
yang memiliki nilai ekonomi tinggi karena dapat menghasilkan sutera untuk bahan dasar kain. Selain sebagai penghasil sutera, ulat ini juga digunakan dalam pengobatan. Sebagai contoh, kotoran ulat sutera banyak diman@ faatkan sebagai obat jerawat (Fahas 2010).
Ulat sutera banyak ditemukan di daerah Asia. Dalam klasifikasi taksonomi, ulat sutera termasuk ke dalam ordo Lepidoptera, subordo Bombycoidea, dan famili Bombycidae (Stehr 1987). Umumnya, makanan ulat sutera adalah
daun (Gambar 1) (Sonthisombat &
Speakman 2004).
Gambar 1 Ulat sutera dan daun .
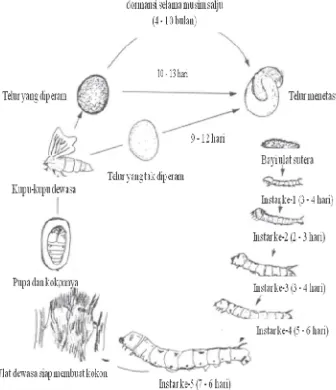
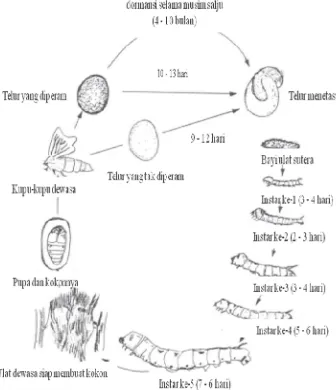
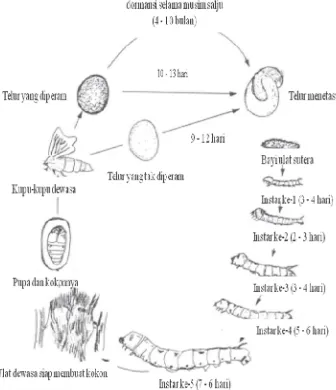
Secara keseluruhan, hidup ulat sutera ter@ bagi atas 4 tahap (Sonthisombat & Speakman 2004) (Gambar 2). Tahap pertama, telur akan menjadi ulat muda setelah 9–12 hari. Tahap kedua, ulat berkembang dengan instar I (3–4 hari), instar II (2–3 hari), instar III (3–4 hari), instar IV (5–6 hari), dan instar V (7–6 hari). Tahap ketiga, ulat menjadi kepompong dan membentuk kupu@kupu pada tahap keempat.
Telur ulat sutera berbentuk lonjong dengan bobot sekitar 1 g, panjang 1–1,3 mm, lebar 0,9–1,2 mm, dan tebal 0,5 mm dengan warna putih kekuningan (Suyono 2006). Pada tahap instar I, larva berwarna kehitaman, berkepala besar, berbulu, dan berukuran 3 cm. Selan@ jutnya larva akan bertambah gemuk, berwarna kehijauan, merontokkan bulu, lalu berganti kulit untuk memasuki fase instar II. Ulat sutera akan mengerut saat tahap akhir instar V dan mengeluarkan benang dari air liurnya
(Adam 2007).
Saat menjadi larva, ulat sutera sangat rakus. Larva akan berhenti makan dan tubuhnya memendek, gemuk, dan transparan pada tahap instar yang terakhir (Miao 2006). Ulat sutera instar V ditandai dengan penambahan bobot ulat yang bisa mencapai 10 ribu kali ulat baru lahir (Fahas 2010). Setelah menjadi kepompong ulat sutera akan berhenti makan.
$ & ' (
Hemolimf merupakan darah serangga yang memiliki beberapa fungsi berbeda dengan darah pada umumnya. Hemolimf tidak mengandung hemoglobin sehingga tidak
berwarna merah. Umumnya hemolimf
berwarna kehijauan atau kekuningan yang ditimbulkan oleh pigmen tanaman yang dikonsumsi serangga.
Ketiadaan hemoglobin mengakibatkan
hemolimf tidak berfungsi mengedarkan
oksigen. Serangga memiliki sistem tersendiri dalam mengedarkan oksigen. Hemolimf pada serangga berfungsi mentransportasikan ma@ kanan dan hormon (Mellanby 2008). Hormon pada hemolimf banyak yang berfungsi dalam pertumbuhan di antaranya adalah
(Ferkovich & Oberlander
1991) dan (Miao
2006).
Proses produksi hemolimf lebih mudah dibandingkan dengan produksi FBS. Selain sebagai suplemen kultur sel, hemolimf juga dapat digunakan sebagai antibakteri (Inoue & Kinoshita 1976), dan juga inhibitor apoptosis
sel Sf9 (Park 2002).
(FBS) adalah serum yang diperoleh dari janin sapi. Janin umumnya masih berumur 3 bulan pada saat
penyembelihan (Jochems 2003). Sapi
bunting yang sedang dipotong diambil
janinnya dan FBS dipanen melalui
pembocoran jantungnya (Even 2006).
Pengambilan FBS melalui pembocoran
jantung dimaksudkan untuk mencegah
kontaminasi dari mikroorganisme yang
berasal dari janin itu sendiri dan lingkungan
sekitar (Jochems . 2003).
Penggunaan FBS sebagai suplemen kultur sel memiliki berbagai fungsi tertentu. Menurut
Valk (2004), terdapat 4 fungsi FBS
dalam kultur sel. Pertama, sebagai hormon yang menstimulasi pertumbuhan sel dan proliferasi. Kedua, berperan dalam transpor protein, mineral, dan lemak. Ketiga, mengikat
dan menyebarkan matriks ekstraselular.
Keempat, sebagai penstabil pH dan peng@ hambat protease secara langsung.
Umumnya, FBS yang digunakan dalam kultur sel adalah 10% (Park & Kim 1999). Dalam FBS terkandung protein (terbesar),
hemoglobin, glukosa, insulin, kortison,
hormon paratiroid (PTH), prostaglandin E
(PGE), dan (PGP) (Price
& Gregory 1982). Selain FBS, alternatif serum yang lain adalah serum manusia, albumin serum sapi, albumin manusia rekombinan, dan albumin manusia murni
(Valk 2004).
# !#% $
Kultur sel adalah teknik menumbuhkan sel pada suatu media. Sel dapat dikulturkan langsung dari organismenya yang dinamakan kultur primer atau dikulturkan dari hasil kultur primer yang dinamakan subkultur (Ryan 2008). Kultur sel banyak digunakan dalam bidang farmakologi dan biologi molekular. Kultur sel juga bermanfaat dalam mengurangi penggunaan hewan yang tidak perlu dalam suatu uji (Hutahean 2002).
Sel@sel yang dikulturkan dibedakan ber@ dasarkan morfologinya. Ryan (2008) mem@ bagi tipe sel kultur ke dalam 3 bentuk. Pertama adalah epitelial, yaitu sel@sel yang terikat pada substrat dengan penampakan datar dan bentuk poligonal. Kedua adalah limfoblas, yaitu sel@sel yang tidak terikat secara normal pada substrat, tetapi tertinggal di dalam suspensi dengan bentuk bulat. Ketiga adalah fibroblas, yaitu sel@sel yang terikat pada substrat dengan bentuk memanjang dan bipolar, kadangkala berbentuk pusaran dalam berbagai kultur.
antibiotik yang dapat digunakan adalah gentamisin. Fungsi antibiotik dan fungisida ini adalah mencegah kontaminasi pada media (Phelan 1998).
Media kultur sel dapat dibeli dalam bentuk cairan dan bentuk bubuk atau disiapkan sendiri dengan menggabungkan berbagai komponen yang dibutuhkan. Media yang siap digunakan terdiri atas berbagai jenis, di
antaranya media ! " # $ "
(DME), F12, F10, Med 199, dan % .
Pemilihan suatu media harus memperhatikan spesifikasi dan kegunaannya. Sebagai contoh, DME memerlukan suplemen serum yang
cukup banyak dan digunakan untuk
pertumbuhan sel dengan kerapatan yang tinggi (Mather & Roberts 1998).
Media Grace merupakan hasil pengem@ bangan media yang dilakukan oleh Grace dalam bidang kultur sel serangga dan masih digunakan hingga saat ini. Media Grace merupakan pengembangan dari media Wyatt yang dimodifikasi dalam beberapa hal, yaitu vitamin B, nisbah ion Na/K dengan Ca/Mg, tekanan osmosis, dan lainnya (Grace 1967).
(Sf9) merupakan salah satu jenis sel serangga yang diperoleh
dari hasil kloning sel Sf21 (Granados .
2007). Sel Sf9 sering digunakan dalam berbagai penelitian. Umumnya, sel Sf9
digunakan dalam penelitian mengenai
ekspresi gen atau protein rekombinan, fisiologi, patologi, dan biologi molekular serangga (Lynn 2002).
)
Elektroforesis gel poliakrilamida@natrium dodesil sulfat (SDS@PAGE) merupakan salah satu jenis metode elektroforesis. Elektro@ foresis adalah salah satu teknik pemisahan
berdasarkan kemampuan analit melalui
medium dalam pengaruh medan listrik (Harvey 2000). SDS@PAGE termasuk ke dalam elektroforesis zona karena meng@
gunakan poliakrilamida sebagai media
penyangga (Nur & Adijuwana 1989a). Protein
hemolimf yang akan diidentifikasi
penyusunnya akan mengalami pemisahan dengan SDS@PAGE berdasarkan muatan dan bobot molekulnya. Hasil analisisnya berupa pola pemisahan protein dengan deteksi pewarnaan dan bobot molekul dari tiap fraksi yang terpisah dengan membandingkannya terhadap standar.
Gel poliakrilamida sebagai media
diperoleh dengan cara polimerisasi akrilamida
dengan adanya , @metilena@ (akrilamida)
sebagai agen pembentuk ikatan silang. Poli@ merisasi akrilamida membutuhkan tetra@ metiletilenadiamina (TEMED) dan amonium persulfat sebagai katalis. Poliakrilamida yang dihasilkan bersifat inert dan tidak terjadi adsorpsi terhadap protein yang akan dianalisis (Mikkelsen & Corton 2004). Hal ini akan menyebabkan pemisahan yang lebih baik karena ketiadaan hambatan gerak protein (Nur & Adijuwana 1989a).
Pada metode ini, SDS dengan 2@ merkaptoetanol dan pemanasan menyebabkan rusaknya struktur tiga dimensi protein dan mendenaturasinya (Nur & Adijuwana 1989a). Selain itu, SDS sebagai detergen anionik akan bergabung dengan bagian hidrofobik protein sehingga membentuk kompleks bermuatan
negatif (Mikkelsen & Corton 2004).
Kompleks protein yang besar akan ber@ migrasi lebih lambat dibandingkan dengan kompleks yang kecil.
Bufer yang digunakan berfungsi mem@ pertahankan pH dalam gel poliakrilamida. Selain itu, bufer juga berperan sebagai elek@ trolit pembawa aliran listrik. Kisaran pH yang digunakan dalam elektroforesis protein adalah 4,5–9,0 (Nur & Adijuwana 1989a).
* + !
Bahan@bahan yang digunakan adalah ulat
sutera ( ) dari peternakan Rumah
Sutera di Ciapus, feniltiourea (PTU), @
heksana, kertas saring, HCl 1 M, H2SO4 96%,
antron, etanol 95%, amonium sulfat,
akrilamida, @akrilamida, Tris, glisin, bufer
Tris@HCl 1,5 M pH 8,8; bufer Tris@HCl 1,5 M pH 6,8; gliserol 50% (v/v), bromfenol biru 1% (b/v), SDS 10% (b/v), 2@merkaptoetanol, tetrametiletilenadiamina (TEMED), amonium persulfat, metanol, asam asetat glasial, pereaksi bradford, albumin serum sapi (BSA),
& jenis ,
media Grace, kertas saring mikropori 0,22 Gm, sel serangga Sf9, dan FBS.
Peralatan yang digunakan adalah peralatan kaca, labu bulat, neraca analitik, termometer, oven, eksikator, radas Soxhlet, lempeng penangas, sentrifuga MSE, spektrofotometer
ultraviolet@tampak (UV@Vis) Shimadzu,
spektro@fotometer UV@Vis Heλios α,
' ,-#. $%/
Penelitian ini dilakukan dalam beberapa bagian, yaitu pengambilan hemolimf dari ulat sutera, penentuan kadar makrokomponen penyusun hemolimf (air, karbohidrat, protein, dan lemak), pemisahan protein dan penentuan bobot molekul penyusun protein, serta pengujian hemolimf ke dalam kultur sel serangga dengan berbagai variasi campuran dengan FBS.
$!&+$
$ , 0' $ & ' (
Ulat sutera yang telah didinginkan sekitar 1 menit, dipotong kakinya yang berada pada
daerah abdomen (perut). Ulat sutera
diposisikan di atas tabung mikrofuga yang telah berisi 50 Gg kristal PTU. Ulat sutera diurut secara perlahan sehingga hemolimf keluar dan masuk ke dalam tabung. Tabung mikrofuga ditutup dan disimpan dalam lemari pembeku.
Hemolimf dipisahkan kepingan selnya dengan cara menyentrifugasi hemolimf yang telah dicairkan setelah pembekuan dengan
kecepatan 2417,04 x selama 5 menit.
Kepingan sel dan PTU akan mengendap dan supernatan yang dihasilkan dipindahkan pada tabung mikrofuga yang baru untuk dilakukan analisis lanjut.
$ $ !# + % '% 123
Cawan porselen dikeringkan pada suhu
105 oC selama 30 menit hingga bobot konstan.
Setelah didinginkan dalam eksikator, cawan tersebut ditimbang. Sebanyak 5 g hemolimf dimasukkan kemudian dipanaskan dalam oven
pada suhu 105 oC selama 24 jam. Setelah
didinginkan dalam eksikator, ditimbang
kembali (pekerjaan dilakukan triplo). Hal tersebut dilakukan hingga bobot konstan. Kadar air dihitung dengan menggunakan rumus di bawah ini.
Keterangan:
a = bobot cawan kosong
b = bobot sampel + cawan sebelum dikeringkan
c = bobot sampel + cawan setelah dikeringkan
$ $ !# + % %&!$'
Kadar protein diukur dengan
menggunakan metode Bradford (1976). Kurva standar dibuat dengan mengukur absorbans
deret standar BSA dengan konsentrasi 0,1; 0,3; 0,5; 0,7; dan 1,0 mg/mL. Sebanyak 100 GL larutan standar ditambahkan dengan 5 mL pereaksi Bradford lalu dihomogenasikan dan diinkubasi pada suhu 37 °C selama 5 menit. Setelah itu, diukur absorbansnya dengan
spektrofotometer UV@Vis pada panjang
gelombang maksimum. Hal serupa dilakukan juga untuk sampel. Konsentrasi sampel diperoleh dengan memasukkan absorbans
sampel pada kurva standar hubungan
konsentrasi dan absorbans.
$ $ !# + % %0&*'+% !
.%'4 !& & 121
Penentuan kadar karbohidrat dilakukan berdasarkan metode antron menggunakan spektrofotometer UV@Vis. Deret standar dibuat dengan memasukkan larutan standar glukosa 0,2 mg/mL sebanyak 0,2; 0,4; 0,6; 0,8; dan 1,0 mL ke dalam tabung reaksi yang berbeda@beda. Setiap tabung reaksi ditam@ bahkan akuades hingga volumenya 1 mL. Sebanyak 5 mL pereaksi antron ditambahkan lalu dicampurkan merata dan dipanaskan selama 12 menit dalam penangas air pada suhu 100 ºC. Tabung reaksi didinginkan dengan air mengalir lalu diukur absorbansnya pada panjang gelombang maksimum. Untuk sampel dilakukan hal yang sama seperti larutan standar dengan volume sampel 1 mL.
Konsentrasi sampel diperoleh dengan
memasukkan absorbans sampel pada kurva standar.
$ $ !# + % $ - 11
Analisis kadar lemak hemolimf
menggunakan metode hidrolisis Weibull. Sebanyak 1–2 g dimasukkan ke dalam gelas piala, lalu ditambahkan 30 mL HCl 25% dan 20 mL akuades serta beberapa butir batu didih. Gelas piala ditutup dengan kaca arloji dan dididihkan selama 15 menit. Setelah mendidih, campuran disaring dengan kertas saring dalam keadaan panas lalu dicuci dengan air panas hingga bebas asam. Kertas saring tersebut dikeringkan pada suhu 100– 105 ºC lalu dimasukkan ke dalam selongsong dan diekstraksi dengan heksana menggunakan metode Soxhlet selama 3 jam. Labu yang
berisi hasil ekstrak dipanaskan untuk
menguapkan heksana lalu dikeringkan pada suhu 100–105 ºC. Setelah kering, labu
didinginkan dan ditimbang. Proses
Keterangan:
b = bobot labu setelah ekstraksi c = bobot labu kosong
a = bobot sampel
% -"' "' %&!$' +$ , )
$ ' 15
Penggumpalan protein pada hemolimf dilakukan dengan cara supernatan hasil sentrifugasi ditambahkan etanol sedikit demi sedikit sambil diaduk dengan pengaduk magnet lalu disentrifugasi pada 2417,04 x selama 10 menit. Endapan fraksi etanol diarutkan dalam 10 mL air dan ditambahkan amonium sulfat hingga konsentrasinya menjadi 60% lalu disentrifugasi dengan
kecepatan 2417,04 x selama 10 menit
sehingga diperoleh fraksi amonium sulfat. Sampel@sampel ini siap digunakan pada proses elektroforesis.
Pemisahan protein dilakukan dengan SDS@ PAGE. Larutan gel pemisah 12% (akrilamida
40%, @akrilamida 2%, bufer Tris@HCl pH
8,8, akuades, APS, dan TEMED) dimasukkan ke dalam cetakan gel dengan pipet mikro
kemudian ditambahkan dengan akuades
sampai penuh agar permukaan gel rata. Setelah gel membeku, akuades dibuang dan sisa airnya diserap dengan kertas saring.
Larutan gel penahan 4% (akrilamida 40%, @
akrilamida 2%, bufer Tris@HCl pH 6,8, akuades, APS, dan TEMED) dimasukkan ke dalam cetakan gel dan dipasang sisir berlubang lalu didiamkan sampai mengeras. Setelah gel sudah siap, dibuat sumur dalam gel yang akan diisi dengan sampel.
Preparasi sampel protein dilakukan dengan memanaskan 20 GL sampel yang telah ditam@ bahkan dengan 10 GL bufer sampel (campuran buffer Tris@HCl pH 6,8, gliserol, SDS, HCl, 2@
merkaptoetanol, bromfenol biru, dan
akuadaes) pada suhu 100 °C selama 2–5 menit. Sampel dan standar yang telah disiapkan dimasukkan ke dalam sumur dengan volume 10 GL.
Elektroforesis dioperasikan pada tegangan 150 volt selama 2 jam dalam bufer elektroforesis pH 8,3 (campuran tris, glisin, SDS, HCl, dan akuades). Setelah selesai, gel diwarnai dengan larutan
R@250 selama 15 menit. Setelah pita terlihat, gel dicuci dengan larutan dekolorisasi (campuran metanol, asam asetat glasial, dan akuades) berulang kali hingga didapatkan pita
protein biru dengan latar belakang gel tidak berwarna.
Identifikasi komponen penyusun protein sampel dilakukan dengan membandingkan pita yang diperoleh dengan pita protein standar (marker jenis
). Bobot molekul dari pita protein
ditentukan berdasarkan kurva standar
hubungan log BM dengan nilai Rm protein standar.
Rm = jarak tempuh pita jarak tempuh pewarna protein
$!&+$ # !#% # ' % / 6 5
Media Grace (Gibco) disaring untuk sterilisasi dengan kertas saring mikropori 0,22
Gm. Media Grace ditambahkan dengan
campuran FBS dengan hemolimf pada suatu tabung. Perbandingan FBS dengan hemolimf yang digunakan bervariasi, yaitu 10:0; 7,5:,2,5; 5:5; 2,5:7,5; dan 0:10. Sebanyak 100
GL inokulum yang mengandung 106 sel
serangga/mL (Sf9) diinokulasikan pada 3 mL media Grace. Sebagai perbandingan, hal tersebut dilakukan juga pada media Grace yang mengandung 10% FBS dan tanpa serum. Tabung diinkubasi pada suhu 28°C hingga 9 hari. Pertumbuhan sel dimonitor pada hari ke@ 3, 6, dan 9 pada mikroskop menggunakan hemositometer.
$ & ' (
Hemolimf yang diperoleh dari ulat sutera berupa cairan berwarna kuning (Gambar 3). Warna hemolimf akan berubah menjadi kecokleatan setelah selang waktu tertentu yang diakibatkan proses enzimatis. Polifenol oksidase akan mengoksidasi senyawaan fenol menjadi bentuk keton sehingga berwarna cokelat. Peristiwa ini tidak diharapkan karena dikhawatirkan akan merusak kandungan hemolimf yang berfungsi sebagai suplemen dalam kultur sel. Pencegahan pencokelatan enzimatis pada hemolimf dilakukan dengan menambahkan feniltiourea (PTU). Zat ini merupakan inhibitor yang efektif dalam pencegahan melanisasi hemolimf serangga
(Arakawa 1995). Ion tembaga yang
pada saat kultur sel. Zat PTU bersifat toksik bagi sel (Wyatt 1956).
Gambar 3 Hemolimf hasil sentrifugasi.
+ % '%
Penentuan kadar air hemolimf dilakukan menggunakan metode gravimetri (AOAC 1984) pada suhu 105 ºC. Air yang terkandung di dalam hemolimf akan menguap pada suhu di atas 100 °C. Banyaknya air yang terkandung diketahui dari selisih bobot sebelum dan setelah pemanasan. Hasil menunjukkan bahwa air merupakan penyusun hemolimf yang terbesar. Kadar air rata@rata pada hemolimf adalah 89,76%. Nilai kadar air ini tidak jauh berbeda dengan pengukuran
kadar air hemolimf oleh Nakayama et .
(1990) yang bernilai 89% pada hari ke@7 instar V. Kadar air yang sangat tinggi ini sudah dapat diduga dari wujud hemolimf yang berupa cairan encer.
+ % %0&*'+% !
Karbohidrat pada hemolimf diukur
menggunakan pereaksi antron 0,1%. Antron dalam asam sulfat akan membentuk senyawa hidroksi furfural@antron jika bereaksi dengan glukosa (Sukesi & Paramitha 2009). Warna yang terbentuk dari reaksi antron dengan standar gula adalah biru kehijauan yang khas
(Apriyantono . 1989). Warna hijau biru
akan menyerap radiasi pada panjang ge@ lombang sekitar 680 nm (Nur & Adijuwana 1989b). Pengukuran absorbans dilakukan pada panjang gelombang maksimum. Panjang gelombang maksimum yang diperoleh adalah 681,6 nm. Panjang gelombang ini diperoleh dengan memayarkan radiasi dari panjang gelombang dari 500–700 nm.
Kadar karbohidrat hemolimf diperoleh dengan memasukkan absorbans hemolimf pada kurva standar. Kadar karbohidrat rata@ rata hemolimf 2,52 mg/mL. Persamaan kurva standar glukosa adalah y = @0,0129 + 3,6164x
dengan nilai r2 0,9928. Kadar karbohidrat
hemolimf ini berada di antara kisaran kadar karbohidrat yang telah dianalisis oleh Wyatt
(1956) sebesar 1,66–6,35 mg/mL.
Karbohidrat pada hemolimf memiliki jumlah yang sama dan dapat lebih besar dengan karbohidrat pada FBS yang telah diukur oleh Price & Gregory (1982) dengan kisaran 0,65– 2,47 mg/mL.
+ % %&!$'
Pengukuran kadar protein hemolimf
dilakukan dengan metode Bradford
menggunakan standar BSA. Pereaksi Bradford
yang berisikan G@250 akan
membentuk warna biru jika ditambahkan pada protein. Ikatan nonkovalen akan terbentuk antara bentuk anion Coomassie Blue G@250 dan protein (Mikkelsen & Corton 2004). Penentuan panjang gelombang maksimum dilakukan dengan memayarkan radiasi dari panjang gelombang 500–700 nm. Pemayaran menghasilkan panjang gelombang maksimum pada 597 nm.
Persamaan garis kurva standar BSA yang
diperoleh y = 0,0752 + 0,9132x dan nilai r2
0,9602. Hasil pengukuran menunjukkan
bahwa kadar protein rata@rata pada hemolimf adalah 55,61 mg/mL. Kadar protein yang diperoleh jauh lebih besar dibandingkan karbohidrat walaupun hemolimf merupakan darah pada ulat yang berfungsi mengedarkan
makanan sehingga banyak mengandung
karbohidrat. Protein menyusun sekitar 1,2–5,3
% dari hemolimf pada instar V (Wyatt .
1956). Total protein pada hemolimf ini tidak jauh berbeda dengan protein pada FBS. Total protein pada FBS berkisar 32–70 mg/mL (Price & Gregory 1982). Berdasarkan data tersebut, protein pada hemolimf diduga mampu menggantikan protein FBS dari segi kuantitasnya.
+ % $
dengan total lemak pada FBS yang telah
dianalisis oleh Caruso . (1972) berkisar
1,4–4,4 mg/mL maka kadar lemak hemolimf melebihi jumlah kadar lemak FBS.
% -"' "' %&!$' +$ , )
Protein pada hemolimf dicirikan kom@ ponen penyusunnya serta ditentukan bobot molekulnya. Pemisahan dan penentuan bobot molekul penyusun protein dilakukan dengan SDS@PAGE. Pencirian pada protein hemolimf dilakukan karena diduga bahwa zat faktor pertumbuhan umumnya berupa protein. Selain itu, jumlah protein yang cukup banyak bahkan melebihi karbohidrat di dalam hemolimf merupakan salah satu pertimbangan bahwa yang akan berperan sebagai suplemen nutrisi kultur sel adalah protein.
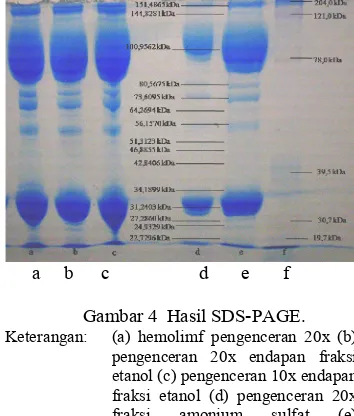
Pemisahan penyusun protein hemolimf dengan SDS@PAGE menghasilkan 15 pita (Gambar 4). Pola yang terbentuk dari berbagai perlakuan (a,b,c,d, dan e) pada hemolimf tetap menunjukkan pola yang sama. Perbedaannya hanya terletak pada jelas atau tidaknya pe@ misahan. Penggunaan etanol dilakukan untuk memisahkan protein dari lemak dan dilanjut@ kan dengan menambahkan amonium sulfat untuk memisahkan protein dari karbohidrat.
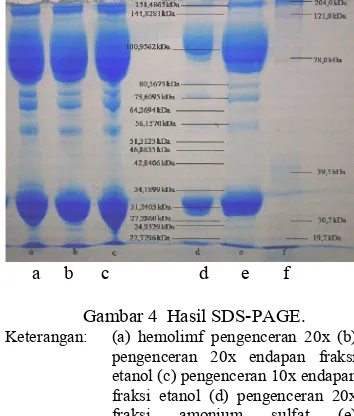
a b c d e f
Gambar 4 Hasil SDS@PAGE.
Keterangan: (a) hemolimf pengenceran 20x (b) pengenceran 20x endapan fraksi etanol (c) pengenceran 10x endapan fraksi etanol (d) pengenceran 20x fraksi amonium sulfat (e) pengenceran 10x fraksi amonium sulfat (f) &
Pita yang terbentuk ditentukan bobot mo@ lekulnya dengan memasukkan nilai mobilitas relatif (Rm) ke dalam persamaan kurva standar protein yang telah diketahui boboot
molekul penyusunnya (marker). Bobot
molekul dari ke@15 pita tersebut berturut@turut dari mobilitas relatif yang kecil menuju besar
adalah 151,4865; 144,8281; 100,9562;
80,5675; 73,6095; 64,2964; 56,1570; 51,3123; 46;8855; 42,8406; 34,1899; 31,2403; 27,2860; 24,9329; dan 22,7796 kDa. Bobot molekul yang kecil akan bermigrasi lebih jauh (Rm yang besar) dibandingkan dengan bobot molekul yang lebih besar (Rm yang kecil) (Mikkelsen & Corton 2004). Pita dengan bobot molekul 100,9562 kDa dan 31,2403 kDa merupakan pita yang lebih besar dan lebih tebal dibandingkan pita yang lain. Diduga pita yang tebal ini diakibatkan sangat banyaknya jumlah komponen tersebut dalam hemolimf.
Pita dengan bobot 51,3123; 46,8855; 42,8406; 34,1899; 27,2860; 24,9329; 22,7796 kDa tidak dapat dilihat secara jelas pada fraksi amonium sulfat dengan pengenceran 10x. Hal ini dikarenakan konsentrasinya sangat kecil dan diperkirakan jumlahnya mendekati limit
deteksi . Umumnya
mendeteksi protein dengan jumlah
terendah 50 ng tiap pita protein (Kappel .
2002).
Polipeptida yang terbentuk perlu di@ identifikasi lebih lanjut mengenai penyusun@ nya. Terdapat 19 asam amino pada hemolimf, yaitu glisin, alanin, β@alanin, valin, leusin, isoleusin, prolin, fenilalanin, tirosin, serin, treonin, asam aspartat, asparagin, asam glutamat, glutamin, arginin, lisin, histidin, dan
metionin (Wyatt 1955). Asam amino ini
akan bergabung menjadi polipeptida dengan bobot molekul seperti yang diperoleh dari pemisahan dengan SDS@PAGE.
Analisis lanjut terhadap fraksi protein dilakukan untuk mengetahui jenis zat faktor pertumbuhan di dalam hemolimf. Salah satu contoh faktor pertumbuhan pada hemolimf yang telah diidentifikasi adalah protein
pemacu dalam replikasi
nucleopolyhedrovirus (BmNPV) (Kanaya & Kobayashi 2000). Sebagai perbandingan, FBS memiliki banyak hormon di antaranya adalah insulin, kortison, hormon paratiroid (PTH), prostaglandin E (PGE), dan
(PGP),
(FSH), , hormon per@
tumbuhan, dan lainnya (Price & Gregory 1982).
$ , %#* $ & ' ( !$%* + .
$%!# 0#* $ (1
kemampuan hemolimf sebagai suplemen nutrisi. Jumlah sel dihitung setiap 3 hari hingga hari ke@9 untuk melihat kemampuan hemolimf sebagai suplemen nutrisi kultur sel. Perkembangan jumlah sel selama 9 hari dari berbagai perlakuan suplemen nutrisi dapat dilihat pada Gambar 5.
Gambar 5 Perkembangan jumlah sel Sf9 dengan media pada berbagai
campuran
(FBS) dan hemolimf (H)
Berdasarkan grafik uji perkembangan jumlah sel (Gambar 5), pertumbuhan sel yang paling baik adalah pada penggunaan FBS
10%. Penggunaan hemolimf tidak
menunjukkan pengaruh yang baik dalam pertumbuhan jumlah sel. Semakin banyak hemolimf yang digunakan, pertumbuhan sel menjadi lebih besar penurunannya. Bahkan
kultur sel tanpa penambahan serum
menunjukkan jumlah sel yang selalu
meningkat dan ini lebih baik dibandingkan dengan adanya keberadaan hemolimf yang
menunjukkan penurunan jumlah sel.
Campuran hemolimf yang paling baik adalah FBS 7,5% : hemolimf 2,5%. Namun, cam@ puran suplemen ini hanya memberikan pertumbuhan sel sampai hari ke@6 dan setelah hari ke@6 jumlah sel menurun.
Penggunaan hemolimf sebagai suplemen
nutrisi tidak menunjukkan hasil yang
diharapkan. Diduga ada beberapa penyebab penggunaan hemolimf tidak menunjukkan hasil yang diharapkan. Pertama adalah
ketidakmampuan sel Sf9 menyesuaikan
kondisi dengan keberadaan hemolimf sebagai suplemen nutrisi. Hal ini disebabkan sel Sf9 yang digunakan merupakan hasil subkultur
dari kondisi media yang disuplementasi nutrisinya oleh FBS sebesar 10%. Walaupun kandungan karbohidrat, protein, dan lemak hemolimf tidak jauh berbeda dengan FBS, tetapi belum tentu jenis penyusunnya sama. Oleh karena itu dibutuhkan adaptasi terlebih dahulu pada kondisi sedikit nutrisi sehingga sel Sf9 dapat menggunakan hemolimf sebagai suplemen nutrisi.
Kedua adalah berubahnya warna hemolimf pada saat inkubasi kultur sel Sf9 dari warna kuning menjadi coklat kehitaman (Gambar 6). Warna coklat kehitaman ini mengindikasikan terjadinya oksidasi pada hemolimf sehingga terbentuk senyawaan kuinon yang toksik bagi sel sehingga menghambat pertumbuhan (Park 1998). Dibutuhkan suatu cara agar hemolimf tidak teroksidasi, yaitu dengan
menggunakan penghambat kerja enzim
polifenol oksidase. Zat PTU yang berfungsi sebagai penghambat proses oksidasi ini hanya digunakan saat pengambilan hemolimf dari ulat sutera. Dalam penggunaannya, hemolimf dipisahkan dari PTU dengan sentrifugasi. Hal ini dikarenakan PTU bersifat toksik bagi sel (Wyatt 1955). Glutation merupakan salah satu zat yang juga mampu menghambat reaksi oksidasi ini. Akan tetapi, glutation hanya mampu mencegah oksidasi selama 4 hari sehingga diperlukan pemanasan hemolimf pada suhu 60 °C selama 5 menit untuk menggumpalkan enzim polifenol oksidase (Wyatt 1955).
Gambar 6 Oksidasi hemolimf pada kultur sel hari ke@3.
' .#
Jumlah makrokomponen penyusun
berkisar dari 22 kDa sampai 152 kDa. Penggunaan hemolimf secara langsung dalam kultur sel tidak dapat menumbuhkan sel Sf9 dengan baik. Hal ini diduga penggunaan sel Sf9 tanpa adaptasi serta teroksidasinya hemolimf merupakan penyebab buruknya pertumbuhan sel Sf9.
%
Diperlukan analisis lanjut mengenai fraksi protein hemolimf sehingga dapat diketahui isi dari fraksi tersebut. Dilakukan adaptasi dalam kondisi sedikit nutrisi dan pencegahan oksi@ dasi hemolimf pada pengujian hemolimf sebagai suplemen nutrisi kultur sel Sf9.
Adam T, Pujiastuti Y, Irsan C. 2007. Perbaikan pola pemberian pakan daun murbei dan sanitasi ruangan untuk meningkatkan kualitas dan produksi kokon ulat sutera di Desa Payakabung Ogan Ilir Sumatera Selatan. Di dalam: Program
Penerapan IPTEKS dan Vucer. '
' (
' & # & ; Indra@ laya, 6@7 Des 2007. Sumsel: LPM Unsri. hlm 56@62.
AOAC. 1984. ) # *
*)* + . Ed ke@14. Virginia:
AOAC Int.
Apriyantono A, Fardiaz D, Puspitasari NL,
Sedarnawati, Budiyanto S. 1989. *
' . Bogor: PAU@IPB.
Arakawa T. 1995. Phenylthiourea, an
effective inhibitor of the insect
haemolymph melanization reaction,
interferes with detection of lipoprotein
hidroperoxide. * $ , 30:443@
449.
Bradford MM. 1976. A rapid and sensitive
method for quantitation of protein
utilization. The principle of protein@dye
binding. * 72:248@254.
Caruso TD, Boone CW, Mantel N, Kazam E, Stevenson RE. 1972. Quality control studies on fetal bovine serum used in
tissue culture. + - 7:174@189.
[DSN] Dewan Standardisasi Nasional. 1992.
./ # & # 0 +
12 3452 0 2553. Jakarta: Standar
Nasional Indonesia.
Ducceschi V. 1902. 11 sangue del Bombyx
mori allo stato larvale. * *
80:365.
Even MS, Sandusky CB, Barnard ND. 2006. Serum@free hybridoma culture: Ethical,
scientific and safety considerations.
6 24:105@108.
Fahas E. 2 Februari 2010. Si rakus pelahap
daun murbei. ' & 7 & .
Ferkovich SM, Oberlander H. 1991. Growth
factors in invertebrate in vitro culture. +
- ! 27:483@486.
Fournier E. 2001. '
* . Kanada: Wiley.
Freshney RI. 2006. '
. Glasgow: Wiley.
Grace TDC. 1967. Insect cell culture and virus
research. + - 3:104@117.
Granados RR, Li G, Blissard GW. 2007. Insect cell culture and biotechnology.
- 22:83@93.
Gstraunthaler G. 2003. Alternatives to the use of fetal bovine serum: Serum@free cell
culture. * 20:275@281.
Harvey D. 2000. # *
. New York: McGraw@Hill.
Hutahean S. 2002. ' ' ./
6 & & ' & . Medan: USU.
Inoue K, Kinoshita T. 1976. Bactericidial
activity of the normal, cell@free
hemolymph of silkworms ( ).
+ + 16:32@36.
Jochems CEA, Jan BF Van Der Valk, Stafleu FR, Baumans V. 2003. The use of fetal bovine serum: Ethical or scientific
problem? * 30:1@22.
Kanaya T, Kobayasi J. 2000. Purification and characterization of an insect hemolymph protein promoting in vitro replication of
8 % - 81:1135@ 1141.
Kappel W, Schuchard M, Mehigh R. 2002. Proteosilver: high sensitivity silver stain for SDS@PAGE. St.Louis: Sigma@Aldrich Co.
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head
of bacteriophage T4. 227:680@685.
Lehninger AL. 1982. ! ! & .
Jilid ke@2. Thenawidjaja M; penerjemah.
Jakarta: Erlangga. Terjemahan dari:
' )
Lynn DE. 2002. Methods for maintaining in@
sect cell cultures. 8 + 2.9:
1@6.
Mather JP, Roberts PE. 1998. +
6 : 6
6 9 . New York: Plenum.
Mellanby K. 2008. The functions of insect
blood. '
14:243 [terhubungberkala]. http://ww@
w3.interscience.wiley.com/journal/119895 886/abstract?CRETRY=1&SRETRY=0 [14 Feb 2010].
Miao . 2006. Proteomic analysis of the
silkworm ( L.) hemolymph
during developmental stage.' 7
5:2809@2814.
Mikkelsen SR, Corton E. 2004. . New Jersey: Wiley.
Muniaraj M, Lal CS, Kumar S, Sinha PK, Das
P. 2007. Mik of cow ( ), buffalo
( ) and goat (
): A better alternative for fetal bovine serum in media for the primary
isolation, in vitro cultivation and
maintenance of :
prosmatigotes. 8 # 10:1@14.
Nakayama S, Fujii S, Yamamoto R. 1990. Changes in activities of glycosidases in the hemolymph of the silkworm,
, during larval development. 8
8 59:443@451.
Nur MA, Adijuwana H. 1989a. 6 & & '
* . Bogor:
PAU@IPB.
Nur MA, Adijuwana H. 1989b. T & & &
& * . Bogor:
PAU@IPB.
Park TH, Kim EJ. 1999. Reduction of FBS concentration through adaption process in mammalian cell culture and addition of silkworm hemolymph in insect cell
culture. 8 # 9:227@229.
Park TH, Kim EJ, Rhee WJ. 2002. Silkworm hemolymph as a potent inhibitor of apoptosis in SF9 cells.
7 295:779@783.
Phelan MC. 1998. 6 9
# 6 . South
Carolina: Wiley.
Price PJ, Gregory EA. 1982. Relationship between in vitro growth promotion and biophysical and biochemical properties of
the serum supplement. + - 18:576@
584.
Ryan JA. 2008. + *
. St. Lowell: Corning.
Sonthisombat A, Speakman PT. 2004. &;
< 6 .
Patumthani: RIT.
Stehr FW. 1987. + + . Dubuque:
Kendall/Hunt.
Sukesi, Paramitha GA. 2009. Produksi abon ikan daging pari (Rayfish): karakterisasi
kimia ikan daging pari. [skripsi].
Surabaya: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh Nopember.
Suyono E. 2006. Pengaruh program kemitraan
bagi pengembangan ekonomi lokal
(KPEL) terhadap pendapatan petani budi@ daya ulat sutera di Kabupaten Wonosobo [tesis]. Semarang: Program Pascasarjana, Universitas Diponegoro.
Valk JVD . 2004. The human collection
of fetal bovine serum and possibilities for
serum@free cell and tissue culture. 6
- 18:1@12.
the silkworm, , and two other
species. 8 % ' 39:853@868.
Wyatt SS. 1956. Culture in vitro of tissue
from the silkworm, :. 8 %
CHANDRA NUR KHALAM. Identifikasi Kandungan Hemolimf Ulat
Sutera (
) sebagai Suplemen
dalam Kultur
Sel Serangga. Dibimbing oleh IRMA H. SUPARTO dan DONDIN
SAJUTHI.
Penggunaan
(FBS) sebagai suplemen nutrisi dalam
kultur sel sangat penting untuk mendapatkan pertumbuhan sel yang baik.
Ketergantungan yang sangat tinggi dan masalah bioetika dalam penggunaan FBS
perlu mendapat perhatian khusus. Oleh karena itu, berbagai upaya untuk mencari
pengganti atau suplemen FBS terus dilakukan. Hemolimf ulat sutera dilaporkan
mengandung banyak nutrien yang dibutuhkan untuk proses metamorfosis. Hal ini
merupakan dapat digunakan sebagai alternatif suplemen nutrisi kultur sel,
sehingga
diharapkan
dapat
mengurangi
penggunaan
FBS.
Analisis
makrokomponen hemolimf, pemisahan fraksi protein, dan pengujian hemolimf
pada kultur sel
(Sf9) dilakukan untuk menggali informasi
kandungan dan kemampuan hemolimf sebagai suplemen nutrisi kultur sel. Hasil
analisis menunjukkan kandungan air pada hemolimf 89,76% air; 2,52 mg/mL
karbohidrat; 2,35% lemak; dan 55,61 mg/mL protein. Protein hemolimf terdiri
atas 15 fraksi yang mengandung bobot molekul dari 22 kDa sampai 152 kDa.
Penggunaan hemolimf pada kultur sel Sf9 secara langsung belum menghasilkan
pertumbuhan sel yang baik. Perlakuan tanpa adaptasi dan teroksidasinya
hemolimf pada saat kultur sel diduga merupakan penyebab buruknya
pertumbuhan sel Sf9.
CHANDRA NUR KHALAM. Identification of Silkworm (
)
Hemolymph Content as Fetal Bovine Serum Supplement in Insect Cell
Culture
.
Under direction of IRMA H. SUPARTO and DONDIN SAJUTHI.
The use of fetal bovine serum (FBS) as nutritional supplement in cell
culture is very important for cell growth. High dependence and bioethical issues
on the use of FBS needs special attention. Therefore, continuous effort to search
for its replacement or supplement is still needed. Hemolymph silkworm has been
reported that it contains many nutrients needed for the process of metamorphosis.
This can be used as an alternative nutritional supplement for cell culture, so it can
reduce the use of FBS. Hemolymph macrocomponent analysis, separation of
protein fractions, and tested as medium supplement for
Kultur sel atau kultur jaringan adalah
perbanyakan sel atau jaringan secara .
Kondisi lingkungan pada kultur sel harus disesuaikan dengan kondisi pada tempat asalnya. Kondisi dan pengaturan lingkungan kultur terdiri atas media, komposisi udara, dan suhu. Media tempat pertumbuhan sel memiliki peran penting sebagai salah satu syarat kultur sel dan mengandung komponen@komponen
yang dibutuhkan dalam kultur. Media
ditambahkan dengan serum yang berperan sebagai suplemen nutrisi dalam kultur sel.
Serum berfungsi sebagai perangsang terjadinya proliferasi sel. Serum yang sering digunakan sebagai suplemen kultur sel adalah serum janin sapi atau
(FBS). Harga FBS cukup mahal sehingga biaya untuk mengultur suatu sel menjadi tinggi. Pembuatan FBS sintetik dengan menggabungkan berbagai komponen yang dibutuhkan juga sangat mahal dan tidak mudah dalam proses pembuatannya (Muniaraj
2007).
Beberapa produksi FBS kurang baik dalam prosesnya dan mendapat pertentangan dari berbagai pihak terutama pencinta binatang. Akan tetapi, kebutuhan terhadap FBS akan semakin tinggi dengan semakin banyaknya penggunaan atau kegiatan kultur sel. Serum yang diproduksi untuk setiap tahunnya diperkirakan sekitar 500.000 liter dan lebih dari 1.000.000 janin sapi harus digunakan setiap tahunnya (Gstraunthaler 2003, Jochems
2003).
Hemolimf ulat sutera mengandung protein yang cukup tinggi sehingga dapat menjadi alternatif dalam mengurangi jumlah pe@ makaian FBS. Park dan Kim (1999) telah membuktikan bahwa hemolimf ulat sutera dapat menjadi campuran FBS dalam kultur sel serangga. Hal ini merupakan suatu peluang dalam mengurangi pemakaian FBS.
Kajian lebih lanjut pada protein perlu dilakukan untuk mengetahui keberhasilan hemolimf sebagai campuran FBS pada kultur sel serangga. Hal ini dikarenakan zat per@ tumbuhan umumnya terdapat dalam bentuk protein. Melalui pemahaman kandungan atau komposisi hemolimf diharapkan dapat di@ peroleh informasi dalam pendugaan mengenai sebab hemolimf dapat berfungsi sebagai suplemen FBS dalam kultur sel serangga. Oleh karena itu, pada penelitian ini dilakukan identifikasi komponen atau kan@dungan pada hemolimf dan menguji hemolimf sebagai suplemen nutrisi dalam kultur sel serangga.
! "#!$%
Ulat sutera ( ) adalah larva
yang memiliki nilai ekonomi tinggi karena dapat menghasilkan sutera untuk bahan dasar kain. Selain sebagai penghasil sutera, ulat ini juga digunakan dalam pengobatan. Sebagai contoh, kotoran ulat sutera banyak diman@ faatkan sebagai obat jerawat (Fahas 2010).
Ulat sutera banyak ditemukan di daerah Asia. Dalam klasifikasi taksonomi, ulat sutera termasuk ke dalam ordo Lepidoptera, subordo Bombycoidea, dan famili Bombycidae (Stehr 1987). Umumnya, makanan ulat sutera adalah
daun (Gambar 1) (Sonthisombat &
Speakman 2004).
Gambar 1 Ulat sutera dan daun .
Secara keseluruhan, hidup ulat sutera ter@ bagi atas 4 tahap (Sonthisombat & Speakman 2004) (Gambar 2). Tahap pertama, telur akan menjadi ulat muda setelah 9–12 hari. Tahap kedua, ulat berkembang dengan instar I (3–4 hari), instar II (2–3 hari), instar III (3–4 hari), instar IV (5–6 hari), dan instar V (7–6 hari). Tahap ketiga, ulat menjadi kepompong dan membentuk kupu@kupu pada tahap keempat.
Kultur sel atau kultur jaringan adalah
perbanyakan sel atau jaringan secara .
Kondisi lingkungan pada kultur sel harus disesuaikan dengan kondisi pada tempat asalnya. Kondisi dan pengaturan lingkungan kultur terdiri atas media, komposisi udara, dan suhu. Media tempat pertumbuhan sel memiliki peran penting sebagai salah satu syarat kultur sel dan mengandung komponen@komponen
yang dibutuhkan dalam kultur. Media
ditambahkan dengan serum yang berperan sebagai suplemen nutrisi dalam kultur sel.
Serum berfungsi sebagai perangsang terjadinya proliferasi sel. Serum yang sering digunakan sebagai suplemen kultur sel adalah serum janin sapi atau
(FBS). Harga FBS cukup mahal sehingga biaya untuk mengultur suatu sel menjadi tinggi. Pembuatan FBS sintetik dengan menggabungkan berbagai komponen yang dibutuhkan juga sangat mahal dan tidak mudah dalam proses pembuatannya (Muniaraj
2007).
Beberapa produksi FBS kurang baik dalam prosesnya dan mendapat pertentangan dari berbagai pihak terutama pencinta binatang. Akan tetapi, kebutuhan terhadap FBS akan semakin tinggi dengan semakin banyaknya penggunaan atau kegiatan kultur sel. Serum yang diproduksi untuk setiap tahunnya diperkirakan sekitar 500.000 liter dan lebih dari 1.000.000 janin sapi harus digunakan setiap tahunnya (Gstraunthaler 2003, Jochems
2003).
Hemolimf ulat sutera mengandung protein yang cukup tinggi sehingga dapat menjadi alternatif dalam mengurangi jumlah pe@ makaian FBS. Park dan Kim (1999) telah membuktikan bahwa hemolimf ulat sutera dapat menjadi campuran FBS dalam kultur sel serangga. Hal ini merupakan suatu peluang dalam mengurangi pemakaian FBS.
Kajian lebih lanjut pada protein perlu dilakukan untuk mengetahui keberhasilan hemolimf sebagai campuran FBS pada kultur sel serangga. Hal ini dikarenakan zat per@ tumbuhan umumnya terdapat dalam bentuk protein. Melalui pemahaman kandungan atau komposisi hemolimf diharapkan dapat di@ peroleh informasi dalam pendugaan mengenai sebab hemolimf dapat berfungsi sebagai suplemen FBS dalam kultur sel serangga. Oleh karena itu, pada penelitian ini dilakukan identifikasi komponen atau kan@dungan pada hemolimf dan menguji hemolimf sebagai suplemen nutrisi dalam kultur sel serangga.
! "#!$%
Ulat sutera ( ) adalah larva
yang memiliki nilai ekonomi tinggi karena dapat menghasilkan sutera untuk bahan dasar kain. Selain sebagai penghasil sutera, ulat ini juga digunakan dalam pengobatan. Sebagai contoh, kotoran ulat sutera banyak diman@ faatkan sebagai obat jerawat (Fahas 2010).
Ulat sutera banyak ditemukan di daerah Asia. Dalam klasifikasi taksonomi, ulat sutera termasuk ke dalam ordo Lepidoptera, subordo Bombycoidea, dan famili Bombycidae (Stehr 1987). Umumnya, makanan ulat sutera adalah
daun (Gambar 1) (Sonthisombat &
Speakman 2004).
Gambar 1 Ulat sutera dan daun .
Secara keseluruhan, hidup ulat sutera ter@ bagi atas 4 tahap (Sonthisombat & Speakman 2004) (Gambar 2). Tahap pertama, telur akan menjadi ulat muda setelah 9–12 hari. Tahap kedua, ulat berkembang dengan instar I (3–4 hari), instar II (2–3 hari), instar III (3–4 hari), instar IV (5–6 hari), dan instar V (7–6 hari). Tahap ketiga, ulat menjadi kepompong dan membentuk kupu@kupu pada tahap keempat.
Telur ulat sutera berbentuk lonjong dengan bobot sekitar 1 g, panjang 1–1,3 mm, lebar 0,9–1,2 mm, dan tebal 0,5 mm dengan warna putih kekuningan (Suyono 2006). Pada tahap instar I, larva berwarna kehitaman, berkepala besar, berbulu, dan berukuran 3 cm. Selan@ jutnya larva akan bertambah gemuk, berwarna kehijauan, merontokkan bulu, lalu berganti kulit untuk memasuki fase instar II. Ulat sutera akan mengerut saat tahap akhir instar V dan mengeluarkan benang dari air liurnya
(Adam 2007).
Saat menjadi larva, ulat sutera sangat rakus. Larva akan berhenti makan dan tubuhnya memendek, gemuk, dan transparan pada tahap instar yang terakhir (Miao 2006). Ulat sutera instar V ditandai dengan penambahan bobot ulat yang bisa mencapai 10 ribu kali ulat baru lahir (Fahas 2010). Setelah menjadi kepompong ulat sutera akan berhenti makan.
$ & ' (
Hemolimf merupakan darah serangga yang memiliki beberapa fungsi berbeda dengan darah pada umumnya. Hemolimf tidak mengandung hemoglobin sehingga tidak
berwarna merah. Umumnya hemolimf
berwarna kehijauan atau kekuningan yang ditimbulkan oleh pigmen tanaman yang dikonsumsi serangga.
Ketiadaan hemoglobin mengakibatkan
hemolimf tidak berfungsi mengedarkan
oksigen. Serangga memiliki sistem tersendiri dalam mengedarkan oksigen. Hemolimf pada serangga berfungsi mentransportasikan ma@ kanan dan hormon (Mellanby 2008). Hormon pada hemolimf banyak yang berfungsi dalam pertumbuhan di antaranya adalah
(Ferkovich & Oberlander
1991) dan (Miao
2006).
Proses produksi hemolimf lebih mudah dibandingkan dengan produksi FBS. Selain sebagai suplemen kultur sel, hemolimf juga dapat digunakan sebagai antibakteri (Inoue & Kinoshita 1976), dan juga inhibitor apoptosis
sel Sf9 (Park 2002).
(FBS) adalah serum yang diperoleh dari janin sapi. Janin umumnya masih berumur 3 bulan pada saat
penyembelihan (Jochems 2003). Sapi
bunting yang sedang dipotong diambil
janinnya dan FBS dipanen melalui
pembocoran jantungnya (Even 2006).
Pengambilan FBS melalui pembocoran
jantung dimaksudkan untuk mencegah
kontaminasi dari mikroorganisme yang
berasal dari janin itu sendiri dan lingkungan
sekitar (Jochems . 2003).
Penggunaan FBS sebagai suplemen kultur sel memiliki berbagai fungsi tertentu. Menurut
Valk (2004), terdapat 4 fungsi FBS
dalam kultur sel. Pertama, sebagai hormon yang menstimulasi pertumbuhan sel dan proliferasi. Kedua, berperan dalam transpor protein, mineral, dan lemak. Ketiga, mengikat
dan menyebarkan matriks ekstraselular.
Keempat, sebagai penstabil pH dan peng@ hambat protease secara langsung.
Umumnya, FBS yang digunakan dalam kultur sel adalah 10% (Park & Kim 1999). Dalam FBS terkandung protein (terbesar),
hemoglobin, glukosa, insulin, kortison,
hormon paratiroid (PTH), prostaglandin E
(PGE), dan (PGP) (Price
& Gregory 1982). Selain FBS, alternatif serum yang lain adalah serum manusia, albumin serum sapi, albumin manusia rekombinan, dan albumin manusia murni
(Valk 2004).
# !#% $
Kultur sel adalah teknik menumbuhkan sel pada suatu media. Sel dapat dikulturkan langsung dari organismenya yang dinamakan kultur primer atau dikulturkan dari hasil kultur primer yang dinamakan subkultur (Ryan 2008). Kultur sel banyak digunakan dalam bidang farmakologi dan biologi molekular. Kultur sel juga bermanfaat dalam mengurangi penggunaan hewan yang tidak perlu dalam suatu uji (Hutahean 2002).
Sel@sel yang dikulturkan dibedakan ber@ dasarkan morfologinya. Ryan (2008) mem@ bagi tipe sel kultur ke dalam 3 bentuk. Pertama adalah epitelial, yaitu sel@sel yang terikat pada substrat dengan penampakan datar dan bentuk poligonal. Kedua adalah limfoblas, yaitu sel@sel yang tidak terikat secara normal pada substrat, tetapi tertinggal di dalam suspensi dengan bentuk bulat. Ketiga adalah fibroblas, yaitu sel@sel yang terikat pada substrat dengan bentuk memanjang dan bipolar, kadangkala berbentuk pusaran dalam berbagai kultur.
antibiotik yang dapat digunakan adalah gentamisin. Fungsi antibiotik dan fungisida ini adalah mencegah kontaminasi pada media (Phelan 1998).
Media kultur sel dapat dibeli dalam bentuk cairan dan bentuk bubuk atau disiapkan sendiri dengan menggabungkan berbagai komponen yang dibutuhkan. Media yang siap digunakan terdiri atas berbagai jenis, di
antaranya media ! " # $ "
(DME), F12, F10, Med 199, dan % .
Pemilihan suatu media harus memperhatikan spesifikasi dan kegunaannya. Sebagai contoh, DME memerlukan suplemen serum yang
cukup banyak dan digunakan untuk
pertumbuhan sel dengan kerapatan yang tinggi (Mather & Roberts 1998).
Media Grace merupakan hasil pengem@ bangan media yang dilakukan oleh Grace dalam bidang kultur sel serangga dan masih digunakan hingga saat ini. Media Grace merupakan pengembangan dari media Wyatt yang dimodifikasi dalam beberapa hal, yaitu vitamin B, nisbah ion Na/K dengan Ca/Mg, tekanan osmosis, dan lainnya (Grace 1967).
(Sf9) merupakan salah satu jenis sel serangga yang diperoleh
dari hasil kloning sel Sf21 (Granados .
2007). Sel Sf9 sering digunakan dalam berbagai penelitian. Umumnya, sel Sf9
digunakan dalam penelitian mengenai
ekspresi gen atau protein rekombinan, fisiologi, patologi, dan biologi molekular serangga (Lynn 2002).
)
Elektroforesis gel poliakrilamida@natrium dodesil sulfat (SDS@PAGE) merupakan salah satu jenis metode elektroforesis. Elektro@ foresis adalah salah satu teknik pemisahan
berdasarkan kemampuan analit melalui
medium dalam pengaruh medan listrik (Harvey 2000). SDS@PAGE termasuk ke dalam elektroforesis zona karena meng@
gunakan poliakrilamida sebagai media
penyangga (Nur & Adijuwana 1989a). Protein
hemolimf yang akan diidentifikasi
penyusunnya akan mengalami pemisahan dengan SDS@PAGE berdasarkan muatan dan bobot molekulnya. Hasil analisisnya berupa pola pemisahan protein dengan deteksi pewarnaan dan bobot molekul dari tiap fraksi yang terpisah dengan membandingkannya terhadap standar.
Gel poliakrilamida sebagai media
diperoleh dengan cara polimerisasi akrilamida
dengan adanya , @metilena@ (akrilamida)
sebagai agen pembentuk ikatan silang. Poli@ merisasi akrilamida membutuhkan tetra@ metiletilenadiamina (TEMED) dan amonium persulfat sebagai katalis. Poliakrilamida yang dihasilkan bersifat inert dan tidak terjadi adsorpsi terhadap protein yang akan dianalisis (Mikkelsen & Corton 2004). Hal ini akan menyebabkan pemisahan yang lebih baik karena ketiadaan hambatan gerak protein (Nur & Adijuwana 1989a).
Pada metode ini, SDS dengan 2@ merkaptoetanol dan pemanasan menyebabkan rusaknya struktur tiga dimensi protein dan mendenaturasinya (Nur & Adijuwana 1989a). Selain itu, SDS sebagai detergen anionik akan bergabung dengan bagian hidrofobik protein sehingga membentuk kompleks bermuatan
negatif (Mikkelsen & Corton 2004).
Kompleks protein yang besar akan ber@ migrasi lebih lambat dibandingkan dengan kompleks yang kecil.
Bufer yang digunakan berfungsi mem@ pertahankan pH dalam gel poliakrilamida. Selain itu, bufer juga berperan sebagai elek@ trolit pembawa aliran listrik. Kisaran pH yang digunakan dalam elektroforesis protein adalah 4,5–9,0 (Nur & Adijuwana 1989a).
* + !
Bahan@bahan yang digunakan adalah ulat
sutera ( ) dari peternakan Rumah
Sutera di Ciapus, feniltiourea (PTU), @
heksana, kertas saring, HCl 1 M, H2SO4 96%,
antron, etanol 95%, amonium sulfat,
akrilamida, @akrilamida, Tris, glisin, bufer
Tris@HCl 1,5 M pH 8,8; bufer Tris@HCl 1,5 M pH 6,8; gliserol 50% (v/v), bromfenol biru 1% (b/v), SDS 10% (b/v), 2@merkaptoetanol, tetrametiletilenadiamina (TEMED), amonium persulfat, metanol, asam asetat glasial, pereaksi bradford, albumin serum sapi (BSA),
& jenis ,
media Grace, kertas saring mikropori 0,22 Gm, sel serangga Sf9, dan FBS.
Peralatan yang digunakan adalah peralatan kaca, labu bulat, neraca analitik, termometer, oven, eksikator, radas Soxhlet, lempeng penangas, sentrifuga MSE, spektrofotometer
ultraviolet@tampak (UV@Vis) Shimadzu,
spektro@fotometer UV@Vis Heλios α,
antibiotik yang dapat digunakan adalah gentamisin. Fungsi antibiotik dan fungisida ini adalah mencegah kontaminasi pada media (Phelan 1998).
Media kultur sel dapat dibeli dalam bentuk cairan dan bentuk bubuk atau disiapkan sendiri dengan menggabungkan berbagai komponen yang dibutuhkan. Media yang siap digunakan terdiri atas berbagai jenis, di
antaranya media ! " # $ "
(DME), F12, F10, Med 199, dan % .
Pemilihan suatu media harus memperhatikan spesifikasi dan kegunaannya. Sebagai contoh, DME memerlukan suplemen serum yang
cukup banyak dan digunakan untuk
pertumbuhan sel dengan kerapatan yang tinggi (Mather & Roberts 1998).
Media Grace merupakan hasil pengem@ bangan media yang dilakukan oleh Grace dalam bidang kultur sel serangga dan masih digunakan hingga saat ini. Media Grace merupakan pengembangan dari media Wyatt yang dimodifikasi dalam beberapa hal, yaitu vitamin B, nisbah ion Na/K dengan Ca/Mg, tekanan osmosis, dan lainnya (Grace 1967).
(Sf9) merupakan salah satu jenis sel serangga yang diperoleh
dari hasil kloning sel Sf21 (Granados .
2007). Sel Sf9 sering digunakan dalam berbagai penelitian. Umumnya, sel Sf9
digunakan dalam penelitian mengenai
ekspresi gen atau protein rekombinan, fisiologi, patologi, dan biologi molekular serangga (Lynn 2002).
)
Elektroforesis gel poliakrilamida@natrium dodesil sulfat (SDS@PAGE) merupakan salah satu jenis metode elektroforesis. Elektro@ foresis adalah salah satu teknik pemisahan
berdasarkan kemampuan analit melalui
medium dalam pengaruh medan listrik (Harvey 2000). SDS@PAGE termasuk ke dalam elektroforesis zona karena meng@
gunakan poliakrilamida sebagai media
penyangga (Nur & Adijuwana 1989a). Protein
hemolimf yang akan diidentifikasi
penyusunnya akan mengalami pemisahan dengan SDS@PAGE berdasarkan muatan dan bobot molekulnya. Hasil analisisnya berupa pola pemisahan protein dengan deteksi pewarnaan dan bobot molekul dari tiap fraksi yang terpisah dengan membandingkannya terhadap standar.
Gel poliakrilamida sebagai media
diperoleh dengan cara polimerisasi akrilamida
dengan adanya , @metilena@ (akrilamida)
sebagai agen pembentuk ikatan silang. Poli@ merisasi akrilamida membutuhkan tetra@ metiletilenadiamina (TEMED) dan amonium persulfat sebagai katalis. Poliakrilamida yang dihasilkan bersifat inert dan tidak terjadi adsorpsi terhadap protein yang akan dianalisis (Mikkelsen & Corton 2004). Hal ini akan menyebabkan pemisahan yang lebih baik karena ketiadaan hambatan gerak protein (Nur & Adijuwana 1989a).
Pada metode ini, SDS dengan 2@ merkaptoetanol dan pemanasan menyebabkan rusaknya struktur tiga dimensi protein dan mendenaturasinya (Nur & Adijuwana 1989a). Selain itu, SDS sebagai detergen anionik akan bergabung dengan bagian hidrofobik protein sehingga membentuk kompleks bermuatan
negatif (Mikkelsen & Corton 2004).
Kompleks protein yang besar akan ber@ migrasi lebih lambat dibandingkan dengan kompleks yang kecil.
Bufer yang digunakan berfungsi mem@ pertahankan pH dalam gel poliakrilamida. Selain itu, bufer juga berperan sebagai elek@ trolit pembawa aliran listrik. Kisaran pH yang digunakan dalam elektroforesis protein adalah 4,5–9,0 (Nur & Adijuwana 1989a).
* + !
Bahan@bahan yang digunakan adalah ulat
sutera ( ) dari peternakan Rumah
Sutera di Ciapus, feniltiourea (PTU), @
heksana, kertas saring, HCl 1 M, H2SO4 96%,
antron, etanol 95%, amonium sulfat,
akrilamida, @akrilamida, Tris, glisin, bufer
Tris@HCl 1,5 M pH 8,8; bufer Tris@HCl 1,5 M pH 6,8; gliserol 50% (v/v), bromfenol biru 1% (b/v), SDS 10% (b/v), 2@merkaptoetanol, tetrametiletilenadiamina (TEMED), amonium persulfat, metanol, asam asetat glasial, pereaksi bradford, albumin serum sapi (BSA),
& jenis ,
media Grace, kertas saring mikropori 0,22 Gm, sel serangga Sf9, dan FBS.
Peralatan yang digunakan adalah peralatan kaca, labu bulat, neraca analitik, termometer, oven, eksikator, radas Soxhlet, lempeng penangas, sentrifuga MSE, spektrofotometer
ultraviolet@tampak (UV@Vis) Shimadzu,
spektro@fotometer UV@Vis Heλios α,
' ,-#. $%/
Penelitian ini dilakukan dalam beberapa bagian, yaitu pengambilan hemolimf dari ulat sutera, penentuan kadar makrokomponen penyusun hemolimf (air, karbohidrat, protein, dan lemak), pemisahan protein dan penentuan bobot molekul penyusun protein, serta pengujian hemolimf ke dalam kultur sel serangga dengan berbagai variasi campuran dengan FBS.
$!&+$
$ , 0' $ & ' (
Ulat sutera yang telah didinginkan sekitar 1 menit, dipotong kakinya yang berada pada
daerah abdomen (perut). Ulat sutera
diposisikan di atas tabung mikrofuga yang telah berisi 50 Gg kristal PTU. Ulat sutera diurut secara perlahan sehingga hemolimf keluar dan masuk ke dalam tabung. Tabung mikrofuga ditutup dan disimpan dalam lemari pembeku.
Hemolimf dipisahkan kepingan selnya dengan cara menyentrifugasi hemolimf yang telah dicairkan setelah pembekuan dengan
kecepatan 2417,04 x selama 5 menit.
Kepingan sel dan PTU akan mengendap dan supernatan yang dihasilkan dipindahkan pada tabung mikrofuga yang baru untuk dilakukan analisis lanjut.
$ $ !# + % '% 123
Cawan porselen dikeringkan pada suhu
105 oC selama 30 menit hingga bobot konstan.
Setelah didinginkan dalam eksikator, cawan tersebut ditimbang. Sebanyak 5 g hemolimf dimasukkan kemudian dipanaskan dalam oven
pada suhu 105 oC selama 24 jam. Setelah
didinginkan dalam eksikator, ditimbang
kembali (pekerjaan dilakukan triplo). Hal tersebut dilakukan hingga bobot konstan. Kadar air dihitung dengan menggunakan rumus di bawah ini.
Keterangan:
a = bobot cawan kosong
b = bobot sampel + cawan sebelum dikeringkan
c = bobot sampel + cawan setelah dikeringkan
$ $ !# + % %&!$'
Kadar protein diukur dengan
menggunakan metode Bradford (1976). Kurva standar dibuat dengan mengukur absorbans
deret standar BSA dengan konsentrasi 0,1; 0,3; 0,5; 0,7; dan 1,0 mg/mL. Sebanyak 100 GL larutan standar ditambahkan dengan 5 mL pereaksi Bradford lalu dihomogenasikan dan diinkubasi pada suhu 37 °C selama 5 menit. Setelah itu, diukur absorbansnya dengan
spektrofotometer UV@Vis pada panjang
gelombang maksimum. Hal serupa dilakukan juga untuk sampel. Konsentrasi sampel diperoleh dengan memasukkan absorbans
sampel pada kurva standar hubungan
konsentrasi dan absorbans.
$ $ !# + % %0&*'+% !
.%'4 !& & 121
Penentuan kadar karbohidrat dilakukan berdasarkan metode antron menggunakan spektrofotometer UV@Vis. Deret standar dibuat dengan memasukkan larutan standar glukosa 0,2 mg/mL sebanyak 0,2; 0,4; 0,6; 0,8; dan 1,0 mL ke dalam tabung reaksi yang berbeda@beda. Setiap tabung reaksi ditam@ bahkan akuades hingga volumenya 1 mL. Sebanyak 5 mL pereaksi antron ditambahkan lalu dicampurkan merata dan dipanaskan selama 12 menit dalam penangas air pada suhu 100 ºC. Tabung reaksi didinginkan dengan air mengalir lalu diukur absorbansnya pada panjang gelombang maksimum. Untuk sampel dilakukan hal yang sama seperti larutan standar dengan volume sampel 1 mL.
Konsentrasi sampel diperoleh dengan
memasukkan absorbans sampel pada kurva standar.
$ $ !# + % $ - 11
Analisis kadar lemak hemolimf
menggunakan metode hidrolisis Weibull. Sebanyak 1–2 g dimasukkan ke dalam gelas piala, lalu ditambahkan 30 mL HCl 25% dan 20 mL akuades serta beberapa butir batu didih. Gelas piala ditutup dengan kaca arloji dan dididihkan selama 15 menit. Setelah mendidih, campuran disaring dengan kertas saring dalam keadaan panas lalu dicuci dengan air panas hingga bebas asam. Kertas saring tersebut dikeringkan pada suhu 100– 105 ºC lalu dimasukkan ke dalam selongsong dan diekstraksi dengan heksana menggunakan metode Soxhlet selama 3 jam. Labu yang
berisi hasil ekstrak dipanaskan untuk
menguapkan heksana lalu dikeringkan pada suhu 100–105 ºC. Setelah kering, labu
didinginkan dan ditimbang. Proses
Keterangan:
b = bobot labu setelah ekstraksi c = bobot labu kosong
a = bobot sampel
% -"' "' %&!$' +$ , )
$ ' 15
Penggumpalan protein pada hemolimf dilakukan dengan cara supernatan hasil sentrifugasi ditambahkan etanol sedikit demi sedikit sambil diaduk dengan pengaduk magnet lalu disentrifugasi pada 2417,04 x selama 10 menit. Endapan fraksi etanol diarutkan dalam 10 mL air dan ditambahkan am