PEMURNIAN DAN KARAKTERISASI PEKTINASE DARI
Aspergillus ustus BL5
FITRIA DEWI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FITRIA DEWI. Pemurnian dan Karakterisasi Pektinase dari Aspergillus ustus BL5. Dibimbing oleh ANJA MERYANDINI dan YOPI.
Pektinase merupakan enzim ekstraseluler yang mampu mendegradasi senyawa pektin, karena mempunyai aktifitas memecah polimer pektin menjadi molekul-molekul yang lebih sederhana seperti asam galakturonat dan asam pektinat. Genus Aspergillus diketahui memproduksi metabolit sekunder dan enzim ekstraseluler seperti hemiselulase, selulase dan pektinase. Pektinase bermanfaat dalam industri sari buah dan minuman anggur, fermentasi daun teh serta industri tekstil dan kertas. Penelitian ini bertujuan untuk melakukan pemurnian dan karakterisasi pektinase ekstraseluler dari Aspergillus ustus BL5. Hasil percobaan menunjukkan bahwa Aspergillus ustus BL5 memiliki waktu produksi tertinggi pada konsentrasi substrat 2% dan pH 7, dengan waktu inkubasi jam ke-120 memiliki aktivitas spesifik sebesar 0,6 U/mg. Pemurnian pektinase dengan PEG 6000 dan ultrafiltrasi dilanjutkan dengan kromatografi filtrasi gel Sephadex G-75 menghasilkan aktivitas spesifik 4,14 U/mg, serta kemurniannya meningkat 6,94 kali dibandingkan dengan ekstrak kasarnya. Pektinase ekstraseluler dari Aspergillus ustus BL5 yang telah dimurnikan memiliki aktivitas optimum pada suhu 500 C dan pH 5. Penambahan 0,05 mM CuSO4 dapat
meningkatkan aktivitas enzim sebesar 163%.
Kata kunci : Pektinase, Aspergillus ustus BL5, pemurnian dan karakterisasi
ABSTRACT
FITRIA DEWI. Purification and Characterization of Pectinase from Aspergillus ustus BL5. Under direction of ANJA MERYANDINI and YOPI.
Pectinase, an extracellular enzymes that degrades pectin to galacturonic acid and pectinat acid. Aspergillus has been reported as a fungi that can produce secondary metabolite and extracellular of enzymes such as hemiselulase, selulase and pectinase. Pectinase plays a vital role in processing industries such as in the production of fruit juice, in fermentation tea leaves and used also at paper and textile industry. This study aimed to purify and characterize the extracellular pectinase from Aspergillus ustus BL5. Extracellular pectinase showed optimum activity with 2% substrate concentration and pH 7, in 120 hours of incubation time with 0,6 U/mg specific activity. The crude enzyme was concentrated with PEG-6000 and ultrafiltration. The crude enzyme of pectinase was purified using Sephadex G-75 gel filtration chromatography. The partial purified enzyme has specific activity 4,14 U/mg. The purity had increase 6,94 than crude enzymes. The optimum temperature and pH were 500 C and 5. The Addition of 0.05 mM CuSO4 can increased
enzyme activity to 163.87%.
iii
PEMURNIAN DAN KARAKTERISASI PEKTINASE DARI
Aspergillus ustus BL5
FITRIA DEWI
Skripsi
Sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Program Studi Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skrispi : Pemurnian dan Karakterisasi Pektinase dari Aspergillus ustus BL5
Nama
: Fitria Dewi
NIM
: G34080081
Menyetujui:
Pembimbing I,
Pembimbing II,
(Prof. Dr. Anja Meryandini)
NIP 196203271987032001
(Dr. Yopi)
NIP 196912201989011001
Mengetahui:
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
(Dr. Ence Darmo Jaya Supena)
NIP 196410021989031002
v
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia dan hidayah-Nya sehingga karya ilmiah ini berhasil diselesaikan. Laporan ini berisi tentang kegiatan penelitian yang berjudul “Pemurnian dan Karakterisasi Pektinase dari Aspergillus ustus BL5”. Penelitian ini dilaksanakan selama bulan Februari-Juni tahun 2012 di Laboratorium Biokatalis dan Fermentasi, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI).
Penulis mengucapkan terima kasih kepada Ibu Prof. Dr. Anja Meryandini dan Bapak Dr. Yopi selaku pembimbing atas saran dan bimbingannya. Terima kasih penulis ucapkan kepada Dr. Sulistijorini selaku penguji atas saran dan bimbingannya. Terima kasih penulis ucapkan kepada peneliti dan staf di Laboratorium Biokatalis dan Fermentasi, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Mbak Nanik Rahmani, Mbak Ade Andriani, Mbak Camelia, Mas Alex Prima dan Mas Dicky atas bantuannya selama pelaksanaan penelitian ini. Terima kasih kepada keluarga tercinta Papah, Mamah, dan Patra atas doa, dukungan dan kasih sayangnya. Terimakasih kepada Mas Indra atas dukungan dan perhatian yang telah diberikan. Terima kasih kepada teman-teman di Laboratorium Biokatalis dan Fermentasi Mas Ashif, Widyo, Ana, Yufi, Yana, Viska, Titi serta Ayi dan teman-teman Biologi 45 atas dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2012
RIWAYAT HIDUP
Penulis dilahirkan di Kuningan pada tanggal 8 Desember 1989 dari ayah Beni Wijaya dan ibu Eti Rostiati. Penulis merupakan putri pertama dari dua bersaudara. Tahun 2008 penulis lulus dari SMA Negeri 1 Sumber, Cirebon dan pada tahun yang sama diterima masuk di Program Studi Biologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah Ekologi Dasar pada tahun ajaran 2011/2012 dan 2012/2013. Penulis aktif di organisasi kemahasiswaan yaitu sebagai staf Dewan Perwakilan Mahasiswa (DPM), staf Kementrian Kebijakan Pertanian Badan Eksekutif Mahasiswa Keluarga Mahasiswa (BEM KM) dan ketua divisi Biosains Himpunan Mahasiswa Biologi (HIMABIO). Penulis melaksanakan Praktik Lapang (PL) di Bidang Sarana Bioproses Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong periode Juli sampai Agustus 2011. Penulis mendapatkan beberapa penghargaan prestasi akademik, diantaranya adalah Program Kreativitas Mahasiswa di Bidang Penelitian didanai oleh DIKTI pada tahun 2010, peserta Pelayaran Kebangsaan Ilmuwan Muda (PKIM) Pulau Bangka yang diselenggarakan oleh Pusat Penelitian Oseanografi Lembaga Ilmu Pengetahuan Indonesia (LIPI) pada tahun 2011 dan mendapatkan medali perak Program Kreativitas Mahasiswa Bidang Pengabdian Masyarakat Pekan Ilmiah Mahasiswa Tingkat Nasional (PIMNAS) XXIV tahun 2012 di Universitas Hassanudin Makasar.
Bogor, November 2012
vii
DAFTAR ISI
Halaman
DAFTAR TABEL ...viii
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN ... 8
PENDAHULUAN... 1
Latar Belakang ... 1
Tujuan ... 1
Waktu dan Tempat ... 1
BAHAN DAN METODE ... 1
Isolat Kapang ... 1
Penentuan Waktu Produksi Tertinggi ... 1
Pemekatan dengan Polietilen Glikol 6000 dan Ultrafiltrasi ... 2
Kromatografi Filtrasi Gel ... 2
Analisis Elektroforesis SDS-PAGE ... 2
Pengaruh Suhu, pH dan Bahan Kimia ... 2
HASIL ... 3
Penentuan Waktu Produksi Tertinggi ... 3
Pemekatan dengan Polietilen Glikol 6000 dan Ultrafiltrasi ... 3
Kromatografi Filtrasi Gel ... 3
Analisis Elektroforesis SDS-PAGE ... 4
Pengaruh Suhu, pH dan Bahan Kimia ... 4
PEMBAHASAN ... 4
Penentuan Waktu Produksi Tertinggi ... 5
Pemurnian Pektinase ... 5
Karakterisasi Pengaruh Suhu, pH dan Bahan Kimia ... 6
SIMPULAN ... 7
SARAN ... 7
DAFTAR TABEL
Halaman
1 Tahapan pemurnian enzim pektinase... 4 2 Pengaruh penambahan bahan kimia terhadap aktivitas enzim... 4
DAFTAR GAMBAR
Halaman
1 Aktivitas pektinase Aspergillus ustus BL5 pada berbagai konsentrasi
substrat pH 7 suhu ruang... 3 2 Pengaruh pH media terhadap pertumbuhan Aspergillus ustus BL5 pada
konsentrasi substrat 2% dan suhu ruang... 3 3 Kromatogram dari kolom filtrasi gel ... 3 4 Pola protein pada gel akrilamid hasil SDS-PAGE ... 4 5 Pengaruh suhu terhadap aktivitas pektinase dari Aspergillus ustus BL5
pada media pektin 2% dan pH 7... 4 6 Pengaruh pH terhadap aktivitas pektinase dari Aspergillus ustus BL5
pada media pektin 2% dan suhu 500 C... 4
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Latar Belakang
Enzim merupakan salah satu produk industri yang mempunyai nilai ekonomi cukup tinggi di pasaran dunia saat ini. Sifat protein enzim sangat menarik untuk digunakan sebagai biokatalis. Enzim dapat diperoleh dari jaringan hewan, tanaman, dan mikroorganisme. Namun dari segi teknis dan ekonomi, enzim dari mikroorganisme memiliki keunggulan diantaranya enzim dapat diproduksi dalam jumlah besar dengan mutu yang lebih seragam (Jayani et al. 2005).
Enzim merupakan protein, beberapa enzim memerlukan adanya komponen non-protein yang disebut kofaktor. Tanpa kehadiran kofaktor enzim tersebut berkurang aktivitas katalitiknya. Pada kasus ini, bagian protein yang tanpa kofaktor disebut apoenzim. Kofaktor dapat berupa molekul organik, sehingga enzim disebut koenzim, atau kofaktor dapat berupa ion logam. Keseluruhan enzim disebut holoenzim (Plamer 1991).
Salah satu mekanisme kerja enzim adalah dengan memecah struktur substrat menjadi suatu produk atau beberapa produk. Substrat untuk enzim bersifat spesifik. Pektin merupakan substrat bagi enzim pektinase.
Pektin merupakan suatu polisakarida komplek yang terdapat di dalam lamela tengah atau ruang antar sel dari jaringan tanaman tingkat tinggi. Selain itu pektinase juga dihasilkan dari bakteri dan fungi. Pektin terdiri atas galakturonan dan rhamnogalakturonan. Pektinase merupakan enzim ekstraseluler yang mampu mendegradasi senyawa pektin menjadi molekul-molekul yang lebih sederhana seperti asam galakturonat (Rashad et al. 2011) dan asam pektinat (Winarno 2010).
Enzim pektinase merupakan enzim yang telah banyak digunakan untuk proses industri. Sebagian besar pektinase diproduksi oleh fungi (Panda et al. 2004). Genus Aspergillus diketahui memproduksi metabolit sekunder dan enzim ekstraseluler seperti hemiselulase, selulase, dan pektinase.
Aspergillus merupakan kapang yang bereproduksi secara aseksual. Aspergillus menghasilkan spora ketika mendapatkan media dan kondisi lingkungan yang sesuai. Organisme ini mensekresikan enzim ke lingkungan, memecah molekul menjadi lebih sederhana dan kemudian mengabsorbsinya kembali. Mikroorganisme ini memiliki karakteristik membentuk koloni berbentuk circular, sel berbentuk bulat berwarna abu-abu, dan hifa bersepta (Bennett 2010).
Pektinase memiliki nilai komersial dalam industri sari buah dan minuman anggur (Panda et al. 2004), fermentasi daun teh (Angayarkanni et al. 2002) serta industri tekstil dan kertas (Kashyap et al. 2000). Spesies yang biasa digunakan adalah Aspergillus niger untuk industri pangan (Jayani et al. 2005). Mikroorganisme lain yang telah diketahui dapat memproduksi pektinase yaitu Aspergillus japonicus (Ishii & Yakotsuka 1975), Aspergillus oryzae (Lim et al. 1983), Aspergillus flavus (Yadav 2008), Neurospora crassa (Polizeli et al. 1991) dan Penicillium chrysogenum (Banu et al. 2010).
Tujuan
Penelitian ini bertujuan melakukan pemurnian dan karakterisasi pektinase dari Aspergillus ustus BL5. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai potensi Aspergillus ustus BL5 sebagai penghasil pektinase ekstraseluler serta memberikan karakteristik pektinasenya.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari sampai dengan bulan Juni 2012 bertempat di Laboratorium Biokatalis dan Fermentasi, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI).
Isolat Kapang
Isolat yang digunakan adalah Aspergillus ustus BL5 koleksi
Biotechnology Culture
Collection (BTCC) LIPI.
Penentuan Waktu Produksi Tertinggi
Konsentrasi substrat pektin yang digunakan adalah 0,5; 1; 1,5; 2 dan 2,5%. Nilai pH yang digunakan adalah 5, 6, 7, 8 dan 9. Sebanyak 1 mata ose Aspergillus ustus BL5 yang berumur 15 hari diinokulasikan pada 3 mL media prekultur dengan komposisi (NH4)2PO4 0,3%;
KH2PO4 0,2%; K2HPO4 0,3%; MgSO4.7H2O
mL substrat pektinase dengan 0,25 mL enzim pektinase lalu diinkubasi selama 30 menit pada suhu ruang. Reaksi dihentikan dengan penambahan 0,75 mL reagen dinitrosalisilat (DNS). Perlakuan kontrol dilakukan dengan mereaksikan substrat dengan DNS lalu ditambahkan enzim. Perlakuan blanko dilakukan dengan mereaksikan 0,75 mL DNS dengan 0,5 mL 0,01 M bufer sitrat pH 5. Kemudian sampel, kontrol dan blanko dididihkan selama 15 menit pada suhu 1000 C lalu didinginkan. Setelah dingin sampel diukur absorbansinya pada panjang gelombang 540 nm (Miller 1959).
Satu unit aktivitas enzim pektinase didefinisikan sebagai banyaknya enzim yang dapat memproduksi 1 µmol pektin dalam 1 menit. Pembuatan kurva standar dilakukan dengan berbagai konsentrasi asam galakturonat 10-1.000 ppm direaksikan dengan 0,75 mL DNS lalu dididihkan selama 15 menit pada suhu 100 0C lalu didinginkan. Setelah dingin sampel diukur absorbansinya pada panjang gelombang 540 nm.
Pemekatan dengan Polietilen Glikol 6000 dan Ultrafiltrasi
Sebanyak 80 mL enzim ekstrak kasar dimasukkan ke dalam membran dialisis kemudian ditaburi dengan PEG-6000 selama semalam di ruang pendingin. Enzim yang tersisa di dalam membran didialisis selama 6 jam dengan 0,01 M bufer sitrat pH 5 di dalam ruang pendingin dan diaduk dengan batang pengaduk. Kemudian enzim dipekatkan kembali dengan cara ultrafiltrasi menggunakan sentricon Corning Spin-X. Sampel disentrifugasi dengan kecepatan 15.000 rpm, suhu 40 C selama 15 menit.
Kromatografi Filtrasi Gel
Matriks Sephadex G-75 dikembangkan dengan cara 10 g matriks direndam dalam 200 mL 0,01 M bufer sitrat pH 5, diaduk perlahan dengan batang pengaduk, kemudian dipanaskan pada suhu 900 C selama 2 jam. Setelah dingin matriks Sephadex G-75 disimpan pada ruang pendingin selama semalam. Dekantasi dilakukan untuk menghilangkan serbuk yang terapung. Pektinase yang dimurnikan sebanyak 1 mL dan dimasukkan ke dalam kolom yang berdiameter 2 cm dan tinggi 18,5 cm. Matriks Sephadex G-75 dielusi dengan 0,01 M bufer sitrat pH 5 dengan kecepatan 1 mL/menit. Volume fraksi yang ditampung masing-masing sebanyak 1 mL. Fraksi yang dikumpulkan ada 100 microtube dan kadar protein masing-masing
microtube diukur menggunakan panjang gelombang 280 nm. Aktivitas pektinase setiap fraksi diukur dengan metode DNS.
Analisis Elektroforesis SDS-PAGE
Elektroforesis protein dengan SDS-PAGE menggunakan gel pemisah 10% poliakrilamida dan gel penahan 4% poliakrilamida. Ke dalam tabung mikro dimasukkan 20 µl sampel protein dan 5µl bufer sampel. Campuran dipanaskan dalam air mendidih selama 10 menit. Sampel dimasukkan ke dalam sumur gel penahan menggunakan siring. Selanjutnya piranti elektroforesis dipasang dan 300 mL bufer elektroforesis dituangkan ke dalam bejana elektroforesis. Proses elektroforesis berlangsung selama 4 jam pada tegangan 60 volt dan 30 mA. Gel hasil elektroforesis dilepas dari cetakan dan jarak migrasi bromfenol biru diukur dari batas atas gel pemisah. Pewarnaan yang digunakan adalah pewarna perak. Prosedurnya sebagai berikut: gel direndam dalam larutan fiksasi (25% (v/v) metanol dan 12% (v/v) asam asetat) selama semalam kemudian direndam dalam 50% (v/v) etanol selama 20 menit, kemudian diganti dengan 30% (v/v) etanol selama 2 x 20 menit, setelah dicuci direndam dalam larutan enhancer selama 1 menit, kemudian dicuci dalam aquabidest 3 x 20 detik. Larutan diwarnai dengan pewarna silver selama 30 menit, kemudian dicuci dengan aquabidest 2 x 20 detik, setelah itu direndam dalam larutan developer maksimal 10 menit, reaksi dihentikan dengan larutan fiksasi.
Pengaruh Suhu, pH dan Bahan Kimia
Penentuan suhu optimum dilakukan dengan cara menguji aktivitas pektinase dalam berbagai kisaran suhu 300 C sampai dengan 800 C (selang 100 C) dengan waktu inkubasi 30 menit. Penentuan pH optimum dilakukan dengan cara menguji aktivitas pektinase dalam berbagai nilai kisaran pH 3 sampai pH 8 (selang 0,5) pada suhu optimumnya. Pengaruh bahan kimia terhadap aktivitas enzim dilakukan dengan cara menguji aktivitas pektinase pada suhu dan pH optimumnya dengan menambahkan bahan kimia masing-masing 0,05 mM EDTA (Ethylene diamine tetraacetic acid), CaCl2, SDS (Sodium dodecyl
sulfate), DMSO (Dimethyl sulfoxide), dan CuSO4. Pengaruh suhu, pH dan bahan kimia
3
HASIL
Penentuan Waktu Produksi Tertinggi
Aktivitas pektinase dengan berbagai konsentrasi substrat pH 7 pada suhu ruang dapat dilihat pada gambar 1. Konsentrasi substrat 2% pada waktu fermentasi jam ke-120 memiliki aktivitas pektinase ekstrak kasar tertinggi sebesar 3,45 U/mL. Konsentrasi substrat 2,5% memberikan aktivitas pektinase terendah sebesar 1,26 U/mL.
Gambar 1 Aktivitas pektinase Aspergillus ustus BL5 pada berbagai konsentrasi substrat pH 7 suhu ruang
Pengaruh pH media kultur terhadap pertumbuhan Aspergillus ustus BL5 pada konsentrasi substrat 2% dan suhu ruang dapat dilihat pada gambar 2. Pertumbuhan Aspergillus ustus BL5 dengan aktivitas pektinase tertinggi dimiliki oleh media kultur pH 7 dengan aktivitas pektinase ekstrak kasar sebesar 3,45 U/mL. Pertumbuhan Aspergillus ustus BL5 dengan aktivitas pektinase ekstrak kasar terendah dimiliki oleh media kultur pH 5 dengan aktivitas sebesar 0,65 U/mL.
Gambar 2 Pengaruh pH media terhadap pertumbuhan Aspergillus ustus BL5 pada konsentrasi substrat 2% dan suhu ruang
Pemekatan dengan Polietilen Glikol 6000 dan Ultrafiltrasi
Aktivitas enzim ekstrak kasar dari waktu produksi tertinggi dapat ditingkatkan dengan pemekatan PEG 6000 dan ultrafiltrasi dari 3,45 U/mL menjadi 5,77 U/mL.
Kromatografi Filtrasi Gel
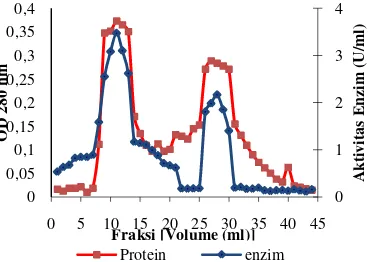
Hasil kromatografi (Gambar 3) dari tahap pemekatan menunjukkan 2 puncak aktivitas enzim. Puncak pertama yaitu dari fraksi nomor 9-13 memiliki aktivitas enzim pektinase rata-rata 3,4 U/mL. Puncak kedua yaitu dari fraksi nomor 26-30 memiliki aktivitas enzim pektinase rata-rata 2,1 U/mL.
Tahapan pemurnian yang dilakukan dari pemekatan dengan PEG 6000 dan ultrafiltrasi serta kromatografi filtrasi gel (Tabel 1) didapatkan bahwa total aktivitas mengalami penurunan dari tahap enzim ekstrak kasar ke tahap kromatografi filtrasi gel. Total protein dari tahap enzim ekstrak kasar sampai kromatografi filtrasi gel juga mengalami penurunan dari 462 mg sampai 2,7 mg.
Aktivitas spesifik dari produksi ekstrak kasar sampai kromatografi filtrasi gel terjadi kenaikan dari 0,6 U/mg menjadi 4,15 U/mg (Gel filtrasi I) dan 3,3 U/mg (Gel filtrasi II). Tingkat kemurnian meningkat dari 1 menjadi 6,94 (Gel filtrasi I) dan 5,53 (Gel filtrasi II). Perolehan (Recovery) mengalami penurunan dari enzim ekstrak kasar 100% ke pengendapan PEG 6000 dan ultrafiltrasi sebesar 50% serta mengalami penurunan yang drastis pada tahap kromatografi filtrasi gel puncak 1 menjadi 5,37% dan puncak 2 menjadi 3,33%.
Gambar 3 Kromatogram dari kolom filtrasi gel dengan matriks Sephadex G-75, elusi menggunakan 10 mM bufer sitrat pH 5, kecepatan alir 1 menit/mL 0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0
0 24 48 72 96 120 144 168
A k ti v it a s E n z im ( U /m L )
Waktu Inkubasi (Jam)
0,5 Konsentrasi substrat (%)1 1,5 2 2,5
0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0
0 24 48 72 96 120 144 168
A k ti v it a s E n z im ( U /m L )
Waktu Inkubasi (Jam)
5 6 pH 7 8 9
0 1 2 3 4 0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4
0 5 10 15 20 25 30 35 40 45
A k ti v it a s E n z im ( U /m l) OD 2 8 0 n m
Fraksi [Volume (ml)]
Tabel 1 Tahapan pemurnian enzim pektinase
Analisis Elektroforesis SDS-PAGE
Hasil elektroforesis SDS-PAGE (Gambar 4) menunjukkan bahwa enzim ekstrak kasar (2) mempunyai pita protein yang banyak, setelah pemekatan dengan PEG 6000 dan ultrafiltrasi (3) pita protein menjadi semakin jelas terlihat.
1 2 3 4
Gambar 4 Pola protein pada gel akrilamid hasil SDS-PAGE (1 : Marker; 2 : Enzim ekstrak kasar; 3 : Polietilen glikol 6000 dan ultrafiltrasi; 4 : Gel filtrasi Sephadex G-75)
Pengaruh Suhu, pH dan Bahan Kimia
Pektinase hasil pemurnian memiliki aktivitas optimum pada suhu 500 C dengan aktivitas sebesar 4,54 U/mL (Gambar 5).
Gambar 5 Pengaruh suhu terhadap aktivitas pektinase dari Aspergillus ustus BL5 pada media pektin 2% dan pH 7
Hasil percobaan menunjukkan bahwa pektinase dari Aspergillus ustus BL5 yang diinkubasi pada suhu 500 C memiliki pH optimum pada pH 5 dengan aktivitas pektinase sebesar 4,53 U/mL (Gambar 6). Nilai pH optimum pada pH 5 menunjukkan bahwa enzim ini termasuk enzim asam.
Gambar 6 Pengaruh pH terhadap aktivitas pektinase dari Aspergillus ustus BL5 pada media pektin 2% dan suhu 500 C
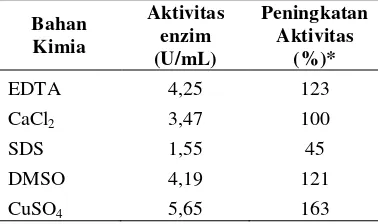
Penambahan bahan kimia juga dapat meningkatkan aktivitas enzim pektinase Aspergillus ustus BL5. Penambahan 0,05 mM CuSO4 dapat meningkatkan aktivitas enzim
sampai 163% dengan aktivitas enzim 5,65 U/mL (Tabel 2).
Tabel 2 Pengaruh penambahan bahan kimia terhadap aktivitas enzim
Bahan Kimia Aktivitas enzim (U/mL) Peningkatan Aktivitas (%)*
EDTA 4,25 123
CaCl2 3,47 100
SDS 1,55 45
DMSO 4,19 121
CuSO4 5,65 163
*Dibandingkan terhadap kontrol dengan aktivitas enzim 3,45 U/mL.
0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 4,5 5,0
30 40 50 60 70 80
A k ti v it as En zi m (u /ml )
Suhu (0C)
0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 4,5 5,0
3 3,5 4 4,5 5 5,5 6 6,5 7 7,5 8
A k ti v it as En zi m (U /ml ) pH Tahap Pemurnian Total Aktivitas (Unit) Total Protein (mg) Aktivitas Spesifik (U/mg) Tingkat kemurnian Recovery (%)
Enzim Ekstrak kasar 276 462 0,6 1 100
PEG-6000 &
Ultrafiltrasi 138,48 81,6 1,7 2,8 50
Filtrasi gel puncak 1 14,83 3,57 4,15 6,94 5,37
5
PEMBAHASAN
Penentuan Waktu Produksi Tertinggi
Aspergillus ustus BL5 ditumbuhkan pada media cair yang mengandung substrat pektin yang berperan sebagai sumber karbon serta untuk menginduksi produksi pektinase. Keberadaan suatu substrat dapat memacu suatu mikroorganisme untuk mensekresi metabolit selnya. Penentuan konsentrasi substrat terbaik dilihat dari peningkatan unit aktivitas pektinase selama inkubasi kultur hingga waktu tertinggi. Aktivitas enzim pektinase tertinggi yaitu terdapat pada konsentrasi pektin 2%, konsentrasi substrat yang sesuai ini menyebabkan substrat dapat memasuki tempat aktif enzim (Plamer 1991).
Penambahan konsentrasi substrat sampai konsentrasi substrat optimum dapat meningkatkan aktivitas enzim. Semakin banyak molekul substrat yang tersedia semakin sering molekul-molekul tersebut memasuki tempat aktif molekul enzim. Akan tetapi, terdapat keterbatasan dalam memacu kecepatan reaksi dengan cara menambahkan lebih banyak lagi substrat ke suatu konsentrasi enzim. Pada konsentrasi substrat 2,5%, konsentrasi substrat itu menjadi cukup tinggi sehingga semua tempat aktif pada semua molekul enzim sudah ditempati oleh substrat. Pada konsentrasi substrat seperti ini enzim mengalami kejenuhan, sehingga aktivitas pektinasenya paling rendah (Plamer 1991).
Pertumbuhan Aspergillus ustus BL5 dipengaruhi oleh pH media, sehingga diperlukan pH media yang sesuai supaya mendapatkan produksi tertinggi. Pertumbuhan Aspergillus ustus BL5 dengan menggunakan pH 7, pada waktu inkubasi jam ke-168 aktivitas pektinase mengalami penurunan. Perubahan aktivitas enzim diakibatkan perubahan pH lingkungan (Winarno 2010). Hal ini dapat terlihat dari perubahan pH media yang digunakan, setelah isolat diinokulasikan pada waktu inkubasi jam ke-0 nilai pH adalah 7,3 dan pada waktu inkubasi jam ke-168 mengalami kenaikan pH menjadi 8,9. Penurunan unit aktivitas enzim juga dimungkinkan dapat terjadi akibat menurunnya jumlah substrat yang tersedia di dalam media sehingga mengakibatkan kompetisi penggunaan substrat oleh jumlah sel yang semakin bertambah (Kansoh & Nagieb 2004).
Prinsip pengujian aktivitas pektinase merupakan reaksi antara enzim dan substrat yang akan menghasilkan produk berupa asam galakturonat selama waktu inkubasi. Produk ini akan bereaksi dengan reagen DNS
(Lampiran 2) dan diukur dengan spektrofotometer. Reagen DNS yang terdiri atas komponen utama 3,5-dinitrosalisilat yang berwarna kuning akan mengalami reaksi reduksi menjadi 3-amino-5-nitrosalisilat (Miller 1959). Reaksi reduksi pada gugus nitro dikarenakan adanya gula pereduksi yang merupakan hasil hidrolisis substrat oleh pektinase. Selain untuk menghentikan reaksi, reagen DNS berfungsi untuk memberikan warna pada sampel sehingga absorbannya dapat diukur dengan spektrofotometer pada panjang gelombang 540 nm. Warna yang terbentuk dari kuning sampai jingga bergantung pada kadar asam galakturonat dalam larutan, semakin banyak kadar asam galakturonat maka warnanya akan semakin pekat.
Pemurnian Pektinase
Pemekatan enzim merupakan langkah awal dari proses pemurnian enzim sebelum tahap pemurnian selanjutnya. Pemekatan protein berfungsi untuk memekatkan konsentrasi protein enzim, mereduksi volume larutan enzim, dan memisahkan enzim yang diinginkan dari sebagian enzim kontaminan yang tidak dikehendaki (Rosenberg 1996). Aktivitas enzim setelah dipekatkan mempunyai aktivitas yang lebih tinggi dibandingkan dengan enzim ekstrak kasarnya.
Tahapan pemekatan Aspergillus ustus BL5 berbeda dengan yang digunakan untuk memekatkan enzim pektinase dari Penicilium chrysogenum yang menggunakan etanol dan memperoleh recovery 57% (Banu et al. 2010). Perolehan kembali enzim (Recovery) menjadi salah satu pertimbangan untuk memilih bahan untuk memekatkan enzim.
Prinsip pemurnian dengan filtrasi gel adalah pemisahan protein berdasarkan ukuran. Matriks yang digunakan pada penelitian ini adalah Sephadex G-75 yang dapat memisahkan bobot molekul protein 3.000-80.000 Da (Rosenberg 1996). Buga et al. (2010) dan Polizeli et al. (1991) menggunakan matriks Sephadex G-100 untuk memurnikan pektinase dari Aspergillus niger SA6 dan Neurospora crassa. Hasil pemurnian enzim pektinase dari Aspergillus niger SA6 dan Neurospora crassa menunjukkan adanya satu puncak enzim. Hasil kromatografi filtrasi gel dari enzim Aspergillus ustus BL5 yang dimurnikan mempunyai dua puncak yang berbeda. Hal ini menunjukkan bahwa terdapat dua enzim pektinase yang berbeda ukurannya.
total aktivitas bukan menunjukkan aktivitas spesifik dari pektinase karena semakin banyak volume enzim di dalam setiap tahapan maka total aktivitasnya semakin besar. Total protein dari tahap enzim ekstrak kasar sampai kromatografi filtrasi gel mengalami penurunan. Penurunan kadar protein dikarenakan pada setiap tahap pemurnian terjadi pengurangan pengotor yang terdapat di dalam larutan. Pengotor dapat berupa protein lain yang tidak diinginkan atau metabolit lain.
Aktivitas spesifik adalah besarnya aktivitas enzim per miligram protein. Aktivitas dari setiap tahapan pemurnian mengalami kenaikan. Tingkat kemurnian adalah perbandingan aktivitas spesifik tiap proses pemurnian dengan aktivitas spesifik enzim ekstrak kasar sehingga apabila aktivitas spesifik dari tiap tahapan pemurnian meningkat maka tingkat kemurnian meningkat. Nilai tingkat kemurnian yang didapatkan lebih kecil dibandingkan dengan pemurnian enzim pada Penicilium chrysogenum sebesar 17,24 (Banu et al. 2010) dan Neurospora crassa sebesar 20,73 (Polizeli et al. 1991).
Niture et al. (2008) menyatakan bahwa enzim pektinase yang berasal dari fungi memiliki bobot molekul 20 sampai 78 kDa. Profil SDS PAGE menunjukkan bahwa pemurnian dengan kromatografi filtrasi gel tidak dapat memurnikan enzim pektinase. Hal ini dapat dilihat dari banyaknya pita protein. Tanpa teknik zymogram tidak dapat diketahui keberadaan pita protein pektinase.
Tahapan pemunian pektinase Aspergillus ustus BL5 berbeda jika dibandingkan dengan proses pemurnian pektinase dari Aspergillus niger SA6 dan Penicillium solitum yang menggunakan kromatografi penukar ion terlebih dahulu sebelum gel filtrasi. Aspergillus niger SA6 menghasilkan pektinase dengan bobot molekul 35 kDa dan 40 kDa (Buga et al. 2010). Penicillium solitum menghasilkan pektinase dengan bobot molekul 50 kDa (Wayne et al. 2009).
Karakterisasi Pengaruh Suhu, pH dan Bahan Kimia
Suhu merupakan salah satu faktor lingkungan yang penting dalam aktivitas suatu enzim. Kecepatan suatu reaksi enzimatik meningkat sejalan dengan meningkatnya suhu, sebagian disebabkan karena substrat akan bertubrukan dengan tempat aktif. Enzim pektinase memiliki aktivitas maksimum pada suhu tertentu. Suhu ini memungkinkan terjadinya tubrukan molekuler paling banyak tanpa mendenaturasikan enzim. Suhu optimum
pektinase dari isolat fungi dan bakteri memiliki kisaran 37-550 C (Sartoglu et al. 2001).
Suhu yang lebih besar dari suhu optimum menyebabkan reaksi enzimatik akan menurun karena protein enzim mengalami perubahan konformasi, sehingga molekul protein itu akan mengalami denaturasi. Substrat juga dapat mengalami perubahan konformasi sehingga sisi reaktifnya tidak dapat lagi atau mengalami hambatan dalam memasuki sisi aktif enzim pada suhu tinggi (Winarno 2010).
Pektinase yang berasal dari fungi memiliki aktivitas optimum di lingkungan yang asam. Suryakant et al. (2001) menyatakan bahwa dari 30 isolat fungi yang telah diteliti memiliki aktivitas poligalakturonase optimum pada pH 2,5-6,0. Peneliti lain mengungkapkan aktivitas poligalakturonase dari isolat fungi memiliki aktivitas optimum pada pH 3,8-6,5 (Buga et al. 2010).
Pektinase yang dihasilkan Aspergillus ustus BL5 memiliki karakteristik yang berbeda dibanding dengan berbagai mikroorganisme lain yang menghasilkan pektinase diantaranya yaitu, Penicillium chrysogenum optimum pada 350 C dan pH 6,5 (Banu et al. 2010), Neurospora crassa pada 450 C dan pH 6 (Polizeli et al. 1991), Penicillium Sp. pada 350 C dan pH 6 (Patil & Dayanand 2006) dan Pleurotus ostreatus pada 600 C dan pH 7,5 (Rashad et al. 2011).
Banyak bahan yang dapat mengubah
aktivitas suatu enzim dengan
menggabungkannya dalam suatu jalur yang mempengaruhi ikatan substrat dengan tempat aktif. Peningkatan dan penurunan aktivitas enzim sangat dipengaruhi oleh jenis garam logam ataupun senyawa kimia yang ditambahkan (Banu et al. 2010). Penambahan EDTA dapat meningkatkan aktivitas enzim karena berperan dalam stabilitas enzim dan juga berperan sebagai suatu kofaktor (Rosenberg 1996). Penambahan CaCl2 tidak
berpengaruh terhadap aktivitas enzim. Hasil ini berbeda dengan penambahan CaCl2 yang dapat
meningkatkan aktivitas enzim Penicilium chrysogenum hingga 104%. Penambahan SDS memiliki nilai aktivitas enzim yang terendah, karena SDS berperan mendenaturasi semua jenis protein enzim (Banu et al. 2010).
Larutan CuSO4 mempunyai peranan
sebagai aktivator pada konsentrasi yang relatif kecil. Perubahan muatan pada enzim akibat penambahan CuSO4 menyebabkan enzim
7
substrat ke sisi aktif enzim (Khaimar et al. 2009).
SIMPULAN
Pektinase isolat Aspergillus ustus BL5 koleksi BTCC-LIPI merupakan enzim yang aktif pada kondisi asam dan bersifat mesofil. Pemekatan menggunakan PEG-6000 dan ultrafiltrasi mampu memekatkan dan memisahkan enzim ekstrak kasar dari protein-protein pengotor. Kromatografi gel filtrasi menggunakan Sephadex-G75 belum dapat memisahkan molekul enzim pektinase dari protein lainnya. Penambahan CuSO4 dapat
meningkatkan aktivitas enzim pektinase.
SARAN
Perlu dilakukan tahapan teknik zymogram agar dapat menentukan pita protein yang diinginkan.
DAFTAR PUSTAKA
Angayarkanni J, Palniswamy M, Murugesan S, Swaminathan K. 2002. Improvement of tea leaves fermentation with Aspergillus spp. Pectinase. J Biosci and Bioeng 94(4):299-303.
Bennett JW. 2010. Aspergillus Molecular Biology and Genomics. Japan:AIST.
Banu R et al. 2010. Production and characterization of pectinase enzyme from Penicillium chrysogenum. Ind J of Sci and Technol 3:377-381.
Buga et al. 2010. Partially purified polygalacturonase from Aspergillus niger SA6. Afr J Biotechnol 9(52):8944-8954.
Ishii S, Yokotsuka T. 1975. Purification and properties of pectin lyase from Aspergillus japonicus. Agric Biol Chem 39:313-321.
Jayani RS, Saxena S, Gupta R. 2005. Microbial pectinolytic enzymes: a review. Elsevier 40:2931-2944.
Kansoh AL, Nagieb ZA. 2004. Xylanase and mananase enzyme from Streptomyces galbus NR and their use in biobleaching of softwood kraft pulp. Ant van Lee 85:103-114.
Kashyap DR, Chandra SKA, Tewari R. 2000. Production, purification and characterization of pectinase from a Bacillus sp. DT7. World J Microbiol Biotechnol 16:277−282.
Khaimar Y et al. 2009. Study of pectinase production in submerged fermentation using different strains of Aspergillus niger. J Microbiol 1:13-17.
Lim JW, Fujio Y, Ueda S. 1983. Purification and characterization of pectinesterase and pectin lyase from Aspergillus oryzae A-3. J Appl Biochem 193:265-275.
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal chem 31:426-428.
Niture SK et al. 2008. Comparative biochemical and structural characterization of fungal polygalacturonase. J Biotechnol 63:1-19.
Panda T, Nair SR, Kumar PM. 2004. Regulation of synthesis of pectinolytic enzymes of Aspergillus niger. Enzyme Microb Technol 34:466−473.
Plamer T. 1991. Understanding Enzymes 3th ed. West Sussex: Ellis Haorwood Limited.
Patil SR, Dayanand A. 2006. Production of pectinase from deseeded sunflower head by Aspergillus niger in submerged and solid state condition. Biores Tech 97: 2054−2058.
Polizeli et al. 1991. Pectinase production by Neurospora crassa: purification and biochemical characterization of extracellular polygalacturonase activity. J of Gene Microbiol 137:1815-1823.
Rashad MM et al. 2011. Purification and characterizationof the pectin lyase produced by Pleurotus ostreatus grown on lemon pulp waste. Aus J of Basic and Appl Sci 5(8):1377-1384.
Rosenberg IM. 1996. Protein Analysis and Purification Benchtcop Techniques. Boston:Birkhäuser.
comercial pectinase. J Food Eng 47(4):271-274.
Suryakant et al. 2001. Active site characterization of the single endo-polygalacturonase produced by Fusarium moniforme.Afr J Biotechnol 268:832-840.
Wayne M et al .2009. Isolation, purification and characterization of polygalacturonase Penicillium solitum. J Biotechnol 99:637-648
Winarno FG. 2010. Enzim Pangan Edisi Revisi. Bogor : M-Brio Press.
9
Lampiran 1 Perhitungan aktivitas pektinase
Aktivitas (U/mL)
=
� −� � � 1000� �� � � � �
Aktivitas Total (U)
=
�� �� � � � ( / )Total protein (mg)
=
�� � � � � ( / )Aktivitas spesifik
=
� � � � �� �
(U/mg)
Recovery
=
� � � � � ��� � � � � �� � � �
Tingkat kemurnian
=
� � � � � ��� � � � � �� � � �
Keterangan :
Xs : Kadar asam galakturonat sampel
Xk : Kadar asam galakturonat kontrol
t : Waktu inkubasi (30 menit)
fp : Faktor pengenceran
BM asam galakturonat : 212 g/mol
Lampiran 2 Prosedur pembuatan reagen yang digunakan dalam penelitian
Reagen dinitrosalisilat (DNS) (Miller 1959)
Sebanyak 10 g NaOH padat; 182 g KNa-tartrat; 0,5 g Na2SO3; 2 g fenol, dan 10 g reagen DNS
dilarutkan dalam akuades sampai 1000 mL.
0,02 M bufer asetat pH 4
Sebanyak 20,5 mL CH3COOH 0,02 M dan 4,5 mL CH3COONa 0,02 M dicampur serta dilarutkan
dengan akuades sampai 50 mL. Pengaturan pH dilakukan dengan 1 N NaOH dan 1 N HCl.
0,02 M bufer asetat pH 5
Sebanyak 7,4 mL CH3COOH 0,02 M dan 17,6 mL CH3COONa 0,02 M dicampur serta dilarutkan
dengan akuades sampai 50 mL. Pengaturan pH dilakukan dengan 1 N NaOH dan 1 N HCl.
0,02 M bufer fosfat pH 6,0
Sebanyak 21,925 mL Na2HPO4 .
2H2O 0,02 M dan 3,075 mL NaH2PO4 .
2H2O 0,02 M dicampur
serta dilarutkan dengan akuades sampai 50 mL. Pengaturan pH dilakukan dengan 1 N NaOH dan 1
N HCl.
0,02 M bufer fosfat pH 6,5
Sebanyak 17,125 mL Na2HPO4.2H2O 0,02 M dan 7,875 mL NaH2PO4.2H2O 0,02 M dicampur
serta dilarutkan dengan akuades sampai 50 mL. Pengaturan pH dilakukan dengan 1 N NaOH dan 1
11
0,02 M bufer fosfat pH 7,0
Sebanyak 9,75 mL Na2HPO4 .
2H2O 0,02 M dan 15,25 mL NaH2PO4 .
2H2O 0,02 M dicampur serta
dilarutkan dengan akuades sampai 50 mL. Pengaturan pH dilakukan dengan 1 N NaOH dan 1 N
HCl.
0,02 M bufer fosfat pH 7,5
Sebanyak 4 mL Na2HPO4.2H2O 0,02 M dan 0,02 M NaH2PO4.2H2O 21 mL dicampur serta
dilarutkan dengan akuades sampai 50 mL. Pengaturan pH dilakukan dengan 1 N NaOH dan 1 N
HCl.
0,02 M bufer fosfat pH 8
sebanyak 1,325 mL Na2HPO4 .
2H2O 0,02 M dan 23,675 mL NaH2PO4 .
2H2O 0,02 M dicampur serta
dilarutkan dengan akuades sampai 50 mL. Pengaturan pH dilakukan dengan 1 N NaOH dan 1 N
HCl.
Lampiran 3 Kurva standar asam galakturonat
Ppm Nilai
10 0.001
20 0.002
40 0.0035
80 0.027
160 0.086
320 0.209
640 0.4205 1000 0.697
y = 0.0007x - 0.0202 R² = 0.9981
-0,1 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
0 500 1000 1500