PENINGKATAN KANDUNGAN ALKALOID KININ
DALAM SUSPENSI SEL KINA (
Cinchona ledgeriana
Moens.)
DENGAN PERLAKUAN SENYAWA KIMIA
DEDI SATRIAWAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Peningkatan Kandungan Alkaloid Kinin dalam Suspensi Sel Kina (Cinchona ledgeriana Moens.) dengan Perlakuan Senyawa Kimia adalah benar dari hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2012
ABSTRACT
DEDI SATRIAWAN. Improvement of Quinine Alkaloids Content in Cell Suspension Culture of Cinchona ledgeriana Treated with Chemical Compounds. Supervised by DIAH RATNADEWI and SUMARYONO.
Quinine is used for tonic, appetite enhancer, antipyretic, antimalarial, cosmetic ingredients and tanning. Quinine can be obtained from the bark of seven or more years old Cinchona tree. Cell suspension culture is an alternative means to obtain secondary metabolites rapidly and continously. Quinine, one of alkaloid compounds, is expected to increase with the addition of abscisic acid (ABA) and paclobutrazol (PBZ) as growth inhibitors, tryptophan as a precursor and mannitol as an osmotic stress inducer. ABA was used at 1 and 3 ppm, PBZ at 5 and 7 ppm combined with 5.3 g/l mannitol, tryptophan at 0.2 and 2 ppm combined with 5.3 g/l mannitol. ABA at 1 and 3 ppm increased the cell suspension growth but reduced the content of quinine. PBZ at 7 ppm combined with 5.3 g/l mannitol and 20 g/l sucrose significantly reduced the cell suspension growth but remarkably increased quinine content, even higher than that was found in the bark of Cinchona tree in the field. Combination of mannitol and paclobutrazol was effective to inhibit the cell growth but enhance the production of quinine.
RINGKASAN
DEDI SATRIAWAN. Peningkatan Kandungan Alkaloid Kinin dalam Suspensi Sel Kina (Cinchona ledgeriana Moens.) dengan Perlakuan Senyawa Kimia. Dibimbing oleh DIAH RATNADEWI dan SUMARYONO.
Korteks kina mengandung berbagai alkaloid, antara lain kinin, kinidin, sinkonin dan sinkonidin yang termasuk golongan kinolin. Korteks kina dengan kadar alkaloid tertinggi terdapat pada Cinchona ledgeriana. Kinin merupakan bahan untuk tonikum, anti piretikum dan anti malaria. Kinidin digunakan sebagai obat jantung, juga anti malaria bagi yang alergi terhadap kinin. Kegunaan kinin yang lain adalah dapat digunakan sebagai bahan kosmetika, minuman penyegar dan bahan baku industri penyamakan.
Produksi metabolit sekunder melalui kultur suspensi sel dianggap merupakan pilihan yang lebih mempunyai harapan dibandingkan dengan produksi dari tumbuhan utuh. Triptofan merupakan prekursor alkaloid indol dan kinolin. Penambahan triptofan, paklobutrazol dan manitol serta penggantian sebagian sukrosa dengan manitol diharapkan dapat meningkatkan produksi metabolit sekunder. Tujuan penelitian ini adalah untuk meningkatkan kadar alkaloid kinin dalam kultur suspensi sel Cinchona ledgeriana Moens dengan mencobakan berbagai perlakuan kimia.
Penelitian ini dilakukan dalam 3 tahap yaitu induksi dan proliferasi kalus, kultur suspensi sel (homogenisasi) dan perlakuan senyawa kimia. Induksi kalus dilakukan dengan menginisiasi potongan lamina daun muda tanpa aksis pada media WP padat dengan gelrite (MB Cell) 3,5 g/l, sukrosa (Merck) 30 g/l, pikloram 15 µM, BA 2 µM, floroglusinol 1 µM. Setelah 4 minggu, kalus yang terbentuk disubkultur ke media baru dengan kandungan yang sama. Empat minggu kemudian, kalus digunakan untuk bahan suspensi sel. Inisiasi dan proliferasi kalus dilakukan pada ruang gelap dengan suhu 26 0
Kultur suspensi sel dilakukan dengan mentransfer kalus remah (sekitar 1 g) dari media padat ke media WP cair (tanpa gelrite) dengan sukrosa 30 g/l, pikloram 15 µM, BA 0,5 µM dan floroglusinol 1 µM pada baffle flask (labu Erlenmeyer bersekat. Baffleflask selanjutnya diletakkan di meja pengocok dengan kecepatan 90 rpm di ruang kultur selama seminggu. Ruang kultur diatur suhunya 26±1
C.
0
C dengan intensitas cahaya 20 µmolfoton/m2
Perlakuan dilakukan dengan memindahkan 1 spatula sel tersebut ke dalam media WP cair yang mengandung pikloram 15 µM, BA 2 µM, floroglusinol 1 µM dengan perlakuan berupa: 1) sukrosa 30g/l (Kontrol), 2) sukrosa 30 g/l dan ABA 1 ppm (A
/detik selama 12 jam/hari.
Hasil homogenisasi disaring dengan ukuran pori 1000 μm dan 50 μm.
pada usia 7 minggu untuk dilakukan pengukuran kadar kinolin. Kultur dengan perlakuan dikocok secara horizontal dengan kecepatan 90 rpm di ruang kultur.
Perlakuan ABA 3 ppm dan sukrosa 30 g/l memberikan hasil terbaik dalam pertumbuhan suspensi sel. Perlakuan paklobutrazol 7 ppm, manitol 5,3 g/l dan sukrosa 20 g/l dengan lama kultur 7 minggu adalah yang terbaik untuk produksi kinin. Perlakuan paklobutrazol 7 ppm, manitol 5,3 g/l dan sukrosa 20 g/l dengan lama kultur 7 minggu juga yang terbaik untuk produksi kinidin dan sinkonin. Perlakuan triptofan 0,2 ppm serta sukrosa 20 g/l dan manitol 5,3 g/l dengan lama kultur 7 minggu adalah yang terbaik untuk produksi sinkonidin. Pertumbuhan suspensi sel terkecil pada perlakuan paklobutrazol 7 ppm, manitol 5,3 g/l dan sukrosa 20 g/l menghasilkan kadar kinin tertinggi. Kombinasi manitol dan paklobutrazol efektif menghambat pertumbuhan suspensi sel dan meningkatkan produksi kinin.
© Hak Cipta Milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah. b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
PENINGKATAN KANDUNGAN ALKALOID KININ
DALAM SUSPENSI SEL KINA (
Cinchona ledgeriana
Moens.)
DENGAN PERLAKUAN SENYAWA KIMIA
DEDI SATRIAWAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Biologi Tumbuhan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul Tesis : Peningkatan Kandungan Alkaloid Kinin dalam Suspensi Sel Kina (Cinchona ledgeriana Moens.) dengan Perlakuan Senyawa Kimia
Nama : Dedi Satriawan NRP : G353090251
Disetujui
Komisi Pembimbing
Dr. Ir. Diah Ratnadewi
Ketua Anggota
Ir. Sumaryono, M.Sc.
Diketahui
Koordinator Mayor Biologi Tumbuhan Dekan Sekolah Pasacasarjana
Dr. Ir. Miftahudin, M.Si. Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Assalamu’alaikum Wr. Wb. Alhamdulillahirobbil’alamin, puji syukur penulis ucapkan ke hadirat Allah SWT yang telah memberikan kesempatan dan kekuatan untuk menyelesaikan tesis berjudul “Peningkatan Kandungan Alkaloid Kinin dalam Suspensi Sel Kina (Cinchona ledgeriana Moens.) dengan Perlakuan Senyawa Kimia” ini. Sholawat dan salam semoga selalu tercurah kepada Nabi Muhammad SAW yang telah membimbing umat manusia ke alam ilmu pengetahuan.
Penulis mengucapkan terimakasih kepada Dr. Ir. Diah Ratnadewi dan Ir. Sumaryono, M.Sc. atas bimbingan dan bantuan dalam pelaksanaan penelitian serta penyelesaian tesis ini; Dr. Dra. Ietje Wientarsih, Apt, M.Sc. atas kesediaannya menjadi penguji; Imron Riyadi, M.Si dan seluruh staf Laboratorium Biak Sel atas bantuan dalam pelaksanaan penelitian. Penulis juga mengucapkan terimakasih kepada orang tua, istri dan seluruh keluarga atas do’anya serta seluruh pihak yang telah membantu yang tidak bisa disebutkan satu persatu.
Penulis mengharapkan tesis ini dapat menyumbangkan ilmu yang bermanfaat khususnya untuk pengembangan kultur suspensi sel tanaman kina dalam produksi kinin. Billahi taufik walhidayah, Assalamu’alaikum Wr. Wb.
Bogor, Mei 2012
RIWAYAT HIDUP
Penulis dilahirkan di Siring Agung (Sumatera Selatan) pada tanggal 6 Desember 1984 dari Bapak Syahril dan Ibu Suarti. Penulis merupakan anak ketiga dari empat bersaudara. Penulis telah menikah dengan Nendra Susanti, SH. dan telah dikaruniakan satu orang putri bernama Syifa Wasithoh.
Pada tahun 2002, penulis lulus dari SMA Negeri 1 Curup Bengkulu. Pada tahun 2007, penulis menyelesaikan studi Program Sarjana di Jurusan Biologi Fakultas MIPA Universitas Andalas Padang. Pada tahun 2009, penulis melanjutkan studi di Mayor Biologi Tumbuhan Sekolah Pascasarjana Institut Pertanian Bogor.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ……… xviii
DAFTAR LAMPIRAN ……… xix
PENDAHULUAN………. 1
Latar Belakang ………. 1
Tujuan Penelitian ………. 2
TINJAUAN PUSTAKA……… 3
Tumbuhan Kina……… 3
Metabolit Sekunder……….. 3
Produksi Metabolit Sekunder Secara In Vitro………. 5
METODE PENELITIAN……….. 9
Waktu dan Tempat Penelitian………. 9
Bahan Penelitian……….. 9
Prosedur Penelitian……….. 9
1. Induksi dan Proliferasi Kalus……… 10
2. Kultur Suspensi Sel/Homogenisasi………... 10
3. Perlakuan Senyawa Kimia dan Pengukuran Volume Sel……….. 10
4. Pengukuran Kadar Kinolin……… 11
HASIL DAN PEMBAHASAN……… 13
Pertumbuhan Kalus dan Induksi Suspensi Sel Sebelum Perlakuan.…… 13
Pertumbuhan Suspensi Sel pada Media Perlakuan……….. 13
Kadar Kinolin……….. 16
KESIMPULAN……… 23
DAFTAR PUSTAKA……….. 25
DAFTAR GAMBAR
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Tumbuhan kina berasal dari daerah hutan di pegunungan Andes di Amerika Selatan yang meluas sampai Peru, Bolivia, Ekuador, Kolombia, Venezeula dan kemudian dikebunkan secara besar-besaran di Indonesia, India, dan Amerika Selatan antara lain di Guatemala (Tjitrosoepomo 2005).
Metabolit sekunder merupakan hasil tumbuhan yang khas dan dijumpai sebagai terpenoid, glikosida (steroid, fenolik) dan alkaloid. Beberapa metabolit sekunder ini merupakan zat aktif yang berguna (Kurz & Constabel 1991). Korteks kina mengandung berbagai alkaloid, antara lain kinin, kinidin, sinkonin dan sinkonidin yang termasuk golongan kinolin. Korteks kina dengan kadar alkaloid tertinggi terdapat pada Cinchona ledgeriana. Kinin merupakan bahan untuk tonikum, anti piretikum dan anti malaria. Kinidin digunakan sebagai obat jantung, juga anti malaria bagi yang alergi terhadap kinin (Tjitrosoepomo 2005). Kegunaan kinin yang lain adalah dapat digunakan sebagai bahan kosmetika, minuman penyegar dan bahan baku industri penyamakan (Prasetiyo 2004).
Kebutuhan akan antimalaria yang meningkat mengakibatkan perlunya peningkatan produksi kinolin dari kina. Pohon kina baru bisa dipanen setelah minimal berusia 7 tahun dan akan menghasilkan kadar kinolin maksimal pada usia 20 tahun. Lambatnya produksi kinolin ini memicu produksi antimalaria sintetik. Antimalaria sintetik ternyata menimbulkan resistensi sehingga permintaan kinolin kina kembali meningkat (Reflini 2002).
dimungkinkannya mengatur proses metabolismenya untuk memperoleh hasil sebesar-besarnya (Kurz & Constabel 1991).
Pemberian triptofan mampu meningkatkan kadar katarantin pada kultur suspensi sel Catharanthus roseus (Usviani 2006). Triptofan merupakan prekursor alkaloid indol dan kinolin (Mann 2001; Daniel 2006). Penambahan triptofan sebagai prekursor diharapkan dapat meningkatkan kadar alkaloid kinin, kinidin, sinkonin dan sinkonidin pada kultur suspensi sel Cinchona ledgeriana Moens. Selain pemberian prekursor, perlakuan retardan yang menghambat pertumbuhan dan penggantian sebagian sukrosa dengan manitol diharapkan dapat meningkatkan produksi metabolit sekunder. Salah satu retardan yang umum digunakan untuk menghambat pertumbuhan vegetatif secara in vitro maupun pada tumbuhan utuh adalah paklobutrazol. Asam absisat (ABA) juga dapat menghambat pertumbuhan vegetatif tumbuhan (Wattimena 1988) sehingga juga digunakan sebagai perlakuan dalam penelitian ini. Pemberian manitol untuk meningkatkan metabolime sekunder antara lain telah digunakan pada kultur kalus tumbuhan Trigonella foenum-graecum L. (Hussein & Aqlan 2011).
Tujuan Penelitian
TINJAUAN PUSTAKA
Tumbuhan Kina
Tumbuhan adalah pemasok bahan obat-obatan yang utama untuk penyakit fisik pada manusia sebelum munculnya obat sintetis. Ketersediaan tumbuhan sehubungan dengan kuantitas dan kualitas pada setiap titik waktu tertentu menjadi penentu pasokan obat-obatan pada akhir dari rantai produksi (Goeschl 2002).
Tumbuhan kina berasal dari daerah hutan di pegunungan Andes di Amerika Selatan yang meluas sampai Peru, Bolivia, Ekuador, Kolombia dan Venezeula. Tumbuhan kina kemudian ditanam secara besar-besaran di Indonesia, India, dan Amerika Selatan antara lain di Guatemala (Tjitrosoepomo 2005). Klasifikasi tumbuhan kina adalah divisi spermatophyta, kelas dicotyledonae, ordo rubiales, famili rubiaceae, genus Cinchona, spesies Cinchona ledgeriana Moens. (Tjitrosoepomo 2007). Pohon kina berupa tajuk berbentuk kerucut, percabangan membentuk sudut yang tajam dengan batang. Duduk daun bersilang-berhadapan. Strobilus tertanam pada sisi atas daun. Bunga berwarna krem dan mengangguk (Tjitrosoepomo 2005).
Pada tumbuhan kina terdapat kulit baik batang maupun akar yang disebut korteks kina. Korteks kina mengandung berbagai alkaloid; antara lain kinin, kinidin, sinkonin dan sinkonidin. Korteks kina dengan kadar alkaloid tinggi terdapat pada Cinchona ledgeriana Moens. Kinin merupakan bahan untuk tonikum, anti piretikum dan anti malaria. Kinidin digunakan sebagai obat jantung, juga anti malaria (bagi yang alergi terhadap kinin). Kandungan korteks kina berupa alkaloids berkisar 6-7%. Jenis Cinchona pitayensis Wedd. di Kolumbia dan Equador mengandung 3-6,5% kinin pada kulitnya. Jenis Cinchona officinalis di Equador, Peru, Kolumbia, Venezeula dan Bolivia mengandung 1-4% total alkaloid pada kulitnya yang setengah sampai dua pertiganya berupa kinin (Tjitrosoepomo 2005).
Metabolit Sekunder
menyediakan berbagai bahan biokimia yang berguna untuk kemanusiaan; seperti bahan obat-obatan, rasa, kosmetik, wewangian dan bahan kimia pertanian (Kurz & Constabel 1991; Collin & Edwards 1998; Linden et al. 2001).
Metabolit sekunder mencakup berbagai senyawa organik kompleks yang disintesis dalam tumbuhan. Ada metabolit sekunder yang memiliki peran yang sangat penting sebagai pertahanan terhadap hama, terutama di jaringan dewasa yang mengakumulasikan senyawa ini. Metabolit sekunder juga dapat disintesis secara cepat dalam menanggapi infeksi mikroba dan serangan serangga. Senyawa yang sama tampaknya disintesis sebagai respons terhadap berbagai cekaman abiotik seperti dingin, panas, osmotik ekstrem dan kerusakan fisik (Collin & Edwards 1998).
Sintesis metabolit sekunder tampaknya dirangsang jika karbon tetap tidak sepenuhnya dimanfaatkan oleh aktivitas metabolik utama dari pertumbuhan dan diferensiasi sel. Karbon tidak digunakan untuk mensintesis dinding sel dan protein diubah menjadi metabolit sekunder dan disimpan dalam vakuola sitoplasma atau vesikel. Metabolit sekunder akan terdegradasi dan karbon yang tersimpan akan dilepaskan ketika pertumbuhan vegetatif berlangsung lebih cepat. Kegiatan metabolisme sekunder dan primer terkait erat dan ada dalam kesetimbangan dinamis yang dihubungkan oleh enzim kunci (Collin & Edwards 1998).
Sekitar 100 alkaloid memiliki inti kinolin. Alkaloid ini sangat terbatas dan dilaporkan terdapat pada Cinchona dari Rubiaceae dan beberapa spesies dari Rutaceae. Sejumlah spesies Cinchona memberikan alkaloid penting, terutama C. officinalis Linn. (kina kuning), C. calisaya Wedd, C. succirubra Pac. (kina merah)
dan C. ledgeriana Moens. (Daniel 2006). Kinin merupakan komponen utama dari kulit kayu Chincona dan telah berhasil diisolasi serta dimurnikan sejak tahun 1817-1832. Kinin merupakan senyawa bernilai penting di bidang farmasi (Mann 2001).
alkaloid berupa garam-garam dari asam kinat dan asam sinkotanat. Jumlah asam kinat pada obat malaria adalah sekitar 5-8% (Daniel 2006).
Sebagian besar kinin juga digunakan sebagai bahan tonik, campuran minuman ringan untuk mencegah kejang otot dan penambah nafsu makan. Kinidin banyak digunakan untuk menormalkan denyut jantung yang tidak teratur. Sinkonin banyak digunakan untuk biopestisida, sedangkan sinkonidin banyak digunakan sebagai katalis pada reaksi-reaksi kimia (Ditjenbun, 2010).
Produksi Metabolit Sekunder Secara In Vitro
Kultur suspensi sel tumbuhan mampu menyediakan sumber metabolit sekunder agar industri tidak bergantung pada tumbuhan di alam. Kultur suspensi sel tumbuhan dapat diatur sehingga penyediaan pasokan bahan baku lebih efisien. Produksi metabolit sekunder dengan suspensi sel tumbuhan dengan cara yang sama seperti mikroba berbasis sistem fermentor dan ditumbuhkan pada skala industri adalah sangat mungkin. Sejumlah peneliti telah mempelajari penggunaan sel tumbuhan dalam kultur sebagai sumber dari beberapa senyawa organik. Banyak yang harus dipelajari dengan lebih baik tentang kondisi optimum bagi pertumbuhan dan produktivitas sel dalam kultur sebelum proses tersebut dapat menjadi pilihan manufaktur yang layak (Kurz & Constabel 1991; Collin & Edwards 1998; Linden et al. 2001).
Kultur suspensi diawali dengan kultur kalus pada media padat. Kultur kalus dapat dikembangkan dengan menggunakan eksplan yang berasal dari berbagai sumber; misalnya tunas muda, daun, ujung akar, buah dan bagian bunga. Kalus akan terbentuk dalam waktu 2 - 4 minggu (tergantung spesies) jika suatu eksplan ditanam pada media yang sesuai. Kalus merupakan massa amorf yang tersusun atas sel-sel berdinding sel tipis yang berkembang dari hasil proliferasi sel-sel jaringan induk. Kalus harus disubkultur secara berkala dalam interval tertentu (misalnya setiap bulan) ke media baru (Yuwono 2008).
dan memberi aerasi pada kultur (Yuwono 2008). Kultur suspensi sel terdiri dari campuran agregat sel, kumpulan sel dan sel tunggal. Laju pertumbuhan kultur suspensi sel biasanya lebih cepat daripada kultur pada media padat. Teknik ini memberikan pengendalian lingkungan tumbuh yang lebih baik, karena kebanyakan sel akan dikelilingi media (Gamborg 1991).
Laju pembelahan sel pada sistem kultur suspensi lebih tinggi dibanding pada kultur kalus, biasanya berkisar antara 24 – 72 jam per siklus. Kultur suspensi sel mempunyai beberapa keuntungan dibanding kultur kalus; yaitu suspensi sel dapat dipipet sehingga mempermudah proses subkultur, lebih homogen dan tingkat diferensiasi rendah, dapat dilakukan dengan volume besar (mencapai 1500 liter), pengaturan kondisi lingkungan lebih mudah dan dapat dilakukan manipulasi produksi metabolit sekunder seperti penambahan prekursor (Yuwono 2008).
Akumulasi metabolit sekunder cenderung meningkat pada akhir periode pembelahan sel yang cepat dalam siklus pertumbuhan pada sebagian besar kultur suspensi sel. Alkaloid indol total meningkat dan mencapai maksimum pada fase akhir eksponensial pada kultur Catharanthus roseus. Hal yang sama juga berlaku untuk alkaloid tropana pada sejumlah spesies pada famili solanaceae dan asam rosmarinat dalam kultur sel dari Anchusa officinalis. Penghambatan pertumbuhan kultur suspensi sel tumbuhan menyebabkan peningkatan akumulasi metabolit sekunder (Collin & Edwards 1998).
Senyawa retardan dapat menghambat pertumbuhan tumbuhan seperti menghambat pemanjangan sel pada meristem sub apikal sehingga ruas batang tumbuhan menjadi lebih pendek (Wattimena 1988; Salisbury & Ross 1992). Salah satu senyawa retardan yang umum digunakan adalah paklobutrazol. Paklobutrazol telah dibuktikan mampu menghambat pertumbuhan benih tanaman barley (Srivastava 2002).
Gula pada media kultur tumbuhan merupakan sumber energi tersedia dan sumber karbon yang sangat dibutuhkan untuk pertumbuhan secara in vitro. Gula juga mempengaruhi potensial osmotik media kultur tumbuhan. Gula yang umum digunakan pada kultur tumbuhan adalah sukrosa. Untuk kebutuhan lainnya; sukrosa bisa digantikan dengan glukosa, fruktosa atau gula alkohol (Sutter 1996; Collin & Edwards 1998). Manitol merupakan gula alkohol yang umum digunakan dalam kultur tumbuhan. Manitol digunakan untuk mengatur potensial osmotik media pada kultur protoplast (Collin & Edwards 1998). Jumlah energi yang terkandung pada manitol lebih rendah dibandingkan dengan sukrosa (von Weymarn 2002). Manitol digunakan untuk mengganti sebagian sukrosa untuk mengurangi energi tersedia tanpa merubah potensial osmotik media. Pengurangan energi tersedia diharapkan menghambat pertumbuhan sehingga meningkatkan laju metabolisme sekunder.
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian berlangsung dari bulan September 2011 sampai Januari 2012 di Laboratorium Biak Sel dan Mikropropagasi Tanaman, Balai Penelitian Bioteknologi Perkebunan Indonesia dan Laboratorium Balai Besar Penelitian dan Pengembangan Pasca Panen Pertanian, Bogor.
Bahan Penelitian
Bahan yang digunakan antara lain daun muda kina (Cinchona ledgeriana Moens.) klon QRC 315, media WP (Woody Plant), sukrosa, gelrite, pikloram, BA, floroglusinol, paklobutrazol, ABA, triptofan, sabun cair, Dithane M-45 dan Bayclin (larutan NaOCl 5,25%).
Prosedur Penelitian
Induksi dan Proliferasi Kalus (8 minggu)
Kultur Suspensi Sel/Homogenisasi (1 minggu)
Perlakuan Senyawa Kimia (7 minggu)
Pengukuran Kadar Kinolin (Minggu ke-6 dan ke-7)
Pengukuran Volume Sel (7 minggu)
1. Induksi dan Proliferasi Kalus
Induksi kalus dilakukan dengan menginisiasi potongan lamina daun muda tanpa aksis pada media WP padat dengan gelrite (MB Cell) 3,5 g/l, sukrosa (Merck) 30 g/l, pikloram 15 µM, BA 2 µM, floroglusinol 1 µM. Daun muda dibersihkan dengan sabun cair dan disterilisasi dengan fungisida Dithane M-45 2 g/l selama 10 menit dan larutan NaOCl 1,05% selama 15 menit sebelum diinisiasi ke media. Kalus yang terbentuk diproliferasi ke media baru dengan kandungan yang sama pada akhir minggu keempat. Kalus digunakan untuk bahan suspensi sel pada akhir minggu keempat proliferasi. Inisiasi dan proliferasi kalus dilakukan pada ruang gelap dengan suhu 26 0
2. Kultur Suspensi Sel/Homogenisasi C.
Kultur suspensi sel dilakukan dengan mentransfer kalus remah (sekitar 1 g) dari media padat ke media WP cair (tanpa gelrite) dengan sukrosa 30 g/l, pikloram 15 µM, BA 0,5 µM dan floroglusinol 1 µM pada Baffle flask (Erlenmeyer bersekat). Kalus hasil proliferasi diambil dengan hati-hati dan diurai menggunakan jarum sampai membentuk agregat (gumpalan) yang agak halus. Agregat kalus dimasukkan ke dalam media pada Baffle flask agar menghasilkan suspensi sel yang homogen. Baffle flask berisi agregat kalus dan media induksi suspensi selanjutnya diletakkan di meja pengocok dengan kecepatan 90 rpm di ruang kultur selama seminggu. Ruang kultur diatur suhunya 26±1 0
Induksi dan proliferasi kalus serta kultur suspensi sel/homogenisasi menikuti prosedur Sumaryono & Riyadi (2005).
C dengan intensitas cahaya 20 µmolfoton/detik selama 12 jam/hari.
3. Perlakuan Senyawa Kimia dan Pengukuran Volume Sel
sel dengan metode CVS (cell volume after sedimentation: volume sel setelah diendapkan) (Blom et al. 1992) dilakukan pada tahap ini pada hari 0, 4, ke-7, ke-14, ke-21, ke-28, ke-35, ke-42 dan ke-49. Masing-masing perlakuan dibuat 10 kultur yang dianggap sebagai ulangan, 5 ulangan dipanen pada usia 6 minggu dan 5 ulangan dipanen pada usia 7 minggu untuk dilakukan pengukuran kadar kinolin. Kultur dengan perlakuan dikocok secara horizontal dengan kecepatan 90 rpm di ruang kultur.
4. Pengukuran Kadar Kinolin
HASIL DAN PEMBAHASAN
Pertumbuhan Kalus dan Induksi Suspensi Sel Sebelum Perlakuan
Potongan lamina daun Cinchona ledgeriana Moens. yang dijadikan eksplan mulai membentuk kalus pada minggu kedua setelah ditanam. Kalus yang dihasilkan berupa kalus remah berwarna putih sedikit kecoklatan bercampur sedikit kalus kompak berwarna coklat muda. Kalus disubkultur ke media baru dengan kandungan yang sama untuk proliferasi setelah empat minggu diinisiasi. Proliferasi dilakukan untuk memperoleh jumlah kalus yang cukup. Kalus yang terbentuk cukup banyak pada inisiasi maupun proliferasi. Hal ini membuktikan bahwa media yang digunakan (Sumaryono & Riyadi 2005) sesuai untuk menghasilkan kalus secara optimal. Kalus remah yang dihasilkan dapat digunakan untuk bahan suspensi sel setelah fase proliferasi mencapai empat minggu. Kultur suspensi mampu menghasilkan cukup banyak sel baru hanya dalam satu minggu pada fase homogenisasi.
Pertumbuhan Suspensi Sel pada Media Perlakuan
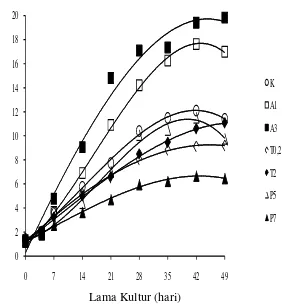
Pertumbuhan sel kina diamati dengan metode CVS selama 7 minggu. Pertumbuhan volume sel dapat dilihat pada Gambar 1. Pertumbuhan sel terbaik diperoleh pada perlakuan A3 yaitu ABA 3 ppm dan sukrosa 30 g/l (mencapai 15 kali dari volume sel awal) dan terendah pada perlakuan P7 yaitu paklobutrazol 7 ppm, sukrosa 20 g/l dan manitol 5,3 g/l (hanya mencapai 5 kali dari volume sel awal). Pertumbuhan sel pada perlakuan A3 dan A1 melebihi pertumbuhan perlakuan Kontrol sedangkan pada perlakuan T0.2, T2, P5 dan P7 di bawah pertumbuhan perlakuan Kontrol. Puncak pertumbuhan umumnya (termasuk perlakuan Kontrol) telah tercapai pada hari ke-42 dalam media perlakuan, kecuali pada perlakuan T2
ABA adalah zat pengatur pertumbuhan yang kadang digunakan dalam media kultur. ABA umumnya ditambahkan ke media kultur untuk meningkatkan, menghambat atau merangsang pertumbuhan kalus (tergantung pada spesies) dan untuk meningkatkan proliferasi tunas atau kuncup (Anonim 2003).
0
Gambar 2. Pertumbuhan Suspensi Sel Cinchona ledgeriana Moens. K = sukrosa 30 g/l; A1 = ABA 1 ppm dan sukrosa 30 g/l; A3 = ABA 3 ppm dan
sukrosa 30 g/l; T0,2 = triptofan 0,2 ppm, sukrosa 20 g/l dan manitol 5,3 g/l; T2 =
triptofan 2 ppm, sukrosa 20 g/l dan manitol 5,3 g/l; P5 = paklobutrazol 5 ppm
sukrosa 20 g/l dan manitol 5,3 g/l; P7 = paklobutrazol 7 ppm sukrosa 20 g/l dan
manitol 5,3 g/l
ABA berperan penting dalam banyak proses seluler termasuk perkembangan benih, dormansi, perkecambahan, pertumbuhan vegetatif dan respon tumbuhan terhadap cekaman lingkungan (Xiong & Zhu 2003; Hirayama & Shinozaki 2007; Hubbard et al. 2010). ABA eksogen tinggi akan menghambat pertumbuhan tumbuhan pada kondisi tanpa cekaman, namun peningkatan kandungan ABA sangat bermanfaat bagi tumbuhan baik tingkat seluler maupun pada seluruh bagian tumbuhan di bawah cekaman lingkungan (Xiong & Zhu 2003). ABA dapat meningkatkan pertumbuhan dan juga sebaliknya dapat menghambat pertumbuhan (Finkelstein & Rock 2002). ABA meningkatkan pertumbuhan sel pada perlakuan A1 dan A3
ABA dapat menyebabkan tidak sempurnanya proses pembentukan dinding sel pada saat sel membelah karena sintesis selulosa menjadi terganggu (Brocard-Gifford et al. 2004). Tidak sempurnanya dinding sel ini mempercepat laju keluar
,.
masuk nutrisi yang dibutuhkan sel sehingga sel bisa memperbanyak diri lebih cepat. ABA menginduksi akumulasi protein cadangan pada embrio somatik tumbuhan cemara putih (Misra et al. 1993). Tersedianya protein cadangan akan mempermudah proses penggandaan dan pembelahan sel sehingga pertumbuhan sel meningkat.
ABA 5 ppm mampu meningkatkan jumlah embrio somatik sekunder per embrio somatik sebesar 9 kali pada induksi embrio somatik tumbuhan Corydalis yanhusuo (Sagare et al. 2000). ABA 0,01 ppm dapat meningkatkan bobot embrio
somatik sebesar 2 kali serta meningkatkan jumlah embrio somatik lebih dari 2 kali pada embriogensis somatik tumbuhan sagu (Metroxylon sagu Rottb.) (Kasi & Sumaryono 2006). Pemberian beberapa konsentrasi ABA dapat menurunkan jumlah tunas, tinggi tunas, jumlah daun dan jumlah akar pada pertumbuhan minimal tanaman obat daun dewa secara in vitro (Lestari & Purnamaningsih 2005). Fenomena ini menunjukkan bahwa ABA dapat menimbulkan respon penghambatan atau peningkatan pertumbuhan.
IAA (3-indoleacetic acid) merupakan salah satu metabolit yang terbentuk dari triptofan (Moore 1979; Torssell 1983). IAA merupakan hormon auksin yang mengontrol beberapa tahapan proses respirasi dan mempengaruhi berbagai aspek perkembangan tumbuhan. Auksin memicu pembesaran sel dan pertumbuhan batang, pembelahan sel kambium, inisiasi akar dan diferensiasi sel. Auksin berperan penting dalam pembelahan sel, diferensiasi akar dan induksi pemanjangan tunas (Bhojwani & Razdan 1996; Stern 2006).
Penggantian sebagian sukrosa dengan manitol juga menyebabkan pertumbuhan sel pada perlakuan T0,2 dan T2
Paklobutrazol menghambat pertumbuhan suspensi sel kina secara efektif (Gambar 1). Paklobutrazol merupakan salah satu senyawa retardan (Wattimena 1988, Salisbury & Ross 1992). Paklobutrazol telah dibuktikan antara lain menghambat pertumbuhan hipokotil Arabidopsis (Liu et al. 2011, Zhang & Wang 2011), menghambat pembentukan umbi pada beberapa spesies tumbuhan iridaceae (Ascough et al. 2010), menurunkan pertumbuhan vegetatif Jatropha curcas L., Brunonia sp. dan Calandrinia sp. (Ghosh et al. 2011). Cekaman diperkuat dengan penggantian sebagian sukrosa dengan manitol sehingga jumlah karbon dan energi tersedia menjadi lebih rendah.
lebih rendah dibanding perlakuan Kontrol. Manitol tidak menyediakan energi dan karbon seperti sukrosa namun mempengaruhi potensial osmotik media. Penggunaan manitol untuk cekaman osmotik secara in vitro antara lain telah digunakan pada tumbuhan Alhagi graecorum (Hassanein 2004), Lycopersicon esculentum L. (Hassanein 2004, Abdel-Raheem et al. 2007), Pelargonium sp. (Hassanein 2010) dan Trigonella foenum-graecum L. (Hussein & Aqlan 2011),
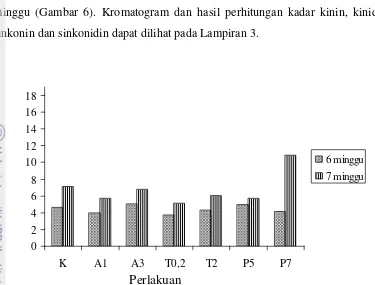
Kadar Kinolin
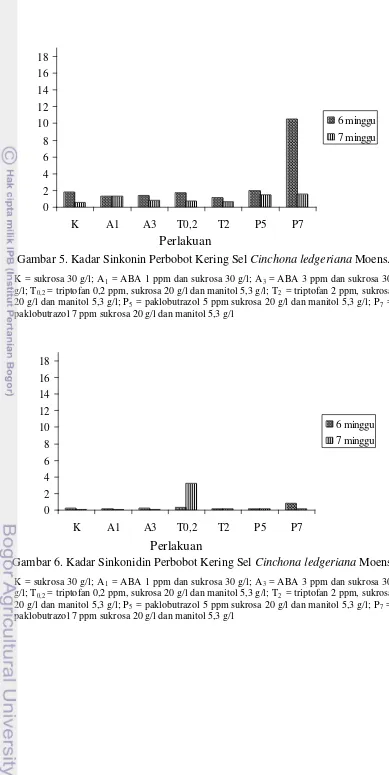
minggu (Gambar 6). Kromatogram dan hasil perhitungan kadar kinin, kinidin, sinkonin dan sinkonidin dapat dilihat pada Lampiran 3.
0
Gambar 3. Kadar Kinin Perbobot Kering Sel Cinchona ledgeriana Moens. K = sukrosa 30 g/l; A1 = ABA 1 ppm dan sukrosa 30 g/l; A3 = ABA 3 ppm dan sukrosa
30 g/l; T0,2 = triptofan 0,2 ppm, sukrosa 20 g/l dan manitol 5,3 g/l; T2 = triptofan 2 ppm,
sukrosa 20 g/l dan manitol 5,3 g/l; P5 = paklobutrazol 5 ppm sukrosa 20 g/l dan manitol
5,3 g/l; P7 = paklobutrazol 7 ppm sukrosa 20 g/l dan manitol 5,3 g/l
Gambar 4. Kadar Kinidin Perbobot Kering Sel Cinchona ledgeriana Moens. K = sukrosa 30 g/l; A1 = ABA 1 ppm dan sukrosa 30 g/l; A3 = ABA 3 ppm dan sukrosa
30 g/l; T0,2 = triptofan 0,2 ppm, sukrosa 20 g/l dan manitol 5,3 g/l; T2 = triptofan 2 ppm,
sukrosa 20 g/l dan manitol 5,3 g/l; P5 = paklobutrazol 5 ppm sukrosa 20 g/l dan manitol
5,3 g/l; P7 = paklobutrazol 7 ppm sukrosa 20 g/l dan manitol 5,3 g/l
0
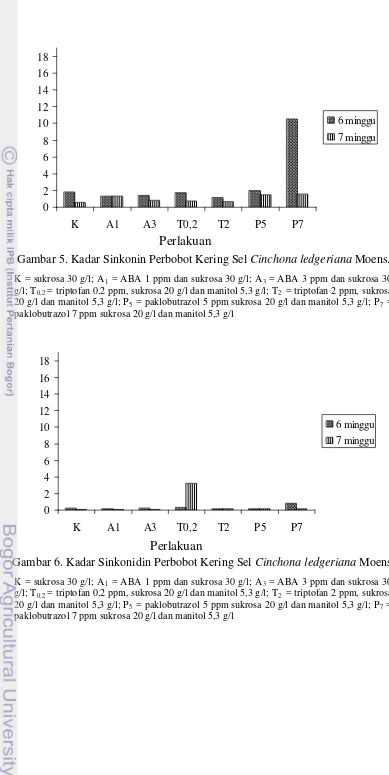
Gambar 5. Kadar Sinkonin Perbobot Kering Sel Cinchona ledgeriana Moens. K = sukrosa 30 g/l; A1 = ABA 1 ppm dan sukrosa 30 g/l; A3 = ABA 3 ppm dan sukrosa 30
g/l; T0,2 = triptofan 0,2 ppm, sukrosa 20 g/l dan manitol 5,3 g/l; T2 = triptofan 2 ppm, sukrosa
20 g/l dan manitol 5,3 g/l; P5 = paklobutrazol 5 ppm sukrosa 20 g/l dan manitol 5,3 g/l; P7 =
paklobutrazol 7 ppm sukrosa 20 g/l dan manitol 5,3 g/l
0
Gambar 6. Kadar Sinkonidin Perbobot Kering Sel Cinchona ledgeriana Moens. K = sukrosa 30 g/l; A1 = ABA 1 ppm dan sukrosa 30 g/l; A3 = ABA 3 ppm dan sukrosa 30
g/l; T0,2 = triptofan 0,2 ppm, sukrosa 20 g/l dan manitol 5,3 g/l; T2 = triptofan 2 ppm, sukrosa
20 g/l dan manitol 5,3 g/l; P5 = paklobutrazol 5 ppm sukrosa 20 g/l dan manitol 5,3 g/l; P7 =
paklobutrazol 7 ppm sukrosa 20 g/l dan manitol 5,3 g/l
Perlakuan
0
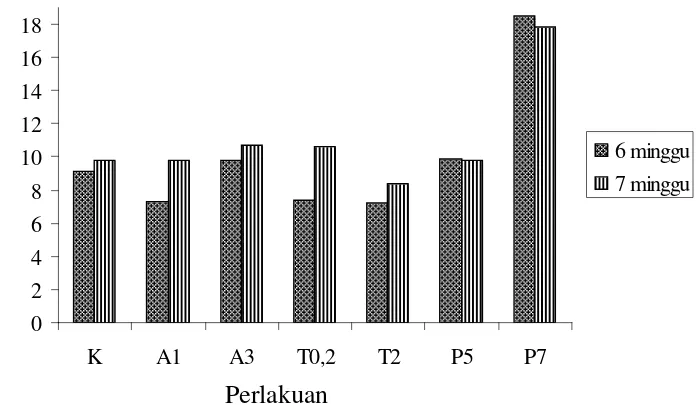
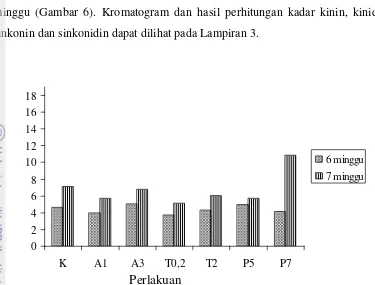
Gambar 7. Kadar Total Kinolin Perbobot Kering Sel Cinchona ledgeriana Moens.
K = sukrosa 30 g/l; A1 = ABA 1 ppm dan sukrosa 30 g/l; A3 = ABA 3 ppm dan sukrosa
30 g/l; T0,2 = triptofan 0,2 ppm, sukrosa 20 g/l dan manitol 5,3 g/l; T2 = triptofan 2 ppm,
sukrosa 20 g/l dan manitol 5,3 g/l; P5 = paklobutrazol 5 ppm sukrosa 20 g/l dan manitol
5,3 g/l; P7 = paklobutrazol 7 ppm sukrosa 20 g/l dan manitol 5,3 g/l
Hampir semua kadar total kinolin usia kultur 7 minggu lebih tinggi daripada 6 minggu. Kadar total kinolin tertinggi terdapat pada perlakuan P7 dengan usia kultur 6 minggu diikuti perlakuan P7 dengan usia kultur 7 minggu dan terendah pada perlakuan T2
Kadar rata-rata kinin dan sinkonidin meningkat tajam pada usia kultur 7 minggu dibandingkan dengan pada usia kultur 6 minggu. Kadar rata-rata kinidin juga meningkat namun tidak sebesar peningkatan kadar rata-rata kinin dan sinkonidin. Kadar sinkonin justru lebih tinggi pada usia kultur 6 minggu dibandingkan dengan usia kultur 7 minggu. Fenomena ini menunjukkan bahwa sintesis sinkonin lebih awal terjadi dibandingkan kinin, kinidin dan sinkonidin sehingga puncak produksi tercapai pada minggu ke-6 dan menurun kembali pada minggu ke-7.
dengan usia kultur 6 minggu (Gambar 7). Tanpa memperhatikan perlakuan yang diberikan; klon QRC 315 mengandung lebih banyak kinin dibanding dengan senyawa kinolin lainnya.
Sintesis kinin, kinidin dan sinkonidin lebih stabil sepanjang pertumbuhan sel sehingga terjadi akumulasi berlanjut dan terus meningkat pada usia kultur 7 minggu. Kadar kinin (rata-rata 5,6%) mewakili 51,13% dari total kinolin (rata-rata
8,92%) (Lampiran 2). Dominasi kinin ini menyerupai apa yang terjadi pada kulit tumbuhan kina di alam yang 60% dari total alkaloidnya adalah kinin.
Kadar kinin pada seluruh perlakuan (tertinggi 10,9% dan rata-rata 5,6%) melebihi hasil tertinggi yang diperoleh Robins et al. (1986) yaitu 0,01%, Rhodes et al. (1986) yaitu 0,003% serta Ratnadewi dan Sumaryono (2010) yaitu 0,12%.
Kadar kinidin pada seluruh perlakuan (rata-rata 2,47%) melebihi hasil tertinggi yang diperoleh Robins et al. (1986) yaitu 0,01%, Rhodes et al. (1986) yaitu 0,01% serta Ratnadewi dan Sumaryono (2010) yaitu 0,81%. Kadar sinkonin pada seluruh perlakuan (rata-rata 1.94%) melebihi hasil tertinggi yang diperoleh Robins et al. (1986) yaitu 0,01%, Rhodes et al. (1986) yaitu 0,07% serta Ratnadewi dan Sumaryono (2010) yaitu 0,01%. Kadar sinkonidin pada seluruh perlakuan (rata-rata 0.44%) melebihi hasil tertinggi yang diperoleh Robins et al. (1986) yaitu 0,02% dan Rhodes et al. (1986) yaitu 0,06% namun kurang dari hasil tertinggi yang diperoleh Ratnadewi dan Sumaryono (2010), yaitu 2,79%. Kadar kinin yang diperoleh melebihi kadar kinin pada kulit pohon kina yaitu 4,2%; kecuali pada perlakuan A1 dengan lama kultur 6 minggu, perlakuan T0,2 dengan lama kultur 6 minggu dan perlakuan P7
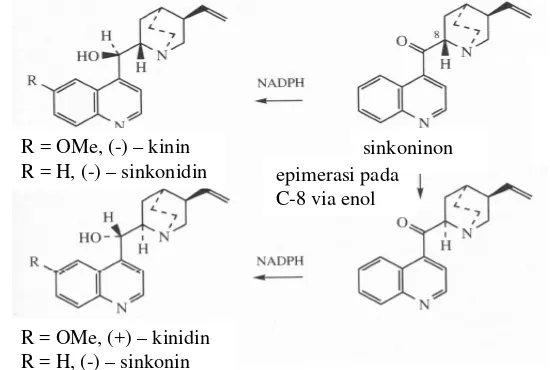
Kinin (C
dengan lama kultur 6 minggu; (Daniel 2006).
20H24N2O2) dan kinidin (C20H24N2O2) atau sinkonin (C19H22N2O) dan sinkonidin (C19H22N2
Triptofan merupakan asam amino aromatik yang mengandung sistem cincin indol yang diperoleh melalui asam antranilat pada jalur shikimat. Triftopan merupakan prekursor umum alkaloid indol dan dengan rangkaian reaksi penyusunan ulang dapat diubah menjadi cincin kinolin (Dewick 2001; Daniel 2006). Beberapa contoh modifikasi alkaloid indol terpenoid ditemukan pada genus Chincona (Rubiaceae) yaitu kinin, kinidin, sinkonin dan sinkonidin yang bernilai penting sebagai anti malaria (Daniel 2006).
Perlakuan T0,2 dan T2 yang diberi triptofan 0,2 ppm dan 2 ppm tidak menimbulkan peningkatan kadar total kinolin. Perlakuan T0,2 dengan usia kultur 6 dan 7 minggu serta T2
dengan usia kultur 6 minggu mampu meningkatkan kadar sinkonidin. Perlakuan meningkatkan kadar sinkonidin Ratnadewi dan Sumaryono (2010) memperoleh peningkatan kinin 8 kali pada perlakuan triptofan 2 ppm usia kultur 7 minggu yaitu 0,09% dibandingkan dengan perlakuan Kontrol yaitu 0,01%, kinidin meningkat 2,57% pada perlakuan triptofan 2 ppm usia kultur 7 minggu yaitu 0,09% dibandingkan dengan perlakuan Kontrol yaitu 0,03%, sinkonin meningkat menjadi 0,002% pada perlakuan triptofan 2 ppm usia kultur 7 minggu dan 0,01% pada perlakuan triptofan 0,2 ppm usia kultur 7 minggu dibandingkan dengan perlakuan Kontrol yang tidak terdeteksi, sinkonidin meningkat hampir 43 kali pada perlakuan triptofan 0,2 ppm usia kultur 6 minggu yaitu 2,79% dan 123,13% pada perlakuan triptofan 2 ppm usia kultur 6 minggu yaitu 0,08% dibandingkan dengan perlakuan Kontrol yaitu 0,06%. Kadar kinolin yang dihasilkan umumnya masih rendah, namun mereka telah membuktikan pemberian triptofan mampu meningkatkan kadar kinolin pada C. ledgeriana dengan klon yang berbeda.
R = OMe, (-) – kinin R = H, (-) – sinkonidin
R = OMe, (+) – kinidin R = H, (-) – sinkonin
sinkoninon
Gambar 8. Struktur Kinin, Kinidin, Sinkonin dan Sinkonidin. epimerasi pada
KESIMPULAN
1. Perlakuan ABA 3 ppm dan sukrosa 30 g/l dalam media WP cair (komposisi terlampir) adalah yang terbaik dalam pertumbuhan suspensi sel kina.
2. Perlakuan paklobutrazol 7 ppm, manitol 5,3 g/l dan sukrosa 20 g/l dalam media WP cair dengan lama kultur 7 minggu adalah yang terbaik untuk produksi kinin.
3. Perlakuan paklobutrazol 7 ppm, manitol 5,3 g/l dan sukrosa 20 g/l dalam media WP cair dengan lama kultur 6 minggu adalah yang terbaik untuk produksi sinkonin dan lama kultur 7 minggu untuk produksi kinidin. Perlakuan triptofan 0,2 ppm dan sukrosa 30 g/l dalam media WP cair dengan lama kultur 7 minggu adalah yang terbaik untuk produksi sinkonidin.
4. Pertumbuhan suspensi sel terendah pada perlakuan paklobutrazol 7 ppm, manitol 5,3 g/l dan sukrosa 20 g/l dalam media WP cair menghasilkan kadar total kinolin tertinggi.
DAFTAR PUSTAKA
Abdel-Raheem AT, Ragab AR, Kasem ZA, Omar FD, Samera AM. 2007. In vitro selection for tomato plants for drought tolerance via callus culture under polyethylene glycol (PEG) and mannitol treatments. Af. Crop Sci. Conf. Proc. 8: 2027-2032.
[Anonim]. 2003. Tissue Culture Media-Composition. Product Information Sheet. PhytoTechnology Laboratories, Inc.
Ascough GD, Swart PA, Finnie JF,Staden JV. 2010. Micropropagation of Romulea minutiflora, Sisyrinchium laxum and Tritonia gladiolaris - Iridaceae with ornamental potential. South Af. J. Bot. 77: 216–221.
Blom TJM, Kreis W, van Iren F, Libbenga KR. 1992. A non-invasive method for the routine-estimation of fresh weight of cells grown in batch suspension cultures. Plant Cell Rep. 11:146-149.
Bhojwani SS, Razdan MK. 1996. Plant Tissue Culture: Theory and Practices. Amsterdam: Elsevier.
Brocard-Gifford I, Lynch TJ, Garcia ME, Malhotra B, Finkelstein RR. 2004. The Arabidopsis thaliana abscisic acid-insensitive8 locus encodes a novel protein mediating abscisic acid and sugar responses essential for growth. The Plant Cell 16: 406–421.
Christmann A, Moes D, Himmelbach A, Yang Y, Tang Y, Grill E. 2006. Integration of abscisic acid signalling into plant responses. Plant Biol. 8: 314–325.
Collin HA, Edwards S. 1998. Plant Cell Culture. Singapore: BIOS Scientific Publishers Limited.
Daniel M. 2006. Medicinal Plants: Chemistry and Properties. USA: Science Publishers.
Dewick PM. 2001. Medicinal Natural Products A Biosynthetic Approach. Second Edition. England: John Wiley & Sons Ltd.
Finkelstein RR, Rock CD. 2002. Abscisic Acid Biosynthesis and Response. Dalam The Arabidopsis Book. New York: American Society of Plant Biologists. hlm 1-52.
Gamborg OL. 1991. Kalus dan kultur sel. Dalam Metode Kultur Jaringan Tanaman Edisi Kedua. Editor Wetter LR dan Constabel F. Diterjemahkan oleh Widianto MB. Bandung: Penerbit ITB. hlm 1-13.
George EF, Sherrington. 1984. Plant Propagation by Tissue Cultur. Dalam Hand Book and Directory Of Commercial Aplication. New York: Academic Press.
Ghosh A, Chikara J, Chaudhary DR. 2011. Diminution of economic yield as affected by pruning and chemical manipulation of Jatropha curcas L. Biomass Bioenergy. 35: 1021-1029.
Goeschl T. 2002. Stakes in the Evolutionary Race: The Economic Value of Plants for Medicinal Applications. Dalam Breeding Research on Aromatic and Medicinal Plants. Editor Johnson CB and Franz Chlodwig. New York: The Haworth Herbal Press. hlm 373-388.
Hassanein AM. 2004. Effect of relatively high concentrations of mannitol and sodium chloride on regeneration and gene expression of stress tolerant (Alhagi graecorum) and stress sensitive (Lycopersicon esculentum L.) Plant Species. Bulg. J. Plant Physiol. 30: 19-36.
Hassanein AMA. 2010. Establishment of efficient in vitro method for drought tolerance evaluation in Pelargonium. J. Hort. Sci. & Ornamen. Plants 2: 08-15.
Hirayama T, Shinozaki K. 2007. Perception and transduction of abscisic acid signals: keys to the function of the versatile plant hormone ABA. TRENDS in Plant Sci. 12: 343-351.
Hubbard KE, Nishimura N, Hitomi K, Getzoff ED, Schroeder JI. 2010. Early abscisic acid signal transduction mechanisms: newly discovered components and newly emerging questions. Genes Develop. 24: 1695–1708.
Hussein EA, Aqlan EM. 2011. Effect of mannitol and sodium chloride on some total secondary metabolites of fenugreek calli cultured In vitro. Plant Tissue Cult. Biotech. 21: 35-43.
Kasi PD, Sumaryono. 2006. Keragaman morfologi selama perkembangan embrio somatik sagu (Metroxylon sagu Rottb.). Menara Perkeb. 74: 44-52.
Kurz WGW, Constabel F. 1991. Produksi dan isolasi metabolit sekunder. Dalam Metode Kultur Jaringan Tanaman Edisi Kedua. Editor Wetter LR dan Constabel F. Diterjemahkan oleh Widianto MB. Bandung: Penerbit ITB. hlm 168-172.
Leclerc J-C. 2003. Plant Ecophysiology. New Hampshire: Science Publishers Inc.
Lestari EG, Purnamaningsih R. 2005. Penyimpanan in vitro tanaman obat daun dewa melalui pertumbuhan minimal. J AgroBiogen 1: 68-72.
Linden JC, Haigh JR, Mirjalili N, Phisaphalong M. 2001. Gas Concentration Effects on Secondary Metabolite Production by Plant Cell Culture. Dalam Advances in Biochemical Engineering/Biotechnology, Vol. 72. Managing Editor Scheper T. Heidelberg: Springer-Verlag Berlin. hlm 27-62.
Liu Z, Zhang Y, Liu R, Hao H, Wang Z, Bi Y. 2011. Phytochrome interacting factors (PIFs) are essential regulators for sucrose-induced hypocotyl elongation in Arabidopsis. J. Plant Physiol. 168: 1771– 1779.
Mann J. 2001. Secondary Metabolism. Second Edition. Oxford: Oxford University Press.
Misra S, Attree SM, Leal I, Fowke LC. 1993. Effect of abscicic acid, osmoticum and dessication on synthesis of storage proteins during the development of white spruce somatic embryos. Ann. Bot. 71: 11-22.
Moore TC. 1979. Biochemistry and Physiology of Plant Hormones. New York: Springer-Verlag New York Inc.
Prasetiyo DA. 2004. Pengujian Kombinasi Dua Faktor Pada Pengamatan Berulang Untuk Menentukan Standard Bibit Setek Sambung Kina [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Ratnadewi D, Sumaryono. 2010. Quinoline alkaloids in suspension cultures of Cinchona ledgeriana treated with various substances. HAYATI J. Biosci. 17 (4): 179-182.
Reflini. 2002. Kajian Pertumbuhan Akar Rambut Cinchona sp. Dari Inokulasi Beberapa Galur Agrobacterium rhizogenes [thesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Rhodes MJC, Payne J, Robins RJ. 1986. Cell suspension cultures of Cinchona ledgeriana; II. the effect of a range of auxins and cytokinins on the production of quinoline alkaloids. Planta Medica: 226-229.
Sagare AP, Lee YL, Lin TC, Chen CC, Tsay HS. 2000. Cytokinin-induced somatic embryogenesis and plant regeneration in Corydalis yanhusuo (Fumariaceae) - a medicinal plant. Plant Sci. 160: 139–147.
Salisbury FB, Ross CW. 1992. Fisiologi Tumbuhan Jilid 3. Lukman DR, Sumaryono; penerjemah. Bandung: Penerbit ITB. Terjemahan dari: Plant Physiology.
Srivastava LM. 2002. Plant Growth and Development Hormone and Environment. California: Academic Press.
Stern KR. 2006. Introductory-Plant Bology. New York: Mc-Graw Hill.
Sumaryono, Riyadi I. 2005. Pertumbuhan biak kalus dan suspensi sel tanaman kina (Cinchona ledgeriana Moens). Menara Perkeb. 73: 1-9.
Tjitrosoepomo G. 2005. Taksonomi Tumbuhan Obat-obatan. Yogyakarta: Gadjah Mada University Press.
Tjitrosoepomo G. 2007. Taksonomi Tumbuhan (Spermatophyta). Yogyakarta: Gadjah Mada University Press.
Torssell KBG. 1983. Natural Product Chemistry A mechanistic and biosynthetic approach to secondary metabolism. New York: John Wiley & Sons Ltd.
Usviany V. 2006. Pengaruh Penambahan Prekursor Triptofan Terhadap Pertumbuhan dan Kandungan Katarantin Pada Kultur Agregat Sel Catharanthus roseus (L.) G. Don [skripsi]. Bandung: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Bandung.
Wattimena GA. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas IPB dan Lembaga Sumberdaya Informasi IPB. Bogor.
Xiong L, Zhu J-K. 2003. Regulation of abscisic acid biosynthesis. Plant Physiol. 133: 29–36.
von Weymarn N. 2002. Process Development for Mannitol Production by Lactic Acid Bacteria [disertasi]. Helsinki: Department of Chemical Technology, Helsinki University of Technology.
Yuwono T. 2008. Bioteknologi Pertanian. Gadjah Mada University Press. Yogyakarta.
Lampiran 1. Komposisi Media WP (Woody Plant) (Bhojwani & Razdan 1996)
Kelompok Senyawa Kadar (mg/l)
A NH4NO3 400,0
Asam Nikotinat 0,5
Piridoksin HCl 0,5
Lampiran 2. Kadar Kinolin Per Bobot Kering Sel Cinchona ledgeriana Moens.
Perlakuan Lama Kultur
Kadar Senyawa Kinolin (%)
Kinin Kinidin Sinkonin Sinkonidin Total
K 6 minggu 4,61 2,38 1,83 0,27 9,09
Hasil diperoleh dengan penelaahan kromatogram dan perhitungan dengan rumus:
Kadar Kinolin =
Luas Area Sampel
x Konsentrasi Standar x Volume Akhir Luas Area Standar
Bobot sampel
- Luas area sampel dan luas area standar diperoleh dari kromatogram.
- Konsentrasi standar kinin 1%, kinidin 1%, sinkonin 0,25% dan sinkonidin 1%. - Volume akhir 250 ml
Lampiran 3. Kromatogram dan hasil perhitungan kadar kinolin
Perhitungan Kadar Kinin
Usia Kultur 6 Minggu
Perhitungan Kadar Kinidin
Usia Kultur 6 minggu
Perhitungan Kadar Sinkonin
Usia Kultur 6 minggu
Perhitungan Kadar Sinkonidin
Usia Kultur 6 minggu
ABSTRACT
DEDI SATRIAWAN. Improvement of Quinine Alkaloids Content in Cell Suspension Culture of Cinchona ledgeriana Treated with Chemical Compounds. Supervised by DIAH RATNADEWI and SUMARYONO.
Quinine is used for tonic, appetite enhancer, antipyretic, antimalarial, cosmetic ingredients and tanning. Quinine can be obtained from the bark of seven or more years old Cinchona tree. Cell suspension culture is an alternative means to obtain secondary metabolites rapidly and continously. Quinine, one of alkaloid compounds, is expected to increase with the addition of abscisic acid (ABA) and paclobutrazol (PBZ) as growth inhibitors, tryptophan as a precursor and mannitol as an osmotic stress inducer. ABA was used at 1 and 3 ppm, PBZ at 5 and 7 ppm combined with 5.3 g/l mannitol, tryptophan at 0.2 and 2 ppm combined with 5.3 g/l mannitol. ABA at 1 and 3 ppm increased the cell suspension growth but reduced the content of quinine. PBZ at 7 ppm combined with 5.3 g/l mannitol and 20 g/l sucrose significantly reduced the cell suspension growth but remarkably increased quinine content, even higher than that was found in the bark of Cinchona tree in the field. Combination of mannitol and paclobutrazol was effective to inhibit the cell growth but enhance the production of quinine.
RINGKASAN
DEDI SATRIAWAN. Peningkatan Kandungan Alkaloid Kinin dalam Suspensi Sel Kina (Cinchona ledgeriana Moens.) dengan Perlakuan Senyawa Kimia. Dibimbing oleh DIAH RATNADEWI dan SUMARYONO.
Korteks kina mengandung berbagai alkaloid, antara lain kinin, kinidin, sinkonin dan sinkonidin yang termasuk golongan kinolin. Korteks kina dengan kadar alkaloid tertinggi terdapat pada Cinchona ledgeriana. Kinin merupakan bahan untuk tonikum, anti piretikum dan anti malaria. Kinidin digunakan sebagai obat jantung, juga anti malaria bagi yang alergi terhadap kinin. Kegunaan kinin yang lain adalah dapat digunakan sebagai bahan kosmetika, minuman penyegar dan bahan baku industri penyamakan.
Produksi metabolit sekunder melalui kultur suspensi sel dianggap merupakan pilihan yang lebih mempunyai harapan dibandingkan dengan produksi dari tumbuhan utuh. Triptofan merupakan prekursor alkaloid indol dan kinolin. Penambahan triptofan, paklobutrazol dan manitol serta penggantian sebagian sukrosa dengan manitol diharapkan dapat meningkatkan produksi metabolit sekunder. Tujuan penelitian ini adalah untuk meningkatkan kadar alkaloid kinin dalam kultur suspensi sel Cinchona ledgeriana Moens dengan mencobakan berbagai perlakuan kimia.
Penelitian ini dilakukan dalam 3 tahap yaitu induksi dan proliferasi kalus, kultur suspensi sel (homogenisasi) dan perlakuan senyawa kimia. Induksi kalus dilakukan dengan menginisiasi potongan lamina daun muda tanpa aksis pada media WP padat dengan gelrite (MB Cell) 3,5 g/l, sukrosa (Merck) 30 g/l, pikloram 15 µM, BA 2 µM, floroglusinol 1 µM. Setelah 4 minggu, kalus yang terbentuk disubkultur ke media baru dengan kandungan yang sama. Empat minggu kemudian, kalus digunakan untuk bahan suspensi sel. Inisiasi dan proliferasi kalus dilakukan pada ruang gelap dengan suhu 26 0
Kultur suspensi sel dilakukan dengan mentransfer kalus remah (sekitar 1 g) dari media padat ke media WP cair (tanpa gelrite) dengan sukrosa 30 g/l, pikloram 15 µM, BA 0,5 µM dan floroglusinol 1 µM pada baffle flask (labu Erlenmeyer bersekat. Baffle flask selanjutnya diletakkan di meja pengocok dengan kecepatan 90 rpm di ruang kultur selama seminggu. Ruang kultur diatur suhunya 26±1
C.
0
C dengan intensitas cahaya 20 µmolfoton/m2
Perlakuan dilakukan dengan memindahkan 1 spatula sel tersebut ke dalam media WP cair yang mengandung pikloram 15 µM, BA 2 µM, floroglusinol 1 µM dengan perlakuan berupa: 1) sukrosa 30g/l (Kontrol), 2) sukrosa 30 g/l dan ABA 1 ppm (A
/detik selama 12 jam/hari.
Hasil homogenisasi disaring dengan ukuran pori 1000 μm dan 50 μm.
pada usia 7 minggu untuk dilakukan pengukuran kadar kinolin. Kultur dengan perlakuan dikocok secara horizontal dengan kecepatan 90 rpm di ruang kultur.
Perlakuan ABA 3 ppm dan sukrosa 30 g/l memberikan hasil terbaik dalam pertumbuhan suspensi sel. Perlakuan paklobutrazol 7 ppm, manitol 5,3 g/l dan sukrosa 20 g/l dengan lama kultur 7 minggu adalah yang terbaik untuk produksi kinin. Perlakuan paklobutrazol 7 ppm, manitol 5,3 g/l dan sukrosa 20 g/l dengan lama kultur 7 minggu juga yang terbaik untuk produksi kinidin dan sinkonin. Perlakuan triptofan 0,2 ppm serta sukrosa 20 g/l dan manitol 5,3 g/l dengan lama kultur 7 minggu adalah yang terbaik untuk produksi sinkonidin. Pertumbuhan suspensi sel terkecil pada perlakuan paklobutrazol 7 ppm, manitol 5,3 g/l dan sukrosa 20 g/l menghasilkan kadar kinin tertinggi. Kombinasi manitol dan paklobutrazol efektif menghambat pertumbuhan suspensi sel dan meningkatkan produksi kinin.
PENDAHULUAN
Latar Belakang
Tumbuhan kina berasal dari daerah hutan di pegunungan Andes di Amerika Selatan yang meluas sampai Peru, Bolivia, Ekuador, Kolombia, Venezeula dan kemudian dikebunkan secara besar-besaran di Indonesia, India, dan Amerika Selatan antara lain di Guatemala (Tjitrosoepomo 2005).
Metabolit sekunder merupakan hasil tumbuhan yang khas dan dijumpai sebagai terpenoid, glikosida (steroid, fenolik) dan alkaloid. Beberapa metabolit sekunder ini merupakan zat aktif yang berguna (Kurz & Constabel 1991). Korteks kina mengandung berbagai alkaloid, antara lain kinin, kinidin, sinkonin dan sinkonidin yang termasuk golongan kinolin. Korteks kina dengan kadar alkaloid tertinggi terdapat pada Cinchona ledgeriana. Kinin merupakan bahan untuk tonikum, anti piretikum dan anti malaria. Kinidin digunakan sebagai obat jantung, juga anti malaria bagi yang alergi terhadap kinin (Tjitrosoepomo 2005). Kegunaan kinin yang lain adalah dapat digunakan sebagai bahan kosmetika, minuman penyegar dan bahan baku industri penyamakan (Prasetiyo 2004).
Kebutuhan akan antimalaria yang meningkat mengakibatkan perlunya peningkatan produksi kinolin dari kina. Pohon kina baru bisa dipanen setelah minimal berusia 7 tahun dan akan menghasilkan kadar kinolin maksimal pada usia 20 tahun. Lambatnya produksi kinolin ini memicu produksi antimalaria sintetik. Antimalaria sintetik ternyata menimbulkan resistensi sehingga permintaan kinolin kina kembali meningkat (Reflini 2002).
dimungkinkannya mengatur proses metabolismenya untuk memperoleh hasil sebesar-besarnya (Kurz & Constabel 1991).
Pemberian triptofan mampu meningkatkan kadar katarantin pada kultur suspensi sel Catharanthus roseus (Usviani 2006). Triptofan merupakan prekursor alkaloid indol dan kinolin (Mann 2001; Daniel 2006). Penambahan triptofan sebagai prekursor diharapkan dapat meningkatkan kadar alkaloid kinin, kinidin, sinkonin dan sinkonidin pada kultur suspensi sel Cinchona ledgeriana Moens. Selain pemberian prekursor, perlakuan retardan yang menghambat pertumbuhan dan penggantian sebagian sukrosa dengan manitol diharapkan dapat meningkatkan produksi metabolit sekunder. Salah satu retardan yang umum digunakan untuk menghambat pertumbuhan vegetatif secara in vitro maupun pada tumbuhan utuh adalah paklobutrazol. Asam absisat (ABA) juga dapat menghambat pertumbuhan vegetatif tumbuhan (Wattimena 1988) sehingga juga digunakan sebagai perlakuan dalam penelitian ini. Pemberian manitol untuk meningkatkan metabolime sekunder antara lain telah digunakan pada kultur kalus tumbuhan Trigonella foenum-graecum L. (Hussein & Aqlan 2011).
Tujuan Penelitian
TINJAUAN PUSTAKA
Tumbuhan Kina
Tumbuhan adalah pemasok bahan obat-obatan yang utama untuk penyakit fisik pada manusia sebelum munculnya obat sintetis. Ketersediaan tumbuhan sehubungan dengan kuantitas dan kualitas pada setiap titik waktu tertentu menjadi penentu pasokan obat-obatan pada akhir dari rantai produksi (Goeschl 2002).
Tumbuhan kina berasal dari daerah hutan di pegunungan Andes di Amerika Selatan yang meluas sampai Peru, Bolivia, Ekuador, Kolombia dan Venezeula. Tumbuhan kina kemudian ditanam secara besar-besaran di Indonesia, India, dan Amerika Selatan antara lain di Guatemala (Tjitrosoepomo 2005). Klasifikasi tumbuhan kina adalah divisi spermatophyta, kelas dicotyledonae, ordo rubiales, famili rubiaceae, genus Cinchona, spesies Cinchona ledgeriana Moens. (Tjitrosoepomo 2007). Pohon kina berupa tajuk berbentuk kerucut, percabangan membentuk sudut yang tajam dengan batang. Duduk daun bersilang-berhadapan. Strobilus tertanam pada sisi atas daun. Bunga berwarna krem dan mengangguk (Tjitrosoepomo 2005).
Pada tumbuhan kina terdapat kulit baik batang maupun akar yang disebut korteks kina. Korteks kina mengandung berbagai alkaloid; antara lain kinin, kinidin, sinkonin dan sinkonidin. Korteks kina dengan kadar alkaloid tinggi terdapat pada Cinchona ledgeriana Moens. Kinin merupakan bahan untuk tonikum, anti piretikum dan anti malaria. Kinidin digunakan sebagai obat jantung, juga anti malaria (bagi yang alergi terhadap kinin). Kandungan korteks kina berupa alkaloids berkisar 6-7%. Jenis Cinchona pitayensis Wedd. di Kolumbia dan Equador mengandung 3-6,5% kinin pada kulitnya. Jenis Cinchona officinalis di Equador, Peru, Kolumbia, Venezeula dan Bolivia mengandung 1-4% total alkaloid pada kulitnya yang setengah sampai dua pertiganya berupa kinin (Tjitrosoepomo 2005).
Metabolit Sekunder
menyediakan berbagai bahan biokimia yang berguna untuk kemanusiaan; seperti bahan obat-obatan, rasa, kosmetik, wewangian dan bahan kimia pertanian (Kurz & Constabel 1991; Collin & Edwards 1998; Linden et al. 2001).
Metabolit sekunder mencakup berbagai senyawa organik kompleks yang disintesis dalam tumbuhan. Ada metabolit sekunder yang memiliki peran yang sangat penting sebagai pertahanan terhadap hama, terutama di jaringan dewasa yang mengakumulasikan senyawa ini. Metabolit sekunder juga dapat disintesis secara cepat dalam menanggapi infeksi mikroba dan serangan serangga. Senyawa yang sama tampaknya disintesis sebagai respons terhadap berbagai cekaman abiotik seperti dingin, panas, osmotik ekstrem dan kerusakan fisik (Collin & Edwards 1998).
Sintesis metabolit sekunder tampaknya dirangsang jika karbon tetap tidak sepenuhnya dimanfaatkan oleh aktivitas metabolik utama dari pertumbuhan dan diferensiasi sel. Karbon tidak digunakan untuk mensintesis dinding sel dan protein diubah menjadi metabolit sekunder dan disimpan dalam vakuola sitoplasma atau vesikel. Metabolit sekunder akan terdegradasi dan karbon yang tersimpan akan dilepaskan ketika pertumbuhan vegetatif berlangsung lebih cepat. Kegiatan metabolisme sekunder dan primer terkait erat dan ada dalam kesetimbangan dinamis yang dihubungkan oleh enzim kunci (Collin & Edwards 1998).
Sekitar 100 alkaloid memiliki inti kinolin. Alkaloid ini sangat terbatas dan dilaporkan terdapat pada Cinchona dari Rubiaceae dan beberapa spesies dari Rutaceae. Sejumlah spesies Cinchona memberikan alkaloid penting, terutama C. officinalis Linn. (kina kuning), C. calisaya Wedd, C. succirubra Pac. (kina merah)
dan C. ledgeriana Moens. (Daniel 2006). Kinin merupakan komponen utama dari kulit kayu Chincona dan telah berhasil diisolasi serta dimurnikan sejak tahun 1817-1832. Kinin merupakan senyawa bernilai penting di bidang farmasi (Mann 2001).
alkaloid berupa garam-garam dari asam kinat dan asam sinkotanat. Jumlah asam kinat pada obat malaria adalah sekitar 5-8% (Daniel 2006).
Sebagian besar kinin juga digunakan sebagai bahan tonik, campuran minuman ringan untuk mencegah kejang otot dan penambah nafsu makan. Kinidin banyak digunakan untuk menormalkan denyut jantung yang tidak teratur. Sinkonin banyak digunakan untuk biopestisida, sedangkan sinkonidin banyak digunakan sebagai katalis pada reaksi-reaksi kimia (Ditjenbun, 2010).
Produksi Metabolit Sekunder Secara In Vitro
Kultur suspensi sel tumbuhan mampu menyediakan sumber metabolit sekunder agar industri tidak bergantung pada tumbuhan di alam. Kultur suspensi sel tumbuhan dapat diatur sehingga penyediaan pasokan bahan baku lebih efisien. Produksi metabolit sekunder dengan suspensi sel tumbuhan dengan cara yang sama seperti mikroba berbasis sistem fermentor dan ditumbuhkan pada skala industri adalah sangat mungkin. Sejumlah peneliti telah mempelajari penggunaan sel tumbuhan dalam kultur sebagai sumber dari beberapa senyawa organik. Banyak yang harus dipelajari dengan lebih baik tentang kondisi optimum bagi pertumbuhan dan produktivitas sel dalam kultur sebelum proses tersebut dapat menjadi pilihan manufaktur yang layak (Kurz & Constabel 1991; Collin & Edwards 1998; Linden et al. 2001).
Kultur suspensi diawali dengan kultur kalus pada media padat. Kultur kalus dapat dikembangkan dengan menggunakan eksplan yang berasal dari berbagai sumber; misalnya tunas muda, daun, ujung akar, buah dan bagian bunga. Kalus akan terbentuk dalam waktu 2 - 4 minggu (tergantung spesies) jika suatu eksplan ditanam pada media yang sesuai. Kalus merupakan massa amorf yang tersusun atas sel-sel berdinding sel tipis yang berkembang dari hasil proliferasi sel-sel jaringan induk. Kalus harus disubkultur secara berkala dalam interval tertentu (misalnya setiap bulan) ke media baru (Yuwono 2008).
dan memberi aerasi pada kultur (Yuwono 2008). Kultur suspensi sel terdiri dari campuran agregat sel, kumpulan sel dan sel tunggal. Laju pertumbuhan kultur suspensi sel biasanya lebih cepat daripada kultur pada media padat. Teknik ini memberikan pengendalian lingkungan tumbuh yang lebih baik, karena kebanyakan sel akan dikelilingi media (Gamborg 1991).
Laju pembelahan sel pada sistem kultur suspensi lebih tinggi dibanding pada kultur kalus, biasanya berkisar antara 24 – 72 jam per siklus. Kultur suspensi sel mempunyai beberapa keuntungan dibanding kultur kalus; yaitu suspensi sel dapat dipipet sehingga mempermudah proses subkultur, lebih homogen dan tingkat diferensiasi rendah, dapat dilakukan dengan volume besar (mencapai 1500 liter), pengaturan kondisi lingkungan lebih mudah dan dapat dilakukan manipulasi produksi metabolit sekunder seperti penambahan prekursor (Yuwono 2008).
Akumulasi metabolit sekunder cenderung meningkat pada akhir periode pembelahan sel yang cepat dalam siklus pertumbuhan pada sebagian besar kultur suspensi sel. Alkaloid indol total meningkat dan mencapai maksimum pada fase akhir eksponensial pada kultur Catharanthus roseus. Hal yang sama juga berlaku untuk alkaloid tropana pada sejumlah spesies pada famili solanaceae dan asam rosmarinat dalam kultur sel dari Anchusa officinalis. Penghambatan pertumbuhan kultur suspensi sel tumbuhan menyebabkan peningkatan akumulasi metabolit sekunder (Collin & Edwards 1998).
Senyawa retardan dapat menghambat pertumbuhan tumbuhan seperti menghambat pemanjangan sel pada meristem sub apikal sehingga ruas batang tumbuhan menjadi lebih pendek (Wattimena 1988; Salisbury & Ross 1992). Salah satu senyawa retardan yang umum digunakan adalah paklobutrazol. Paklobutrazol telah dibuktikan mampu menghambat pertumbuhan benih tanaman barley (Srivastava 2002).
Gula pada media kultur tumbuhan merupakan sumber energi tersedia dan sumber karbon yang sangat dibutuhkan untuk pertumbuhan secara in vitro. Gula juga mempengaruhi potensial osmotik media kultur tumbuhan. Gula yang umum digunakan pada kultur tumbuhan adalah sukrosa. Untuk kebutuhan lainnya; sukrosa bisa digantikan dengan glukosa, fruktosa atau gula alkohol (Sutter 1996; Collin & Edwards 1998). Manitol merupakan gula alkohol yang umum digunakan dalam kultur tumbuhan. Manitol digunakan untuk mengatur potensial osmotik media pada kultur protoplast (Collin & Edwards 1998). Jumlah energi yang terkandung pada manitol lebih rendah dibandingkan dengan sukrosa (von Weymarn 2002). Manitol digunakan untuk mengganti sebagian sukrosa untuk mengurangi energi tersedia tanpa merubah potensial osmotik media. Pengurangan energi tersedia diharapkan menghambat pertumbuhan sehingga meningkatkan laju metabolisme sekunder.
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian berlangsung dari bulan September 2011 sampai Januari 2012 di Laboratorium Biak Sel dan Mikropropagasi Tanaman, Balai Penelitian Bioteknologi Perkebunan Indonesia dan Laboratorium Balai Besar Penelitian dan Pengembangan Pasca Panen Pertanian, Bogor.
Bahan Penelitian
Bahan yang digunakan antara lain daun muda kina (Cinchona ledgeriana Moens.) klon QRC 315, media WP (Woody Plant), sukrosa, gelrite, pikloram, BA, floroglusinol, paklobutrazol, ABA, triptofan, sabun cair, Dithane M-45 dan Bayclin (larutan NaOCl 5,25%).
Prosedur Penelitian
Induksi dan Proliferasi Kalus (8 minggu)
Kultur Suspensi Sel/Homogenisasi (1 minggu)
Perlakuan Senyawa Kimia (7 minggu)
Pengukuran Kadar Kinolin (Minggu ke-6 dan ke-7)
Pengukuran Volume Sel (7 minggu)
1. Induksi dan Proliferasi Kalus
Induksi kalus dilakukan dengan menginisiasi potongan lamina daun muda tanpa aksis pada media WP padat dengan gelrite (MB Cell) 3,5 g/l, sukrosa (Merck) 30 g/l, pikloram 15 µM, BA 2 µM, floroglusinol 1 µM. Daun muda dibersihkan dengan sabun cair dan disterilisasi dengan fungisida Dithane M-45 2 g/l selama 10 menit dan larutan NaOCl 1,05% selama 15 menit sebelum diinisiasi ke media. Kalus yang terbentuk diproliferasi ke media baru dengan kandungan yang sama pada akhir minggu keempat. Kalus digunakan untuk bahan suspensi sel pada akhir minggu keempat proliferasi. Inisiasi dan proliferasi kalus dilakukan pada ruang gelap dengan suhu 26 0
2. Kultur Suspensi Sel/Homogenisasi C.
Kultur suspensi sel dilakukan dengan mentransfer kalus remah (sekitar 1 g) dari media padat ke media WP cair (tanpa gelrite) dengan sukrosa 30 g/l, pikloram 15 µM, BA 0,5 µM dan floroglusinol 1 µM pada Baffle flask (Erlenmeyer bersekat). Kalus hasil proliferasi diambil dengan hati-hati dan diurai menggunakan jarum sampai membentuk agregat (gumpalan) yang agak halus. Agregat kalus dimasukkan ke dalam media pada Baffle flask agar menghasilkan suspensi sel yang homogen. Baffle flask berisi agregat kalus dan media induksi suspensi selanjutnya diletakkan di meja pengocok dengan kecepatan 90 rpm di ruang kultur selama seminggu. Ruang kultur diatur suhunya 26±1 0
Induksi dan proliferasi kalus serta kultur suspensi sel/homogenisasi menikuti prosedur Sumaryono & Riyadi (2005).
C dengan intensitas cahaya 20 µmolfoton/detik selama 12 jam/hari.
3. Perlakuan Senyawa Kimia dan Pengukuran Volume Sel
sel dengan metode CVS (cell volume after sedimentation: volume sel setelah diendapkan) (Blom et al. 1992) dilakukan pada tahap ini pada hari 0, 4, ke-7, ke-14, ke-21, ke-28, ke-35, ke-42 dan ke-49. Masing-masing perlakuan dibuat 10 kultur yang dianggap sebagai ulangan, 5 ulangan dipanen pada usia 6 minggu dan 5 ulangan dipanen pada usia 7 minggu untuk dilakukan pengukuran kadar kinolin. Kultur dengan perlakuan dikocok secara horizontal dengan kecepatan 90 rpm di ruang kultur.
4. Pengukuran Kadar Kinolin
HASIL DAN PEMBAHASAN
Pertumbuhan Kalus dan Induksi Suspensi Sel Sebelum Perlakuan
Potongan lamina daun Cinchona ledgeriana Moens. yang dijadikan eksplan mulai membentuk kalus pada minggu kedua setelah ditanam. Kalus yang dihasilkan berupa kalus remah berwarna putih sedikit kecoklatan bercampur sedikit kalus kompak berwarna coklat muda. Kalus disubkultur ke media baru dengan kandungan yang sama untuk proliferasi setelah empat minggu diinisiasi. Proliferasi dilakukan untuk memperoleh jumlah kalus yang cukup. Kalus yang terbentuk cukup banyak pada inisiasi maupun proliferasi. Hal ini membuktikan bahwa media yang digunakan (Sumaryono & Riyadi 2005) sesuai untuk menghasilkan kalus secara optimal. Kalus remah yang dihasilkan dapat digunakan untuk bahan suspensi sel setelah fase proliferasi mencapai empat minggu. Kultur suspensi mampu menghasilkan cukup banyak sel baru hanya dalam satu minggu pada fase homogenisasi.
Pertumbuhan Suspensi Sel pada Media Perlakuan
Pertumbuhan sel kina diamati dengan metode CVS selama 7 minggu. Pertumbuhan volume sel dapat dilihat pada Gambar 1. Pertumbuhan sel terbaik diperoleh pada perlakuan A3 yaitu ABA 3 ppm dan sukrosa 30 g/l (mencapai 15 kali dari volume sel awal) dan terendah pada perlakuan P7 yaitu paklobutrazol 7 ppm, sukrosa 20 g/l dan manitol 5,3 g/l (hanya mencapai 5 kali dari volume sel awal). Pertumbuhan sel pada perlakuan A3 dan A1 melebihi pertumbuhan perlakuan Kontrol sedangkan pada perlakuan T0.2, T2, P5 dan P7 di bawah pertumbuhan perlakuan Kontrol. Puncak pertumbuhan umumnya (termasuk perlakuan Kontrol) telah tercapai pada hari ke-42 dalam media perlakuan, kecuali pada perlakuan T2
ABA adalah zat pengatur pertumbuhan yang kadang digunakan dalam media kultur. ABA umumnya ditambahkan ke media kultur untuk meningkatkan, menghambat atau merangsang pertumbuhan kalus (tergantung pada spesies) dan untuk meningkatkan proliferasi tunas atau kuncup (Anonim 2003).