POTENSI BAKTERI SIMBION
TUMBUHAN LAMUN SEBAGAI PENGHAMBAT
TERJADINYA
BIFOULING
DI LAUT
BINTANG MARHAENI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi berjudul “Potensi Bakteri Simbion Tumbuhan Lamun sebagai Penghambat Terjadinya Biofouling di Laut” adalah karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan atau tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi.
Bogor, April 2011
ABSTRACT
BINTANG MARHAENI. Potential of Bacterial Simbionts of Seagrass as Preventing Marine Biofouling. Under direction of DIETRIECH GEOFFREY BENGEN, RICHARDUS KASWADJI, and OCKY KARNA RADJASA.
Biofouling is defined as the attachment and growth of microorganisms (microbial fouling) and macroorganisms (macrofouling) on solid surface. Biofouling bacteria also result on surface of marine plant seagrass as symbiotic. Bacteria-seagrass association that occur on the surface have been known to produce secondary metabolites that have important ecological roles, including prevention from pathogen infection and fouling organisms. A research aimed at the bacterial symbionts of seagrass Enhalus acoroides, Thalassia hemprichii and
Syringodium isoetifolium as defense marine biofouling was performed. Bacterial
symbionts including endophytes and epiphytes were isolated from the seagrass. Marine biofilm-forming bacteria had been isolated from the fiber and wooden panels from the surrounding colonies. Epiphyte isolate found more than endophyte isolate, however more biological activity was found among endophyte compare to epiphyte against biofilm-forming bacteria. Bacterial endophyte inhibited more biofilm-forming bacteria than epiphyte. Extract endophytes and epiphytes bacteria also inhabited biofilm-forming bacteria. Field experimental of extract bacteria show that extract of two bacteria spesies cannot obtained fouling organisms identified as Virgibacillus genus and one identified as Bacillus genus. Bacterial symbionts of seagrass in this experiment show potential source as natural marine antifouling.
RINGKASAN
BINTANG MARHAENI. Potensi Bakteri Simbion Tumbuhan Lamun sebagai Penghambat Terjadinya Biofouling di Laut. Dibimbing oleh Dietriech Geoffrey Bengen., Richardus Kaswadji., dan.Ocky Karna Radjasa.
Biofouling adalah penempelan dan pertumbuhan organisme pada permukaan
substrat baik yang bersifat abiotik maupun biotik yang berada di bawah permukaan air. Biofouling dibedakan menjadi microfouling yaitu pembentukan
biofilm (kolonisasi bakteri dan mikroalga) dan macrofouling yaitu penempelan
makroorganisme (kolonisasi avertebrata dan makroalga). Tahapan proses
biofouling dimulai dari terbentuknya biofilm secara biokimia pada permukaan
substrat diikuti penempelan mikroba atau microfouling dan tahap akhir adalah penempelan macrofouling. Biofouling banyak terjadi pada berbagai struktur di lingkungan laut dan telah menjadi permasalahan yang serius. Usaha penanggulangan biofouling di laut banyak dilakukan dengan cara pengecatan menggunakan cat antifouling sintetis yang mengandung logam berat dan TBT
(tributyltin). Aplikasi cat tersebut pada kenyataannya menyebabkan timbulnya
pencemaran lingkungan karena merusak kehidupan organisme non-target yang merupakan spesies ekonomis penting. Hal tersebut menyebabkan penggunaan TBT sebagai antifoulant pada saat ini tidak boleh digunakan lagi. Berawal dari permasalahan tersebut maka penelitian potensi bakteri simbion tumbuhan lamun sebagai penghambat biofouling dilaut telah dilakukan.
Penelitian ini dilakukan mulai bulan Desember 2008 sampai Maret 2010. Tahap awal dari penelitian ini adalah isolasi bakteri simbion tumbuhan lamun (epifit dan endofit) dari jenis Enhalus acoroides, Thalassia hemprichii dan
Syringodium isoetifolium yang tumbuh di perairan Teluk Awur, Jepara, Jawa
Hasil penelitian memperlihatkan bahwa isolat bakteri simbion epifit ditemukan lebih banyak dibandingkan bakteri simbion endofit namun demikian dilihat dari persentase bakteri terisolasi yang aktif pada uji hambat lebih banyak persentase bakteri endofit yang aktif dibandingkan bakteri epifit. Kemampuan penghambatan bakteri simbion endofit lebih besar baik zona hambatnya maupun kemampuan menghambat banyaknya jumlah isolat bakteri biofilm. Kemampuan penghambatan ekstrak bakteri simbion lamun (epifit dan endofit) terhadap bakteri lebih kecil dibandingkan isolat bakteri. Pada aplikasi lapang uji penghambatan
macrofouling terhadap ekstrak bakteri lamun yang dicampurkan dengan cat tanpa
antifoulant sintetis dengan perbandingan 50 : 50 memperlihatkan ada tiga ekstrak
isolat bakteri simbion lamun yaitu bakteri simbion epifit pada Enhalus acoroides
(EA 6), bakteri simbion epifit Thalassia hemprichii (TB 3) dan bakteri simbion endofit Syringodium isoetifolium (ESJ 1) tidak ditemukan macrofouling. Ketiga bakteri tersebut merupakan bakteri yang memiliki kemampuan penghambatan maksimal pada uji penghambatan terhadap pertumbuhan bakteri biofilm. Hasil identifikasi molekuler bakteri memperlihatkan bahwa dua isolat bakteri tersebut tergolong genus Virgibacillus dan satu isolat bakteri adalah genus Bacillus . Hasil isolasi bakteri biofilm memperlihatkan bahwa jumlah isolat bakteri biofilm
(microfouling) yang terisolasi dari substrat kayu dan fiber permukaan kasar lebih
banyak dibandingkan permukaan halus. Pengamatan terhadap macrofouling pada suksesi proses biofouling memperlihatkan kecenderungan yang sama yaitu permukaan kasar lebih banyak dibandingkan permukaan halus dan jumlah organisme fouling pada substrat kayu lebih banyak dibandingkan substrat fiber.
@ Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
POTENSI BAKTERI SIMBION TUMBUHAN LAMUN
SEBAGAI PENGHAMBAT TERJADINYA
BIOFOULING
DI LAUT
BINTANG MARHAENI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Ilmu Kelautan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi
Penguji pada Ujian Tertutup : Dr. Malikusworo Hutomo. Dr. Iwan Saskiawan.
Judul Disertasi : Potensi Bakteri Simbion Tumbuhan Laut Lamun sebagai Penghambat terjadinya Biofouling di Laut
Nama : Bintang Marhaeni
NIM : C 561060031
Disetujui Komisi Pembimbing
Ketua
Prof. Dr. Ir. Dietriech G. Bengen, DEA
Dr. Ir. Richardus Kaswadji, MSc
Anggota Anggota
Ocky Karna Radjasa, Ph.D
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Kelautan
Dr. Ir.Neviaty P. Zamani., MSc Dr.Ir. Dahrul Syah, M.Sc.Agr.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam
penelitian yang dilaksanakan sejak bulan Desember 2008 sampai Maret 2010
adalah mencari sumber alternatif antifoulant alami ramah lingkungan, dengan
judul Potensi Bakteri Simbion Tumbuhan Lamun sebagai Penghambat Terjadinya
Biofouling di Laut.
Terima kasih penulis ucapkan kepada Bapak Prof.Dr.Ir. Dietriech Geoffrey
Bengen, DEA, Bapak Dr. Ir. Richardus Kaswadji, MSc dan Bapak Drs. Ocky
Karna Radjasa, MSc, Ph D selaku pembimbing. Kepada Bapak Dr. Ir. Agus Oman
Sudrajat yang telah memimpin sidang baik pada Ujian Tertutup maupun Ujian
Terbuka dan Ibu Dr. Neviaty P. Zamani sebagai ketua Program Studi Ilmu
Kelautan kami ucapkan terima kasih banyak. Ucapan terima kasih juga
disampaikan kepada Rektor Universitas Jenderal Soedirman Purwokerto, Dekan
Fakultas Sains dan Teknik Universitas Jenderal Soedirman, Pimpinan dan Staf
Sekolah Pascasarjana IPB, Pimpinan dan Staf Program Studi Ilmu Kelautan IPB
yang telah memberi kesempatan kepada penulis untuk mengikuti Program Doktor
dan atas segala bantuan dan pelayanan Bagian Administrasi yang diberikan
selama proses studi.
Ucapan terima kasih juga disampaikan kepada Ditjen DIKTI yang telah
memberikan bantuan beasiswa dan dana penelitian melalui BPPS-DIKTI, Pihak
Universitas Jenderal Soedirman Purwokerto yang telah memberikan bantuan dana
untuk penyelesaian disertasi. Kepada keluarga penulis juga mengucapkan terima
kasih yang sebesar-besarnya terutama suami Drs. Noor Abiyoso Syakhrie dan
anak-anak tercinta Aisyah Amanda Kirana, Annisa Dian Kirani dan Alyya
Meigita Karina serta Orang Tua yang telah senantiasa memberikan suport baik
moril maupun materiil kepada penulis. Kepada segenap pimpinan dan staf
laboratorium jurusan Perikanan dan Ilmu Kelautan Universitas Diponegoro
Semarang kami ucapkan terimakasih atas bantuannya selama penelitian serta
rekan-rekan sesama mahasiswa Ilmu Kelautan dan rekan-rekan pengajar di
Ucapan terimakasih juga kami sampaikan kepada rekan-rekan yang bersama-sama
menuntut ilmu di IPB atas segala motivasi dan bantuannya semoga kita semua
RIWAYAT HIDUP
Penulis dilahirkan di Banjarnegara, Jawa Tengah dari orang tua Ibu Soekijati
dan Bapak Drs. Didi Sayidi (Alm) pada tanggal 3 Juli 1966. Kuliah S1
diselesaikan di Jurusan Biologi Lingkungan, Fakultas Biologi, Universitas
Jenderal Soedirman Purwokerto lulus tahun 1989 dan kuliah S2 di Program Studi
Ilmu Kelautan, Institut Pertanian Bogor lulus tahun 1999 dengan beasiswa TMPD
dari Ditjen DIKTI. Pada tahun 2006 penulis diterima sebagai mahasiswa doktoral
Pascasarjana Program Studi Ilmu Kelautan, Institut Pertanian Bogor dengan
beasiswa melalui BPPS-DIKTI dan sekarang menjadi kandidat untuk gelar doktor
pada di Departemen Ilmu Kelautan FPIK-IPB.
Riwayat pekerjaan penulis dimulai sebagai Staf Peneliti di Program Tropical
Aquatic Biology, SEAMEO-BIOTROP tahun 1990–1995, selanjutnya sebagai
staf pengajar di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor
pada tahun 1993–2004 dan pada saat ini penulis bekerja sebagai staf pengajar di
jurusan Perikanan dan Kelautan, Fakultas Sains dan Teknik, Universitas Jenderal
Soedirman, Purwokerto dari tahun 2004–sekarang.
Sebuah artikel berjudul Screening of Bacterial Symbionts of Seagrass
Enhalus acoroides against Biofilm-Forming Bacteria telah diterbitkan pada bulan
Februari 2010 di Journal of Coastal Development 13(2). Karya ilmiah tersebut
xii
DAFTAR LAMPIRAN ... xvii
PENDAHULUAN ... 1
Latar belakang ... 1
Perumusan Masalah ... 2
Tujuan Penelitian ... 5
Manfaat Penelitian ... 5
Ruang Lingkup Penelitian ... 5
Kebaharuan Penelitian (Novelty Penelitian) ... 5
TINJAUAN PUSTAKA ... 6
Ekobiologi Lamun ... 6
Sumber-sumber Antifoulant Alami ... 10
Biofouling ... 15
BAHAN DAN METODE ... 22
Waktu dan Tempat Penelitian ... 22
Prosedur Penelitian... 24
Isolasi Bakteri Epifit ... 24
Isolasi Bakteri Endofit... 24
Isolasi Bakteri Pembentuk Biofilm ... 25
Uji Penghambatan Bakteri Simbion Lamun (epifit dan endofit) terhadap Pertumbuhan Bakteri Biofilm ... 26
Uji Penghambatan Ekstrak Bakteri Simbion Lamun (epifit dan endofit) terhadap Pertumbuhan Bakteri Biofilm ... 27
Uji Aplikasi Lapang Penghambatan Ekstrak Bakteri Simbion Lamun terhadap Penempelan Macrofouling ... 27
Identifikasi Bakteri ... 28
Analisis Pohon Filogenetik ... 29
Uji Penempelan Macrofouling pada jenis substrat kayu dan fiber ... 30
Pengamatan Parameter Fisik-Kimia Perairan ... 30
HASIL ... 31
Identifikasi Tumbuhan Lamun ... 31
Isolasi Bakteri Simbion Lamun (epifit dan endofit) ... 32
Uji Penghambatan Bakteri Simbion Lamun (epifit dan endofit) terhadap Pertumbuhan Bakteri Biofilm ... 32
xiii
Uji Aplikasi Lapang Penghambatan Ekstrak Bakteri Simbion Lamun
terhadap penempelan Macrofouling ... 37
Isolasi Bakteri Pembentuk Biofilm ... 38
Suksesi Proses Biofouling pada Jenis Substrat Kayu dan Fiber ... 39
Pengamatan Parameter Fisik-Kimia Perairan ... 40
Identifikasi Bakteri ... 44
Analisis Filogenetik ... 45
PEMBAHASAN ... 47
Identifikasi Tumbuhan Lamun ... 47
Isolasi Bakteri Simbion Lamun (epifit dan endofit) ... 47
Uji Penghambatan Bakteri Simbion Lamun (epifit dan endofit) terhadap Pertumbuhan Bakteri Biofilm ... 49
Uji Penghambatan Ekstrak Bakteri Simbion Lamun terhadap Pertumbuhan Bakteri Biofilm ... 51
Uji Penghambatan Ekstrak Bakteri Simbion Lamun terhadap Macrofouling ... 53
Isolasi Bakteri Pembentuk Biofilm ... 55
Pengamatan Suksesi Proses Biofouling pada Jenis Substrat Kayu dan Fiber ... 57
Pengamatan Parameter Fisik-Kmia Perairan ... 62
Identifikasi Bakteri ... 63
KESIMPULAN ... 67
SARAN ... 69
DAFTAR PUSTAKA ... 70
xiv
DAFTAR TABEL
xv
DAFTAR GAMBAR
Halaman
1. Latar belakang penelitian ... 2
2. Kerangka perumusan masalah... 4
3. Rangkaian peristiwa microfouling dan macrofouling (Egan, 2001) ... 17
4. Peta lokasi pengambilan contoh daun lamun ... 23
5. Cara melakukan isolasi bakteri epifit dari daun lamun ... 24
6. Cara melakukan isolasi bakteri endofit dari daun lamun ... 25
7. Pemasangan substrat kayu dan fiber dengan posisi empat mata angin untuk penjebakan bakteri pembentuk biofilm. ... 26
8. Substrat kayu yang dicat dengan campuran cat tanpa antifoulant dan ekstrak bakteri untuk aplikasi lapang ... 28
9. Balok kayu dan fiber yang digunakan dalam percobaan biofouling ... 30
10.Morfologi jenis lamun yang digunakan sebagai objek penelitian ... 31
11.Hasil isolasi bakteri simbion epifit (a) dan endofit (b) ... 32
12.Jumlah isolat bakteri epifit dan endofit terisolasi dari 3 jenis lamun. ... 32
13.Besar zona hambat maksimum (mm) uji penghambatan bakteri simbion lamun (epifit dan endofit) terhadap pertumbuhan bakteri biofilm ... 33
14.Jumlah bakteri biofilm yang dihambat pada uji penghambatan bakteri simbion lamun (epifit dan indofit) terhadap pertumbuhan bakteri biofilm ... 34
15.Persentase bakteri simbion lamun (epifit dan indofit) yang aktif pada uji penghambatan terhadap pertumbuhan bakteri biofilm ... 35
16.Zona hambat maksimum uji penghambatan ekstrak bakteri simbion lamunn (epifit dan endofit) terhadap pertumbuhan bakteri biofilm ... 36
17.Jumlah biofilm yang dihambat pada uji penghambatan ekstrak bakteri simbion lamun (epifit dan endofit) terhadap pertumbuhan bakteri biofilm ... 37
18.Jumlah macrofouling pada uji aplikasi lapang ekstrak bakteri simbion lamun terhadap penempelan macrofouling ... 38
19.Jumlah isolat bakteri biofilm yang terisolasi dari substrat kayu dan fiber ... 38
xvi
21.Suksesi proses biofouling pada substrat fiber dan kayu satu minggu
pertama pengamatan... 40 22.Parameter lingkungan perairan pada saat isolasi bakteri simbion
lamun (epifit dan endofit)... 41 23.Parameter lingkungan perairan pada saat uji aplikasi lapang ekstrak
bakteri terhadap macrofouling ... 42 24.Parameter lingkungan perairan pada saat pengamatan suksesi
biofouling ... 43
25.Hasil analisis pohon filogenetik bakteri simbion lamun (epifit dan
endofit) ... 45
26.Hasil analisis filogenetik bakteri biofilm ... 46
27.Zona hambat pada uji penghambatan ekstrak bakteri simbion E. acoroides, T. hemprichii dan S. isoetifolium terhadap pertumbuhan
bakteri biofilm ... 53 28.Jenis macrofouling yang mendominasi pada uji aplikasi lapang
penempelan macrofouling pada substrat uji yang dicampur dengan
ekstrak bakteri ... 55 29.Jenis macrofouling yang mendominasi pada pengamatan suksesi
xvii
DAFTAR LAMPIRAN
Halaman
1. Pembuatan media isolasi bakteri ... 76
2. Sterilisasi alat dan bahan ... 77
3. Ekstraksi bakteri ... 77
4. Kultur pada media cair ... 77
5. Hasil analisis ragam zona hambat bakteri epifit E. acoroides terhadap bakteri biofilm ... 78
6. Hasil analisis ragam zona hambat bakteri epifit T. hemprichi terhadap bakteri biofilm ... 78
7. Hasil analisis ragam zona hambat bakteri epifit S. isoetifolium terhadap bakteri biofilm ... 78
8. Hasil analisis ragam zona hambat bakteri endofit T. hemprichi terhadap bakteri biofilm ... 78
9. Hasil analisis ragam zona hambat bakteri endofit E. acoroides terhadap bakteri biofilm ... 79
10.Hasil analisis ragam zona hambat bakteri endofit S. isoetifolium terhadap bakteri biofilm ... 79
11.Analisis ragam (Anova) uji daya hambat ekstrak bakteri simbion epifit E. acoroides terhadap bakteri biofilm ... 79
12.Analisis ragam (Anova) uji daya hambat ekstrak bakteri simbion epifit T. hemprichi terhadap bakteri biofilm ... 79
13.Analisis ragam (Anova) uji daya hambat ekstrak bakteri simbion epifit S. isoetifolium terhadap bakteri biofilm ... 79
14.Analisis ragam (Anova) uji daya hambat ekstrak bakteri simbion endofit E. acoroides terhadap bakteri biofilm ... 80
15.Analisis ragam (Anova) uji daya hambat bakteri simbion endofit T. hemprichi terhadap bakteri biofilm ... 80
16.Analisis ragam (Anova) uji daya hambat bakteri simbion endofit S. isoetifolium terhadap bakteri biofilm ... 80
17.Hasil analisis ragam uji macrofouling terhadap ekstrak bakteri simbion lamun ... 80
18.Hasil analisis ragam perlakuan perbedaan jenis dan permukaan substrat ... 81
19.Pengkodean bakteri simbion lamun dan bakteri biofilm ... 81
Latar belakang
Peristiwa biofouling pada berbagai benda di lingkungan laut telah mengakibatkan masalah bagi pelaku industri maritim khususnya dalam bidang transportasi laut seperti perkapalan dan struktur pelabuhan. Biofouling yang terjadi pada badan kapal mengakibatkan peningkatan kekasaran dan menambah beban daya tarik kapal sehingga menyebabkan konsumsi bahan bakar semakin meningkat. Masalah biofouling juga dapat terjadi pada jaring budidaya, pipanisasi bawah laut dan struktur pelabuhan.
Usaha penanggulangan biofouling telah dilakukan dengan beberapa metode antara lain dengan melakukan pengerokan dan pengecatan dengan cat yang mengandung bahan antifouling sintetis. Pengerokan organisme penempel pada badan kapal memerlukan cara tertentu dengan terlebih dahulu melakukan pendaratan kapal. Hal ini menyebabkan kerugian besar bagi industri perkapalan karena pada masa itu kapal tidak bisa melakukan aktifitasnya di laut. Pengecatan dengan antifouling sintetis banyak dilakukan dengan pengecatan antifouling yang mengandung tembaga (logam berat) dan TBT (tributyltin) sebagai unsur aktif yang paling efektif (Willemsen and Ferrari 1993), diacu dalam Abarzua and Jakubowski 1995). Cat antifouling ini mencegah terjadinya biofouling dengan mewujudkan biosida yang efektif dan konstan. Sejak tahun 1970 triaryltin dan
trialkiltin (turunan tributyltin) meningkat penggunaannya sebagai cat antifouling
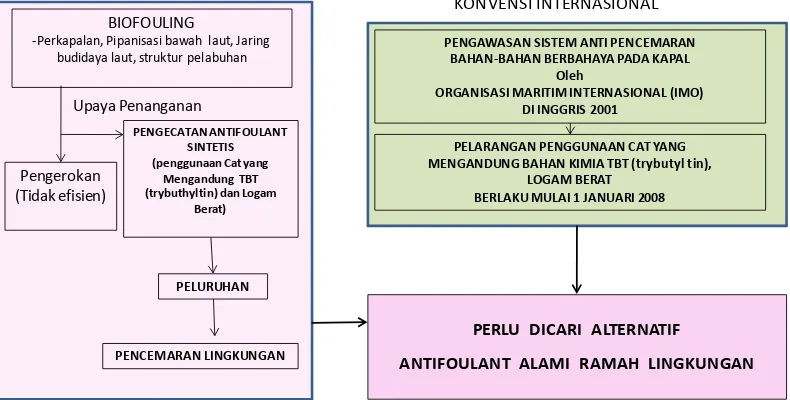
2010). Berdasarkan hal tersebut maka alternatif yang efisien dari penggunaan TBT sebagai antifoulant pada saat ini sudah tidak dapat digunakan lagi. Oleh karena itu pencarian alternatif antifoulant alami yang ramah lingkungan sangat diperlukan pada saat ini (Mayavu et al. 2009). Hal tersebut dapat dijelaskan melalui Gambar 1 mengenai latar belakang penelitian.
Gambar 1 Latar belakang penelitian.
Perumusan Masalah
Biofouling adalah penempelan dan pertumbuhan organisme pada permukaan substrat abiotik maupun biotik yang berada di bawah permukaan air. Biofouling
dibedakan menjadi microfouling yaitu pembentukan biofilm (kolonisasi bakteri dan mikroalga) dan macrofouling yaitu penempelan makroorganisme (kolonisasi avertebrata dan makroalga) (Railkin 2004). Menurut Egan (2001) proses pembentukan komunitas biofouling terjadi melalui suatu proses dimana kolonisasi pada suatu permukaan terjadi sebagai hasil suksesi dari beberapa tahap. Mula-mula terjadi penempelan bahan organik pada suatu permukaan substrat yang bersih kemudian diikuti dengan penempelan bakteri atau microfouling yang kemudian membentuk lapisan eksopolisakarida (EPS) dan tahap akhir adalah penempelan macrofouling. Dalam hal ini terbentuknya biofilm merupakan syarat utama terjadinya biofouling sehingga untuk melakukan penghambatan terjadinya
BIOFOULING
-Perkapalan, Pipanisasi bawah laut, Jaring budidaya laut, struktur pelabuhan
PENGAWASAN SISTEM ANTI PENCEMARAN BAHAN-BAHAN BERBAHAYA PADA KAPAL
Oleh
ORGANISASI MARITIM INTERNASIONAL (IMO) DI INGGRIS 2001
PELARANGAN PENGGUNAAN CAT YANG MENGANDUNG BAHAN KIMIA TBT (trybutyl tin),
LOGAM BERAT BERLAKU MULAI 1 JANUARI 2008
PERLU DICARI ALTERNATIF
ANTIFOULANT ALAMI RAMAH LINGKUNGAN
MASALAH BIOFOULING
macrofouling dapat dilakukan dengan cara memutus rantai dengan melakukan penghambatan terjadinya biofilm bakteri.
Biofouling yang terjadi pada benda mati sangat dipengaruhi oleh jenis substrat dan tekstur permukaan substrat sehingga pemilihan substrat yang tepat pada benda yang terendam di perairan sangat diperlukan. Organisme laut yang hidup dalam perairan juga mengalami peristiwa biofouling namun tidak semua organisme mengalami biofouling yang kompleks karena banyak organisme laut terutama organisme laut sesil memiliki kemampuan pertahanan diri dengan menghasilkan metabolit sekunder. Tumbuhan laut merupakan organisme sesil yang dikenal sebagai sumber metabolit sekunder. Metabolit sekunder yang dihasilkan oleh organisme tersebut memiliki fungsi penting memberikan pertahanan kimia dalam melawan infeksi dan fouling (Davis et al. 1989). Menurut Sammarco dan Coll (1992), metabolit sekunder pada organisme laut berperan penting dalam fungsi ekologis terutama untuk perlindungan terhadap predator, kompetisi ruang hidup, reproduksi dan antifouling. Penelitian yang telah dilakukan membuktikan beberapa metabolit sekunder yang dimiliki oleh tumbuhan lamun menunjukkan adanya aktivitas farmakologi dan merupakan kandidat baru sebagai bahan obat-obatan. Jika kita melakukan produksi bahan-bahan tersebut dari tumbuhan lamun maka kita akan memerlukan suplai biomas lamun dalam jumlah banyak secara kontinyu. Hal yang mengkhawatirkan adalah terjadinya masalah suplai biomas lamun tersebut. Maka hal tersebut jika dilaksanakan dapat mengundang terjadinya permasalahan baru terjadinya eksploitasi berlebihan terhadap keberadaan lamun padahal kita ketahui bahwa ekosistem lamun merupakan ekosistem tempat kehidupan banyak organisme laut. Berdasarkan hal tersebut perlu dilakukan upaya eksplorasi terhadap tumbuhan lamun tanpa melakukan pengrusakan terhadap komunitas lamun itu sendiri.
Bakteri yang bersimbiosis pada organisme hidup sebagai inangnya merupakan bakteri yang hidup bersimbiosis mutualisme. Bakteri simbion ini dapat menghasilkan senyawa hasil metabolit sekunder yang sama dengan inangnya sehingga jika kita mampu mengisolasi bakteri simbion tumbuhan lamun dan berhasil mengkulturnya maka kita bisa mendapatkan metabolit sekunder berupa bahan bioaktif yang sama dengan yang dihasilkan oleh tumbuhan lamun tersebut. Dengan cara ini maka kekhawatiran akan terjadinya eksploitasi berlebihan terhadap biomas lamun dapat terhindarkan. Salah satu fungsi metabolit sekunder yang dihasilkan tumbuhan lamun adalah sebagai antifouling dengan demikian besar kemungkinan bahwa bakteri simbion lamun juga mampu menghasilkan metabolit sekunder yang dapat digunakan sebagai antifouling. Hal ini merupakan terobosan untuk mendapatkan sumber antifoulant alami yang ramah lingkungan karena dengan hanya melakukan isolasi bakteri kita hanya memerlukan bagian tumbuhan lamun dalam jumlah kecil dan antifoulant yang dihasilkan berasal dari organisme bukan bahan sintetis sehingga ramah lingkungan. Untuk melihat keterkaitan pada penjelasan diatas dapat dilihat pada Gambar 2 tentang kerangka perumusan masalah.
Gambar 2 Kerangka perumusan masalah
Tujuan Penelitian
Penelitian ini bertujuan untuk menemukan bakteri simbion tumbuhan lamun yang berpotensi sebagai penghambat terjadinya biofouling di laut.
Manfaat Penelitian
Hasil penelitian ini bermanfaat bagi tersedianya sumber alternatif
antifoulant alami yang ramah lingkungan.
Ruang Lingkup Penelitian
Penelitian ini diawali dengan isolasi bakteri simbion lamun epifit dan endofit pada lamun jenis Enhalus acoroides, Thalassia hemprichii. dan
Syringodium isoetifolium yang tumbuh di perairan Teluk Awur, Jepara, Jawa Tengah. Pengujian kemampuan penghambatan bakteri simbion lamun dilakukan pada isolat bakteri dan ekstrak isolat bakteri simbion epifit dan endofit terhadap bakteri biofilm dari substrat kayu dan fiber yang memiliki permukaan kasar dan halus. Aplikasi lapang terhadap penempelan makrofouling di laut dilakukan terhadap ekstrak isolat bakteri simbion epifit dan endofit lamun yang dipilih berdasarkan kemampuan penghambatan yang tinggi pada uji penghambatan isolat bakteri simbion lamun terhadap pertumbuhan isolat bakteri biofilm. Pengamatan terhadap proses biofouling pada substrat kayu dan fiber yang memiliki permukaan kasar dan halus yang dipaparkan pada air laut hingga diperoleh makroorganisme penempel. Isolasi bakteri biofilm dilakukan pada substrat kayu dan fiber yang memiliki permukaan kasar dan halus yang diletakkan pada lokasi dimana dilakukan isolasi bakteri simbion tumbuhan lamun yang digunakan untuk pengujian penghambatan bakteri simbion lamun terhadap pertumbuhan bakteri
biofilm.
Kebaharuan Penelitian (Novelty Penelitian)
Ekobiologi Lamun
Lamun adalah tumbuhan laut yang memiliki arti penting dalam siklus ekologi pada perairan dangkal pantai tropis dan subtropis, khususnya berhubungan dengan produktivitas lautan. Tumbuhan ini merupakan produsen yang tinggi di daerah tropis. Salah satu hal penting dari lamun adalah memiliki daya adaptasi pada kondisi yang terendam air (hydrofit). Tumbuhan ini memiliki perkembangan rhizoma yang baik (secara horizontal) yang biasanya terdapat di bawah permukaan substrat dan asosiasinya saling menutup satu dengan yang lain. Hal tersebut menyebabkan tumbuhan lamun di lokasinya berperan pada proses sedimentasi karena dapat menangkap serasah dan menstabilkan substrat. Semua jenis tumbuhan lamun memiliki alternatif munculnya daun dari dua kedudukan biasanya muncul dari bagian yang berdiri tegak berupa tunas pendek atau dari rhizoma (Tomlinson 1974, diacu dalam Dawes 1981). Akar yang muncul dan berkembang dari rhizoma sama baiknya seperti yang keluar dari bagian dasar dari setiap bagian yang berdiri tegak. Lamun biasanya memiliki akar yang lebat dan berkulit. Daunnya rata, berbentuk seperti pita, atau silindris jika dilihat dari irisan melintang. Tumbuhan ini dapat menahan gerakan air. Bunganya kecil dan muncul dari dasar tandan daun. Stamen (antera), pistil (style) dan stigma menjulur di atas petal. Biasanya pollen dikeluarkan dengan lapisan bergelatin yang akan terbawa oleh arus air. Butiran polen memanjang (elongated) (Famili Potamogetonaceae) atau seperti bola (spherical) (Famili Hydrocharitaceae) dan tersusun saling melekat berbentuk monili seperti rantai.
Lamun tumbuh subur terutama di daerah terbuka dengan pasang surut dan perairan pantai atau goba yang dasarnya berupa lumpur, pasir, kerikil dan patahan karang mati dengan kedalaman sampai empat meter. Pada perairan yang sangat jernih, beberapa jenis lamun ditemukan tumbuh sampai kedalaman 8–15 meter bahkan sampai 40 meter (Larkum et al. 1989). Padang lamun dapat berbentuk vegetasi tunggal yaitu tersusun atas satu jenis lamun yang tumbuh membentuk padang lebat atau vegetasi campuran yang terdiri dari 2 sampai 12 jenis yang tumbuh bersama-sama pada satu substrat. Pertumbuhan lamun sangat dipengaruhi oleh faktor-faktor internal seperti kondisi fisiologis dan metabolisme, serta faktor eksternal seperti zat hara (nutrien) dan tingkat kesuburan perairan. Faktor-faktor eksternal (lingkungan) yang mempengaruhi distribusi dan pertumbuhan ekosistem padang lamun adalah (1) kecerahan, (2) temperatur, (3) salinitas, (4) substrat dan (5) kecepatan arus.
Lamun yang ditemukan di perairan Indonesia terdiri dari tujuh genus. Tiga diantaranya : Enhalus, Thalassia dan Halophila termasuk Famili Hidrocharitaceae, sedangkan empat genus lainnya adalah Halodule, Cymodocea, Syringodium dan Thalassodendron yang termasuk Famili Potamogetonaceae (Nontji 1987, diacu dalam Dahuri 2003). Kekayaan jenis yang dijumpai di Indonesia menurut Den Hartog (1970), diacu dalam Dahuri (2003) terdapat 13 jenis lamun yaitu: Cymodocea serrulata, C. rotundata, Enhalus acoroides, Halodule uninervis, H.
pinifolia, Halophila minor, H. ovalis, H. decipiens, H. spinulosa, H. sulawesii,
Thalassia hemprichii, Syringodium isoetifolium dan Thalassodendron ciliatum. Lamun jenis Thalassia sp. merupakan jenis yang jumlahnya bisa berlimpah dan memiliki penyebaran yang luas. Hal demikian juga terjadi di Indonesia.
binatang kecil sebagai dasar dari rantai makanan yang akan dikonsumsi oleh anakan ikan dan udang (Dawes 1981).
Tumbuhan lamun di perairan biasanya cepat terkoloni oleh mikroorganisme seperti bakteri dan mikroalga. Selanjutnya akan terjadi penempelan makroalga dan avertebrata namun hal ini tidak akan terjadi jika makrofita tersebut memiliki mekanisme pertahanan diri secara kimia dan fisika (Larkum 1989). Menurut Larkum (1989) jangka waktu hidup bagian-bagian yang berbeda dari lamun juga akan berakibat pada diversitas dan biomas dari epifit. Jangka waktu hidup daun tumbuhan lamun berkisar antara 1 sampai 4 bulan. Kecepatan pertumbuhan daun lamun juga akan berbeda pada habitat dan variasi musim yang berbeda dan terjadi perubahan kecepatan pertumbuhan. Distribusi epifit pada daun lamun dipengaruhi oleh:
1. Umur relatif dari bagian yang berbeda pada setiap permukaan daun
2. Urutan bagian pada perkembangan daun yang berbeda dalam setiap tanaman 3. Arah permukaan daun dan lingkungan sekelilingnya.
4. Jenis epifit pada tumbuhan lamun yang merupakan simbiosis.
diproduksi dapat dibuat dalam skala yang besar. Keuntungan lain yang dapat diperoleh yaitu menjaga kelestarian tumbuhan tersebut agar tidak dieksploitasi secara terus menerus yang akhirnya dapat mengakibatkan kepunahan.
Simbiosis diartikan sebagai hidup bersama atau terjadinya hubungan yang permanen diantara dua organisme yang berbeda. Keeratan hubungan ini dapat dibedakan sebagai ektosimbion atau episimbion dimana kolonisasi mikroorganisme terjadi pada permukaan luar dan endosimbion adalah kolonisasi mikroorganisme yang terjadi di dalam sel inangnya. Endosimbion seringkali memperlihatkan adaptasi yang spesifik dalam kehidupan intraseluler inangnya. Seringkali mikroorganisme yang terlibat simbiosis dapat hidup tanpa inang, tetapi pada situasi yang lain mereka dapat kehilangan kemampuannya untuk hidup terpisah dari inangnya. Interaksi diantara mikroorganisme yang tipenya berbeda dan diantara mikroorganisme dengan organisme hidup yang lebih tinggi tingkatannya seperti binatang dan tumbuhan merupakan hal penting yang mendasar dalam ekologi di lingkungan lautan (Munn 2004). Beberapa penelitian menunjukkan besarnya potensi bakteri endofit banyak dilakukan pada tumbuhan darat seperti pada tanaman Sambung nyawa Gynura procumbens sebagai antimikroba (Simarmata 2007), tumbuhan obat Taxus brevifolia menghasilkan antikanker (Prihatiningtias 2006), tanaman Jati belanda Guazumae folium
menghasilkan pelangsing (Syarmalina dan Hanafi 2006).
aslinya atau bahkan dalam jumlah yang lebih tinggi, maka kita tidak perlu menebang/mengambil tanaman aslinya yang kemungkinan besar memerlukan waktu lama untuk dapat dipanen (Strobel et al. 2003, diacu dalam Radji 2005).
Sumber-sumber Antifoulant Alami
Tumbuhan laut mempunyai pergerakan terbatas dibandingkan vertebrata laut oleh karena itu tumbuhan laut mampu mengembangkan sistem pertahanan diri dengan memproduksi senyawa kimia (chemical defense). Senyawa kimia yang dihasilkan berguna untuk mencegah dan mempertahankan diri dari serangan predator, media kompetisi, mencegah infeksi bakteri, membantu proses reproduksi dan mencegah sengatan sinar ultra violet (Kubanek et al. 2003; Harper et al. 2001, diacu dalam Murniasih 2005). Selain itu senyawa kimia tersebut juga merupakan respon terhadap kompetisi dengan lingkungannya. Fungsi lain dari metabolit sekunder adalah: (1) sebagai media interaksi dengan organisme lain, seperti hubungan antara predator maupun kompetitor, komensalisme dan mutualisme. (2) mencegah terjadinya infeksi dari mikroorganisme (antifouling), dan (3) sebagai media dalam proses reproduksi, seperti feromon.
Menurut Shafer et al. (2007) tumbuhan laut dan avertebrata merupakan sumber yang kaya akan bahan aktif biologi berupa metabolit sekunder, beberapa diantaranya memberikan kepentingan fungsi ekologis seperti pertahanan kimia yang potensial untuk melawan predator. Metabolit tersebut juga memberikan pertahanan kimia sebagai antimikroba untuk mencegah terjadinya infeksi dan
laku (behavioral misalnya cryptic, nocturnal), fisik (sclerites, pengerasan permukaan tubuh) dan substansi kimia “chemical defense”.
Metabolit sekunder banyak dihasilkan oleh organisme laut sesil seperti rumput laut, lamun, karang dan lainnya dan merupakan sebuah perspektif baru dalam mencegah pertumbuhan yang pesat dari epibiont (fouling) dan dapat berpotensi digunakan sebagai antifoulant (Pereira 2003). Metabolit sekunder dari organisme laut yang dapat berperan sebagai antifouling juga dapat diisolasi dari beberapa organisme laut lain termasuk bakteri, sponge, ascidian, bryozoa dan gorgonia (Davis et al. 1989; Clare 1996, diacu dalamPereira 2003).
Seringkali terjadi kondisi dimana beberapa organisme laut tidak terlapisi oleh biofilm yang kompleks pada permukaan tubuhnya. Menurut Armstrong et al. (2000) tumbuhan laut dan avertebrata laut memiliki bakteri pada permukaan tubuhnya yang menghasilkan komponen untuk menghambat penempelan organisme. Suatu peran perlindungan oleh beberapa strain bakteri epibiotik hadir pada permukaan tubuhnya dengan mengeluarkan bahan kimia yang menghambat
biofouling oleh organisme lain (Armstrong et al. 2000). Produksi komponen
bioaktif oleh bakteri dan inangnya dilakukan secara bekerjasama untuk
melindungi permukaan inangnya. Dengan kata lain dapat dikatakan bahwa terjadi simbiosis antara bakteri dan inangnya. Kerjasama atau simbiosis ini sering dilakukan untuk menghasilkan bahan bioaktif. Bertambahnya bukti keterlibatan mikroba simbion sebagai sumber yang bisa diandalkan dari komponen turunan beberapa organisme laut, menjadikan mikroba laut simbion sebagai hal penting di bidang biologi laut dan produk alami laut karena potensinya tersebut merupakan alternative menyelesaikan masalah suplai produk alami dari laut tanpa melakukan pemanenan biomas inang secara berlebihan (Li 2009). Simbiosis organisme laut dengan bakteri dapat menghasilkan bahan aktif hasil metabolit sekunder yang memiliki peran penting bagi inangnya (Kelecom 2002). Peran penting metabolit sekunder yang dihasilkan oleh bakteri simbion epifit adalah memberikan perlindungan lingkungan permukaan organisme inangnya dengan menghambat perlekatan bakteri laut yang merugikan dan larva organisme lain yang biasanya menempati permukaan eukariotik seperti organisme bercangkang, alga dan
memperlihatkan bahwa makroalga dan bakteri dapat menghasilkan metabolit sekunder yang berfungsi untuk melindungi makroalga dari biofouling yang merugikan. Simbiosis mutualisme yang banyak terjadi pada organisme laut telah banyak diteliti dimana hasil simbiosis tersebut dapat berupa metabolit sekunder yang merupakan bahan bioaktif yang digunakan sebagai pertahanan terhadap pathogen dan organisme fouling (Pereira et al. 2003; Lane and Kubanek 2008; Steinberg 2004; Murniasih 2005 dan Rao 2006). Menurut Kelecom (2002) terdapatnya kandungan alkaloid pada sponge genus Reniera merupakan hasil dari simbiosis dengan mikroorganisme yang berfungsi sebagai antibakteri. Beberapa tumbuhan laut juga telah diteliti menghasilkan komponen antifouling seperti pada lamun Zostera sp. (zosteric acid) yang terbukti merupakan antifouling yang tidak beracun terhadap orgnisme nontarget (Qian 2010).
Tumbuhan memproduksi senyawa metabolit sekunder lebih banyak dibandingkan binatang (Wibowo et al. 2003). Untuk mengambil senyawa bioaktif
secara langsung dari tanamannya dibutuhkan sangat banyak biomassa atau bagian dari tanamannya. Untuk mengefisienkan cara memperoleh senyawa bioaktif
tersebut maka pemanfaatan mikroba simbion seperti mikroba epifit dan endofit perlu dikembangkan. Mikroba epifit adalah mikroba yang hidup pada permukaan tubuh inang dan mikroba endofit adalah mikroba yang spesifik yang diperoleh dari bagian dalam tanaman. Mikroba yang bersimbiosis tersebut diharapkan mampu menghasilkan sejumlah senyawa bioaktif yang dibutuhkan tanpa harus mengekstrak tanamannya inang (Simarmata et al. 2007).
Penemuan antifoulant dari metabolit sekunder organisme laut dapat merupakan penemuan baru sebagai sebuah alternatif teknologi non-toksik untuk mengontrol biofouling lautan. Berbagai macam substansi telah diidentifikasi (dan dipatenkan) sebagai antifoulant, walaupun sebagian besar hanya dilakukan uji coba di laboratorium dengan menggunakan larva organisme fouling seperti
alami metabolit sekunder yang ditemukan berasal dari organisme sumbernya (Pereira et al. 2003).
Salah satu bahan yang paling umum digunakan sebagai antifoulant alami adalah bahan organik irgarol 1051 ( 2-methylthio-4-tert-butylamino-6-isopropylamino-s-triazine). Irgarol termasuk herbisida s-triazine, bahan ini mempunyai struktur yang sama dengan herbisida atrazine yang digunakan dalam pertanian (Maxey 2006). Hasil penelitian Maxey (2006) menunjukkan bahwa irgarol merupakan pencemar yang umum di lautan. Meskipun demikian irgarol
tidak berpengaruh terhadap organisme laut. Akumulasi irgarol pada organisme laut tidak pernah ditemukan. Pada tumbuhan lamun, irgarol mengalami
bioakumulasi walaupun akumulasi yang terjadi bervariasi. Konsentrasi irgarol
pada jaringan lamun sepanjang tahun konsisten. Irgarol dimiliki oleh vegetasi yang terendam air laut sebagai pencegah pertumbuhan epifit atau bisa dikatakan sebagai antifouling (Maxey 2006).
Jensen et al. (1989) dalam penelitiannya menemukan bahwa tumbuhan lamun Thalassia testudinum menghasilkan bahan antibiotik flavone glycoside
yang berfungsi sebagai bahan pertahanan melawan mikroorganisme fouling yaitu bahan kimia pertahanan yang menghambat mikroorganisme fouling. Pada jaringan daun T. testudinum yang masih sehat dimana mengandung bahan aktif flavone glycoside mengindikasikan bahwa organisme yang menempel tidak selengkap pada jaringan daun T. testudinum yang sudah mati. Penelitiannya di laboratorium mengindikasikan bahwa substrat yang berisi ekstrak jaringan daun T. testudinum
yang sehat menghambat pertumbuhan Schizochytrium aggregatum dan menghalangi penempelan zoospora motil S. aggregatum. Bahan kimia flavone glycoside merupakan antibiotik baru untuk pertahanan Lamun Thalassia testudinum dalam melawan zoospora fungi. Pada penelitiannya memperlihatkan bahwa terjadi penurunan jumlah zoospora fungi pada T. testudinum yang mati yaitu yang telah diautoklaf dan dikembalikan pada tempat koleksi selama 48 jam dibandingkan pada T. testudinum yang sehat. Penelitian tersebut menemukan hipotesis bahwa metabolit sekunder dari lamun ini dihasilkan dari asosiasi dengan populasi mikroba. Pertahanan kimia oleh antimikroba berfungsi menurunkan
perlu dilengkapi penelitian mulai dari besarnya konsentrasi metabolit sekunder yang dihasilkan oleh T. testudinum sebagai antimikroba hingga isolasi bakteri dan mengetahui karakter dari struktur flavone glycoside tersebut.
Mayavu (2009) telah meneliti ekstrak lamun jenis Cymodosea serrulata dan
Syringodium isoetifolium dapat berfungsi sebagai antifouling. Geiger (2003) meneliti ekstrak lamun jenis Zostera marina ternyata menghasilkan antifouling zosteric acid. Newby (2006) dan Qi (2008) hasil penelitiannya memperlihatkan adanya kemampuan antifouling dari ekstrak Enhalus acoroides. Ravikumar et al.
(2009) memperlihatkan hasil penelitiannya bahwa telah dapat diisolasi sebanyak 32 strain isolat bakteri endofit dan epifit dari tumbuhan lamun Syringodium isoetifolium dan Cymodocea serrulata. Salah satu strain bakteri yang diisolasi dari bakteri endofit Syringodium isoetifolium memiliki kemampuan paling besar mampu menghambat lima jenis bakteri pathogen yang diuji dengan penghambatan maksimum perhadap bakteri pathogen Pseudomonas aeruginosa.
Penelitian mengenai antifoulant pada karang gorgonia memperlihatkan bahwa karang tersebut adalah salah satu binatang penghasil komponen
antifouling. Ekstrak dari binatang maupun tumbuhan laut penghasil antifouling
dapat dicampur dalam cat atau pelapis antifouling yang lebih lengkap sebagai proteksi antifouling alami. Antifoulant produk alami tersebut ditemukan oleh ahli biologi yang meneliti spesies secara bersamaan karang dan tumbuhan laut yang tidak pernah terkoloni oleh bakteri, jamur dan organisme yang lebih tinggi. Pada ekosistem laut terjadinya kolonisasi pada permukaan tubuh organisme signifikan dengan faktor pembatas perkembangan beberapa bentuk kehidupan. Oleh karena itu ketidakhadiran koloni organisme laut pada spesies karang dan tumbuhan laut merupakan hal yang mengejutkan. Penelitian lebih jauh terhadap karang gorgonia dan lamun Zostera marina ternyata menghasilkan komponen organik komplek, dimana pada saat ekstraksi dan aplikasi pengecatan dapat mencegah kolonisasi organisme fouling (Mittelman 1999).
Pada akhir tahun 1980, Staffan Kjelleberg dan Pete Steinberg menemukan bahwa alga merah menghasilkan molekul yang dinamakan furanon. Furanon
namun pada panel yang berisi furanon tidak terjadi kolonisasi. Pada kenyataannya
furanon dapat menghambat pembentukan biofilm dari ratusan spesies bakteri (Costerton 1999).
Egan et al. (2001) dalam penelitiannya memperlihatkan bahwa bakteri laut
Pseudomonas tunicata mampu menghambat organisme fouling seperti larva avertebrata laut, alga, bakteri dan jamur sedangkan ekstrak bakteri Bacillus sp. dan Virgibacillus sp. yang diisolasi dari sponge Pseudoceratina purpurea mampu menghambat bakteri Vibrio algoniticus dan V. fishery yang yang menyebabkan
biofouling. Hasil penelitian Sabdono et al. (2005) memperlihatkan bahwa 371 isolat bakteri telah terisolasi dari karang lunak Sarcophyton sp. dan Sinularia sp. di perairan Ujung Kulon dan Karimunjawa. Hasil uji antibakteri skala laboratorium memperlihatkan bahwa 10 isolat (2,39 %) bakteri tersebut berpotensi menghasilkan senyawa antifoulant alami. Austin (1988) menemukan antibiotik dari hasil metabolisme sekunder bakteri yang pertama kali adalah senyawa pirol
(pyrrole) yang mengandung unsur Br. Bakteri ini melekat pada lamun (Thalassia testudinum) yang ditemukan di laut Karibia.
Bakteri Vibrio sp. bersimbiosis dengan hewan laut porifera jenis Dysilea sp. ditemukan di samudera Hindia. Bakteri ini menghasilkan bahan bioaktif bis(dibromofenil)eter yang khas ditemukan pada Dysilea sp. Hal ini juga membuktikan bahwa bakteri berperan menghasilkan metabolit sekunder pada simbiosis ini (Sidharta 2000).
Biofouling
Semua permukaan di lingkungan laut dipengaruhi oleh faktor-faktor biologi, fisika dan kimia yang menghasilkan bentuk suatu lapisan kompleks dari perlekatan mikroorganisme (microfouling) dan makroorganisme (macrofouling) yang dikenal sebagai biofouling. Komposisi spesies organisme yang ada pada kolom air merupakan faktor biologi yang sangat penting terhadap terjadinya
biofouling. Bakteri merupakan bagian penting dimana mereka membentuk
pengkoloni yang pertama pada permukaan yang bersih dan mengubah sifat fisika-kimia permukaan. Sifat-sifat fisik dapat mempengaruhi perkembangan biofouling
permukaan serta peningkatan panas, gas dan nutrient. Sifat-sifat kimia yang berpengaruh termasuk hadirnya bermacam-macam molekul pada permukaan, kandungan kalsium, magnesium atau ion yang ada dalam air, ketersediaan nutrient yang spesifik dan sinyal kimia organisme di sekitarnya (Egan et al. 2001).
Menurut Zaitsev (1970; 1997), diacu dalam Railkin (2004) penyebab proses
biofouling awalnya diperankan oleh adanya akumulasi nutrien pada permukaan karena hal tersebut memicu tersedianya sumber makanan sehingga menarik mikroorganisme untuk menempel. Akumulasi dan reproduksi mikroorganisme pada permukaan tersebut merupakan sumber nutrisi bagi perkembangan organisme jenjang trofik yang lebih tinggi dan selanjutnya dapat menarik organisme multiseluler. Wahl (1989: 1997), diacu dalam Railkin (2004) menggolongkan proses kolonisasi pada permukaan keras yang meliputi: 1) pengkondisian secara biokimia (adsorpsi makromolekul dan ion-ion); 2) pengkolonian bakteri; 3) kolonisasi eukariotik uniseluler; dan 4) kolonisasi eukariotik multiseluler.
Komunitas macrofouling yang terdiri dari ’soft fouling’ dan ’hard fouling’, tumbuh dan berkembang dari komunitas microfouling. Soft fouling beranggotakan alga dan avertebrata seperti karang lunak, spong, anemon, tunikata, cacing tabung dan hidroida. Organisme spesifik yang berkembang dalam komunitas fouling
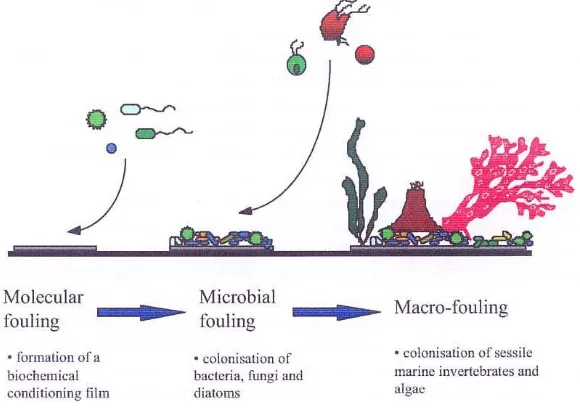
tergantung pada substrat, lokasi geografis, musim dan faktor-faktor seperti kompetisi dan predasi. Komunitas fouling memiliki proses dinamika yang tinggi (Callow and Callow 2002). Microfouling dan macrofouling merupakan proses yang overlapping yang dapat digambarkan sebagai berikut: bakteri muncul setelah kira-kira 1–2 jam, diatom setelah 24 jam, spora makroalga dan protozoa setelah satu minggu dan larva makrofouler setelah dua hingga tiga minggu (Von Oertzen
et al. 1989, diacu dalam Abarzua dan Jakubowski 1995). Rangkaian peristiwa
microfouling dan macrofouling dimulai dari pembentukan lapisan film secara biokimia dan dilanjutkan dengan terjadinya kolonisasi mikroba (bakteri, jamur dan diatom). Kolonisasi tersebut akan mengundang terjadinya kolonisasi organisme macrofouling seperti avertebrata dan alga (Gambar 3).
Gambar 3 Rangkaian peristiwa microfouling dan macrofouling (Egan 2001).
interaksi antara penempel dan substrat. Mikrostruktur yang padat mempengaruhi kemampuan mekanik dan kekuatan penempelan (Callow and Callow 2002).
Analisa proses yang mendasar dari biofouling merupakan hal yang penting untuk mengetahui mekanisme kolonisasi oleh fouler (organisme penempel) pada permukaan keras alami dan struktur buatan manusia. Kolonisasi merupakan bagian dari akumulasi dan pertumbuhan. Akumulasi adalah pengertian timbulnya
fouling pada suatu permukaan keras sebagai hasil dari transport oleh arus, pengkolonian dan pelekatan. Transport fouler ke substrat dilakukan oleh arus dan kolonisasi dianggap sebagai imigrasi. Walaupun faktanya mekanisme kolonisasi pada permukaan keras yang dilakukan oleh mikroorganisme, spora makroalga dan larva binatang berbeda, namun fenomena proses tersebut mirip. Kesamaan peristiwa proses kolonisasi dari mikroorganisme dan makroorganisme menurut Railkin (2004) adalah :
1. Kesamaan bentuk hidup dimana terdapat satu organisme sesil yang dominan. 2. Pada suatu lingkungan yang umum, dicirikan oleh kondisi dari transport oleh
arus, pengkolonian, perlekatan, nutrisi dan pertumbuhan. 3. Kehadiran suatu permukaan keras sebagai suatu substrat. 4. Keterbatasan area permukaan suatu substrat keras
Menurut Bhaduri dan Wright (2004) proses biofouling secara lebih rinci memiliki 4 tahapan yaitu :
1. Fouling diawali oleh proses substrat terendam air. Permukaan substrat secara cepat mengalami akumulasi materi organik terlarut dan molekul seperti polisakarida dan fragmen protein. Fase ini dinamakan fase conditioning.
2. Secara berangsur-angsur bakteri dan diatom bersel tunggal akan menempel pada permukaan dan mulai menetap disana, membentuk lapisan (biofilm) mikroba. Kemampuan sel bakteri melakukan penempelan pada permulaan ini dikontrol oleh dua faktor yaitu faktor lingkungan seperti kandungan nutrien, sensor lingkungan, daya lekat dan faktor genetik.
Kehadiran substansi pelekat dan koloni mikroba yang kasar dan bentuknya tidak teratur, berangsur-angsur mulai menangkap banyak partikel dan organisme lain. Setelah menempel pada permukaan sel bakteri akan melekatkan diri pada permukaan dengan substansi EPS yang mengandung biopolimer tinggi seperti polisakarida, protein dan asam nukleat (Flemming 2009).
4. Tahap terakhir adalah penempelan organisme laut lain seperti barnacle, tunikata, kerang-kerangan, bryozoa, polikaeta dan cacing tabung, bersama-sama dengan pertumbuhan alga. Penempelan organisme ini diawali oleh pertumbuhan biofilm yang menjadi dasar bagi pertumbuhan alga, barnacle dan organisme lain. Dilain pihak mikroorganisme seperti bakteri, diatom, dan mikroalga membentuk lapisan primer berlendir bagi penempelan makroorganisme seperti moluska, sponge, anemon laut, cacing bertabung, polikaeta dan barnacle (Stanczak 2004).
air pada pembangkit dapat menurunkan efisiensi kondenser karena dapat menurunkan keseluruhan daya pembangkit untuk kepentingan masyarakat. Hal ini dapat menyebabkan stasiun pembangkit secara temporer menutup pembangkit tenaga disebabkan karena terjadi biofouling (Meesters et al. 2003, diacu dalam Maxey 2006).
Biofouling secara komersial dapat menyebabkan dampak besar bagi
konsumer, tetapi ahli lingkungan mengatakan bahwa biofouling memiliki beberapa kerugian yang lain juga (Maxey 2006). Penelitian yang dilakukan oleh Sudaryanto et al. (2001) dan Harder (2004) membuktikan terjadinya akumulasi bahan TBT pada sedimen perairan di Indonesia dan menyebabkan terjadinya
imposex pada gastropoda laut betina karena dapat menyebabkan penyumbatan pada saluran pengeluaran telur. Kelainan seksual pada spesies gastropoda yang terekspos TBT tergambar secara luas pada awal tahun 1990 (Soedharma dan Fauzan 1996; Adelman 1990 and Stewart 1996, diacu dalam Maxey 2006). Kandungan TBT juga diperlihatkan oleh adanya akumulasi pada ikan.
bahan aktifnya. Hal ini menyebabkan kandungan campuran pada di lingkungan menjadi sangat tinggi. Akibat kecepatan peluruhan yang tinggi menyebabkan kapal harus didaratkan lebih sering untuk dilakukan pengecatan kembali dan perbaikan. Hal tersebut menyebabkan penurunan efisiensi dan tingginya biaya bagi industri perkapalan. Hal tersebut tidak berlangsung lama setelah penggunaan TBT di seluruh dunia memperlihatkan dampak negatif terhadap lingkungan.
Indonesia bersama 74 negara anggota Organisasi Maritim Internasional (IMO) lainnya, menandatangani Konvensi Internasional Pengawasan Sistem Anti Pencemaran Bahan-bahan Berbahaya pada kapal di Inggris, yang melarang penggunaan jenis cat berbahaya untuk badan kapal. Dengan adanya kesepakatan tersebut, maka penggunaan cat kapal lama yang dianggap mengandung TBT tersebut dilarang. Menurut penelitian, cat yang digunakan untuk pengecatan badan kapal oleh hampir semua kapal di seluruh dunia termasuk Indonesia, selama ini ternyata mengandung bahan kimia TBT yang berbahaya dan dapat membunuh biota laut (Ine dan Ant 2001).
Strategi penanggulangan biofouling menggunakan antifouling yang ramah lingkungan difokuskan pada pengkarakterisasian dan pengembangan produk berdasarkan pada pertahanan kimia pada organisme laut sesil yang dapat mengkondisikan permukaan tubuhnya bebas dari organisme fouling. Beberapa
Waktu dan Tempat Penelitian
Penelitian dilakukan mulai bulan Desember 2008 sampai bulan Maret 2010. Pengambilan contoh daun tumbuhan lamun jenis Enhalus acoroides, Thalassia hemprichii dan Syringodium isoetifolium yang diisolasi bakteri epifit dan endofit serta penjebakan biofilm primer pada substrat kayu dan fiber dilakukan di ekosistem padang lamun perairan pantai Teluk Awur, Jepara Jawa Tengah (Gambar 4).
Isolasi bakteri, uji hambat dan uji aplikasi secara laboratorium dilakukan di Laboratorium Kelautan, Jurusan Kelautan, Universitas Diponegoro, Semarang. Identifikasi bakteri pembentuk biofilm yang berespon terhadap bakteri simbion tumbuhan lamun pada uji hambat serta bakteri simbion epifit dan endofit pada tumbuhan lamun dilakukan di laboratorium Bioteknologi Fakultas Pertanian Universitas Gadjah Mada dan Universitas Islam Negeri Yogjakarta.
Prosedur Penelitian
Isolasi Bakteri Epifit
Daun dari jenis lamun Enhalus acoroides, Thalassia hemprichii dan Syringodium isoetifolium (identitifikasi menurut Larkum 1989) yang terbebas dari makroepifit yaitu yang tidak dijumpai adanya makroorganisme yang menempel diambil sebanyak kurang lebih 5 cm. Sampel kemudian dimasukkan dalam kantong plastik dan ditempatkan dalam kontainer pendingin untuk selanjutnya dibawa ke laboratorium. Sampel selanjutnya disemprot dengan air laut steril (air laut yang disterilisasi) sebanyak tiga kali untuk mendapatkan biofilm permanen kemudian dilakukan pengerokan dengan alat pengerok steril. Hasil kerokan dimasukkan ke dalam 90 ml air laut steril (Gambar 5) dan diencerkan hingga diperoleh pengenceran 10-1, 10-2, dan 10-3
. Dari masing-masing tingkat pengenceran diambil 100 µl dengan pipet, dimasukkan ke dalam media ZoBell 2216E (Lampiran 2) yang telah disiapkan di dalam cawan petri. Selanjutnya diratakan dengan menggunakan spreader dan diinkubasikan selama 2 x 24 jam pada suhu kamar. Pemurnian isolat bakteri dilakukan dengan metode goresan (streak method) hingga diperoleh kultur murni.
Gambar 5 Cara melakukan isolasi bakteri epifit dari daun lamun.
Isolasi Bakteri Endofit
daun lamun kemudian diinkubasi dalam inkubator pada suhu kamar selama 2-4 hari. Mikroba yang tumbuh secara bertahap dimurnikan satu persatu.
Gambar 6 Cara melakukan isolasi bakteri endofit dari daun lamun.
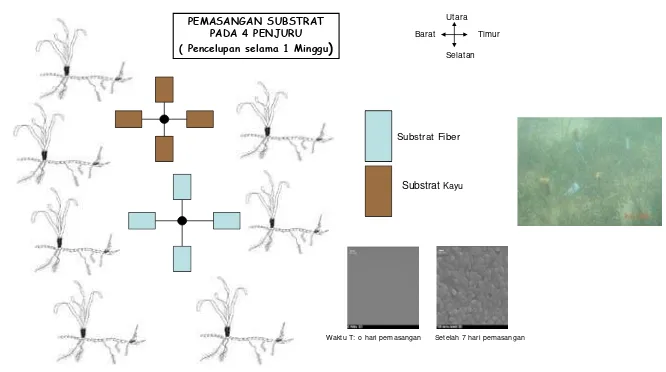
Isolasi Bakteri Pembentuk Biofilm
Biofilm bakteri disiapkan dalam rangka memperoleh isolat bakteri
pembentuk biofilm bakteri. Beberapa jenis substrat penempel steril (kayu dan fiber) disiapkan, kemudian diikatkan pada penyangga dengan menggunakan tali yang dipasang sedemikian rupa sehingga dapat mewakili 4 penjuru mata angin (Gambar 7). Selanjutnya dipasang di daerah lamun yang akan diisolasi bakterinya. Substrat diletakkan pada kedalaman 1 meter di bawah permukaan laut pada surut paling rendah selama 1 minggu. Substrat tersebut selanjutnya diambil dan dimasukkan ke dalam kotak pendingin dan dibawa ke laboratorium untuk proses isolasi. Substrat selanjutnya dicuci dengan air laut steril dengan cara disemprotkan sebanyak tiga kali untuk memastikan bahwa bakteri yang terisolasi adalah bakteri pembentuk biofilm yang sudah permanen. Isolasi bakteri dilakukan dengan metode pour plate (lempeng tuang) menurut Brock dan Madigan (1991). Substrat tersebut selanjutnya dimasukkan ke dalam cawan petri steril yang sebagian berisi air laut steril, kemudian dilakukan pengerokan (scrapping) terhadap permukaan substrat dengan alat pengerok steril secara aseptik. Sampel selanjutnya dimasukkan ke dalam 90 ml air laut steril dan diencerkan hingga diperoleh pengenceran 10-1, 10-2, dan 10-3. Dari masing-masing tingkat pengeceran diambil 100 µl dengan pipet ke dalam media ZoBell 2216 E (Lampiran 1) yang telah disiapkan di dalam cawan petri. Selanjutnya diratakan dengan menggunakan
Setelah 7 hari pemasangan
PEMASANGAN SUBSTRAT PADA 4 PENJURU ( Pencelupan selama 1 Minggu)
Waktu T: o hari pemasangan
Substrat Fiber
Utara
Selatan Timur Barat
SubstratKayu
Gambar 7 Pemasangan substrat kayu dan fiber pada posisi empat penjuru mata angin untuk penjebakan bakteri pembentuk biofilm.
Uji Penghambatan Bakteri Simbion Lamun (epifit dan endofit) terhadap pertumbuhan Bakteri Biofilm
Metode difusi agar dilakukan berdasarkan Radjasa et al. (2004) dengan menyiapkan cawan petri steril berisi 20 ml media Zobell 2216E. Sebanyak 75 μl kultur bakteri biofilm dalam media Zobell 2216E cair (Lampiran1) yang telah diinkubasi selama 1 hari diinokulasikan pada cawan petri tersebut dengan metode
spread sampai merata dan didiamkan sekitar tiga menit supaya bakteri biofilm
Uji Penghambatan Ekstrak Bakteri Simbion Lamun (epifit dan endofit) terhadap Pertumbuhan Bakteri Biofilm
Metode yang digunakan dalam adalah metode difusi agar yang dilakukan berdasarkan Radjasa et al. (2004) dengan menyiapkan cawan petri steril berisi 20 ml media Zobell 2216E. Kemudian sebanyak 75 μl kultur bakteri biofilm dalam media Zobell 2216E cair yang telah diinkubasi selama 1 hari diinokulasikan pada cawan petri tersebut dengan metode spread sampai merata dan didiamkan sekitar tiga menit supaya bakteri biofilm meresap pada media. Selanjutnya beberapa
paper disk diletakkan secara aseptis pada permukaan agar lalu ditetesi 25 µl ekstrak isolat bakteri (Lampiran 3) yang akan diuji yaitu bakteri epifit atau endofit simbion tumbuhan lamun E. acoroides, T. hemprichii, dan S. isoetifolium yang telah dikultur pada media Zobell 2216E cair dan telah dilakukan pengukuran kepadatan bakteri dengan spektrofotometer pada panjang gelombang (λ) maksimal 500. Media tersebut selanjutnya diinkubasikan pada suhu kamar selama 2 x 24 jam. Pengamatan dilakukan dengan melihat ada tidaknya zona hambatan pertumbuhan bakteri di sekeliling cawan petri. Zona hambat yang terbentuk diukur dengan menggunakan jangka sorong dengan ketelitian 0.05 mm.
Uji Aplikasi Lapang Penghambatan Ekstrak Bakteri Simbion Lamun terhadap Penempelan Macrofouling
Uji lapang dilakukan dengan cara mencampur cat yang tidak mengandung
antifoulant sintetis dengan ekstrak bakteri untuk mengetahui kemampuan senyawa aktif dalam melindungi struktur dari penempelan organisme fouling (Burgess et al. 2003). Disiapkan substrat berupa balok kayu berukuran 3 x 6 cm2 dan dibuat lubang kecil untuk memasukkan tali pengikat.Beberapa larutan campuran ekstrak bakteri simbion lamun dan cat kayu tanpa antifoulantdibuat dengan perbandingan 25 : 75 dan 50 : 50. Satu balok kayu dicat dengan campuran cat tanpa antifoulant
permukaan air laut pada surut terendah.Balok kayu yang digunakan untuk setiap perlakuan sebanyak 3 buah untuk pengulangan. Rancangan penelitian yang digunakan adalah Rancangan Acak Kelompok (RAK) dengan perlakuan ekstrak isolat bakteri simbion lamun (epifit dan endofit), dan terdapat perlakuan kontrol atau pembanding yaitu kayu yang hanya dicat dengan cat tanpa antifoulant. Pengamatan dilakukan sekali dalam seminggu. Identifikasi dan penghitungan organisme penempel dilakukan setelah terdapat organisme penempel pada perlakuan kontrol.
Gambar 8 Substrat kayu yang dicat dengan campuran cat tanpa antifoulant dan ekstrak bakteri simbion lamun untuk aplikasi lapang
Identifikasi Bakteri
Ekstraksi DNA Bakteri
Diambil isolat murni bakteri secukupnya dan selanjutnya isolat tersebut dimasukkan tabung ependorf 1,5 ml diisi 100 ul akuades. Selanjutnya direbus dalam panci berisi air mendidih 10 – 20 menit dan setelah itu tabung dimasukkan dalam es 5 – 10 menit. Sentrifuse dilakukan pada 12.000 rpm selama 10 menit dan supernatan yang terjadi diambil dan dimasukkan tabung ependorf baru. Selanjutnya disimpan pada 4oC sebelum digunakan.
Amplifikasi DNA
Amplifikasi DNA dengan PCR dilakukan dengan DNA thermal cycler dengan perlakuan suhu sebagai berikut :
Denaturasi awal dilakukan pada 94°C selama 5 menit dan selanjutnya dilakukan annealing (94°C selama 30 detik), ekstensi (54°C selama 45 detik), dan denaturasi (72°C selama 1 menit), sebanyak 35 siklus. Kemudian ekstra annealing selama 1 menit, dan ekstra ekstensi akhir pada 72°C selama 5 menit.
Visualisasi produk PCR dilakukan melalui elektroforesis dengan tahapan sebagai berikut:
Produk PCR sebanyak 50 μl dimasukkan ke dalam sumur gel agarose 0,6% yang diletakkan pada bufer TEB (Tris-acetat-EDTA Buffer) 1 X, dilakukan running selama 45 menit. Gel kemudian direndam dalam ethidium bromide
selama 5 menit untuk mewarnai pita DNA yang terperangkap pada gel. Hasil amplifikasi 16S rDNA yang memiliki panjang sekitar 1460 bp dapat dilihat dengan meletakkan gel di atas UV transluminator (Long dan Azam, 2001, diacu dalam Radjasa et al. 2007). Analisis sekuen DNA isolat bakteri terbaik kemudian dibandingkan dengan sekuen DNA pada basis data (database) DNA. Penelusuran homologi dilakukan dengan menggunakan internet melalui program pelacakan database Basic Local Alignment Search Tool (BLAST) pada National Center for Biotechnology Information, National Institute for Health, USA (www.ncbi.nlm.nih.gov) (Altschul et al. 1997, diacu dalam Radjasa et al. 2007).
Analisis Pohon Filogenetik
Uji Penempelan Macrofouling pada Jenis Substrat Kayu dan Fiber
Disiapkan substrat balok kayu dan fiber (Gambar 9) yang memiliki permukaan kasar dan halus. Pada percobaan ini juga digunakan substrat kayu yang dicat dengan cat berwarna terang (putih) dan berwarna gelap (coklat) berukuran 4 x 8 cm2 dan dibuat lubang kecil pada salah satu ujungnya untuk memasukkan tali pengikat. Substrat kayu dan fiber yang telah diikat dengan tali plastik tersebut kemudian ditempatkan 50 cm dibawah permukaan laut pada surut terendah. Hal ini untuk lebih memastikan bahwa substrat akan selalu terendam air laut. Selanjutnya dilakukan pengamatan terhadap organisme penempel dua kali dalam seminggu hingga diperoleh organisme penempel yang dominan pada setiap substrat percobaan. Masing-masing jenis substrat dilakukan pengulangan sebanyak tiga kali. Pada akhir pengamatan dihitung jumlah makroorganisme penempel yang ada pada setiap substrat perlakuan.
Gambar 9 Balok kayu dan fiber yang digunakan dalam percobaan
biofouling.
Pengamatan Parameter Fisik-Kimia Perairan
Identifikasi Tumbuhan Lamun
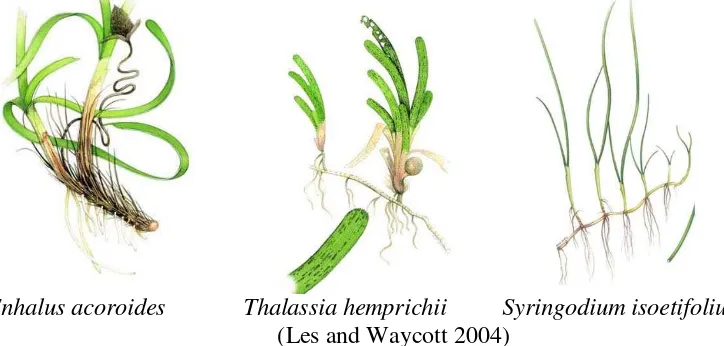
Tiga jenis tumbuhan lamun yang diisolasi bakteri simbionnya adalah jenis
Enhalus acoroides, Thalassia hemprichii dan Syringodium isoetifolium. Ketiga jenis lamun tersebut dapat diklasifikasikan (Les and Waycott 2004) sebagai berikut :
Kingdom : Plantae
Divisio : Magnoliophyta (Angiosperms) Class : Liliopsida
Sub-class : Alismatidae Order : Alismatales
Family : Hydrocharitaceae Genus : Thalassia
Species : Thalassia hemprichii Genus : Enhalus
Species : Enhalus acoroides
Order : Potamogetonales Family : Potamogetonaceae
Genus : Syringodium
Species : Syringodium isoetifolium
Morfologi ketiga jenis tumbuhan lamun dapat dilihat pada Gambar 10.
Enhalus acoroides Thalassia hemprichii Syringodium isoetifolium
(Les and Waycott 2004)
Isolasi Bakteri Simbion lamun (epifit dan endofit)
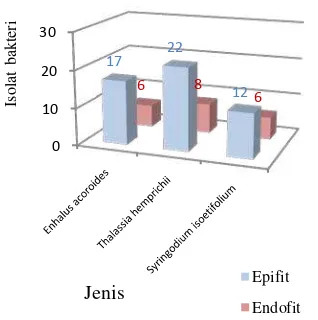
Hasil pengamatan terhadap jumlah isolat bakteri terisolasi dari ketiga jenis lamun yang diuji memperlihatkan bahwa jumlah isolat bakteri simbion epifit lebih banyak dibandingkan bakteri simbion endofit pada semua jenis lamun yang diuji (Gambar 11). Jumlah isolat bakteri simbion paling banyak diantara ketiga jenis lamun tersebut adalah isolat bakteri yang terisolasi dari jenis lamun Thalassia hemprichii (22 epifit dan 8 endofit). Isolat bakteri yang terisolasi dari lamun
Syringodium isoetifolium jumlahnya paling sedikit (12 epifit dan 6 endofit) (Gambar 12).
a. b.
Gambar 11 Hasil isolasi bakteri simbion epifit (a) dan endofit (b).
Gambar 12 Jumlah isolat bakteri simbion epifit dan endofit terisolasi dari 3 jenis lamun
Uji Penghambatan Bakteri Simbion Lamun (epifit dan endofit) terhadap Pertumbuhan Bakteri Biofilm
Zona hambat maksimum bakteri simbion lamun (epifit dan endofit) terhadap pertumbuhan bakteri biofilm pada ketiga jenis lamun yang diuji secara umum memperlihatkan bahwa zona hambat bakteri simbion endofit lebih besar dibandingkan bakteri simbion epifit (Gambar 13). Bakteri simbion epifit pada
jenis lamun Enhalus acoroides merupakan bakteri yang memiliki zona hambat maksimum paling tinggi diantara bakteri epifit pada ketiga jenis lamun sedangkan bakteri simbion endofit Syringodium isoetifolium merupakan bakteri yang memiliki zona hambat maksimum paling tinggi diantara bakteri endofit pada ketiga jenis lamun yang diteliti.
Keterangan : EA, EB, ET : Bakteri simbion epifit Enhalus acoroides
TA, TB, TT : Bakteri simbion epifit Thalassia hemprichii
SA, ST : Bakteri simbion epifit Syringodium isoetifolium
EEJ : Bakteri simbion endofit Enhalus acoroides
ETJ : Bakteri simbion endofit Thalassia hemprichii
ESJ : Bakteri simbion endofit Syringodium isoetifolium
Gambar 13 Besar zona hambat maksimum (mm) uji penghambatan bakteri simbion lamun (epifit dan endofit) terhadap pertumbuhan bakteri biofilm.
Jumlah bakteri biofilm yang dihambat pada uji penghambatan bakteri simbion (epifit dan endofit) terhadap pertumbuhan bakteri biofilm
menghambat bakteri biofilm lebih banyak dibandingkan bakteri epifit (Gambar 14).
Gambar 14 Jumlah bakteri biofilm yang dihambat pada uji penghambatan bakteri simbion lamun (epifit dan endofit) terhadap pertumbuhan bakteri biofilm.
Persentase bakteri simbion lamun (epifit dan endofit) yang aktif dalam uji penghambatan bakteri simbion lamun terhadap pertumbuhan bakteri biofilm
memperlihatkan bahwa bakteri simbion endofit memiliki persentase lebih besar dibandingkan bakteri epifit walaupun jumlah bakteri epifit yang terisolasi lebih banyak (Gambar 15). Pada jenis lamun Enhalus acoroides dan Syringodium
isoetifolium semua bakteri endofit yang terisolasi memiliki kemampuan
Gambar 15 Persentase bakteri simbion lamun (epifit dan endofit) yang aktif pada uji penghambatan terhadap pertumbuhan bakteri biofilm.
Uji Penghambatan Ekstrak Bakteri Simbion Lamun terhadap Pertumbuhan Bakteri Biofilm
Zona hambat maksimum uji penghambatan ekstrak bakteri simbion lamun terhadap pertumbuhan bakteri biofilm memperlihatkan hasil bahwa bakteri epifit simbion pada lamun Enhalus acoroides dan Thalassia hemprichii memiliki kemampuan penghambatan terhadap pertumbuhan bakteri biofilm lebih besar dibandingkan bakteri epifit simbion pada lamun Syringodium isoetifolium. Bakteri simbion endofit pada lamun Syringodium isoetifolium memiliki kemampuan penghambatan paling besar dibandingkan bakteri simbion endofit kedua jenis lamun lainnya (Gambar 16).
0 50 100
Enhalus
acoroides Thalassia
hempprichii Syringodium isoetifolium 47
40
33 100
75
100
Epifit Endofit
P
er
sen
b
ak
te
ri