31
LAMPIRAN
1. Komposisi Media Hestrin Scrahmm (HS) Agar dalam 1 Liter Media
Glukosa = 20 g Yeast extract = 5 g Pepton = 5 g Na2HPO4 = 2,7 g MgSO4.7H2O = 0,5 g Asam sitrat = 1,15 g Agar = 20 g
2. Uji Statistik ANOVA
Tests of Between-Subjects Effects
Dependent Variable: Tebal
Source Type III Sum of
Corrected Total 46,250 47
a. R Squared = ,727 (Adjusted R Squared = ,598)
Multiple Comparisons
Dependent Variable: Rendemen
(I) Sukrosa (J) Sukrosa Mean
Difference
(I-J)
Std. Error Sig. 95% Confidence Interval
Lower
The error term is Mean Square(Error) = 3,926.
33
3. Alur Kerja Penyiapan Starter A. xylinum (Kholifah, 2010)
Air kelapa 2 liter
Starter
Disaring dengan kain sampai bersih
Dimasukkan kedalam beaker glass
Ditambahkan amonium sulfat dan sukrosa
masing-masing 6 g dan 40 g
Ditambahkan asama asetat glasial 6 ml
Dipanaskan hingga mendidih dengan kompor listrik
Dimasukkan ke dalam botol masing-masing 500 ml
Ditutup dan ditunggu hingga dingin
Ditambahkan starter induk A. xylinum sebanyak 20 % dari volume media
Diinkubasi selama 3 hari pada suhu ambient
Dihitung jumlah A. xylinum dan konsorsium bakteri dengan metode TPC
4. Alur Kerja Produksi Selulosa Mikrobial (Kholifah, 2010)
Selulosa Mikrobial
Disimpan selama 3 hari
Disaring dengan kain sampai bersih
Ditambahkan amonium sulfat dan sukrosa sesuai perlakuan
Ditambahkan asama asetat glasial 2 ml
Dipanaskan hingga mendidih dengan kompor listrik Dimasukkan ke dalam toples masing-masing perlakuan sebanyak 270 ml
Ditutup dan ditunggu hingga dingin
35
5. Alur Kerja Pengukuran Rendemen Selulosa Mikrobial (AOAC, 1979)
Hasil
Diangkat selama 30 detik
Ditimbang dengan neraca analitik
Dihitung berdasarkan rumus rendemen Selulosa Mikrobial
6. Alur Kerja Pengukuran Ketebalan Selulosa Mikrobial
Hasil
Diangkat selama 30 detik
Diukur ketebalan dengan alat digital caliper pada dua sisi yang berbeda
37
7. Alur Kerja Pengukuran Kandungan Air (SNI 01-2891-1992)
Hasil
Ditimbang 1 g dan dimasukkan ke dalam botol timbang Ditimbang dengan neraca analitik
Dikeringkan dengan oven pada suhu 105°C selama 3 jam Didinginkan dengan desikator
Ditimbang dengan neraca analitik
Diulangi prosedur yang sama sampai berat konstan
Dihitung dengan rumus kandungan air Kandungan air
8. Alur Pengukuran Daya Tarik Selulosa Mikrobial
Hasil
Dicetak menggunakan dumbbell cutter
39
9. Alur Kerja Perhitungan A. xylinum
Hasil
Diambil sebanyak 1 ml
Dimasukkan ke dalam 9 ml akuades steril Dilakukan pengenceran sampai 10-4 Diambil sebanyak 0,1 ml
Disebar pada media HS dengan hockey stick Diinkubasi selama 48 jam pada suhu ambient Dihitung jumlah koloni
10. Alur Kerja Perhitungan Konsorsium Bakteri
Hasil
Diambil sebanyak 1 ml
Dimasukkan ke dalam 9 ml akuades steril Dilakukan pengenceran sampai 10-4 Diambil sebanyak 0,1 ml
Disebar pada media PCA dengan hockey stick Diinkubasi selama 48 jam pada suhu ambient Dihitung jumlah koloni
41
11. Foto Kerja
Starter A. xylinum Media air kelapa TPC A. xylinum dengan perlakuan
TPC Konsorsium Bakteri Selulosa Mikrobial Selulosa Mikrobial Steril
Pembuatan media Penambahan starter Pengukuran ketebalan
Amnuaikit, T., Chusuit, T., Raknam, R. and Boonme, P. 2011. Effects of a Cellulose Mask Synthesized by a Bacterium on Facial Skin Characteristics and User Satisfaction. Dove Press. 4: 77-81.
Ampe, F., Benomar, N., Moizan, C., Wacher, C. and Guyot, J. 1999. Polyphasic Study of Microorganism in Mexican Pozol, a Fermented Maize Dough, Demonstrates the Need for Cultivation-independent Method to Investigate Traditional Fermentation. Applied & Environmental Microbiology. 65:5464-5473.
AOAC. 1979. Official Methods of Analysis of Assosiation of Official Analytical Chemists. Di dalam Sudarmadji, S. Haryono, B dan Suhardi. Prosedur Analisa untuk Bahan Makanan dan Pertanian. Yogyakarta: Liberty. Baumann, U and Bisping, B. 1995. Proteolysis During Tempe Fermentation. Food
Microbiology.12:39-47.
Brown, R. M.JR. 2004. Cellulose Structure and Biosynthesis: What is in Store for the 21st Century?. Journal of Polymer Science. 42:487–495.
Buckle, K. A., Edwards, R. A., Fleet, G. H. dan Wooton, M. 1985. Ilmu Pangan. Jakarta: UI Press.
Budhiono, A., Rosidi, B., Taher, H. and Iguchi, M. 1999. Kinetic Aspects of
Bacterial Cellulose Formation in Nata de Coco Culture System. Carbohydrate Polymers. 40:137–143.
Caplice, E and Fitzgerald, G. F. 1999. Food Fermentations: Role of Microorganisms in Food Production and Preservation. International Journal Food Microbiology. 50:131-149.
Cheng, K., Catchmark, J. M. and Demirci, A. 2009. Effect of Different Additives on Bacterial Cellulose Production by Acetobacter xylinum and Analysis of Material Property. Cellulose. 16:1033–1045.
Çoban, E. P and Biyik, H. 2011. Effect of Various Carbon and Nitrogen Sources on Cellulose Synthesis by Acetobacter lovaniensis HBB5. African Journal of Biotechnology. 10:5346-5354.
Denter, J., Rehm, H. and Bisping, B. 1998. Changes in the Contents of Fat-soluble Vitamins and Provitamins During Tempe Fermentation. International Journal Food Microbiology. 45:129-134.
27
Gama, M., Gatenholm, P. and Klemm, D. 2013. Bacterial Nanocellulose. Boca Raton: CRC Press.
Hesseltine, C. W. 1991. Mixed Culture Fermentation an Introduction to Oriental Food Fermentation. McGraw-Hill, Inc. New York.
Holzapfel, W. H. 2002. Appropriate Starter Culture Technologies for Small-Scale Fermentation in Developing Countries. International Journal Food Microbiology.75:197-212.
Hornung, M., Biener, R. and Schmauder, H. 2009. Dynamic Modelling of Bacterial Cellulose Formation. Journal of Enginering Live Sciences. 9 (4): 342-347.
Hubert, J., Berger, M., Nepveu, F., Paul, F. and Dayde, J. 2008. Effects of Fermentation on the Phytochemical Composition and Antioxidant Properties of Soy Germ. Food Chemistry.109:709-721.
Iguchi, M., Yamanaka, S. and Bidhiono, A. 2000. Review Bacterial Cellulose – A Masterpiece of Nature’s Arts. Journal of Materials Science. 35:261– 270. Jagannath, A., Kalaiselvan, A., Manjunatha, S.S., Raju, P.S. and Bawa, A.S. 2008. The Effect of pH, Sucrose and Ammonium Sulphate Consentration on the Production of Cellulose (Nata de Coco) by Acetobacter xylinum. World Journal Microbiology and Biotechnology. 24: 2593-2599.
Ketaren, S. 1978. Daya Guna Air Kelapa. Bogor: Departemen Teknologi Hasil Pertanian, Fatemepa IPB.
Kholifah, S. 2010. Pengaruh Penambahan ZA dan Gula Terhadap Karakteristik Fisik, Organoleptik dan Kandungan Logam Nata de Coco. [Skripsi]. Bogor: IPB.
Kimura, S and Itoh, T. 1995. Evidence for the Role of the Glomerulocyte in Cellulose Synthesis in the Tunicate, Metandrocarpa uedai. Protoplasma. 186:24-33.
Krystynowicz, A., Czaja, W., Wiktorowska-Jezierska, A., Gonc¸alves-Mis´kiewicz, M., Turkiewicz, M. and Bielecki, S. 2002. Factors Affecting the Yield and Properties of Pacterial Cellulose. Journal of Industrial Microbiology and Biotechnology. 29: 189-195.
uedai
Kurosumi, A., Sasaki, C., Yamashita, Y. and Nakamura, Y. 2009. Utilization of Various Fruit Juices as Carbon Source for Production of BacterialCellulose by Acetobacter xylinum NBRC 13693. Carbohydrate Polymers. 76:333-335.
inDifferent Stages of Development, in Plantation on the Northwest Area of Paraná, Brazil. Journal of Food, Agriculture & Environment. 6:102-105.
Lestari, P., Elfrida, N., Suryani, A. and Suryadi, Y. 2014. Study on the Production of Bacterial Cellulose from Acetobacter xylinum using Agro-Waste. Jordan Journal of Biological Sciences. 7:75-80.
Masaoka, S., Ohe, T. and Sakota, N. 1993. Production of Cellulose from Glucose by Acetobacter xylinum. Journal of Fermentation and Bioengineering. 75:18-22.
Melliawati, R., Prayitno,N.R. dan Sukara, E. 1998. Pengaruh Cara Sterilisasi dan Jenis Air Kelapa Terhadap Produksi Bioselulosa oleh Acetobactersp.EMN-1. Prosiding Simposium Tahunan Perhimpunan Mikrobiologi Indonesia. Bandar Lampung, Desember 1997.
Melliawati, R. 2008. Kajian Bahan Pembawa untuk Meningkatkan Kualitas InokulumPasta Nata de Coco. Biodiversitas. 9:255-258.
Mounier, J., Monnet, C., Vallaeys, T., Arditi, R., Santhou, A., Helias, A. and Irlinger, F. 2008. Microbial Interaction Within a Cheese Microbial Community. Applied & Environmental Microbiology. 74:172-181.
Nainggolan, J. 2009. Kajian Pertumbuhan Bakteri Acetobacter sp. dalam Kombucha-Rosella Merah (Hibiscus sabdariffa) pada Kadar Gula dan Lama Fermentasi yang Berbeda. [Thesis]. Medan : USU.
Ogier, J. C., Lafarge, V., Girard, V., Rault, A., Maladen, V., Gruss, A., Leveau, J. Y. and Delacroix-Buchet. 2004. Molecular Fingerprinting of Dairy Microbial Ecosystems by Use of Temporal Temperature and Denaturing Gradient Gel Electrophoresis. Applied & Environmental Microbiology. 70:5628-5643.
Raghunathan, D. 2013. Production of Microbial Cellulose from the New Bacterial Strain Isolated From Temple Wash Waters. International Journal of Current Microbiology & Applied Sciences. 2:275-290.
Rajwade, J. M., Paknikar, K. M. and Kumbhar, J. V. 2015.Applications of Bacterial Cellulose and its Composites in Biomedicine.Applied Microbiology & Biotechnology. 70:5628-5643.
Ramana, K. V., Tomar, A. and Singh, L. 2000. Effect of Various Carbon and Nitrogen Sources on Cellulose Synthesisby Acetobacter xylinum. World Journal of Microbiology & Biotechnology. 16:245-248.
29
During Production of an Artisanal Sicilian Cheese as Evaluated by 16S rRNA Analysis. Applied & Environmental Microbiology. 68:1882-1892. Saragih, Y. P. 2004. Membuat Nata de Coco. Jakarta: Puspa Swara.
Seumahu, C. A. 2005. Analisa Dinamika Populasi Bakteri Selama Proses Fermentasi Nata de Coco Menggunakan Amplified Ribosomal DNA Restriction Analysis (ARDRA). [Thesis]. Bogor : IPB.
Scionti, G. 2010. Mechanical Properties of Bacterial Cellulose Implants. [Thesis]. Sweden: Chalmers University of Technology.
SNI 01-2891-1992. Analisis Kadar Air Metode Gravimetri. Badan Standardisasi Nasional, Jakarta.
SNI 01-4317-1996. Standar Mutu Produk Nata dalam Kemasan. Badan Standardisasi Nasional, Jakarta.
SNI 02-1760-2005. Syarat Mutu Pupuk Amonium Sulfat. Badan Standardisasi Nasional, Jakarta.
Son, H. J., Kim, H. G., Kim, K., Kim, H. S., Kim, Y. G. and Lee, S. J. 2003. Increased Production of Bacterial Cellulose by Acetobacter sp.V6 in Synthetic Media Under Shaking Culture Conditions. Bioresource Technology. 86:215–219.
Sukumaran, R. K., Singhania, R. R. and Pandey, A. 2005. Microbial Cellulases-Production, Applications and Challenges. Journal of Scientific & Industrial Research. 64:832-864.
Sutarminingsih, L. 2004. Peluang Usaha Nata de Coco. Yogyakarta: Kanisius. Torres, F. G., Commeaux, S. and Troncoso, O. P. 2012. Biocompatibility of
Bacterial Cellulose Based Biomaterials. Journal of Functional Biomaterials. 3:864-878.
Trovatti, E. 2012.The Future of Bacterial Cellulose and Other Microbial Polysaccharides. Journal Renewable Material. 1(1).
Van der Meulen, R., Scheirlinck, I., Van Schoor, A., Huys, G., Vancanneyt, M., Vandamme, P. and De Vuyst, L. 2007. Population Dynamics and Metabolite Target Analysis of Lactic Acid Bacteria During Laboratory Fermentations of Wheat and Spelt Sourdoughs. Applied & Environtal Microbiology. 73:4741-4750.
Winarno, F. G. 1980. Kimia Pangan dan Gizi. Bogor: PUSBANGTEPA, IPB. Zambre, M., Chowdhury, B., Kuo, Y. H., Montagu, M. V., Angenon, G. and
Lambein, F. 2002. Prolific Regeneration of Fertile Plants from Green Nodular Callus Induced from Meristematic Tissues in Lathyrus sativus L. (Grass Pea). Plant Science. 163:1107- 1112.
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juni-September 2015 di Laboratorium Mikrobiologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Penelitian Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara.
3.2 Rancangan Penelitian
Penelitian ini menggunakan metode Rancangan Acak Lengkap (RAL) faktorial dengan 2 perlakuan yaitu konsentrasi sukrosa (X) dibuat 4 level yaitu X0: 0 %, X1: 2 %, X2: 4 %, dan X3: 6% sedangkan konsentrasi amonium sulfat (Y) dibuat 4 level yaitu Y0: 0 %, Y1: 0,5 %, Y2: 1%, dan Y3: 1,5%. Masing-masing perlakuan dibuat dengan 3 kali ulangan. Data yang diperoleh dianalisis dengan menggunakan SPSS 20.0.
3.3 Prosedur Penelitian
3.3.1 Penyiapan Starter Acetobacter xylinum
3.3.2 Produksi Selulosa Mikrobial
Produksi selulosa mikrobial dilakukan berdasarkan modifikasi metode Kholifah (2010). Air kelapa disimpan terlebih dahulu selama 3 hari kemudian disaring sampai diperoleh air kelapa yang bersih. Sukrosa dan amonium sulfat ditimbang sesuai perlakuan. Sukrosa yang digunakan sebanyak 20 g, 40 g, dan 60 g. Amonium sulfat yang digunakan sebanyak 2 g, 4 g, dan 6 g. Kemudian dimasukkan masing-masing kedalam 1 liter air kelapa sesuai perlakuan. Air kelapa yang telah ditambahkan sukrosa dan amonium sulfat direbus sampai mendidih sambil diaduk. Asam asetat glasial ditambahkan sebanyak 2 ml sehingga pH media sekitar 4. Media air kelapa yang masih panas dituang sebanyak 270 ml ke masing-masing wadah dan ditutup dengan kertas, lalu dibiarkan sampai dingin. Starter A. xylinum yang telah diketahui konsentrasinya dimasukkan sebanyak 30 ml ke masing-masing wadah perlakuan dan diinkubasi selama 3 hari. Selulosa mikrobial yang dihasilkan dianalisis dan diamati karakteristik fisiknya.
3.3.3 Analisis Karakteristik Fisik Selulosa Mikrobial 3.3.3.1 Pengukuran Rendemen
Pengukuran rendemen berdasarkan AOAC (1979), selulosa mikrobial diangkat dan ditunggu hingga 30 detik, kemudian ditimbang menggunakan neraca analitik. Rendemen selulosa yang dihasilkan diukur dengan metode gravimetri dan dinyatakan dalam berat per volume media cair yang digunakan.
Rendemen (%) = ( )
( ) x 100%
3.3.3.2 Pengukuran Ketebalan Selulosa Mikrobial
13
3.3.3.3 Analisis Kandungan Air
Selulosa mikrobial disterilkan dengan air panas dan di rendam berulang. Analisis kandungan air pada selulosa mikrobial menggunakan metode termogravimetri berdasarkan SNI 01-2891-1992. Botol timbang dikeringkan menggunakan oven pada suhu 105 ºC selama 1 jam. Setelah itu didinginkan di dalam desikator. Botol timbang yang telah dingin ditimbang menggunakan neraca analitik. Selulosa mikrobial sebanyak 1 g dimasukkan kedalam botol timbang. Kemudian ditimbang menggunakan neraca analitik. Botol timbang yang telah berisi sampel dikeringkan menggunakan oven pada suhu 105 ºC selama 3 jam. Lalu didinginkan di dalam desikator dan ditimbang. Langkah ini diulangi sampai diperoleh berat konstan. Kandungan air dihitung dengan menggunakan rumus :
Kandungan air = x 100 %
W = berat sampel sebelum dikeringkan (g)
W1 = berat sampel konstan sesudah dikeringkan (g)
3.3.3.4 Uji Tarik
Selulosa mikrobial yang telah disterilkan dari masing-masing perlakuan dicetak dengan alat dumbbell cutter. Pengujian tarik dilakukan menggunakan alat Gotech AI-7000M di Laboratorium Penelitian Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara.
3.3.4 Pertumbuhan Acetobacter xylinum
3.3.5 Pertumbuhan Konsorsium Bakteri
BAB 4
HASIL DAN PEMBAHASAN
4.1 Rendemen Selulosa Mikrobial
Penambahan sukrosa dengan konsentrasi 0, 2, 4, dan 6 % dikombinasikan dengan konsentrasi amonium sulfat 0, 0,5, 1, dan 1,5 %. Hasil uji statistik dengan ANOVA menunjukkan bahwa perbedaan perlakuan konsentrasi sukrosa dan amonium sulfat tidak berbeda nyata terhadap rendemen selulosa mikrobial yang dihasilkan. Pengaruh perbedaan perlakuan terhadap rendemen selulosa mikrobial disajikan pada Gambar 4.1
Gambar 4.1 Rendemen Selulosa Mikrobial Fermentasi Tiga Hari
Hasil penelitian diperoleh bahwa rendemen meningkat seiring dengan penambahan konsentrasi sukrosa. Peningkatan rendemen selulosa ini tidak signifikan setelah diuji secara statistik dengan SPSS 20.0, hal ini kemungkinan disebabkan perbedaan penambahan konsentrasi amonium sulfat dan sukrosa yang terlalu kecil. Konsentrasi sukrosa 6 % menghasilkan rendemen yang paling tinggi kemudian diikuti oleh konsentrasi sukrosa 4 % dan 2 %. Sedangkan rendemen yang paling rendah dihasilkan dari media tanpa penambahan konsentrasi sukrosa. Perlakuan X3Y2 dengan konsentrasi sukrosa 6 % dan amonium sulfat 1 % menghasilkan rendemen yang paling tinggi yaitu 31,23 %. Selain dipengaruhi oleh konsentrasi sukrosa, rendemen selulosa mikrobial kemungkinan juga dipengaruhi oleh lama fermentasi. Dengan waktu fermentasi selama 3 hari
22.10 22.5923.9022.76 22.78 26.01
29.92
28.3029.77 30.3331.17 30.77 30.09 30.50 31.23 30.93
0
X0Y0 X0Y1 X0Y2 X0Y3 X1Y0 X1Y1 X1Y2 X1Y3 X2Y0 X2Y1 X2Y2 X2Y3 X3Y0 X3Y1 X3Y2 X3Y3
kemungkinan aktivitas A. xylinum dalam membentuk selulosa mikrobial belum maksimal. Menurut Kholifah (2010) setelah 7 hari fermentasi dengan konsentrasi sukrosa 0,6 % dihasilkan rendemen selulosa mikrobial sebesar 65, 62 %.
Rendemen selulosa mikrobial yang lebih tinggi dihasilkan dari penambahan konsentrasi amonium sulfat 1 % pada setiap kombinasi (X0Y2, X1Y2, X2Y2, dan X3Y2), tetapi pada konsentrasi 1,5 % menyebabkan penurunan rendemen. Hal ini kemungkinan disebabkan amonium sulfat pada konsentrasi 1 % dapat dimanfaatkan oleh A. xylinum secara maksimal untuk menghasilkan selulosa mikrobial, sedangkan konsentrasi amonium sulfat lebih dari 1 % dapat menghambat pertumbuhan A. xylinum dan pembentukan selulosa mikrobial. Hasil ini juga sesuai dengan penelitian Kholifah (2010), pada penambahan konsentrasi amonium sulfat sebesar 0.6 % menghasilkan rendemen yang paling tinggi yaitu sebesar 62,49 %, sedangkan pada penambahan konsentrasi amonium sulfat lebih dari 1 % menyebabkan penurunan rendemen selulosa mikrobial dengan waktu fermentasi selama 7 hari. Rendahnya rendemen ini disebabkan karena penambahan amonium sulfat berlebih dapat menurunkan pH media karena ion SO4-2 bersifat asam. Pada awal fermentasi pH cairan media adalah sebesar 4,3 yang kemungkinan mengalami perubahan. Jagannath et al. (2008), menambahkan bahwa proses pembentukan selulosa mikrobial lebih dipengaruhi oleh pH dibandingkan dengan konsentrasi sukrosa dan amonium sulfat.
Rendemen selulosa mikrobial kemungkinan dipengaruhi oleh strain A. xylinum yang digunakan, sehingga perlu diketahui jenis strain agar dapat dibandingkan dan dipilih strain yang lebih unggul menghasilkan selulosa mikrobial. Strain yang digunakan pada penelitian Jagannath et al. (2008) ialah A. xylinum NCIM 2526 menghasilkan selulosa mikrobial yang maksimum pada pH 4 dengan konsentrasi sukrosa 10 % dan konsentrasi amonium sulfat 0,5 % yang difermentasi selama 15-20 hari. Strain lain yang sering digunakan seperti pada penelitian Cheng et al. (2009) menggunakan strain A. xylinum ATCC 700178 dan Kurosumi et al. (2009) menggunakanstrain A. xylinum NBRC 13693.
17
Keberadaan bakteri lain ini diduga dapat menunjang kebutuhan dari A. xylinum. Hal ini sesuai dengan penelitian Seumahu (2005), pada fermentasi nata dengan hasil yang baikdijumpai jenis kelompok bakteri yang cukup bervariasi dibandingkan pada fermentasi dengan hasil yang jelek. Berdasarkan hasil ARDRA (Amplified Ribosomal DNA Restriction Analysis) dan kurva pola pertumbuhan didapatkan 22 jenis bakteri yang terdapat pada cairan media hasil fermentasi nata.
4.2 Ketebalan Selulosa Mikrobial
Ketebalan yang diperoleh dari hasil penelitian ini berkorelasi positif terhadap rendemen selulosa mikrobial. Semakin tebal selulosa mikrobial yang dihasilkan maka akan semakin tinggi pula rendemennya. Hasil uji statistik dengan ANOVA menunjukkan bahwa perbedaan perlakuan konsentrasi sukrosa dan amonium sulfat tidak berbeda nyata terhadap ketebalan selulosa mikrobial yang dihasilkan. Pengaruh perbedaan perlakuan terhadap ketebalan selulosa mikrobial disajikan pada Gambar 4.2
Gambar 4.2 Ketebalan Selulosa Mikrobial Fermentasi Tiga Hari
Ketebalan selulosa mikrobial yang dihasilkan meningkat seiring dengan penambahan konsentrasi sukrosa. Ketebalan selulosa mikrobial yang paling tinggi dihasilkan dari media dengan penambahan konsentrasi sukrosa sebesar 6 % dan yang paling rendah dihasilkan dari media tanpa penambahan konsentrasi sukrosa. Penambahan amonium sulfat dengan konsentrasi 1 % dapat menghasilkan
5.80
6.85 7.10 7.07 6.61
7.81 8.25 7.87 7.87 8.65 8.68 8.49 7.78 8.54 8.77 8.28
0
X0Y0 X0Y1 X0Y2 X0Y3 X1Y0 X1Y1 X1Y2 X1Y3 X2Y0 X2Y1 X2Y2 X2Y3 X3Y0 X3Y1 X3Y2 X3Y3
ketebalan yang maksimum (8,77 mm) pada setiap kombinasi (X0Y2, X1Y2, X2Y2, dan X3Y2), sedangkan pada konsentrasi 1,5 % menyebabkan penurunan ketebalan selulosa mikrobial (7,07 mm). Menurut penelitian Ramana et al. (2000) penambahan amonium sulfat sebagai sumber nitrogen dan sukrosa sebagai sumber karbon menghasilkan selulosa mikrobial dengan ketebalan yang lebih tinggi dibandingkan kombinasi sumber karbon dan nitrogen yang lain. Hasil yang berbeda didapatkan pada penelitian Khalifah (2010), konsentrasi sukrosa sebesar 0,6 % menghasilkan ketebalan yang lebih tinggi yaitu 1,23 cm. Sedangkan konsentrasi amonium sulfat yang menghasilkan ketebalan maksimum ialah 0,6 % dengan ketebalan 0,96 cm. Hasil yang berbeda juga didapatkan dalam penelitian Jagannath et al. (2008), ketebalan maksimum selulosa mikrobial oleh A. xylinum NCIM 2526 diperoleh pada pH 4 dengan konsentrasi sukrosa 10 % dan amonium sulfat 0,5 %.
Konsentrasi sukrosa 6 % dan konsentrasi amonium sulfat 1 % menghasilkan selulosa mikrobial dengan ketebalan tertinggi yaitu 8,77 mm. Konsentrasi amonium sulfat lebih dari 1 % dapat menurunkan ketebalan selulosa mikrobial seperti halnya dengan rendemen. Ketebalan selulosa mikrobial juga dipengaruhi oleh waktu fermentasi dan volume atau ketinggian media pada wadah yang digunakan. Wadah yang permukaannya lebih luas dan dangkal akan lebih cepat membentuk selulosa mikrobial dibandingkan dengan wadah yang sempit dan dalam. Menurut Masaoka et al. (1993) hanya bakteri di permukaan saja yang dapat membentuk selulosa karena adanya keterbatasan oksigen pada wadah fermentasi. Hasil yang sama juga didapatkan pada penelitian Kholifah (2010) dengan waktu fermentasi 7 hari dan Jagannath et al. (2008) yang menggunakan wadah lebih luas berupa baki dan difermentasi selama 15 hari menghasilkan ketebalan yang lebih tinggi.
19
4.3 Kandungan Air Selulosa Mikrobial
Hasil uji statistik menggunakan ANOVA didapatkan bahwa penambahan berbagai kadar sukrosa dan amonium sulfat terhadap kandungan air selulosa mikrobial tidak berbeda nyata. Pengaruh perlakuan terhadap kandungan air selulosa mikrobial dapat dilihat pada Gambar 4.3
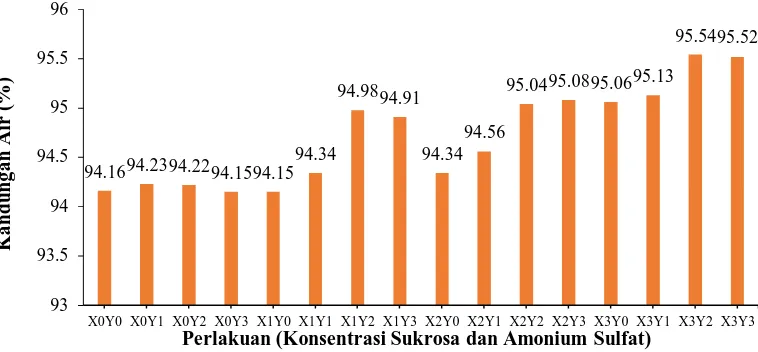
Gambar 4.3 Kandungan Air Selulosa Mikrobial
Dari Grafik dapat diketahui bahwa kandungan air yang paling tinggi dihasilkan dari penambahan konsentrasi sukrosa 6 % dan kosentrasi amonium sulfat 1 % yaitu 95,54 %. Sedangkan kandungan air terendah dihasilkan dari media tanpa penambahan sukrosa dan amonium sulfat. Hasil ini lebih tinggi dibandingkan yang dilakukan Kholifah (2010) dengan kandungan air yang paling tinggi didapatkan dari konsentrasi amonium sulfat 1 % yaitu 94, 95 %.
Kandungan air selulosa mikrobial yang dihasilkan adalah 94,15 % sampai 95,54 %. Kandungan air pada selulosa mikrobial juga berkorelasi positif dengan ketebalan. Semakin tebal selulosa mikrobial yang dihasilkan maka kandungan air juga akan semakin tinggi dan semakin tipis selulosa mikrobial maka kandungan air juga akan semakin rendah. Jagannath et al. (2008) menyatakan bahwa ketebalan memiliki dampak langsung pada jumlah air yang terperangkap pada selulosa mikrobial, sehingga mempengaruhi kandungan air dan kekerasan. Kurosumi et al. (2009) menambahkan bahwa air pada selulosa mikrobial berasal
X0Y0 X0Y1 X0Y2 X0Y3 X1Y0 X1Y1 X1Y2 X1Y3 X2Y0 X2Y1 X2Y2 X2Y3 X3Y0 X3Y1 X3Y2 X3Y3
xylinum air dari media terperangkap pada lapisan selulosa sehingga terbentuk seperti gel.
Selulosa mikrobial yang memiliki kandungan air yang tinggi diharapkan dapat digunakan untuk industri kosmetik. Hal ini bertujuan untuk mengikat zat aktif yang akan ditambahkan dan bahan yang digunakan tidak cepat kering. Menurut Trovatti (2012), untuk tujuan kosmetik selulosa mikrobial digunakan sebagai masker kecantikan dan perawatan wajah. Membran selulosa mikrobial dapat menyerap emulsi kosmetik seperti pemutih, anti jerawat, anti keriput yang diaplikasikan langsung ke kulit.
4.4 Daya Tarik Selulosa Mikrobial
Selulosa mikrobial sebagai salah satu biomaterial yang banyak diteliti aplikasinya dalam bidang medis, tentu kekuatan mekanik dari biomaterial ini sangat penting untuk diketahui. Hasil uji statistik menggunakan ANOVA didapatkan bahwa pengaruh perlakuan tidak signifikan terhadap daya tarik. Pengaruh penambahan sukrosa dan amonium sulfat terhadap uji tarik disajikan pada Gambar 4.4
Gambar 4.4 Daya Tarik Selulosa Mikrobial
Dari Grafik di atas dapat dilihat bahwa selulosa mikrobial yang dihasilkan dari media kontrol, tanpa penambahan sukrosa dan amonium sulfat memiliki daya tarik paling rendah yaitu 1,176 MPa. Daya tarik paling tinggi dihasilkan dari
X0Y0 X0Y1 X0Y2 X0Y3 X1Y0 X1Y1 X1Y2 X1Y3 X2Y0 X2Y1 X2Y2 X2Y3 X3Y0 X3Y1 X3Y2 X3Y3
21
perlakuan X3Y2 daya tarik yang lebih tinggi. Rendemen dan ketebalan kemungkinan turut mempengaruhi daya tarik selulosa mikrobial yang diperoleh dari kultur statik. Menurut Cheng et al. (2009) selulosa mikrobial yang diperoleh dari kultur agitasi kehilangan kekuatan mekanik terutama daya tarik. Selulosa mikrobial dengan penambahan CMC (carboxy methyl cellulose) yang dihasilkan dari kultur agitasi memiliki kekuatan mekanik 2,4 MPa. Daya tarik selulosa mikrobial berkorelasi dengan polimerisasi glukosa untuk membentuk selulosa.
Krystynowiczet al. (2002) menambahkan pembentukan selulosa mikrobial pada kultur statik akan lebih tinggi dibandingkan dengan kultur agitasi. Pada kultur statik selulosa akan dibentuk dengan formasi yang kompak karena keterbatasan oksigen, sedangkan pada kultur agitasi yang berlimpah oksigen terjadi pertumbuhan sel yang tinggi sehingga menghambat pembentukan selulosa mikrobial.
Selulosa mikrobial dengan kekuatan mekanik atau daya tarik yang lebih tinggi menjadikan biomaterial ini sangat bagus digunakan untuk berbagai keperluan medis. Dari penelitian ini didapatkan selulosa mikrobial yang memiliki kekuatan mekanik yang lebih baik pada perlakuan X2Y3 yaitu 3,234 MPa. Rajwade et al. (2015) menyatakan selulosa mikrobial dapat diproduksi dengan berbagai bentuk dan teknik pengkulturan, sehingga daya tarik dari biomaterial ini juga bervariasi tergantung dari faktor tersebut. Biomaterial yang digunakan untuk keperluan medis pada umumnya harus memiliki kekuatan mekanik yang tinggi. Selulosa mikrobial memiliki kekuatan mekanik yang lebih tinggi dari bahan biokompatibel lain seperti politetrafloroetilen.
4.5 Pertumbuhan A. xylinum
Gambar 4.5 Pertumbuhan A. xylinum Fermentasi Tiga Hari
Dari Grafik diatas dapat diketahui bahwa terjadi peningkatan jumlah A. xylinum pada setiap peningkatan konsentrasi sukrosa. Jumlah tertinggi didapat pada perlakuan X2Y2, X3Y0, dan X3Y2 yaitu 25 x 104 CFU/ml. Pertumbuhan A. xylinum yang rendah pada perlakuan ini kemungkinan disebabkan oleh rendahnya jumlah A. xylinum pada starter dan waktu fermentasi yang pendek. Jumlah A. xylinum pada hari ke-0 adalah 12 x 103 CFU/ml dan pada perlakuan X0Y0 jumlah A. xylinum ialah 9 x 104 CFU/ml, sehingga dapat diketahui bahwa A. xylinum mengalami pertumbuhan meskipun tidak ada penambahan amonium sulfat dan sukrosa pada media air kelapa. Hal ini disebabkan masih tersedianya nutrisi pada air kelapa untuk pertumbuhan bakteri. Ketaren (1978) menyatakan air kelapa mengandung karbohidrat seperti glukosa, fruktosa, sukrosa, sorbitol, 5-inositol, dan galaktosa. Sutarminingsih (2004) menambahkan bahwa pada air kelapa juga terdapat mineral, zat besi, asam fosfat, dan nitrogen. Air kelapa merupakan media yang lebih efisien dalam pembentukan selulosa mikrobial dibandingkan dengan media ekstrak nenas. Menurut Kholifa (2010) jumlah A. xylinum pada starter yang dihitung dengan metode hemacytometer ialah 5 x 107 CFU/ml dan waktu fermentasi yang digunakan ialah 7 hari.
Jumlah A. xylinum yang didapatkan dari masing-masing perlakuan tidak semua berbanding lurus dengan rendemen dan ketebalan selulosa mikrobial. Hasil ini kemungkinan disebabkan oleh perhitungan jumlah bakteri hanya dilakukan dari sisa media hasil fermentasi, sedangkan pada bagian selulosa yang dihasilkan tidak dilakukan perhitungan. Menurut Hornung et al. (2009) pada bagian
X0Y0 X0Y1 X0Y2 X0Y3 X1Y0 X1Y1 X1Y2 X1Y3 X2Y0 X2Y1 X2Y2 X2Y3 X3Y0 X3Y1 X3Y2 X3Y3
23
permukaan selulosa lebih tinggi biomassa sel, karena pada bagian ini lebih banyak tersedia oksigen atau disebut zona aerob. Pada bagian tengah dan bawah dari fiber selulosa hanya ditemukan sel yang inaktif karena oksigen sangat terbatas.
Jumlah Acetobacter yang tidak jauh berbeda didapatkan pada penelitian Nainggolan (2009), pertumbuhan koloni Acetobacter yang paling baik terdapat pada perlakuan penambahan kadar gula 10 % pada media rosela dan lama fermentasi 8 hari ialah 93,33 x 104 CFU/ml. Pertumbuhan Acetobacter terendah terdapat pada penambahan gula 8 % dan lama fermentasi 8 hari yaitu 74,33 x 104 CFU/ml.
4.6 Pertumbuhan Konsorsium Bakteri
Pertumbuhan konsorsium bakteri pada media fermentasi dilakukan untuk mengetahui apakah konsorsium tersebut mempengaruhi proses pembentukan selulosa mikrobial. Pertumbuhan konsorsium bakteri dihitung dengan metode TPC (Total Plate Count). Hasil perhitungan jumlah bakteri dapat dilihat pada Gambar 4.6
Gambar 4.6 Pertumbuhan Konsorsium Bakteri Fermentasi Tiga Hari
Dari Grafik diatas diketahui bahwa konsorsium bakteri yang paling rendah terdapat pada perlakuan X0Y2 dan X0Y3 yaitu 20 x 104 CFU/ml. Sedangkan konsorsium bakteri teringgi terdapat pada perlakuan X3Y0 dan X3Y2. Hasil ini menunjukkan bahwa sebagian besar peningkatan konsorsium bakteri berkorelasi positif dengan rendemen dan ketebalan dari selulosa mikrobial. Menurut Seumahu
25
X0Y0 X0Y1 X0Y2 X0Y3 X1Y0 X1Y1 X1Y2 X1Y3 X2Y0 X2Y1 X2Y2 X2Y3 X3Y0 X3Y1 X3Y2 X3Y3
(2005) proses fermentasi nata de coco tidak hanya melibatkan Acetobacter saja tetapi juga melibatkan bakteri lain yang secara genetik bervariasi. Bakteri lain tersebut melakukan simbiosis dengan A. xylinum dalam menghasilkan selulosa mikrobial.
Hesseltine et al. (1991) menambahkan mikroorganisme yang berperan dalam proses fermentasi terutama dari golongan khamir dan bakteri. Fermentasi berbagai bahan makanan dan minuman dapat melibatkan satu macam atau beberapa mikroorganisme yang bekerja secara simbiotik. Bakteri ini dapat berasal dari starter yang digunakan maupun dari lingkungan.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan dari penelitian ini ialah:
1. Penambahan sukrosa (2, 4, dan 6 %) dan amonium sulfat (0,5, 1 dan 1,5%) pada media air kelapa dapat meningkatkan produksi selulosa mikrobial. 2. Konsentrasi sukrosa dan amonium sulfat yang optimum untuk produksi
selulosa mikrobial adalah berturut-turut 6 % dan 1 %.
3. Selulosa mikrobial yang dihasilkan pada pada sukrosa 6 % dan amonium sulfat 1 % mempunyai nilai kandungan air dan daya tarik tertinggi dibandingkan semua perlakuan, masing-masing 95,54 % dan 3,234 MPa.
5.2 Saran
Perlu dilakukan identifikasi strain A. xylinum dan bakteri lain yang terdapat dalam konsorsium yang digunakan serta perlu dilakukan penelitian dengan menggunakan konsentrasi sukrosa dan amonium sulfat dengan rentang yang lebih besar.
BAB 2
TINJAUAN PUSTAKA
2.1 Selulosa Mikrobial
Selulosa merupakan biopolimer dan makromolekul yang sangat penting di alam yang diperkirakan lebih dari 1011 ton disintesis tiap tahunnya. Selulosa disintesis oleh organisme yang sangat beragam (Brown, 2004). Organisme prokariot seperti bakteri Acetobacter, Rhizobium, Agrobacterium dan beberapa bakteri patogen juga dapat mensintesis selulosa (Zogaj et al., 2001). Organisme eukariot seperti jamur, amoeba, dan algae dapat memproduksi selulosa dengan baik. Selulosa juga disintesis oleh tumbuhan darat diantaranya lumut, tumbuhan paku, Angiosperma, Gymnosperma, dan juga oleh algae air tawar dan air laut. Selulosa bahkan dapat dihasilkan oleh beberapa hewan Tunicata (Kimura dan Itoh, 1995).
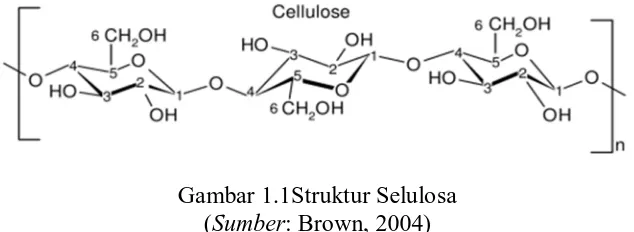
Selulosa merupakan senyawa kimia yang disusun oleh monomer glukosa dengan ikatan β-1,4. Jumlah unit monomer glukosa yang dibutuhkan untuk menghasilkan produk yang tidak dapat larut sekitar 8 unit, diatas itu rantai glukan memembentuk ikatan yang lebih kuat terhadap larutan air (Brown, 2004). Berikut ini adalah gambar struktur dari selulosa:
Gambar 1.1Struktur Selulosa (Sumber: Brown, 2004)
5
dihasilkan oleh tumbuhan, karena tidak mengandung lignin, pektin, dan hemiselulosa. Selulosa mikrobial merupakan selulosa yang memiliki bobot mulekul tinggi, derajat polimerisasi tinggi, daya tarik tinggi, dan sangat hidrofilik (Brown, 2004).
2.2 Acetobacter xylinum
A. xylinum merupakan bakteri non-patogen, gram-negatif, berbentuk batang, aerob obligat, dan dapat menghasilkan selulosa ekstraseluler (Scionti, 2010). Bakteri ini membentuk biofilm selulosa pada permuakaan buah dan bunga di alam. Pembentukan selulosa ini menguntungkan bagi bakteri seperti menyebabkan bakteri dekat dengan nutrisi, melindungi dari musuh dan radiasi UV, dan untuk mengangkat pada permukaan yang terdapat oksigen (Iguchi et al., 2000).
A. xylinum menghasilkan selulosa sebagai metabolit sekunder, sedangkan metabolit primernya adalah asam asetat. Semakin banyak kadar nutrisi maka akan semakin cepat pertumbuhan sel dan semakin banyak selulosa yang terbentuk. Faktor – faktor yang mempengaruhi A. xylinum dalam menghasilkan selulosa yaitu sumber karbon, sumber nitrogen, pH, temperatur, dan metode kultivasi (Çoban dan Biyik, 2011).
proteinaceous nitrogen juga dapat meningkatkan sintesis selulosa mikrobial oleh A. xylinum.
A. xylinum merupakan bakteri yang hidup pada kondisi asam, sehingga pH media pertumbuhan sangat mempengaruhinya. Menurut penelitian Çoban dan Biyik (2011), A. xylinum pada umumnya tumbuh pada pH 3,5–8,5. Sedangkan pH optimum untuk sintesis dan produksi selulosa mikrobial adalah pH 4-6 (Masaoka et al., 1993). Suhu juga berpengaruh terhadap pertumbuhan sel dan pembentukan selulosa mikrobial. Suhu untuk pertumbuhan A. xylinum berkisar antara 28-31ºC. Çoban dan Biyik (2011) menggunakan suhu kultivasi 22-37 ºC dalam penelitiannya tetapi suhu optimal untuk menghasilkan selulosa mikrobial yaitu 30ºC.
2.3 Konsorsium Mikroba
Konsorsium mikroba telah banyak dipelajari terutama dalam proses fermentasi makanan. Proses fermentasi makanan dapat dikategorikan menjadi dua, yaitu proses fermentasi yang tidak menggunakan kultur starter dan proses fermentasi menggunakan kultur starter. Kultur starter yang digunakan dapat berupa isolat tunggal atau kultur campuran. Proses fermentasi spontan maupun fermentasi yang menggunakan starter, masih memungkinkan masuknya berbagai mikroba lain yang akhirnya terlibat dalam proses fermentasi tersebut (Holzapfel, 2002). Proses tersebut dapat pula melibatkan berbagai jenis bakteri terkultur maupun tidak terkultur (Ampe et al., 1999).
7
yangmemungkinkan pertumbuhannya (Van der Meulen et al., 2007). Jenis mikroba berbeda dapat mensintesis metabolit berbeda walaupun pada bahan makanan yangsama. Jenis metabolit yang disintesis pada bahan makanan tertentu sangat dipengaruhi oleh jenis mikroba dalam proses fermentasinya (de Reu et al., 1994; Bauman & Bisping, 1995; Denter et al., 1998; Hubert et al., 2008).
Proses fermentasi nata de coco tidak hanya melibatkan Acetobacter saja tetapi juga melibatkan sejumlah bakteri lain yang secara genetik bervariasi. Fermentasi nata dalam media yang tidak mengalami perlakuan pemanasan meberikan hasil pertumbuhan Acetobacter dan nata yang lebih baik dibandingkan dengan media yang diberikan perlakuan pemanasan. Hal ini dikarenakan adanya simbiosis yang baik dengan bakteri atau mikroorganisme lain dalam media fermentasi tanpa pemanasan (Seumahu, 2005).
2.4 Amonium Sulfat
Amonium sulfat atau ZA (Zwavelzuur Ammoniak) merupakan senyawa kimia dengan rumus (NH4)2SO4 yang berbentuk kristal dan umumnya berwarna putih. Senyawa ini mengandung nitrogen antara 20,4-21 %, bersifat tidak higroskopis dan baru akan menyerap air bila kelembapan nisbi sudah mencapai 80 % pada suhu 3 ºC. Sedangkan SNI 02-1760-2005 mensyaratkan kandungan nitrogen untuk amonium sulfat minimal 25 %. Pupuk ZA merupakan sumber nitrogen yang biasanya digunakan untuk tanaman dan dalam proses pembuatan pupuk ini menggunakan katalis logam. Hasil penelitian Kholifah (2010), penggunaan pupuk ZA sebagai sumber nitrogen menghasilkan nata de coco mentah yang mengandung logam Cu, Zn, dan Pb. Setelah dilakukan pengolahan lebih lanjut seperti pencucian, perebusan, penekanan, dan pengembangan, kandungan logam pada nata de coco menurun sehingga memenuhi persyaratan dalam SNI 01-4317-1996.
umumnya lebih sering digunakan karena harganya relatif murah dan mudah diperoleh (Saragih, 2004).
Sumber nitrogen yang optimum dalam menghasilkan selulosa mikrobial sangat bervariasi sesuai dengan sumber karbon dari media yang digunakan. Diantara beberapa sumber nitrogen yang telah dipelajari, pepton, amonium sulfat, dan hidrolisat kasein lebih baik untuk sintesis selulosa mikrobial dengan satu sumber karbon seperti sukrosa, glukosa maupun manitol (Ramana et al., 2000). Hasil penelitian Kholifah (2010) menyatakan bahwa penambahan pupuk ZA sebagai sumber nitrogen dengan konsentrasi 0,4 %, 0,6 %, 0,8 %, 1 %, dan 1,2 % tidak menunjukkan perbedaan nyata terhadap rendemen, ketebalan, warna dan kekerasan selulosa mikrobial.
2.5 Sukrosa
Sukrosa atau gula pasir merupakan senyawa karbohidrat yang digunakan sebagai pemanis dalam industri pangan yang berasal dari bit atau tebu. Sukrosa adalah gula utama yang digunakan dalam industri pangan (Buckle et al., 1985). Winarno (1980) menyatakan industri-industri makanan biasa menggunakan sukrosa dalam bentuk kristal halus atau kasar dan jika penggunaannya dalam jumlah banyak maka digunakan dalam bentuk cair. Sukrosa adalah disakarida yang banyak terdapat pada tebu, bit, siwalan, dan kelapa kopyor.
Sukrosa berfungsi sebagai sumber karbon bagi A. xylinum. Gula ini pada umumnya digunakan untuk memproduksi selulosa mikrobial karena mudah diperoleh dan harganya relatif murah. Gula yang digunakan adalah gula yang berwarna putih dengan tujuan agar menghasilkan selulosa mikrobial yang berwarna putih bersih (Saragih, 2004).
9
dan asam asetat menghasilkan jumlah selulosa yang rendah. Jumlah selulosa yang dihasilkan dari sumber karbon tersebut adalah 0,4 - 2 g/l (Ramana et al., 2000).
2.6 Air Kelapa
Air kelapa merupakan bagian dari buah kelapa yang biasanya tidak digunakan lagi setelah pengolahan kelapa. Kandungan nutrisi yang tinggi pada air kelapa sangat cocok digunakan sebagai media pertumbuhan A. xylinum. Air kelapa mengandung karbohidrat seperti glukosa, fruktosa, sukrosa, sorbitol, 5-inositol, dan galaktosa (Ketaren, 1978). Nilai kalori yang terdapat di dalam air kelapa sebesar 17,4 kalori/100 gram bahan (Vigliar et al., 2006). Air kelapa juga mengandung mineral yang cukup tinggi (Kwiatkowski et al., 2008). Menurut penelitian Lestari et al. (2014), air kelapa merupakan media yang lebih efisien dalam pembentukan selulosa mikrobial dibandingkan dengan media ekstrak nenas.
didalamnya mudah mengalami fermentasi spontan sehingga rasanya cepat menjadi asam.Lama penyimpanan air kelapa juga mempengaruhi pembentukan selulosa mikrobial oleh A. xylinum. Produksi selulosa mikrobial akan lebih baik jika media air kelapa yang digunakan disimpan dahulu selama 3 hari sebelum dipakai (Melliawati et al., 1998).
2.7 Aplikasi Selulosa Mikrobial
Selulosa mikrobial memiliki banyak kegunaan, salah satunya adalah untuk makanan. Selulosa mirkobial atau lebih dikenal dengan nata de coco banyak mengandung serat serta tidak mengandung lemak dan kolesterol. Penghasil nata de coco sebagian besar berasal dari negara-negara Asia Timur seperti Filipina, Indonesia, Thailand, China, Vietnam, dan Malaysia. Filipina dan Indonesia adalah negara pengekspor nata de coco paling tinggi. Produksi nata de coco mengalami peningkatan setiap tahunnya, tidak hanya di pasar domestik, tetapi juga untuk dieksport ke Eropa, Jepang, Amerika Serikat, dan Timur Tengah (Gama et al., 2013).
Selain untuk makanan, nata de coco juga dapat digunakan untuk aplikasi lain. Sifat selulosa mikrobial yang unik seperti tingginya kemurnian, daya simpan air, dan daya tarik sehingga sangat cocok diaplikasikan untuk pembuatan masker wajah. Masker wajah yang berasal dari selulosa mikrobial lebih fleksibel, tipis tetapi kuat, dan sangat bagus membawa zat aktif kosmetik. Selulosa mikrobial juga tidak toksik dan mempercepat pertumbuhan sel kulit (Amnuaikitet al., 2011).
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Selulosa mikrobial merupakan jenis selulosa yang dihasilkan oleh berbagai jenis bakteri. Selulosa mikrobial memiliki kelebihan dibanding selulosa yang dihasilkan oleh tumbuhan, antar lain memiliki kemurnian yang tinggi tanpa adanya lignin, pektin, dan hemiselulosa. Selulosa mikrobial juga memiliki sifat unik seperti kekuatan mekanis yang tinggi, kristalinitas tinggi, dan kemampuan menyimpanan air yang tinggi dibandingkan selulosa yang dihasilkan tumbuhan. Sifat unik dan keunggulan ini menjadikan selulosa mikrobial sebagai material yang sangat bermanfaat dalam berbagai industri, seperti makanan, pembuatan kertas, biomedis dan farmasi (Cheng et al., 2009). Aplikasi selulosa mikrobial dalam dunia kesehatan atau biomedis diantaranya adalah sebagai kulit buatan, pembuluh darah buatan, teknik jaringan tulang rawan, pembalut luka, dan masker wajah (Scionti, 2010).
Acetobacter xylinum telah lama digunakan sebagai mikroorganisme model dalam penelitian dasar maupun aplikasi selulosa mikrobial. Hal ini dikarenakan kemampuannya dalam memproduksi polimer yang tinggi dari berbagai sumber karbon dan nitrogen (Raghunathan, 2013). Sumber karbon dan nitrogen sangat berpengaruh terhadap laju pembentukan selulosa mikrobial oleh A. xylinum. Kedua faktor ini juga akan mempengaruhi sifat fisik dari selulosa mikrobial yang dihasilkan seperti ketebalan, berat basah, kandungan air, kekerasan dan daya simpan air (Jagannath et al., 2008).
(2009) adalah sari buah-buahan. Air kelapa adalah bagian buah kelapa yang biasanya tidak digunakan lagi, tetapi masih banyak akan nutrisi yang dibutuhkan oleh mikroorganisme sehingga cocok digunakan sebagai media pertumbuhan.
Nitrogen yang digunakan dapat berupa nitrogen organik atau nitrogen anorganik. Sumber nitrogen organik yang digunakan antara lain hidrolisat protein, glisin, sari kacang kedelai, pepton, dan sodium glutamat. Sedangkan nitrogen anorganik yang sering digunakan adalah amonium sulfat. Konsentrasi masing-masing sumber nitrogen yang digunakan adalah 5 g/l (Ramana et al., 2000). Penggunaan sumber nitrogen anorganik seperti pupuk ZA lebih sering digunakan dibandingkan nitrogen organik, karena lebih terjangkau secara ekonomi dan mudah didapat (Kholifah, 2010).
Proses fermentasi umumnya mikroba bekerja delam bentuk konsorsium (Ampe et al., 1999).Proses fermentasi nata de coco tidak hanya melibatkan Acetobacter saja tetapi juga melibatkan sejumlah bakteri lain yang secara genetik bervariasi.Pengunaan konsorsium mikroba dari starter juga akan turut berperan dalam menghasilkan selulosa mikrobial yang lebih baik.Hal ini dikarenakan adanya simbiosis yang baik dengan bakteri atau mikroorganisme lain dalam media fermentasi (Seumahu, 2005).
Penambahan amonium sulfat dan sukrosa dengan berbagai variasi konsentrasi pada media air kelapa akan dihasilkan selulosa mikrobial dengan sifat fisik yang terbaik. Dengan demikian sangat memungkinkan diperoleh konsentrasi amonium sulfat dan sukrosa yang sesuai untuk produksi selulosa mikrobial dengan berbagai sifat yang fisik oleh A. xylinum pada media air kelapa.
1.2 Rumusan Masalah
3
1.3 Tujuan Penelitian Tujuan penelitian ini ialah:
a. Mengetahui pengaruh penambahan amonium sulfat dan sukrosa terhadap laju pembentukan selulosa mikrobial oleh A. xylinum.
b. Mengetahui konsentrasi amonium sulfat dan sukrosa yang optimum untuk produksi selulosa mikrobial oleh A. xylinum.
c. Mengetahui pengaruh penambahan amonium sulfat dan sukrosa terhadap sifat fisik selulosa mikrobial oleh A. xylinum.
1.4 Manfaat Penelitian
v
PRODUKSI DAN KARAKTERISTIK FISIK SELULOSA
MIKROBIAL Acetobacter xylinum
ABSTRAK
Acetobacter xylinum merupakan bakteri penghasil selulosa mikrobial yang telah digunakan pada berbagai industri, seperti industri makanan, kertas, elektronik, farmasi dan biomedis. Studi tentang pengaruh penambahan amonium sulfat dan sukrosa pada media air kelapa terhadap produksi dan karakteristik fisik selulosa mikrobial telah dilakukan. Konsentrasi amonium sulfat yang digunakan adalah 0, 0,5, 1, dan 1,5 % dikombinasikan dengan konsentrasi sukrosa 0, 2, 4, dan 6 %, dilakukan pengkulturan selama 3 hari. Selanjutnya selulosa mikrobial dari masing-masing perlakuan di uji karakteristik fisik berdasarkan rendemen, ketebalan, kandungan air, dan daya tarik. Semakin tinggi konsentrasi sukrosa yang digunakan akan meningkatkan produksi dan kualitas fisik selulosa mikrobial. Konsentrasi amonium sulfat 1 % menghasilkan produksi dan kualitas fisik selulosa mikrobial yang terbaik, akan tetapi dapat menurunkan produksi dan kualitas fisik pada konsentrasi 1,5 %. Rendemen selulosa mikrobial tertinggi yang didapatkan ialah 31,23 %. Ketebalan selulosa mikrobial tertinggi yang diperoleh ialah 8,77 mm. Kandungan air selulosa mikrobial tertinggi ialah 95,54 % dan daya tarik tertinggi ialah 3,234 MPa. Perlakuan penambahan amonium sulfat sebanyak 1 % dan sukrosa 6 % menghasilkan selulosa mikrobial dengan rendemen, ketebalan, kandungan air, dan daya tarik yang lebih tinggi. Namun, hasil uji statistik menunjukkan bahwa perbedaan perlakuan tidak berbeda nyata terhadap rendemen, ketebalan, kandungan air, dan daya tarik.
vi
THE EFFECTS OF AMMONIUM SULPHATE AND SUCROSE
ADDITION INTO COCONUT WATER MEDIA ON THE
PRODUCTION AND PHYSICALCHARACTERISTICS OF
MICROBIAL CELLULOSE BY Acetobacter xylinum
ABSTRACT
Acetobacter xylinum is a bacterium that produces microbial cellulose which has been commonly used in several industries factory such as food industry, paper, electronics, pharmacy, and biomedical. Study about the effects of ammonium sulphate and sucrose addition into coconut water media on the production and physical characteristics of microbial cellulose by Acetobacter xylinum has been conducted. Ammonium sulphate were 0, 0.5, 1 and 1.5 % which were combined with 0, 2, 4, 6 % of sucrose. The cultures were growth for three days. Microbial cellulose of each treatments was analysed based on the physical properties such as rendemen, thickness, water content and tensile strength . The higher sucrose concentration added to the medium, the better production and physical characteristics of microbial cellulose. Concentration of ammonium sulphate 1 % was produce the best quality of microbial cellulose, while 1.5 % decreased the production and the quality of microbial cellulose. The highest rendemen, thickness, water content and the tensile strength of microbial cellulose was 31.23 %, 8.77 mm, 95.54 %, 3.234 MPa, respectively. The combination treatment of 1 % ammonium sulphate and 6 % of sucrose produced the best value of rendemen, thickness, water content and the tensile strength. However statistical test showed that there were no significant different among the treatment.
PRODUKSI DAN KARAKTERISTIK FISIK SELULOSA
MIKROBIAL Acetobacter xylinum
SKRIPSI
OLEH
CHANDRA OKTAVIANUS DEBATARAJA 110805071
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENGARUH PENAMBAHAN AMONIUM SULFAT DAN
SUKROSA PADA MEDIA AIR KELAPA TERHADAP
PRODUKSI DAN KARAKTERISTIK FISIK SELULOSA
MIKROBIAL Acetobacter xylinum
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
OLEH
CHANDRA OKTAVIANUS DEBATARAJA 110805071
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
i
Judul : Pengaruh Penambahan Amonium Sulfat dan Sukrosa pada Media Air Kelapa Terhadap Produksi dan Karakteristik Fisik Selulosa Mikrobial Acetobacter xylinum
Kategori : Skripsi
Nama : Chandra Oktavianus Debataraja
Nomor Induk Mahasiswa : 110805071
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, Januari 2016
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dra. Nunuk Priyani, M.Sc Prof. Dr. Erman Munir, M.Sc NIP.196404281996032001 NIP.196511011991031002
Disetujui Oleh :
Departemen Biologi FMIPA USU Ketua
ii
PERNYATAAN
PENGARUH PENAMBAHAN AMONIUM SULFAT DAN
SUKROSA PADA MEDIA AIR KELAPA TERHADAP
PRODUKSI DAN KARAKTERISTIK FISIK SELULOSA
MIKROBIAL Acetobacter xylinum
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2016
iii
Puji dan syukur penulis ucapkan ke hadirat Tuhan YME yang telah memberikan karunia-Nya sehingga penulis dapat menyelesaikan penulisan skripsi ini. Skripsi yang berjudul “Pengaruh Penambahan Amonium Sulfat dan Sukrosa pada Media Air Kelapa Terhadap Produksi dan Karakteristik Fisik Selulosa Mikrobial Acetobacter xylinum” dibuat sebagai salah satu syarat untuk meraih gelar Sarjana Sains FMIPA USU Medan.
Ucapan terimakasih terbesar pertama kali penulis sampaikan kepada kedua orang tua penulis, ayahanda Hotman Debataraja dan ibunda tercinta Hanna br. Nainggolan yang selalu memberikan pengorbanan, dukungan, semangat, kasih sayang dan doa kepada penulis. Kepada adik-adik, Junita Debataraja dan Riogomosdo Debataraja yang selalu mendoakan dan memicu semangat penulis. Kepada seluruh keluarga besar atas segala bantuan yang diberikan baik moril maupun materil kepada penulis.
Terimakasih penulis sampaikan kepada Ketua Departemen Biologi Ibu Dr. Nursahara Pasaribu, M. Sc dan staf pegawai Departemen Biologi FMIPA USU. Terimakasih banyak kepada Bapak Prof. Dr. Erman Munir, M.Sc selaku dosen pembimbing 1 dan Ibu Dra. Nunuk Priyani, M. Sc selaku dosen pembimbing 2 yang telah memberikan bimbingan dan banyak masukan selama pelaksanaan penelitian maupun penyusunan skripsi ini. Ucapan terimaksih juga penulis sampaikan kepada Ibu Dr. It Jamilah, M.Sc dan Bapak Drs. Arlen Hanel Jhon, M. Si selaku dosen penguji yang telah memberikan masukan demi penyelesaian penulisan skripsi ini. Kepada seluruh dosen dan staf pengajar di Biologi USU, terimakasih atas ilmu yang penulis dapatkan selama perkuliahan.
Penulis juga menyampaikan terimakasih kepada teman-teman dan sahabat di Biologi angkatan 2011, Frico Situmeang, Grace Sonia, Grace Lumbantoruan, Poppy, Virza, Steven, Famela, Rasmin, Rani Artha, Imelda, Dewi Olivia, Nisa, Siska Teresya, Titis, Romida, Jordan, Natanael, Taufik, Mujahidin, Nasir, Junet, Luhut, Riski, Feby, Nopi, Corry, Dedek, Khairiyah, Sera, Arisa, Siska Renata, Violita, Suri, Nana, Rinda, Berlina, Maya, Desy Budi, Ribka, Venitha, Nelly, Yentiti, Pufeb, Elsa, Sahrina, Putri Pucil, Siska Dewi, Desi Munthe, Ristia, Gani, Zia, Mesra, Rani Apriani, dan Mariati. Terimakasih atas kesan dan keberagaman yang penulis dapatkan di Biologi USU. Kepada teman-teman asisten Mikrobiologi Aditiya Bungsu, Zulfatun Naimah, Boby Pranoto, Rita SM Pardosi, Novita Wijaya, Dian Pratiwi, Ella Ramadayani, Khairisa “Icha”, Ester Raisa Lase, dan Agung, terimakasih atas dukungan dan kerjasamanya. Kepada abang/kakak asuh Yulliyanti D Silalahi, Adrian Hartanto, dan semua Biologi 2009. Kepada adik asuh Nadya Damanik dan semua Biologi 2013. Kepada seluruh keluarga besar Biologi USU, Biologi 2010, Biologi 2012, Biologi 2014, dan Biologi 2015.
iv
Akhirnya dengan senang hati, penulis mengharapkan kritik dan saran yang bersifat membangun dari semua pihak demi kesempurnaan penellitian dan penulisan skripsi ini. Semoga Tuhan YME membalas semua kebaikan yang kita berikan.
Medan, Januari 2016
v
PRODUKSI DAN KARAKTERISTIK FISIK SELULOSA
MIKROBIAL Acetobacter xylinum
ABSTRAK
Acetobacter xylinum merupakan bakteri penghasil selulosa mikrobial yang telah digunakan pada berbagai industri, seperti industri makanan, kertas, elektronik, farmasi dan biomedis. Studi tentang pengaruh penambahan amonium sulfat dan sukrosa pada media air kelapa terhadap produksi dan karakteristik fisik selulosa mikrobial telah dilakukan. Konsentrasi amonium sulfat yang digunakan adalah 0, 0,5, 1, dan 1,5 % dikombinasikan dengan konsentrasi sukrosa 0, 2, 4, dan 6 %, dilakukan pengkulturan selama 3 hari. Selanjutnya selulosa mikrobial dari masing-masing perlakuan di uji karakteristik fisik berdasarkan rendemen, ketebalan, kandungan air, dan daya tarik. Semakin tinggi konsentrasi sukrosa yang digunakan akan meningkatkan produksi dan kualitas fisik selulosa mikrobial. Konsentrasi amonium sulfat 1 % menghasilkan produksi dan kualitas fisik selulosa mikrobial yang terbaik, akan tetapi dapat menurunkan produksi dan kualitas fisik pada konsentrasi 1,5 %. Rendemen selulosa mikrobial tertinggi yang didapatkan ialah 31,23 %. Ketebalan selulosa mikrobial tertinggi yang diperoleh ialah 8,77 mm. Kandungan air selulosa mikrobial tertinggi ialah 95,54 % dan daya tarik tertinggi ialah 3,234 MPa. Perlakuan penambahan amonium sulfat sebanyak 1 % dan sukrosa 6 % menghasilkan selulosa mikrobial dengan rendemen, ketebalan, kandungan air, dan daya tarik yang lebih tinggi. Namun, hasil uji statistik menunjukkan bahwa perbedaan perlakuan tidak berbeda nyata terhadap rendemen, ketebalan, kandungan air, dan daya tarik.
vi
THE EFFECTS OF AMMONIUM SULPHATE AND SUCROSE
ADDITION INTO COCONUT WATER MEDIA ON THE
PRODUCTION AND PHYSICALCHARACTERISTICS OF
MICROBIAL CELLULOSE BY Acetobacter xylinum
ABSTRACT
Acetobacter xylinum is a bacterium that produces microbial cellulose which has been commonly used in several industries factory such as food industry, paper, electronics, pharmacy, and biomedical. Study about the effects of ammonium sulphate and sucrose addition into coconut water media on the production and physical characteristics of microbial cellulose by Acetobacter xylinum has been conducted. Ammonium sulphate were 0, 0.5, 1 and 1.5 % which were combined with 0, 2, 4, 6 % of sucrose. The cultures were growth for three days. Microbial cellulose of each treatments was analysed based on the physical properties such as rendemen, thickness, water content and tensile strength . The higher sucrose concentration added to the medium, the better production and physical characteristics of microbial cellulose. Concentration of ammonium sulphate 1 % was produce the best quality of microbial cellulose, while 1.5 % decreased the production and the quality of microbial cellulose. The highest rendemen, thickness, water content and the tensile strength of microbial cellulose was 31.23 %, 8.77 mm, 95.54 %, 3.234 MPa, respectively. The combination treatment of 1 % ammonium sulphate and 6 % of sucrose produced the best value of rendemen, thickness, water content and the tensile strength. However statistical test showed that there were no significant different among the treatment.
vii
2.7 Aplikasi Selulosa Mikrobial 10
BAB 3 BAHAN DAN METODE 11
3.3.3 Analisis Karakteristik Fisik Selulosa Mikrobial 12
3.3.3.1 Pengukuran Rendemen 12
3.3.3.2 Pengukuran Ketebalan Selulosa Mikrobial 13 3.3.3.3 Analisis Kandungan Air 13
3.3.3.4 Uji Tarik 13
3.3.4 Pertumbuhan Acetobacter xylinum 13
3.4.5 Pertumbuhan Konsorsium Mikroba 14
BAB 4 HASIL DAN PEMBAHASAN 15
viii
4.2 Ketebalan Selulosa Mikrobial 17
4.3 Kandungan Air Selulosa Mikrobial 19
4.4 Daya Tarik Selulosa Mikrobial 20
4.5 Pertumbuhan Acetobacter xylinum 21
4.6 Konsorsium Bakteri 23
BAB 5 KESIMPULAN DAN SARAN 25
5.1 Kesimpulan 25
5.2 Saran 25
DAFTAR PUSTAKA 26
ix
DAFTAR GAMBAR
Nomor Judul Halaman
1 Struktur Selulosa 4
2 Rendemen Selulosa Mikrobial 15
3 Ketebalan Selulosa Mikrobial 17
4 Kandungan Air Selulosa Mikrobial 19
5 Daya Tarik Selulosa Mikrobial 20
6 Pertumbuhan A. xylinum 22
x
DAFTAR LAMPIRAN
Nomor Judul Halaman
1 Komposisi Media Hestrin Scrahmm (HS) Agar dalam 1 Liter Media
31
2 Uji Statistik ANOVA 32
3 Alur Kerja Penyiapan Starter A. xylinum 33
4 Alur Kerja Produksi Selulosa Mikrobial 34
5 Alur Kerja Pengukuran Rendemen Selulosa Mikrobial 35 6 Alur Kerja Pengukuran Ketebalan Selulosa Mikrobial 36
7 Alur Kerja Pengukuran Kandungan Air 37
8 Alur Kerja Pengukuran Daya Tarik 38
9 Alur Kerja Perhitungan A. xylinum 39
10 Alur Kerja Perhitungan Konsorsium Bakteri 40