ANALISIS KERAGAMAN GENETIK GLADIOL DENGAN
PENANDA RAPD DAN EVALUASI KETAHANAN TURUNAN
DARI BEBERAPA KOMBINASI SILANGAN TERHADAP
FUSARIUM
OLEH:
BAKHTIAR
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
BAKHTIAR. Analisis Keragaman Genetik Gladiol dengan Penanda RAPD dan Evaluasi Ketahanan Turunan dari Beberapa Kombinasi Silangan terhadap Fusarium. Di bimbing oleh Hajrial Aswidinnoor dan Toto Sutater.
Produksi bunga dan subang gladiol sering tidak optimal karena adanya penyakit layu dan busuk subang yang disebabkan cendawan Fusarium oxysporum f sp. gladiolii. Oleh karena itu, penggunaan kultivar tahan merupakan salah satu cam untuk pengendalian penyakit tersebut. Informasi keragaman genetik antar genotipe sangat penting diketahui untuk mendukung program pemuliaan gladiol tahan fusarium. Analisis keragaman genetik secara cepat dan mudah dapat dilakukan dengan RAPD. Dalam program persilangan gladiol sering dijumpai adanya ketidak berhasilan persilangan antar genotipe tertentu, sehingga diperlukan informasi tentang tingkat keberhasilan persilangan dari berbagai kombinasi tetua. Setelah rekombinasi sifat ketahanan terhadap fusarium dengan persilangan, diperlukan seleksi terhadap individu turunannya. Seleksi ketahanan terhadap fusarium pada gladiol, memerlukan waktu beberapa tahun setelah persilangan. Untuk mempercepat prosedur seleksi &lam program pemuliaan gladiol tahan fusarium, seleksi pada tahap semaian sangat memungkinkan dilakukan.
Penelitian ini dilaksanakan di Laboratorium Virologi, Laboratorium Biokontrol, Balai Penelitian Tanaman Hias, Segunung, Kebun percobaan dan rumah plastik Instalasi Penelitian Tanaman Hias (INLITHI) Cipanas dari bulan Oktober 2000 sampai dengan Maret 2002. Penelitian ini bertujuan untuk (1) menduga keragaman genetik beberapa genotipe gladiol koleksi INLITHI Cipanas (2) mempelajari produksi biji sebagai indikasi tingkat keberhasilan persilangan antar beberapa genotipe gladiol, (3) mengembangkan metode seleksi ketahanan terhadap fusarium pada gladiol di tingkat semaian dan (4) mengevaluasi ketahanan terhadap fusarium populasi turudn dari beberapa kombinasi silangan. Untuk i t - penelitian dilakukan dua tahapan percobaan, yaitu (1) Analisis keragaman genetik gladiol dan (2) hibridisasi dan evaluasi ketahanan populasi turunan beberapa kombinasi silangan terhadap fusarium pada tahap semaian.
Analisis pengelompokan berdasarkan hasil amplifikasi dengan menggunakan 9 primer yang menghasilkan 120 lokus polimorfik menunjukkan bahwa 16 genotipe gladiol koleksi INLITHI Cipanas mengelompok menjadi empat kelompok utarna pada tingkat kemiripan 75 %. Kelompok pertama terdiri dari Yester, Yellow, Queen Occer, 623-1, Dayang Sumbi, Holand Merah dan Mirella, Rififi, Priscilla dan White Friendship. Kelompok kedua dan ketiga berturut-turut Silver Jubille dan Rendesvous. Kelompok keempat terdiri dari HWF8, HWF56, PHI9 dan PH75. Koefisien kemiripan genetik antar 16 genotipe glad101 koleksi INLITHI Cipanas yang diuji berkisar 0,69
-
0,89. Genotipe Silver Jubille dan Rendezvous, hasil introduksi dari Belanda tahun 1999 dapat menambah keragaman genetik koleksi plasma nutfah gladiol di INLITHI Cipanas. Kemiripan genetik antar tetua belum &pat menjelaskan tingkat keberhasilan persilangan antar genotipe gladiol. Pembentukan biji akan lebih banyak jika Priscilla, 646-15 dan Holand Merah digunakan sebagai tetua betina dan sebaliknya jika Silver Jubille, Rendezvous, Rififi dan Queen Occer sebagai tetua betina. Seleksi penapisan genotipe tahan terhadap harium dengan kerapatan inokulurn lo3 propagul pergram
tanah dapat dilakukan pada 8 minggu setelah semai. Persentase jumlah zuriat tahan lebih banyak diperoleh dari kombinasi silangan 623-1 x Queen Occer, Queen Occer x 623-1 dan 646-ANALISIS KERAGAMAN GENETIK GLADIOL DENGAN
PENANDA RAPD DAN EVALUASI KETAHANAN TURUNAN
DARI BEBERAPA KOMBINASI SILANGAN TERHADAP
FUSARIUM
OLEH:
BAKHTIAR
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Agronomi
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Analisis Keragaman Genetik Gladiol dengan Penanda RAPD dan Evaluasi Ketahanan Turunan dari Beberapa Kombinasi Silangan terhadap Fusarium
Nama : Bakhtiar
NPR : 99052
Program Studi : Agronomi
Menyetuj ui,
1. Kornisi Pembimbing
Dr.Ir.Hairia1 Aswidinnoor. M.Sc. Ketua
2. Ketua Program Studi Agronomi rogram Pascasarjana
Dr.Ir. Hairial Aswidinnoor. M.Sc.
SURAT PERNYATAAN
Dengan ini saya menjatakan bahwa tcsis yang be judul:
ANALISIS I(ERAGmi4AN GENETIK GLADIOL DENGAN PENANDA RAPD DAN EVALUASI ISETAHAr'AN lTJRmTA?u' GNU BEBERAPA KOMBINASI
SILANGAN TEIZHADAF FUS-Tvf
Adalah benar merupahfi hail karya saya sendiri dan Selum pernah dipublikasih. Scmwi srrmbcr &rii daii informasi yang digunakan telah dinyatakan stoczira jelas dan &pat diperiksa kebenaramya.
RIWAYAT HIDUP
Penulis dilahirkan di Bireuen pada tanggal 1 Nopember 1968 sebagai anak bungsu dari pasangan Ahmad Basyah Ibrahim dan Halimah (Alm). Pendidikan dasar sampai menengah atas diselesaikan di Bireuen Aceh Jeumpa. Pendidikan sarjana ditempuh pada Program Studi Agronomi, Fakultas Pertanian Universitas Syiah Kuala, Banda Aceh dan lulus tahun 1994. Pada tahun 1999 penulis mendapat kesempatan untuk melanjutkan pendidikan di Program Pascasarjana IPB pada Program Studi Agronomi. Beasiswa pendidikan pascasarjana diperoleh dari BPPS Dikti Depdiknas.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala ramat dan karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2000 adalah pemuliaan gladiol tahan fusarium, dengan judul Analisis Keragaman Genetik Gladiol dengan Penanda RAPD dan Evaluasi Ketahanan Turunan dari Beberapa Kombinasi Silangan terhadap Fusarium.
Penulis mengucapkan terima kasih kepada Bapak Dr.Ir. Hajrial Aswidinnoor, M.Sc. dan Dr.Ir. Toto Sutater, MS.,APU., selaku pembimbing yang telah memberikan bimbingan dan saran dalam perencanaaan sarnpai penulisan hasil penelitian ini. Ucapan yang sama penulis sarnpaikan kepada Ir. Dedeh Siti Badriah, M.Si atas bantuan penyediaan bahan tanaman dan saran-sarannya dalam pelaksanaan penelitian di lapangan, Ir. Yoyo Sulyo, MS atas kemudahan pemakaian fasilitas laboratorium, ibu Fitri Racmawati, SP dan ibu Lely, ibu Risna dan sdr. Aang yang telah memberi bantuan dalam pelaksanaan penelitian, ibu Ir. Evie atas bantuannya dalam penyediaan isolat fusarium, dan semua pihak yang telah mendukung pelaksanaan penelitian ini.
Rasa terimakasih yang sangat dalam penulis sampaikan kepada ibunda (alm) dan ayahanda serta seluruh keluarga, atas doa dan kasih sayangnya. Untuk isteri dan anakku tercinta, disampaikan terimakasih dan penghargaan yang talc terhingga atas doa, dorongan, pengorban dan kesabarannya dalam mendamping penulis selama mengikuti pendidikan dan penulisan tesis ini.
Semoga tulisan ini bermanfaat.
Bogor, April 2002
DAFTAR IS1
... DAFTAR TABEL
DAFTAR GAMBAR ...
...
DAFTAR LAMPIRANPENDAHULUAN
Latar Belakang ... ... Tujuan Penelitian
... Hipotesis TINJAUAN PUSTAKA ... Tanaman Gladiol ... Penanda Genetik untuk Analisis Keragaman Tanarnan
... Penyakit Fusarium
... Pengendalian Fusarium pada Gladiol
... Pemuiiaan Tanaman Gladio Tahan Fusarium
ANALISIS KERAGAMAN GENETIK GLADIOL DENGAN PENANDA RAPD
Pendahuluan ... Bahan clan Metode ... ... ...
... Hasil
...
PembahasanKesimpulan
dan
Saran...
HIBRIDISASI DAN EVALUASI KETAHANAN TERHADAP FUSARI-U M
PADA POPULASI KETURUNAN DARI BEBERAPA KOMBINASI SILANGAN GLADIOLPendahuluan ... Bahan dan Metode ...
...
... ..... Hasil
... Pembahasan
Kesimpulan clan Saran ... PEMBAHASAN UMUM ...
... KESIMPULAN DAN SARAN
DAFTAR PUSTAKA ...
vi vii ...
DAFTAR TABEL
1 Genotipe-genoti pe gladiol yang di gunakan dalarn analisis keragaman genetik.. ... 2 Susunan basa primer yang digunakan dan jumlah fragmen DNA
yang teramplifikasi pada masing-masing primer.. ... 3 Genotipe gladiol yang digunakan dalam persilangan ... 4 Persentase keberhasilan persilangan dan jurnlah biji bernas dari
... populasi gladiol hasil silangan
5 Persentase zuriat gladiol tahan dan peka terhadap fusarium dari populasi beberapa kombinasi silangan pada 8 minggu setelah
... semal..
DAFTAR
GAMBAR
Halaman 1 Profil hasil amplifikasi DNA gladiol dengan menggunakan primer
...
...
OPCl9 ; 25
2 Dendogram kesarnaan genetik 16 genotipe gladiol koleksi
INLITHI Cipanas berdasarkan penanda RAPD ... 26 3 Tanaman gladiol yang sehat dan diserang fbsarium pada tahap
semaian ... 3 7 4 Persentase jumlah tanaman layu pada semaian genotipe gladiol yang
digunakan sebagai kontrol tahan dan kontrol peka pada pengamatan ' 39
DAFTAR LAMPIRAN
Halaman 1 Penampilan bunga beberapa genotipe gladiol yang digunakan dalam .
.
...
penelit~an. 60
2 Profil hasil amplifikasi DNA gladiol dengan menggunakan primer
No.5 ... 6 1 3 Profil hasil arnplifikasi DNA gladiol dengan menggunakan primer
PENDAHULUAN
La tar Bela kangTanaman gladiol (Gladiolus hybridus. Hort) merupakan sdah satu komoditas hortikultura wnbi-wnbian yang digunakan sebagai bunga potong dan tanaman taman. Pengembangan gladiol sangat menguntungkan karena mudah dibudidayakan, dapat ditanam pada lahan terbuka, tidak memerlukan naungan dan pada luasan lahan yang relatif sempit masih memberikan keuntungan.
Di Indonesia, gladiol dapat dibudidayakan di daerah dataran tinggi sepanjang tahun. Pusat produksi bunga gladiol di antaranya di Cipanas (Cianjur), Selabintana (Sukabumi), Lembang, Parongpong (Bandung) Jawa Barat, di Bandungan Jawa Tengah, di Batu dan Pujon Jawa Tirnur, di Brastagi Sumatera Utara dan di Malino Sulawesi Selatan.
Permintaan bunga potong di dalam negeri cenderung meningkat setiap tahun, terutama di kota bear seperti Jakarta, Bandung, Medan, Surabaya, Sernarang dan Denpasar. Daya serap pasar di Indonesia terhadap bunga potong gladiol mencapai 127.200 tangkai per minggu (BCI dan Nehem, 1989) apalagi pada hari-hari besar sering mencapai 20 - 30 kali dari hari-hari biasa (Hasyim, 1989). Hal ini akan memacu pertumbuhan ekonomi petani penanam bunga, industri tanaman hias dan pendapatan daerah.
gladiol cukup besar, di Florida Amerika Serikat bisa mencapai 1,s juta dolar setiap musim (Pirone, 1978), sedangkan di Indonesia penyakit ini dapat mengakibatkan kerugian sampai 100 % (Djatnika, 1989).
Usaha untuk mengatasi penyakit layu dan busuk subang dilakukan dengan beberapa cara untuk membatasi infeksi oleh fusarium pada bahan tanam. Di antaranya adalah anak subang yang telah dicuci bersih segera direndam &lam air hangat, subang dapat direndam dalam fungisida setelah panen dan sebelum tanam dan fimigasi lahan (Wilfret, 1992; MacKay and Hughes, 1982). Di samping itu, rotasi tanam dianjurkan untuk menghmdari endemik, tetapi dalam jangka waktu pen&k tidak optimal (Kartapraja, Sutater dan Djatnika, 1996). Penggunaan kultivar tahan merupakan strategi yang ekonomis, ramah lingkungan clan efektif untuk pengendalian penyakit (Agrios,
1996).
Kultivar gladiol yang tahan terhadap h a r i u m di Indonesia saat ini sangat jarang ditemukan dan keragaman karakter bunga juga terbatas. Sedangkan pemintaan gladiol sebagai bunga potong selalu menghendaki sesuatu yang baru, karena selera konsumen cepat berubah dari waktu ke waktu. Hal tersebut menjadi tantangan bagi pemulia untuk merakit kultivar barn yang lebih beragam secara terus menerus.
RAPD (Random Amplrjied Polymorphic DNA) merupakan salah satu penanda molekuler yang menggunakan prinsip kerja mesin PCR yang mampu mengamplifikasi
DNA genom dengan menggunakan primer tunggal dari sequen nukleotida acak (Williams et al., 1990). RAPD sangat banyak digunakan untuk analisis keragaman genetik dan organisasi plasma nutfah tanaman. Sampai saat ini, informasi keragaman genetik dan hubungan kekerabatan antar kultivar gladiol pada tingkat DNA sangat terbatas.
Untuk mendapatkan keragaman berbagai sifat bunga gladiol seperti warna, bentuk bunga yang lebih bervariasi dan ketahanan terhadap penyakit diperlukan genotipe-genotipe yang tidak berkerabat dekat untuk dijadikan sebagai tetua persilangan. Tanaman gladiol biasanya dapat disaling-silangkan antar kultivar (Herlina, 199 l), tetapi sering juga dijumpai dari persilangan tersebut yang tidak berhasil. Persilangan dilakukan
untuk menggabungkan sifat ketahanan terhadap fusarium dan sifat bunga yang diinginkan konsumen. Setelah persilangan, perlu
dilaLulran
selelisi terhadap iddividu keturunan hasil silangan untuk mengetahui tingkat ketahanan terhadap h a r i u m yang akan dikembangkan sebagai kultivar baru.Penentuan tingkat ketahanan terhadap penyakit pada tanaman gladiol biasanya baru dapat dilakukan beberapa tahun setelah dibuat persilangan, sedangkan seleksi untuk karakteristik bunga baru dapat dilakukan 4 - 5 tahun setelah persilangan (Straathof, et al., 1997). Hal ini mengakibatkan waktu yang dibutuhkan sangat lama, sehingga seleksi pada tahap semaian akan sangat membantu pemulia tanaman gladiol untuk mempersingkat waktu dan mengurangi biaya.
terhadap fusarium pada tingkat semaian dapat digunakan untuk memperkirakan tingkat ketahanan populasi keturunannya terhadap fusarium (Straathof et al., 1997), dan mempercepat seleksi ketahanan gladiol teihadap fharium (Badriah, et al., 1998).
Tujuan Penelitian
1. Menduga keragaman genetik beberapa genotipe gladiol koleksi INLITHI Cipanas dengan penanda RAPD.
2. Mengetahui tingkat keberhasilan persilangan dari beberapa kombinasi silangan antar beberapa genotipe gladiol
3. Mengembangkan metode penapisan genotipe gladiol tahan fusarium pada tahap semaian
4. Mengevaluasi ketahanan populasi kelanmm hasil silangan beberapa genotipe gladiol terhadap fusanum.
Hipotesis
1. Keragaman genetik antar genotipe gladiol koleksi INLITHI Cipanas sangat tinggi. 2. Tingkat keberhasilan persilangan antar genotipe yang mempuyai jarak genetik yang
dekat akan lebih tinggi.
TINJAUAN
PUSTAKA
Tanaman GladiolGladiol merupakan tanarnan semusim yang sangat cocok digunakan sebagai bunga potong ataupun sebagai tanaman taman. Hal ini disebabkan karena gladiol memiliki wama, bentuk dan ukuran bunga yang sangat bervariasi yang sangat jarang ditemukan pada tanaman hias lainnya. Gladiol dapat menghasilkan bunga dengan berbagai warna, kecuali biru, hitam dan coklat, bahkan satu bunga bisa memiliki dua sampai tiga kombinasi warna (Wilfret, 1992). Bentuk bunga bundar, segitiga, dan seperti bunga anggrek, pinggr mahkota bunga juga bervariasi seperti keriting, rata, agak membengkok dan lancip. Tangkai bunganya panjang dan bunga tersusun rapi di sepanjang tangkai mulai agak jarang sampai rapat dengan susunan bunga yang simetris (Herlina, 199 1 ).
Gladiol berasal dari Afrika Selatan kemudian menyebar ke daratan Asia sampai ke Eropa dan berkembang dengan baik di Belanda. Gladiol juga sudah dibudidayakan secara komersial sebagai bunga potong di Amerika yang bibitnya berasal
dari
silangan di Eropa (Wilfiet, 1992). Nama gladiol berasal dari bahasa Latin yang berarti pedang kecil yang mengacu pada bentuk daunnya yang sempit dan panjang seperti pedang, sehingga gladiol juga dikenal dengan nama lili pedang (Suardi, 1999).Dalarn taksonomi gladiol dimasukkan ke dalam dunia Plantae, divisi Traheophyta, subdivisi Pteropsida, kelas Angiospermae, subklas Monocotyledonae, ordo Iridales, famili Iridaceae, genus Gladiolus, dan spesiesnya sangat banyak di antaranya Gludiolus b.bridus, Gludiolus grundflorus dan lain-lain (Badriah, 1995). Pada umumnya jumlah set kromosom gladiol yang berasal dari Afiika adalah n = 15 sehingga
ternyata memiliki kromosom 60 sampai 130 yang termasuk tanarnan poliploid. Dengan demikian diperkirakan spesies Afrika merupakan nenek moyang genus gladiol (Goldblatt, Tekei and Razzaq, 1993).
Hibrida gladiol modem mempakan polihibrida yang dikenal dengan Gladiolus grandrflorrus atau gladiol berbunga besar yang di peroleh dari persi langan interspesies dengan melibatkan 11 spesies (Wilfret, 1992). Gladiol yang dibudidayakan oleh petani di Indonesia merupakan kultivar yang diintroduksi dari luar negeri yang sudah berlangsung sejak puluhan bahkan mungkin ratusan tahun silam dan masih berlangsung sampai sekarang (Badriah, 1995).
Kultivar-kultivar yang banyak berkembang di Indonesia diantaranya adalah Queen Occer, Piscilla, Holand Merah, White Friendship, Dr. Mansoer dan lain-lain. Kultivar Dayang Sumbi memiliki bunga berwarna merah cerah yang merupakan hasil persilangan yang dilakukan oleh INLITHI Cipanas antara tetua betina Groene Specht (introduksi dari Belanda tahun 1986) dengan tetua jantan Dr. Mansoer yang banyak ditanam di Lembang dan Bandung (Badriah et al., 2000).
S i k h hidup gladiol berlangsung selama 16 - 18 minggu. Pada umur 3
-
5 minggu setelah bibit subang ditanam tumbuh tunas baru. Setelah 12 - 14 minggu sudah mulai berbunga. Pada umur 16 - 18 minggu gladiol akan membentuk subang dan beberapa anak subang baru, sedangkan subang lama akan mengkerut dan mati. Subang bam tersebut terus membesar dan dapat mencapai diameter 3 cm atau lebih yang nantinya dapat dijadikan sebagai bibit baru setelah mencapai masa dormansi selarna dua sampai empat bulan di penyimpanan (Herlina, 199 1 ).dalam rangka perluasan keragaman genetik dan mendapatkan kultivar baru. Hal ini disebabkan tanaman hasil perbanyakan generatif hanya bisa menghasilkan anak subang yang berdiameter kecil yaitu 1 cm. Sedangkan subang yang bisa langsung menghasilkan bunga ukuran standar hams berdiameter 3 cm atau lebih. Untuk msndapatkan subang yang berdiameter besar diperlukan beberapa siklus hidup yang membutuhkan waktu sekitar 2 - 4 tahun setelah persilangan. Perbanyakan vegetatif bisa langsung menghasilkan bunga dengan ukuran standar yang biasanya dilakukan dengan menggunakan subang utuh, subang belah, anak subang dan teknik kultur jaringan (Herlina dan Heryanto, 1995).
Penanda Genetik untuk Analisis Keragaman Tanaman
Dalam pemuliaan konvensional, identifikasi sumber keragaman genetik yang
akan dijadikan sebagai tetua untuk mendapatkan genotipe unggul biasanya dilakukan
identifikasi secara morfologi dan sitogenetika. Dalam rangka menambah informasi yang lebih banyak, menelusuri genotipe unggul yang ads dalam plasma nutfhh pada
At
ini telah banyak digunakan identifikasi dengan isozirn dan molekuler.Tanaman &pat diidentifikasi secara morfologi karena adanya kemudahan dalam mengamati perbedaan-perbedan antar tanaman secara visual. Identifkasi secara morfologi telah digunakan secara luas dalam pemuliaan tamman seperti jumlah anakan, karakteristik batang, daun, bunga, buah, biji, dan lain sebagainya. Namun demikian, hanya karakteristik morfologi yang dikendalikan oleh lokus tunggal dan ekspresinya sama pada berbagai lingkungan yang dapat digunakan sebagai penanda genetik (Staub et al., 1996).
tanaman secara visual. Oleh karena itu diperlukan pengalaman yang banyak dan kejelian yang tinggi dalam mengamati tanaman. Di samping itu penanda morfologi merniliki kelemahan karena dipengaruhi oleh tahap perkembangan tanaman dan lingkungan sehingga kadangkala tidak dapat dibedakan antar genotipe yang diamati karena secara morfologi kelihatannya sama, tetapi sebenarnya berbeda akibat sifat resesif yang tertutup oleh sifat dominan.
Penanda sitogenetika juga sering digunakan dalam kajian genetika dan pemuliaan tanarnan yang berhubungan dengan karakteristik kromosom. Penanda sitogenetika yang sering digunakan untuk membedakan antar spesies tanaman adalah jumlah, bentuk, ukuran clan prilaku lcromosom (Moore, 1976). Namun demikian penggunaan penanda sitogenetika j u g memiliki kelemahan karena prosedur sitogenetika yang biasa dilakukan sering juga tidak dapat membedakan adanya sisipan bagian kromosom yang pindah silang sehingga terjadinya rekombinasi suatu sifat. Oleh karena itu para ahli
terus
mengembangkan penanda genetik lainnya yang dapat digunakan secara lebih tepat untuk mengidentifikasi keragaman genetik tanaman.Isozim merupakan enzim-enzim yang mengkatalis reaksi yang sama tetapi mempunyai struktur kimia, berat molekul
dan
muatan listrik yang berbeda-bedakodominan sehingga bisa membedakan individu homozigot dari yang heterozigot (Bustamam dan Moeljopawiro, 1998).
Penanda isozim telah banyak digunakan pemulia tanaman dalam mempelajari keragaman individu tanaman dalam sebuah populasi, mengidentifikasi kultivar, membuat peta genetik, klasifikasi plasma nutfah, mendeteksi rekombinasi genetik dari persilangan kerabat jauh (Pierce and Brewbaker, 1973). Penanda isozim juga masih memiliki banyak kelemahan karena hasil polimorfismenya masih dipengaruhi oleh tingkat perkembangan tanaman, jenis jaringan sampel yang digunakan dan sebagian besar tanaman memperlihatkan keragaman pita yang relatif sempit (Staub et al., 1996). Oleh karena itu untuk keperluan cakupan yang lebih luas, pemanfaatan penanda isozim
akan
terbatas, tetapi keterbatasan ini selanjutnya diperbaiki dengan menggunakan penanda molekuler.Penanda molekuler kadang-kadang dikenal sebagai sidik jari DNA karena mengacu pada pita polirnorfisme berupa h g m e n DNA Keunggulan utarna penanda molekuler adalah keakuratan yang tinggi dan tidak dipen- oleh lingkungan (Bustamam dan Moeljopawiro, 1998), Penanda molekuler dapat diuji pada berbagai tingkat perkembangan tanaman, pada pengujian ketahanan terhadap hama clan penyakit tidak tergantung pada organisme pengganggu, seleksi pada tingkat genotipe dapat mempercepat proses seleksi dan hemat dalarn pengujian lapangan seianjutnya (Wattimena, 1999).
Pengkajian keragaman genetik berdasarkan penanda molekuler dapat dilakukan
Analisis penanda molekuler dengan RFLP hampir sama dengan isozim bersifat kodominan tetapi polimorfismenya lebih besar daripada isozim dan dapat digunakan untuk menyusun peta keterpautan antara sifat morfologi dengan penanda RFLP (Tanksley et ul., 1989).
T e h k RFLP memiliki kelemahan karena memerlukan koleksi pustaka DNA pelacak, melibatkan hibridisasi southern blot, visualisasi menggunakan bahan radio aktif atau chemiluminescent, pemakaian enzim-enzim restriksi, memerlukan ketrampilan yang tinggi, banyak menyita waktu dan tenaga kerja sehingga relatif mahal (Demeke and Adam, 1994). Sebaliknya, RAPD memiliki keunggulan karena biaya pelaksanaannya relatif murah, teknik pengerjaannya sederhana, prosesnya cepat, hanya memerlukan DNA dalam jumlah yang sedikit, tidak menggunakan radioaktif, tidak memerlukan pelacak dan enzim restriksi dan tidak memerlukan informasi urutan DNA sebelurnnya (Gallego and Martinez, 1996). Kelemahannya adalah data yang dihasilkannya tidak spesifik dan tidak kodominan karena tidak dapat membedakan genotipe homozigot dominan dengan genotipe heterozigot (Vogel et al., 1996).
Penan& RAPD dihasilkan dari penempelan primer acak tunggal yang panjangnya 10 nukleotida ke DNA sampel komplementernya kemudian diamplifikasi dengan PCR (William er al., 1990). Fragmen DNA hasil amplifikasi dapat dipisahkan dengan elektroforesis pada gel agarosa atau poliakrilamid dan divisualisasikan dengan ethidium bromi& di atas UV-tmnsluminator atau dengan perak nitrat (Staub et ul.,
1996).
(Koch and Jung, 1997), keragaman genetik dan evaluasi organisasi plasma nutfah (Okuno et ul., 1998), hubungan genetik antar kultivar pepaya (Stiles et al., 1993) dan sebagainya.
Penyakit Layu Fusarium
Penyakit layu fusarium pada gladiol dijumpai di berbagai negara penghasil bunga gladiol seperti Belanda, Italia, Arnerika Serikat, India, dan di Indonesia juga tidak luput dari penyakit ini (Maryarn dan Djatnika, 1995). Penyakit layu fusarium merupakan penyakit utama yang menyerang gladiol, yang disebabkan oleh cendawan Fusarium oxysporum f sp. gladioli (Straathoff et al., 1997). Patogen ini dapat menyebabkan kehilangan produksi subang dan bunga yang sangat besar bukan hanya pada gladiol tetapi juga pada spesies Iridaceae lainnya seperti Babiana, Croczls, Freesia, Iris, Ixia, Sparaxis, Stepthathera dan Watsonia (McClelland, 1945).
Fusarium terrnasuk subdivisi Deuromycotina yaitu cendawan yang tidak
sempurna karena hanya memiliki daur aseksual saja dan dikelompokkan dalarn kelas
Hypomyetes, ordo Hyphales yaitu cendawan yang menghasilkan spora aseksual pada
atau di dalam hifa dan genus Alternaria yaitu penyebab bercak dan hawar daun.
Fzlsarium oxysprum merupakan patogen tular tanah yang menyebabkan penyakit layu
dan busuk akar pada kebanyakan tanaman semusim (Agrios, 1996).
ada yang seperti silinder biasa atau gem& pendek, bercabang tidak beraturan, makrokonidianya sedikit melengkung dan ujungnya bengkok, sedangkan mikrokonidianya berbentuk oblong (Barnett, 1960).
Spesies Fwarium oxysporum dibedakan menurut formae spesiales untuk menggambarkan kemiripan patogen tersebut secara morfologi yang menyebabkan penyakit pada tanaman yang berbeda, sehingga dinamakan sesuai dengan spesies tanaman yang diserangnya (Kistler, 1997). Kebanyakan dari formae spesiales tersebut menyebabkan layu dan menyurnbat pembuluh tanaman inang (McClelland, 1945).
Infeksi terjadi pada saat spora cendawan berkecambah dan mas& ke dalam jaringan tanaman melalui bagian dasar atau buku-buku subang dan luka (MacHardy and Beckman, 198 1).
Pada gladiol yang diifeksi fUsarium tam* ada nekrosis pada ujung daun yang diikuti dengan perubahan warna dam menjadi hijau kekuningan. Bagian tanaman di atas pemukaan tanah tumbuh melengkung clan pertumbuhan tamman kerdil dan mudah patah dan menghasilkan bunga yang cacat. Pada serangan lebih lanjut pangkal batang membusuk, berwarna kehitarnan kemudian rebah dan mati (Badriah, 200 1). Infeksi pada awal pertumbuhan tanaman akan mempengaruhl pembentukan bunga, sedangkan infeksi pada tahap lebih lanjut hanya mempengaruhi produksi subang, sehingga masih memunglunkan untuk memanen bunga (Remotti, 1996).
membusuk kemudian mengering, sehingga kulit subang mengeriput dan menjadi liat seperti mumrni, kalau dijatuhkan ke benda keras akan berbunyi seperti batu dijatuhkan (Badriah, 200 1 ).
Patogen h r i u m &pat menyebar melalui sisa bahan tanam, tanah terinfebi, air siraman atau alat-alat pertanian. Di tempat penyimpanan, satu subang yang terinfeksi akan menularkan penyakit tersebut ke seluruh subang lainnya (Maryam dan Djatnika, 1995). Patogen ini juga merupakan penginfeksi laten di dalam subang, sehingga penyakit ini sangat mudah meyebar di daerah pertanaman gladiol, walaupun ditanam pada lahan yang belum terinfeksi sebelumnya ( Remotti, 1996).
Pengendalian Fusarium pada Gladiol
Pengendalian penyakit layu fusariurn telah dilakukan dengan cara penanaman bahan tanam dan lahan yang bebas patogen fusarium. Lahan dijaga agar tetap bersih dan membuang tanaman yang terserang untuk mengurangi inokulum fusarium dan penyemprotan dengan fungisida (Maryam dan Djatnika, 1995). asinfeksi subang dan pembersihan lahan (McKay and Hughes, 1982), dan rotasi tanam O(artapraja et al., 1996) juga sering diterapkan untuk pengendalian k r i u m .
Disinfeksi subang biasanya dilakukan dengan m e n m a n bahan kimia. Sebelum digunakan sebagai bibit, subang yang akan ditanam bisa direndam dalam suspensi pestisida. Anak subang dapat direndam dalam air hangat yang mengandung 5% alkohol (Pirone, 1978) yang diperkirakan dapat meminimalkan terbawanya patogen ke lapangan. Pemakaiaan pestisida yang terus menerus akan mengganggu keseimbangan lingkungan akibat matinya organisme lain yang bukan target pengendalian dan menambah polusi lingkungan di samping juga biayanya mahal.
Penggenangan lahan dengan air dan fumigasi lahan dengan pestisida dapat dilakukan untuk menghllangkan infeksi ataupun kontaminasi lahan oleh fusarium. Penggenangan lahan dilakukan sebelum penanaman gladiol sehinga diperkirakan h a r i u m yang ada di &lam tanah akan kekurangan oksigen dan akhirnya mati. Namun demikian, ha1 ini sulit dilakukan terutama karena penanaman gladiol biasanya pada daerah dataran tinggi yang kontur tanahnya berbukit-bukit serta tidak ada irigasi. Fumigasi lahan dengan metilbromida juga sering dilakukan terutama pada lahan yang relatif sempit karena biayanya sangat mahal clan menyebabkan polusi tanah.
Penanaman gladiol pada lahan bebas fusariurn dapat dilakukan untuk menghambat penyebaran M u m dan menghlndari kerusakan gladiol yang lebih parah. Untuk itu penanaman gladiol tidak dilakukan terus menerus pada lahan yang sama. Rotasi tanam dapat menghmdari terjadinya endemik fusarium pada suatu areal tertentu dan diperkirakan dapat memutuskan s i b hidup fUsarium, tetapi dalarn jangka waktu pendek kurang memuaskan (Kartapraj a, et al., 1996).
tanah (Schippers and van Eck, 198 1; Booth, 1971). Di samping itu, dengan rotasi tanam mengakibatkan setiap musim tanam petani hams mencari lahan baru dan selalu berpindah-pindah untuk menanam gladiol pada lahan yang berbeda-beda. Akibatnya, petani harus mengeluarkan biaya tambahan untuk sewa lahan baru dan biaya produksi lainnya.
Perkembangan fusarium akan pesat pada pemupukan nitrogen yang tinggi (Nelson, Horst and Woltz, 1981), kondisi lingkungan yang lembab dan penggunaan kultivar rentan (Maryam dan Djatnika, 1995). Dengan demikian untuk membatasi perkembangan penyakit fusarium dapat dilakukan pemupukan nitrogen yang rendah, dan penanam pada musim kering. Namun demikian, hal tersebut akan membatasi perturnbuhan gladiol dan ketersediaan bunga potong setiap saat tidak terjamin sehingga
bisa merugikan petani. Akibatnya semua usaha-usaha di atas belum memberikan hasil yang maksimal dalam pengendalian penyakit f h r i u m pada gladiol.
Penggunaan kultivar gladiol yang tahan terhadap fusarium merupakan salah satu alternatif pengendalian f h r i u r n yang lebih ekonomis dan ramah lingkungan (Agrios, 1996). Selama ini, kultivar gladiol yang dibudidayakan petani di Indonesia kebanyakan adalah kultivar yang peka terhadap fusarium. Hasil pengujian pada tahun 1996 terhadap beberapa kultivar yang ditanarn petani ternyata belum ada kultivar yang tahan (Badriah, Djatnika dan Permadi 1996). Kultivar Mirella termasuk yang tahan, tetapi h a n g diminati petani karena bunganya kecil dan tangkainya lemah sirta sulit disilangkan dengan kultivar lainnya, sehingga kultivar ini sulit ditemukan di lapangan.
Pemuliaan Tanaman Gladiol Tahan Fusarium
nutfah, introduksi, hibridisasi dan pengujian adaptasi. Koleksi plasma nutfah terhadap gladiol yang telah lama beradaptasi di Indonesia dilakukan dalam rangka mengumpullcan plasma nutfah yang ada untuk dikarakterisasi dan digunakan sebagai tetua dalam persilangan-persilangan. Sampai dengan tahun 1995 lebih kurang ada 50 kultivar yang diusahakan oleh petani di Indonesia (Badriah, 1995).
Introduksi kultivar-kultivar baru biasanya dilakukan dari Belanda sebagai penghasil bunga gladiol terbesar di dunia. Introduksi bertujuan untuk menambah keragaman genetik dan koleksi plasma nutfah. Sampai tahun 1994, Balai Penelitian tanaman Hias (BALITHI) telah mengintroduksi sebanyak 20 kultivar. Narnun dernikian tidak semuanya berkembang dengan baik karena peka terhadap penyakit layu b a r i u m dan daya adaptasinya tidak baik. Pada tahun 1999 BALITHI mengintroduksi kembali 10 kultivar baru (Badriah, 200 1).
Hibridisasi pada tanaman gladiol dilakukan dalam rangka mendapatkan tipe-tipe barb khususnya memiliki estetika yang tinggi dari segi variasi warna, ukuran, bentuk, produksi bunga dan penampilan yang lebih memenuhi selera konsurnen atau juga memiliki keistimewaan tertentu seperti warna bunga variegata. Di sarnping itu, kepentingan utama dalam hibridisasi adalah untuk mendapatkan kultivar yang tahan terhadap penyakit terutama b a r i u m (Badriah, 1995).
gen aditif (Armstrong and Armstrong, 1981). Pada gladiol, belum ada informasi, tetapi diperkirakan aksi gen ketahanan terhadap fusarium sesuai dengan model aditif (Straathof at al., 1997).
Pengujian ketahanan gladiol terhadap b a r i u m telah banyak dilakukan dengan cara inokulasi buatan. Tanah di lapang diinfestasikan dengan inokulum fusarium atau pada lahan bekas pertanaman gladiol yang terserang berat sebelurnnya. Untuk pengujian subang gladiol ditanarn pada lahan tersebut, selanjutnya diamati tingkat kelayuan tanaman atau tingkat pembusukan subang (Badriah et al., 1996). Namun demikian ha1 tersebut dilakukan pada Mtivar yang sudah ada. Di samping itu, dengan metode tersebut kemunglunan 1010s dari serangan penyakit lebih tinggi dan kehomogenan tekanan seleksi tidak dapat te rjamin. Sedangkan pada klon-klon harapan atau pada awal program pemuliaan metode tersebut tidak bisa diterapkan.
Metode untuk lebih mengefisienkan clan mempercepat pengujian tingkat ketahanan terhadap M u m bisa dilakukan pada tahap sernaian Dengan ietode tersebut biji hasil silangan langsung dapat diuji, sehingga pemulia secara langsung dapat menyeleksi hasil silangan yang peka dan hanya yang tahan yang dilanjutkan untuk pengujian tahap berikutnya. Dengan dernikian pemulia tidak menghabiskan waktu, tenaga dan biaya untuk pemeliharaan populasi hasil silangan yang peka.
ANALISIS KERAGAMAN
GENETIK
GLADIOL DENGAN
PENANDA RAPD
ABSTRAK
Informasi keragaman genetik antar genotipe sangat penting untuk mendukung program pemuliaan gladiol tahan fusariurn. Analisis keragaman genetik secara cepat dan mudah dapat dilakukan dengan RAPD. Penelitian ini bertujuan untuk menduga keragaman genetik beberapa genotipe gladiol koleksi INLITHI Cipanas. Analisis pengelornpokan berdasarkan fiagrnen DNA hasil amplifikasi dengan 9 primer yang menghasilkan 120 lokus polimorfik menunjukkan bahwa 16 genotipe gladiol koleksi INLITHI Cipanas mengelompok menjadi empat kelompok utarna pada tingkat kemiripan 75 %. Kelompok pertama terdiri dari Yester, Yellow, Queen Occer, 623-1, Dayang Sumbi, Holand Merah dan Mirella, Rififi, Priscilla dan White Friendship. Kelompok kedua dm ketiga berturut-
turut Silver Jubille dan Rendesvous. Kelompok keempat terdiri dari HWF8, HWF56, pH19 dan PH75. Koefisien kemiripan genetik 16 genotipe gladiol koleksi INLITHI Cipanas berkisar 0,69 - 0,89, namun demikian masih memunglunkan untuk memanfaatkan koleksi tersebut dalam merakit kultivar baru dengan berbagai karakteristik bunga.
PENDAHULUAN
Tanaman gladiol (Gladiolus hybridus. Hort) merupakan salah satu komoditas hortikultursr yang digunakan sebagai bunga potong dan tamman taman. Gladiol menempati urutan ke empat setelah mawar, krisan dan sedap malam sebagai bunga potong komersial yang diperdagangkan di pasaran dalam negeri (Abidin dan Harahap, 1991). Di samping itu, gladiol juga mudah dibudidayakan, dapat ditanarn pada lahan terbuka dan pada luasan lahan yang relatif sempit masih memberikan keuntungan.
Permintaan bunga potong lalu menghendaki sesuatu yang baru dan lebih beragam dari segi warna, bentuk, jumlah bunga, kuntum yang susun teratur dan simetris, tangkai yang panjang, kesegaran yang lama dan mudah pengepakannya (Pratiwi dan Sarimo, 1989). Kultivar dengan karakteristik bunga sesuai keinginan konsumen menjadi tantangan bagi pemulia tanaman hias untuk merakit kultivar baru. Dalarn merakit kultivar, pemulia memerlukan informasi keragaman genetik antar bahan pemuliaan untuk mernilih tetua yang akan disilangkan (Brown-Guedira et al., 2000).
RAPD (Random Amplrfied Polymorphic DNA) merupakan salah satu penanda molekuler yang dapat digunakan untuk menduga keragaman genetik antar genotipe tanaman (Williams et al., 1990). RAPD telah digunakan untuk menganalisis keragaman genetik
dan
kekerabatan antar kultivar berbagai jenis tanaman seperti pada Vaccinizm augustifolium Aiton (Burgher, Jamieson andLy
2002), bunga aster (Gettys and Werner, 2001), buah plum (Boonprakop, et al., 2001), ape1 (Oraguizie et al., 2001), duku (Song et a1.,2000), bunga mawar (Debener, Bartels and Mattiesch, 19%), bunga poinsettia (Jing-Tian, Sawe and Gawel, 1997), pepaya (Stiles et al., 1993) dan sebagainya.RAPD memiliki beberapa kelebihan karena teknik pengerjaannya sederhana, relatif murah, cepat, hanya memerlukan sedikit DNA, tidak melibatkan penggunaan
- .
radioaktif, mudah dilakukan. Di samping itu analisis RAPD juga tidak memerlukan pelacak dan enzim restriksi, dapat dilakukan pada berbagai tahap pertumbuhan tamman dan tidak mernerlukan inforrnasi sequen DNA sebeluninya (Gallego and Martinez, 1996). Polimorfisme yang dihasilkan RAPD juga lebih tinggi dibandingkan isozim (Fuentes et al., 1999).
luas karena memiliki berbagai variasi warna bunga. Oleh karena itu penelitian ini bertujuan untuk menduga keragaman genetik beberapa genotipe gladiol koleksi INLITHI Cipanas pada tingkat DNA dengan menggunakan penanda RAPD.
BAHAN DAN METODE
Materi TanamanBahan tanam yang digunakan dalam penelitian ini terdiri dari delapan genotipe gladiol yang telah beradaptasi di Indonesia, empat genotipe introduksi dari Belanda tahun 1999 dan empat genotipe hasil persilangan yang dilakukan oleh INLITHI Cipanas. Semua bahan tanam tersebut merupakan koleksi INLITHI Cipanas dengan karakter bunga dan tingkat ketahanan terhadap fharium yang berbeda-beda (Tabel 1).
Ekstraksi DNA
DNA total diekstraksi
dari
daun gladiol dengan menggunakan metode Doyle andDoyle (1987) dengan sedikit modifikasi pada peningkatan konsentrasi
P-
mercaptoethanol dari O,2 % menjadi 2 %. Sebanyak 0,3 g daun muda dimasukkan ke &lam tabung eppendorf 1,s mL dan dilurnatkan dengan ujung besi yang terbuat dari stainless steel kemudian ditambahkan 700 pL buffer CTAE3 [ 100m M
Tris-HC1 pH 8,O;1,4 M NaCI; 20
m M
EDTA; 2 % (blv) CTAE3; yang sebelumnya dipanaskan pada suhu65' C dan 2 % P-mercaptoethanol yang ditambahkan pada s a t melakukan ekstraksi].
Tabel 1. Genotipe-genotipe gladiol yang digunakan dalam analisis keragaman genetik
NO.
( Genotipe ( Warna bunga ( KetahananI
Keterangani
thd Fusariurn
1
1I
ester1
Kuning1
-
1
Sudah berdaptasiI
I
Queen OccerI
Orange1
Tahan(
Sudah berdaptasiI I I I
1
623-1I
Merahhning/
Sangat tahanI
Introduksi 1999I I I I
7
I
Dayang SumbiI
MerahI
Agak pekaI
Sudah berdaptasi KuningYellow
I
Mirella/
Merah/
TahanI
Sudah berdaptasiI I I I
-
-- -
Holand Merah
I
Silver JubilleI
PinkI
Agak tahanI
Introduksi 1999 Sudah berdaptasi1
91
Rendez-vousI
Pink1
TahanI
IntmduLsi 1999I
-
Merah Sangat peka
11
16
1
pH75Sumber : Badriah (2001)
Sudah berdaptasi
Priscilla
12 Sudah berdaptasi
1
White Friendship
Merdputih
I
-
1
Holand Merah x White FreinshipI 1
Mer-g
-
Merah berbintik
Untuk memisahkan larutan DNA dengan kotoran lainnya ditambahkan
klorofodisoamilalkohol (24 : 1) sebanyak 700 pL dan digoyang-goyang sampai terbentuk emulsi kemudian disentrifugasi pada kecepatan 15.000 rpm selama 15 menit pada suhu niang. Larutan bagian atas dipipet dan dimasukkan ke dalam tabung yang baru kemudian ditambahkan 750 pL isopropanol dingin dan digoyang-goyang secara
perlahan.
Pengendapan DNA dilakukan dengan sentrifugasi pada kecepatan 15.000 rpm selama 15 menit pada suhu ruang. Larutan bagian atas dibuang dan pellet dicuci dengan
Holand Merah x White Freinship
M e r d kuning
I
-
I 1
-
Priscilla x Holand Merah Priscilla x Holand Merah
200 pL ethanol 70 % dengan cara menggoyang-goyang dan disentrifugasi 10.000 rpm selama 10 menit kemuQan ethanol 70 % dibuang dengan cara dipipet. Endapan DNA dikeringkan dengan cara membalikkan tabung di atas kertas tisue dan divacurn 10 menit sampai kering. Endapan DNA dilarutkan dengan 50 pL aquabides dengan cara digoyang-goyang secara perlahan dan dinkubasi selama 30 menit atau pada suhu 3 7 ' ~ selama satu malam.
Amplifikasi DNA
DNA diamplifikasi dengan menggunakan primer acak (Amersham Pharnacia Biotech) yang terseleksi pada penelitian sebelumnya (Sutater et al., 2000; Tabel 2). Reaksi amplifikasi dilakukan dengan menggunakan 25 pL campuran larutan PCR yang terdiri dari beads (Amersham Pharmacia Biotech), 25 pmol primer (5 pmoVpL), 2 pL
DNA cetakan, dan 18 pL dH2O sampai volume akhir 25. Setiap beads telah mengandung iimPli~aqm DNA polimerase clan Stoffel flagmen, d N T P s (masing- masing dATP, dCTP, dGTP, dan dTTP 0,4 mM dalam 25 pL), 2,5 pg bovine serum albumin (BSA) dan buffer (3 mM MgC12, 30 mM KC1 dan 10 mM Tris, pH 8,3 dalam 25 pL volume reaksi).
Selanjutnya dimasukkan ke dalam tabung eppendorf volume 500 pL dan kocok secara perlahan-lahan supaya semua larutan tercampur sempurna. Minyak mineral ditarnbahkan ke atas campuran larutan PCR sebanyak 20 pL untuk menghindari penguapan selama berlangsungnya reaksi.
satu siklus. Dcnaturasi DNA pada suhu 95" selama 30 dctik, penempelan primer ke DNA cetakan pada suhu sesuai dengan susunan basa pada primer kira-kira 3 6 ' ~ selama 1 menit dan pemanjangan pada 7 2 ' ~ selama 2 menit sebanyak 45 silkus, .dan PCR-akhir pada suhu 7 2 ' ~ selama 7 menit sebanyak satu siklus, kemudian diambil- untuk dielektroforesis.
Tabel 2. Susunan basa primer yang digunakan dan jumlah fiagmen DNA yang teramplifikasi pada masing-masing primer
Elektroforesis dan Visualisasi DNA
DNA hasil amplifikasi kemudian dicampur dengan loadzng bz&%er FDEU dan dielektroforesis bersama DNA standar 1 kb DNA ladder (GibcoBRL) pada gel 6%
akrilamid Elektroforesis dibuat dalam aparatus gel vertikal dalam larutan buffer 1 x
TRE [1 0 x TRE dibuat clengm tlr\elan~t!can 22 1, 1 g basa Tris, 5 1,4 g asam borat dan 3,7 g NazEDTA2HzO dalam 800 mL aquabides dan dijadikan 1 L, pH = 8,3] pada voltase 60 V selama 7 jam. Gel diwarnai dengan perak nitrat menurut prosedur Trigiano and
GGT GCG GGAA
5 6 7 8 9 I
AAC GCG CAAC
CCC GTC AGCA
CTC ACC GTCC
CTG ACC AGCC
GCT CGT CAAC
Jumlah 1 2 3 6 1 23 10 11 15 15 11 120 11 13 18
2 1 12 143
Caetano-Anolles (1998). Hasil elektroforesis divisualisasi di atas lampu TL kernudian dipotret dengan menggunakan kamera biasa dan dipetakan kembali pita-pita DNA di atas plastik transparan untuk menghindari kehilangan pita-pita DNA yang intensitasnya lemah.
Analisis Data
Pita-pita hasil pemetaan kembali pada plastik transparan dihitung jumlahnya
untuk setiap primer yang digunakan. Pita-pita tersebut diberi nomor yang diurutkan dari
yang paling atas yaitu terdekat dengan swnur loading sampai pita yang paling bawah yaitu yang te jauh dari sumur loadzng. Ukuran potongan DNA genom dilakukan dengan membandingkannya dengan berat molekul standar 1 kb DNA ladder.
Setiap posisi pita polirnorfik diasurnsikan mewakili ale1 dominan pada lokus tertentu. Profil pita DNA hasil ampliiikasi pada laju elektroforesis yang sama untuk setiap tanaman diinterpretasikan sebagai satu lukus homolog. Lokus yang polimorfik tersebut diskor dengan nilai no1 (0) jika tidak ada pita dan satu (I) jika ada pita pada posisi yang sama individu yang dibandinglcan. Kesamaan genetik antar dua individu tanaman gladiol dihitung koefisien DICE. Berdasarkan nilai kesamaan genetik tersebut, dilakukan analisis pengelompokan dengan metode UPGMA (Unweighted Pair Group Method Arimtic). Pengelompokan ini mencerminkan tingkat kesamaan genetik antar setiap individu tanaman gladiol dan disajikan &lam bentuk dendogram kesamaan genetik. Semua data RAPD dianalisis dengan menggunakan program NTSYS-pc versi 1.80 (Rohlf, 1993).
HASIL
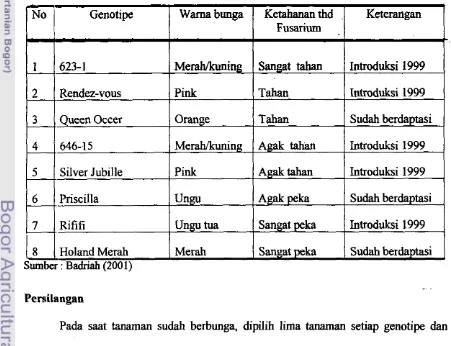
gladiol yang dianalisis. Jumlah fragmen DNA yang teramplifikasi setiap primer berlusar 11 - 24, tergantung susunan basa pada primer yang digunakan. (Tabel 2.). Salah satu contoh profil hasil amplifikasi dengan menggunakan primer OPC 19 disajikan pada Gambar 1.
bp M 1 2 3 4 5 6 7 8 9 10 11 1 2 1 3 1 4 1 5 1 6
Gambar 1. Profil hasil amplifikasi DNA gladiol dengan menggunakan primer OPC19. M = marker, 1 - 16 genotipe yang diuji (narna genotipe berdasarkan
urutannya dapat lihat Tabel 1).
Semua genotipe gladiol koleksi INLITHI Cipanas membentuk satu kelompok pada tingkat kesamaan kurang dari 69 % (Gambar 2). Genotipe yang paling mirip adalah antara Yester dan Yellow mencapai 89 %, sehingga jarak genetiknya hanya mencapai 1 1%. Genotipe 623-1 sangat mirip (tingkat kemiripan 88%) dengan Dayang Sumbi, genotipe Rififi mirip dengan Priscilla pada tingkat kesamaan mencapai 82 % lebih. Genotipe HWF8, HWF56, pH75 dan pH19 relatif tidak mirip (tingkat i kemiripan 69 %)
dengan 12 genotipe lainnya.
Y est er Yellow QueenOcccr
I
RififiI
PriscillaGambar.2. Dendogram kesamaan genetik 16 genotipe gladiol koleksi INLITHI Cipanas her-kan penanda RAPD.
PEMBAHASAN
[image:120.589.126.526.274.460.2]menghasilkan 104 lokus polimorfik (Debemer et al., 1996) dan duku menggunakan 10 primer menghasilkan 107 lokus polimorfik (Song et al.,2000).
Semakin banyak primer yang digunakan dan semakin banyak lokus polimorfik yang dihasilkan akan semakin terwakili bagian-bagian genom tanaman yang dianalisis. Hal ini terlihat pa& analisis keragaman genetik 16 kerabat liar kacang tanah dengan menggunakan 5 primer bisa menghasilkan 13 1 lokus polimorfik (He, Singh and Prakash, 1997), demikian juga pada 112 aksesi gandum, dengan 21 primer dapat menghasilkan 202 ale1 polimofik (Okuno, et al., 1998).
Pada penelitian ini, kemiripan antar 16 genotipe gladiol mencapai 69 % sampai 89%, lebih sempit jika dibandingkan dengan kemiripan antar aksesi duku bisa mencapai 34,3 % sampai 98,7 % (Song et al.,2000). Pengelompokan genotipe gladiol pada penelitian ini juga lebih sedikit hanya 4 kelompok dibandingkan dengan tingkat pengelompolcan pada @ (Tasliah et al. 2000) dengan menggunakan 8 primer dapat mengelompokkan 54 genotipe menjadi 22 kelompok yang berbeda pada tingkat kesamaan genetik 75 %. Hal ini menunjukkan bahwa keragaman genetik 16 genotipe gladiol koleksi INLITHI Cipanas relatif sempit.
Rendahnya keragaman genetik 16 genotipe bunga gladiol koleksi INLITHI Cipanas diperkirakan karena koleksi plasma nutfah tersebut hanya berasal dari satu. negara saja yaitu Belanda. Akibatnya, kemiripan genetik antar genotipe tersebut masih tinggi, sedangkan pusat asal tanaman gladiol adalah Afrika Selatan (Wilfret, 1992). Dengan demikian diperlukan usaha secara terus-menerus untuk memperluas sumber keragaman genetik koleksi plasma nutfah gladiol dari pusat asalnya, di samping memanfaatkan plasma nutfah yang ada secara optimal.
Keragaman genetik plasma nutfah pepaya Hawaii sangat sempit, karena pada koefisien kemiripan 0.7, sebelas genotipe pepaya yang diuji hanya mengelompok menjadi satu kelompok saja. Hal ini terjadi kemungkinan karena jumlah sampel genom dengan menggunakan sebelas primer dan sebelas kultivar pejmya tersebut, belum cukup (Stiles et al., 1993). Sedangkan pada penelitian ini, genotipe yang digunakan adalah sebanyak enam belas genotipe dan dapat dikelompokkan menjadi empat kelompok pada tingkat kesamaan 75%. Jing-Tian, Sauve and Gawel, (1997) menggunakan sembilan genotipe untuk analisisis keragaman genetik bunga poinsettia dan hasilnya hanya dapat membedakan kultivar poinsettia menjadi dua kelompok saja. Gettys and Werner, (2001) hanya menggunakan sepuluh kultivar untuk analisisis keragaman genetik bunga aster. Dengan dernikian, wdlaupun jumlah genotipe gladiol yang digunakan dalam penelitian masih sedikit tetapi sudah cukup memadai digunakan
untuk
analisis keragaman genetik.Genotipe Yester dan Yellow sangat mirip (89 %),kedua genotipe tersebut memiliki warm bunga yang sarna yaitu kuning dan tingkat ketahanan terhadap fusarium juga sama (Tabel 1). Kemungkinan besar kedua kultivar tersebut berasal dari
kedua tetua dari genotipe tersebut tidak diketahui dengan jelas karena kultivar tersebut merupakan hasil introduksi yang tidak menyebutkan asal tetuanya.
Genotipe 623-1 hasil introduksi dari Belanda pada tahun 1999 yang sangat mirip (tingkat kerniripan 88%) dengan Dayang Sumbi kultivar yang dihasilkan oleh INLITHI Cipanas. Kultivar Rififi mirip dengan kultivar Priscilla yang sudah beradaptasi di Indonesia dengan tingkat kesamaan mencapai 82 % lebih. Silver Jubille dan Rendezvous keduanya mempunyai wama bunga pink dan tingkat ketahanan terhadap fusarium juga tinggi (Tabel 1). Dengan demikian kultivar Silver Jubille dan Rendezvous sangat berpotensi untuk dikembangkan sebagai tetua untuk disilangkan dengan genotipe yang sudah beradaptasi di Indonesia untuk memperkaya keragaman genetik gladiol.
Penelitian ini juga menunjukkan, genotipe-genotipe hasil silangan yang dilakukan oleh INLITHI Cipanas antara genotipe Holand Merah dengan White Friendship dan antara Holand Merah dengan Priscilla mengelompok sendiri dan berbeda dari genotipe yang lain. Genotipe HWF8 dan HWF56 merupakan dua individu di antara keturunan hasil silangan antara tetua betina Holand Merah dan jantan White Friendship. pH75 dan pH19 juga dua individu di antara keturunan hasil silangan tetua betina Holand Merah dan jantan Priscilla.
dalam menghasilkan hibrida maka ada kemungkinan genom dari berbagai spesies tetua akan muncul kembali.
KESIMPULAN DAN SARAN
Kesimpulan
Analisis pengelompokan berdasarkan hasil amplifikasi dengan menggunakan sembilan primer yang menghasilkan 120 lokus polimorfik dapat membedakan 16 genotipe gladiol koleksi INLITHI Cipanas kedalam empat kelompok pada tingkat kesamaan 75 %. Kelompok pertama terdiri dari Yester, Yellow, Queen Occer, 623-1, Dayang Sumbi, Holand Merah dan Mirella, Rififi, Priscilla dan White Friendship. Kelompok kedua dan ketiga berturut-turut Silver Jubille dan Rendesvous. Kelompok keempat terdiri dari HWF8, HWF56, pH75 dan PH19. Koefisien kemiripan antar 16 genotipe gladiol koleksi INLITHI Cipanas yang diuji berkisar 0,69 - 0,89. Dari penelitian ini memperlihatkan genotipe gladiol introduksi dari Belanda tahun 1999 yaitu Silver Jubille dan Rendezvous dapat menambah keragaman genetik bagi koleksi plasma nutfah gladiol di INLITHI Cipanas, sehingga berpotensi untuk dijadikan sebagai tetua dalam program hibridisasi.
Saran
HIBRIDISASI DAN EVALUASI KETAHANAN TERHADAP
FCTSARIUM PADA POPULASI KETURUNAN DARI BEBERAPA
KOMBINASI SILANGAN GLADIOL
ABSTRAKProduksi bunga dan umbi gladiol sering tidak optimal karena dibatasi oleh penyakit layu dan busuk subang yang disebabkan cendawan Fusarium oxysporum f. sp. gladiolii. Oleh karena itu untuk pengendalian penyakit tersebut, diperlukan perakitan kultivar tahan melalui program pemuliaan tanaman. Untuk mengefisienkan program pemulliaan gladiol tahan fusarium diperlukan infonnasi tentang tingkat keberhasilan persilimgan dari berbagai kombinasi tetua dan metode seleksi yang efisien. Penelitian ini bertujuan untuk (1) mempelajari produksi biji sebagai indikasi tingkat keberhasilan persilangan antar beberapa genotipe gladiol (2) mengembangkan metode seleksi ketahslnan terhadap fusarium pada gladiol di tingkat semaian dan (3) mengevaluasi ketahanan terhadap fusarium pa& populasi tunman dari beberapa kombinasi silangan gladiol. Hasil penelitian menunjukkan pembentukan biji akan lebih banyak jika Priscilla, 646-15 dan Holand Merah digunakan sebagai tetua betina dan sedikit jika Silver Jubille, Rendezvous, Rififi dan Queen Occer sebagai tetua betina. Seleksi penapisan genotipe tahan terhadap fusarium dengan kerapatan inokulum 10' propagule per gram tanah dapat dilakukan pada 8 minggu setelah semai. Persentase jumlah zuriat tahan lebih banyak diperleh dari kombinasi silangan 623-1 x Queen Occer, Queen Occer x 623-1, dan 646- 15 x 623-1.
PENDAHULUAN
Gladiol (Gladiolm hybridm Hort) merupakan salah satu tanaman hias yang memiliki nilai ekonomi tinggi. Tanaman tersebut selain menghasilkan bunga yang digunakan sebagai bunga potong juga menghasilkan subang sebagai bibit. Produksi bunga dan umbi gladiol sering tidak optimal karena dibatasi oleh penyakit layu clan busuk :rubang yang disebabkan cendawan Fusarium oxysporum f. sp. gladiolii (Straathof
Pengendalian F.oxysporum f.sp. gludiolii pada gladiol biasanya dilakukan dengan disinfektasi subang sebelum tanam dengan memakai f h g s i d a dan fumigasi lahan (Wilfret,1992), rotasi tanam (Kartapraja, et a[., 1996) tetapi belum memberikan hasil yang optimal. Penggunaan kultivar yang tahan mempakan stmtegi yang ekonomis, ramah lingkungan dan efektif untuk pengendalian penyakit (Agrios, 1996).
Kultivar gladiol yang tahan terhadap fusarium di Indonesia saat ini sangat jarang ditelrtuka apalagi variasi karakter bunga yang terbatas. Sedangkan pennintaan bunga potong selalu menghendala sesuatu yang baru dan lebih beragam
dari
segi warna, bentuk, jumlah bunga, kuntum yang susun teratur dan simetris, tangkai panjang, kesegaran yang lama dan mudah pengepakannya (Pratiwi dan Sarimo, 1989). Dengan demikian diperlukan usaha yang terus menerus untuk merakit kultivar baru.Tanaman gladiol biasanyabisa disaling-silangkan antar kultivar (Herlina, 1991), tetapi sering juga dijumpai dari persilangan tersebut yang tidak berhasil. Persilangan dilakukan untuk menggabungkan sifat ketahanan terhadap fusarium dan sifat bunga yang diinginkan konsumen. Untuk mengefisienkan program perakitan kultivar bam, pemulia memerlukan informasi tentang tingkat keberhasilan persilangan antar genotipe yang a hdijadikan sebagi tetua. Setelah persilangan perlu dilakukan seleksi ketahanan terhadap fusarium pada individu turunan
untuk
dikembangkan xbagai kultivar baru.Subang gladiol yang dijadikan bibit baru dapat menghasilkan bunga dengan
ukuran standar apabila diameter subangnya mencapai 3 cm lebih (Badriah, 1995). Untuk
karer~a itu, membutuhkan waktu yang sangat lama untuk mengetahui tingkat ketahanan suatu kultivar yang sedang dikembangkan.
Biji yang dihasilkan dari persilangan dapat ditanam langsung karena tidak mengalami dormansi seperti halnya subang (Herlina
dan
Haryanto,l995). Dengan demiltian seleksi pada tahap semaian sangat memunglunkan dilakukan. Seleksi pada tahap semaian telah berhasil dilakukan pada bunga lili dan diperoleh adanya keselarasan antam seleksi semaian dan seleksi klonal (Straathof and Loffler, 1994). Seleksi pada tahap semaian dapat juga digunakan untuk memperkirakan tingkat ketahanan fusarium pada lpopulasi keturunannya (Straathof et a[., 1997), dan mempercepat seleksi (Badriah,et al., 1998). Namun demilaan, waktu yang diperlukan untuk evaluasi penyakit dengan seleksi pada tahap semaian yang telah dilakukan Straathof et al. (1997) dan Badriah, et al(1998) juga masih sekitar 7 - 10 bulan. Oleh karena itu untuk lebih mengefisienkan waktu dan biaya seleksi masih diperlukan usaha untuk mempersingkat periode penguiian.
Penelitian ini bertujuan untuk mempelajari produksi biji sebagai indikasi tingkat keberhasilan persilangan antar beberapa genotipe gladiol. Penelitian ini juga mengembangkan metode seleksi ketahanan terhadap fusarium pada gladiol di tingkat semaizm dm mengevaluasi ketahanan terhadap fusarium pada populasi turunan dari beberapa kombinasi silangan gladiol.
BAHAN DAN METODE Tempwt dan Waktu
bulan Nopember sampai dengan Desember 2000. Pengujian ketahanan populasi gladiol hasil persilangan dilakukan di nunah plastik INLITHI Cipanas pada bulan Januari 2001 sampiii dengan Maret 2002. Tempat penelitian terletak pada ketinggian 1.100 m di atas permukaan laut dengan suhu maksimum 24 - 2 7 ' ~ suhu minimum 14 - 1 6 ' ~ .
Bahan tanam yang digunakan dalam penelitian ini adalah 8 genotipe gladiol, terdiri dari tiga genotipe yang telah beradaptasi di Indonesia dan lima genotipe introduksi dari Belanda tahun 1999. Semua bahan tanam tersebut merupakan koleksi INLITHI Cipanas dengan karakter bunga dan tingkat ketahanan terhadap barium yang
Tabel 3. Genotipe gladiol yang digunakan dalam persilangan
Ungu tua Sangat peka Introduksi 1999 Merah Sangat peka Sudah berdaptasi
S u m h : Badriah (2001)
Persilangan
[image:128.602.79.530.378.724.2]satu hari sebelum mekar. Petal bunga dibuka, daun mahkota dan benang sari dibuang dengan menggunakan pinset. Bunga yang telah diemaskulasi dibungkus dengan kantong kertas yang tahan air untuk menghindari persilangan yang tidak diharapkan.
Kotak sari yang berisi tepung sari diambil dari tetua jantan dan dikeluarkan dengan menggunakan ujung pinset. Penyerbukan dilakukan dengan mengoleskan tepung sari ke kepala putik yang telah mengeluarkan lapisan lendir dan telah membuka. Setelah dilakukan penyerbukan, bunga ditutup kembali dengan kantong kertas tahan air dan diberi label. Apabila putik telah layu yang ditandai dengan warna putik yang berubah dari putih menjadi kecoklatan
dan
akhimya kehitaman, maka katong pembungkus dapat dibuka. Buah gladiol dapat dipanen pa& saat warna buah berubah dari hijau menjadi coklat dan ujung buah retalc, kira-kira 30 hari setelah penyerbukan.Penyhpan Kultur Fusarium
Isolat F. oxysporum diisolasi dari subang gladiol yang menunjukkan gejala sakit layu fitsarium dari pertanaman gladiol di kebun percobaan INLITHI Cipanas. Bagian subang yang sakit dipotong kira-kira 0,5 cm pada bagian antara yang sakit
dan
yangmasih sehat kemudian direndam dalam larutan sodium hipoklorit 10% (vlv) selama 5 menit untuk sterilisasi permukaan kemudian dibilas dengan air steril lalu ditelakkan di atas media agar dekstrosa kentang atau potato dextrose agar (PDA). Kemudian diletakltan dalam inkubator