IDENTIFIKASI GEN AROMA PADA PADI BC5F1
PANDAN WANGI DAN BC4F1
CIHERANG-MENTIK WANGI
MOCHAMAD NASODIKIN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MOCHAMAD NASODIKIN. Identifikasi Gen Aroma Pada Padi BC5F1
Ciherang-Pandan Wangi dan BC4F1 Ciherang-Mentik Wangi. Dibimbing oleh
DJAROT SASONGKO HAMISENO dan TRI JOKO SANTOSO.
ABSTRACT
MOCHAMAD NASODIKIN. Identification of Genes BC5F1 Ciherang-Pandan
Wangi and BC4F1 Ciherang-Mentik Wangi. Under the direction of DJAROT
SASONGKO HAMISENO and TRI JOKO SANTOSO.
IDENTIFIKASI GEN AROMA PADA BC5F1
CIHERANG-PANDAN WANGI DAN BC4F1 CIHERANG-MENTIK WANGI
MOCHAMAD NASODIKIN
G84080042
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Identifikasi Gen Aroma Pada BC5F1 Ciherang-Pandan Wangi
dan BC4F1 Ciherang-Mentik Wangi
Nama
: Mochamad Nasodikin
NIM
: G84080042
Disetujui
Komisi Pembimbing
Diketahui
Tanggal Lulus:
Dr. Ir. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
Dr. Djarot Sasongko Hamiseno, MS.
Ketua
PRAKATA
Alhamdulillah, segala puji dan syukur penulis panjatkan kepada Allah
SWT atas segala karunia-Nya. Shalawat dan salam semoga selalu tercurah kepada
Nabi Muhammad SAW dan para pengikutnya sampai akhir zaman sehingga
penulis dapat menyelesaikan penelitian yang berjudul
“
Identifikasi Gen Aroma
(
badh2
termutasi) dari Tanaman Padi Hasil Persilangan (BC5F1 CP dan BC4F1
CM)
”
.
Kegiatan penelitian ini dilakukan dari bulan Februari 2012 hingga Juli
2012, bertempat di Laboratorium Biologi Molekuler BB-Biogen Cimanggu,
Bogor.
Terima kasih penulis ucapkan kepada semua pihak yang telah membantu
dalam penyelesaian penelitian ini, terutama kepada Dr. Djarot Sasongko, MS
selaku ketua pembimbing dan Dr. Tri Joko Santoso, S.P. M.Si. selaku anggota
pembimbing dalam memberikan saran, kritik, dan bimbingannya serta orang tua
dan keluarga yang selalu memberikan doa, dukungan, motivasi, dan semangat
bagi penulis untuk menyelesaikan penelitian ini. Tak lupa pula ucapan terima
kasih kepada teh Dewi Praptiwi, teh Falin Zainati Fakhrina, teh Dina, teh Zahroh,
mas Nazar, Firda, Dika, dan segenap staf di Laboratorium Biologi Molekuler
BB-Biogen atas peran, bantuan, dan kerjasamanya dalam menyelesaikan penelitian
ini.
Penulis juga menyampaikan terima kasih kepada rekan-rekan selama
penelitian yaitu Ihsan, Akos, Restu, Beki, Sekar atas saran dan motivasi yang
diberikan. Terima kasih juga kepada para editor yang bersedia membantu
penyusunan skripsi ini yaitu Linda Erijayanti dan Rian Triana. Selain itu kepada
Gina Kusuma Intani yang selalu memberi masukan dan dukungan serta
rekan-rekan Biokimia 45, 44, 46, 47. Semoga penelitian ini mampu memberikan
informasi dan manfaat bagi yang memerlukan.
Bogor, Februari 2013
RIWAYAT HIDUP
Penulis adalah putra dari bapak Illi dan ibu Kursinah. Penulis merupakan
anak Pertama dari tiga bersaudara dan mempunyai dua orang adik, yang pertama
laki-laki bernama Andi Alfian dan yang kedua perempuan bernama Neng Ovi
Rofiah.
Pendidikan penulis dimulai dari SDN Raden Fatah dan melanjutkan
pendidikan ke SMPN 1 Pusakanagara. Penulis lulus tahun 2008 dari SMA 1
Subang dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur
Undangan Seleksi Masuk IPB (USMI). Penulis memilih mayor Departemen
Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah melakukan Praktik
Lapangan (PL) di Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI)
Jalan Taman Kencana No.1, Bogor selama periode Juli 2011 hingga Agustus
2011. Penulis pernah melakukan
fieldtrip
sebanyak dua kali ke beberapa
perusahaan dan balai penelitian besar di Indonesia.
Beberapa organisasi yang diikuti penulis selama perkuliahan yakni Staf
Divisi
Cyber Community
KOPMA IPB 2008-2012, Staf Divisi Sosial dan
Lingkungan BEM FMIPA IPB 2009-2010, dan Staf Divisi Badan Pengawas
Himpunan Profesi Mahasiswa Biokimia (CREBs) tahun 2010-2011. Penulis juga
pernah mengikuti berbagai kepanitiaan seperti Ketua Pelaksana
Green Society
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Tanaman Padi ...
2
Senyawa Pembawa Aroma Padi...
2
Gen Pengendali Sifat Aroma Padi...
3
Metode Seleksi Aroma ...
4
Marka Aromatik PCR ...
5
Metode Silang Terarah (
Site-directed Crossing
) ...
6
BAHAN DAN METODE
Alat dan Bahan ...
7
Metode...
7
HASIL DAN PEMBAHASAN
Kuantitatif dan Kualitatif DNA BC5F1 CP dan BC4F1 CM ...
9
Tanaman Padi BC5F1 CP Hasil Seleksi PCR dengan Marka RM223 ... 10
Tanaman Padi BC4F1 CM Hasil Seleksi PCR dengan Marka Bradbury . 10
SIMPULAN DAN SARAN
Simpulan ... 11
Saran ... 11
DAFTAR PUSTAKA ... 11
DAFTAR GAMBAR
Halaman
1 Tanaman padi ... 2
2 Struktur 2
-
asetil-1-pirolin ... 2
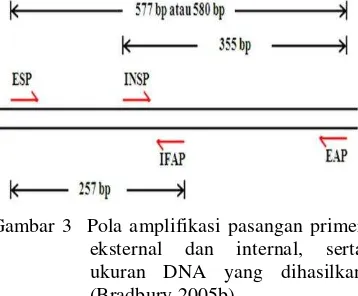
3 Pola amplifikasi pasangan primer eksternal dan internal, serta ukuran
DNA yang dihasilkan (Bradbury 2005b) ... 5
4 Ukuran amplikon dengan marka RM223 ... 6
5 Elektroforegram uji kualitatif DNA hasil isolasi ... 9
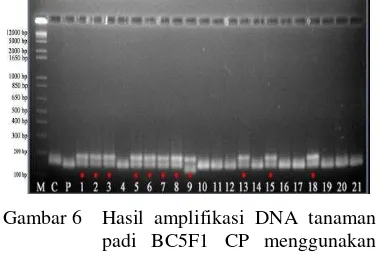
6 Hasil amplifikasi DNA tanaman padi BC5f1 CP menggunakan marka
RM223. M = Marker 1 kb ladder; C = Ciherang; P = Pandan Wangi;
nomor 1-21 = tanaman BC5F1 CP ... 10
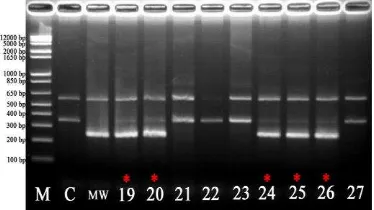
7 Hasil amplifikasi DNA tanaman padi BC4F1 CM menggunakan marka
Bradbury. M = Marker 1 kb ladder; C = Ciherang; MW = Mentik Wangi;
nomor 19-27 = tanaman BC4F1 CM ... 11
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian... 15
2 Sekuen Primer yang digunakan dalam penelitian ... 16
3 Isolasi DNA dengan metode Doyle & Doyle (1980) ... 17
4 Hasil analisis kuantitatif DNA BC4F1 CM dengan nanodrop ... 18
5 Hasil analisis kuantitatif DNA BC5F1 CP dengan nanodrop ... 20
6 Elektroforegram hasil PCR BC5F1 CP dengan marka RM223 ... 23
PENDAHULUAN
Padi adalah makanan pokok bagi lebih dari setengah penduduk di dunia. Sebagian besar tanaman padi diproduksi dan dikonsumsi di Asia (Kibria et al. 2008). Indonesia sebagai salah satu produsen padi dunia mengalami peningkatan laju pertumbuhan rata-rata produksi padi sebesar 1.67% per tahun pada periode 1997-2000. Pada tahun 2007, produksi padi meningkat sebesar 4.96% dibandingkan dengan tahun 2006. Pencapaian ini telah mengantar Indonesia kembali meraih swasembada beras (Puslitbang Tanaman Pangan 2013). Mutu suatu varietas sangat mempengaruhi besarnya pendapatan bagi para petani karena akan mempengaruhi harga jualnya. Salah satu parameter yang menjadi tolak ukur kualitas padi adalah aromanya (Padmadi 2009).
Pemuliaan tanaman merupakan suatu metode yang menggali potensi genetik suatu tanaman untuk memaksimalkan ekspresi dari potensi tersebut pada suatu kondisi lingkungan tertentu (Stoskopf et al. 1993). Tujuan pemuliaan tanaman adalah mengurangi resiko kegagalan panen saat tanam di lahan dan meningkatkan kualitas panen sehingga menambah nilai komersial pada saat pasca panen. Pemuliaan tanaman padi dilakukan melalui perakitan varietas unggul baru yang berdaya hasil tinggi, berkualitas, serta resisten terhadap kendala biotik dan abiotik (Shivanna & Sawhney 1997).
Peningkatan kualitas produk pangan seperti rasa, aroma, dan nontransgenik belum cukup banyak mendapat perhatian. Jika dilihat dari berbagai aspek komersial, kualitas produk pangan tersebut selalu dipertanyakan pada saat pemasaran (pasca panen) terutama untuk tujuan ekspor maupun pasar menengah ke atas. Aroma dan rasa dari padi menjadi bahan pertimbangan penting untuk meningkatkan selera makan konsumen. Salah satu jawaban untuk mengatasi permasalahan tersebut adalah padi aromatik.
Perakitan varietas unggul yang memiliki sifat aromatik adalah salah satu cara terbaik untuk meningkatkan kualitas produksi pertanian di Indonesia. Hal ini dapat dilakukan dengan cara perbaikan genetik, yaitu mengintroduksikan gen aroma padi (badh2 termutasi) dari varietas aromatik ke varietas non-aromatik. Metode yang dapat digunakan salah satunya adalah persilangan terarah (site-directed crossing) yang dapat mengintroduksikan gen yang diinginkan
secara spesifik. Kelebihan dari metode persilangan terarah ini dibandingkan dengan metode rekayasa genetika adalah produk yang dihasilkan bukan merupakan produk transgenik sehingga akan lebih mudah dalam pemasarannya karena tidak akan terhambat oleh regulasi GMO (Genetically Modified Organism) yang ketat. Selain itu juga produk yang dihasilkan memiliki stabilitas hingga puluhan tahun, sifat rekombinasi terarah, relatif tidak memiliki efek negatif, dan pemasarannya tidak bermasalah.
Padi yang digunakan pada penelitian ini merupakan hasil silang balik padi Ciherang-Pandan Wangi (BC5F1 CP) dan padi hasil silang balik Ciherang-Mentik Wangi (BC4F1 CM). Padi Ciherang sebagai tetua betina non-aromatik, dan Pandan Wangi serta Mentik Wangi sebagai tetua jantan aromatik. Varietas Ciherang merupakan varietas pengembangan lokal yang sudah akrab dengan masyarakat yang memiliki ketahanan terhadap berbagai hama dan penyakit, tidak memerlukan kondisi prasyarat lahan yang ketat, dan memiliki produktivitas yang tinggi sekitar 8 ton/hektar. Penyeleksian padi BC5F1 CP dilakukan menggunakan marka RM223, sedangkan padi BC4F1 CM menggunakan marka Bradburry.
Marka Bradburry digunakan karena mampu membedakan padi aromatik dan non-aromatik melalui identifikasi alel homozigot aroma, homozigot non-aroma serta heterozigot dalam suatu populasi yang bersegregasi (Bradburry et al. 2005b). Sedangkan marka RM223 digunakan karena marka Bradburry tidak dapat digunakan untuk padi Pandan Wangi. Kelebihan dari marka RM223 ini mampu membedakan polimorfisme pada padi aromatic dan non-aromatik (Lang & Buu 2008).
2
TINJAUAN PUSTAKA
Tanaman Padi
Padi aromatik lokal yang digunakan dalam penelitian ini adalah padi Mentik Wangi dan Pandan Wangi. Padi Mentik Wangi merupakan padi varietas javanica dengan karakteristik berbiji bulat, daun berwarna hijau, dan tinggi tanamannya berkisar antara 95 hingga 115 sentimeter. Kelebihan dari padi Pandan Wangi yaitu memiliki aroma menyerupai pandan dan bertekstur pulen. Namun, padi Pandan Wangi memiliki tingkat produktivitas yang relatif rendah dan tidak tahan terhadap hama (LITBANG 2006).
Pandan Wangi merupakan varietas padi aromatik yang telah terkenal sejak tahun 1973. Aroma yang menyerupai pandan merupakan karakter paling menarik dari padi Pandan Wangi yang banyak diminati di pasaran Asia maupun dunia. Pandan Wangi merupakan varietas javanica dengan ciri bulat, berbulu, tahan rontok dan usia tanamnya mencapai 150 hingga 160 hari dan tingginya mencapai 150 sentimeter. Pandan Wangi mengandung kadar amilosa 7-20% yang menyebabkan padi varietas ini bertekstur pulen. Selain itu, Pandan Wangi cocok tumbuh di suhu 25ºC hingga 30ºC, dengan ketinggian 500 sampai 800 meter dari permukaan laut. Kelemahan dari padi Pandan Wangi adalah tingkat produktivitasnya rendah dan tidak tahan terhadap hama dan penyakit (LITBANG 2006).
Ciherang merupakan kelompok padi sawah varietas unggul hasil beberapa kali persilangan, yaitu IR18349-53-1-3-1- 3/IR19661-131-3-1//IR119661-131-3-1///IR 64////IR64. Padi Ciherang memiliki karakteristik umur tanamannya cukup singkat yaitu 116 hingga 125 hari, bentuk tanaman tegak, tingginya mencapai 107 hingga 115 sentimeter, menghasilkan anakan produktif 14 hingga 17 batang, warna kaki hijau, warna batang hijau, warna daun hijau, posisi daun tegak, bentuk gabah panjang ramping, warna gabah kuning bersih, tekstur nasi pulen, bobot 1000 butir 27 hingga 28 gram, rata-rata produksi 5 hingga 8.5 ton/ha, tahan terhadap bakteri hawar daun (HDB) strain III dan IV, tahan terhadap wereng coklat biotipe 2 dan 3. Padi Ciherang mulai diresmikan oleh menteri pertanian pada tahun 2000 dengan anjuran cocok ditanam pada musim hujan dan kemarau dengan ketinggian di bawah 500 meter di bawah permukaan laut (Hermanto 2006).
Gambar 1 Tanaman padi
Senyawa Pembawa Aroma Padi
Rasa yang berbeda dan tekstur yang pulen dari nasi yang dikonsumsi sangat mempengaruhi selera makan seseorang. Konsumen menyadari adanya suatu rasa yang khas dalam beras yang dikonsumsi sering mereka anggap sebagai suatu kualitas dari beras terbaik. Terdapat dua jenis aroma yang terdapat pada padi, yaitu aroma yang dihasilkan karena telah simpan lama dan aroma padi yang masih segar. Beberapa konsumen lebih menyukai rasa dan kualitas padi yang disimpan lebih lama, sementara yang lainnya lebih memilih untuk aroma padi segar. Terdapat beberapa senyawa kimia yang berperan dalam aroma dan rasa dalam padi dan hal ini sering dikaitkan dengan penyimpanan jangka panjang. Senyawa 1-heksanal, metil etil keton, 1- pentanal dan propanol dikaitkan dengan aroma padi yang disimpan dalam waktu yang lama, sedangkan 1-butanal dan 1-heptanal terkait dengan aroma padi segar (Bradbury et al. 2005a).
Aroma padi disebabkan oleh senyawa kimia yang mudah menguap. Aroma pada padi dipengaruhi oleh faktor genetik dan lingkungan. Hasil penelitian menunjukkan terdapat lebih dari 114 senyawa kimia yang terdapat pada padi aromatik. Namun, senyawa utama yang menyebabkan adanya aroma wangi pada padi adalah senyawa 2-asetil-1-pirolin (2AP) dengan struktur seperti yang diperlihatkan pada Gambar 2. Senyawa 2-asetil-1-pirolin memiliki gugus pirol dan keton yang terdiri atas enam atom karbon (C), sembilan atom hidrogen (H), satu atom nitrogen (N), dan satu atom oksigen (O).
Penelitian Buttery et al. (1983) menemukan bahwa 2AP adalah senyawa kimia utama penyebab keharuman aroma pada daun pandan. Aroma pandan memiliki kesamaan genetik dan molekuler dalam aroma padi, namun tanaman pandan
(Pandanus amaryllifolius Roxb) tidak dikelompokkan ke dalam golongan rumput-rumputan (Poaceae). Aroma padi Basmati sering digambarkan seperti daun pandan dan di beberapa budaya Asia, daun pandan kering sering ditambahkan ke dalam beras non-aromatik saat dimasak. Aroma padi non-aromatik tidak hanya dapat dicium pada saat pemasakan nasi. Sejak penemuan bahwa 2AP adalah senyawa kimia utama yang terlibat dalam aroma pandan, Buttery et al. (1983) juga telah menemukan berbagai cita rasa makanan seperti jagung berondong, jagung tortila, ham, keju, kacang hijau, teh hijau, dan anggur yang juga dikaitkan dengan kehadiran 2AP.
Padi aromatik mengandung senyawa 2AP lebih tinggi (0,04–0,07 ppm) dibandingkan padi non-aromatik (0.004–0.006 ppm) (Adijono et al. 1993). Hal yang sama dikemukakan oleh Buttery et al. (1983) bahwa kandungan senyawa 2AP dalam padi aromatik mencapai 0.04–0.09 ppm, sepuluh kali jauh lebih tinggi dibanding padi non-aromatik yang hanya 0.004–0.006 ppm. Senyawa 2AP terdeteksi pada semua bagian tanaman padi, kecuali di akar (Lorieux et al. 1996). Konsentrasi ambang batas 2AP yang dapat dideteksi oleh hidung manusia ketika butiran padi dilarutkan dalam air adalah sekitar 0.1 ppb, tetapi kemungkinan dapat lebih tinggi pada butiran padi yang kompleks (Buttery et al. 1983). Perbedaan ini mungkin disebabkan oleh perbedaan prosedur ekstraksi atau kuantifikasi 2AP, pengaruh lingkungan seperti temperatur, garam dan kekeringan, pengaruh waktu panen atau kondisi penyimpanan beras, dan pengaruh waktu penggunaan pupuk nitrogen ke tanaman (Buttery et al. 1983).
Biosintesis jalur reaksi yang rinci tentang kompleks ini belum sepenuhnya dijelaskan. Namun, telah ditemukan bahwa prekursor dan sumber nitrogen 2AP pada varietas aromatik Thai Hom Mali adalah senyawa prolin (Yoshihashi et al. 2002). Jalur pembentukkan 2AP dimulai dari pemecahan prolin menjadi putresin kemudian membentuk senyawa gama-minobutiraldehid (GABald), sebuah substrat dari enzim BADH2. Jika enzim BADH2 aktif, maka enzim ini dapat mengubah GABald
menjadi asam gama-aminobutirat (GABA), tetapi jika enzim BADH2 tidak aktif, GABald mengalami asetilasi (penambahan gugus asetil) membentuk 2AP. Putresin ditemukan dalam jumlah tinggi pada jaringan yang tumbuh aktif membelah. Putresin akan dipecah menjadi GABald oleh diamina oksidase (DAO) selama proses pembentukan lignin dan kaku dinding sel, yaitu setelah sebagian besar pembelahan sel telah terjadi. Oleh karena itu, pembentukan GABald cenderung terjadi di jaringan muda yang secara aktif membelah dan dinding sel mengalami kaku (Bradbury 2005b).
Ujung daun padi mengandung 2AP dalam jumlah yang lebih tinggi daripada di pangkal daun, sementara daun muda lebih beraroma daripada daun tua (Lorieux et al. 1996). Penurunan jumlah 2AP dalam jaringan yang lebih tua kemungkinan besar disebabkan oleh sifat volatil kimia. Aroma padi aromatik tidak hanya dapat dicium pada saat pemasakan nasi. Aroma juga dapat tercium saat tanaman padi berbunga di lahan (Mittal
et al. 1995). Pada tanaman prolin berfungsi sebagai zat pelindung terhadap kerusakan daun ketika terjadi dehidrasi. Prolin diakumulasi dalam jumlah yang sangat tinggi di dalam daun ketika tanaman terpapar oleh cekaman kekeringan atau terdapatnya kandungan garam yang tinggi di dalam tanah (Heldt 2005).
Gen Pengendali Sifat Aroma Padi
Studi genetik awal yang dilakukan oleh Ahn et al. (1992) terhadap sebuah gen fgr
(fragrance) yang mengendalikan sifat aroma pada varietas Della (padi aromatik turunan Jasmine) pada kromosom 8. Terdapat tiga kandidat gen dalam wilayah fgr yaitu gen yang menyandi protein betain aldehid dehidrogenase (badh2), karbonat anhidrase (Cah), dan 3-metilkrotonil-KoA (Mccc2). Bradbury et al. (2005a) lebih mempersempit wilayah genom untuk sifat aroma dan mengidentifikasi satu gen resesif yang bertanggung jawab untuk sifat aroma pada verietas-varietas padi seperti Jasmine dan Basmati. Bradbury juga telah melakukan pengurutan gen di wilayah fgr dari 64 padi aromatik dan 14 padi aromatik varietas Thailand dan melaporkan bahwa gen yang menyandi protein badh2 yang menjadi gen penyebab aroma karena memiliki delesi 8 basa.
4
memiliki polimorfisme di daerah ekson pada genotip tanaman. Polimorfisme gen tersebut terdiri atas gen badh1 dan gen badh2 yang memiliki kesamaan bentuk namun berbeda fungsinya. Gen badh1 disandi oleh kromosom nomor 4 yang berkaitan dengan toleransi tanaman ketika dalam kondisi cekaman. Gen ini terdapat pada tanaman padi, jagung, barley, dan sorgum. Gen badh2
terdapat di kromosom nomor 8 yang bertanggung jawab dalam menyebabkan aroma. Gen ini tidak hanya terdapat pada padi aromatik tetapi juga terdapat dalam padi non-aromatik (Bradbury 2005b).
Penemuan terbaru dari Shi et al. (2008) yang mengungkap adanya delesi pada ekson 2 yang mirip dengan delesi di ekson 7. Struktur lokus gen fgr mengandung 15 ekson dan 14 intron yang dibatasi oleh kodon awal ATG dan kodon berhenti TAA. Ekson 7 terdapat delesi 8 basa (5’-GATTATGC-3’), dan 3 SNP (polimorfisme nukleotida tunggal), sedangkan di ekson 2 terjadi delesi 7 basa (5’-CGGGCGC-3’). Akumulasi senyawa 2AP disebabkan oleh berkurangnya aktivitas enzim betain aldehid dehidrogenase (BADH2). Adanya mutasi delesi 8 basa pada padi aromatik mengakibatkan kodon berhenti (TAA) lebih awal dan diduga adanya delesi tersebut menyebabkan aktivitas enzim BADH2 pada tanaman menjadi berkurang (Bradbury et al. 2005a).
Penelitian Bourgis et al. (2008) yang mengungkap adanya mutasi gen pada berbagai varietas padi di berbagai negara. Mutasi gen badh2 disebabkan oleh peristiwa domestikasi atau terjadinya evolusi dalam suatu populasi yang terisolasi secara genetik. Selain itu, Bourgis et al. (2008) melakukan studi perbandingan sekuen gen badh2
terhadap beberapa varietas padi di dunia. Analisis sekuen gen badh2 ekson 7 dari gen padi aromatik (KDML105, RD6, dan SuYuNuo) menunjukkan adanya delesi 8 pasang basa dan 3 polimorfisme nukleotida (SNP), sedangkan pada varietas non-aromatik (SMJ, NST, Nipponbare, dan Nanjing11) tidak terdapat delesi. Bourgis menyimpulkan bahwa asam amino parsial dari gen badh2
padi Thailand diperkirakan mengalami mutasi atau delesi pada ekson 7 yang menyebabkan enzim BADH2 kehilangan fungsinya.
Metode Seleksi Aroma
Sejumlah metode panca indera telah digunakan untuk membantu petani dalam menyeleksi padi aromatik. Pengecapan individu merupakan salah satu metode
tradisional untuk menyeleksi kualitas padi aromatik. Sebuah panel analis digunakan untuk mendeteksi variasi aroma dari berbagai varietas, namun kemampuan setiap analis menjadi berkurang karena indera pengecap menjadi jenuh atau terjadi kerusakan fisik berupa lecet pada lidah sebagai akibat dari pengunyahan beras yang keras (Badbury et al. 2005b).
Metode kimia telah dikembangkan untuk menyeleksi aroma padi. Metode ini meliputi uji bau dengan melibatkan jaringan daun atau butir padi yang dipanaskan dalam air atau dalam pereaksi KOH. Namun, metode ini dapat mengakibatkan kerusakan pada rongga nasal hidung (Sood & Sidiq 1978). Metode penentuan jumlah 2AP juga telah dikembangkan menggunakan kromatografi gas. Namun, metode ini membutuhkan sampel yang banyak, membutuhkan biaya yang tinggi, menghabiskan banyak waktu, dan menghasilkan puncak senyawa 2AP dari kromatografi gas yang lebih kecil dibandingkan dengan puncak dengan senyawa lain yang ada di dalam padi sehingga membuat hasilnya sulit untuk dijelaskan (Lorieux et al. 1996). Metode lainnya dikembangkan oleh Srivong et al.
(2008) yang melakukan pengukuran aktivitas enzim BADH2 melalui pemberian sejumlah substrat 4-aminobutiraldehid dan hasilnya
diukur dengan menggunakan
spektrofotometer pada panjang gelombang 340 nm. Namun, metode ini memiliki sensitivitas terbatas, mengonsumsi banyak waktu, dan memerlukan sampel yang banyak. Penemuan baru dari sebuah marka molekuler yang digunakan untuk melacak keberadaan gen penyandi aroma. Marka molekuler dalah suatu penanda pada tingkat DNA yang memberikan keleluasaan dalam meningkatkan efisiensi pemuliaan dengan melakukan seleksi tidak langsung pada karakter yang diinginkan, yaitu pada marka yang terkait dengan karakter tersebut. Marka molekuler tidak dipengaruhi oleh kondisi lingkungan dan dapat terdeteksi pada semua fase pertumbuhan tanaman. Marka molekuler telah digunakan secara luas oleh para pemulia tanaman karena menyediakan informasi genetik yang sangat berguna pada tingkat molekuler (Roy et al. 2006).
Ahn et al. (1992) telah melaporkan marka DNA yang berhubungan dengan gen fgr padi pada kromosom nomor 8. Marka yang digunakan adalah RFLP untuk mendeteksi gen aroma pada varietas turunan Della. Analisis RFLP yang menggunakan RG28 menunjukkan bahwa pada kromosom nomor 8 terdapat gen tunggal yang merupakan penyebab aroma pada jarak 4.5 cM (senti Morgan).
Namun, penggunaan marka-marka tersebut hanya dapat mendeteksi gen aromatik saja dan tidak dapat membedakan status dari gen yang telah terdeteksi tersebut (utuh atau terdelesi). Penelitian Bradbury et al. (2005b) dan Lang & Buu (2008) mengenai perbandingan sekuen padi aromatik dan non-aromatik di berbagai negara menghasilkan pengembangan sebuah marka molekuler yang dapat mendeteksi sekaligus dapat membedakan padi aromatik dan non-aromatik. Metode seleksi dengan PCR marka aromatik yang menggunakan primer Bradbury dan RM223 merupakan metode yang paling sensitif karena melalui amplifikasi gen.
Marka Aromatik PCR
Penemuan teknik marka gen yang mengendalikan suatu karakter sebagai penanda sangat membantu dalam proses seleksi. Marka gen atau yang sering juga dikenal dengan nama marka molekuler digunakan berdasarkan pada polimorfisme yang terdeteksi pada tingkat molekul di dalam sel. Metode ini melakukan pelacakan sifat-sifat tanaman berdasarkan DNA yang dimiliki tanaman. Pemanfaatan marka molekuler dalam pemuliaan tanaman salah satunya adalah untuk mempercepat seleksi kembalinya genom tetua pemulih dalam persilangan silang balik. Sebuah metode digunakan untuk menyeleksi hasil persilangan antara padi aromatik dan non-aromatik dengan menggunakan marka molekuler aromatik berbasis PCR (Corderio
et al. 2002).
Sebuah uji dengan metode sederhana yang digunakan untuk skrining padi dan penentuan aroma di antara berbagai macam jenis padi dan segregasi populasi, memiliki beberapa kelebihan yaitu sederhana dan cepat (Badbury
et al. 2005a). Perbanyakan fragmen DNA dilakukan secara selektif dan spesifik oleh sepasang oligonukleotida yang dikenal sebagai primer. Metode seleksi generasi hasil persilangan menggunakan metode PCR berbasis marka aromatik. Marka aromatik
yang digunakan dalam penelitian ini adalah primer Bradbury et al. (2005b) dan primer Lang & Buu (2008). Walaupun telah terbukti pada berbagai varietas padi di berbagai negara, namun marka-marka tersebut belum pernah digunakan untuk varietas padi Indonesia.
Primer Bradbury memiliki beberapa kelebihan yaitu mampu membedakan padi aromatik dan non-aromatik, melalui identifikasi alel homozigot aroma, homozigot nonaroma serta heterozigot dalam suatu populasi yang bersegregasi. Primer Bradbury terdiri atas dua buah primer eksternal dan dua buah primer internal. Primer internal yang terdiri atas internal fragrant antisense primer (IFAP) dan internal nonfragrant sense primer (INSP), sedangkan primer eksternalnya terdiri atas external sense primer (ESP), external antisense primer
(EAP). Primer eksternal dirancang sebagai kontrol positif yang akan mengamplifikasi daerah di 580 bp pada padi aromatik dan non-aromatik.
Kombinasi primer eksternal dan internal dari primer Bradbury akan memberikan produk dengan berbagai ukuran tergantung dari genotip DNA sampel (Gambar 3). Campuran primer ESP dan IFAP akan menghasilkan pita berukuran 257 bp yang menunjukkan bahwa alel tersebut berasal dari padi aromatik, sedangkan campuran dari INSP dan EAP akan menghasilkan pita berukuran 355 bp yang menunjukkan bahwa alel tersebut berasal dari padi non-aromatik. Alel aromatik (bawah) dan alel non-aromatik (atas) berkorespondensi di daerah intron 5-8 (warna biru) dan daerah ekson 6-7 (warna merah muda). Ekson 7 pada alel aromatik menunjukkan adanya mutasi atau delesi basa dan dapat diamplifikasi melalui PCR menggunakan campuran primer ESP dan IFAP.
6
Lang & Buu (2008) melaporkan primer RM223 sebagai primer yang dapat membedakan pola pita dari padi aromatik dan non-aromatik berdasarkan ukuran DNA padi penyandi gen aromatik. Sebuah marka SSR (single sekuen repeat) yang berhasil mengamplifikasi lokus target sekaligus membedakan polimorfisme di antara tetua tanaman padi telah berhasil dilakukan untuk menyeleksi hasil persilangan antara padi varietas aromatik Thailand yaitu Jasmine 85 dengan non-aromatik C53. Sepasang primer RM223 yang terdiri atas forward dan reverse
digunakan dalam reaksi amplifikasi untuk membedakan padi aromatik Jasmine 85, non-aromatik C53, dan hasil persilangannya pada generasi BC2F2.
Prinsip kerja primer RM223 ini berdasarkan pada reaksi amplifikasi dengan ulangan berupa sekuen pendek. Primer RM223 memberikan gambaran polimorfisme pada generasi BC2F2 yang menghasilkan fragmen DNA dengan ukuran variasi 90 bp hingga 190 bp (Gambar 4). Varietas Jasmine yang merupakan tetua aromatik menghasilkan ukuran di 120 bp dan varietas C53 yang merupakan tetua non-aromatik menghasilkan ukuran fragmen 160 bp. Ukuran dari fragmen-fragmen DNA yang dapat teramplifikasi pada tanaman padi aromatik dan non-aromatik oleh primer ini mempunyai panjang fragmen DNA yang besarnya bervariasi antara 120 bp hingga 160 bp. Ukuran fragmen DNA yang diamplifikasi menggunakan primer ini tidak seragam pada tiap varietasnya. Primer RM223 memiliki kelebihan yaitu mampu membedakan polimorfisme pada kedua jenis tanaman padi tersebut (Lang & Buu 2008). Namun, primer berbasis SSR ini memiliki kelemahan yaitu marka ini hanya berhubungan dengan gen aroma dan tidak dapat diprediksi status wangi (aroma) dari salah satu contoh beras dengan akurasi 100% (Badbury et al. 2005b).
Gambar 4 Ukuran amplikon dengan marka RM223
Metode Silang Terarah (Site-directed Crossing)
Metode pemuliaan tanaman dibagi menjadi tiga yaitu metode konvensional
(random crossing), persilangan terarah (site- directed crossing), dan rekayasa genetik. Persilangan konvensional merupakan metode yang lebih dahulu dikembangkan, memiliki kelebihan berupa waktu pengerjaannya lebih singkat sekitar 8 hingga 10 bulan bila belum tersedia dari awal atau dapat berlangsung 4 hingga 5 bulan bila sudah tersedia tanaman BC4F1. Namun, metode ini memiliki kelemahan yaitu penggabungan sifat tidak spesifik, memiliki ketepatan terhadap sekumpulan gen, melibatkan organisme utuh, dan hanya dapat digunakan dalam satu spesies atau genus (Nasution 2002).
Rekayasa genetik dapat digunakan tanpa ada batasan taksonomi (dalam spesies yang berbeda) dan hanya melibatkan sel atau molekul. Namun, rekayasa genetik ini akan menghasilkan organisme modifikasi yang stabilitasnya belum teruji untuk waktu yang lama. Secara ekologi penggunaan organisme modifikasi dikhawatirkan akan mengganggu tekstur dan struktur tanah. Gen yang dipindahkan ke tanaman transgenik akan menghasilkan endotoksin yang dapat mencegah serangan hama dalam tanah. Sisa tanaman transgenik tersebut yang masih mengandung toksin dapat mematikan mikroorganisme dan organisme di dalam tanah, sehingga terjadi degradasi bakteri maupun organisme di dalam tanah, yang akan mengubah struktur dan tekstur tanah dalam jangka waktu tertentu (Dekeyser & Motagu 1990).
Perdebatan mengenai penggunaan organisme hasil modifikasi genetik atau yang lebih dikenal dengan genetically modified organism (GMO) telah menimbulkan arus pertentangan antara setuju dan yang kurang setuju. Hal ini perlu diantisipasi dengan menghindari metode-metode pengembangan yang menghasilkan produk tanaman transgenik. Metode persilangan terarah merupakan metode alternatif yang dapat digunakan untuk memasukkan sifat tertentu secara spesifik tanpa harus melalui rekayasa genetik yang menghasilkan produk tanaman transgenik (Mackill et al. 2007).
Metode site-directed crossing yang sering digunakan dengan nama marker-assisted backcrossing atau PCR-assisted backcrossing
genetik saja dan tidak dipengaruhi oleh lingkungan. Oleh karena itu, kegiatan pemuliaan menjadi lebih cepat, tepat, dan relatif lebih hemat biaya dan waktu (Azrai 2005). Melalui metode ini, pemasukkan gen donor dapat diminimalisasi dan hanya sifat yang diinginkan yang terinduksi pada tanaman induk. Pemindahan gen padi aromatik ke padi non-aromatik untuk menghasilkan turunan varietas aromatik pada penelitian ini dilakukan dengan metode persilangan terarah. Padi non-aromatik akan disilangkan dengan padi aromatik selanjutnya individu turunannya akan disilangkan balik dengan tetuanya dari non-aromatik. Proses silang balik ini akan diulangi lima kali sampai generasi BC5F1. Silang balik merupakan teknik persilangan yang dapat digunakan untuk memindahkan satu atau beberapa gen yang diinginkan dari tanaman donor ke tanaman penerima. Namun, diperlukan persilangan silang balik beberapa kali agar diperoleh introgresi sifat yang diinginkan dan sekecil mungkin membawa introgresi negatif fragmen liar yang tidak diinginkan (Reyes 2000).
Gen badh2 pada generasi silang balik selalu dalam keadaan heterozigot, sementara gen ini hanya terekspresi dalam keadaan resesif dan keberadaannya tidak dapat dideteksi dengan uji aroma. Oleh karena itu, digunakan marka molekular berbasis PCR untuk melacak keberadaan alel gen badh2
dari padi aromatik Pandan Wangi dan Mentik Wangi pada individu turunan di setiap generasi silang balik. Tanpa bantuan analisis molekuler PCR, penyerbukan sendiri harus selalu dilakukan pada setiap generasi silang balik, sehingga jangka waktu penelitian menjadi dua kali lebih lama (Mackill et al.
2007).
Persilangan terarah merupakan metode persilangan yang memiliki kelebihan yaitu penggabungan sifat tanaman bersifat spesifik atau selektif dengan ketepatan terhadap satu gen tunggal, memiliki stabilitas gen selama puluhan tahun, menghasilkan produk yang aman (bukan organisme modifikasi) dengan kepastian perubahan genetiknya mudah atau dapat dikarakterisasi dengan baik, waktu pengerjaannya 2 hingga 3 tahun bila mulai dari awal atau 8 hingga 10 bulan jika belum tersedia BC4F1 atau dapat berlangsung lebih singkat yaitu 4 hingga 5 bulan jika sudah tersedia BC4F1. Kelemahan dari persilangan terarah adalah metode ini hanya dapat digunakan dalam satu spesies atau genus dan melibatkan organisme utuh (Nasution 2002).
BAHAN DAN METODE
Alat dan Bahan
Bahan-bahan yang digunakan untuk isolasi DNA padi yaitu daun padi hasil persilangan (BC5F1) Ciherang/Pandan Wangi (107 tanaman) dan daun padi hasil persilangan (BC4F1) Ciherang/Mentik Wangi (90 tanaman), etanol 70%, nitrogen cair, buffer CTAB yaitu buffer ekstrak yang mengandung Tris-HCl (pH 8.0), etilendiamin tetraasetat (EDTA), natrium klorida (NaCl), setiltrimetil amonium bromida (CTAB), kloroform, isoamil alkohol, dan isopropanol. Bahan-bahan yang digunakan untuk menguji hasil isolasi DNA dengan PCR adalah buffer PCR 10x, MgCl2 50mM, dNTP mix 10 mM, buffer Tris-EDTA (TE) yang mengandung ribonuklease. Reaksi PCR menggunakan buffer PCR, MgCl2, dNTP (dATP, dCTP, dGTP, dTTP), primer Bradbury (ESP, EAP, IFAP, dan INSP), primer Lang & Buu (RM223), DNA hasil isolasi, Taq polimerase (FastStart), dan ddH2O. Selain itu, bahan lain yang digunakan pada analisis elektroforesis adalah agarosa, buffer Tris HCl - asam asetat - EDTA (TAE) etidium bromida (etbr), dan DNA standar (1 kb ladder).
Alat-alat yang digunakan dalam penelitian adalah gunting, spidol marker, microfuge, autopipet, neraca analitik, autoklaf, ruang asam, tissuelizer, pelor, vortex, gelas piala, labu Erlenmeyer, magnetic stirrer, UV
illuminator Chemidoc EQ Biorad, elektroforesis, tip, tabung mikro, kertas alumunium, stopwatch, waterbath,
microwave, stirrer plate, dan cawan Petri.
Metode
Isolasi DNA Padi (Doyle & Doyle 1987; Shure et al. 1983)
8
tissuelizer di lakukan dua kali agar hasilnya lebih lembut yang kemudian hasilnya dimasukkan buffer ekstraksi sebanyak 1000 µL. Setelah itu diinkubasi di dalam penangas air pada suhu 65°C selama 15 menit. Setiap 5 menit sekali tabung dibolak-balik agar tercampur dengan rata.
Pemurnian DNA dilakukan melalui penambahan natrium asetat 3M sebanyak 100 µL dan kloroform isoamilalkohol sebanyak 1000 µL ke dalam tabung, kemudian dikocok hingga merata. Suspensi selanjutnya disentrifugasi dengan kecepatan 12000 rpm selama 5 menit. Hasil sentrifugasi menghasilkan pelet dan supernatan yang kemudian diambil supernatannya dan dimasukkan ke dalam Eppendorf 1.5 mL.
Pemekatan DNA dilakukan dengan penambahan natrium asetat 3M sebanyak 70 µL dan isopropanol sebanyak 500 µL ke dalam supernatan dan dicampur perlahan. Sampel disentrifugasi pada kecepatan 12000 rpm selama 15 menit. Pelet yang diperoleh dicuci dengan 500 µL etanol 70%. Campuran disentrifugasi kembali selama 5 menit pada kecepatan 12000 rpm. Pelet selanjutnya dikeringkan dalam oven selama 10 menit. Pelet yang telah kering dilarutkan dalam bufer TE yang mengandung ribonuklease sebanyak 50 µL dan diinkubasi pada suhu 37°C selama 30 menit.
Pengukuran Kuantitas dan Kualitas DNA
Hasil isolasi DNA sampel yang telah didapatkan selajutnya dilakukan kuantifikasi untuk melihat konsentrasi dan kemurniannya. Konsentrasi dan kemurnian DNA dari masing-masing hasil isolasi diuji dengan menggunakan suatu alat yang bernama nano drop untuk diukur pada panjang gelombang 260 nm dan 280 nm. Kemurnian DNA ditetapkan berdasarkan nilai perbandingan A260/A280 dengan satuan ng/µl. Batas kemurnian yang biasa dipakai dalam analisis molekuler pada rasio A260/A280 adalah 1.8-2.0 (Sambrook et al. 1989). Selain didapat nilai kemurnian DNA, alat ini juga dapat langsung diketahui konsentrasi DNA sampel.
Total volume yang digunakan untuk pengukuran sebanyak 2 µL sampel. Sebelum dilakukan pengukuran pada sampel terlebih dahulu harus digunakan blanko berupa buffer TE yang digunakan dalam tahap akhir isolasi DNA sampel. Kualitas DNA diuji dengan elektroforesis untuk mengetahui ada atau tidaknya DNA dengan melihat pita yang terbentuk. Elektroforesis DNA hasil isolasi dilakukan pada gel agarosa 1%.
Seleksi PCR dengan Marka RM223 (Lang & Buu 2008)
Tanaman BC5F1 hasil persilangan Ciherang/Pandan Wangi perlu dilakukan seleksi untuk memastikan bahwa individu yang dihasilkan untuk dilakukan persilangan balik dengan tetua non-aromatik (Ciherang) mengandung alel heterozigot. Seleksi tanaman BC5F1 hasil persilangan Ciherang dan Pandan Wangi menggunakan primer RM223
.
Primer RM223 mampu membedakan padi varietas aromatik dan non-aromatik berdasarkan ukuran pita DNA. Primer RM223 mengandung sekuen basa forward 5’ - GAGTGAGCTTGGGCTTGGGCTGAAAC-3’ dan sekuen basa reverse 5’ -GAAGGCAAGTCTTGGCACTG-3’. Ukuran DNA yang teramplifikasi menggunakan primer RM223 adalah 120 bp – 160 bp (Lang & Buu 2008). Reaksi amplifikasi dilakukan sebanyak 35 siklus yang terdiri atas denaturasi awal selama 5 menit pada suhu 94ºC, denaturasi selama 1 menit pada suhu 94ºC, penempelan primer RM223 selama 30 detik pada suhu 55ºC dan perpanjangan primer selama 1 menit pada suhu 72ºC. Perpanjangan primer terakhir terjadi selama 5 menit pada suhu 72ºC.
Analisis PCR dilakukan dengan mesin PCR TETRAD menggunakan program RM223 untuk primer RM223 dan program BAD2 untuk primer Bradbury. Jumlah total volume yang digunakan adalah 20 µL, berisi 2.0 µL buffer PCR (10 mM Tris-HCl (pH 8.3)), 1.2 µL MgCl2 50 mM, 0.4 µL dNTP (dATP, dCTP, dGTP, dTTP) 5 mM, 1 µL masing-masing primer (RM223 forward dan RM223 reverse), 0.16 µL DNA Taq
polymerase, 2 µL DNA sampel 50 µg/mL dan ditepatkan volumenya menjadi 20 µL dengan ddH2O sebanyak 12.24 µL.
Seleksi PCR dengan Marka Bradbury (Bradbury 2005)
Primer Bradbury menggunakan empat primer masing-masing terdiri atas 2 primer eksternal dan 2 primer internal. Primer eksternal terdiri eksternal antisense primer
(EAP) dengan sekuen 5’
-AGTGCTTTACAAAGTCCCG-3’, eksternal sense primer (ESP) dengan sekuen 5’ -TTGTTTGGAGCTTGCTGATG-3’. Primer internal terdiri atas internal nonfragrant sense primer (INSP) dengan sekuen 5’ -CTGGTAAAAAGATTATGGCTTCA-3’ dan
Pasangan primer eksternal EAP dan ESP akan menghasilkan fragmen berukuran 580 bp sebagai kontrol positif untuk masing-masing sampel. Pasangan primer IFAP dan ESP akan menghasilkan fragmen alel aromatik berukuran 257 bp. Pasangan primer INSP dan EAP akan menghasilkan fragment alel non-aromatik berukuran 355 bp (Bradbury 2005b). Reaksi amplifikasi dilakukan sebanyak 30 siklus yang terdiri atas denaturasi awal selama 2 menit pada suhu 94ºC, denaturasi selama 30 menit pada suhu 94ºC, penempelan primer selama 30 menit pada suhu 58ºC dan perpanjangan primer selama 45 menit pada suhu 72ºC. Perpanjangan primer terakhir selama 5 menit pada suhu 72 ºC.
Sedangkan untuk PCR dengan program BAD2, jumlah total volume yang digunakan adalah 20 µL, berisi 2.0 µL buffer PCR (10 mM Tris-HCl (pH 8.3)), 1.2 µL MgCl2 50 mM, 0.4 µL dNTP (dATP, dCTP, dGTP, dTTP) 5 mM, 1 µL masing-masing primer (ESP, EAP, INSP dan IFAP), 0.16 µL DNA
Taq polymerase, 2 µL DNA sampel 50 µg/mL dan ditepatkan hingga total volumenya menjadi 20 µL dengan ddH2O sebanyak 10.24 µL.
Konfirmasi DNA dengan Elektroforesis
Hasil isolasi DNA dan hasil PCR perlu dilakukan konfirmasi untuk mengetahui kualitas DNA hasil isolasi dan ukuran DNA hasil amplifikasi. Konfirmasi DNA hasil isolasi menggunakan agarosa 1%. Sebanyak 4 µL DNA sampel dicampur dengan 2 µL
loading dye. Kemudian disertakan DNA lambda dengan konsentrasi 20 ng/µL dan 40 ng/µL. Konsentrasi gel agarose yang digunakan untuk konfirmasi produk PCR adalah 3% untuk produk PCR dengan menggunakan program RM223 dan 2% untuk produk PCR dengan menggunakan program BAD2 serta disertakan marker 1 kb ladder untuk mengetahui ukuran DNA hasil amplifikasi (Lang & Buu 2008).
Gel agarosa direndam dalam tangki elektroforesis yang berisi 1x buffer TAE dan dialiri arus dengan tegangan 90 volt selama 120 menit. Tahap selanjutnya dilakukan proses pewarnaan dengan larutan etidium bromide (10mg/L) selama 10 menit, kemudian dibilas dengan air selama 10 menit. Proses pewarnaan dan pembilasan dilakukan dengan digoyang pelan menggunakan shaker. Gel agarose selanjutnya divisualisasi atau ditampakkan dengan menggunakan chemidoc gel system pada panjang gelombang 260 nm (Sambrook et al. 1989).
HASIL DAN PEMBAHASAN
Penggabungan dua sifat tanaman melalui proses pembuahan di sebut dengan istilah persilangan tanaman. Benih dihasilkan dari proses jatuhnya benang sari ke kepala putik yang kemudian menghasilkan embrio. Embrio inilah yang kemudian berkembang menjadi benih. Kombinasi karakter yang dihasilkan dari kedua tetua individu pada generasi pertama akan terjadi secara acak. Sehingga dapat dihasilkan kombinasi sifat anakan yang menguntungkan dari keduanya (Welsh 1981).
Pada penelitian ini dilakukan proses silang balik yang artinya tanaman hasil persilangan (F1) di kawinkan kembali dengan tetuanya. Dalam hal ini berarti tanaman padi BC4F1 CM disilangbalikkan dengan tetua Ciherang sehingga menghasilkan BC5F1 CM. Proses persilangan balik ini dilakukan sampai silang balik yang kelima agar mendapatkan tanaman hasil persilangan yang stabil jika dilakukan pembuahan sendiri (selfing). Seleksi dengan menggunakan PCR dilakukan terhadap tanaman hasil persilangan untuk menyeleksi tanaman yang positif mengandung gen aroma yaitu gen badh2. Proses seleksi ini dilakukan pada setiap tanaman hasil silang balik. Setelah didapatkan BC5F1 dan BC5F2 masih harus dilakukan identifikasi gen aroma untuk memastikan bahwa tanaman yang dihasilkan memiliki gen aromatik. Sehingga bisa disimpulkan bahwa gen aromatik tersebut sudah stabil berada pada tanaman tersebut meskipun telah mengalami pembuahan sendiri atau selfing seperti yang diperlihatkan pada Gambar 5.
Kuantitatif dan Kualitatif DNA BC5F1 CP dan BC4F1 CM
10
tanaman. Sehingga diharapkan kemurnian DNA yang diperoleh akan lebih tinggi.
Kemurnian DNA yang diperoleh memiliki rata-rata rasio nilai kemurnian sebesar 1.90 untuk DNA BC4F1 CM dan 1.94 untuk DNA BC5F1 CP. Data hasil analisis kuantitatif DNA ditunjukkan pada Lampiran 3 dan 4. Nilai rasio kemurnian DNA yang baik adalah 1.8 hingga 2.0. Nilai rasio kemurnian DNA yang kurang dari 1.8 menunjukkan bahwa sampel DNA memiliki kontaminan berupa protein, sedangkan nilai rasio kemurnian DNA yang lebih dari 2.0 menunjukkan bahwa sampel DNA memiliki kontaminan berupa RNA (Sambrook et al. 1989).
Pengujian kualitatif DNA dilakukan dengan elektroforesis gel agarosa. Uji kualitatif ini menghasilkan pita-pita untuk mengetahui ada atau tidaknya DNA hasil isolasi. Pola pita DNA hasil isolasi menunjukkan DNA sudah murni. Hal itu ditunjukkan dengan pita DNA yang tampak jelas pada gel agarosa (Gambar 5).
Gambar 5 Elektroforegram uji kualitatif DNA hasil isolasi
Hasil amplifikasi DNA tanaman padi BC5F1 CP menggunakan Marka RM223
Untuk menyeleksi tanaman padi BC5F1 CP Ciherang/Pandan Wangi ini digunakan marka RM223. Penggunaan marka RM223 ini berdasarkan penelitian sebelumnya yang dilakukan Fatahajudin (2011). Marka RM223 ini dapat membedakan pola amplifikasi yang disebabkan oleh adanya polimorfisme pada kromosom 8 antara padi Ciherang dengan Pandan Wangi dengan jelas. Menurut Lang & Buu (2008) marka RM223 ini memiliki keunggulan lain jika dibandingkan dengan marka Bradbury yaitu mampu membedakan homozigot aroma (resesif), homozigot nonaroma (dominan), dan heterozigot.
Marka RM223 ini terdiri dari dua bagian yaitu forward dan reverse. Marka RM223 dapat mengamplifikasi DNA padi Ciherang yang non-aromatik dengan ukuran basa sebesar 160 bp dan padi Pandan Wangi yang aromatik dengan ukuran basa sebesar 140 bp
sehingga BC5F1 CP akan menghasilkan dua pita yaitu pada ukuran 160 bp dan 140 bp (Gambar 3)(Lang & Buu 2008). Sampel DNA hasil PCR divisualisasikan dengan menggunakan elektroforesis memakai gel agarosa 3%. Penggunaan konsentrasi tersebut dikarenakan perbedaan basa yang sangat kecil dari kedua pita yang dihasilkan pada sampel yaitu berbeda 20 bp. Perbedaan jarak dari hasil PCR tersebut tidak akan terlihat jelas apabila digunakan konsentrasi gel agarosa di bawah 3%.
Hasil elektroforesis dari seratus tujuh sampel tanaman padi BC5F1 CP (Lampiran 5) menunjukkan bahwa terdapat empat puluh tiga sampel padi BC5F1 CP yang positif mengandung gen heterozigot badh2. Hasil elektroforesis gel agarosa memperlihatkan tanaman BC5F1 CP yang positif memiliki gen aromatik ditunjukkan dengan dua buah pita yang merupakan kombinasi dari kedua tetua padi BC5F1 CP yaitu Ciherang dan Pandan wangi, sedangkan yang tidak mengandung gen aromatik hanya memiliki satu pita.
Gambar 6 merupakan contoh
elektroforegramnya.
Gambar 6 Hasil amplifikasi DNA tanaman padi BC5F1 CP menggunakan marka RM223. M = Marker 1 kb ladder; C = Ciherang; P = Pandan Wangi; nomor 1-21 = tanaman BC5F1 CP; * = sampel positif
Hasil amplifikasi DNA tanaman padi BC4F1 CM menggunakan Marka
Bradbury
tidak dapat dibedakan oleh marka RM223 karena memiliki pola pita DNA yang berbeda dengan varietas padi Pandan Wangi, yaitu adanya perbedaan delesi pada kromosom 8. Oleh karena itu, digunakanlah marka Bradbury untuk menyeleksi tanaman BC4F1 CM (Fatahajudin 2011).
Menurut Lang & Buu (2008), marka Bradbury yang digunakan terdiri atas dua buah primer eksternal dan dua buah primer internal. Primer internal terdiri dari dua buah primer yaitu primer IFAP dan primer INSP, sedangkan primer eksternalnya terdiri dari duah buah primer yaitu primer ESP dan primer EAP. Primer eksternal yaitu primer EAP dan primer ESP akan menempel pada kedua jenis padi (non-aromatik dan aromatik) yang akan mengamplifikasi DNA dan membentuk kontrol positif dengan ukuran 580 bp. Pasangan primer EAP dan primer INSP akan menempel pada padi varietas non-aromatik dan akan menghasilkan pita DNA yang berukuran 355 bp. Sedangkan, pasangan primer ESP dan primer IFAP akan menempel pada padi varietas aromatik dan menghasilkan pita DNA dengan ukuran 257 bp (Gambar 4). Dengan demikian padi tetua Ciherang akan menghasilkan dua pita DNA yang masing-masing berukuran 580 bp dan 355 bp, sedangkan padi tetua Mentik Wangi akan menghasilkan dua pita DNA yang masing-masing berukuran 580 bp dan 257 bp. Hasil persilangan dari kedua varietas padi Ciherang dan Mentik Wangi menghasilkan tiga buah pita DNA dengan ukuran 580 bp, 355 bp, dan 257 bp.
Konsentrasi gel agarosa yang digunakan untuk menyeleksi hasil persilangan balik Ciherang/Mentik wangi berbeda dengan konsentrasi yang digunakan untuk menyeleksi hasil persilangan balik Ciherang/Pandan Wangi. Konsentrasi gel agarosa yang digunakan lebih kecil yaitu 2%. Pemilihan konsentrasi ini berdasarkan perbedaan ukuran pita DNA yang dihasilkan. Hasil PCR dengan marka Bradbury menghasilkan perbedaan pita DNA yang lebih besar sehingga menggunakan konsentrasi gel agarosa yang lebih kecil.
Sebanyak sembilan puluh sampel tanaman padi BC4F1 CM yang di elektroforesis menunjukkan tujuh belas sampel diantaranya positif mengandung gen heterozigot badh2. Penampakan pada gel agarosa menunjukkan adanya dua buah pita yang merupakan kombinasi dari kedua tetua padi Ciherang dan Mentik Wangi (Lampiran 6). Gambar 7 merupakan contoh hasil elektroforegram yang diperoleh. Dua buah pita yang merupakan gen
heterozigot badh2 tersebut merupakan kombinasi dari tetua Ciherang 355 bp dan Mentik Wangi 257 bp. Hasil tersebut didukung pernyataan Bradbury (2005) dan penelitian-penelitian sebelumnya (Padmadi 2009; Praptiwi 2010; Sugihartati 2010; Taufiq 2011; Fatahajudin 2011). Ukuran produk amplifikasi padi Mentik Wangi yang diperoleh dari penelitian lebih kecil dari padi Ciherang yang disebabkan oleh adanya delesi basa pada gen badh2. Selain itu, pola hasil amplifikasi pada tanaman BC4F1 CM bersifat heterozigot karena mengandung gen dari kedua tetua Ciherang dan Mentik Wangi.
Gambar 7 Hasil amplifikasi DNA tanaman padi BC4F1 CM menggunakan marka Bradbury. M = Marker 1 kb ladder; C = Ciherang; MW = Mentik Wangi; nomor 19-27 = tanaman BC4F1 CM; * = sampel positif
SIMPULAN DAN SARAN
Simpulan
Identifikasi gen aroma pada tanaman padi BC5F1 CP dan BC4F1 berhasil dilakukan. Marka RM223 dan marka Bradbury telah berhasil melacak introgresi gen aroma tanaman padi Pandan Wangi atau Mentik Wangi ke padi Ciherang. Hal tersebut terlihat dari pita heterozigot sampel progeni BC5F1 CP menggunakan marka RM223 dengan ukuran pita DNA 120 bp dan 160 bp dan BC4F1 CM menggunakan marka Bradbury dengan ukuran pita DNA 257 bp, 355 bp, dan 580 bp.
Saran
12
spesifik lagi dalam menentukan padi aromatik dan padi non-aromatik tersebut.
DAFTAR PUSTAKA
Adijono et al. 1993. Pemuliaan Padi Aromatik dan Ketan. Di dalam: Mahyudin S, editor. Kinerja Penelitian Tanaman Pangan. Bogor: IPB Pr. hlm.422-428.
Ahn SN, Bollisch CN, Tanksley SD. 1992. RFLP tagging of a gene for aroma in rice. Theor Appl Genet 84:825–828. Azrai M. 2005. Pemanfaatan markah
molekuler dalam proses seleksi pemuliaan tanaman. J Agro Biogen
1:26-37.
Berner DK, Hoff BJ. 1986. Inheritance of scent in American long grain rice. J Crop Sci 26:876-878.
Bourgis et al. 2008. Characterization of the major fragance gene from an aromatic japonica rice and analysis of its diversity in Asian cultivated rice. Theor Appl Genet 117: 353– 368.
Bradbury LMT, Fitgerald TL, Henry RJ, Jin Q, Waters DLE. 2005a. The gene for fragrance in rice. J Plant Biotech
3:363–370.
Bradbury LMT, Henry RJ, Jin Q, Reinke RF, Waters DLE. 2005b. A perfect marker for fragrance genotyping in rice. J Mol Breed 16:279–283. Buttery RG, Ling LC, Juliano BO, Turnbaugh
JG. 1983. Cooked rice aroma and 2-acetyl–1-pyroline in rice. J Agric Food Chem 31:823–826.
Corderio GM, Christopher MJ, Henry RJ, Reinke RF. 2002. Identification of microsatellite markers for fragrance in rice by analysis of the rice genome sequence. J Mol Breed 9:245-250. Dekeyser RPL, Motagu MV. 1990.
Transgenic plants. [Di dalam]: Gene manipulation in plant improvement II. New York Plenum Pr.
Doyle JJ, Doyle JL. 1987. A rapid DNA
isolation from small amount of fresh leaf tissue. J Phytochem Bull 19:11-15.
Fatahajudin MT. 2011. Introduksi Gen aroma (badh2 termutasi) dari Varietas Pandan Wangi atau Mentik Wangi ke Ciherang [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Heldt W. 2005. Plant Biochemistry. German:
Elvesier All Right Reserved.
Hermanto. 2006. Padi Ciherang makin populer. Warta Penelitian dan Pengembangan Pertanian 28:14-15.
[terhubung berkala]
http://crifc@indo.net.id/journal/wart a (14 Mei 2012).
Kibria et al. 2008. Screening of aromatic rice lines by phenotypic and molecular markers. J Bot 37:141-147.
Lang NT, Buu BC. 2008. Development of PCR based markers for aroma (fgr) gene in rice (Oryza sativa L.). J Omonrice 16:16-23.
[LITBANG] Balai Penelitian Bahan Pangan. 2006. Mengenal padi VUTB Fatmawati. J Litbang 12:1-6.
Lorieux M, Petrov M, Huang N, Guiderdoni E, Ghesquiere A. 1996. Aroma in rice: genetic analysis of a quantitative trait. Theor App Genet
93:1145–1151.
Mackill et al. 2007. Marker assisted selection for submergence tolerance in rice. J Mol Plant Breed 5:207-208.
Mittal et al. 1995. Variability of aroma in some land races and cultivar of scented rice. J Crop Improv 22:109-122.
Nasution MA. 2002. Biologi molekuler dan ketahanan pangan nasional [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Praptiwi D. 2010. Pembentukan dan seleksi F1 padi Ciherang-Pandan Wangi dan Fatmawati-Mentik Wangi menggunakan marka aromatik [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Puslitbang Tanaman Pangan. 2013.
Peningkatan produksi padi menuju 2020. [terhubung berkala]. http:// http://pangan.litbang.deptan.go.id/ind ex.php?bawaan=download/download _detail&&id=35 [17 Jan 2013] Reyes MH. 2000. A model for marker based
selection in gene introgression breeding program. J Crop Sci 40: 91–98.
Sambrook J, Fritsch EF, Maniatis T. 1989.
Molecular Cloning 3rd edition. New York: Cold Spring Harbor Laboratory Pr.
Shi W, Yang Y, Chen S, Xu M. 2008. Discovery of a new fragrance allele and the development of functional markers for the breeding of fragrant rice varieties. J Mol Breeding
22:185-192.
Shivanna KR, Sawhney. 1997. Pollen Biotechnology for Crop Production and Improvement. UK: Cambridge University Pr.
Shure, Wessler MS, Fedorrof N. 1983. Molecular identification and the isolation of the waxy locus in maize.
J Cell 35:225-233.
Slamet, Loedin IH. 2000. Tanaman transgenik: Perspekstif dan tantangan di masa mendatang bagi Indonesia.
Warta Biotek LIPI 1-3.
Sood BC, Sidiq EA. 1978. A rapid technique for scent determination in rice ndian.
J Genet Plant Breed 38:268-271.
Soedyanto et al. 1978. Bercocok Tanam Jilid II. Jakarta: Yasaguna.
Srivong P, Wangsomnuk P, Pongdontri P. 2008. Characterization of a fragrant gene enzymatic activity of betaine aldehyde dehydrogenase in aromatic and nonaromatic Thai rice cultivar. J KKU Sci 36:290-301.
Stoskopf NC, Thomes DT, Christie BR. 1993.
Plant Breeding, Theory, and Practice. Oxford: Westview Pr. Welsh, James R. 1981. Dasar-dasar Genetika
dan Pemuliaan Tanaman. Jakarta: Erlangga.
Benih BC5F1 CP dan BC4F1 CM
dikecambahkan di dalam cawan Petri
(1-2 minggu)
Benih dipindahkan dalam media ember
(3-4 minggu)
Kuantifikasi hasil isolasi DNA dengan
nano drop
Lampiran 1 Diagram alir penelitian
Benih dipindahkan dalam media bak
(1-2 minggu)
Isolasi DNA
Analisis PCR dengan menggunakan
marka Bradbury atau RM223
Identifikasi menggunakan elektroforesis
16
Lampiran 2 Sekuen Primer yang digunakan dalam penelitian
No
Marka
Sekuen
1
RM223
-
Forward :
5’
GAGTGAGCTTGGGCTTGGGCTGAAAC
3’
-
Reverse :
5’
GAAGGCAAGTCTTG
GCACTG 3’
2
Bradbury
-
Eksternal :
ESP :
5’ TTGTTTGGAGCTTGCTGATG 3’
EAP :
5’ AGTGCTTTACAAAGTCCCGC 3’
-
Internal :
IFAP :
5’ CATAGGAGCAGCTGAAATATATACC 3’
INSP :
18
Lampiran 4 Hasil analisis kuantitatif DNA BC4F1 CM dengan nanodrop
No sampel
A
260A
260/A
280A
260/A
230[DNA] ng/µ L
1
15.657
1.92
1.93
782.8
2
35.908
1.93
2.06
1795.4
3
57.517
1.93
2.18
2875.9
4
47.600
1.91
2.02
2380.0
5
20.338
1.94
2.10
1016.9
6
6.682
1.88
1.51
334.1
7
31.027
1.94
2.13
1551.4
8
27.113
1.89
1.96
1355.6
9
16.640
1.90
2.04
832.0
10
19.518
1.90
2.00
975.9
11
37.568
1.94
2.16
1878.4
12
31.017
1.91
2.11
1550.8
13
44.018
1.93
2.06
2200.9
14
25.584
1.91
2.03
1279.2
15
58.819
1.94
2.07
2940.9
16
22.743
1.91
1.97
1137.2
17
48.044
1.91
2.06
2402.2
18
52.552
1.87
2.01
2627.6
19
35.192
1.92
2.07
1759.6
20
25.557
2.09
2.87
1277.9
21
27.023
1.94
2.05
1351.1
22
46.874
2.06
2.07
2343.7
23
15.789
2.07
3.74
789.4
24
35.745
1.92
2.10
1787.3
25
21.078
1.93
2.05
1053.9
26
76.433
1.93
2.13
3821.7
27
37.252
1.91
2.05
1862.6
28
42.721
1.91
2.10
2136.0
29
20.968
1.89
2.02
1048.4
30
37.243
1.90
2.10
1862.2
31
46.975
1.93
2.15
2348.7
32
51.492
1.89
2.09
2574.6
33
35.636
1.91
1.96
1781.8
34
0.339
1.37
0.23
17.0
35
28.799
1.92
2.12
1439.9
36
30.296
1.90
1.92
1514.8
37
25.909
1.89
1.96
1295.4
38
42.199
1.93
2.20
2109.9
39
47.249
1.90
2.09
2362.4
40
22.109
1.91
2.12
1105.4
41
20.090
1.92
2.00
1004.5
42
50.909
1.94
2.10
2545.5
43
47.977
1.90
2.12
2398.8
44
34.497
1.91
2.00
1724.8
Lanjutan Lampiran 4 Hasil analisis kuantitatif DNA BC4F1 CM dengan nanodrop
No sampel
A
260A
260/A
280A
260/A
230[DNA] ng/µ L
46
51.204
1.90
2.05
2560.2
47
36.587
1.90
1.94
1829.3
48
45.038
1.92
2.11
2251.9
49
54.683
1.87
1.90
2734.1
50
43.311
1.90
2.10
2165.6
51
37.202
1.89
2.07
1860.1
52
176.621
1.79
1.65
8831.1
53
45.366
1.93
2.12
2268.3
54
0.674
1.58
0.37
33.7
55
39.207
1.87
207
1960.4
56
34.451
1.88
2.06
1722.6
57
18.091
1.91
2.02
904.6
58
26.269
1.89
1.90
1313.4
59
55.717
1.94
2.11
2785.8
60
29.402
1.94
2.10
1470.1
61
56.709
1.87
2.02
2835.4
62
16.976
1.91
2.02
848.8
63
36.648
1.90
2.04
1832.4
64
20.355
2.03
2.40
1017.7
65
42.923
1.89
1.93
2146.2
66
50.871
1.91
2.08
2543.5
67
71.211
1.94
2.16
3560.6
68
41.435
1.92
2.07
2071.8
69
29.543
1.93
2.05
1477.2
70
25.336
1.86
1.71
1266.8
71
25.645
1.91
2.07
1282.2
72
0.352
1.32
0.26
17.6
73
63.510
1.92
2.22
3175.5
74
43.439
1.89
2.03
2171.9
75
29.813
1.91
1.98
1490.7
76
37.715
1.87
1.84
1885.7
77
29.995
1.90
2.00
1499.7
78
73.437
1.76
1.68
3671.8
79
31.730
1.90
2.04
1586.5
80
40.124
1.93
2.10
2006.2
81
46.864
1.92
2.13
2343.2
82
62.957
1.91
2.20
3147.9
83
53.973
1.90
2.14
2698.7
84
58.155
1.91
1.98
2907.8
85
30.063
1.91
2.09
1503.2
86
27.021
1.94
2.05
1351.1
87
60.663
1.91
2.16
3033.1
88
54.877
1.84
1.82
2743.8
89
40.000
1.89
2.07
2000.0
20
Lampiran 5 Hasil analisis kuantitatif DNA BC5F1 CP dengan nanodrop
No sampel
A
260A
260/A
280A
260/A
230[DNA] ng/µ L
1
0.438
1.88
0.28
21.9
2
101.303
1.76
1.95
5065.1
3
36.538
1.97
2.20
1826.9
4
89.409
1.96
2.11
4470.5
5
83.896
1.98
2.20
4194.8
6
85.861
2.02
2.09
4293.0
7
62.054
1.96
2.13
3102.7
8
51.634
1.94
2.05
2581.7
9
121.205
1.87
1.94
6060.3
10
15.207
1.92
2.04
760.4
11
40.006
1.99
2.11
2000.3
12
105.975
1.95
2.04
5298.7
13
66.354
2.00
2.20
3317.7
14
37.664
1.97
2.11
1883.2
15
228.885
1.99
2.17
11444.2
16
39.996
1.93
1.98
1999.8
17
31.254
1.92
1.97
1562.7
18
40.763
1.97
2.12
2038.1
19
197.065
2.03
2.12
9853.3
20
165.359
1.90
1.62
8268.0
21
26.505
1.95
2.16
1325.2
22
19.569
1.96
2.05
978.4
23
104.840
1.93
2.01
5242.0
24
69.657
1.95
2.15
3482.8
25
104.679
1.94
2.07
5234.0
26
188.812
1.97
2.10
9440.6
27
79.567
1.99
2.16
3978.3
28
184.217
2.04
2.16
9210.9
29
97.515
1.95
2.02
4875.7
30
43.030
1.78
2.21
2151.5
31
38.634
1.95
2.02
1931.7
32
50.382
1.96
2.05
2519.1
33
109.948
1.94
1.96
5497.4
34
43.522
1.97
2.11
2176.1
35
39.985
1.95
2.12
1999.2
36
98.241
1.95
2.12
4912.0
37
88.867
1.96
2.14
4443.3
38
97.720
2.00
2.12
4886.0
39
89.762
1.99
2.08
4488.1
40
28.717
1.97
2.18
1435.9
41
71.863
2.00
2.20
3593.2
42
177.356
2.02
2.20
8867.8
43
96.963
1.96
2.18
4848.1
44
78.254
1.98
2.02
3912.7
Lanjutan Lampiran 5 Hasil analisis kuantitatif DNA BC5F1 CP dengan nanodrop
No sampel
A
260A
260/A
280A
260/A
230[DNA] ng/µ L
46
81.354
1.95
2.22
4067.7
47
86.468
1.94
2.12
4323.4
48
40.115
1.94
2.18
2005.8
49
30.817
1.92
1.96
1540.8
50
65.048
1.95
2.22
3252.4
51
60.624
1.95
2.22
3031.2
52
67.605
1.94
2.10
3380.3
53
13.121
1.92
1.97
656.1
54
83.143
1.94
2.02
4157.2
55
52.622
1.92
2.12
2631.1
56
41.601
1.91
2.11
2080.1
57
80.472
1.94
2.10
4023.6
58
81.858
1.94
2.23
4092.9
59
92.331
1.94
2.15
46165.0
60
89.879
1.95
2.22
4493.9
61
94.566
1.93
2.22
4728.3
62
62.470
1.96
2.21
3123.5
63
81.287
1.96
2.21
4064.3
64
85.411
1.93
1.99
4270.6
65
98.197
1.91
2.05
4909.8
66
49.159
1.90
1.94
2457.9
67
25.395
1.95
2.14
1269.8
68
80.609
1.94
2.19
4030.5
69
84.320
1.95
2.24
4216.0
70
26.063
1.96
2.18
1303.2
71
39.948
1.94
2.16
1997.4
72
50.198
1.90
2.05
2509.9
73
29.361
1.94
2.11
1468.1
74
45.703
1.95
2.26
2285.2
75
26.434
1.97
2.37
1321.7
76
39.675
1.98
2.24
1983.7
77
24.664
1.97
2.40
1233.2
78
36.231
1.97
2.34
1811.6
79
24.331
1.96
2.51
1216.5
80
64.998
1.96
2.37
3249.9
81
46.198
1.95
2.32
2309.9
82
29.226
1.93