ELY ERMAYANTI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
ELY ERMAYANTI. Komponen Kimia Chetoceros gracilis yang dikultivasi
di Outdoor menggunakan media pupuk NPSi. Dibimbing oleh IRIANI SETYANINGSIH dan DESNIAR.
Mikroalga merupakan salah satu biota perairan yang memiliki potensi yang tinggi untuk dikembangkan. Salah satu jenisnya adalah Chaetoceros gracilis.Banyak faktor yang dapat mempengaruhi pertumbuhan dan
komposisi kimia dari mikroalga, antara lain kondisi lingkungan dan jenis media kultivasi. Tujuan penelitian ini adalah mendapatkan kurva pertumbuhan dan
komposisi biokimia (proksimat, asam lemak, mineral, dan fitokimia) dari C. gracilis yang dikultivasi diluar ruangan menggunakan media NPSi (Nitrogen,
Phospat, Silika). Penelitian ini dilakukan dengan mengkultivasi C. gracilis pada media NPSi dan dikultivasi di luar ruangan, kemudian penentuan kurva pertumbuhan, dan penentuan komposisi biokimia C. gracilis meliputi lemak,
protein, karbohidrat, abu, asam lemak, mineral, dan fitokimia. Chaetoceros gracilis yang dikultivasi di luar ruangan menggunakan media
NPSi mengalami fase log, fase stasioner, dan fase kematian dalam pertumbuhannya. Fase log terjadi pada hari ke-0 sampai hari ke-7. Fase stasioner terjadi pada hari ke-8 sampai hari ke-19. Fase kematian pada kultur dengan media pupuk NPSi mulai terjadi pada hari ke-20.
ELY ERMAYANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Nama : Ely Ermayanti NIM : C34060432
Menyetujui
Pembimbing I, Pembimbing II,
(Dr. Ir. Iriani Setyaningsih, MS) (Desniar, SPi. MSi) NIP. 1960 0925 1986 01 2001 NIP. 1970 1224 1997 02 2001
Mengetahui: Ketua Departemen
(Dr. Ruddy Suwandi, MS.,M Phil.) NIP. 1958 0511 1985 03 1002
Dengan ini menyatakan bahwa skripsi dengan judul “Komponen Kimia Chetoceros gracilis yang Dikultivasi di Outdoor Menggunakan Media Pupuk NPSi” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun di Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Februari 2011
Puji dan syukur penulis panjatkan kehadirat Allah SWT, karena berkat rahmat dan hidayah-Nya penulis dapat menyelesaikan penyusunan skripsi ini. Hanya dengan izin-Nya penulis dapat menyelesaikan penulisan skripsi dengan judul Komponen Kimia Chaetoceros gracilis Dikultivasi di Outdoor Menggunakan Media Pupuk NPSi.
Penulis ingin mengucapkan terima kasih kepada Dr. Ir. Iriani Setyaningsih, MS dan Desniar, S.Pi, M.Si selaku dosen pembimbing. Terima kasih kepada Dra. Ella Salamah, MSi sebagai dosen penguji. Terima kasih kepada Dr. Ir. Ruddy Suwandi, MS, M.Phil. sebagai Ketua Departemen Teknologi Hasil Perairan. Terima kasih kepada Dr. Ir. Agoes Mardiono Jacoeb Dipl. Biol, sebagai Ketua Program Studi Departemen Teknologi Hasil Perairan. Terima kasih kepada ibu Ema, Mas Saeful, Mbak Silvi, dan Mbak Lastri yang telah banyak membantu penulis dalam menyelesaikan penelitian ini. Terima kasih untuk kedua orang tua dan seluruh keluarga atas doa dan dukungannya, serta kepada teman-teman THP 43 (Dina, Hasanah, Dwi, Budi, Merlinda, Hilda, Yayan, dan teman-teman yang lain) atas doa, dukungan serta bantuannya kepada penulis selama penelitian.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun dari berbagai pihak dalam proses penyempurnaan skripsi ini. Semoga tulisan ini dapat bermanfaat bagi semua pihak yang memerlukan.
Bogor, Februari 2011
1989dari pasangan Bapak Muhtar dan Ibu Sumini. Penulis merupakan anak kedua dari tiga bersaudara. Riwayat pendidikan penulis yaitu Pendidikan Dasar di SD 2 Poncokresno (tahun 1994-1996), penulis selanjutnya melanjutkan Pendidikan Dasar di SDN 4 Wates, Gading Rejo (tahun 1996-2000). Setelah itu, penulis masuk ke SLTP N 1 Pringsewu (2000-2003), dan penulis melanjutkan pendidikan di SMA N 1 Pringsewu, Lampung.
Pada tahun 2006, penulis melanjutkan pendidikan formal di Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Pada tahun 2007, penulis masuk ke Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor setelah mengikuti program Mayor-Minor. Selama masa perkuliahan, penulis aktif dalam beberapa organisasi kemahasiswaan, seperti Himasilkan tahun 2007-2008 dan 2008-2008 sebagai anggota dan UKM Keluarga mahasiswa Lampung (KEMALA) sebagai anggota. Penulis juga aktif sebagai asisten praktikum m.k Teknologi Pengolahan Produk Tradisional Hasil Perairan tahun ajaran 2009-2010, dan asisten m.k Mikrobiologi Hasil Perairan tahun ajaran 2010-1011.
Halaman
2.1 Deskripsi dan Klasifikasi Chaetoceros gracilis ... 3
2.2 Pertumbuhan Mikroalga ... 4
2.3 Faktor-Faktor yang Mempengaruhi Pertumbuhan Mikroalga ... 5
2.9 Atomic Absorption Spectrophotometry (AAS) ... 17
3 METODOLOGI ... 19
3.1 Waktu dan Tempat ... 19
3.2 Bahan dan Alat ... 19
3.3 Metode Penelitian ... 20
3.4 Prosedur Analisis ... 21
3.4.1 Penghitungan jumlah sel (Hadioetomo 1993) ... 21
3.4.2 Analisis proksimat ... 21
3.4.3 Uji fitokimia (Harborne 1987) ... 25
3.4.4 Analisis total mineral ... 27
3.4.5 Analisis Asam Lemak dengan GC-MS ... 28
4 HASIL DAN PEMBAHASAN ... 30
4.1 Kultur Chaetoceros gracilis ... 30
4.2 Kurva Pertumbuhan Chaetoceros gracilis ... 32
4.3 Komposisi Kimia Chaetoceros gracilis ... 35
4.4 Mineral ... 39
4.5 Komponen Aktif ... 42
4.6 Asam Lemak ... 47
5 KESIMPULAN DAN SARAN ... 52
5.1 Kesimpulan ... 52
5.2 Saran ... 52
DAFTAR PUSTAKA ... 54
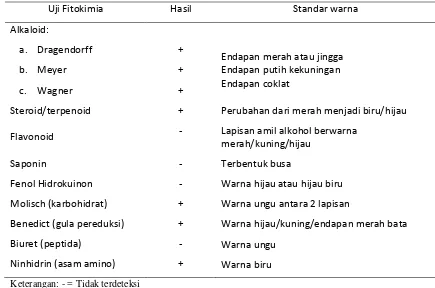
Halaman 1 Hasil uji fitokimia pada Chaetoceros gracilis ... 43 2 Hasil analisis asam lemak Chaetoceros gracilis yang dikultivasi di luar
Halaman 1 Chaetoceros gracilis ... 4 2 Fase pertumbuhan sel alga ... 4 3 Diagram alir metode penelitian ... 20 4 Kultur Chaetoceros gracilis yang dikultivasi di luar ruangan
menggunakan media pupuk NPSi ... 32 5 Kurva pertumbuhan C. gracilis yang dikultivasi di luar ruangan
menggunakan media pupuk NPSi ... 33 6 Kurva pertumbuhan C. gracilis yang dikultivasi di ruang ber-AC
menggunakan media pupuk NPSi ... 33 7 Hasil uji proksimat pada C. gracilis yang dikultivasi di luar ruangan
menggunakan media pupuk NPSi ... 36 8 Hasil pengujian total mineral pada C. gracilis yang dikultivasi di luar
ruangan menggunakan media pupuk NPSi ... 40 9 Perbandingan kandungan asam lemak pada C. gracilis yang dikultivasi di
luar ruangan menggunakan media pupuk NPSi ... 48 10 Persentase kandungan asam lemak jenuh pada C. gracilis yang
dikultivasi di luar ruangan menggunakan media pupuk NPSi ... 49 11 Persentase kandungan asam lemak tak jenuh pada C. gracilis yang
1.1Latar Belakang
Fitoplankton merupakan tumbuhan yang amat banyak ditemukan di semua perairan, tetapi karena ukurannya yang sangat kecil maka sukar dilihat keberadaanya (Nontji 2005). Fitoplankton juga sering disebut sebagai pembuka kehidupan di planet bumi ini. Hal ini sesuai dengan sifatnya yang autotrof sehingga mampu merubah unsur hara anorganik menjadi bahan organik dan penghasil oksigen yang sangat mutlak diperlukan bagi kehidupan makhluk hidup yang lebih tinggi tingkatannya (Isnansetyo & Kurniastuty 1995).
Mikroalga merupakan salah satu biota perairan yang memiliki potensi
yang tinggi untuk dikembangkan. Salah satu jenisnya adalah Chaetoceros gracilis. Chaetoceros gracilis biasanya digunakan dalam dunia
budidaya ikan sebagai pakan alami bagi larva. Hal ini karena kandungan kimianya yang cukup tinggi, baik lemak, karbohidrat, protein, maupun mineralnya. Chaetoceros gracilis merupakan salah satu diatom yang mudah untuk dikultivasi dan jumlahnya yang melimpah di perairan Indonesia (Pratiwi et al. 2009).
Banyak faktor yang dapat mempengaruhi pertumbuhan dan komposisi
kimia dari mikroalga. Menurut Richmond (1986) diacu dalam Raghavan et al. (2008), komposisi kimia pada mikroalga sangat tergantung pada
kondisi lingkungan dan fase pertumbuhan. Faktor lingkungan yang mempengaruhi pertumbuhan mikroalga antara lain suhu dan cahaya matahari. Kultivasi mikroalga biasanya dilakukan di dalam ruangan dengan suhu dan intensitas cahaya yang sudah diatur. Hal tersebut kurang efektif jika ingin kultivasi dalam skala besar. Selain itu, mikroalga tidak seperti tumbuhan tingkat tinggi, hal ini karena nutrisi yang diperlukan harus sesuai dengan jenis mikroalga yang dikultur (Mc. Clellan et. al 1991 diacu dalam Diharmi 2001).
dikeluarkan untuk kultivasi menyebabkan tingginya biaya produksi. Hal ini sangat tidak menguntungkan jika ingin mengembangkan dalam jumlah yang besar.
Mahalnya harga media untuk pertumbuhan mikroalga dapat diatasi dengan menggantikan media f/2 dengan media lain yang harganya lebih terjangkau. Menurut Lopez-Elias et al. (2005) diatom mungkin dapat dikultivasi di luar ruangan dan menggunakan media yang lebih murah, yaitu menggunakan pupuk yang telah dimodifikasi. Larastri (2006) dalam penelitiannya menyebutkan bahwa diatom dapat tumbuh dalam media pupuk NPSi. Informasi mengenai kandungan biokimia dari C. gracilis yang ditumbuhkan di luar ruangan menggunakan media pupuk masih sangat jarang ditemukan. Oleh sebab itu, perlu dilakukan penelitian tentang kandungan biokimia dari C. gracilis yang dikultivasi di luar ruangan menggunakan media pupuk NPSi.
1.2Tujuan
Penelitian ini dilakukan dengan tujuan untuk:
1 Menentukan kurva pertumbuhan C. gracilis yang dikultivasi di luar ruangan dengan menggunakan medium pupuk NPSi.
2.1 Deskripsi dan Klasifikasi Chaetoceros gracilis
Chaetoceros gracilis merupakan mikroalga yang memiliki dinding sel yang dibentuk dari silika. Karotenoid dan diatomin merupakan pigmen yang dominan pada Chaetoceros gracilis. Toleransi terhadap salinitas sangat lebar, yaitu 6-50‰. Kisaran salinitas 17-25‰ merupakan salinitas optimal untuk pertumbuhannya. Salinitas minimum untuk pertumbuhan mikroalga ini adalah
6‰ (Isnansetyo dan Kurniastuty 1995).
Chaetoceros gracilis disebut dengan golden–brown algae karena kandungan pigmen dalam tubuhnya lebih banyak pigmen kuning daripada pigmen hijau. Apabila pada perairan tertentu populasi mikroalga ini padat, maka perairan tersebut akan terlihat berwarna coklat muda (Arinardi 1997).
Klasifikasi Chaetoceros gracilis (Bold & Wayne 1985) adalah sebagai berikut:
Filum : Chrysophyta Kelas : Bacillariophyceae Ordo : Centricae
Subordo : Biddulphioidae Famili : Chaetoceraceae Genus : Chaetoceros
Spesies : Chaetoceros gracilis
Gambar 1. Chaetoceros gracilis
(Sumber : http://nria.fra.affrc.go.jp/biology/biology5.jpg)
2.2 Pertumbuhan Mikroalga
Kultivasi mikroalga pada media yang terbatas terdiri dari beberapa fase pertumbuhan. Fase pertumbuhan tersebut meliputi fase lag, fase eksponensial, fase penurunan laju pertumbuhan, fase stasioner, dan fase kematian (Fogg 1975). Fase pertumbuhan tersebut dapat dilihat pada Gambar 2.
Gambar 2. Fase pertumbuhan sel alga (Fogg 1975)
(1 fase lag ; 2 Fase eksponensial; 3 Fase deklinasi; 4 Fase stasioner; 5 Fase kematian)
a) Fase lag ditandai dengan peningkatan populasi yang tidak terlalu nyata. Fase ini juga disebut dengan fase adaptasi karena sel mikroalga sedang beradaptasi terhadap media pertumbuhannnya (Fogg 1975).
b) Fase eksponensial ditandai dengan tingginya laju pertumbuhan. Hal ini terjadi karena mikroalga sedang aktif berkembangbiak (Fogg 1975).
d) Fase stasioner, pada fase ini pertambahan jumlah populasi seimbang dengan laju kematian sehingga seperti tidak ada penambahan populasi. Pertumbuhan sel yang baru juga dihambat dengan keberadaan sel yang telah mati dan faktor pembatas lainnya (Fogg 1975).
e) Fase kematian ditandai dengan penurunan produksi biomassa karena kematian dan sel lisis (Vonshak 1985 diacu dalam Diharmi 2001).
2.3 Faktor-Faktor yang Mempengaruhi Pertumbuhan Mikroalga
Pertumbuhan mikroalga dipengaruhi oleh beberapa faktor, baik faktor fisik maupun faktor kimia. Faktor-faktor tersebut diantaranya adalah nutrisi, suhu, cahaya, pH, dan CO2 bebas.
2.3.1 Nutrisi
Mikroalga tidak seperti tumbuhan tingkat tinggi, hal ini karena nutrisi
yang diperlukan harus sesuai dengan jenis mikroalga yang dikultur (Mc. Clellan et. al 1991 diacu dalam Diharmi 2001). Kultivasi mikroalga sangat
membutuhkan berbagai macam unsur baik unsur hara makro maupun unsur hara mikro. Setiap unsur hara mempunyai fungsi khusus bagi pertumbuhan mikroalga. Unsur hara makro dibutuhkan dalam jumlah banyak, diantaranya nitrogen (N), fosfor (P), silikat (Si), karbon (C), hidrogen (H), kalium (K), magnesium (Mg), dan sulfur (S) (Nontji 2006).
Unsur N, P, dan S berperan penting dalam proses sintesis protein. Unsur K berfungsi dalam metabolisme karbohidrat. Unsur Si dan Ca merupakan
bahan untuk pembentukan dinding sel atau cangkang pada mikroalga, sedangkan besi (Fe) dan natrium (Na) berperan dalam pembentukan klorofil (Isnansetyo & Kurniastuty 1995).
2.3.2 Suhu
Suhu merupakan salah satu variabel lingkungan yang mempengaruhi laju fotosintesis dan pertumbuhan mikroalga. Suhu di perairan merupakan salah satu faktor yang mempengaruhi proses-proses kimia dalam tubuh mikroalga. Tingkat percepatan proses-proses dalam sel akan meningkat seiring dengan meningkatnya suhu (Fogg 1975).
2.3.3 Cahaya
Cahaya akan mempengaruhi pertumbuhan mikroalga karena merupakan
sumber energi dalam proses fotosintesis (West 2005 diacu dalam Wijaksono 2008). Cahaya matahari yang dapat ditangkap oleh klorofil
fitoplankton di laut hanya radiasi dalam spektrum dengan panjang gelombanng antara 400-720 nm, yang disebut dengan PAR (photosynthetically active radiation). Energi sinar matahari untuk proses fotosintesis tergantung pada
panjang gelombang, intensitas, dan waktu atau lamanya penyinaran (Heddy 1990 diacu dalam Wijaksono 2008).
Komposisi spektrum cahaya dapat mempengaruhi perubahan fisiologi dan biokimia suatu tanaman, dan komposisi spektrum cahaya pada kultivasi mikroalga dapat dimodifikasi dengan menggunakan sumber cahaya yang berbeda (Dubinsky et.al 1995 diacu dalam Saavedra & Votolina 2005).
2.3.4 pH
Derajat keasaman (pH) merupakan faktor yang dapat mempengaruhi kultur mikroalga. Proses fotosintesis akan mengambil CO2 terlarut dari dalam air, sehingga terjadi penurunan kandungan CO2 terlarut di air. Penurunan ini akan meningkatkan pH berkaitan dengan kesetimbangan CO2 terlarut, bikarbonat, dan ion karbonat dalam air. Peningkatan pH akan mengurangi CO2 yang dapat digunakan. Mikroalga memerlukan pH antara 7-8,5 untuk pertumbuhan optimum (Najmushabah 2004 diacu dalam Wijaksono 2008).
2.3.5 CO2 bebas
2.4 Kandungan Gizi
Segala sesuatu yang dapat dimakan dinamakan bahan makanan, akan tetapi tidak semua yang dapat dimakan bermanfaat. Komponen bahan makanan yang dapat dicerna, dapat diserap serta bermanfaat bagi tubuh disebut zat gizi. Pada dasarnya bahan makanan terdiri dari empat komponen utama, yaitu air, protein, karbohidrat, dan lemak (Anwar 1985).
2.4.1 Protein
Protein berfungsi sebagai bahan dasar pembentuk sel-sel dan jaringan tubuh. Selain itu, protein juga berperan dalam proses pertumbuhan, pemeliharaan, dan perbaikan jaringan tubuh yang mengalami kerusakan (Winarno 1997). Protein merupakan polimer yang komplek, terdiri dari 20 bahkan lebih asam amino yang berbeda. Protein dibentuk di dalam ribosom. Dalam bentuk dasar, protein terdiri dari 50-55% karbon, 6-7% hidrogen, 20-23% oksigen, 12-19% nitrogen, dan 0,2-3% sulfur (Fennema 1996).
Kandungan protein pada bahan pangan dianalisis menggunakan uji yang berdasarkan kandungan nitrogen (metode Kjeldhall). Kandungan
protein dapat dihitung dengan mengalikan total nitrogen dengan 6,25 (Dierenfeld & McCann 1999). Kandungan protein tidak sama untuk nitrogen non
protein dengan protein nitrogen (Huyghebaert 2003). 2.4.2 Lemak
Lemak mempunyai komposisi kimia yang unik sehingga tidak larut dalam air, melainkan larut dalam pelarut organik seperti kloroform dan benzen (Muchtadi 2001). Fungsi lemak secara umum adalah penghasil energi, pembangun/pembentuk struktur tubuh, protein sparer (penghematan fungsi protein), penghasil asam lemak esensial yang penting bagi tubuh, pembawa vitamin larut lemak, pelumas diantara persendian, membantu mengeluarkan sisa makanan, dan prekursor prostaglandin (Suharjo & Kusharto 1989).
kandungan asam lemak harus dilakukan saponifikasi dan esterifikasi (Huyghebaert et al. 2003).
2.4.3 Karbohidrat
Karbohidrat merupakan sumber energi utama bagi hampir seluruh penduduk Indonesia. Semua hidrat arang atau karbohidrat terdiri atas unsur-unsur karbon (C), hidrogen (H), oksigen (O) yang pada umumnya mempunyai rumus kimia Cn(H2O)n (Nasoetion et.al 1994). Karbohidrat terbentuk saat proses fotosintesis berlangsung. Lebih terperinci lagi, karbohidrat dibentuk oleh air (H2O) yang berasal dari tanah, karbondioksida (CO2) yang berasal dari udara, dan energi yang berasal dari sinar matahari (Anwar 1985).
2.4.4 Air
Air merupakan zat gizi yang sangat penting bagi tubuh. Air merupakan komponen utama dari semua struktur sel dan merupakan media kelangsungan proses metabolisme dan reaksi kimia di dalam tubuh (Suhardjo & Kusharto 1989). Semua bahan pangan mengandung air dalam jumlah yang berbeda-beda. Kandungan air dalam bahan pangan mempengaruhi daya tahan bahan pangan tersebut dari serangan mikroba pembusuk. Analisis kadar air dalam bahan pangan juga bertujuan untuk memperhitungkan kadar zat gizi yang lain (Anwar 1985).
2.5 Mineral
2.5.1 Kalsium
Tubuh manusia mengandung sekitar 22 gram kalsium per kg berat badan tanpa lemak. Peranan kalsium tidak hanya untuk pembentukan tulang dan gigi, namun juga berperan penting dalam proses fisiologik dan biokhemik di dalam tubuh, seperti pembekuan darah. Peranan kalsium dalam pembekuan darah ada hubungannya dengan vitamin K. Mineral ini tampaknya diperlukan untuk mengaktifkan protrombin yang berperan dalam proses pembekuan darah (Suhardjo & Kusharto 1989).
Sumber kalsium utama adalah susu dan hasil susu, ikan, serelia, kacang-kacangan dan hasil kacang-kancangan, dan sayuran hijau, akan tetapi pada sayuran hijau terdapat fitat dan oksalat yang dapat menghambat penyerapan kalsium. Bahan makanan yang mengandung banyak oksalat dan fitat, berbagai bentuk serat makanan dan lemak jenuh, dilaporkan dapat menurunkan absorpsi kalsium (Nasoetion & Karyadi 1988). Angka kecukupan kalsium rata-rata per hari bagi orang Indonesia ditetapkan oleh Widyakarya Pangan dan Gizi LIPI (1998) diacu dalam Almatsier (2006) adalah sebagai berikut:
Bayi : 300-400 mg
Anak-anak : 500 mg
Remaja : 600-700 mg
Dewasa : 500-800 mg
Hamil dan menyusui : >400 mg 2.5.2 Fosfor
Tubuh manusia mengandung sekitar 12 gram fosfor per kilogram jaringan tanpa lemak. Fosfor adalah bagian dari senyawa tinggi energi ATP yang diperlukan dalam suplai energi untuk kegiatan selular. Fosfor dari makanan di absorpsi dalam bentuk fosfat bebas. Kira-kira 60-70 persen fosfor dari makanan dapat diserap (Suhardjo & Kusharto 1989).
Absorpsi fosfat hanya berlangsung di daerah usus kecil, terutama di bagian tengah usus halus, dan berlangsung dengan pengangkutan aktif yang mebutuhkan natrium maupun secara difusi. Kekurangan vitamin D dapat menyebabkan turunnya absorpsi fosfat dan juga kalsium. Tingkat absorpsi fosfat dari makanan
fosfat tidak larut di dalam usus yaitu kalsium, aluminium, dan stronsium (Nasoetion & Karyadi 1988).
Fosfor berfungsi mengatur pengeluaran energi dari hasil pembakaran karbohidrat, lemak, dan protein (Almatsier 2006). Angka kecukupan fosfor rata-rata per hari bagi orang Indonesia ditetapkan oleh Widyakarya Pangan dan Gizi LIPI (1998) diacu dalam Almatsier (2006) adalah sebagai berikut:
Bayi : 200-250 mg
Anak-anak : 250-400 mg
Remaja : 400-500 mg
Dewasa : 400-500 mg
Hamil dan menyusui : +200 - + 300 mg 2.5.3 Magnesium
Magnesium berperan sangat penting sebagai ion esensial di berbagai reaksi enzimatis dasar pada metabolisme senyawa antara. Magnesium memiliki
sifat-sifat yang sama seperti kalsium dalam hal absorpsi yang sangat terbatas dan penyimpanannya dalam tulang (Nasoetion & Karyadi 1988). Tubuh manusia seberat 70 kg mengandung kurang lebih 20 hingga 28 gram magnesium (Widdowson et al. (1951), Schroeder et al. (1969) diacu dalam Nasoetion & Karyadi (1988)). Kira-kira 55% magnesium terdapat dalam tulang
dan kira-kira 27% terdapat di otot (Nasoetion & Karyadi 1988).
Jumlah magnesium yang dianjurkan untuk dikonsumsi per hari adalah 300 hingga 350 mg masing-masing untuk wanita dan pria dewasa, dan tambahan 50 hingga 250 mg untuk bayi dan anak-anak. Kira-kira 60 hingga 70 persen magnesium yang dicerna, dibuang melalui feses oleh sebagian besar individu. Sisanya (selain yang ditahan oleh jaringan dan hilang dalam keringat atau kulit yang terkelupas), dibuang melalui urin (Nasoetion & Karyadi 1988).
2.5.4 Kalium
umumnya disebabkan karena ekskresi yang berlebihan melalui ginjal, muntah-muntah, dan diare yang berat. Pengaruh kekurangan kalium terutama
pada otot yaitu lemak urat dan dapat menimbulkan kelumpuhan (Suhardjo & Kusharto 1989).
2.5.5 Natrium
Tubuh manusia mengandung 1,8 gram natrium per kilogram berat badan bebas lemak, di mana sebagian besar terdapat dalam cairan ekstraselular. Natrium merupakan kation utama dalam cairan plasma, sehingga pengontrolan osmolaritas dan volume cairan tubuh sangat tergantung pada ion natrium dan rasio natrium terhadap ion lainnya (Suhardjo & Kusharto 1989). Sumber utama natrium adalah garam dapur atau NaCl (Almatsier 2006).
Metabolisme natrium terutama diatur oleh aldosteron suatu hormon korteks adrenal yang meningkatkan reabsorbsi natrium dari ginjal. Bila hormon tersebut tidak ada maka ekskresi natrium bertambah dan akan timbul tanda-tanda defisiensi. Kehilangan natrium dapat terjadi karena diare, berkeringat dan muntah-muntah (Suhardjo & Kusharto 1989).
2.5.6 Besi
Besi merupakan mineral mikro yang paling banyak terdapat di dalam tubuh manusia dan hewan (Almatsier 2006). Jumlah seluruh besi di dalam tubuh orang dewasa sekitar 3,5 gram, di mana 70 persennya terdapat dalam hemoglobin, 25 persennya merupakan besi cadangan (iron storage) yang terdiri dari feritin dan hemosiderin terdapat dalam hati, limfa dan sumsum tulang. Besi simpanan ini berfungsi sebagai cadangan untuk memproduksi hemoglobin dan ikatan-ikatan besi lainnya yang mempunyai fungsi fisiologis (Suhardjo & Kusharto 1989).
Bayi : 3-9 mg
Anak-anak : 10 mg
Remaja : 14-25 mg
Dewasa : 13-26 mg
Hamil dan menyusui : +2- + 20 mg 2.5.7 Seng
Seng terdapat dalam semua jaringan tubuh hewan, seperti hati, otot dan tulang. Jumlah seng dalam tubuh kira-kira 28 mg per kilogram berat badan bebas lemak (Suhardjo & Kusharto 1989). Seng sangat dibutuhkan bagi fungsi lebih dari 70 enzim pada berbagai spesies. Seng juga diperkirakan mempunyai peranan dalam metabolisme prostaglandin atau proses-proses yang diperantai oleh prostaglandin (Nasoetion & Karyadi 1988).
Angka kecukupan besi rata-rata per hari bagi orang Indonesia ditetapkan oleh Widyakarya Pangan dan Gizi LIPI (1998) diacu dalam Almatsier (2006) adalah sebagai berikut:
Bayi : 3-5 mg
Anak-anak : 8-10 mg
Remaja dan dewasa : 15 mg Hamil dan menyusui : + 10 mg 2.5.8 Tembaga
Tubuh manusia mengandung 1,5-2,5 mg tembaga per kilogram berat badan bebas lemak. Mineral ini tersebar di seluruh jaringan tubuh, namun hati,
otak, jantung dan ginjal mengandung Cu yang lebih banyak (Suhardjo & Kusharto 1989). Sebanyak 25-40 persen Cu yang dikonsumsi akan
diabsorpsi oleh tubuh, dan jumlah ini sangat bergantung pada banyak dan sumber makanan yang dikonsumsi. Makanan yang banyak mengandung asam askorbat
akan mengganggu absorpsi Cu. Mekanisme hambatan asam askorbat terhadap ketersediaan biologis Cu belum diketahui dengan jelas, tetapi diduga asam askorbat mengubah tapak pengikatan pada metallotionin (Nasoetion & Karyadi 1988).
reaksi yang menggunakan oksigen atau radikal bebas (Almatsier 2006). Beberapa mineral seperti tembaga, seng, dan mangan diketahui sebagai mineral antioksidan (Astawan & Kasih 2008).
2.5.9 Mangan
Mangan banyak terdapat di dalam tulang, hati, pankreas, dan jaringan
saluran pencernaan. Mangan diperlukan dalam oksidasi fosforilasi (Suhardjo & Kusharto 1989). Fungsi mangan secara biokimia adalah sebagai
kofaktor yang mengaktifkan sejumlah besar enzim yang membentuk senyawa kompleks enzim-logam, atau sebagai bagian yang utuh dari metalloenzim. Selain itu, mangan juga berperan serta dalam metabolisme amin biogenik (Nasoetion & Karyadi 1988).
Tubuh manusia mengandung 10-20 mg mangan. Angka kebutuhan tubuh akan mangan diperkirakan atas dasar studi keseimbangan yaitu sekitar 0,035-0,070 mg per kilogram berat badan perhari. Sumber mangan yang baik terutama pangan nabati, karena pangan hewani umumnya kandungan mineralnya masih rendah (Suhardjo & Kusharto 1989).
2.6 Komponen Aktif
Komponen bioaktif merupakan kelompok senyawa fungsional yang terkandung dalam bahan pangan dan dapat memberikan pengaruh biologis. Komponen bioaktif tidak terbatas pada hasil metabolisme sekunder saja, tetapi juga termasuk metabolit primer yang memberikan aktivitas biologis fungsional, seperti protein dan peptida (Kannan et al. 2009). Penapisan komponen bioaktif ini dapat dilakukan dengan metode uji fitokimia. Fitokimia merupakan senyawa bioaktif yang terdapat dalam tumbuhan dan dapat memberikan kesehatan bagi tubuh manusia (Hasler 1998 diacu dalam Kristiono 2009).
2.6.1 Alkaloid
biasanya tidak berwarna dan sebagian besar berbentuk kristal dengan titik lebur tertentu (Harborne 1987).
Alkaloid berperan melindungi tumbuhan, pembuahan dan untuk
merangsang pertumbuhan. Untuk menguji ada tidaknya golongan alkaloid dalam suatu tumbuhan dapat digunakan pereaksi Draggendorff’s dan Meyer. Apabila hasil uji menunjukkan hasil yang positif maka akan
berwarna merah untuk Draggendorff’s dan berwarna putih untuk Meyer (Ayoola et al. 2008 diacu dalam Kristiono 2009).
2.6.2 Terpenoid/steroid
Terpenoid merupakan senyawa alam yang terbentuk dengan proses biosintesis dan terdistribusi secara luas dalam dunia tumbuhan dan hewan. Struktur terpenoid dibangun oleh molekul isoprene dimana
kerangka terpenoid terbentuk dari dua atau lebih satuan isoprene (C5) (Sirait 2007 diacu dalam Kristiono 2009). Untuk mengetahui kandungan terpenoid
pada suatu bahan dapat digunakan pereaksi Liebermann Burchad, yang memberikan warna biru-hijau pada triterpenoid dan steroid (Harborne 1987).
Terpenoid terbagi atas dua kelas utama, yaitu karotenoid dan non karotenoid. Karotenoid adalah komponen fitokimia yang sangat penting bagi kesehatan, terutama untuk menjaga kesehatan mata (Astawan & Kasih 2008). Terpenoid memiliki banyak kegunaan antara lain minyak atsiri, rempah-rempah, sebagai cita rasa dalam industri makanan, antioksidan, dan meningkatkan sistem imun tubuh (Sirait 2007 diacu dalam Kristiono 2009).
2.6.3 Flavonoid
Flavonoid merupakan golongan terbesar dari senyawa polifenol. Flavonoid sangat efektif untuk digunakan sebagai antioksidan (Astawan & Kasih 2008). Flavonoid umumnya merupakan komponen larut air (polar). Flavonoid dapat dikelompokan menjadi 9 kelas, yaitu anthosianin, proanthosianidin, flavonol, flavon, glikoflavon, biflavonil, chlacone dan aurone, flavanon, serta isoflavon (Harborne 1987).
berwarna merah menandakan adanya kandungan flavonoid pada sampel (Egwaikhide & Gimba 2007 diacu dalam Kristiono 2009).
2.6.4 Saponin
Saponin adalah senyawa aktif permukaan kuat yang menimbulkan busa jika dikocok dalam air dan pada konsentrasi rendah sering menyebabkan hemolisis sel darah merah (Robinson 1995). Saponin merupakan glikosida yang apabila dihidrolisis secara sempurna akan menghasilkan gula dan satu fraksi non-gula yang disebut sapogenin atau genin. Saponin larut dalam air, sedikit larut atau tidak sama sekali dalam etanol dan metanol pekat yang dingin (Muchtadi 1989).
Komponen saponin berperan dalam mereduksi kolesterol dan melawan kanker kolon. Saponin juga memiliki aktivitas antimikroba, merangsang sistem imun, dan mengatur tekanan darah (Astawan & Kasih 2008). Saponin memberikan rasa pahit pada bahan pangan nabati (Kristiono 2009).
2.6.5 Fenol hidokuinon
Kuinon adalah senyawa berwarna dan memiliki kromofor dasar. Pigmen quinon alami berada pada kisaran warna kuning muda hingga hitam. Untuk tujuan identifikasi, quinon dapat dibagi menjadi empat kelompok, yaitu benzoquinon, naftaquinon, antraquinon, dan isoprenoid quinon. Tiga kelompok pertama umumnya terhidrolisis dan memiliki sifat fenol, sedangkan isoprenoid quinon terdapat pada respirasi seluler (ubiquinon) dan fostosintesis (plastoquinon). Komponen fenolat merupakan struktur aromatik yang berikatan dengan satu atau lebih gugus hidroksil, beberapa mungkin digantikan dengan gugus metil atau glikosil (Harborne 1987).
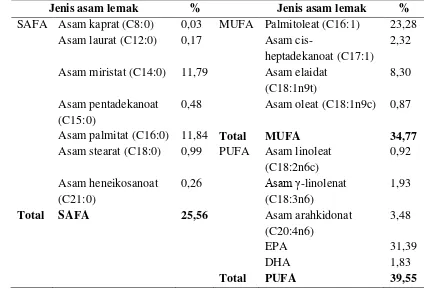
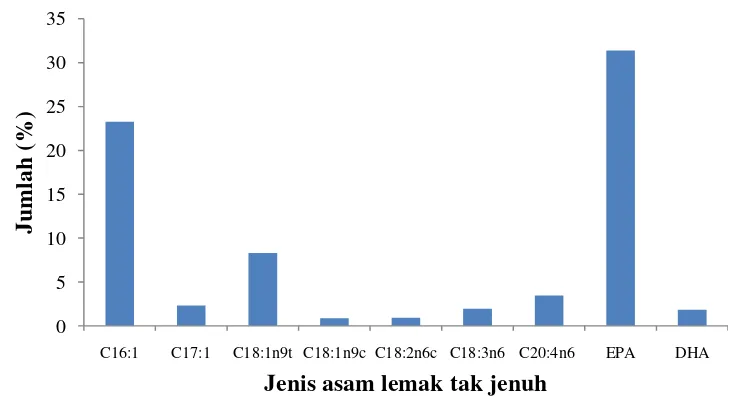
2.7 Asam Lemak
lipid yang berbeda, sehingga dapat dibebaskan dari ikatan tersebut melalui hidrolisis kimia atau enzimatik (Muchtadi et al. 1993).
Asam lemak dibedakan menjadi asam lemak jenuh dan asam lemak tidak jenuh. Asam lemak jenuh mempunyai titik cair lebih tinggi dibandingkan asam lemak tidak jenuh. Oleh sebab itu, lipid yang tersusun oleh asam lemak tidak jenuh akan bersifat cair pada suhu kamar, sedangkan lipid yang tersusun oleh asam lemak jenuh akan berbentuk padat pada suhu kamar. Asam lemak tidak jenuh yang mengandung satu ikatan rangkap disebut asam lemak tidak jenuh tunggal (MUFA). Asam lemak yang mengandung dua atau lenih ikatan rangkap disebut asam lemak tidak jenuh majenuk (PUFA) (Muchtadi et al. 1993).
Polyunsaturated Fatty Acid (PUFA) akan berperan dalam proses tumbuh-kembang otak atau kecerdasan, perkembangan indera penglihatan, dan
sistem kekebalan tubuh bayi atau balita. Jenis PUFA yang paling terkenal adalah DHA dan EPA yang termasuk golongan omega-3. Jenis mikroalga yang banyak mengandung omega yaitu Nitzchia closterium, Chaetoceros sp., Thalassiosira sp., Asterionella glacialis, dan lain-lain (Viso & Marty 1993). Cadangan makanan dalam diatom paling besar disimpan dalam bentuk lipid, sehingga diatom dapat menjadi sumber asam lemak yang potensial, khususnya PUFA (Labeau & Robert (2003) diacu dalam Pratiwi et al. (2009)).
Komposisi kimia pada mikroalga sangat tergantung pada kondisi lingkungan dan fase pertumbuhan (Richmond 2004). Hal ini juga berlaku untuk kandungan asam lemak. Komposisi lemak dan asam lemak pada mikroalga bergantung pada intesitas cahaya, suhu, nutrien atau media pertumbuhan, dan fase pertumbuhan (Pernet et al. 2003). Suhu lingkungan yang rendah dapat meningkatkan pembentukan asam lemak tidak jenuh. Hal ini merupakan respon untuk melindungi ketidakstabilan membran sel. Chaetoceros gracilis tidak dapat mensintesis PUFA secara lengkap ketika dikultur pada suhu 25-28oC (Pratiwi et al. 2009).
2.8 GC (Gas Chromatography)
komponen-komponen dari suatu campuran. Kromatografi gas merupakan suatu teknik analisis yang unik dan baik. Sebagai suatu alat analitik, kromatografi gas dapat digunakan untuk menganalis dan pemisahan langsung sampel-sampel gas, larutan-larutan, dan padatan yang bersifat mudah menguap. Pada analisis asam lemak, asam-asam lemak biasanya diubah menjadi ester-ester metil atau alkil yang lainnya sebelum disuntikkan ke dalam kromatograf gas. Hal ini karena bentuk-bentuk turunan tersebut memiliki sifat yang lebih mudah menguap dibandingkan dengan asam lemaknya (Fardiaz 1989).
Kromatografi gas memiliki beberapa keuntungan, diantaranya memiliki daya resolusi yang tinggi sehingga dapat memisahkan komponen-komponen yang hampir sama titik didihnya melalui pemilihan fase cairan yang tepat, kepekaan yang tinggi dan sampel yang dibutuhkan sedikit, waktu analisis yang cepat, mudah dilakukan, dan biaya relatif lebih murah (Fardiaz 1989).
Metode GC memiliki prinsip kerja pemisahan antara gas dan lapisan tipis cairan berdasarkan perbedaan jenis bahan. Hasil analisis akan terekam dalam suatu lembaran yang terhubung dalam rekorder dan ditunjukkan melalui beberapa puncak pada waktu retensi tertentu sesuai dengan karakter masing-masing komponen (Kuskis 1987 diacu dalam Wijaksono 2008). Waktu retensi adalah perbedaan waktu antara penyuntikan komponen sampel dengan puncak maksimum yang tercatat dalam kromatogram (Fardiaz 1989).
2.9 Atomic Absorption Spectrophotometry (AAS)
3.1 Waktu dan Tempat
Penelitian dilaksanakan pada bulan Februari 2010 sampai November 2010. Penelitian ini bertempat di Laboratorium Terpadu Fakultas Kedokteran Hewan, Bioteknologi Hasil Perairan 2 dan Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2 Bahan dan Alat
Inokulum Chaetoceros gracilis yang digunakan dalam penelitian ini berasal dari Lembaga Ilmu Pengetahuan Indonesia (LIPI) Ancol. Bahan-bahan yang digunakan sebagai media yaitu pupuk urea, pupuk TSP, NaSi(OH)2, vitamin B1, vitamin B12, biotin, trace element, akuades dan air laut. Bahan-bahan yang dibutuhkan untuk analisis proksimat meliputi akuades, larutan H2SO4 pekat, asam borat (H3BO3) 2% yang mengandung indikator bromcherosol green-methyl
red (1:2) berwarna merah muda, larutan HCl 0,10 N, n-heksana p.a, larutan HCl 10% dan larutan AgNO3 0,10 N.
Bahan-bahan yang dibutuhkan untuk uji fitokimia meliputi pereaksi Wagner, pereaksi Meyer, pereaksi Dragendroff (uji alkaloid), kloroform, anhidra
asetat, asam sulfat pekat (uji steroid), serbuk magnesium, amil alkohol (uji flavonoid), air panas, larutan HCL 2 N (uji saponin), etanol 70%, larutan
FeCl3 5% (uji fenol hidrokuinon), peraksi Molisch, asam sulfat pekat (uji Molisch), pereaksi Benedict (uji Benedict), pereaksi Biuret (uji Biuret) dan
larutan Ninhidrin 0,10% (uji Ninhidrin).
Bahan yang digunakan untuk analisis mineral yaitu HNO3, H2SO4 pekat, HClO4, HCL, asam nitrat, asam molibdat, asam vanadat, ammonium molibdat, ammonium vanadat, KH2PO4 dan akuades. Bahan yang digunakan untuk analisis asam lemak yaitu lemak, NaOH 0,5 N dalam metanol, n-heksana, BF3 16 %, NaCl jenuh, larutan standar, Na2SO4, dan kertas lakmus.
porselen, timbangan digital, alumunium foil, gegep, desikator, oven, tanur pengabuan, kertas saring Whatman 42 bebas abu, kapas bebas lemak, labu lemak, kondensator, tabung Soxhlet, penangas air, labu Kjeldahl, destilator, labu Erlenmeyer, buret, pipet mikro, alat-alat gelas, vortex, hot plate, AAS, dan perangkat GC (Gas Chromatography).
3.3 Prosedur Penelitian
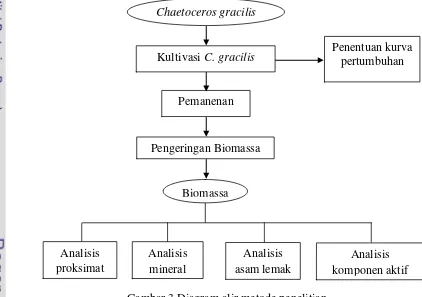
Pelaksanaan penelitian ini dilakukan dalam tiga tahap. Tahap (1) kultivasi; (2) pemanenan menggunakan sentrifuse dan dikeringkan menggunakan freeze dryer; dan (3) analisis kandungan gizi, analisis asam lemak, analisis mineral, dan analisis komponen aktif dari biomassa Chaetoceros gracilis. Diagram alir metode penelitian dapat dilihat pada Gambar 3.
Gambar 3 Diagram alir metode penelitian
Kultivasi Chaetoceros gracilis pada penelitian ini dilakukan dengan menggunakan media pertumbuhan pupuk. Media pertumbuhan menggunakan perbandingan N:P:Si:trace element:vitamin yaitu 3:1:4:1:1 untuk setiap 1 L air laut. Kultivasi mikroalga Chaetoceros gracilis dilakukan bertahap, yaitu tahap penyegaran dan tahap perbesaran skala. Tahap penyegaran selama 6 hari yang
Chaetoceros gracilis
Penentuan kurva pertumbuhan Kultivasi C.gracilis
Pemanenan
Biomassa Pengeringan Biomassa
Analisis komponen aktif Analisis
proksimat
Analisis mineral
bertujuan agar mikroalga dapat beradaptasi dengan media pertumbuhan yang baru. Selanjutnya dilakukan perbesaran skala kultur dan pembuatan kurva pertumbuhan. Pembuatan kurva pertumbuhan dilakukan dengan metode penghitungan langsung menggunakan haemasitometer.
Pemanenan C. gracilis dilakukan pada saat kultur berada pada fase stasioner. Pemanenan menggunakan sentrifuse dengan kecepatan 10.000 rpm pada suhu 4 oC selama 10 menit. Biomasa yang diperoleh selanjutnya dikeringkan dengan menggunakan freeze dryer dengan suhu <-18 oC selama ± 6 jam. Biomasa kering yang diperoleh selanjutnya dianalisis komponen kimianya.
3.4 Prosedur Analisis
Analisis yang dilakukan antara lain penghitungan jumlah sel, analisis proksimat, analisis komponen aktif, , analisis mineral, dan analisis kandungan asam lemak dari biomasa kering C. gracilis.
3.4.1 Penghitungan jumlah sel (Hadioetomo 1993)
Penghitungan jumlah sel dalam kultur dilakukan dengan cara pengambilan sampel setiap harinya dengan menggunakan mikro pipet, kemudian dimasukkan ke dalam chamber hemasitometer. Proses penghitungan jumlah sel adalah sebagai berikut:
1) Permukaaan hitung hemasitometer dibersihkan dengan secarik kertas lensa yang telah dibasahi dengan setetes akuades.
2) Kaca tutup hemasitometer dibersihkan sampai tidak lagi tertinggal sisa-sisa kotoran pada permukaan.
3) Biakan Chaetoceros gracilis hasil pengambilan contoh diambil dengan menggunakan mikro pipet sebanyak 250 μl dan diteteskan pada tempat menaruh sampel dan ditutup dengan kaca penutup sehingga suspensi Chaetoceros gracilis menyebar pada ruang hitung.
4) Hemasitometer diletakkan di bawah lensa mikroskop, kemudian jumlah sel yang terdapat dalam 80 kotak kecil yang bervolume 0,02 mm3 dihitung dengan mikroskop pada perbesaran 400 kali.
Keterangan: N = kepadatan sel (sel/ml)
∑ N1 = jumlah sel dalam 80 kotak
∑ N2 = jumlah sel dalam 80 kotak
1mm = panjang hemasitometer dalam 80 kotak 0,2mm = lebar hemasitometer dalam 80 kotak 0,1mm = tinggi hemasitometer dalam 80 kotak
Keterangan:
Kotak yang dihitung jumlah selnya
3.4.2 Analisis proksimat
Analisis proksimat merupakan suatu analisis yang dilakukan untuk memprediksi komposisi kimia suatu bahan, termasuk di dalamnya analisis kadar air, lemak, protein, dan abu
1) Analisis kadar air (AOAC 1995)
Tahap pertama yang dilakukan untuk menganalisis kadar air adalah mengeringkan cawan porselen dalam oven pada suhu 105 oC selama 1 jam. Cawan tersebut diletakkan ke dalam desikator (kurang lebih 15 menit) dan dibiarkan sampai dingin kemudian ditimbang. Cawan tersebut ditimbang kembali hingga beratnya konstan. Sebanyak 5 gram contoh dimasukkan ke dalam cawan tersebut, kemudian dikeringkan dengan oven pada suhu 105 oC selama 5 jam atau
hingga beratnya konstan. Setelah selesai, cawan tersebut kemudian dimasukkan ke dalam desikator dan dibiarkan sampai dingin dan selanjutnya ditimbang kembali.
Perhitungan kadar air :
Kehilangan berat (g) = berat sampel awal (g) – berat setelah dikeringkan (g)
2) Analisis kadar lemak (AOAC 1995)
Contoh seberat 5 gram (W1) dimasukkan ke dalam kertas saring pada kedua ujung bungkus ditutup dengan kapas bebas lemak, kemudian sampel yang telah dibungkus dimasukkan ke dalam tabung Soxhlet yang sudah ditimbang berat tetapnya (W2) dan disambungkan dengan labu lemak. Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung Soxhlet dan disiram dengan pelarut lemak (n-heksana p.a.). Kemudian dilakukan refluks selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105 oC, setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W3).
Perhitungan kadar lemak:
Keterangan : W1 = Berat sampel (gram)
W2 = Berat labu lemak kosong (gram) W3 = Berat labu lemak dengan lemak (gram)
3) Analisis kadar protein (AOAC 1980)
dan 5 ml NaOH 50%, kemudian dilakukan proses destilasi dengan suhu destilator 100 oC. Hasil destilasi ditampung dalam labu Erlenmeyer 125 ml yang berisi campuran 25 ml asam borat (H3BO3) 4% dan 2 tetes indikator bromcherosol green-methyl red yang berwarna merah muda (1:2). Setelah volume destilat mencapai 40 ml dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Lalu destilat dititrasi dengan HCl 0,10 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti contoh. Kadar protein dihitung dengan rumus sebagai berikut :
*) Faktor Konversi = 6,25 4) Analisis kadar abu (AOAC 1995)
Cawan pengabuan dikeringkan di dalam oven selama 1 jam pada suhu 105 oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel sebanyak 5 gram dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api hingga tidak berasap lagi. Setelah itu, dimasukkan ke dalam tanur pengabuan dengan suhu 600 oC selama 6 jam, kemudian ditimbang hingga didapatkan berat yang konstan.
Kadar abu ditentukan dengan rumus:
5) Analisis karbohidrat
3.4.3 Uji fitokimia (Harborne 1987)
Uji fitokimia dilakukan untuk mengetahui ada tidaknya komponen-komponen aktif yang terdapat pada biomasa kering C. gracilis. Uji fitokimia meliputi uji alkaloid, uji steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon, Molisch, Benedict, Biuret dan Ninhidrin. Metode uji ini berdasarkan Harborne (1987).
1) Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
Pereaksi Meyer dibuat dengan cara menambahkan 1,36 gram HgCl2
dengan 0,50 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 100 ml dengan labu takar. Pereaksi ini tidak berwarna. Pereaksi Wagner dibuat dengan cara 10 ml akuades dipipet kemudian ditambahkan 2,50 gram iodin dan 2 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 200 ml dalam labu takar. Pereaksi ini berwarna coklat. Pereaksi Dragendorff dibuat dengan cara 0,80 gram bismut subnitrat ditambahkan dengan 10 ml asam asetat dan 40 ml air. Larutan ini dicampur dengan larutan yang dibuat dari 8 gram kalium iodida dalam
20 ml air. Sebelum digunakan, 1 volume campuran ini diencerkan dengan 2,30 volume campuran 20 ml asam asetat glasial dan 100 ml air. Pereaksi ini
berwarna jingga. 2) Steroid/ triterpenoid
Sejumlah sampel dilarutkan dalam 2 ml kloroform dalam tabung reaksi yang kering. Lalu, 10 tetes anhidra asetat dan 3 tetes asam sulfat pekat ditambahkan ke dalamnya. Larutan berwarna merah yang terbentuk untuk pertama kali kemudian berubah menjadi biru dan hijau, menunjukkan reaksi positif.
3) Flavonoid
sama) dan 4 ml alkohol kemudian campuran dikocok. Warna merah, kuning atau jingga yang terbentuk pada lapisan amil alkohol menunjukkan adanya flavonoid. 4) Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
5) Fenol hidrokuinon (pereaksi FeCl3)
Sebanyak 1 gram sampel diekstrak dengan 20 ml etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3 5%. Warna hijau atau hijau biru yang terbentuk menunjukkan adanya senyawa fenol dalam bahan.
6) Uji Molisch
Sebanyak 1 ml larutan sampel diberi 2 tetes pereaksi Molish dan 1 ml asam sulfat pekat melalui dinding tabung. Uji positif yang menunjukkan adanya karbohidrat ditandai terbentuknya kompleks berwarna ungu diantara 2 lapisan cairan.
7) Uji Benedict
Larutan sampel sebanyak 8 tetes dimasukkan ke dalam 5 ml pereaksi Benedict. Campuran dikocok dan dididihkan selama 5 menit. Warna hijau, kuning, atau endapan merah bata yang terbentuk menunjukkan adanya gula pereduksi.
8) Uji Biuret
Sebanyak 1 ml larutan sampel ditambahkan 4 ml pereaksi Biuret. Campuran dikocok dengan seksama. Larutan berwarna ungu yang terbentuk menunjukkan hasil uji positif adanya peptida.
9) Uji Ninhidrin
3.4.4 Analisis total mineral
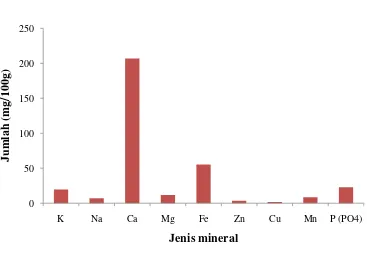
Analisis mineral dilakukan untuk mengetahui profil atau komposisi mineral makro (natrium, kalium, kalsium, magnesium, dan fosfor) dan mineral mikro (seng, besi, mangan, dan tembaga) yang terdapat pada biomasa kering Chaetoceros gracilis.
1) Pengujian total mineral Ca, Na, K, Mg, Fe, Zn, Se, Cu (Reitz et al. 1987) Sampel yang akan diuji, terlebih dahulu mengalami proses pengabuan basah. Pada proses ini, sampel ditimbang sebanyak 5 gram, kemudian dimasukkan ke dalam Erlenmeyer 150 ml. Ke dalam erlenmeyer tersebut ditambahkan 5 ml HNO3 dan dibiarkan selama 1 jam. Erlenmeyer ditempatkan di atas hot plate
selama ±4 jam dan ditambahkan 0,4 ml H2SO4 pekat, campuran (HClO4 dan HNO3) sebanyak 3 tetes, 2 ml akuades dan 0,6 ml HCl pekat. Larutan
contoh kemudian diencerkan menjadi 100 ml dalam labu takar. Sejumlah larutan stok standar dari masing-masing mineral diencerkan menggunakan akuades sampai konsentrasinya berada dalam kisaran kerja logam yang diinginkan.
Larutan standar, blanko dan contoh dialirkan ke dalam Atomic Absorption Spectrophotometer (AAS) merek Shimadzu tipe AA 680 flame emission dengan panjang gelombang dari masing-masing mineral. Kemudian diukur absorbansinya atau tinggi puncak standar, blanko dan contoh pada panjang gelombang dan parameter yang sesuai untuk masing-masing mineral dengan spektrofotometer. Setelah diperoleh absorbansi standar, hubungkan antara konsentrasi standar (sebagai sumbu Y) dengan absorbansi standar (sebagai sumbu X) sehingga diperoleh kurva standar mineral dengan persamaan garis linier y = ax + b (dimana y= variabel terikat (konsentrasi standar); a= kemiringan/gradien; x= variabel bebas (absorbansi); dan b= konstanta) yang digunakan untuk perhitungan konsentrasi larutan sampel. Konsentrasi larutan sampel dihitung dengan mengalikan a dengan absorbansi contoh.
2) Pengujian fosfor
kompleks asam vanadimolibdifosfat yang berwarna biru dan intensitas warnanya diukur dengan panjang gelombang 660 nm.
Sebanyak 20 gram ammonium molibdat dilarutkan dalam 400 ml akuades hangat untuk pembuatan reaksi vanadat molibdat. Sebanyak 1 gram ammonium vanadat untuk dilarutkan dalam 300 ml akuades dan didinginkan, secara perlahan-lahan ditambahkan 140 ml asam nitrat pekat, setelah tercampur ditambahkan pereaksi larutan vanadat molibdat dan diencerkan sampai volume 1 liter.
Pada pembuatan larutan standar, sebanyak 4,394 gram KH2PO4 dilarutkan dengan menggunakan akuades sampai 1000 ml untuk mendapatkan konsentrasi fosfor 1000 ppm. Konsentrasi ini kemudian diencerkan dengan akuades untuk mendapatkan konsentrasi standar fosfor yaitu 0, 2, 3, 4 dan 5 ppm. Larutan sampel hasil pengabuan basah diambil sebanyak 10 ml, kemudian dimasukkan ke dalam labu takar 100 ml. Sebanyak 25 ml pereaksi vanadat molibdat ditambahkan ke dalam sampel tersebut kemudian diencerkan dengan akuades sampai tanda tera. Selanjutnya sampel didiamkan 10 menit dan diukur absorbansi sampel pada panjang gelombang 660 nm.
3.4.5 Analisis asam lemak dengan GC
Sebelum asam lemak dianalisis ke dalam GC, terlebih dahulu lemak dihidrolisis sampai diperoleh asam lemak, kemuadian ditransformasikan menjadi bentuk esternya yang bersifat lebih mudah menguap.
Lemak ditimbang dalam tabung bertutup teflon sebanyak 20-30 mg, selanjutnya ditambahkan 1 mL NaOH 0,5 N dalam metanol dan dipanaskan dalam penangas air selama 20 menit. Larutan tersebut selanjutnya ditambahkan 2 ml BF3 16 % dan 5 mg/mL standar internal, kemudian dipanaskan kembali selama 20 menit. Larutan kemudian didinginkan dan ditambahkan 2 ml NaCl jenuh serta 1 mL heksana, kocok dengan baik. Lapisan heksana yang terbetuk, dipisahkan dengan bantuan pipet tetes dan dimasukkan ke dalam tabung yang berisi 0,1 g Na2SO4 anhidrat, biarkan selama 15 menit. Fasa cair yang terpisah selanjutnya diinjeksikan ke GC.
Alat tersebut menggunakan kolom jenis cyanopropil methyl sil (capilary column) dengan panjang kolom 60 meter, diameter dalam 0,25 mm. Fase gerak berupa gas N2 dengan laju alirnya 20 mL/menit dan laju alir udara 200-250 mL/menit.
4.1 Kultur Chaetoceros gracilis
Pertumbuhan C. gracilis dapat terlihat dari perubahan warna kultur selama kultivasi. Seiring bertambahnya umur kultur, warna kultur C. gracilis semakin pekat. Warna kultur pada hari pertama kultivasi (awal kultivasi) masih menunjukkan warna bening, sedangkan pada hari ke enam kultivasi warna kultur berubah menjadi coklat tua. Perubahan warna kultur juga dapat mengindikasikan adanya peningkatan jumlah atau kepadatan sel C. gracilis. Warna coklat yang terbentuk selama kultivasi disebabkan oleh pigmen yang terkandung dalam C. gracilis. Chaetoceros gracilis disebut dengan golden –brown algae karena kandungan pigmen dalam tubuhnya lebih banyak pigmen kuning daripada pigmen hijau (Arinardi 1997). Karotenoid dan diatomin merupakan pigmen yang dominan pada Chaetoceros gracilis (Isnansetyo & Kurniastuty 1995).
Karotenoid merupakan salah satu pigmen asesoris dalam fotosintesis. Beberapa karotenoid mungkin dapat memperluas spektrum dari warna-warna yang dapat menggerakkan fotosintesis. Namun, sebagian karotenoid berfungsi sebagai fotoproteksi. Karotenoid tidak meneruskan energi ke klorofil, tetapi justru menyerap dan melepaskan energi cahaya yang berlebihan. Energi tersebut jika tidak dilepaskan justru akan merusak klorofil (Campbell et al. 2002). Karotenoid pada alga umumnya terdapat dalam kloroplas tapi apabila keadaan sedang tidak baik, karotenoid dapat ditemukan di dalam sitoplasma (Goodwin 1976).
Pertumbuhan Chaetoceros gracilis dipengaruhi oleh beberapa faktor diantaranya keadaan lingkungan (suhu dan cahaya) serta unsur hara makro. Unsur hara makro yang sangat penting dalam pertumbuhan Chaetoceros gracilis yaitu nitrogen (N), fosfor (P), dan silikat (Si). Unsur N, P, dan S (sulfur) berperan penting dalam proses sitesis protein. Unsur Si dan Ca merupakan bahan
untuk pembentukan dinding sel atau cangkang pada mikroalga (Isnansetyo & Kurniastuty 1995).
pertumbuhan mikroalga karena merupakan sumber energi dalam proses fotosintesis (West 2005 diacu dalam Wijaksono 2008). Energi sinar matahari untuk proses fotosintesis tergantung pada panjang gelombang, intensitas, dan waktu atau lamanya penyinaran (Heddy 1990 diacu dalam Wijaksono 2008). Lampu TL dapat digunakan sebagai sumber cahaya pada kultivasi mikroalga. Hal ini disebabkan lampu TL memiliki cahaya yang berwarna putih. Akan tetapi, spektrum warna pada lampu TL kurang lengakap sehingga kurang efektif untuk dijadikan sebagai sumber cahaya. Cahaya putih pada lampu TL hanya terdiri dari tiga macam spektrum warna, yaitu biru, merah, dan jingga (Qadafi 2009 diacu dalam Aprimara 2010). Sumber cahaya untuk pertumbuhan mikroalga pada penelitian ini berasal dari cahaya matahari.
Kultur C. gracilis rata-rata setiap harinya memperoleh penyinaran dari matahari selama setengan hari dengan intensitas yang berubah-ubah. Intensitas cahaya matahari yang sering berubah-ubah (3500-7000 lux) sangat mempengaruhi pertumbuhan mikroalga. Campbell et al. (2002) menyatakan spektrum cahaya matahari berkisar antara 380 sampai 750 nm. Cahaya tersebut disebut sebagai cahaya tampak yang juga berperan dalam fotosintesis. Namun, kultivasi dengan sumber penyinaran cahaya matahari memiliki kelemahan, yaitu faktor lingkungan seperti intensitas cahaya dan suhu tidak dapat dikendalikan. Intensitas penyinaran cahaya matahari yang terlalu tinggi dapat menyebabkan terjadinya fotoinhibisi. Fotoinhibisi adalah fenomena penurunan kecepatan fotosintesis akibat intensitas cahaya yang terlalu tinggi (Masojidek et al. 2004). Selain itu, suhu lingkungan yang tidak stabil berkisar antara 22 oC sampai 33,6 oC (BMKG 2010) juga ikut mempengaruhi pertumbuhan Chaetoceros gracilis.
Mikroalga memerlukan pH antara 7-8,5 untuk pertumbuhan optimum (Najmushabah 2004 diacu dalam Wijaksono 2008). Pada penelitian ini, pH media
pada awal kultivasi adalah 7, sehingga masih berada dalam kisaran pH optimum untuk pertumbuhan mikroalga.
Kultivasi C. gracilis pada penelitian ini dilakukan secara bertahap. Tahap pertama , yaitu kultur penyegaran yang bertujuan agar mikroalga beradaptasi dengan kondisi kultivasi yang baru. Tahap selanjutnya adalah perbesaran skala kultivasi, pada tahap ini juga dilakukan penghitungan kurva pertumbuhan. Pemanenan C. gracilis dilakukan pada umur kultur 9 hari, yaitu pada saat kultur mengalami memasuki fase stasioner. Pemanenan dilakukan dengan menggunakan sentrifuse suhu 4 oC dengan kecepatan 10.000 rpm selama 10 menit. Biomasa kemudian dikeringkan dengan menggunakan freeze dryer dengan suhu <-18oC. Kultur Chaetoceros gracilis yang dikultivasi di luar ruangan menggunakan media pupuk NPSi dapat dilihat pada Gambar 4.
Gambar 4 Kultur Chaetoceros gracilis yang dikultivasi di luar ruangan menggunakan media pupuk NPSi
4.2 Kurva Pertumbuhan Chaetoceros gracilis
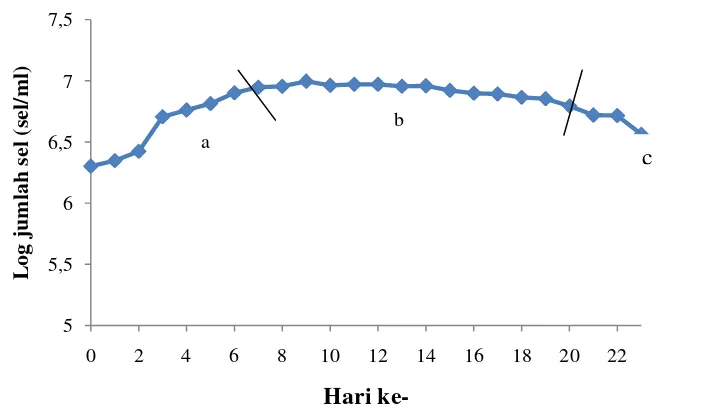
bawah mikroskop dengan perbesaran 10 x 40 kali. Setiap hari mikroalga diambil dan dihitung jumlah selnya menggunakan haemasitometer. Data jumlah sel tersebut selanjutnya diplotkan ke dalam grafik sehingga terbentuk kurva pertumbuhan Chaetoceros gracilis. Kurva pertumbuhan Chaetoceros gracilis yang dikultivasi di luar ruangan menggunakan media NPSi dapat dilihat pada Gambar 5. Kurva pertumbuhan C. gracilis yang dikultivasi di ruang yang dilengkapi AC (Setyaningsih 2010), dapat dilihat pada Gambar 6.
Gambar 5 Kurva pertumbuhan Chaetoceros gracilis yang dikultivasi di luar ruangan menggunakan media pupuk NPSi (a: fase log ;
b: fase stasioner ; c: fase kematian)
Gambar 6 Kurva pertumbuhan Chaetoceros gracilis yang dikultivasi di ruang ber-AC menggunakan media pupuk NPSi (a = fase log; b = fase
stasioner; c = fase kematian) (Setyaningsih 2010)
Chaetoceros gracilis yang dikultivasi di luar ruangan dengan media NPSi mengalami fase log, fase stasioner, dan fase kematian dalam pertumbuhannya, akan tetapi tidak mengalami fase lag. Hal ini disebabkan adanya kultur penyegaran terlebih dahulu selama 6 hari. Kultur penyegaran dilakukan di luar ruangan dengan menggunakan media NPSi sehingga saat dilakukan kultivasi dalam skala besar, mikroalga sudah beradaptasi dengan lingkungannya. Fase log terjadi pada hari ke-0 sampai hari ke-7. Fase log ditandai dengan meningkatnya laju pertumbuhan. Selama fase logaritmik, laju pertumbuhan C. gracilis sebesar 0,23 sel per hari. Hal ini terjadi karena mikroalga sedang aktif berkembangbiak. Ciri metabolisme selama fase logaritmik yaitu tingginya aktivitas fotosintesis yang berguna untuk pembentukan protein dan komponen-komponen plasma sel yang dibutuhkan dalam pertumbuhan. Selain itu, ketersediaan nutrien dalam media kultivasi masih mencukupi untuk terjadinya pertumbuhan (Fogg 1975).
Fase stasioner ditandai dengan penambahan jumlah populasi yang seimbang dengan pengurangan jumlah populasi (kematian). Fase stasioner terjadi setelah hari ke-8 sampai hari ke-19. Fase stasioner dapat didefinisikan sebagai konsentrasi biomasa maksimum yang dapat dicapai oleh alga dalam suatu sistem tertutup (kultur) (Becker 1994). Pada penelitian ini, jumlah sel pada fase stasioner tidak konstan akan tetapi cenderung menurun. Hal ini menunjukkan bahwa pertumbuhan mulai terhambat. Fogg (1975) menyatakan bahwa pertumbuhan sel yang baru akan terhambat oleh keberadaan sel yang telah mati dan faktor pembatas lainnya.
Fase kematian ditandai dengan penurunan produksi biomassa karena kematian dan sel lisis (Vonshak 1985 diacu dalam Diharmi 2001). Fase kematian pada kultur dengan media pupuk NPSi mulai terjadi pada hari ke-20. Fase ini dapat terjadi karena kondisi lingkungan yang kurang baik, umur kultur yang sudah lama dan terbatasnya suplai cahaya serta nutrien, atau karena adanya infeksi dari mikroorganisme lain (Becker 1994). Kematian C. gracilis pada penelitian ini diduga disebabkan oleh menurunnya atau berkurangnya suplai nutrien.
(Gambar 6). Fase stasioner C. gracilis yang dikultivasi di luar ruangan lebih pendek (sampai hari ke-19) dibandingkan C. gracilis yang dikultivasi di dalam ruangan yang dilengkapi AC (sampai hari ke-25) dengan pencahayaan lampu TL selama 24 jam. Hal ini diduga karena kondisi kultivasi yang berbeda. Suhu lingkungan dan pencahayaan yang tidak stabil (22-33,6 oC) menyebabkan mikroalga lebih cepat mati. Becker (1994) menyebutkan bahwa fase kematian pada mikroalga dapat terjadi karena kondisi lingkungan yang kurang baik, umur kultur yang sudah lama dan terbatasnya suplai cahaya serta nutrien, atau karena adanya infeksi dari mikroorganisme lain.
4.3 Komposisi Kimia Chaetoceros gracilis
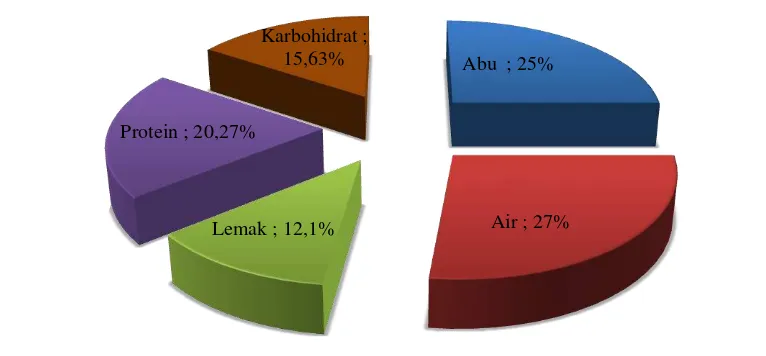
Setiap bahan makanan mempunyai susunan kimia yang berbeda-beda dan mengandung zat gizi yang bervariasi pula baik jenis maupun jumlahnya. Manusia memerlukan zat gizi atau bahan makanan untuk memperoleh energi guna melakukan kegiatan fisik sehari-hari, untuk memelihara proses tubuh dan untuk tumbuh dan berkembang. Komposisi kimia pada Chaetoceros gracilis dapat diketahui melalui analisis proksimat. Analisis proksimat merupakan suatu analisis yang dilakukan untuk memprediksi komposisi kimia suatu bahan, termasuk didalamnya kandungan air, lemak, protein, abu dan karbohidrat (Susanto 2010). Kadar karbohidrat pada Chaetoceros gracilis diperoleh melalui perhitungan by difference. Hasil analisis proksimat Chaetoceros gracilis dapat dilihat pada Gambar 7.
dilakukan pada suhu rendah, sehingga dapat menjaga flavor, warna, dan penampakan, serta meminimalisasi kerusakan akibat panas untuk nutrien yang sensitif terhadap suhu tinggi.
Gambar 7 Hasil uji proksimat pada C. gracilis yang dikultivasi di luar ruangan menggunakan media pupuk NPSi
Kadar air C. gracilis yang terukur dalam penelitian ini sebesar 27%.
Pengeringan biomasa C. gracilis menggunakan freeze dryer. Menurut Liapis & Bruttini (1995) metode pengeringan dengan freeze dryer terdiri
dari tiga tahap yaitu tahap pembekuan, tahap pengeringan utama dimana terjadi sublimasi dari air dan pelarut yang terkandung dalam bahan, dan tahap pengeringan sekunder meliputi pengeluaran uap air dari hasil sublimasi. Sehingga diduga air yang terkandung dalam sampel C. gracilis belum sepenuhnya keluar.
Analisis kadar lemak yang dilakukan dalam penelitian ini bertujuan untuk mengetahui kandungan lemak yang terdapat pada C. gracilis. Lemak mempunyai
komposisi kimia yang unik sehingga tidak larut dalam air (polar) (Muchtadi 2001). Penelitian ini menggunakan pelarut organik n-heksana yang
bersifat non polar, untuk mengekstrak lemak dari dalam bahan. Lemak disusun oleh dua jenis molekul yang lebih kecil, yaitu gliserol dan asam lemak. Lemak terdiri dari tiga asam lemak yang berikatan dengan satu molekul gliserol melalui ikatan ester, suatu ikatan antara gugus hidroksil dengan gugus karbonil (Campbell et al. 2002). Fungsi lemak secara umum adalah penghasil energi, pembangun/pembentuk struktur tubuh, protein sparer (penghematan fungsi protein), penghasil asam lemak esensial yang penting bagi tubuh, pembawa
Abu ; 25%
Air ; 27% Lemak ; 12,1%
Protein ; 20,27%
vitamin larut lemak, pelumas diantara persendian, membantu mengeluarkan sisa makanan, dan prekursor prostaglandin (Suharjo & Kusharto 1989). Lemak pada mikroalga juga memiliki fungsi yang penting, yaitu sebagai cadangan energi dan berperan dalam metabolisme (Becker 1994).
Sintesis lemak pada alga hampir sama dengan tumbuhan tingkat tinggi pada umumnya. Lemak dapat disintesis dari karbohidrat dan protein melalui intermediat glikolisis dan siklus Krebs (Campbell et al. 2002). Sintesa lemak pada alga dipengaruhi oleh banyak faktor, diantaranya suhu dan jumlah nitrogen. Kekurangan silika pada media pertumbuhan juga dapat meningkatkan jumlah lemak, terutama pada diatom (Becker 1994). Lombardi & Wangersky (1995) menyatakan bahwa C. gracilis memiliki kandungan lemak yang terus meningkat sampai akhir fase stasioner. Pratiwi et al. (2009) menyatakan suhu lingkungan yang rendah dapat meningkatkan pembentukan asam lemak tidak jenuh. Hal ini merupakan respon untuk melindungi ketidakstabilan membran sel.
Hasil pengujian menunjukkan bahwa C. gracilis mengandung lemak sebesar 12,1%. Nilai ini lebih rendah dibandingkan dengan hasil pengujian kadar lemak yang dilakukan oleh Setyaningsih (2010) yaitu sebesar 16,5%. Perbedaan nilai kadar lemak ini diduga karena adanya perbedaan suhu selama kultivasi. Penelitian ini dilakukan di luar ruangan sehingga suhu selama kultivasi berubah-ubah sesuai dengan suhu lingkungan luar. Suhu selama kultivasi berlangsung berkisar antara 22-33,6oC. Setyaningsih (2010) dalam penelitiannya menggunakan suhu ruangan AC yaitu sekitar 25-26 oC. Pernyataan ini juga didukung oleh Raghavan et al. (2008), berdasarkan penelitian yang telah dilakukan, pada suhu 20 oC sampai 25 oC kandungan lemak dan karbohidrat pada C. calcitrans lebih tinggi dibandingkan kandungan lemak pada suhu 30 oC. Kandungan lemak C. calcitrans yang dikultivasi pada suhu 20 oC dan 25 oC yaitu sekitar 180 mg/g berat kering dan 240 mg/g berat kering. Kandungan lemakC. calcitrans yang dikultivasi pada suhu 30 oC yaitu sekitar100 mg/g berat kering.
sebagai bahan dasar pembentuk sel-sel dan jaringan tubuh. Selain itu, protein juga berperan dalam proses pertumbuhan, pemeliharaan, dan perbaikan jaringan tubuh yang mengalami kerusakan (Winarno 1997).
Kandungan protein pada C. gracilis yang dikultivasi di luar ruangan dengan menggunakan media pupuk NPSi sebesar 20,27 %. Nilai ini lebih kecil jika dibandingkan dengan hasil penelitian Setyaningsih (2010), yang menggunakan media NPSi sebagai media pertumbuhan dan dikultivasi di ruang ber-AC (25oC-26oC), yaitu sebesar 45,88 %. Amotz et al. (1987) dalam penelitiannya menyebutkan bahwa kandungan protein C. gracilis yang dikultivasi pada suhu 22 oC sebesar 36,1 %. Chen & Jiang (2001) menyatakan bahwa pada suhu di bawah 20 oC mikroalga dapat meningkatkan daya larut O2, sehingga meningkatkan ketersediaan O2 di dalam sel. Menurut Campbell et al. (2002), peningkatan kelarutan O2 di dalam sel dapat meningkatkan pembentukan ATP. ATP yang terbentuk selanjutnya dapat digunakan untuk pembentukan makromolekul (karbohidrat, lemak, dan protein) melalui reaksi anabolisme di dalam sel.
Karbohidrat merupakan sumber energi utama bagi hampir seluruh penduduk Indonesia. Semua hidrat arang atau karbohidrat terdiri atas unsur-unsur karbon (C), hidrogen (H), oksigen (O) yang pada umumnya mempunyai rumus kimia Cn(H2O)n (Nasoetion et al 1994). Karbohidrat terbentuk saat proses fotosintesis berlangsung (Anwar 1985). Selama siklus Calvin berlangsung, CO2 direduksi menjadi glukosa atau produk organik lain dengan bantuan dari ATP dan NADH yang terbentuk selama reaksi terang (Lehninger 1982).
Perhitungan karbohidrat dengan metode by difference merupakan metode penentuan kadar karbohidrat dalam bahan pangan secara kasar, dimana serat kasar juga terhitung sebagai karbohidrat (Winarno 2008). Berdasarkan hasil penelitian,
Bahan makanan terdiri dari 96% bahan organik dan air, sedangkan sisanya merupakan unsur-unsur mineral. Unsur tersebut juga dikenal sebagai zat anorganik atau kadar abu (Winarno 2008). Zat anorganik tidak ikut terbakar dalam proses pembakaran sehingga membentuk abu (Guthrie 1975). Berdasarkan hasil pengujian, kadar abu yang terukur dari sampel C. gracilis sebesar 25%. Nilai tersebut lebih rendah dibandingkan dengan hasil penelitian yang
telah dilakukan oleh Setyaningsih et al. (2009) yaitu sebesar 36,38%. Isnansetyo & Kurniastuty (1995) menyebutkan bahwa kadar abu pada
Chaetoceros sp. yaitu sebesar 28%. Tinggi rendahnya kadar abu dapat disebabkan oleh perbedaan keadaan lingkungan saat kultivasi. Menurut Richmond (2004) komposisi kimia pada mikroalga sangat tergantung pada kondisi lingkungan dan fase pertumbuhan.
4.4 Mineral
Unsur-unsur mineral adalah unsur kimia selain karbon, hidrogen, oksigen, dan nitrogen yang dibutuhkan oleh tubuh. Unsur mineral juga dikenal sebagai zat anorganik atau kadar abu (Guthrie 1975). Mineral dapat digolongkan ke dalam mineral makro dan mineral mikro (Almatsier 2006). Manusia dapat memperoleh
mineral dari dua sumber yaitu melalui konsumsi nabati dan hewani (Muchtadi 2001). Mineral pada C. gracilis diduga berasal dari media