APLIKASI ERITROMISIN DAN KLORAMFENIKOL DALAM
MENEKAN JUMLAH Campylobacter spp. DAN KOLIFORM
PADA AYAM YANG DIINFEKSI OLEH Campylobacter jejuni
MURDIANA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2012
Dengan ini saya menyatakan bahwa skripsi yang berjudul Aplikasi Eritromisin dan Kloramfenikol dalam Menekan Jumlah Campylobacter spp. dan Koliform pada Ayam yang Diinfeksi oleh Campylobacter jejuni adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2012
Murdiana
MURDIANA. Application Erythromycin and Chloramphenicol to Eliminate
Campylobacter spp. and Coliform in Chickens were Infected by
Campylobacter jejuni. Under the guidance of HERWIN PISESTYANI.
Campylobacter is one of the major pathogenic bacteria causing food poisoning that can be transmitted through poultry products. Infection C. jejuni and coliform in humans can be caused by eating contaminated food. Transmission can be achieved at the farm level with treatment suffering from campylobacteriosis in poultry, for example by administering antimicrobial. The aimed of this study was to determine the number of Campylobacter spp. and coliform in chickens were infected by C. jejuni before and after treatment with erythromycin and chloramphenicol. A total of 17 chickens kept divided into four experimental groups, namely (A) negative control, chickens were not infected by C. jejuni and without antibiotic treatment, (B) positive control, chickens were infected by C. jejuni and without antibiotic treatment, (C) chickens were infected by C. jejuni and were treated by erythromycin, and (D) chickens infected by C. jejuni and treated by chloramphenicol. Inspection was done in three times, in one day old chickens, after infection (12 days old chickens), and after treatment (17 days old chickens). The average number of Campylobacter spp. at one day old chickens was 2.0 + 0.57 MPN/g, while the average number of coliforms was 2.8 x 107 + 3.5 x 106 cfu/g. After was infected by C. jejuni, the average number of Campylobacter spp. increased to 46 + 27.15 MPN/g, while the average number of coliforms was 2.0 x 106 + 1.7 x 105 cfu/g. After treatment by erythromycin and chloramphenicol, the average number of Campylobacter spp. in both groups decreased, respectively 2.5 + 2.12 as MPN/g and 2 + 0 MPN/g, while the average number of coliforma much as 5.7 x 108 + 3.2 x 107 cfu/g and 4.3 x 108 + 1.7 x 108 cfu/g. From this research, erythromycin or chloramphenicol were effective for treatment of campylobacteriosis in chickens.
MURDIANA. Aplikasi Eritromisin dan Kloramfenikol dalam Menekan Jumlah
Campylobacter spp. dan Koliform pada Ayam yang Diinfeksi oleh
Campylobacter jejuni. Dibawah bimbingan HERWIN PISESTYANI.
Campylobacter merupakan salah satu bakteri patogen utama penyebab keracunan pangan yang dapat ditularkan melalui produk unggas. Campylobacter
dapat menginfeksi unggas sehat dan dapat mengontaminasi karkas selama proses pemotongan dan pengolahan. Infeksi C. jejuni dan kelompok koliform pada manusia dapat disebabkan karena mengonsumsi makanan yang terkontaminasi. Upaya pencegahan dapat dilakukan di tingkat peternakan dengan pengobatan pada unggas yang menderita campylobacteriosis, misalnya dengan pemberian antimikroba. Pemberian antimikroba pada unggas yang menderita campylobacteriosis dilakukan agar kontaminasi pada produk pangan dapat dicegah sehingga pencegahan campylobacteriosis pada manusia dapat dilakukan. Penelitian ini bertujuan untuk mengetahui jumlah Campylobacter spp. dan koliform pada ayam yang diinfeksi C. jejuni sebelum dan setelah pengobatan menggunakan antimikroba eritromisin dan kloramfenikol.
Sebanyak 17 ekor ayam dipelihara yang dibagi menjadi empat kelompok percobaan, yaitu (A) 5 ekor kontrol negatif, ayam tidak diinfeksi C. jejuni dan tanpa pengobatan antibiotik; (B) 4 ekor kontrol positif, ayam diinfeksi C. jejuni
dan tanpa pengobatan antibiotik; (C) 4 ekor ayam diinfeksi C. jejuni dengan konsentrasi 104 cfu/ml secara oral dan diobati dengan eritromisin dengan dosis 40 µg/ml secara oral sebanyak 1 ml/hari/ekor; dan (D) 4 ekor ayam diinfeksi
C. jejuni dengan konsentrasi 104 cfu/ml secara oral dan diobati dengan kloramfenikol dengan dosis 5 µg/ml secara oral sebanyak 1 ml/hari/ekor. Pemeriksaan dilakukan tiga kali, yaitu pada ayam umur satu hari, setelah infeksi (ayam umur 12 hari), dan setelah pengobatan (ayam umur 17 hari).
Rataan jumlah Campylobacter spp. pada ayam umur satu hari adalah 2.0 + 0.57 MPN/g, sedangkan rataan jumlah koliform adalah 2.8 x 107 + 3.5 x 106 cfu/g. Setelah diinfeksi C. jejuni, rataan jumlah Campylobacter spp. meningkat menjadi 46 + 27.15 MPN/g, sedangkan rataan jumlah koliform adalah 2.0 x 106 + 1.7 x 105 cfu/g. Setelah dilakukan pengobatan menggunakan antimikroba eritromisin dan kloramfenikol, rataan jumlah Campylobacter spp. pada kedua kelompok mengalami penurunan, yaitu masing-masing sebanyak 2.5 + 2.12 MPN/g dan 2 + 0 MPN/g, sedangkan rataan jumlah koliform sebanyak 5.7 x 108 + 3.2 x 107
cfu/g dan 4.3 x 108 + 1.7 x 108 cfu/g. Dari penelitian ini, eritromisin dosis 40 µg/ml atau kloramfenikol dosis 5 µg/ml efektif dalam pengobatan campylobacteriosis pada ayam.
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
MURDIANA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Nama : Murdiana
NIM : B04080021
Disetujui,
drh. Herwin Pisestyani, M.Si Pembimbing
Diketahui,
drh. H. Agus Setiyono, MS, Ph.D, AP.Vet Wakil Dekan Fakultas Kedokteran Hewan
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala berkah dan karunia-Nya sehingga tugas akhir ini dapat diselesaikan. Judul penelitian ini adalah Aplikasi Eritromisin dan Kloramfenikol dalam Menekan Jumlah
Campylobacter spp. dan Koliform pada Ayam yang Diinfeksi oleh
Campylobacter jejuni.
Terima kasih penulis ucapkan kepada ibu drh. Herwin Pisestyani, M.Si selaku dosen pembimbing skripsi atas segala bimbingan dan ilmu yang diberikan kepada penulis selama penelitian dan penyusunan tugas akhir ini dan kepada bapak Dr. drh. Koekoeh Santoso, M.Si selaku dosen pembimbing akademik atas bimbingan dan nasehat selama penulis menjalani studi. Ucapan terima kasih penulis juga sampaikan kepada drh. Rahmat Hidayat, M.Si selaku dosen penguji pada seminar hasil penelitian, dan kepada drh. Ekowati Handharyani, MS, Ph.D dan Prof. drh. Tutik Wresdiyati, Ph.D selaku dosen penguji pada ujian akhir sarjana yang telah memberikan banyak saran kepada penulis. Kepada lembaga Kerja Sama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (K2P3T) penulis ucapkan terimakasih atas penyelenggaraan dana pada penelitian ini. Tidak lupa penulis mengucapkan terima kasih kepada drh. Rama Prima SF, M.Si atas dukungan dan bimbingannya selama penelitian dan kepada Bapak Yuhendra yang telah banyak membantu selama penelitian berlangsung. Kepada teman satu penelitian (Iin Nuraeni) penulis berterima kasih atas kerjasama dan bantuannya selama penelitian.
Terima kasih yang tak terhingga juga disampaikan kepada kedua orang tua Bapak dan Mama, kakak-kakak tercinta daeng Udin, kak Mudi, daeng Didi, dan
kak Unni serta seluruh keluarga atas doa, semangat, dan cinta yang telah diberikan. Selanjutnya ucapan terimakasih penulis ucapkan kepada keluarga Avenzoar 45 atas kesan dan nuansa indah selama perkuliahan dan juga kepada keluarga Rumah Nahla atas doa, semangat, dan torehan tawa selama ini.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini tidak luput dari kekurangan, untuk itu penulis sangat berterimakasih atas kritik dan saran-saran yang bersifat membangun dari semua pihak demi kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat.
Bogor, September 2012
Penulis dilahirkan di Gowa, Sulawesi Selatan pada tanggal 26 Januari 1990. Penulis merupakan putri kelima dari lima bersaudara dari pasangan Bapak Djamaluddin dan Ibunda Mardiah.
Pendidikan formal penulis dimulai dari SDI Tetebatu I dan lulus pada tahun 2002, yang kemudian dilanjutkan ke SMPN 1 Pallangga dan lulus pada tahun 2005. Pendidikan SMA penulis selesaikan di SMAN 3 Makassar dan lulus pada tahun 2008. Penulis melanjutkan pendidikan tinggi di Institut Pertanian Bogor (IPB) pada tahun 2008 melalui jalur Undangan Seleksi Masuk IPB (USMI). Mayor yang dipilih adalah Mayor Kedokteran Hewan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor (FKH IPB).
MURDIANA. The Number of Campylobacter spp. and Coliform in Chick were Treated by Erythromycin and Chloramphenicol. Under the guidance of HERWIN PISESTYANI.
This study was aimed to determine the number of Campylobacter spp. and coliform before and after treatment with erythromycin and chloramphenicol. Total of 100 DOC were divided into four groups, (A) negative control, chickens did not infect C. jejuni; (B) positive control, chickens infected C. jejuni without treatment, (C) chickens infected by C. jejuni treated with erythromycin, and (D) chickens infected C. jejuni treated with chloramphenicol. Examinations were performed three times, at 1 day-old-chick, after infection, and after treatment. The average number of Campylobacter spp. at one day old chickens is 2.0 + 0.57 MPN/g, while the average number of coliforms was 2.8 x 107 + 3.5 x 106 cfu/g. Once infected by C. jejuni, the average number of Campylobacter spp. increased to 46 + 27.15 MPN/g, while the average number of coliforms was 2.0 x 106 + 1.7 x 105 cfu/g. After treatment with erythromycin and chloramphenicol, the average number of Campylobacter spp. decreased in both groups, ie each as much as 2.5 + 2.12 MPN/g and 2 + 0 MPN/g, while the average number of total coliform 5.7 x 108 + 3.2 x 107 cfu/g and 4.3 x 108 + 1.7 x 108 cfu/g.
Halaman
Campylobacteriosis pada Manusia ... 5
Karakteristik Koliform ... 7
Kolibasilosis pada Ayam ... 8
Bakteri Koliform pada Manusia ... 9
Antimikroba dan Antibiotik ... 9
Eritromisin ... 11
Kloramfenikol ... 11
Penggunaan Antibiotik pada Peternakan Ayam ... 12
BAHAN DAN METODE ... 14
Waktu dan Tempat Penelitian ... 14
Sampel dan Hewan Percobaan ... 14
Alat dan Bahan ... 14
Metode Penelitian ... 15
PemeliharaanAyam Broiler ... 15
InfeksiIsolatCampylobacterjejuni ... 15
PengobatandenganMenggunakanEritromisin danKloramfenikol ... 15
PenghitunganJumlahCampylobacterjejuni danKoliform ... 15
PenghitunganJumlahCampylobacterjejuni (Review and Methods for New Zaeland Laboratoriestahun 2003) ... 16
PenghitunganJumlah Koliform (Compendium of Methods for the Microbiological Examination of Foods tahun 2003) ... 17
HASIL DAN PEMBAHASAN ... 18
Jumlah Campylobacter spp. pada Ayam Umur Satu Hari ... 18
Jumlah Campylobacter spp. pada Ayam setelah Diinfeksi oleh Campylobacter jejuni ... 19
Jumlah Campylobacter spp. pada Ayam setelah Pengobatan Menggunakan Eritromisin dan Kloramfenikol ... 20
Jumlah Koliform pada Ayam Umur Satu Hari ... 22
Jumlah Koliform pada Ayam setelah Diinfeksi oleh Campylobacter jejuni ... 23
Jumlah Koliform pada Ayam setelah Pengobatan Menggunakan Eritromisin dan Kloramfenikol ... 25
SIMPULAN DAN SARAN ... 27
Simpulan ... 27
Saran ... 27
DAFTAR PUSTAKA ... 28
DAFTAR TABEL
Halaman
1 Rataan jumlah Campylobacter spp. pada ayam umur 1 hari
(sebelum diinfeksi) ... 18 2 Rataan jumlah Campylobacter spp. pada ayam setelah
diinfeksi oleh C. jejuni (ayam umur 12 hari) ... 19 3 Rataan jumlah Campylobacter spp. pada ayam setelah
pengobatanmenggunakan eritromisin dan kloramfenikol
(ayam umur 17 hari) ... 20 4 Rataan jumlah koliform pada ayam umur 1 hari ... 23 5 Rataan jumlah koliform pada ayam setelah diinfeksi C. jejuni
(ayam umur 12 hari) ... 24 6 Rataan jumlah koliform pada ayam setelah pengobatan
menggunakan eritromisin dan kloramfenikol
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Latar Belakang
Campylobacter merupakan salah satu bakteri patogen utama penyebab keracunan pangan pada manusia yang dapat ditularkan melalui produk unggas.
Campylobacter mampu hidup di saluran pencernaan unggas sehat. Bakteri ini bereplikasi di mukosa saluran pencernaan yang memiliki kadar oksigen rendah (mikroaerofilik). Campylobacter dapat menginfeksi unggas sehat dan dapat mengontaminasi karkas selama proses pemotongan dan pengolahan. Pada karkas ayam, Campylobacter dapat bertahan hidup namun tidak mampu bereplikasi (Wesley 2009). Kontaminasi pada karkas ayam dapat mengakibatkan campylobacteriosis pada manusia.
Kasus campylobacteriosis di beberapa negara telah banyak dilaporkan, misalnya pada tahun 2004, 25 negara bagian Uni Eropa melaporkan 183 961 kasus campylobacteriosis. Di Amerika Serikat, hampir dua juta penderita campylobacteriosis mengakibatkan penurunan produktivitas kurang lebih $1.2 juta setiap tahunnya. Secara epidemiologi, diketahui bahwa 72% kasus campylobacteriosis tersebut disebabkan oleh kontaminasi C. jejuni pada produk unggas (Wesley2009; CDC2011a).
Pada saluran pencernaan ayam, selain Campylobacter juga terdapat jenis bakteri lain yang hidup sebagai mikroflora normal, misalnya koliform. Koliform merupakan kelompok bakteri yang sering digunakan sebagai indikator sanitasi pada berbagai jenis bahan pangan. Bakteri ini ditemukan pada feses hewan maupun manusia (Ray & Bhunia 2008). Beberapa jenis dari kelompok bakteri ini dapat ditemukan pada produk pangan asal hewan, misalnya daging ayam. Adanya mikroorganisme ini dalam suatu produk pangan menunjukkan adanya kontaminasi pada proses persiapan dan pengolahan. Kontaminasi tersebut salah satunya dapat berasal dari feses hewan.
jumlah mikroorganisme tersebut jauh lebih tinggi dibanding dalam kondisi normal sehingga peluang terjadinya kontaminasi pada produk pangan jauh lebih tinggi. Upaya pencegahan dapat dilakukan di tingkat peternakan dengan pengobatan pada unggas yang menderita campylobacteriosis dan kolibasilosis, misalnya dengan pemberian antimikroba.
Pemberian antimikroba pada unggas yang menderita campylobacteriosis dan kolibasilosis dilakukan agar kontaminasi pada produk pangan dapat dicegah sehingga pencegahan penyakit pada manusia dapat dilakukan. Antimikroba yang sering digunakan dalam kasus campylobacteriosis adalah eritromisin (Giguère 2006). Menurut Setiabudy dan Kunardi (2003), kloramfenikol memiliki spektrum luas terhadap berbagai jenis mikroba, sehingga dapat digunakan untuk pengobatan campylobacteriosis dan kolibasilosis. Pada uji Minimum Bactericidal Concentration (MBC) yang dilakukan pada penelitian sebelumnya, kedua antimikroba tersebut memiliki daya hambat yang tinggi terhadap perkembangan
C. jejuni.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui jumlah Campylobacter spp. dan koliform pada ayam yang diinfeksi C. jejuni sebelum dan setelah pengobatan menggunakan antimikroba eritromisin dan kloramfenikol.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang jenis antimikroba yang efektif dalam menangani kasus campylobacteriosis pada peternakan ayam. Penelitian ini juga diharapkan dapat bermanfaat untuk pengendalian foodborne disease yang disebabkan oleh Campylobacter spp. dan koliform dari produk ayam.
Hipotesis Penelitian
Antimikroba eritromisin atau kloramfenikol dapat menurunkan jumlah
TINJAUAN PUSTAKA
Karakteristik Campylobacter jejuni
Campylobacter spp. merupakan bakteri Gram negatif, tidak berspora, dan bersifat oksidase positif. Bentuk sel pleomorfik dan berukuran kecil, yaitu lebar 0.2-0.5 µm dan panjang 0.5-8.0 µm. Bakteri ini berbentuk spiral, ramping, dan memiliki satu atau lebih flagela yang memberikan kemampuan untuk bergerak cepat (Adams & Moss 2008).
Menurut Debruyne et al. (2008), genus Campylobacter termasuk ke dalam famili Campylobacteraceae. Genus ini terdiri dari 14 spesies yang beberapa diantaranya patogen bagi manusia.
Klasifikasi
Kingdom : Bacteria
Filum : Proteobacteria Kelas : Epsilonproteobacteria Ordo : Campylobacterales Famili : Campylobacteraceae Genus : Campylobacter
Spesies : Campylobacter jejuni
Gambar 1 Bentuk morfologi C. jejuni.
kelangsungan hidupnya menurun, sehingga bakteri ini dapat bertahan hidup dalam produk unggas hingga beberapa bulan.
Campylobacter jejuni bersifat mikroaerofilik dan 'capnophilic' (menyukai karbondioksida) sehingga optimal tumbuh pada suasana yang mengandung karbondioksida 10% dan 5-6% oksigen (Fernandes 2009). Campylobacter spp.
tidak mampu mengoksidasi karbohidrat, namun bakteri ini memiliki sistem metabolisme kemoorganotropik yang mampu menggunakan asam amino sebagai sumber energi (Sellars et al. 2002).
Campylobacteriosis pada Ayam
Ayam merupakan inang utama dari C. jejuni. Bakteri ini hidup secara komensal pada mukosa saluran pencernaan ayam. Campylobacter jejuni dapat bersifat patogen pada ayam usia muda, tapi umumnya pada ayam dewasa tidak bersifat patogen. Pada day old chicken (DOC), infeksi dapat dengan mudah terjadi tanpa menimbulkan gejala klinis (Snelling et al. 2005; Lee & Newell2006).
Penularan Campylobacter spp. pada peternakan ayam dapat terjadi secara vertikal dan horizontal. Menurut Sahin et al. (2003b), penularan
Campylobacter spp. secara vertikal dapat terjadi melalui kontaminasi telur dalam saluran reproduksi ayam betina selama tahap perkembangan telur dan juga melalui kontaminasi pada kerabang telur oleh feses yang mengandung
Campylobacter spp. dan berpenetrasi ke dalam bagian telur. Secara horizontal, penularan Campylobacter spp. pada suatu peternakan ayam dapat terjadi melalui kontaminasi dari lingkungan sekitar. Menurut Pearson et al. (1993) bakteri ini dapat mengontaminasi pakan dan air minum. Kontaminasi silang melalui udara, serangga, burung liar, dan pekerja juga dapat terjadi. Penyebaran penyakit dari satu ayam ke ayam lainnya dalam satu kandang terjadi dengan sangat cepat. Ayam yang terinfeksi dalam suatu peternakan dapat menyebarkan penyakit ke semua populasi ayam dalam waktu beberapa hari (Lee & Newell 2006).
rodensia dan burung liar merupakan reservoar bagi C. jejuni yang dapat menyebarkan bakteri tersebutmelalui kotoran yang mengandung bakteri.
Proses infeksi C. jejuni pada ayam dapat terjadi melalui rute oral. Infeksi masuk melalui pakan atau air minum yang terkontaminasi. Bakteri masuk melalui mulut ke dalam lambung, dan selanjutnya ke saluran intestinal. Patogenesis akibat infeksi C. jejuni dimulai ketika bakteri ini berpenetrasi pada lapisan mukosa usus. Bakteri ini berpenetrasi dengan menggunakan flagella. Bakteri yang telah berpenetrasi akan melekat pada sel epitel dengan bantuan fibronectin binding protein (CadF), lipoprotein (JlpA), flagellin, dan lipopolisakarida (LPS). Proses perlekatan bakteri akan diikuti oleh proses invasi sel epitel yang mengakibatkan terjadinya respon peradangan (Songer & Post 2005; Cox et al. 2010). Menurut van Vliet dan Ketley (2001), respon peradangan yang terjadi mengakibatkan kerusakan pada mukosa usus dan memicu terjadinya diare. Selain itu, kejadian diare juga dapat terjadi akibat toksin yang dihasilkan oleh C. jejuni, yaitu enterotoksin dan sitotoksin. Toksin ini dianggap merupakan salah satu faktor terjadinya diare akibat infeksi C. jejuni (Shane & Stern 2003).
Infeksi Campylobacter spp. pada broiler dapat terjadi sejak ayam berumur 7 hari. Masa inkubasi penyakit pada ayam selama 2-7 hari (Shane & Stern 2003; Lee & Newell 2006). Campylobacteriosis pada ayam dapat menimbulkan diare dan dilatasi saluran pencernaan mulai dari distal lengkung duodenum sampai bifurkasio pada sekum. Pada kejadian tersebut juga terjadi perdarahan akibat enteritis hemoragi yang ditimbulkan oleh infeksi C. jejuni. Penyakit yang ditimbulkan ini dapat pulih tanpa pemberian antibiotik (Dhillon et al. 2006; Pisestyani 2010).
Campylobacteriosis pada Manusia
Campylobacteriosis pada manusia disebabkan oleh infeksi bakteri
Campylobacter spp. Bakteri ini dapat menyebabkan enterokolitis akut. Gejala klinis yang terjadi diantaranya demam, nyeri perut, dan diare. Gejala lainnya berupa muntah, sakit kepala, dan panas dingin juga sering ditemukan. Diare merupakan gejala utama dari infeksi C. jejuni. Feses yang dihasilkan mengandung
Penyakit ini bersifat self limiting disease yang dapat sembuh dalam waktu seminggu (van Vliet & Ketley 2001; Adams & Moss 2008).
Kejadian campylobacteriosis pada manusia umumnya disebabkan oleh
C. jejuni (95%) dan C. coli (5%) (Songer & Post 2005). Sumber infeksi pada manusia dapat berasal dari makanan atau minuman yang terkontaminasi dan melalui kontak langsung dengan hewan atau feses hewan yang terinfeksi. Konsumsi daging ayam yang tidak matang sempurna merupakan faktor utama penyebab campylobacteriosis pada manusia. Kontaminasi pada daging ayam dapat terjadi selama proses pemotongan dan pengeluaran jeroan, sedangkan kontaminasi pada air minum bisa terjadi melalui feses burung liar dan berbagai jenis hewan domestik yang mengandung Campylobacter spp. dalam fesesnya. Proses pemanasan dapat membunuh Campylobacter spp. Oleh karena itu, dengan proses pengolahan yang benar diharapkan mampu mengurangi risiko penularan
C. jejuni pada manusia (Wesley 2009).
Mekanisme patogenik campylobacteriosis belum sepenuhnya dipahami, tetapi diketahui beberapa faktor virulensi dari C. jejuni berperan penting dalam proses infeksi, diantaranya kemampuan motilitas, kemotaksis, dan produksi racun.
Campylobacter jejuni mampu memproduksi beberapa toksin, utamanya enterotoksin dan sitotoksin. Kemampuan motilitas memiliki peran yang sangat penting dalam virulensi karena diperlukan untuk menembus lapisan dinding usus. Ketika kemampuan motilitas bakteri hilang, maka infeksi yang terjadi juga hilang (Cox et al. 2010).
Menurut van Vliet dan Ketley (2001), campylobacteriosis pada manusia dapat menimbulkan penyakit kronis yang disebut Guillain-Barrè Syndrome
(GBS). Sindrom ini merupakan salah satu penyakit autoimun yang menyerang sistem saraf perifer. Kejadian GBS pada manusia menyebabkan infiltrasi sel mononuklear pada saraf perifer yang akan mengakibatkan degenerasi akson atau demielinasi pada saraf perifer. Hal ini dapat mengakibatkan terjadinya gangguan motoris dan alexia (Ang et al. 2001; Winer 2001).
lipopolisakarida (LPS) pada bagian membran luarnya. Inti oligosakarida pada LPS
C. jejuni mengandung gangliosida yang strukturnya sangat mirip dengan gangliosida pada sel saraf manusia. Struktur LPS pada C. jejuni bersifat sangat antigenik, sehingga pada saat terjadi gastroenteritis akibat C. jejuni tubuh akan memproduksi antibodi untuk menghancurkan struktur LPS tersebut. Kemiripan struktur antara inti oligosakarida pada LPS dan gangliosida pada sel saraf ini mengakibatkan antibodi dan sel mononuklear dari dalam tubuh ikut menyerang bagian gangliosida dari sel saraf perifer. Seiring dengan serangan yang berlanjut, jaringan saraf perifer akan hancur secara bertahap. Saraf motorik dan sensorik akan diserang, sehingga terjadi disfungsi motorik dan sensorik. Kejadian ini pada akhirnya dapat mengakibatkan kelumpuhan pada manusia (van Vliet & Ketley 2001).
Karakteristik Koliform
Bakteri koliform merupakan kelompok bakteri yang digunakan sebagai indikator sanitasi air dan berbagai produk pangan. Istilah koliform bukan merupakan istilah taksonomi melainkan mewakili sekelompok spesies dari beberapa genus yang memiliki banyak karakteristik umum. Kelompok koliform diantaranya Escherichia, Enterobacter, Kleibsiella, dan Citrobacter. Bakteri-bakteri tersebut merupakan Bakteri-bakteri dari famili Enterobacteriaceae yang bersifat Gram negatif, berbentuk batang, tidak membentuk spora, pada umumnya motil, anaerob fakultatif, dan mampu memfermentasi laktosa yang menghasilkan asam dan gas dalam waktu 48 jam pada suhu 32 C atau 35 C. Beberapa spesies dapat tumbuh pada suhu tinggi (44.5 C), namun pada umumnya tumbuh pada suhu 4-5 C. Semua anggota kelompok koliform sensitif terhadap suhu rendah dan dapat mati pada suhu pasteurisasi. Kelompok koliform dapat ditemukan pada feses manusia, hewan berdarah panas, dan burung. Beberapa diantaranya juga dapat ditemukan di tanah, air, dan tanaman (Mead 2007; Ray & Bhunia 2008).
Kelompok koliform yang merupakan kontaminan feses disebut koliform fekal. Koliform fekal adalah bagian dari bakteri kelompok koliform yang mampu memfermentasi laktosa pada suhu 44.5 + 0.2 C dalam waktu 48 jam dan bersifat
Enterobacter. Kebanyakan dari kelompok ini terdiri dari E. coli. Escherichia coli
merupakan indikator keberadaan bakteri enterik patogen dalam feses. Peningkatan populasi koliform fekal pada air memungkinkan adanya peningkatan bakteri patogen (McMurry et al. 1998; Mead 2007).
Beberapa bakteri dari kelompok koliform fekal dapat ditemukan pada makanan mentah dari produk hewani. Pada produk pasteurisasi juga sering ditemukan akibat proses sanitasi setelah pemanasan yang tidak benar. Pada makanan mentah, kontaminasi koliform fekal dapat berasal dari feses dan sanitasi yang buruk (Ray & Bhunia 2008).
Kolibasilosis pada Ayam
Bakteri koliform merupakan mikroflora normal pada saluran pencernaan hewan berdarah panas, unggas, dan manusia (Ray & Bhunia 2008). Lebih dari 90% dari jumlah total koliform terdiri dari E. coli. Umumnya E. coli bersifat komensal pada saluran pencernaan ayam, namun beberapa strain E. coli bersifat patogen (Mead 2007).
Menurut Bolder (1998), jumlah bakteri koliform pada saluran pencernaan ayam dapat mencapai 106-109 cfu/g. Sebagian besar dari jumlah tersebut bersifat komensal dan beberapa diantaranya bersifat patogen. Penularan bakteri koliform patogen pada peternakan ayam dapat terjadi melalui kontaminasi feses pada air dan pakan. Air minum berperan penting sebagai jalur transmisi berbagai jenis bakteri patogen. Beberapa jenis bakteri koliform dan bakteri patogen lainnya dapat bertahan lama dalam air (Jafari et al. 2006).
Bakteri Koliform pada Manusia
Pada manusia, bakteri koliform juga merupakan mikroflora normal dalam saluran pencernaan. Jenis bakteri ini umumnya bersifat komensal, namun beberapa strain E. coli bersifat sangat patogen pada manusia. Beberapa strain yang dianggap sangat patogen pada manusia adalah E. coli O157 yang merupakan penyebab infeksi E. coli utama pada manusia dan E. coli O104:H4 yang merupakan penyebab wabah E. coli di Jerman pada tahun 2011 (Ogden 2007; CDC 2011b).
Bakteri koliform dapat ditemukan di tanah, tanaman, dan air. Kontaminasi tersebut dapat berasal dari kotoran hewan atau manusia yang mengandung koliform fekal di dalamnya. Penularan bakteri koliform patogen pada manusia dapat terjadi melalui konsumsi bahan pangan dan air yang terkontaminasi. Kontaminasi pada daging dan susu dapat terjadi secara langsung melalui feses hewan. Selain itu, kontaminasi juga dapat terjadi pada proses pengolahan bahan pangan melalui air dan tanah yang terkontaminasi. Proses penyimpanan yang tidak tepat dan sanitasi yang buruk juga menjadi salah satu sumber kontaminasi bakteri koliform pada bahan pangan (Ray & Bhunia 2008).
Kejadian infeksi E. coli pada manusia dapat terjadi tanpa menimbulkan gejala klinis, namun dalam beberapa kasus terlihat adanya gejala diare berair dan kolitis hemoragi. Diare merupakan gejala yang paling banyak ditemukan. Kolitis hemoragi ditandai dengan adanya gejala diare berat yang sering disertai dengan diare berdarah, kram perut, mual, dan muntah. Akibat kehilangan banyak cairan tubuh pada saat diare dan muntah, maka risiko dehidrasi sering terjadi. Pada infeksi yang berat, penyakit ini dapat menimbulkan kematian pada manusia jika tidak dilakukan pengobatan (OIE 2009; CDC 2011b).
Antimikroba dan Antibiotik
antimikroba bakterisidal mampu membunuh mikroba. Antimikroba tertentu aktivitasnya dapat meningkat dari bakteriostatik menjadi bakterisidal apabila kadar antimikroba tersebut ditingkatkan (Kee & Hayes 1996; Setiabudy & Gan 2003).
Sifat antimikroba berbeda satu dengan lainnya. Beberapa jenis antimikroba bersifat aktif terhadap bakteri Gram positif, namun bakteri Gram negatif tidak peka. Berdasarkan sifat ini, antimikroba dibagi menjadi dua kelompok, yaitu berspektrum sempit dan berspektrum luas. Antimikroba berspektrum luas merupakan antimikroba yang aktif terhadap berbagai jenis mikroba baik Gram positif maupun Gram negatif, misalnya kloramfenikol dan tetrasiklin, sedangkan antimikroba berspektrum sempit merupakan antimikroba yang hanya aktif pada beberapa jenis mikroba tertentu misalnya benzil penisilin dan streptomisin (Setiabudy & Gan 2003).
Mekanisme kerja antimikroba dibagi dalam lima kelompok, yaitu mengganggu metabolisme sel mikroba, menghambat sintesis dinding sel mikroba, mengganggu permeabilitas membran sel mikroba, menghambat sintesis protein sel mikroba, dan menghambat sintesis atau merusak asam nukleat sel mikroba. Penggunaan antimikroba ini ditentukan berdasarkan indikasi dengan mempertimbangkan beberapa faktor, diantaranya gambaran klinik penyakit infeksi, jenis mikroba, dan patogenisitas mikroba. Oleh karena itu, indikasi untuk memberikan antimikroba pada pasien harus dipertimbangkan dengan seksama (Setiabudy & Gan 2003).
Eritromisin
Eritromisin merupakan antibiotik golongan makrolida yang dihasilkan oleh
Streptomyces erythreus. Antibiotik ini memiliki sebuah cincin lakton makrosiklik yang terdiri dari keton dan gula amino. Eritromisin berupa kristal berwarna kekuningan yang kelarutannya rendah dalam air dan tidak stabil dalam suasana asam (Setiabudy 2003; Giguère 2006).
Eritromisin bekerja dengan menghambat sintesis protein mikroba yaitu dengan berikatan secara reversibel pada ribosom sub unit 50S. Antibiotik ini bersifat bakteriostatik atau bakterisidal tergantung dari jenis dan jumlah mikroba (Setiabudy 2003).
Eritromisin sangat mudah didegradasi oleh asam lambung. Hal tersebut dapat dihindari dengan pemberian lapisan yang tahan asam pada eritromisin yang diberikan secara per oral atau digunakan sediaan dalam bentuk basa bebas, stearat, etilsuksinat atau ester estolat. Stearat dihidrolisis dalam usus menjadi basa, sedangkan etilsukinat dan ester estolat langsung diserap dan dihidrolisis dalam tubuh menjadi basa aktif. Eritromisin mudah diserap oleh usus halus bagian atas dan mudah didistribusikan ke berbagai jaringan tubuh kecuali otak dan cairan serebrospinal. Antibiotik ini dimetabolisme dan diekskresikan sebagian besar dalam empedu. Sebagian besar dari obat ini akan terikut dalam feses meskipun penyerapan usus terjadi (Setiabudy 2003; Giguère 2006).
Menurut Giguère (2006), eritromisin merupakan obat pilihan untuk pencegahan dan pengobatan diare akibat infeksi C. jejuni. Pada unggas, antibiotik ini juga dapat ditambahkan ke dalam air minum untuk pengobatan dan pencegahan infeksi staphylococcal atau streptococcal, dermatitis nekrosa,
infectious coryza, dan infeksi M. gallisepticum.
Kloramfenikol
Kloramfenikol bekerja dengan menghambat pembentukan protein mikroba. Obat ini berikatan secara irreversibel dengan reseptor pada ribososom sub unit 50S dan menghambat enzim peptidil transferase, sehingga pembentukan ikatan-ikatan peptida pada proses sintesis protein mikroba tidak terjadi. Kloramfenikol umumnya bersifat bakteriostatik, namun pada konsentrasi tinggi obat ini dapat bersifat bakterisidal terhadap mikroba-mikroba tertentu (Setiabudy & Kunardi 2003; Dowling 2006).
Pada hewan monogastrik, kloramfenikol dapat diserap baik oleh saluran pencernaan. Obat ini didistribusikan secara baik ke berbagai jaringan tubuh, termasuk jaringan otak, cairan serebrospinal, dan mata (Setiabudy & Kunardi 2003; Brumbaugh et al. 1983 diacu dalam Dowling 2006). Masa paruh eliminasi kloramfenikol bervariasi antar spesies. Eliminasi terutama oleh metabolisme hati melalui konjugasi dengan asam glukuronat. Metabolit yang tidak aktif akan diekskresikan melalui urin (Dowling 2006).
Menurut Hofacre (2006), kloramfenikol memiliki potensi untuk menimbulkan anemia aplastik pada manusia. Pada dosis tertentu kloramfenikol dapat menghambat sintesis protein mitokondria sel-sel sumsum tulang mamalia sehingga menimbulkan gangguan pada sistem hemopoetik. Hal tersebut mengakibatkan pelarangan penggunaan kloramfenikol pada hewan konsumsi di sebagian besar negara.
Penggunaan Antibiotik pada Peternakan Ayam
Pada suatu industri unggas komersial, pencegahan penyakit merupakan fokus utama bagi seorang dokter hewan. Ketika prosedur biosekuriti gagal untuk mencegah masuknya suatu agen penyakit, maka penggunaan antibiotik merupakan salah satu usaha yang dapat dilakukan untuk menekan kerugian ekonomi. Beberapa hal yang harus diperhatikan dalam penggunakan antibiotik pada peternakan ayam diantaranya, pemilihan obat yang sesuai dengan aturan, cara pemberian obat yang tepat, dan waktu henti obat (withdrawal time) dalam produk ternak.
pertumbuhan. Antibiotik pemacu pertumbuhan dapat diberikan melalui pakan. Penggunaan antibiotik sebagai pemacu pertumbuhan pada kebanyakan negara tidak diperbolehkan karena dapat menimbulkan resistensi berbagai jenis mikroba terhadap antibiotik.
Infeksi bakteri pada ayam cenderung berjalan dengan cepat dan dalam waktu singkat dapat menimbulkan kematian. Selain itu, berbagai jenis penyakit pada ayam dapat terjadi tanpa menimbulkan gejala klinis. Seorang dokter hewan harus mampu melihat tanda atau perubahan yang terjadi dalam kelompok ternak sedini mungkin agar kerugian ekonomi akibat suatu penyakit dapat ditekan.
Penggunaan Antibiotik pada Kejadian Campylobacteriosis di Ayam
Penularan C. jejuni melalui makanan dapat dikontrol melalui proses sanitasi yang baik. Pengolahan pangan yang tepat mulai dari proses pemotongan diharapkan mampu mengurangi kejadian campylobacteriosis pada manusia. Pencegahan campylobacteriosis pada manusia juga dapat dilakukan dengan pemberian antibiotik pada ayam. Sebagian besar Campylobacter sp. rentan
terhadap antibiotik, diantaranya eritromisin (Songer & Post 2005; Roasto et al. 2007).
Pada suatu kajian mengenai resistensi C. jejuni terhadap beberapa antibiotik di Norwegia, diketahui bahwa C. jejuni rentan terhadap antibiotik golongan quinolone, yaitu eritromisin, gentamisin, enrofloksasin, dan asam nalidiksat. Sedangkan pada oksitetrasiklin dan ampisilin diketahui tingkat resistensi C. jejuni
masing-masing sebesar 1.3% dan 4% (Norstrom et al. 2007).
Sebuah hasil penelitian di Kanada pada tahun 2005 menunjukkan bahwa, persentase resistensi C. jejuni pada beberapa antibiotik berbeda-beda. Resistensi
C. jejuni terhadap ampisilin sebesar 14.3%; asitromisin 17.9%; kloramfenikol 0%; siprofloksasin 3.7%; klindamisin2.3%; eritromisin6.7%; gentamisin 0.2%; asam nalidiksat 5.1%; streptomisin 13.6%; dan tetrasiklin 52.6% (Larkin et al. 2006). Tingkat resistensi C. jejuni terhadap antibiotik dari berbagai wilayah berbeda-beda. Hal ini berkaitan dengan jenis strain dari isolat C. jejuni dan tingkat penggunaan suatu antibiotik pada wilayah tersebut.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Mei 2011-Januari 2012. Penelitian dilakukan di Laboratorium Kesehatan Masyarakat Veteriner, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, dan Laboratorium Lapangan Terpadu Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Sampel dan Hewan Percobaan
Sampel berupa usus ayam broiler yang diambil dari bagian duodenum sampai yeyunum. Penelitian ini menggunakan ayam broiler bangsa Cobb berumur satu hari sebanyak 17 ekor yang dipelihara selama 17 hari. Ayam dibagi menjadi empat kelompok percobaan, yaitu:
A. 5 ekor kontrol negatif, ayam tidak diinfeksi C. jejuni tanpa pengobatan antibiotik;
B. 4 ekor kontrol positif, ayam diinfeksi C. jejuni tanpa pengobatan antibiotik;
C. 4 ekor ayam diinfeksi C. jejuni dan diobati dengan eritromisin; D. 4 ekor ayam diinfeksi C. jejuni dan diobati dengan kloramfenikol.
Alat dan Bahan
Bahan yang digunakan untuk isolasi C. jejuni terdiri media Nutrient Broth
No. 2 (Oxoid CM00678), Buffered Pepton Water (Pronadisa 1402.00), Preston,
Growth Supplement (Oxoid SR0232E), Charcoal Cefaphorazone Deoxychilate AgarSelective Supplement (Oxoid SR0155E), dan Campygen. Untuk identifikasi
C. jejuni diperlukan alkohol 70%, akuades steril, pewarna carbol fuchsin, dan minyak emersi. Sedangkan untuk penghitungan jumlah koliform digunakan media
Violet Red Bile Agar (Pronadisa 0102.00).
Peralatan yang digunakan untuk pemeliharaan ayam antara lain, kandang unggas, tempat pakan, tempat minum, dan alat pemanas.
Metode Penelitian
Penelitian ini terdiri dari beberapa tahap, yaitu tahap pemeliharaan ayam broiler, infeksi C. jejuni, pengobatan, dan penghitungan jumlah Campylobacter
spp. dan koliform.
Pemeliharaan Ayam Broiler
Sebanyak 17 ekor ayam broiler dipelihara selama 17 hari. Waktu pemeliharaan yang dibutuhkan sejak ayam berumur 1 hari sampai tahap pengobatan selesai adalah 17 hari. Tahap pemeliharaan terdiri dari pemberian pakan, vaksinasi ND dan IB, pemberian air minum dan vitamin, serta pembersihan kandang dan peralatan kandang lainnya.
Infeksi Isolat Campylobacter jejuni
Sebanyak 0.5 ml suspensi C. jejuni dengan konsentrasi 104 cfu/ml (dosis infektif) dicekokkan (oral) ke ayam pada hari ke-9 pemeliharaan (Pisestyani 2010). Pada ayam umur 9 hari, titer maternal antibodi telah menurun, sehingga rentan terhadap infeksi C. jejuni (Sahin et al. 2003a). Isolat C. jejuni adalah isolat lapang yang berasal dari Kudus (Andriani 2012).
Pengobatan dengan Menggunakan EritromisindanKloramfenikol
Penghitungan Jumlah Campylobacter jejuni dan Koliform
Penghitungan jumlah C. jejuni dan koliform dilakukan sebanyak 3 kali, yaitu sebelum diinfeksi C. jejuni (ayam umur 1 hari), pasca infeksi (ayam umur 12 hari), dan pasca pengobatan (ayam umur 17 hari).
Penghitungan Jumlah Campylobacter jejuni (Review and Methods for New Zaeland Laboratories tahun 2003)
Penghitungan C. jejuni terdiri dari beberapa tahapan, yaitu pre enrichment,
selective enrichment, dan identifikasi dengan pewarnaan. Jumlah C. jejuni
dihitung menggunakan metode most probable number (MPN) tiga tabung dengan tiga tingkat pengenceran.
Tahap pre-enrichment. Usus sebanyak 1 g dibuka dengan menggunakan gunting dan dimasukkan ke dalam kantong plastik steril. Pada pengenceran 10-1, 9 ml BPW 0.1% dimasukkan ke dalam sampel kemudian dihancurkan menggunakan stomacher. Pengenceran 10-2, sebanyak 1 ml larutan 10-1 dimasukkan ke dalam 9 ml BPW 0.1% kemudian dihomogenkan. Begitu pula untuk pengenceran 10-3. Setiap tingkat pengenceran diinokulasi ke dalam tiga tabung media Nutrient Broth 2 dan selanjutnya diinkubasi selama 48 jam pada suhu 42 C dalam kondisi mikroaerofilik.
Tahap enrichment. Setelah diinkubasi, sebanyak satu ose pupukan diinokulasikan pada media CCDA kemudian diinkubasi pada suhu 42C dalam kondisi mikroaerofilik selama 24-48 jam.
Pewarnaan C. jejuni. Pewarnaan dilakukan untuk melihat morfologi bakteri dengan menggunakan pewarna carbol fuchsin. Sebanyak 1-2 loop akuades steril diletakkan di atas gelas objek, kemudian ditambahkan koloni yang diduga
C. jejuni. Koloni diratakan, dikeringkan, dan difiksasi di atas api. Selanjutnya ditetesi dengan pewarna carbol fuchsin, didiamkan selama satu menit, kemudian dibilas dengan akuades dan dikeringkan. Preparat ditetesi minyak emersi dan diamati di bawah mikroskop dengan pembesaran 10x100.
Penghitungan metode MPN. Penghitungan C. jejuni dilakukan dengan menggunakan metode MPN, yaitu:
Penghitungan Jumlah Koliform (Compendium of Methods for the Microbiological Examination of Foods tahun 2003)
Penghitungan jumlah koliform dilakukan pada tiga tingkat pengenceran terakhir dari setiap sampel. Hasil pengenceran sampel dimasukkan ke dalam cawan Petri. Sebanyak 10-15 ml media VRBA dituang ke dalam masing-masing cawan Petri dan dihomogenkan dengan cara digeser membentuk angka 8 supaya media merata ke seluruh permukaan, kemudian didiamkan hingga memadat. Setelah memadat, dilakukan proses overlay dengan cara menuang kembali media VRBA di atas permukaan sampai menutupi permukaan dan dibiarkan memadat kembali. Selanjutnya pupukan diinkubasi pada suhu 37C selama 24-48 jam.
Koloni koliform yang dihitung memiliki ciri-ciri berwarna merah ungu dengan diameter 0.5 mm atau lebih. Penghitungan koloni koliform dilakukan dengan metode hitungan cawan.
Jumlah mikroba = jumlah koloni x faktor pengenceran Faktor pengenceran =
T
Analisis Data
HASIL DAN PEMBAHASAN
Jumlah Campylobacter spp. pada Ayam Umur Satu Hari
Penghitungan jumlahCampylobacter spp. pada ayam dilakukan dengan metode most probable number (MPN). Metode ini digunakan jika bakteri yang akan dihitung dalam jumlah sedikit atau terbatas (< 10 cfu/g atau cfu/ml). Metode MPN menggunakan penghitungan estimasi jumlah bakteri dengan memupuk suatu tingkat pengenceran ke dalam tiga atau lima tabung berisi media cair. Hasil penghitungan rataan jumlahCampylobacter spp. pada ayam umur 1 hari disajikan pada Tabel 1.
Tabel 1 Rataan jumlah Campylobacter spp. pada ayam umur 1 hari
(sebelum diinfeksi)
Sampel
Rataan+ simpangan baku 2.0+ 0.57
Dari penelitian ini diperoleh rataan jumlah Campylobacter spp. pada ayamumur 1 hariadalah 2.0 + 0.57 MPN/g.Jumlah ini tergolong rendah, karenaCampylobacter spp. hidup secara alami dalam saluran pencernaan ayam. Pada ayamumur 1 hari,Campylobacter spp. jarangditemukan karena penularan
Campylobacter spp. secara vertikal sangat jarang terjadi. Selain itu, ayam umur 1 hari memiliki maternal antibodi yang dapat melindungi ayam dari infeksi berbagai agen penyakit termasuk infeksi olehCampylobacter spp. (Sahin et al.2003a).
Jumlah Campylobacter spp. pada Ayam setelahDiinfeksi oleh
Campylobacter jejuni
Tahap penginfeksian C. jejuni pada ayam dilakukan pada hari ke-9 pemeliharaan. Pada umur ini titer maternal antibodi telah menurun, sehingga ayam rentan terhadap infeksi C. jejuni (Sahin et al. 2003a).Penghitungan rataan jumlah Campylobacter spp. pada ayam setelah diinfeksi oleh C. jejunidilakukan pada hari ketiga setelah infeksi, yaitu pada ayam umur 12 hari. Hasil penghitungan disajikan pada Tabel 2.
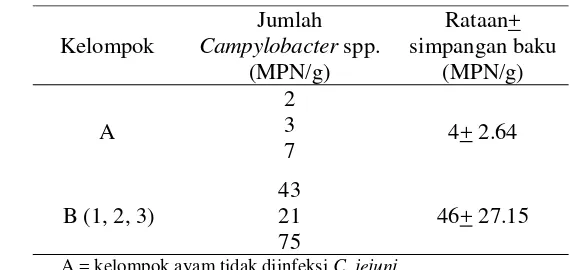
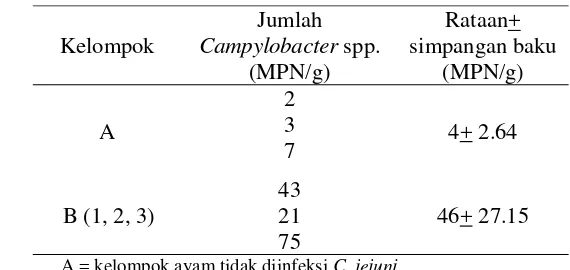
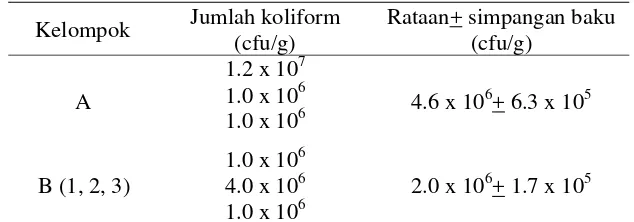
Tabel 2 Rataan jumlah Campylobacter spp. pada ayam setelah diinfeksi oleh C. jejuni (ayam umur 12 hari)
A = kelompok ayam tidak diinfeksi C. jejuni B = (1, 2, 3) kelompok ayam diinfeksi C. jejuni
Secara deskriptif, jumlah Campylobacter spp. pada kelompok yang diinfeksi (B) lebih besar dibanding kelompok yang tidak diinfeksi (A).Hasil ini menunjukkan bahwa jumlah Campylobacter spp. akan mengalami peningkatan pada saat terjadi infeksi. Kemampuan bakteri dalam menimbulkan penyakit tidak hanya bergantung dari jumlah bakteri yang menginvasif. Menurut Supardi dan Sukanto (1999), bakteri dapat menginfeksi dan menimbulkan penyakit tergantung dari daya patogenitas, virulensi, daya invasif, dan daya pertahanan bakteri terhadap sel-sel fagosit di dalam tubuh.
terjadi karena adanya gangguan di daerah lumen intestinal. Kejadian ini juga dapat diikuti oleh kejadian diare berdarah akibat enteritis hemoragi yang ditimbulkan oleh infeksi Campylobacter spp. Pada anak ayam, infeksi
Campylobacter spp. dapat terjadi tanpa menunjukkan tanda-tanda klinis dan perubahan patologis. Hal ini menyebabkan sulitnya mendiagnosa dan melakukan pencegahan terhadap infeksi yang disebabkan oleh bakteri ini di tingkat peternakan (Shane & Stern 2003; Dhillon et al. 2006).
Jumlah Campylobacter spp. pada Ayam setelah Pengobatan Menggunakan Eritromisin dan Kloramfenikol
Pengobatan ayam menggunakan eritromisin dan kloramfenikol mulai dilakukan pada ayam umur 12 hari (hari ke-3 setelah infeksi). Menurut Pisestyani (2010), masa inkubasi C. jejuni berlangsung selama 3-7 hari sehingga gejala klinis dapat terlihat pada hari tersebut. Untuk mengurangi kerugian akibat infeksi
Campylobacter spp., maka pengobatan dilakukan pada hari ke-3 setelah infeksi selama 5 hari berturut-turut sesuai dengan aturan penggunaan minimal antimikroba. Penghitungan rataan jumlah Campylobacter spp. pada ayam setelah dilakukan pengobatan dilakukan pada satu hari setelah pengobatan terakhir berlangsung, yaitu pada ayam umur 17 hari. Hasil penghitungan disajikan pada Tabel 3.
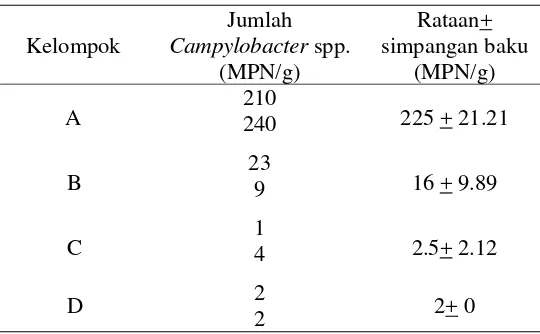
Tabel 3 Rataan jumlah Campylobacter spp. pada ayam setelah pengobatan menggunakan eritromisin dan kloramfenikol (ayam umur 17 hari)
Hasil penghitungan jumlah Campylobacter spp. setelah pengobatan menggunakan eritromisin dan kloramfenikol menunjukkan hasil yang tidak berbeda. Jika dibandingkan dengan kelompok kontrol positif (B), jumlah
Campylobacter spp. memperlihatkan hasil yang lebih tinggi dibanding kelompok C dan D. Kelompok ini merupakan kelompok dengan infeksi Campylobacter spp. tanpa dilakukan pengobatan. Hasil ini menunjukkan bahwa pemberian antimikroba memiliki efek dalam menekan jumlah pertumbuhan Campylobacter
spp.
Dari hasil penelitian ini, dapat dilihat bahwa eritromisin (C) efektif dalam menekan pertumbuhan Campylobacter spp. Eritromisin bersifat bakterisidal terhadap Campylobacter spp. Antimikroba ini merupakan obat pilihan untuk pengobatan diare akibat infeksi Campylobacter spp. Pada unggas, selain untuk infeksiCampylobacterspp., eritromisin juga digunakan untuk pencegahan dan pengobatan infeksi staphylococcal atau streptococcal, dermatitits nekrosa,
infectious coryza, dan infeksi Mycoplasma gallisepticum (Giguère 2006).
Food and Drug Administration (FDA) menetapkan waktu henti obat (withdrawal time) eritromisin pada unggas yang diberikan secara per oral adalah 5 hari. Waktu henti obat merupakan jangka waktu yang diperlukan oleh tubuh hewan untuk menurunkan kadar residu obat sampai di bawah batas maksimum residu (BMR). Hewan tidak boleh dipotong sebelum waktu henti obat tersebut terpenuhi (Murtidjo 2003). Oleh karena itu, pemotongan unggas yang telah diobati oleh eritromisin dapat dilakukan 5 hari setelah pengobatan terakhir dilakukan.
Aturan penggunaan obat hewan di Indonesia dilakukan berdasarkan Peraturan Pemerintah No. 78 tahun 1992. Peraturan tersebut menetapkan pelarangan penggunaan kloramfenikol sebagai antibiotik pada unggas dan hewan ternak lainnya. Hal ini terkait dengan penggunaan kloramfenikol pada manusia.Selainitu, antibiotik ini memiliki potensi untuk menimbulkan anemia aplastik pada manusia. Pada dosis tertentu kloramfenikol dapat menghambat sintesis protein mitokondria sel-sel sumsum tulang mamalia sehingga menimbulkan gangguan pada sistem hemopoetik. Oleh karena itu, penetapan waktu henti obat dan batas aman residu kloramfenikol tidak ditetapkan (FDA 1997; Hofacre 2006).
Penyebaran Campylobacter spp. pada peternakan ayam umumnya terjadi secara horizontal. Hal ini dapat terlihat pada kelompok kontrol negatif(A) yang menunjukkan hasil yang lebih tinggi dibanding kelompok lainnya yaitu sebesar 225 + 21.21 MPN/g. Penyebaran Campylobacter spp. secara horizontal dapat melalui perantara serangga. Lalat dan kumbang merupakan vektor yang dapat menyebarkan Campylobacter spp. pada peternakan ayam (Jacob 1995 diacu dalam Shane & Stern 2003). Menurut Shane dan Stern (2003), rodensia merupakan salah satu reservoar dari Campylobacter spp. Penularan
Campylobacter spp. pada peternakan ayam dapat melalui kotoran tikus yang mengontaminasi air, pakan, dan sekam. Selain itu, kontaminasi silang antar kandang juga dapat terjadi melalui kontaminasi udara dan debu. Hal ini menunjukkan bahwa kontaminasi lingkungan di sekitar peternakan memegang peranan penting pada penyebaran bakteri Campylobacter spp.
Jumlah Koliform pada Ayam Umur Satu Hari
Tabel 4Rataan jumlah koliform pada ayam umur 1 hari Sampel Jumlah koliform
(cfu/g)
Ayam 1 3.2 x 107
Ayam 2 2.5 x 107
Ayam 3 2.8 x 107
Rataan+ simpangan baku 2.8 x 107+ 3.5 x 106
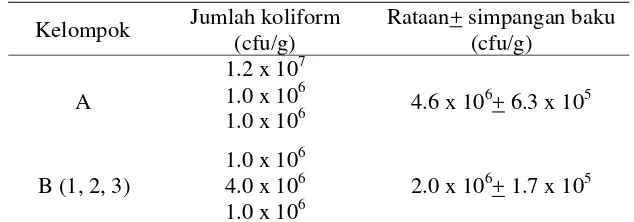
Hasil penghitungan jumlah koliform pada ayam umur1 hari menunjukkan bahwa rataan jumlah koliform pada usus halus ayam adalah 2.8 x 107+ 3.5 x 106 cfu/g. Menurut Bolder (1998), jumlah koliform pada usus halus ayam umur 1 hari dapat mencapai107-109 cfu/g. Selain koliform, bakteri lain yang banyak ditemukan pada ayam umur 1 hari adalah Streptococcus dan Clostridium.
Koliform merupakan mikroflora normal yang terdapat pada saluran pencernaan ayam. Kelompok ini kebanyakan terdiri dari Eschericia coli, beberapa jenis Kleibsiella, Enterobacter spp., dan Citobacter (Ray & Bhunia 2008). Umumnya E. coli bersifat komensal pada saluran pencernaan ayam, namun beberapa strain E. coli juga bersifat patogen (Mead 2007). Secara komensal, mikroflora ini dapat melindungi tubuh dari infeksi mikroorganisme patogen dalam saluran pencernaan (Flint et al. 2006).
Jumlah Koliform pada Ayam setelahDiinfeksi oleh Campylobacter jejuni
Keberadaan bakteri koliform pada saluran pencernaan ayam dapat mengalami penurunan akibat pertumbuhan bakteri patogen, salah satunya
Tabel 5 Rataan jumlah koliform pada ayam setelahdiinfeksi C. jejuni
(ayam umur 12 hari)
Kelompok Jumlah koliform (cfu/g) A = kelompok ayam tidak diinfeksi C. jejuni B (1, 2, 3) = kelompok ayam diinfeksi C. jejuni
Rataan jumlah koliform pada kontrol positif (B) setelah diinfeksi oleh C. jejunilebih rendahdibanding kontrol negatif (A). Secara normal, Campylobacter
spp.dapat hidup pada saluran pencernaan bersama dengan mikroflora lainnya. Namun pada saat terjadi campylobacteriosis, jumlah Campylobacter spp. akan meningkat dari kondisi normal sehingga terjadi kompetisi antara Campylobacter
spp. dan mikroflora lain, misalnya bakteri koliform. Kompetisi dapat terjadi pada saat melakukan kolonisasi di mukosa usus atau pada saat memperoleh nutrisi untuk pertumbuhan. Beberapa unsur nutrisi memiliki jumlah yang terbatas pada jaringan saluran pencernaan, diantaranya zat besi dan asam amino. Keterbatasan ini mengakibatkan adanya kompetisi untuk memperoleh nutrisi agar bakteri tersebut dapat bertahan hidup dalam saluran pencernaan (Donoghue et al. 2006).
Jumlah Koliform pada Ayam setelah Pengobatan Menggunakan Eritromisin dan Kloramfenikol
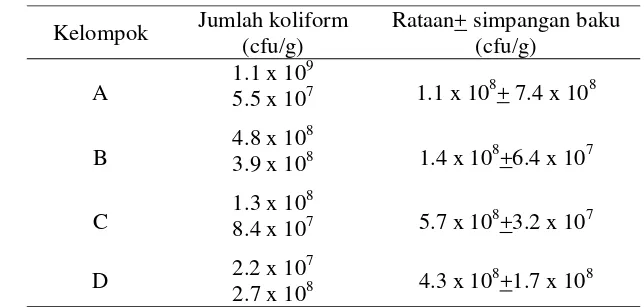
Eritromisin merupakan antimikroba yang memiliki aktivitas terhadap bakteri Gram positif dan beberapa bakteri Gram negatif, sedangkan kloramfenikol merupakan antimikroba yang memiliki spektrum luas terhadap berbagai jenis bakteri.Jumlah koliform pada ayam setelah dilakukan pengobatan oleh eritromisin dan kloramfenikol disajikan pada Tabel 6.
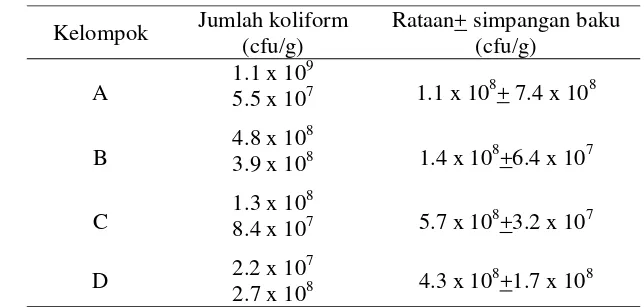
Tabel 6 Rataan jumlah koliform pada ayam setelah pengobatan menggunakan eritromisin dan kloramfenikol (ayam umur 17 hari)
Kelompok Jumlah koliform (cfu/g)
Perbandingan rataan jumlah koliform pada ayam setelah dilakukan pengobatan menggunakan eritromisin dan kloramfenikol menunjukkan hasil yang hampir sama diantara setiap kelompok perlakuan. Hal ini terjadi kemungkinan akibat kurang efektifnya kedua antimikroba tersebut terhadap bakteri koliform.
Dari hasil penelitian ini, penggunaan eritromisin untuk menekan pertumbuhan bakteri koliform tidak efektif. Antimikroba ini diketahui tidak efektif terhadap kebanyakan bakteri Gram negatif. Pada bakteri jenis
SIMPULAN DAN SARAN
Simpulan
Dari hasil penelitian ini dapat disimpulkan bahwa:
1. Jumlah Campylobacter spp. pada saluran pencernaan ayam umur satu hari adalah 2.0 + 0.57 MPN/g, sedangkan jumlah koliform adalah 2.8 x 107+3.5 x 106 cfu/g.
2. Jumlah Campylobacter spp. pada saluran pencernaan ayam setelah diinfeksi oleh C. jejuni mengalami peningkatan, sebesar 46 + 27.15 MPN/g, sedangkan jumlah koliform mengalami penurunan, 2.0 x 106+ 1.7 x 105 cfu/g.
3. Jumlah Campylobacter spp. pada saluran pencernaan ayam yang diinfeksi C. jejuni dan setelah dilakukan pengobatan menggunakan eritromisin mengalami penurunan, yaitu sebanyak 2.5 + 2.12 MPN/gdan setelah pengobatan menggunakan kloramfenikol adalah 2.0+0 MPN/g, sedangkan jumlah koliform mengalami peningkatan, masing-masing sebanyak 5.7 x 108 + 3.2 x 107 cfu/g dan4.3 x 108+ 1.7 x 108 cfu/g.
4. Eritromisin dengan dosis 40 µg/ml atau kloramfenikol dengan dosis 5 µg/ml efektif untuk mengurangi jumlah Campylobacter spp. pada saluran pencernaan ayam.
Saran
Berdasarkan penelitian ini, dapat disarankan beberapa hal terkait pengendalian campylobacteriosis pada peternakan ayam, diantaranya:
1. Percobaan dengan jumlah sampel yang lebih besar dan antibiotik yang lebih beragam dengan tingkat dosis yang berbeda-beda.
2. Penghitungan ekonomi untuk mengetahui kerugian ekonomi akibat campylobacteriosis dan keuntungan yang diperoleh apabila dilakukan pengobatan dan pengendalian.
Pertumbuhan Lactobacillus sp. dapat menurunkan jumlah koliform pada usus halus karena bakteri ini mampu menghasilkan asam laktat dan hidrogen peroksida. Senyawa tersebut diketahui mampu menghambat atau menyebabkan hilangnya aktivitas bakteri koliform pada usus halus (Liviana 1998).
Infeksi Campylobacter sp. biasa terjadi pada peternakan ayam broiler umur 2-3 minggu. Kejadian ini berkaitan dengan penurunan maternal antibodi pada ayam (Sahin et al. 2003).
DAFTAR PUSTAKA
Adams MR, Moss MO. 2008. Bacterial agents of foodborne illness. Food Microbiology. Ed ke-3. Cambridge: RSC Publ. hlm 192-195.
Ang CW, de Klerk MA, Endtz HP, Jacobs BC, Laman JD, van der Meche´ FGA, Van Doorn PA. 2001. Guillain-Barre´ syndrome- and Miller fisher syndrome-associated Campylobacter jejuni lipopolysaccharides induce anti-GM1 and anti-GQ1b antibodies in rabbits. J inf and immun 69(4): 2462– 2469.
Bolder NM. 1998. The microbiology of the slaughter and processing of poultry. Di dalam: Davies A, Board R, editor. The Microbiology of Meat and Poultry. London: Blackie Academic. hlm 160.
[CDC] Centre for Disease Control and Prevention. 2011a.
Pathogen-Campylobacter jejuni. [terhubung berkala]. http://www.cdc.gov/pulsenet/pathogens_pages. [12 September 2011].
[CDC] Centre for Disease Control and Prevention. 2011b. Investigation update: Outbreak of Shiga toxin-producing E. coli O104 (STEC O104:H4) infections associated with travel to Germany. [terhubung berkala]. http://www.cdc.gov/ecoli/2011/ecolio104/. [9 Juni 2012].
Corry JEL, Atabay HI. 2001. Poultry as a source of Campylobacter and related organisms. J Appl Microbiol 90: 96S-114S.
Cox NA, Richardson LJ, Musgrove MT. 2010. Campylobacter jejuni and other Campylobacters. Di dalam: Juneja VK, Sofos JN, editor. Pathogens and Toxins in Foods: Challenges and Interventions. Washington DC: ASM Pr. hlm 20-22.
Debruyne L, Gevers D, Vandamme P. 2008. Taxonomy of the family Campylobacteraceae. Di dalam: Nachamkin I, Szymanski CM, Blaser MJ, editor. Campylobacter. Ed ke-3. Washington DC: ASM Pr. hlm 3-26.
Dhillon AS, Shivaprasad HL, Schaberg D, Wier F, Weber S, Bandli D. 2006.
Campylobacter jejuni infection in broiler chickens. Avian Dis 50(1): 55-58. Donnison A. 2003. Isolation of thermotolerant Campylobacter: Review and
methods for New Zaeland Laboratories. Report prepared for ministry of health. New Zaeland.
Dowling PM. 2006. Chloramphenicol, Thiamphenicol, and Florfenicol. Di dalam Giguère S et al., editor. Antimicrobial Therapy in Veterinary Medicine. Ed ke-4. Victoria: Blackwell Publ. hlm 241-245.
Fauzi RPS. 2012. Resistensi Campylobacter jejuni isolat lokal secara in vitro dan
in vivo terhadap lima jenis antimikroba. [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Fernandes R. 2009. Pathogen profiles. Di dalam: Fernandes R, editor.
Microbiology Handbook Meat Products. Cambridge: Leatherhead Publ. hlm 263.
[FDA] Food and Drug Administration. 1997. Animal drug. [terhubung berkala]. http://www.accessdata.fda.gov/scripts/animaldrugsatfda. [25 Juni 2012].
Flint HJ, Leitch ECM, Duncan SH, Walker AW, Patterson AJ, Rincon MT, Scott KP, Louis P. 2006. Molecular approaches to the analysis of gastrointestinal microbial ecosystems. Di dalam: Perry GC, editor. Avian Gut Function in Health and Disease. London: CABI.
Giguère S. 2006. Macrolides, Azalides, and Ketolides. Di dalam: Giguère S et al., editor. Antimicrobial Therapy in Veterinary Medicine. Ed ke-4. Victoria, Australia: Blackwell Publ. hlm 193-195.
Hofacre CL. 2006. Antimicrobial drug use in poultry. Di dalam: Giguère S et al., editor. Antimicrobial Therapy in Veterinary Medicine. Ed ke-4. Victoria, Australia: Blackwell Publ. hlm 548-549.
Ismail ZSH. 2011. Effects of dietary black cumin growth seeds (Nigella sativa l.) or its extract on performance and total coliform bacteria count on broiler chicks. Egypt: Animal Production Department, Faculty of Agriculture, South Valley University.
Jafari RA, Fazlara A, Govahi M. 2006. An investigation into Salmonella and fecal coliform contamination of drinking water in broiler farms in Iran. Int J of Poult Sci 5(5): 491-493.
Kee JL, Hayes ER. 1996. Farmakologi Pendekatan Proses Perawatan. Jakarta: Penerbit Buku Kedokteran EGC. hlm 324.
[Kementan RI] Kementerian Pertanian Republik Indonesia. Peraturan Pemerintah Republik Indonesia Nomor 78 Tahun 1992 tentang Obat Hewan. Jakarta: Kementan; 1992.
Kornacki JL, Johnson JL. 2003. Enterobacteriaceae, coliforms, and Eschericia coli as quality and safety indicators. Di dalam: Downes FP, Ito K, editor.
Lee MD, Newell DG. 2006. Campylobacter in poultry: filling an ecological niche.
Avian Dis 50(1): 1-9.
McMurry SW, Coyne MS, Perfect E. 1998. Fecal coliform transport through intact soil blocks amended with poultry manure. J Environ 27: 86-92.
Mead GJ. 2007. Faecal indicator organisms for red meat and poultry. Di dalam Mead GJ, editor. Microbiological Analysis of Red Meat, Poultry and Eggs. Cambridge: Woodhead Publ. hlm 84-100.
Murtidjo BA. 2003. Pemotongan, Penanganan, dan Pengolahan Daging Ayam. Yogyakarta: Penerbit Kanisius. hlm 20.
Ogden DI. 2007. Escherichia coli O157 and other VTEC in the meat industry. Di dalam Mead GJ, editor. Microbiological Analysis of Red Meat, Poultry and Eggs. Cambridge: Woodhead Publ. hlm 55-83.
[OIE] Office International des Epizooties. 2009. Enterohemorrhagic Escherichia coli infections. [terhubung berkala]. http://www.oie.int. [25 Juni 2012]. Pearson AD, Greenwood M, Healing TD, Rollins D, Shahamat M, Donaldson J,
Colwell5 RR. 1993. Colonization of broiler chickens by waterborne
Campylobacter jejuni. J Appl and Environ Microbiol 59(4): 987-996. Pisestyani H. 2010. Isolasi dan identifikasi Campylobacter jejuni menggunakan
metode konvensional dan molekuler serta mekanisme patogenesis pada saluran pencernaan ayam broiler. [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Ray B, Bhunia A. 2008. Indikator of bacterial pathogens. Fundamental Food Microbiology. Ed ke-4. New York: CRD Pr. hlm 350-351.
Rizki F. 2003. Jumlah bakteri Salmonella sp. dalam sekum ayam yang diberi probiotik Bacillus apiarius dan Bacillus coagulans dan diinfeksi Salmonella typhimurium. [skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Sahin O, Luo N, Huang S, Zhang Q. 2003a. Effect of Campylobacter-specific maternal antibodies on Campylobacter jejuni colonization in young chickens. J Appl Microbiol 69(9): 5372–5379.
Sahin O, Kobalka P, Zhang Q. 2003b. Detection and survival of Campylobacter in chicken eggs. J Appl Microbiol 95: 1070–1079.
Sampel Tingkat pengenceran Nilai positif yang dilaporkan
Estimasi MPN/gr 10-1 10-2 10-3
Ayam 1 0/3 0/3 0/3 0-0-0 <3
Ayam 2 0/3 0/3 0/3 0-0-0 <3
Ayam 3 0/3 0/3 0/3 0-0-0 <3
Hasil penghitungan MPN Campylobacter spp. pada ayam setelah diinfeksi oleh
C. jejuni (ayam umur 12 hari)
Kelompok Tingkat pengenceran Nilai positif yang dilaporkan
Estimasi MPN/gr 10-1 10-2 10-3
A/1 0/3 0/3 0/3 0-0-0 2
A/2 0/3 0/3 1/3 0-0-1 3
A/3 1/3 0/3 1/3 1-0-1 7
B/1 3/3 1/3 0/3 3-1-0 43
B/2 2/3 2/3 0/3 2-2-0 21
B/3 3/3 1/3 1/3 3-1-1 75
K/1 2/3 2/3 2/3 2-2-2 35
K/2 2/3 1/3 1/3 2-1-1 20
K/3 2/3 1/3 2/3 2-1-2 27
Keterangan: A = kontrol negatif, ayam tidak diinfeksi C. jejuni
B = kontrol positif, ayam diinfeksi C. jejuni tanpa pengobatan antibiotik (isolat Demak)
Kelompok Tingkat pengenceran Nilai positif
B = kontrol positif, ayam diinfeksi C. jejuni tanpa pengobatan antibiotik (isolat Demak)
C = ayam diinfeksi C. jejuni (isolat Demak) dengan pengobatan menggunakan eritromisin
D = ayam diinfeksi C. jejuni (isolat Demak) dengan pengobatan menggunakan kloramfenikol
K = kontrol positif, ayam diinfeksi C. jejuni tanpa pengobatan antibiotik (isolat Kudus)
K/ER = ayam diinfeksi C. jejuni (isolat Kudus) dengan pengobatan menggunakan eritromisin
Ayam 1 3.2 x 107
Ayam 2 2.5 x 107
Ayam 3 2.8 x 107
Hasil penghitungan jumlah koliform pada ayam setelah diinfeksi oleh C. jejuni
(ayam umur 12 hari)
Kelompok Jumlah mikroorganisme (cfu/g)
A/1 1.0 x 106
A/2 4.0 x 106
A/3 1.0 x 106
B/1 1.2 x 107
B/2 1.0 x 106
B/3 1.0 x 106
K/1 3.2 x 106
K/2 1.0 x 107
K/3 1.7 x 106
Keterangan: A = kontrol negatif, ayam tidak diinfeksi C. jejuni
B = kontrol positif, ayam diinfeksi C. jejuni tanpa pengobatan antibiotik (isolat Demak)
Kelompok Jumlah mikroorganisme (cfu/g)
A/1 1.1 x 109
A/2 5.5 x 107
B/1 4.8 x 108
B/2 3.9 x 108
C/1 1.3 x 108
C/2 8.4 x 107
D/1 2.2 x 107
D/2 2.7 x 108
K/1 3.5 x 108
K/2 1.0 x 108
K/ER1 8.4 x 107
K/ER2 4.2 x 106
K/CL1 2.2 x 107
K/CL1 6.2 x 107
Keterangan: A = kontrol negatif, ayam tidak diinfeksi C. jejuni
B = kontrol positif, ayam diinfeksi C. jejuni tanpa pengobatan antibiotik (isolat Demak)
C = ayam diinfeksi C. jejuni (isolat Demak) dengan pengobatan menggunakan eritromisin
D = ayam diinfeksi C. jejuni (isolat Demak) dengan pengobatan menggunakan kloramfenikol
K = kontrol positif, ayam diinfeksi C. jejuni tanpa pengobatan antibiotik (isolat Kudus)
K/ER = ayam diinfeksi C. jejuni (isolat Kudus) dengan pengobatan menggunakan eritromisin
Setiabudy R. 2003. Antimikroba lain. Di dalam: Ganiswarna SG, editor.
Farmakologi dan Terapan. Ed ke-4. Jakarta: Gaya Baru. hlm 675-677. Setiabudy R, Gan VHS. 2003. Pengantar antimikroba. Di dalam: Ganiswarna SG,
editor. Farmakologi dan Terapan. Ed ke-4. Jakarta: Gaya Baru. hlm 571-572.
Setiabudy R, Kunardi L. 2003. Golongan tetrasiklin dan kloramfenikol. Di dalam: Ganiswarna SG, editor. Farmakologi dan Terapan. Ed ke-4. Jakarta: Gaya Baru. hlm 657-659.
Shane SM, Stern NJ. 2003. Campylobacter infection. Di dalam: Saif YM, editor.
Diseases of Poultry. Ed ke-11. Iowa: Blackwell Publ. hlm 617-619.
Songer JG, Post KW. 2005. Veterinary Microbiology, Bacterial and Fungal
Agents of Animal Disesase. North Carolina: Elsevier Saunders. hlm 223-226.
Snelling WJ, Moore JE, Dooley JSG. 2005. The colonization of briolers with
Campylobacter. J Poult Sci 61: 655-662.
Supardi I, Sukanto. 1999. Mikrobiologi dalam Pengolahan dan Keamanan Pangan. Bandung: Penerbit Alumni.
van Vliet AHM, Ketley JM. 2001. Pathogenesis of enteric Campylobacter
infection. J Appl Microbiol 90: 45S-56S.
Wesley I. 2009. Public health impact of foodborne illness: impetus for the international food safety effort; food safety issues and the microbiology of poultry. Di dalam: Heredia N, Wesley I, dan Garc’ia S, editor.
PENDAHULUAN
Latar Belakang
Campylobacter merupakan salah satu bakteri patogen utama penyebab keracunan pangan pada manusia yang dapat ditularkan melalui produk unggas.
Campylobacter mampu hidup di saluran pencernaan unggas sehat. Bakteri ini bereplikasi di mukosa saluran pencernaan yang memiliki kadar oksigen rendah (mikroaerofilik). Campylobacter dapat menginfeksi unggas sehat dan dapat mengontaminasi karkas selama proses pemotongan dan pengolahan. Pada karkas ayam, Campylobacter dapat bertahan hidup namun tidak mampu bereplikasi (Wesley 2009). Kontaminasi pada karkas ayam dapat mengakibatkan campylobacteriosis pada manusia.
Kasus campylobacteriosis di beberapa negara telah banyak dilaporkan, misalnya pada tahun 2004, 25 negara bagian Uni Eropa melaporkan 183 961 kasus campylobacteriosis. Di Amerika Serikat, hampir dua juta penderita campylobacteriosis mengakibatkan penurunan produktivitas kurang lebih $1.2 juta setiap tahunnya. Secara epidemiologi, diketahui bahwa 72% kasus campylobacteriosis tersebut disebabkan oleh kontaminasi C. jejuni pada produk unggas (Wesley2009; CDC2011a).
Pada saluran pencernaan ayam, selain Campylobacter juga terdapat jenis bakteri lain yang hidup sebagai mikroflora normal, misalnya koliform. Koliform merupakan kelompok bakteri yang sering digunakan sebagai indikator sanitasi pada berbagai jenis bahan pangan. Bakteri ini ditemukan pada feses hewan maupun manusia (Ray & Bhunia 2008). Beberapa jenis dari kelompok bakteri ini dapat ditemukan pada produk pangan asal hewan, misalnya daging ayam. Adanya mikroorganisme ini dalam suatu produk pangan menunjukkan adanya kontaminasi pada proses persiapan dan pengolahan. Kontaminasi tersebut salah satunya dapat berasal dari feses hewan.