INTRODUKSI GEN METALLOTHIONEIN TIPE II
KE DALAM RUMPUT LAUT
Kappaphycus alvarezii
MENGGUNAKAN
Agrobacterium tumefaciens
ULIA FAJRIAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Introduksi Gen Metallothionein Tipe II ke dalam Rumput Laut Kappaphycus alvarezii Menggunakan Agrobacterium tumefaciens adalah benar karya saya bersama komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
RINGKASAN
ULIA FAJRIAH. Introduksi Gen Metallothionein Tipe II ke dalam Rumput Laut Kappaphycus alvarezii Menggunakan Agrobacterium tumefaciens. Dibimbing oleh UTUT WIDYASTUTI dan SUHARSONO.
Kappaphychus alvarezii (DOTY) atau Eucheuma cotonii merupakan spesies alga merah yang sangat penting bagi industri makanan, farmasi, dan kosmetik yang produksinya semakin meningkat setiap tahun. Suatu lingkungan yang memiliki tingkat kandungan logam berat melebihi jumlah yang diperlukan dapat mengakibatkan pertumbuhan alga terhambat. Metallothionein (MT) merupakan protein dengan kemampuan mengikat atom logam dengan membentuk ikatan logam-Cys (thiolate). Sintesis metallothionein tidak hanya diinduksi logam berat seperti Cd, Zn, dan Cu, tetapi juga menjadi mediator pada stress fisiologis, termasuk hormon dan Reactive Oxygen Spesies (ROS). Gen MaMt2 diisolasi dari Melastoma affine D. Don yang ekspresinya diinduksi oleh stres aluminium. Penelitian ini bertujuan untuk mengintroduksi gen MaMt2 ke dalam genom rumput laut K.alvarezii melalui perantara Agrobacterium tumefaciens.
Transformasi genetik K. alvarezii dilakukan pada potongan talus yang ditumbuhkan pada media PES cair. Sebanyak 423 eksplan diinfeksi dengan A. tumefaciens LBA4404 yang mengandung plasmid pIG6 yang membawa gen MaMt2 dibawah kendali promoter Ubiquitin dan terminator Nos. Kokultivasi dilakukan pada media PES cair yang mengandung 100 µM acetosyringone selama 3 hari pada kondisi gelap dan digoyang pada shaker dengan kecepatan 100 rpm. Setelah kokultivasi selanjutnya eksplan dipindahkan pada media pemulihan yaitu media PES cair yang mengandung 0,1 mg/l NAA dan 0,5 mg/l BAP selama 2 minggu. Setelah pemulihan selama 2 minggu, eksplan transgenik diseleksi di dalam media PES cair yang mengandung higromisin 10 mg/l selama 7 hari dan selanjutnya meningkat menjadi 20 mg/l selama 2 minggu. Regenerasi eksplan yang masih hidup pada media seleksi di lakukan pada media pemulihan hingga eksplan menghasilkan tunas. Analisis DNA dilakukan pada DNA genom dari tunas yang tumbuh.
Jumlah eksplan yang tahan higromisin 20 mg/l dan dipindahkan pada media regenerasi adalah 116 eksplan sehingga efisiensi transformasi putatifnya adalah 27,4%. Jumlah eksplan bertunas adalah sebanyak 32 eksplan yang menghasilkan 135 tunas sehingga efisiensi regenerasi eksplan transgenik adalah 27,6% dengan rata-rata regenerasi 4,2 tunas tiap eksplan. Analisis PCR terhadap 43 tunas transgenik putatif dengan primer Smt2F-NosTR1 yang mengamplifikasi 450 pb dan UbiqF-NosTR2 yang mengamplifikasi 431 pb, menunjukkan bahwa 13 tunas mengandung transgen. Hal ini menunjukkan bahwa hanya 3,1% dari tunas yang tumbuh dari eksplan adalah transgenik.
SUMMARY
ULIA FAJRIAH. Introduction of Metallothionein Type II Gene to Kappaphycus alvarezii using Agrobacterium tumefaciens. Under direction by: UTUT WIDYASTUTI and SUHARSONO.
Kappaphychus alvarezii (Doty) or Eucheuma cotonii is species of red algae that very important for the food industry, pharmaceuticals, and cosmetics whose production is increasing every year. An environment that has a heavy metal content exceeds the required amount can blocked growth of algae. Metallothionein (MT) is a protein with the ability to bind the metal atoms form a bond with the metal-Cys (thiolate). Production of metallothionein not only induced by heavy metals such as Cd, Zn, and Cu, but also a mediator in physiological stress, including hormones and Reactive Oxygen Species (ROS). MaMt2 gene was isolated from M. affine D. Don whose expression is induced by aluminum stress. This study aims to introduce MaMt2 genes into the genome seaweed K. alvarezii through Agrobacterium tumefaciens intermediaries.
Genetic transformation of K. alvarezii using pieces of the thalus were grown in liquid PES medium. 423 explants infected with A. tumefaciens LBA4404 containing plasmid pIG6 carrying MaMt2 gene under control of Ubiquitin promoter and Nos terminator. Co-cultivation was performed on liquid PES medium containing 100 µ m acetosyringone for 3 days in dark conditions and shaking on a shaker at 100 rpm. After co-cultivated then explants transferred to the recovery medium is liquid PES medium with 0.1 mg/l NAA and 0.5 mg/l BAP for 2 weeks. After recovery for 2 weeks, selected transgenic explants in liquid PES medium containing hygromycin 10 mg/l for 7 days and then increased to 20 mg/l for 2 weeks. Regenerating explants were still alive in the selection medium transfer to the recovery medium until produce shoots. DNA analysis performed on genomic DNA from shoots that grow.
The number of explants were resistant on hygromycin 20mg/l transferred to regeneration medium was 116 explants, which putative transformation efficiency was 27.4%. The number of explants was 32 that produced shoots 135 so that the efficiency regeneration of transgenic explants were 27.6% with an average of shoots per explant regeneration 4.2. PCR analysis of the 43 putative transgenic shoots with primers Smt2F-NosTR1 that amplify 450 bp and UbiqF- NosTR2 which amplify 431 bp, showed that 13 shoots containing transgenes. This indicates that only 3.1% of the shoots that grow from the explants were transgenic.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau
menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau
tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini
INTRODUKSI GEN METALLOTHIONEIN TIPE II
KE DALAM RUMPUT LAUT
Kappaphycus alvarezii
MENGGUNAKAN
Agrobacterium tumefaciens
ULIA FAJRIAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Introduksi Gen Metallothionein Tipe II ke dalam Rumput Laut Kappaphycus alvarezii Menggunakan Agrobacterium
tumefaciens.
Nama : Ulia Fajriah
NRP : P051100241
Disetujui oleh Komisi Pembimbing
Dr Ir Utut Widyastuti, MSi Prof Dr Ir Suharsono, DEA
Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Bioteknologi
Prof Dr Ir Suharsono, DEA Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia dan rahmat-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2011 hingga bulan April 2013 ini ialah introduksi gen Metallothionein tipe II ke dalam genom rumput laut Kappaphycus alvarezii menggunakan Agrobacterium tumefaciens.
Penulis menyadari bahwa karya ilmiah ini dapat diselesaikan dengan bantuan dari berbagai pihak. Untuk itu ucapan terima kasih penulis ucapkan kepada:
1. Ibu Dr. Ir. Utut Widyastuti, M.Si. selaku Ketua Komisi Pembimbing, Bapak Prof. Dr. Ir. Suharsono, DEA selaku Anggota Komisi Pembimbing yang telah memberi bimbingan dan petunjuk selama melakukan penelitian dan penulisan karya ilmiah ini, juga Bapak Dr. Agus Oman Sudrajat. 2. Proyek penelitian kerjasama antara Balai Riset Kelautan dan Perikanan
Air Payau (BRKP) Maros dan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB, atas nama Dr. Utut Widyastuti, M.Si. yang telah mendanai penelitian ini.
3. Ibu Emma Suryani yang telah mengajarkan mengenai kultur jaringan rumput laut.
4. Mbak Peppy dan Mbak Nia beserta bapak-ibu staf laboratorium Biorin dan Laboratorium Kultur Jaringan PPSHB, teman-teman Lab. Biorin yang telah memberikan bantuan serta dukungan selama penelitian hingga penyelesaian karya ilmiah ini.
5. Teman-teman BTK 10, yang sama-sama berjuang dan saling mendukung selama menjadi mahasiswa PS Bioteknologi.
6. Suami Wawan A. Setiawan, Bapak dan Ibu serta seluruh keluarga atas doa, dukungan dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat. Terima Kasih.
Bogor, Mei 2014
DAFTAR ISI
Halaman
DAFTAR ISI ix
DAFTAR GAMBAR xi
DAFTAR TABEL xii
DAFTAR LAMPIRAN xiii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
TINJAUAN PUSTAKA 3
Rumput Laut Kappaphycus alvarezii 3
Logam Berat di Perairan 3
Gen Metallothionein 4
Transformasi Genetik Tanaman dengan Agrobacterium tumefaciens 5
BAHAN DAN METODE 7
Bahan 7
Persiapan Rumput Laut 7
Kokultivasi 8
Seleksi 8
Regenerasi 8
Isolasi DNA Genom 8
Analisis Tanaman Transgenik 9
HASIL DAN PEMBAHASAN 10
Transformasi K. alvarezii dengan Gen MaMt2 10
Analisis Integrasi Gen MaMt2 pada K. alvarezii 12
Morfologi Rumput Laut Transgenik Putatif 13
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 16
LAMPIRAN 21
DAFTAR GAMBAR
Halaman 1. Peta fisik daerah T-DNA yang terdapat di dalam plasmid pIG6-MaMt2 7
2. Tahap inokulasi talus K. alvarezii 10
3. Perkembangan eksplan pada media seleksi 12
4. Hasil analisis PCR 13
5. Pertumbuhan tunas transgenik putatif dan non transgenik putatif pada
eksplan yang sama 14
DAFTAR TABEL
Halaman 1. Perkembangan eksplan selama transformasi dan seleksi 11
DAFTAR LAMPIRAN
Halaman
1
PENDAHULUAN
Latar Belakang
Rumput laut merupakan salah satu komoditas strategis dalam bidang kelautan. Berdasarkan data Kementerian Kelautan dan Perikanan, Indonesia memiliki luas area untuk kegiatan budidaya rumput laut mencapai 1.110.900 ha, tetapi baru termanfaatkan 20% dari luas areal potensial (BPPT 2010). Berdasarkan data yang dirilis oleh kementerian kelautan dan perikanan (KKP 2013) produksi rumput laut tahun 2012 meningkat menjadi 6,2 juta ton dibandingkan dengan produksi tahun 2011 yang mencapai 5,1 juta ton. Kementerian Kelautan dan Perikanan (KKP) juga menargetkan bahwa pada tahun 2014 produksi rumput laut bisa mencapai 10 juta ton.
Kappaphychus alvarezii (DOTY) atau Eucheuma cotonii merupakan spesies alga merah (Rhodophyta, Gigartinales, Areschougiaceae) yang mengandung karagenan jenis kappa yang merupakan jenis phycocolloid yang sangat penting bagi industri makanan, farmasi, dan kosmetik (Schmidt et al. 2010; Bindu dan Levine 2011; Hayashi et al. 2011). Produksi spesies ini umumnya masih menggunakan metode budidaya tradisional oleh masyarakat di pesisir pantai. Metode budidaya ini sangat tergantung oleh kondisi lingkungan seperti suhu, pH (Hurtado and Biter 2007), pasang surut dan perubahan salinitas (Hayashi et al. 2011). Menurut Bindu dan Levine (2011) budidaya K. alvarezii pada kawasan pantai Vietnam dapat mereduksi kadar amoniak, nitrit, nitrat, phospat dan fosfor pada kolom air hingga 10-80%.
Pada lingkungan perairan pantai, polusi menjadi masalah yang serius yang berakibat langsung terhadap pertumbuhan dan kelangsungan hidup organisme pantai khususnya pada makroalga (Mamboya 2007). Efek toksisitas logam berat seperti Cu pada alga sama dengan tanaman tingkat tinggi, menyebabkan fotoinhibitor pada photosystem II yang berakibat pada terbentuknya Reactive Oxygen Species (ROS) dan disfungsi kloroplas (Owen et al. 2012).
Contreras-Porcia et al. (2011) mengidentifikasi 18 gen yang terekspresi pada Ulva compressa yang diberi cekaman tembaga antara lain ascorbate peroxidase,
peroxiredoxin, thioredoxin, glutathione-S-transferase 2, metallothionein, calmodulin, ubiquitin, calcium-dependent protein kinase.
Metallothionein (MT) merupakan protein dengan berat molekul rendah (4 – 8 kDa), kaya akan sistein dengan kemampuan mengikat atom logam. Sintesis metallothionein tidak hanya diinduksi oleh beberapa logam berat seperti Cd, Zn, dan Cu, tetapi juga menjadi mediator pada stress fisiologis, termasuk hormon dan Reactive Oxygen Spesies (ROS). Penelitian pada hewan diperkirakan bahwa MTs dapat mendetoksifikasi logam berat dengan homeostasis ion logam pada intraseluler (Laplaze et al. 2002).
2
residu asam amino dengan 14 residu sistein (Suharsono et al. 2009). Ekspresi gen MT2 cenderung lebih tinggi di akar dibandingkan di daun pada tanaman M. affine yang mendapat cekaman Al‾ (Trisnaningrum 2009). Anggraito (2012) telah berhasil melakukan transformasi genetik tanaman Nicotiana benthamiana L. dan kedelai dengan menggunakan gen MaMt2 yang berasal dari M. affine.
Rekayasa genetik merupakan teknologi yang penting pada rumput laut untuk peningkatan mutu genetik rumput laut. Peningkatan mutu genetik dapat dilakukan dengan kultur jaringan, fusi protoplas dan transformasi genetik pada rumput laut Porphyra yezoensis (Cheney 2000). Untuk rumput laut jenis Kappaphycus khususnya K. alvarezii, perbanyakan embrio melalui induksi kalus secara in vitro telah dilakukan dengan menggunakan media semi solid PES 1/20 (Suryati et al. 2011). Transformasi genetik sering digunakan pada tanaman tingkat tinggi. Transfer gen pada tanaman tingkat tinggi dapat dilakukan melalui metode: 1) Transfer gen menggunakan Agrobacterium, 2) Biolistik atau Microparticle Bombardment, dan 3) elektroporasi (Cheney 2000). Teknologi rekayasa genetik telah banyak dilakukan pada rumput laut menggunakan metode elektroporasi dan biolistik seperti pada alga merah (Porphyra, Glacilaria, Grateloupia, Ceramium, dan Kappaphycus) dan pada alga coklat (Ulva, Laminaria dan Undaria) (Qin et al. 2005).
Agrobacterium tumefaciens merupakan bakteri tanah patogen yang menginfeksi tanaman dan mentransfer T-DNA kedalam genom inang menggunakan Ti (Tumor inducing) plasmid, sehingga mengakibatkan tumbuh tumor atau disebut dengan crown galls. Kemampuan transfer gen ini yang digunakan untuk mentransfer gen asing ke dalam tanaman (Cheney 2000). Transformasi genetik pada alga menggunakan Agrobacterium telah banyak dilakukan yaitu pada Porphyra yezoensis (Cheney 2000), Chlamydomonas reinhardtii (Kumar et al. 2004), Haematococcus pluvialis (Kathiresan et al. 2009), Dunaliella bardawil (Anila et al. 2011) dan K. alvarezii (Handayani 2012 dan Daud 2013).
Untuk meningkatkan toleransi rumput laut K. alvarezii terhadap kondisi lingkungan perairan yang tercemar logam berat maka perbaikan genetik dapat dilakukan dengan mengintroduksikan gen MaMt2 dibawah kendali promotor ubiquitin ke dalam genom K. alvarezii menggunakan perantara A. tumefaciens. Peningkatan ekspresi gen MaMt2, diharapkan akan meningkatkan ketahanan rumput laut terhadap kondisi lingkungan yang ekstrim, sehingga rumput laut K. alvarezii dapat tumbuh pada kondisi lingkungan yang tercemar logam berat.
Tujuan Penelitian
3
TINJAUAN PUSTAKA
Rumput Laut Kappaphychus alvarezii
Secara komersial rumput laut Kappaphychus alvarezii (DOTY) pertama kali dibudidayakan di Philipina pada tahun 1967 (Thirumaran & Anantharaman 2009). Kappaphychus alvarezii (DOTY) atau Eucheuma cotonii merupakan spesies alga merah (Rhodophyta) yang mengandung karagenan jenis kappa. Jenis phycocolloid ini berfungsi pada industri makanan, farmasi, dan kosmetik. Produksi spesies ini menggunakan metode budidaya tradisional oleh masyarakat di pesisir pantai. Metode budidaya ini sangat tergantung oleh kondisi lingkungan seperti suhu, pH (Thirumaran & Anantharaman 2009), pasang surut dan perubahan salinitas (Hayashi et al. 2011). K. alvarezii yang ditumbuhkan pada salinitas 15 ppm mengakibatkan talus terserang ice-ice dan mati setelah 3 hari kultur (Hayashi et al. 2011). Selain itu lingkungan perairan yang bebas dari bahan pencemar juga merupakan parameter kimia yang perlu diperhatikan dalam budidaya rumput laut K. alvarezii. Bahan pencemar di dalam perairan berbahaya bagi pertumbuhan bibit rumput laut (Pong_masak et al. 2011).
Perbanyakan rumput laut K. alvarezi dilakukan dengan teknik kultur jaringan yang menghasilkan mikropropagul dari strain yang terbaik secara in vitro (Hayashi, et al. 2011). Suryati et al. (2011) telah melakukan perbanyakan embrio melalui induksi kalus secara in vitro dengan menggunakan media semi solid PES 1/20. Hurtado & Biter (2007) menyatakan metode kultur jaringan saat ini digunakan sebagai alat memproduksi tanaman yang menyediakan propagul untuk pembenihan dan budidaya secara komersil.
Upaya yang dapat dilakukan untuk mengatasi masalah penurunan kualitas bibit K. alvarezii di masa mendatang adalah melalui teknologi peningkatan mutu genetik dari rumput laut. Peningkatan mutu genetik dapat dilakukan dengan kultur jaringan, fusi protoplas dan transformasi genetik. Transformasi genetik sering digunakan pada tanaman tingkat tinggi (Cheney 2000). Masalah utama pada transformasi genetik adalah efisiensi transfer gen. Transfer gen pada tanaman tingkat tinggi dapat dilakukan dengan beberapa metode, yaitu: 1) Transfer gen menggunakan Agrobacterium, 2) Biolistik atau Microparticle Bombardment, dan 3) elektroporasi.
Logam Berat Di Perairan
4
et al. 2008). Atau secara langsung diserap oleh organisme hidup yang ada di laut (Perez-Lopez et al. 2003).
Kadar logam berat (Fe2O3, Zn dan Cu) dan nutrien (N dan P2O5) pada
sedimen dan air di muara sungai teluk Banten memiliki konsentrasi yang lebih tinggi bila dibandingkan dengan bagian tengah teluk. Hal ini membuktikan material organik dan anorganik didistribusikan melalui aliran air sungai dan akhirnya sampai ke perairan laut disekitar teluk Banten (Suwandana et al. 2011).
Tingkat toksisitas logam berat pada ekosistem akuatik dipengaruhi oleh struktur kimianya. Beberapa logam berat merupakan unsur yang esensial bagi kehidupan organisme seperti Mn, Cu dan Fe tetapi dalam jumlah berlebih sangat beracun bagi kehidupan organisme (Rohyatun et al. 2005). Logam berat yang teroksidasi akan mempengaruhi tingkat toksisitas dan ketersediaannya (Rajamohan et al. 2010). Efek negatif yang ditimbulkan menjadi bukti tidak hanya menurunkan keragaman spesies akuatik tapi juga secara langsung dapat masuk ke dalam rantai makanan yang dapat menyebabkan gangguan kesehatan bagi manusia (Perez-Lopez et al. 2003).
Flora dan fauna laut seperti tanaman lamun (seagrass), ikan dan bivalvia memiliki kemampuan menyerap logam berat dan nutrien dari air dan sedimen laut (Suwandana et al. 2011), sehingga dapat digunakan sebagai bioindikator terhadap akumulasi logam berat yang ada di lingkungan perairan (Perez-Lopez et al. 2003). Alga juga dapat digunakan sebagai bioindikator terhadap logam berat, karena dalam pertumbuhannya beberapa jenis logam merupakan nutrien alami seperti Cu, Fe dan Zn dalam jumlah yang sedikit. Suatu lingkungan yang memiliki tingkat kandungan logam berat melebihi jumlah yang diperlukan dapat mengakibatkan pertumbuhan alga terhambat, sehingga dalam keadaan ini logam menjadi polutan bagi alga (Bactiar 2007; Pong_Masak et al. 2011).
Gen Metallothionein
Beberapa logam berat seperti tembaga (Cu) dan zinc (Zn) merupakan mikronutrien yang esensial bagi proses fisiologi tanaman dimana Cu dan Zn merupakan kofaktor enzim. Ion logam berat non esensial seperti cadmium (Cd), timbal (Pb), dan mercury (Hg) sangat reaktif dan dapat menjadi toksik bagi sel organisme. Tanaman dan organisme hidup lainnya memiliki mekanisme untuk mengkontrol dan merespon peningkatan dan akumulasi logam berat esensial dan non esensial. Ada dua kelompok protein pengikat logam pada sel tanaman yaitu phytochelatins (PCs) dan Metallothionein (MT) (Cobbett & Goldsbrough 2002).
Metallothionein (MT) merupakan protein dengan berat molekul rendah (4 – 8 kDa), kaya akan residu sistein dengan kemampuan mengikat atom logam dengan membentuk ikatan logam-Cys (thiolate). Protein ini banyak terdapat pada organisme akuatik dengan konsentrasi MT tertinggi pada saluran pencernaan dan insang (Morris et al. 1999; Mir et al. 2004; Bernal-Herna´ndez, et al. 2010). Residu sistein pada metallothionein mengikat berbagai jenis logam dengan ikatan mercaptide.
5
Cobbett & Goldsbrough (2002) mengklasifikasikan MT pada tanaman ke dalam empat tipe berdasarkan urutan asam aminonya. Tipe 1 terdiri dari 6 motif Cys-Xaa-Cys (dimana Xaa merupakan asam amino lain) tersebar secara merata dalam dua domain. Tipe II terdiri atas dua domain yang kaya sistein, bagian pertama sistein memiliki motif Cys-Cys pada asam amino ke 3 dan 4 dari protein tersebut. Tipe III atau juga disebut dengan Phytochelatin (PC), hanya terdiri atas empat asam amino Cys pada ujung-N. Tiga Cys pertama membentuk motif Cys-Gly-Asn-Cys-Asp-Cys. Sedangkan Cys ke empat membentuk motif sendiri yaitu Gln-Cys-X-Lys-Lys-Gly. Tipe IV berbeda dengan MT tipe yang lain, memiliki tiga domain kaya sistein, masing-masing memiliki 5 atau 6 residu cys yang terkonservasi.
Morris et al. (1999) telah berhasil mengidentifikasi gen MT dari makroalga Fucus vesiculosus yang ekspresinya diinduksi oleh tembaga (Cu).
Protein MT yang dihasilkan berfungsi sebagai “lalu lintas” logam, mengarah pada protein pengikat logam ke dalam bagian intraseluler, dan atau juga termasuk dalam penyimpanan jangka panjang ion logam pada makroalga. Makroalga mampu mengasingkan logam pada kompartemen selular yang disebut physodes, yang mengandung tembaga dan sulfur dengan konsentrasi yang tinggi.
Gen MaMt2 merupakan penyandi metallothionein tipe II yang diisolasi dari Melastoma malabathricum atau Melastoma affine D. Don yang ekspresinya diinduksi oleh stres aluminium. Gen MaMt2 memiliki ukuran 250 bp yang terdiri dari 81 residu asam amino dengan 14 residu sistein (Suharsono et al. 2009). Pada konsentrasi aluminium 3,2 mM ekspresi gen MT2 cenderung lebih tinggi di akar dibandingkan di daun pada tanaman M. affine (Trisnaningrum 2009).
Transformasi Genetik Tanaman dengan Agrobacterium tumefaciens
Saat ini transformasi genetik yang banyak dilakukan pada microalga, umumnya menggunakan metode transformasi genetik secara langsung seperti elektroporasi, agitasi dengan glass beads dan particle bombartment. Metode transformasi menggunakan Agrobacterium memiliki beberapa keuntungan dalam metode transfer gen secara langsung. Keuntungan tersebut meliputi kemungkinan dapat mentransfer DNA yang berukuran besar, jumlah kopi transgen yang terintegrasi rendah, transgen dengan penyusunan kembali sedikit, secara sempurna dapat bergabung pada sisi aktif transkripsi dan sangat sederhana (San et al. 2011). Pada tahap transformasi embrio pemberian acetosyrngone dan glukosa pada tahap inokulasi dan media kokultivasi sangat penting untuk efisiensi transfer T-DNA, dan jumlahnya tergantung tipe dan genotipe eksplan yang digunakan (He et al. 2010).
Transformasi genetik pada N. benthamiana dengan gen MaMt2 melalui Agrobacterium yang dilakukan oleh Anggraito (2012) menggunakan potongan daun dengan teknik kokultivasi. Efisiensi transformasi pada tanaman N. benthamiana lebih tinggi yaitu sebesar 29,59% dibandingkan pada tanaman kedelai yang memiliki efisiensi transformasi sebesar 12,50%.
6
reinhardtii (Kumar et al. 2004), Haematococcus pluvialis (Kathiresan et al. 2009), Chlorella dan Nannochloropsis (San et al. 2011), Dunaliella bardawil (Anila et al. 2011), serta K. alvarezii (Handayani 2012 dan Daud 2013).
Cheney (2000) melakukan transformasi genetik pada makroalga P. yezoensis dengan gen GUS (beta- glucuronidase) menggunakan perantara A. tumefaciens strain LBA 4404. Setelah 2 – 4 minggu inkubasi dengan Agrobacterium, potongan rumput laut mulai melepaskan monospore, yang menandai potongan tumbuh menjadi potongan baru. Selanjutnya potongan yang memproduksi monospore dipindahkan pada media seleksi geneticin dengan konsentrasi 125 ug/ml selama 7 – 10 hari. Potongan yang bertahan hidup pada media seleksi merupakan transforman putatif dan mulai menunjukkan sel berwarna biru yang mengiindikasikan bahwa gen GUS terekspresi.
7
BAHAN DAN METODE
Bahan
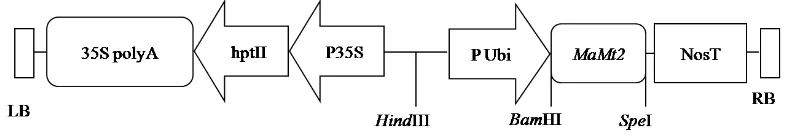
Bahan percobaan yang digunakan meliputi talus rumput laut K. alvarezii yang diperoleh dari BRBAP (Balai Riset Budidaya Air Payau) Maros. Media pertumbuhan rumput laut Provasoli Enrichment Seawater (PES) (Lampiran 1.) digunakan untuk menumbuhkan rumput laut, Agrobacterium tumefaciens strain LBA4404 mengandung plasmid pIG6-MaMt2 yang membawa gen MaMt2 dibawah kendali promotor ubiquitin dan terminator Nos (Anggraito 2012) digunakan untuk mentransformasi rumput laut. Peta plasmid pIG6-MaMt2 yang membawa gen MaMt2 di sajikan pada Gambar 1. Pasangan primer UbiQF (5’
-TGATGGCC CTGCCTTCATACG-3’) dan NosTR2 (5’
-TGCCGGTCTTGCGATGATTA-3’), primer SMt2UF (5’
-TCATGGATCCATGTCTTGCTGTGGAGG-3’) dan NosTR1 (5’
-CTCATAAATAACGTCATGCAT TACA-3’), digunakan untuk mendeteksi keberadaan gen MaMt2 di dalam genom rumput laut transgenik.
Gambar 1. Peta fisik daerah T-DNA yang terdapat di dalam plasmid pIG6-MaMt2 (Anggraito 2012)
Persiapan Rumput Laut
Perbanyakan dan pemeliharaan anakan rumput laut menggunakan metode yang dilakukan oleh Suryati et al. (2011) yang telah dimodifikasi. Talus rumput laut yang akan digunakan sebagai eksplan diperoleh dari BRBAP Maros. Talus yang sehat dipotong sepanjang 5 cm dan dibersihkan dari kotoran yang menempel. Sterilisasi dilakukan dengan menggunakan 1% larutan iodine dan 0,05% larutan antibiotik. Eksplan yang telah disterilisasi ditumbuhkan pada media PES cair, digoyang menggunakan shaker kecepatan 100 rpm dengan suhu 23°C selama 1 minggu. Eksplan yang bertahan hidup selanjutnya dipotong sepanjang 2 cm dan dikultur selama 1 bulan dengan subkultur dilakukan setiap 2 minggu sekali. Eksplan siap diinokulasi dengan A. tumefaciens.
Kokultivasi
8
digoyang dengan kecepatan 220 rpm selama 2 hari. Suspensi bakteri yang tumbuh selanjutnya disubkultur pada media yang sama selama 18 jam. Bakteri yang tumbuh selanjutnya disentrifugasi dengan kecepatan 5000 rpm selama 5 menit. Endapan bakteri yang diperoleh diresuspensi dengan media PES cair dan ditambahi 100 µM Acetosyringone hingga mencapai OD600= 0,5-1.
Eksplan yang siap ditransformasi sebelumnya dilukai dengan menggunakan jarum steril di seluruh permukaan, selanjutnya eksplan dimasukkan ke dalam media infeksi berupa media PES cair yang telah diresuspensi dengan bakteri selama 15-60 menit pada shaker dengan kecepatan 100 rpm. Eksplan yang telah diinfeksi dipindahkan pada media kokultivasi berupa media PES cair yang diberi 100 µM Acetosyringone dan diinkubasi selama 3 hari pada kondisi gelap dan digoyang pada shaker dengan kecepatan 100 rpm.
Seleksi
Setelah dikokultivasi selama 3 hari eksplan selanjutnya dibilas dengan air laut steril sebanyak 3 kali dan dipindahkan pada media pemulihan yaitu media PES cair yang mengandung ZPT 0,1 mg/l NAA dan 0,5 mg/l BAP selama 2 minggu. Eksplan yang tumbuh pada media pemulihan dipindahkan pada media seleksi yaitu media PES cair yang mengandung higromisin 10 mg/l (seleksi I) dan diinkubasi selama 7 hari. Eksplan yang hidup pada media seleksi I dipindahkan pada media seleksi II (higromisin 20 mg/l) dan diinkubasi selama 14 hari.
Regenerasi
Eksplan yang tetap hidup pada media seleksi II selanjutnya dipindahkan pada media regenerasi yang sama dengan media pemulihan hingga tumbuh tunas. Pergantian media dilakukan setiap satu bulan sekali.
Isolasi DNA Genom
9
DNA dikeringkan dan diberi ddH2O dan RNAse (1 mg/ml), kemudian diinkubasi
pada suhu 370C selama 60 menit. Inaktivasi RNAse dilakukan pada suhu 700C selama 10 menit.
Analisis Tanaman Transgenik
DNA hasil isolasi selanjutnya digunakan sebagai cetakan untuk analisis PCR dengan menggunakan pasangan primer UbiQF dan NosTR2 dan pasangan primer Smt2UF dan NosTR1. Campuran reaksi yang digunakan adalah 100 ng DNA genom ; 0,5 µM masing-masing pasangan primer (10 pmol/µl); 1x buffer; 0,2 mM dNTPmix; 1.25 U Tag DNA Polymerase dan ditambah dengan ddH2O
10
HASIL DAN PEMBAHASAN
Transformasi K. alvarezii dengan Gen MaMt2
Pada penelitian ini transformasi genetik K. alvarezii dilakukan menggunakan potongan talus yang ditumbuhkan pada media PES cair. Permukaan talus yang akan ditransformasi sebelumnya dilukai dengan menggunakan jarum steril seperti yang dilakukan oleh Cheney (2000) terhadap sel P. yezoensis. Kokultivasi dilakukan pada media PES cair yang mengandung 100 µM acetosyringone sama dengan yang dilakukan oleh Cheney (2000) pada transformasi rumput laut P. yezoensis. Penambahan acetosyringone pada media kokultivasi menyebabkan peningkatan frekuensi transformasi secara signifikan pada C. reinhardtii (Kumar et al. 2004). Sedangkan pada D. bardawil, pemberian acetosyringone tidak berpengaruh terhadap jumlah sel yang resisten higromisin (Anila et al. 2011). Pada penelitian ini infeksi eksplan dengan suspensi bakteri dilakukan selama 15-60 menit pada media PES cair dengan penambahan acetosyringone. Perendaman eksplan pada suspensi bakteri dimaksudkan untuk memberi kesempatan kontak antara bakteri Agrobacterium dengan eksplan di media infeksi (Cheney 2000).
Talus yang ditumbuhkan di media pemulihan setelah kokultivasi dapat dikelompokkan menjadi: 1) talus yang tidak mengalami perubahan bentuk dan warna yaitu coklat tua dan 2) talus yang mengalami perubahan warna menjadi coklat muda serta pada bagian ujung terdapat warna kemerahan dan terdapat kerutan pada dinding talus. Eksplan yang mengalami perubahan warna umumnya tidak bertahan lama pada media pemulihan yang ditandai dengan perubahan talus menjadi berwarna putih transparan dan akhirnya mati (Gambar 2d).
Gambar 2. Tahap inokulasi talus K. alvarezii; a) Eksplan yang telah dipotong dan siap
11
Untuk mengetahui eksplan yang mengandung gen MaMt2 maka eksplan diseleksi menggunakan media PES cair yang mengandung higromisin. Higromisin dan kanamisin adalah agen seleksi yang umum digunakan untuk menentukan keberhasilan dari transformasi (Torregrosa et al. 2000). Seleksi terhadap sel atau jaringan yang resisten higromisin pada penelitian ini dilakukan secara bertingkat, yaitu pada seleksi I dengan konsentrasi higromisin 10 mg/l selama 7 hari dan seleksi II dengan konsentrasi higromisin 20 mg/l selama 14 hari. Menurut Anggraito (2012) seleksi bertingkat dimaksudkan untuk mendapatkan tanaman transgenik dengan persentase yang lebih tinggi dan mengurangi adanya tanaman transgenik palsu. Pada penelitian transformasi K. alvarezii, Daud (2013) melakukan seleksi menggunakan higromisin dengan konsentrasi 10 mg/l pada media PES padat dan Handayani (2012) menggunakan higromisin dengan konsentrasi 20 mg/l pada media PES cair. Menurut Anila et al. (2011), kemampuan toleransi D. bardawil transgenik terhadap higromisin pada media cair lebih tinggi dibandingkan media padat. Oleh karena itu pada penelitian ini menggunakan higromisin yang lebih tinggi dari pada yang dilakukan oleh Daud (2013).
Setelah tujuh hari di dalam media seleksi I, hanya 146 dari 423 eksplan bertahan hidup, persentase eksplan yang hidup sebesar 34,5% (tabel 1). Setelah 14 hari ditumbuhkan di dalam media seleksi II dengan konsentrasi higromisin yang ditingkatkan menjadi 20 mg/l dari 146 eksplan yang hidup di media seleksi I hanya 116 eksplan yang dapat bertahan hidup, sehingga persentase eksplan yang hidup di media seleksi II adalah sebesar 27,4% (tabel 1). Persentase eksplan yang hidup pada media seleksi higromisin ini lebih tinggi dibandingkan dengan persentase hasil seleksi higromisin pada penelitian transformasi K. alvarezii yang dilakukan oleh Handayani (2012) sebesar 23,56% dan penelitian yang dilakukan oleh Daud (2013) sebesar 7,5%. Eksplan yang hidup di dalam media seleksi II merupakan eksplan transgenik putatif.
Tabel 1. Perkembangan Eksplan Selama Transformasi dan Seleksi.
Perlakuan
**di tumbuhkan pada media hiromisin 20 mg/l
***ditumbuhkan pada media yang tidak mengandung higromisin
12
disebut sebagai tunas transgenik putatif. Perkembangan eksplan pada media seleksi disajikan pada Gambar 3.
Dari 116 eksplan yang ditumbuhkan di media regenerasi, 32 eksplan menghasilkan 135 tunas sehingga efisiensi regenerasi eksplan transgenik putatif adalah 27,6% dan rata-rata regenerasi tunas per eksplannya adalah 4,2. Efisiensi regenerasi eksplan transgenik ini lebih rendah dibandingkan dengan efisiensi regenerasi eksplan non transgenik yang tidak di inokulasi yaitu sebesar 70,8% dengan rata-rata jumlah tunas per eksplan sebesar 5,5. Efisiensi regenerasi pada penelitian ini lebih tinggi dibandingkan dengan efisiensi regenerasi yang diperoleh Handayani (2012) yaitu sebesar 11,32%, dan lebih rendah dibandingkan dengan yang diperoleh Daud (2013) yaitu sebesar 100%.
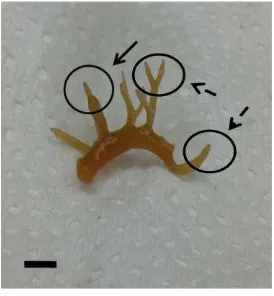
Gambar 3. Perkembangan eksplan pada media seleksi. a). Eksplan transforman di media seleksi I (higromisin 10 mg/l); b). Eksplan transforman di media seleksi II (higromisin 20 mg/l); c). Eksplan transforman di media regenerasi; d). Eksplan non transforman di media seleksi I (higromisin 10 mg/l); e). Eksplan non transforman di media seleksi II (higromisin 20 mg/l); 2b). Eksplan non transforman di media regenerasi. Bar= 1 cm.
Analisis Integrasi Gen MaMt2 pada K. alvarezii
galur-13
galur tersebut resisten terhadap higromisin tetapi tidak semuanya mengandung transgen MaMt2. Hasil analisis PCR terhadap beberapa galur transgenik dapat dilihat pada Gambar 4.
Analisis PCR terhadap tunas transgenik putatif yang menggunakan pasangan primer UbiQF dan NosTR2, menghasilkan pita berukuran 431 pb, sesuai dengan pasangan dengan ukuran sisipan pada plasmid pIG6-MaMt2. Hasil PCR dikonfirmasi ulang dengan menggunakan pasangan primer Smt2F dan NosTR1 berukuran 450 pb yag sesuai dengan ukuran DNA sisipan pada plasmid pIG6-MaMt2 (Gambar 4). Hasil PCR tersebut menunjukkan bahwa tunas rumput laut yang dianalisis adalah tanaman transgenik yang mengandung gen MaMt2 dibawah promoter ubiquitin dan terminator NosTR.
Untuk konfirmasi bahwa DNA yang diamplifikasi tersebut adalah transgen MaMt2, PCR dengan pasangan primer yang sama dilakukan terhadap DNA rumput laut non transgenik. Hasil PCR terhadap rumput laut non trangenik tidak menghasilkan pita DNA. Hal ini menunjukkan bahwa primer yang digunakan untuk PCR adalah spesifik terhadap promoter ubiquitin dan terminator Nos serta gen MaMt2.
Morfologi Rumput Laut Transgenik Putatif
Eksplan yang mengandung tunas transgenik putatif selanjutnya ditumbuhkan pada media pertumbuhan yaitu media PES dengan penambahan 0,5 mg/l BAP dan 0,1 mg/l NAA, namun tunas tersebut mengalami pertumbuhan yang lebih lambat jika dibandingkan dengan tunas non transgenik pada media yang sama. Tunas transgenik putatif yang berumur 3 bulan memiliki panjang tunas kurang dari 1 mm, sedangkan tunas non transgenik dengan umur yang sama memiliki panjang tunas 5 mm (Gambar 5). Hal ini mungkin disebabkan karena stres akibat pemotongan pada tunas dan masuknya gen asing ke dalam genom sehingga menganggu pertumbuhan tunas transgenik putatif.
Menurut Qin et al. (2005) transformasi genetik pada protoplas menggunakan Agrobacterium mengalami kesulitan dalam regenerasi protoplas menjadi talus baru. Kemungkinan yang terjadi adalah material yang digunakan berbeda-beda karakter genetik dan tahapan reproduksinya. Ekspresi gen asing yang tidak stabil sering ditemukan pada regenerasi talus transgen sehingga
14
menghasilkan talus yang abnormal. Pertumbuhan protoplas transgenik Glacilaria gracilis pada media yang diberi penambahan PES mengalami penurunan jika dibandingkan dengan protoplas yang ditumbuhkan pada media air laut steril, karena protoplas sangat sensitif terhadap ammonium dan nitrat yang terdapat pada media PES (Huddy, 2011). Kemungkinan hal ini dapat terjadi pada tunas transgenik putatif di penelitian ini dimana media pertumbuhan dan zat pengatur tumbuh yang diberikan dapat menghambat regenerasi pada tunas transgenik putatif.
15
SIMPULAN DAN SARAN
Simpulan
Gen MaMt2 telah berhasil diintroduksikan ke dalam genom rumput laut K. alvarezii melalui perantara A. tumefaciens. Efisiensi transformasi adalah sekitar 27,4% dan rata-rata tunas yang dihasilkan per eksplan sebesar 4,2. Analisis integrasi gen MaMt2 dengan PCR menghasilkan 13 tunas transgenik yang mengandung gen MaMt2 di bawah promoter ubiquitin dan terminator Nos.
Saran
16
DAFTAR PUSTAKA
Anggraito YU. 2012. Transformasi genetik Nicotiana benthamiana L. dan kedelai dengan gen MaMt2 penyandi Metallothionein Tipe II dari Melastoma malabathricum L. [Desertasi]. Bogor [ID]: Sekolah Pascasarjana. Institut Pertanian Bogor.
Anila N, Chandrashekar A, Ravishankar GA and Sarada R. 2011. Establishment of Agrobacterium tumefaciens-mediated genetic transformation in Dunaliella bardawil. Eur J Phycol. 46 (1):36-44.doi:10.1080/09670262.2010.550386.
Bactiar E. 2007. Penelusuran sumber daya hayati laut (alga) sebagai biotarget industri. Makalah. Fakultas Perikanan dan Ilmu Kelautan. Universitas Padjadjaran: Jatinangor. 21 hal.
Bernal-Herna´ndez YY, Medina-Dı´az IM, Robledo-Marenco ML, Vela´zquez-Ferna´ndez JB, Giro´n-Pe´rez MI, Ortega-Cervantes L, Maldonado-Va´zquez WA, Rojas-Garcı´a EA. 2010. Acetylcholinesterase and metallothionein in oysters (Crassostrea corteziensis) from a subtropical Mexican Pacific estuary. Ecotoxicology. 19:819–825. DOI 10.1007/s10646-009-0459-2.
Bindu MS and Levine IA. 2011. The commercial red seaweed Kappaphycus alvarezii an overview on farming and environment. J Appl Phycol. 23:789– 796.doi:10.1007/s10811-010-9570-2.
BPPT. 2010. BPPT Produk olahan rumput laut Indonesia rendah. Berita. Website Resmi KKP.htm. http://www.kkp.go.id/index.php/BPP-Produk-Olahan-Rumput-Laut-Indonesia-Rendah-Berita-Website-Resmi-KKP.htm. [tanggal akses 24 Juli 2011].
Cheney DP. 2000. Agrobacterium-mediated genetic transformation of multicellular marine algae, resultant strains and their products. International classes. Northeastern University (Huntington Avenue Boston) US. http://ip.com/patfam/en/22440221. [tanggal akses 20 september 2012].
Cheng R, Ma R, Li K, Rong H, Lin X, Wang Z, Yang S, Ma Y. 2012. Agrobacterium tumefaciens mediated transformation of marine microalgae Schizochytrium. Microbiol Res.167 (3):179 – 186.doi:10.1016/j.micres.2011.05.003.
17
Contreras-Porcia L, Dennett G, González A, Vergara E, Medina C, Correa JA, Moenne A. 2011. Identification of copper-induced genes in the marine alga Ulva compressa (Chlorophyta). Mar Biotechnol. 13:544–556. Doi:10.1007/s10126-010-9325-8.
Daud RF. 2013. Introduksi gen Sitrat Sintase ke dalam rumput laut Kappaphycus alvarezii menggunakan Agrobacterium tumefaciens.[Tesis]. Bogor [ID]: Sekolah Pascasarjana. Institut Pertanian Bogor.
Doyle JJ, Doyle JL. 1990. Isolation of plant DNA from fresh tissue. Focus. 12:13-15.
Handayani T. 2012. Konstruksi vektor biner dan transformasi gen lisozin pada rumput laut Kappaphycus alvarezii menggunakan Agrobacterium tumefaciens.[Tesis]. Bogor [ID]: Sekolah Pascasarjana. Institut Pertanian Bogor.
Hayashi L, Faria GSM, Nunes BG, Zitta CS, Scariot LA, Rover T, Felix MRL, Bouzon ZL. 2011. Effects of salinity on the growth rate, carrageenan yield, and cellular structure of Kappaphycus alvarezii (Rhodophyta, Gigartinales) cultured in vitro. J Appl Phycol. 23:439–447. Doi:10.1007/s10811-010-9595-6.
He Y, Jones HD, Chen S, Chen XM, Wang DW, Li KX, Wang DS and Xia LQ. 2010. Research Paper. Agrobacterium-mediated transformation of durum wheat (Triticum turgidum L. var. durum cv Stewart) with improved efficiency. J Exp Bot. 61 (6) : 1567–1581. Doi:10.1093/jeb/erq035.
Huddy SM. 2011. Development of a transformation protocol and cell culture system for the commercially important species of red macroalga, Glacilaria gracilis. [thesis]. Cape town [SA]: Departement of Molecular and Cell Biology, Faculty of Science, University of Cape Town.
Hurtado AQ and Biter AB. 2007. Plantlet regeneration of Kappaphycus alvarezii var. adik-adik by tissue culture. J Appl Phycol. 19:783–786. Doi:10.1007/s10811-007-9269-1.
[KKP] Kementrian Kelautan dan Perikanan. 2013. Ekspor rumput 2013, US$230 Juta. J Nas. Tanggal 17 Januari 2013 Hal.10. info media. Website Resmi KKP.htm. http://www.kkp.go.id/index.p...mobile/arsip/?categori_id=58 [tanggal akses 12 Maret 2013].
18
Kathiresan S, Chandrashekar A, Ravishankar GA, and Sarada R. 2009. Agrobacterium-mediated transformation in the green alga Haematococcus pluvialis (Chlorophyceae, Volvocales). J Phycol. 45 : 642–649. DOI: 10.1111/j.1529-8817.2009.00688.x.
Laplaze L, Gherbi H, Duhoux E, Pawlowski K, Auguy F, Guermache F, Franche C and Bogusz D. 2002. Symbiotic and non-symbiotic expression of cgMT1, a metallothionein-like gene from the actinorhizal tree Casuarina glauca. Plant Mol Biol. 49: 81–92. Kluwer academic publishers.
Mamboya, FA. 2007. Heavy metal contamination and toxicity: studies of macroalgae from the Tanzania coast. Stockholm [US]: Stockholm University library. pp. 1–48.ISBN 91-7155-374-6. http://www.diva-portal.org/smash/get/diva2:197112/FULLTEXT01.pdf
Mir G, Dome`nech J, Huguet G, Guo WJ, Goldsbrough P, Atrian S, Molinas M. 2004. A plant type 2 metallothionein (MT) from cork tissue responds to oxidative stress. J Exp Bot. 55 (408): 2483–2493.doi:10.1093/jxb/erh254.
Moilanen, Lori H., Fukushige T, Freedman JH. 1999. Identification of upstream regulatory elements and transcription factors responsible for cell-specific expression of the metallothionein genes from Caenorhabditis elegans. J Biol Chem. 274 (42), Issue of October 15: 29655– 29665.doi:10.1074/jbc.274.42.29655.
Morris CA, Nicolaus B, Sampson V, Harwood JL and Kille P. 1999. Identification and characterization of a recombinant metallothionein protein from a marine alga, Fucus vesiculosus. Biochem J. 338: 553 – 560.
Omidvar V, Abdullah SNA, Izadfard A, Ling Ho C, Mahmood M. 2010. The oil palm metallothionein promoter contains a novel AGTTAGG motif conferring its fruit-specific expression and is inducible by abiotic factors. Planta. 232:925–936. Doi:10.1007/s00425-010-1220-z.
Owen JR, Morris CA, Nicolaus B, Harwood JL, Kille P. 2012. Induction of expression of a 14-3-3 gene in response to copper exposure in the marine alga, Fucus vesiculosus. Ecotoxicol. 21:124– 138.doi:10.1007/s10646-011-0772-4.
Perez-Lopez M, Alonso J, Novoa-Valinas MC and Melgar MJ. 2003. Assessment of heavy metal contamination of seawater and marine limpet, Patella vulgata L., from Northwest Spain. J Environ Sci Health A. 38(12) : 2845– 2856. Doi:10.1081/ESE-120025835.
19
Qin S, Jiang P and Tseng C. 2005. Transforming kelp into a marine bioreactor. Review. TRENDS in Biotechnol. 23 (5) May 2005. www.scincedirect.com. [Access at March 26 2012].
Rajamohan R, Rao TS, Anupkumar B, Sahayam AC, Krishna MVB, VenugopalanVP and Narasimhan SV. 2010. Distribusion of heavy metals in the vicinity of a nuclear power plant, East Cost of India: With emplasis on copper concentration and primary productivity. Indian J Mar Sci. 39 (2): pp 182 – 191.
Rohyatun E, Endang and Rozak A. 2005. Kualitas lingkungan perairan Banten Dan sekitarnya ditinjau dari kondisi logam berat. Oseanologi dan Limnologi di Indonesia 38 : 23 – 46. ISSN 0125-9830.
San CT, Yee W, bin Ahmad A. 2011. Assessment of factors affecting Agrobacterium-mediated transformation of microalgae. UMTAS. Kuala Tengganu [Malaysia]: Universiti Malaysia Terengganu.
Schmidt ÉC, Nunes BG, Maraschin M and Bouzon ZL. 2010. Effect of ultraviolet-B radiation on growth, photosynthetic pigments, and cell biology of Kappaphycus alvarezii (Rhodophyta, Gigartinales) macroalgae brown strain. Photosynthetica. 48 (2): 161-172.
Shestivska S, Adam V, Prasek J, Macek T, Mackova M, Havel L, Diopan V, Zehnalek J, Hubalek J, Kizek R. 2011. Investigation of the antioxidant properties of metallothionein in transgenic tobacco plants using voltammetry at a carbon paste electrode. Int J Electrochem Sci. 6: 2869– 2883.
http://www.electrochemsci.org/papers/vol6/6072869.pdf
Soltani J, van Heusden GPH and Hooykaas PJJ. 2008. Agrobacterium-mediated transformation of non-plant organisms. Di dalam: Tzvira, T. and V. Citovsky, Editor. Agrobacterium: From biology to biotechnology. USA: Springer Science Business Media, LLC.
Subiakto S dan Sakti I. 2012. Berita. 2012, KKP Targetkan produksi rumput laut 5.1 juta ton. Diterbitkan pada 9 April 2012.
http://www.kkp.go.id/index.php/arsip/c/7620/2012-kkp-Targetkan-Produksi-Rumput-Laut-5,1-Juta-Ton/?category_id=2. [tanggal akses 13 april 2012].
Suharsono, Trisnaningrum N, Sulistyaningsih LD, Widyastuti U. 2009. Isolation and cloning of cDNA of gene encoding for metallothionein type 2 from Melastoma affine. Biotropia. 16 (1): 28 – 37.
20
Suryati E, Fadilah S, Tenriulo A. 2011. Perkembangan kristal filamen serta pembentukan mikropropagule rumput laut Kappaphycus alvarezii melalui induksi kalus pada media PES 1/20. Makalah disajikan pada Seminar forum inovasi dan teknologi di Inna Grand Bali Beach Denpasar [ID] tanggal 19-21 Juli 2011.
Suwandana E, Kawamura K and Soeyanto E. 2011. Assessment of the heavy metal and nutrient status in the seawater, sediment and seagrass in Banten bay, Indonesia and their distributional patterns. J Fish Int. 6 (1): 18-25. ISSN:1817-3381.
Torregrosa L, Lopez G, Bouquet A. 2000. Antibiotic sensitivity of grapevine: a comparison between the effect of hygromicin and kanamycin on shoot development of transgenic 110 richter rootstock (Vitis berlandieri x Vitis rupestris). S Afr J Enol Vitic. 21 (1): 32-39. http://www.sawislibrary.co.za/dbtextimages/76344.pdf
Trisnaningrum N. 2009. Analisis ekspresi gen penyandi metallothionein tipe II pada Melastoma affine L. yang mendapat cekaman pH rendah dan aluminium.[Tesis]. Bogor [ID]: Sekolah Pascasarjana. Institut Pertanian Bogor.
Thirumaran G and Anantharaman P. 2009. Daily Growth Rate of Field Farming Seaweed Kappaphycus alvarezii (Doty) Doty ex P. Silva in Vellar Estuary. World J Fish & Marine Sci. 1(3) : 144-153. ISSN 1992-0083.
Vieira ALG, Camilo CM. 2011. Agrobacterium tumefaciens-mediated transformation of the aquatic fungus Blastocladiella emersonii. Fungal GenetBiol. 48:806–811.doi: 10.1016/j.fgb.2011.02.006.
Yulianto K dan Mira S. 2009. Budidaya makro alga Kappaphycus alvarezii
21
Lampiran 1. Prosedur pembuatan media PES cair
Pembuatan Stok PES 1liter
Diawali dengan pembuatan PII metal yaitu dengan melarutkan semua bahan dengan menggunakan akuades hingga volume akhir 250 ml. Selanjutnya seluruh bahan pembuatan PES stok di larutkan dengan menggunakan akuades hingga volume akhir media 1000 ml dan larutan di aduk hingga homogen. Media stok dapat disimpan pada suhu 4°C.
Pembuatan media PES cair
22
RIWAYAT HIDUP
Penulis dilahirkan di Sidoarjo pada tanggal 10 Juni 1986 dari ayah Sukis Haryadi dan ibu Maria Ulfah. Penulis merupakan putri pertama dari tiga bersaudara. Penulis pernah menjadi asisten praktikum beberapa mata kuliah diantaranya dasar-dasar akuakultur, analisis penyakit ikan, parasit dan penyakit ikan I dan II. Tahun 2009 penulis lulus dari Jurusan Budidaya Perikanan Fakultas Perikanan Universitas Airlangga. Pada tahun 2010, penulis diterima di Program Studi Bioteknologi pada Sekolah Pascasarjana IPB.
23