TRANSFORMASI GEN KAPPA(
κ
)-CARRAGEENASE
PADA RUMPUT LAUT Kappaphycus alvarezii
MUH. ALIAS L. RAJAMUDDIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul “Transformasi Gen Kappa(κ)-Carrageenase pada Rumput Laut Kappaphycus alvarezii” adalah benar karya bersama saya dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016
RINGKASAN
MUH. ALIAS L. RAJAMUDDIN. Transformasi Gen Kappa(κ)-Carrageenase pada Rumput Laut Kappaphycus alvarezii. Dibimbing oleh ALIMUDDIN, ENANG HARRIS dan UTUT WIDYASTUTI.
Teknologi transgenesis telah diaplikasikan untuk meningkatkan performa karakter penting organisme budidaya, diantaranya peningkatan ketahanan terhadap penyakit, kondisi lingkungan yang ekstrim, atau peningkatan kandungan produk primer. Kandungan karagenan menentukan kualitas rumput laut Kappaphycus alvarezii. Dalam rangka untuk meningkatkan kandungan kappa( )-karagenan pada K. alvarezii, pada penelitian ini gen penyandi enzim κ -Carrageenase (κ-Car) ditransformasi ke K. alvarezii dengan metode mediasi Agrobacterium tumefaciens. Gen penyandi enzim κ-Car berperan dalam
biosintesis -karagenan. Gen κ-Car dibuat dengan sintesis secara in vitro berdasarkan sekuen gen κ-Car yang berasal dari Pseudoalteromonas yang telah ada di bank gen.
Penelitian ini terdiri atas 3 (tiga) tahapan utama. Penelitian tahap pertama bertujuan menghasilkan vektor kloning dan vektor ekspresi untuk proses transformasi. Sekuen gen penyandi κ-Car disisipkan dalam plasmid pMSH untuk membuat konstruksi biner pMSH/κ-Car yang dikendalikan oleh promoter 35S CaMV (35S) dan terminator Nos (tNos). Transformasi plasmid pMSH/κ-Car pada bakteri Escherichia coli dilakukan menggunakan metode heat-shock, sedangkan pada Agrobacterium tumefaciens menggunakan metode tri-parental mating. Hasil penelitian menunjukkan bahwa koloni bakteri E. coli dan A. tumefaciens transforman dapat tumbuh pada media selektif. Analisis polymerase chain reaction (PCR) dengan cetakan DNA dari koloni bakteri tersebut menggunakan primer 35S-Forward (35S-F) dan tNos-Reverse (tNos-R) menghasilkan fragmen DNA berukuran sekitar 2.000 bp, sama dengan total ukuran sekuen promoter 35S, gen κ-Car, dan tNos. Pengurutan DNA dan analisis pensejajaran menggunakan program Basic Local Alignment Search Tool (BLAST) menunjukkan kesamaan sekuen (73-76%) fragmen gen κ-Car produk PCR dengan urutan nukleotida gen κ-Carrageenase yang telah diisolasi dari sumber lainnya yang ada di bank gen. Hasil ini juga menguatkan bahwa fragmen κ-Car yang ditransformasi ke vektor adalah sesuai yang diharapkan. Konstruksi pMSH/κ-Car berhasil dibuat dan telah dihasilkan koloni A. tumefaciens transforman positif membawa pMSH/κ-Car.
hasil amplifikasi dari K. alvarezii transgenik menggunakan primer 35S-F dan tNos-R adalah 2.000 bp, berukuran sama dengan produk PCR dari kontrol positif dengan cetakan plasmid pMSH/κ-Car. Sementara itu, tidak ada produk amplifikasi pada K. alvarezii yang tidak ditransformasi (kontrol negatif). Selanjutnya, analisis PCR menggunakan primer 35S-F dan 35S-R menunjukkan produk amplifikasi berukuran 300 bp, hal ini sama dengan ukuran sekuen promoter 35S CaMV. Dengan demikian, rumput laut K. alvarezii transgenik yang membawa κ-Car telah berhasil diproduksi.
Penelitian tahap ketiga, meliputi pemeliharaan lanjut eksplan K. alvarezii transgenik, kandidat transgenik lainnya dan non transgenik (kontrol), serta analisis ekspresi mRNA. Pemeliharaan lanjut dilakukan selama delapan bulan secara semi- steril menggunakan wadah botol kerucut volume 1500 mL yang dilengkapi sistem aerasi. Ekstraksi RNA total dari K. alvarezii transgenik dilakukan menggunakan TRIzol® Reagent dan sintesis DNA komplementer (cDNA) dilakukan menggunakan IscriptTM cDNA Synthesis Kit dengan teknik reverse transcriptase PCR (RT-PCR). Primer yang digunakan untuk gen κ-Car adalah κ-Car-F 5’-CCA CTT GCC ATT CGA CCC AAGA-γ’ dan κ-Car-R 5’-CAC CAA CGA TTT CAC CGT CAA CG-γ’ sedangkan primer untuk gen Actin sebagai kontrol internal adalah Actin-F 5’-CCG TCC CGA TTT ACG AGG GTTA-γ’ dan Actin-R 5’ -GCA TGA GGA GCT TCG CCA TCC-γ’. Hasil pemeliharaan lanjut menunjukkan sintasan eksplan K. alvarezii transgenik sebesar 100%, eksplan kandidat transgenik lainnya sebesar 36%, dan kontrol sebesar 43%, dengan jumlah tunas 2-4 per eksplan dan panjang tunas 5-18 mm. Hasil analisis kuantitatif PCR pada K. alvarezii transgenik menunjukkan tingkat ekspresi gen κ-Carrageenase dinormalisasi dengan ekspresi gen Actin adalah sebesar 0,983 untuk tunas transgenik T1 dan 0,962 pada tunas transgenik T2. Dengan demikian, gen κ -Carrageenase diekspresikan pada Kappaphycus alvarezii transgenik dengan level relatif sama.
SUMMARY
MUH. ALIAS L. RAJAMUDDIN. Transformation of Kappa(κ)-Carrageenase gene in seaweed Kappaphycus alvarezii. Supervised by ALIMUDDIN, ENANG HARRIS and UTUT WIDYASTUTI.
Foreign gene transformation technique have been applied to improve the valuable traits of farmed organism. Carrageenan content determines quality of seaweed Kappaphycus alvarezii. As the first step towards increasing of kappa( ) -carrageenan content in K. alvarezii, in this study kappa(κ)-Carrageenase gene (κ -Car) from Pseudoalteromonas was transformed into K. alvarezii mediated by Agrobacterium tumefaciens method. The κ-Car gene involves in -carrageenan biosynthesis.
This research consisted of three steps. The first steps of research purpose was to produce a cloning vector and an expression vector for transformation process. The κ-Car gene sequence was artificially synthesized, an then inserted in pMSH plasmid to generate a binary pMSH/κ-Car plasmid. The pMSH/κ-Car was controlled by 35S CaMV promoter (35S) and Nos terminator (tNos).
Transformation of pMSH/κ-Car to Escherichia coli as cloning vector was performed using a heat-shock method, while into Agrobacterium tumefaciens was using triparental mating method. The result showed that the transformed E. coli and A. tumefaciens colonies could grow on the selective media. PCR analysis with DNA template from bacterial colonies using 35S-Forward primer (35S-F) and tNos-Reverse (tNos-R) produced DNA fragment with size of 2,000 bp, the same size with the total length of 35S promoter, κ-Car gene, and tNos sequences. Thus pMSH/κ-Car construct and A. tumefaciens transformant carrying pMSH/κ-Car were successed to be produced.
The second steps of research purpose was to produce a transgenic K. alvarezii carrying κ-Car gene. Transfomation of κ-Car gene to K. alvarezii was conducted using A. tumefaciens mediation method. Analysis of K. alvarezii transgenic carrying κ-Car was performed by PCR method with two set primers. The result showed that survival percentage posttransformation of K. alvarezii explants was 36% and sprout was 88.9% while the percentage of transgenic was 100% out of the sprout explants samples. The size of DNA band of PCR product from K. alvarezii transformants using 35S-F and tNos-R set primers was 2,000 bp, the same size as PCR product of the positive control of pMSH/κ-Car plasmid as template, while no amplification product in non-transformated as negative control was found. Furthermore, PCR analysis using 35S-F and 35S-R set primers showed amplification product of 300 bp, the same size as the length of 35S promoter sequence. Thus, K. alvarezii transgenic carrying κ-Car gene had been generated.
CGT CAA CG-γ’. Set primers of Actin gene as internal control of mRNA loading in cDNA synthesis was Actin-F 5’-CCG TCC CGA TTT ACG AGG GTTA-γ’ and Actin-R 5’-GCA TGA GGA GCT TCG CCA TCC-γ’. Analysis of κ-Car gene expression level was carried out by quantitative real time PCR (qrt-PCR). The result of rearing culture showed that survival of transgenic K. alvarezii explants was 100%, the others transgenic candidates explant were 36% and controls was 43%. The number of shoots was 2-4 each explants, and the length of shoots was 5-8 mm. Expression analysis results of Kappaphycus alvarezii transgenic indicated the normalized expression level of κ-Carrageenase gene/Actin gene was 0.983 in T1 explant transgenic and 0.962 in T2 explant transgenic. Thus κ -Carrageenase gene was expressed in similar level in Kappaphycus alvarezii transgenic.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Akuakultur
TRANSFORMASI GEN KAPPA(
κ
)-CARRAGEENASE
PADA RUMPUT LAUT Kappaphycus alvarezii
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Penguji pada Ujian Tertutup: Dr Raden Roro Sri Puji Sinarni Dewi Dr Dinamella Wahjuningrum
Judul Disertasi : Transformasi Gen Kappa(κ)-Carrageenase pada Rumput Laut Kappaphycus alvarezii Nama : Muh. Alias L. Rajamuddin
NIM : C161110021
Disetujui oleh Komisi Pembimbing
Dr Alimuddin, SPi, MSc Ketua
Prof Dr Ir Enang Harris, MS Anggota
Dr Ir Utut Widyastuti, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian Tertutup: 2 Agustus 2016 Tanggal Sidang Promosi: 16 Agustus 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulisan disertasi ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2014 ini adalah Aplikasi teknologi transgenesis rumput laut, dengan judul “Transformasi Gen Kappa(κ)-Carrageenase pada Rumput Laut Kappaphycus alvarezii”. Penelitian ini mencakup pembuatan konstruksi plasmid biner pMSH/κ-Car, transformasi dan pemeliharaan lanjut K. alvarezii transgenik serta analisis ekspresi.
Penghargaan dan ucapan terima kasih penulis sampaikan kepada Bapak Dr Alimuddin, Bapak Prof Enang Harris, Ibu Dr Utut Widyastuti (alm), dan Bapak Prof. Komar Sumantadinata (alm), selaku komisi pembimbing, serta kepada Ibu Dr Raden Roro Sri Pudji Sinarni Dewi dan Ibu Dr Dinamella Wahjuningrum sebagai penguji luar komisi atas saran penyempurnaan pada disertasi ini.
Penelitian ini merupakan salah satu bagian yang dibiayai program kerjasama penelitian antara Balai Penelitian dan Pengembangan Budidaya Air Payau (BPPBAP), Kementerian Kelautan dan Perikanan dengan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), IPB a.n. Dr Utut Widyastuti. Untuk itu, ucapan terima kasih kepada Pimpinan beserta semua staf di BPPBAP Maros, dan ucapan terima kasih yang sama kepada Pimpinan beserta semua staf di PPSHB-IPB, atas bantuan alat dan bahan selama pelaksanaan penelitian. Terima kasih kepada teman-teman seperjuangan di Lab. Biorin dan Kultur Jaringan PPSHB-IPB. Terima kasih kepada Bapak/Ibu dosen dan semua staf di Program Studi Ilmu Akuakultur (AKU)-IPB, serta teman-teman seperjuangan di prodi AKU, spesial S3 AKU 2011. Terima kasih dan penghargaan kepada Pimpinan dan semua staf di Politeknik Pertanian Negeri Pangkep tempat penulis mengabdi, atas izin dan segala bantuan yang diberikan.
Terima kasih khusus disampaikan kepada isteri tercinta Nurjanna, S.Pi, anak-anakku: N. Abdi Sahab L.Rajamuddin, N. Putra Shafar L.Rajamuddin, N. Agung Ramadhan L.Rajamuddin. Hormat dan sujud kepada ayahanda L.Rajamuddin, ibunda Husniah dan mertua A.Hawiyah Krg Tonji. Terima kasih juga kepada saudara-saudaraku/ipar, serta seluruh keluarga, atas segala bantuan, doa dan kasih sayangnya selama penulis melaksanakan pendidikan Doktor. Spesial kepada Palem 6 Group, Forum Mahasiswa Pascasarjana IPB Sul-Sel, Badminton Club, kolega, semua pihak yang tidak sempat disebut satu per satu. Semoga disertasi ini bermanfaat.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN x
DAFTAR ISTILAH xi
1 PENDAHULUAN UMUM 1
1.1 Latar Belakang 1
1.2 Perumusan Masalah 2
1.3 Hipotesis 3
1.4 Tujuan Penelitian 3
1.5 Manfaat Penelitian 3
1.6 Ruang Lingkup Penelitian 3
1.7 Kebaruan Penelitian (Novelty) 4
2 TINJAUAN PUSTAKA 5
2.1 Biologi Rumput Laut Kappaphycus alvarezii 5
2.2 Karagenan pada Rumput Laut Kappaphycus alvarezii 5
2.3 Teknologi Transgenesis 7
2.4 Transformasi Gen dengan Perantara Agrobacterium tumefaciens 8 3 KONSTRUKSI VEKTOR BINER GEN KAPPA(κ)-CARRAGEENASE
DAN TRANSFORMASI KE Agrobacterium tumefaciens SEBAGAI
MEDIA UNTUK PEMBUATAN RUMPUT LAUT TRANSGENIK 11
3.1 Pendahuluan 12
3.2 Metode Penelitian 13
3.2.1 Tempat dan Waktu Penelitian 13
3.2.2 Sekuen dan Sumber Gen κ-Carrageenase 13 3.2.3 Pembuatan Vektor Ekspresi pMSH/κ-Car 13 3.2.4 Transformasi pMSH/κ-Car ke Escherichia coli DH5α 14 3.2.5 Transformasi pMSH/κ-Car ke Agrobacterium tumefaciens 15 3.2.6 Pengurutan DNA dan Analisis Kesejajaran Gen κ-Carrageenase 16
3.3 Hasil dan Pembahasan 16
3.3.1 Vektor Ekspresi pMSH/κ-Car 16
3.3.2 Identifikasi Transforman Escherichia coli DH5α 16 3.3.3 Identifikasi Agrobacterium tumefaciens Transforman 18 3.3.4 Pengurutan DNA dan Analisis Kesejajaran Gen κ-Carrageenase 19
3.4 Simpulan 20
4 TRANSFORMASI GEN KAPPA(κ)-CARRAGEENASE PADA RUMPUT
LAUT Kappaphycus alvarezii 21
4.1 Pendahuluan 22
4.2 Bahan dan Metode 23
vii
4.2.2 Preparasi Talus dan Sumber Eksplan Steril Kappaphycus
alvarezii 23
4.2.3 Transformasi Gen κ-Carrageenase pada Kappaphycus alvarezii 23 4.2.4 Pemeliharaan Eksplan Kappaphycus alvarezii Pascatransformasi 24 4.2.5 Analisis DNA Rumput Laut K. alvarezii Transgenik dengan PCR 24
4.3 Hasil dan Pembahasan 24
4.3.1 Pertumbuhan Eksplan Kappaphycus alvarezii Pascatransformasi 24 4.3.2 Identifikasi Rumput Laut K. alvarezii Transgenik dengan PCR 26
4.4 Simpulan 27
5 PEMELIHARAAN LANJUT EKSPLAN Kappaphycus alvarezii
TRANSGENIK DAN ANALISIS EKSPRESI mRNA 28
5.1 Pendahuluan 29
5.2 Metode Penelitian 29
5.2.1 Tempat dan Waktu Penelitian 29
5.2.2 Pemeliharaan Lanjut Eksplan/Tunas K. alvarezii Transgenik 30 5.2.3 Analisis Ekspresi Gen κ-Carrageenase dengan q-PCR 30
5.3 Hasil dan Pembahasan 31
5.3.1 Pemeliharaan Lanjut Eksplan/Tunas K. alvarezii Transgenik 31 5.3.2 Analisis Ekspresi Gen κ-Carrageenase 33
5.4 Simpulan 35
6 PEMBAHASAN UMUM 36
7 SIMPULAN UMUM DAN SARAN 39
7.1 Simpulan Umum 39
7.2 Saran 39
DAFTAR PUSTAKA 40
LAMPIRAN 46
DAFTAR TABEL
1 Analisis kesejajaran fragmen nukleotida gen κ-Carrageenase
menggunakan program BLAST 20
2 Persentase eksplan hidup dan bertunas dari eksplan Kappaphycus alvarezii hasil perlakuan transformasi gen κ-Carrageenase (κ-Car) 25 3 Pertumbuhan panjang tunas dan jumlah tunas pada eksplan
transgenik, kandidat transgenik dan kontrol hasil pemeliharaan pada
kultur pembesaran secara semi-steril 32
4 Hasil kuantifikasi cDNA Kappaphycus alvarezii transgenik (T) dan non transgenik (NT) menggunakan mesin Nanodrop-2000 33 5 Nilai Cт (cycle of threshold) dan rasio Cт gen κ-Carrageenase (κ
-Car) dan gen Actin dari masing-masing cDNA Kappaphycus
alvarezii transgenik (T1 dan T2) 34
DAFTAR GAMBAR
1 Kerangka alir penelitian transformasi gen Kappa(κ)-Carrageenase pada rumput laut Kappaphycus alvarezii (Doty) 4 2 Morfologi dan warna talus Kappaphycus alvarezii: coklat (A), coklat
kemerahan (B), dan hijau (C) 5
3 Perbedaan stereotipe struktur molekul dan posisi ion sulfat dari tiga
tipe karagenan (Campo et al. 2009) 6
4 Struktur kimia dan pembentukan kappa-karagenan dari bentuk
sebelumnya mu-karagenan, oleh enzim sulfohydrolase κ-Carrageenase (Meta Cyc Pathway: carrageenan biosynthesis 2015) 7
5 Ilustrasi mekanisme transformasi genetik menggunakan perantara Agrobacterium tumefaciens (Tzfira & Citovsky 2002) 10 6 Sekuen gen κ-Carrageenase berukuran sekitar 1.300 bp; highlight
warna hijau: start codon; warna kuning: stop codon (B), diligasi ke vektor kloning pJET1.2 (A) menghasilkan plasmid pJET1.2-Emblcds-Carrageenase dengan ukuran total 4.168 bp 13 7 Peta plasmid pMSH (NAIST, Japan) (A) dan posisi insersi gen κ
-Carrageenase (κ-Car) di daerah MCS plasmid pMSH, RB: right border, pNos: promoter Nos, NPT II: gen marka seleksi neomycin phosphotransferase II, T: terminator Nos, HPT: gen marka seleksi hygromycin phosphotransferase, p35S: promoter 35S CaMV, MCS:
multiple cloning site, LB: left border 14
8 Peta plasmid pMSH/κ-Car: gen κ-Carrageenase (κ-Car) tersisip pada situs NotI dan SpeI di daerah multiple cloning site (MCS) pada vektor pMSH. Panjang total sekuen dari p35S hingga terminator Nos pada
plasmid pMSH/κ-Car adalah 2.000 bp 16
ix
koloni E. coli pada media LA tanpa antibiotik marka seleksi, sebagai
kontrol positif (C) 17
10 Master plate (replika) koloni Escherchia coli DH5α transforman (A), elektroforegram hasil amplifikasi PCR menggunakan primer 35S-F dan tNnos-R menghasilkan fragmen sekitar 2.000 bp (kepala panah) (B), M: marka gene ruler 1kb DNA ladder, K+: plasmid pMSH/κ -Car sebagai kontrol positif, K-: koloni tanpa transformasi sebagai kontrol negatif, E1-E5: koloni bakteri E. coli DH5α hasil
transformasi 17
11 Koloni A. tumefaciens transforman hasil konjugasi dapat tumbuh pada media selektif (tanda panah) yang mengindikasikan proses tri-parental mating/TPM berhasil dilakukan (A), sedangkan kultur tunggal masing-masing: Escherichia coli DH5α/donor (1), E. coli DH1 (pRK2013)/helper (2), Agrobacterium tumefaciens/resipien (3) tidak tumbuh pada media selektif, sebagai kontrol negatif (B) 18 12 Master plate (replika) koloni A. tumefaciens transforman (A), dan
elektroforegram amplikon PCR menggunakan primer 35S-F dan tNos-R dengan fragmen berukuran sekitar 2.000 bp (B). Tanda kepala panah di sebelah kanan Gambar 12B menunjukkan ukuran produk amplikon PCR, M: marka gene ruler 1kb DNA ladder, K+: plasmid pMSH/κ-Kar sebagai kontrol positif, K-: koloni tanpa transformasi
sebagai kontrol negatif 19
13 Koleksi Kappaphycus alvarezii hasil budidaya sebagai sumber eksplan (A), adaptasi pemeliharaan secara terkontrol di laboratorium (B), dan eksplan steril ukuran 7-10 mm, siap digunakan dalam proses
transfer gen (C) 23
14 Eksplan Kappaphycus alvarezii awal transformasi gen κ -Carrageenase (A), dan eksplan umur empat bulan pascatransformasi yang memiliki tunas baru dengan ukuran panjang 5-10 mm (lingkaran merah) (B) 25
15 Hasil ekstraksi DNA genom rumput laut Kappaphycus alvarezii (A), analisis PCR menggunakan primer 35S-F dan tNos-R dengan produk berukuran sekitar 2.000 bp (B), dan analisis PCR menggunakan primer 35S-F dan 35S-R dengan produk sekitar 300 bp (C). G: genom; -3 dan -5: marka dengan konsentrasi 30 ng/µl dan 50 ng/µl (BioLabs, Inc. New England); T1 dan T2: K. alvarezii transgenik; NT: K. alvarezii kontrol non-transformasi; K+: plasmid pMSH/κ-Car sebagai kontrol positif, M: marker gen ruler 1KB DNA ladder (BioLabs, Inc. New England); tanda kepala panah menunjukkan
target produk PCR 26
16 Morfologi perkembangan tunas Kappaphycus alvarezii pada wadah pembesaran semisteril di botol kerucut volume 1500 ml dengan aerasi: 2 tunas (A), 3 tunas (B) dan 4 tunas (C) 32 17 Produk RT-PCR menggunakan primer κ-Car-F dan κ-Car-R (A) dan
New England); K+: produk amplifikasi dengan cetakan plasmid
pMSH/κ-Car. 34
DAFTAR LAMPIRAN
1 Komposisi media PES (Prevasoli’s Enriched Seawater) stok 47 2 Gambar pemeliharaan secara steril eksplan Kappaphycus alvarezii
pascatransformasi menggunakan botol kultur volume 200 ml dengan
penggoyangan 48
3 Komposisi bahan bufer ekstraksi DNA dengan metode CTAB 2x 49 4 Gambar pemeliharaan lanjut semi steril eksplan Kappaphycus alvarezii
transgenik menggunakan botol kerucut volume 1500 ml yang dilengkapi
DAFTAR ISTILAH
35SCaMV : cauliflower mosaic virus (salah satu promoter kuat) bp : base pair (pasang basa)
cDNA : complementary DNA
ddH2O : double distilled H2O/sterile distilled water DEPC : diethylpyrocarbonate
DMSO : dimethyl sulfo oxide DNA : deoxyribonucleic acid
EDTA : ethylenediaminetetraacetic acid GFP : green fluorescent protein
IPTG : isopropanoltio- -D-galaktopiranosida κ-Car : gen penyandi enzim κ-Carrageenase LA : Luria Bertani + Agar
LB : Luria Bertani MCS : multiple cloning site mRNA : messenger RNA
PCR : polymerase chain reaction
PES : Provasoli enriched seawater (media kultur alga)
Plasmid biner : sistem plasmid di Agrobacterium tumefaciens untuk mentransfer segmen T-DNA yang membawa gen ke inang
pMSH : vektor/plasmid biner pMSH q-PCR : quantitative real time- PCR RNA : ribonucleic acid
RT-PCR : reverse transcription-PCR
Sel kompoten : sel yang tingkat permeabilitas membran selnya telah mampu dilewati plasmid DNA
SOD : superoxide dismutase
T-DNA : transfer-DNA/deoxyribonucleic acid TFB : transformation buffer
TPM : tri-parental mating
Transformasi : proses introduksi gen asing yang menyandikan karakter tertentu ke inang
1
PENDAHULUAN UMUM
1.1 Latar Belakang
Kappaphycus alvarezii adalah salah satu spesies rumput laut dari kelompok alga merah Rhodophyceae (Neish 2005b), yang mempunyai nilai ekonomis tinggi dengan produk hidrokoloid kappa karagenan (κ-karagenan). Karagenan merupakan bahan yang memiliki aplikasi sangat luas (McHugh 2003) baik pada industri farmasi, kosmetika, makanan, minuman, cat, industri tekstil, industri pesawat terbang, atau dapat digunakan untuk menghasilkan sekitar 500 jenis produk akhir (end products) (DPDPB-KKP 2011). Kompleksitas nilai guna rumput laut yang begitu besar sebagai penunjang kebutuhan hidup masyarakat dunia membuat rumput laut saat ini menjadi komoditas yang prospektif dan telah menjadi bagian dari kebutuhan global. Pertumbuhan penduduk dunia yang semakin pesat, akan diiringi oleh semakin tingginya tuntutan kebutuhan hidup masyarakat, sehingga kebutuhan karagenan diprediksi akan mengalami kenaikan secara signifikan.
Upaya-upaya peningkatan produksi karagenan dari rumput laut, yang selama ini telah dilakukan pemerintah antara lain melalui kebijakan: intensifikasi (perbaikan teknologi budidaya), ekstensifikasi (perluasan areal budidaya), dan diversifikasi spesies (pengembangan spesies rumput laut lainnya penghasil karagenan selain K. alvarezii) (DPDPB-KKP 2011). Selain itu, peningkatan produksi karagenan juga dapat dilakukan dengan perbaikan mutu genetik rumput laut, seperti: kegiatan seleksi klon, hibridisasi somatik dan zigotik, ataupun rekayasa genetik dengan transgenesis (Yuwono 2006 ; Nasir 2002).
Teknologi transgenesis merupakan terobosan teknis dalam pemuliaan karena dilakukan pada level molekul DNA. Modifikasi genetik pada genom inang dilakukan secara terarah dengan melakukan penyisipan gen asing yang menyandikan karakter tertentu dan dapat memprediksi sifat-sifat baru yang akan muncul pada inang hasil rekayasa (Yuwono 2006). Transfer gen asing ke inang dengan cara memasukkan DNA asing ke dalam nukleus sel target dan menggabungkannya ke genom inang. Transformasi karakter-karakter genetik baru atau over-ekspresi ke suatu individu diharapkan dapat diwariskan ke keturunannya (Lutz 2001).
Aplikasi teknologi transfer gen atau transgenesis telah banyak dilakukan pada berbagai spesies ikan dengan tujuan seperti peningkatan pertumbuhan (Devlin et al. 2004 ; Kobayashi et al. 2007), resistensi penyakit (Dunham et al. 2002) dan daya tahan terhadap kondisi lingkungan ekstrim (Wang et al. 1995; Wu et al. 1998), sedangkan aplikasi transgenesis pada rumput laut (alga) juga sudah mulai dikembangkan dan telah memperlihatkan potensi yang besar di masa mendatang (Hallmann 2007; Walker et al. 2005), misalnya dalam rangka peningkatan kandungan karagenan, ketahanan pada lingkungan yang ekstrim dan peningkatan resistensi terhadap penyakit. Potvin & Zhang (2010) juga menyebutkan tentang prospek rekombinan protein pada mikroalga transgenik.
2
seperti: gen isoenzim superoxide dismutase (SOD) pada Haematococcus pluvialis Chlorophyceae (Wang et al. 2011); gen manganese SOD dari dua strains Gracilaria lemaneiformis Gracilariaceae-Rhodophyta (Lu et al. 2012).
Pada K. alvarezii telah sukses dilakukan transfomasi gen green fluorescent protein (GFP) menggunakan promoter berbeda (Rajamuddin et al. 2014); gen LacZ (Wang et al. 2010); gen PaCS (penyandi sitrat sintase) (Daud et al. 2013); gen lisozim-c (Handayani et al. 2014); dan gen metallothionein tipe II (Fajriah et al. 2014).
Hingga saat ini belum ada penelitian yang terkait transformasi genetik rumput laut K. alvarezii menggunakan gen κ-Carrageenase, sehingga penelitian ini bertujuan mentransformasi gen yang menyandikan protein enzim κ -Carrageenase ke K. alvarezii menggunakan metode mediasi Agrobacterium tumefaciens. Gen ini berperan sebagai regulator dalam sintesis κ-karagenan dalam tubuh K. alvarezii. Rumput laut K. alvarezii hasil transformasi diharapkan dapat mengekspresikan gen κ-Carrageenase (over ekspresi), dalam rangka perakitan rumput laut K. alvarezii yang memiliki kandungan κ-karagenan lebih tinggi.
1.2 Perumusan Masalah
Kebutuhan bahan baku karagenan dari rumput laut K. alvarezii, dalam negeri maupun ekspor terus meningkat seiring berkembangnya konsumsi masyarakat dunia yang sumbernya dari produk olahan karagenan dan derivatnya seperti fungsi emulsifier, pensuspensi, pengental pada industri: makanan, minuman, pembuatan kertas, serta kosmetik dan farmasi (obat-obatan).
Upaya peningkatan produksi karagenan telah banyak dilakukan, diantaranya: penambahan luasan areal budidaya, perbaikan teknologi budidaya, dan diversifikasi spesies. Karakteristik budidaya rumput laut K. alvarezii di perairan pantai yang sepenuhnya bergantung pada kondisi perairan (water base culture), menyebabkan sangat kecil kemungkinan untuk dilakukan intervensi lingkungan seperti pemberian pupuk dalam upaya peningkatan produksi budidaya, ataupun pengobatan dalam rangka pengendalian penyakit.
Dengan karakter budidaya rumput laut K. alvarezii tersebut, sehingga salah satu upaya alternatif yang efektif untuk peningkatan produksi karagenan adalah melalui rekayasa genetik dengan transgenesis. Peningkatan mutu genetik dengan transgenesis memiliki keutamaan, diantaranya: dapat dilakukan secara terarah (menyisipkan gen penyandi dan menghasilkan karakter yang diinginkan), dan sekali sukses terintegrasi ke genom inang, maka karakter tersebut dapat diwariskan ke keturunannya.
3
1.3 Hipotesis
a. Gen κ-Carrageenase dapat ditransformasi ke rumput laut K. alvarezii menggunakan metode mediasi Agrobacterium tumefaciens.
b. Rumput laut K. alvarezii hasil transformasi, dapat mengekspresikan gen κ-Carrageenase.
1.4 Tujuan Penelitian
Tujuan umum dari penelitian ini adalah untuk mendapatkan rumput laut
Kappaphycus alvarezii yang mengekspresikan gen penyandi enzim κ-Carrageenase, dalam rangka perakitan rumput laut K. alvarezii dengan karakter
kandungan karagenan lebih tinggi.
Penelitian ini terdiri atas tiga tahap, dengan masing-masing tujuan sebagai berikut :
a. Menghasilkan vektor kloning dan vektor ekspresi untuk transformasi gen κ-Carrageenase ke rumput laut K. alvarezii.
b. Menghasilkan rumput laut K. alvarezii transgenik mengandung gen κ-Carrageenase
c. Menganalisis tingkat ekspresi gen κ-Carrageenase pada rumput laut K. alvarezii transgenik yang dipelihara lebih lanjut.
1.5 Manfaat Penelitian
Penelitian ini diharapkan dapat menyediakan rumput laut K. alvarezii yang mempunyai karakter kandungan karagenan tinggi. Rumput laut hasil transformasi ini diharapkan menjadi salah satu alternatif efektif dalam rangka peningkatan produksi karagenan dari rumput laut K. alvarezii.
Hasil penelitian ini juga diharapkan menjadi acuan dan referensi dalam mentransformasikan gen target yang menyandikan karakter lainnya ke rumput laut K. alvarezii, seperti: gen ketahanan terhadap penyakit, gen ketahanan dari kondisi lingkungan yang ekstrim, ataupun gen pertumbuhan cepat, pada penelitian-penelitian berikutnya.
1.6 Ruang Lingkup Penelitian
4
Gambar 1 Kerangka alir penelitian transformasi gen Kappa(κ)-Carrageenase pada rumput laut Kappaphycus alvarezii
1.7 Kebaruan Penelitian (Novelty)
2
TINJAUAN PUSTAKA
2.1 Biologi Rumput Laut Kappaphycus alvarezii
Rumput laut tergolong tanaman tingkat rendah, umumnya di alam tumbuh melekat pada substrat tertentu seperti karang, lumpur, pasir, batu, benda keras lainnya ataupun dapat melekat pada tumbuhan lain secara epifitik. Tanaman ini tidak mempunyai akar, batang maupun daun sejati tetapi hanya menyerupai batang yang disebut talus (Neish 2005b). Untuk pertumbuhannya, rumput laut mengambil nutrisi dari sekitarnya secara difusi melalui dinding talusnya (Neish 2005b). Secara taksonomi rumput laut dikelompokkan ke dalam divisio Thallophyta (Rhodophyta). Berdasarkan kandungan pigmennya, Kappaphycus alvarezii dikelompokkan dalam kelas Rhodophyceae (ganggang merah), bangsa Gigartinales, suku Solierisceae, marga Eucheuma (Neish 2005a). Kappaphycus alvarezii atau Eucheuma cottonii tergolong penghasil karagenan tipe kappa (kappa-karagenan mempunyai sifat gel yang kuat atau rigid), dari dasar ini sehingga para ahli taksonomi dan klasifikasi sepakat merubah nama spesiesnya menjadi Kappaphycus alvarezii.
Gambar 2 Morfologi dan warna talus Kappaphycus alvarezii: coklat (A), coklat kemerahan (B), dan hijau (C)
Ciri-ciri K. alvarezii yaitu talus silindris, permukaan licin, cartilageneus menyerupai tulang rawan muda, serta berwarna hijau terang, hijau olive dan coklat kemerahan (Gambar 2). Warna talus tidak menjadi pedoman utama dalam klasifikasi dan pengenalan jenis, karena tidak stabil dan sangat dipengaruhi oleh substrat dan lingkungan perairan di mana rumput laut tumbuh dan dibudidayakan (Sukardi et al. 2005). Percabangan talus berujung runcing atau tumpul, ditumbuhi nodulus (tonjolan), dan duri lunak atau tumpul untuk melindungi gametangia. Percabangan bersifat alternatus (berseling), tidak teratur serta dapat bersifat dichotomus (percabangan dua-dua) atau trichotomus (sistem percabangan tiga-tiga). Umumnya perkembangbiakan dan perbanyakan K. alvarezii dilakukan masyarakat pembudidaya secara vegetatif dengan cara stek yaitu potongan talus yang kemudian tumbuh menjadi tanaman baru (Neish 2005a).
2.2 Karagenan pada Rumput Laut Kappaphycus alvarezii
6
untuk keluarga polisakarida linear yang diperoleh dari rumput laut merah dan penting untuk pangan. Dalam bidang industri, tepung karagenan berfungsi sebagai stabilisator (pengatur keseimbangan), thickener (bahan pengental), pembentuk gel dan lain-lain. Karagenan merupakan getah rumput laut yang diperoleh dari hasil ekstraksi dengan menggunakan air panas atau larutan alkali pada suhu tinggi (Glicksman 1983). Karagenan hasil ekstraksi dapat diperoleh melalui pengendapan dengan alkohol: methanol, etanol dan isopropanol (Winarno 1996).
Karagenan di dalam talus Eucheuma terdapat pada dinding sel. Dinding sel alga merah tersusun atas dua lapisan, yaitu lapisan dalam dan lapisan luar. Lapisan dalam yang lebih keras banyak mengandung selulosa, sedangkan lapisan luar terdiri atas substansi pektik yang mengandung agar dan karagenan.
Karagenan adalah galaktan tersulfatasi linear hidrofilik. Galaktan tersulfatasi ini diklasifikasi menurut adanya unit 3,6-anhydro D-galactose (DA) dan posisi gugus sulfat (Campo et al. 2009). Selain galaktosa dan sulfat, beberapa karbohidrat juga ditemui, seperti xylose, glucose, uronic acids, dan substituen seperti methyl esters dan grup pyruvate (Van de Velde 2002).
Karagenan merupakan senyawa hidrokoloid yang terdiri atas ester kalium, natrium, magnesium, dan kalium sulfat dengan galaktosa 3,6 anhidrogalaktosa kopolimer. Karagenan adalah suatu bentuk polisakarida linear dengan berat molekul lebih dari 100 kDa (Winarno 1996). Karagenan tersusun dari perulangan unit-unit galaktosa dan 3,6-anhidro galaktosa (3,6-AG). Keduanya baik yang
berikatan dengan sulfat atau tidak, dihubungkan dengan ikatan glikosidik α–1,3
dan -1,4 secara bergantian (Villanueva & Montaño 2003).
Didasarkan pada stereotipe struktur molekul dan posisi ion sulfatnya, karagenan dibedakan menjadi tiga macam, yaitu: kappa, iota dan lambda karagenan (Gambar 3). Ketiganya berbeda dalam sifat gel dan reaksinya terhadap protein (Villanueva & Montaño 2003). Pembentukan DA atau pengurangan sulfat merupakan reaksi penting dan dikenal sebagai reaksi karagenan serta digunakan untuk meningkatkan sifat gelasi (Campo et al. 2009). Jenis karagenan yang berbeda ini diperoleh dari spesies Rhodophyta yang berbeda. Menurut Glicksman (1983), terdapat tiga fraksi karagenan yang bernilai penting, yaitu kappa, iota dan lambda, serta empat fraksi yang kurang penting yaitu mu, nu, theta dan xi. Karagenan mu adalah prekursor karagenan kappa, sedangkan karagenan nu adalah prekursor karagenan iota (Campo et al. 2009).
Gambar 3 Perbedaan stereotipe struktur molekul dan posisi ion sulfat dari tiga tipe karagenan (Campo et al. 2009)
7
kappa karagenan dihasilkan dari rumput laut jenis cottonii, iota karagenan dihasilkan dari Eucheuma spinosum, sedangkan lambda karagenan dari Chondrus crispus.
Kappa karagenan tersusun dari α(1,γ)-D-galaktosa-4-sulfat dan (1,4) -3,6-anhidro-D-galaktosa. Karagenan juga mengandung D-galaktosa-6-sulfat ester dan 3,6-anhidro-D-galaktosa-2-sulfat ester. Iota karagenan ditandai dengan adanya 4-sulfat ester pada setiap residu D-glukosa dan gugus 2-4-sulfat ester pada setiap gugus 3,6-anhidro-D-galaktosa. Lambda karagenan berbeda dengan kappa dan iota karagenan, karena memiliki residu disulfat (1-4) D-galaktosa, sedangkan kappa dan iota karagenan selalu memiliki gugus 4-fosfat ester (Winarno 1996). Secara alami, dalam tubuh rumput laut, jenis karagenan kappa dibentuk secara enzimatis dari prekursornya oleh enzim sulfohydrolase κ-Carrageenase. Karagenan mu adalah prekursor dari kappa-karagenan (Gambar 4).
Gambar 4 Struktur kimia dan pembentukan kappa-karagenan dari bentuk
sebelumnya mu-karagenan, oleh enzim sulfohydrolase κ-Carrageenase (Meta Cyc Pathway: carrageenan biosynthesis 2015)
Menurut Doty (1987), rumput laut yang dihasilkan di Indonesia sampai saat ini masih tergolong berkualitas rendah dilihat dari indeks nilainya. Rumput laut standar, memiliki clean anhydrous carrageenan yield (CAY) atau kandungan karagenan dalam rumput laut bersih dan kering, sebesar 40% sedangkan rumput laut berkualitas rendah memiliki CAY sebesar 30%.
2.3 Teknologi Transgenesis
8
dapat diskenario untuk mampu menghasilkan bahan pangan yang lebih bergizi sehingga dapat meningkatkan kesehatan manusia.
Teknologi transgenesis merupakan suatu proses mentransformasi DNA asing ke organisme lain dengan maksud untuk memanipulasi struktur genetiknya (Glick & Pasternak 2003). Gen yang disisipkan ke dalam genom inang target harus dapat diekspresikan sehingga menghasilkan protein yang diinginkan serta harus stabil diwariskan ke generasi berikutnya. Gen-gen yang diekspresikan pada inang target pada awalnya adalah gen-gen asli dari sumbernya : bakteri, jamur, hewan, namun kebanyakan ekspresi dari gen tersebut di dalam inang sangat rendah. Hal ini antara lain disebabkan oleh penggunaan kodon sinyal peptida yang tidak sesuai. Oleh karena itu modifikasi penggunaan kodon yang sesuai dengan inang target telah umum dilakukan untuk meningkatkan ekspresi gen. Selain itu penambahan enhancer dikombinasikan dengan penggunaan promoter kuat atau promoter spesifik dapat meningkatkan ekspresi gen pada inang. Beberapa penelitian menunjukkan bahwa apabila gen telah terintegrasi pada genom inang target maka gen tersebut akan stabil diwariskan ke generasi berikutnya.
Aplikasi transgenesis pada rumput laut (makroalga) memperlihatkan potensi besar pada masa mendatang (Hallmann 2007; Walker et al. 2005), misalnya untuk peningkatan ketahanan dari cekaman lingkungan dan resistensi terhadap penyakit. Hingga saat ini penelitian transformasi gen pada makroalga telah berhasil dilakukan, antara lain: Porphyra yezoensis (Cheney et al. 2001) dan Laminaria japonica (Li et al. 2009) menggunakan gen β-glucuronidase (GUS); serta Gracilaria dengan gen LacZ (Huddy et al. 2012). Pada K. alvarezii telah sukses dilakukan transfomasi gen green fluorescent protein (GFP) menggunakan promoter berbeda (Rajamuddin et al. 2014); gen LacZ (Wang et al. 2010); gen PaCS (penyandi sitrat sintase) (Daud et al. 2013); gen lisozim-c (Handayani et al. 2014); dan gen metallothionein tipe II (Fajriah et al. 2014).
Potvin dan Zhang (2010) juga menyebutkan tentang prospek rekombinan protein pada mikroalga transgenik, serta beberapa progres transgenik pada alga lainnya. Alga sebagai sumber gen-gen baru, juga telah banyak diteliti yang nantinya akan diaplikasikan untuk kegiatan transgenesis pada alga, seperti isolasi gen antisalt dan anticadmium dari alga hijau laut Chlamydomonas sp (Tanaka et al. 2007). Kloning dan uji ekspresi gen-gen ketahanan dari kecaman lingkungan, seperti gen isoenzim SOD superoxide dismutase pada Haematococcus pluvialis Chlorophyceae (Wang et al. 2011); kloning gen, analisis ekspresi dan aktivitas gen manganese SOD dari dua strains Gracilaria lemaneiformis Gracilariaceae-Rhodophyta (Lu et al. 2012).
2.4 Transformasi Gen dengan Perantara Agrobacterium tumefaciens
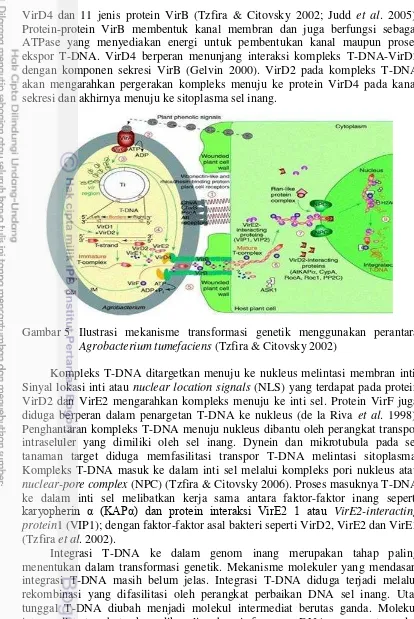
9
sitoplasma sel inang, (6) Vir E2 berasosiasi dengan utas T-DNA dan bergerak menuju sitoplasma sel inang, (7) kompleks T-DNA dimasukkan ke dalam inti sel inang melalui proses impor aktif dan (8) di dalam inti, T-DNA dibawa menuju ke titik tempat integrasi DNA pada kromoson, kemudian protein-protein pengawal T-DNA terlepas dan T-DNA akhirnya terintegrasi ke dalam genom inang.
Interaksi antara Agrobacterium dan sel inang target didahului dengan mekanisme secara kimiawi di mana sel inang yang luka menghasilkan suatu metabolit yang berperan sebagai isyarat bagi Agrobacterium. Metabolit tersebut dapat berupa senyawa gula, asam, asam amino atau senyawa fenol (Winans 1992). Adanya senyawa tersebut menginduksi Agrobacterium untuk bergerak aktif menuju ke sel sasaran. Gerakan yang bersifat kemotaksis dan untuk memperkuat kontak tersebut Agrobacterium mengeluarkan suatu metabolit yaitu -1-2-glukan. Beberapa gen dalam kromosom Agrobacterium diketahui merupakan penyandi enzim yang berperan dalam sintesis berbagai senyawa glukan, yaitu chvA, chvB, dan exoC. Gen lain pada kromosom yang berperan seperti ketiga gen tersebut adalah cel, produk cel berperan penting dalam sintesis senyawa selulosa fibril (Douglas et al. 1985; Gelvin 2000).
Induksi faktor virulensi (vir) yang akan mengatur proses pemotongan dan transfer T-DNA ke sel inang target. Beberapa metabolit yang disekresi oleh inang, akan menginduksi faktor virulensi. Metabolit tersebut adalah asetosiringon, hidroksi asetosiringon, koniferil alkohol dan etil piruvat (Winans 1992). Aktivasi gen vir dimulai dengan penerimaan sinyal oleh VirA. VirA merupakan protein sensor trans-membran yang berfungsi mendeteksi molekul sinyal berupa senyawa fenolik seperti asetosiringon. Selain itu, beberapa jenis monosakarida juga berfungsi sebagai sinyal. Deteksi monosakarida dimungkinkan oleh adanya interaksi dan asosiasi antara protein VirA dengan ChvE yang berfungsi sebagai protein pengikat gula (glukosa/galaktosa) pada periplasma (de la Riva et al. 1998). Protein dari VirA ini akan menginduksi VirG melalui fosforilasi, yang selanjutnya VirG akan mengaktifkan ekspresi berbagai Vir lainnya (Winans 1992). Induksi protein-protein Vir dikontrol oleh dua komponen sistem yaitu VirA/G (Rosen & Ron 2011).
Protein yang dihasilkan oleh gen Vir berperan untuk memotong dan mentransfer T-DNA ke inang. Proses perpindahan T-DNA ke sel tanaman diawali dengan pemotongan utas T-DNA dari plasmid Ti. Protein VirD1 dan VirD2 yang memiliki aktivitas endonuklease akan mengenali sekuen batas T-DNA dan memotong utas DNA pada posisi tersebut dan melepaskan utas tunggal T-DNA. Setelah pemotongan, protein VirD2 tetap terikat secara kovalen pada ujung 5’ utas T-DNA (batas kanan). Asosiasi VirD2 melindungi T-DNA dari aktivitas
eksonuklease pada ujung 5’ T-DNA dan juga berfungsi membedakan ujung 5’ T-DNA (batas kanan) sebagai ujung yang akan ditransfer terlebih dahulu ke sel tanaman. Sintesis utas T-DNA dimulai dari batas kanan T-DNA dan berlangsung
dalam arah 5’ ke γ’. Kompleks utas tunggal T-DNA-VirD2 diselubungi oleh VirE2. Asosiasi protein ini mencegah serangan nuklease dan berfungsi membentangkan utas kompleks T-DNA sehingga bentuknya menjadi lebih ramping dan mudah melintasi kanal membran (de la Riva et al. 1998).
10
VirD4 dan 11 jenis protein VirB (Tzfira & Citovsky 2002; Judd et al. 2005). Protein-protein VirB membentuk kanal membran dan juga berfungsi sebagai ATPase yang menyediakan energi untuk pembentukan kanal maupun proses ekspor T-DNA. VirD4 berperan menunjang interaksi kompleks T-DNA-VirD2 dengan komponen sekresi VirB (Gelvin 2000). VirD2 pada kompleks T-DNA akan mengarahkan pergerakan kompleks menuju ke protein VirD4 pada kanal sekresi dan akhirnya menuju ke sitoplasma sel inang.
Gambar 5 Ilustrasi mekanisme transformasi genetik menggunakan perantara Agrobacterium tumefaciens (Tzfira & Citovsky 2002)
Kompleks T-DNA ditargetkan menuju ke nukleus melintasi membran inti. Sinyal lokasi inti atau nuclear location signals (NLS) yang terdapat pada protein VirD2 dan VirE2 mengarahkan kompleks menuju ke inti sel. Protein VirF juga diduga berperan dalam penargetan T-DNA ke nukleus (de la Riva et al. 1998). Penghantaran kompleks T-DNA menuju nukleus dibantu oleh perangkat transpor intraseluler yang dimiliki oleh sel inang. Dynein dan mikrotubula pada sel tanaman target diduga memfasilitasi transpor T-DNA melintasi sitoplasma. Kompleks T-DNA masuk ke dalam inti sel melalui kompleks pori nukleus atau nuclear-pore complex (NPC) (Tzfira & Citovsky 2006). Proses masuknya T-DNA ke dalam inti sel melibatkan kerja sama antara faktor-faktor inang seperti
karyopherin α (KAPα) dan protein interaksi VirEβ 1 atau VirE2-interacting protein1 (VIP1); dengan faktor-faktor asal bakteri seperti VirD2, VirE2 dan VirE3 (Tzfira et al. 2002).
[image:32.595.63.477.77.696.2]11
3
KONSTRUKSI VEKTOR BINER GEN
KAPPA(Κ)-CARRAGEENASE DAN TRANSFORMASI KE Agrobacterium
tumefaciens SEBAGAI MEDIA UNTUK PEMBUATAN
RUMPUT LAUT TRANSGENIK
ABSTRAK
Peningkatan kandungan kappa( )-karagenan pada rumput laut Kappaphycus alvarezii berpotensi dicapai melalui aplikasi teknologi transgenesis. Penelitian ini dilakukan untuk mendapatkan konstruksi gen κ-Carrageenase, dan Agrobacterium tumefaciens membawa konstruksi gen tersebut. Gen penyandi enzim κ-Carrageenase (κ-Car) berperan dalam biosintesis -karagenan. Sekuen gen κ-Car diligasi antara sekuen promoter 35S CaMV dan terminator Nos untuk menghasilkan vektor ekspresi pMSH/κ-Car. Ekspresi gen κ-Car pada plasmid pMSH/κ-Car diatur oleh promoter 35S CaMV dan terminator Nos. Transformasi plasmid pMSH/κ-Car ke bakteri Escherichia coli dilakukan menggunakan metode heat-shock, sedangkan ke Agrobacterium tumefaciens menggunakan metode tri-parental mating. Hasil penelitian menunjukkan bahwa beberapa koloni bakteri E. coli dan A. tumefaciens tumbuh pada media selektif yang mengandung antibiotik. Analisis PCR dengan cetakan DNA dari koloni bakteri E. coli dan A. tumefaciens tersebut menggunakan primer 35S-Forward dan tNos-Reverse menghasilkan fragmen DNA berukuran sekitar 2.000 bp, sama dengan total ukuran sekuen promoter 35S CaMV, gen κ-Car, dan terminator tNos. Hal tersebut menunjukkan bahwa konstruksi pMSH/κ-Car telah berhasil dibuat, dan koloni A. tumefaciens transforman positif membawa plasmid pMSH/κ-Car telah dihasilkan.
Kata kunci: Agrobacterium tumefaciens, gen Kappa(κ)-Carrageenase, transgenesis, vektor
BINARY VECTOR
CONSTRUCTION OF KAPPA(
κ
)-CARRAGEENASE GENE AND TRANSFORMATION TO
Agrobacterium tumefaciens AS MEDIATOR FOR SEAWEED
TRANSGENIC GENERATION
ABSTRACT
12
those bacterial colonies resulted DNA fragment of about 2,000 bp, the same as the total length of 35S CaMV promoter, κ-Car gene and tNos terminator sequences. Thus, the pMSH/κ-Car gene construct succeed to make and A. tumefaciens transformant carrying pMSH/κ-Car plasmid have been produced.
Keywords: Agrobacterium tumefaciens, Kappa(κ)-Carrageenase gene, transgenesis, vector
3.1 Pendahuluan
Peningkatan kandungan karagenan pada rumput laut Kappaphycus alvarezii merupakan salah satu target rekayasa gen (transgenesis) yang sangat potensial
untuk dilakukan. Hal tersebut dapat dicapai dengan menyisipkan gen κ-Carrageenase penyandi enzim yang terlibat dalam biosintesis karagenan.
Aplikasi transgenesis pada rumput laut (alga) memperlihatkan potensi besar pada masa mendatang (Walker et al. 2005; Hallmann 2007; Potvin & Zhang 2010). Beberapa penelitian transgenik pada alga yang telah berhasil dilakukan, antara lain: pengujian ekspresi gen -glucuronidase (GUS) pada Laminaria japonica (Li et al. 2009), gen LacZ pada Gracilaria (Huddy et al. 2012), gen Sitrat sintase pada K. alvarezii (Daud et al. 2013), gen green fluorescent protein (GFP) pada K. alvarezii (Rajamuddin et al. 2014), gen lisozim pada K. alvarezii (Handayani et al. 2014), dan gen Metallothionein tipe II pada K. alvarezii (Fajriah et al. 2014).
Dalam rangka pembuatan rumput laut transgenik, dua tahap awal diperlukan yaitu pembuatan vektor ekspresi gen dan penyediaan bakteri transforman sebagai kendaraan/biotransport (Muladno 2002). Terkait dengan biosintesis kappa-karagenan, telah tersedia informasi sekuen gen penyandi enzim kappa (κ )-Carrageenase (κ-Car). Gen penyandi enzim κ-Car mengonversi µ-karagenan menjadi -karagenan dalam tubuh K. alvarezii (Campo et al. 2009). Pembuatan sekuen gen secara sintetis in vitro dan pembuatan vektor ekspresi telah dapat dilakukan menggunakan metode molekuler. Selanjutnya, teknik penyediaan bakteri A. tumefaciens transforman dengan metode tri-parental mating/TPM (Bevan, 1984) juga sudah dikembangkan untuk kebutuhan pembuatan rumput laut transgenik. Tiga jenis bakteri diperlukan, yaitu Escherichia coli DH5α sebagai vektor kloning dan donor, E.coli DH1 (pRK2013) sebagai helper, dan A. tumefaciens LBA4404 sebagai resipien dalam proses TPM.
Agrobacterium tumefaciens sebagai agen transformasi, telah digunakan pada proses transformasi gen pada makroalga laut Porphyra yezoensis (Rhodopiceae) (Cheney et al. 2001; Bernasconi et al. 2004), pada K. alvarezii (Daud et al. 2013; Handayani et al. 2014; Fajriah et al. 2014), mikroalga Haematococcus pluvialis (Kathiresan et al. 2009), mikroalga laut Schizochytrium (Cheng et al. 2012), dan fungi perairan Blastocladiella emersonii (Vieira & Camilo 2011).
13
3.2 Metode Penelitian
3.2.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Biorin, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) Institut Pertanian Bogor (IPB), mulai Februari 2013 sampai Juni 2013.
3.2.2 Sekuen dan Sumber Gen κ-Carrageenase
Gen κ-Carrageenase (κ-Car) yang digunakan pada penelitian ini, disintesis secara in vitro menggunakan jasa Genetika Science (1st BASE Pte Ltd. Singapore) berdasarkan sekuen gen κ-Carrageenase yang berasal dari Pseudoalteromonas (Zhou et al. 2008) yang ada di bank gen. Sekuen gen κ-Car disisipkan sementara pada vektor kloning pJET1.2 (Gambar 6) sebelum digunakan lebih lanjut.
Gambar 6 Sekuen gen κ-Carrageenase berukuran sekitar 1.300 bp; highlight warna hijau: start codon; warna kuning: stop codon (B), diligasi ke vektor kloning pJET1.2 (A) menghasilkan plasmid pJET1.2-Emblcds-Carrageenase dengan ukuran total 4.168 bp
3.2.3 Pembuatan Vektor Ekspresi pMSH/κ-Car
Sekuen gen κ-Car dari plasmid pJET1.2 dikonstruksi ke vektor ekspresi plasmid biner pMSH (Nara Institute of Science and Technology/NAIST, Japan), dan hasil ligasi disebut pMSH/κ-Car. Plasmid biner pMSH sudah umum digunakan sebagai vektor DNA plasmid pada transgenesis yang dimediasi Agrobacterium tumefaciens.
14
Gambar 7 Peta plasmid pMSH (NAIST, Japan) (A) dan posisi insersi gen κ -Carrageenase (κ-Car) di daerah MCS plasmid pMSH, RB: right border, pNos: promoter Nos, NPT II: gen marka seleksi neomycin phosphotransferase II, T: terminator Nos, HPT: gen marka seleksi hygromycin phosphotransferase, p35S: promoter 35S CaMV, MCS: multiple cloning site, LB: left border
3.2.4 Transformasi pMSH/κ-Car ke Escherichia coli DH5α
Transformasi pMSH/κ-Car ke bakteri E. coli DH5α menggunakan metode heat-shock dan identifikasi koloni transforman (Sambrook et al. 1989 dengan beberapa modifikasi Suharsono et al. 2002).
Pembuatan Sel E. coli DH5α Kompeten
Sebuah koloni bakteri E. coli DH5α diambil dari biakan murni dan dikultur dalam 2 mL media cair Luria Bertani dalam tabung reaksi (LB: 1% tripton; 0,5% ekstrak khamir; dan 1% NaCl), sebagai sub kultur. Kemudian diinkubasi pada suhu 37 oC selama 16-18 jam pada shaker inkubator kecepatan 180 rpm. Hasil kultur segar bakteri diletakkan di atas es selama 30 menit. Sebanyak 1,5 mL disentrifugasi dengan kecepatan 10.000 rpm selama 5 menit pada suhu 4 oC. Supernatan dibuang, pelet ditambahkan transformation buffer (TFB) CaCl2 sebanyak 495 µL (0,33% dari volume 1,5 mL) dan diresuspensi, kemudian diletakkan di atas es selama 10 menit. Selanjutnya disentrifugasi dengan kecepatan 10.000 rpm selama 5 menit pada suhu 4 oC. Supernatan dibuang dan pelet ditambahkan dengan TFB sebanyak 125 µL (0,08% dari volume 1,5 mL) dan antioksidan dimethyl sulfo oxide (DMSO) sebanyak 8,8 µL (7,8% dari volume 1,5 mL), kemudian diletakkan di atas es selama 10 menit. Bakteri yang telah kompeten siap digunakan untuk transformasi.
Transformasi
Transformasi pMSH/κ-Car ke bakteri E. coli DH5α dilakukan dengan cara
50 L sel bakteri kompeten yang telah dibuat sebelumnya, dicampurkan dengan 5
L plasmid pMSH/κ-Car ke dalam tabung mikro, selanjutnya diinkubasi dalam es selama 20-30 menit. Campuran tersebut diberi kejutan panas (heat-shock) untuk membuka pori sel bakteri, pada suhu 42 oC selama 45 detik, kemudian diletakkan
dalam es selama 5 menit. Hasil kejutan panas ditambahkan 100 L media LB,
selanjutnya diinkubasi pada suhu 37 oC pada shaker inkubator dengan kecepatan 200 rpm selama 30-60 menit.
Analisis Transforman E. coliDH5α
15
antibiotik kanamisin dan higromisin, masing-masing 50 mg/L. Bakteri yang tumbuh pada media tersebut merupakan kandidat transforman.
Analisis PCR dilakukan untuk meyakinkan koloni bakteri yang merupakan transforman. PCR dilakukan menggunakan primer 35S-Fμ 5’-ATG GCT GGA GTA TTA GCT GGG-γ’ dan tNos-Rμ 5’-CTC ATA AAT AAC GTC ATG CAT TAC A-γ’ (Hannum 2012). Cetakan DNA yang digunakan adalah koloni transforman yang dilarutkan ddH2O sebanyak 10 µL. Program PCR yang digunakan adalah pradenaturasi pada suhu 95 °C selama 5 menit, 30 siklus amplifikasi yang terdiri atas denaturasi pada suhu 94 °C selama 30 detik, annealing pada suhu 56 °C selama 1 menit, dan extention pada suhu 72 °C selama 2 menit, serta final extention pada suhu 72 °C selama 5 menit dan pendinginan pada 20 °C selama 10 menit. Sebanyak 10 l produk PCR diseparasi dengan elektroforesis 100 V selama 30 menit pada 1% agarose dalam TAE 1x (stok TAE 50x terdiri dari: 4,84 g Tris base, 1,14 mL Acetic acid glacial, 2 mL EDTA pH 8 0,5 M, 800 mL ddH2O). Hasil elektroforesis divisualisasi dengan gel documentation system-UV transilluminator. Sampel koloni sebagai cetakan DNA juga digoreskan ke dalam master plate, yang merupakan sumber koloni bakteri untuk tahap penelitian berikutnya. Master plate berisi koloni bakteri E. coli DH5α transforman, diinkubasi pada suhu 37 oC selama 8 jam.
3.2.5 Transformasi pMSH/κ-Car ke Agrobacterium tumefaciens
Plasmid pMSH/κ-Car selanjutnya ditransformasi ke A. tumefaciens menggunakan metode tri-parental mating (TPM) mengacu pada metode Bevan (1984) dengan beberapa modifikasi Liberty et al. (2008) dan Handayani et al. (2014). Proses transformasi menggunakan prinsip konjugasi melibatkan tiga macam bakteri, yakni E. coli DH5α sebagai donor pembawa plasmid pMSH/κ -Car, bakteri E. coli DH1 (pRK2013) sebagai helper, dan A. tumefaciens LBA4404 sebagai resipien. Bakteri E. coli DH5α tahan terhadap antibiotik kanamisinR dan higromisinR, E.coli DH1 tahan kanamisinR, dan A. tumefaciens LBA4404 tahan terhadap streptomisinR.
Ketiga bakteri ini disegarkan terlebih dahulu dengan mengkultur pada media LB yang ditambahkan antibiotik sesuai marka seleksinya, kemudian diinkubasi pada suhu 37 oC selama 24 jam (E. coli DH5α dan E. coli DH1) dan A. tumefaciens pada suhu 30 oC selama 32 jam. Hasil kultur segar ditumbuhkan masing-masing sebanyak β0 l pada media LA secara sendiri-sendiri (tunggal) sebagai kontrol positif dan secara mix (gabungan ketiganya) untuk proses konjugasi. Selanjutnya diinkubasi pada suhu 30 oC selama 32 jam.
16
3.2.6 Pengurutan DNA dan Analisis Kesejajaran Gen κ-Carrageenase
Pengurutan DNA gen κ-Carrageenase (κ-Car) terhadap produk PCR dilakukan dengan menggunakan automatic DNA sequencer (ABI Prism 3700 squencer, Perkin Elmer, USA). Analisis kesejajaran gen κ-Car dengan database gen di gen bank dilakukan menggunakan program BLAST (Basic Local Alignment Search Tool) (http://www.ncbi.nlm.nih.gov/BLAST).
3.3 Hasil dan Pembahasan
3.3.1 Vektor Ekspresi pMSH/κ-Car
Gen κ-Carrageenase (sekitar1300 bp) tersisip pada situs NotI dan SpeI di daerah MCS pada vektor pMSH yang dikendalikan oleh promoter 35S CaMV (sekitar 300 bp) di bagian depan dan terminator Nos (tNos; sekitar 400 bp) di bagian left border, sehingga total ukuran dari promoter 35S, gen κ-Car, sampai dengan tNos adalah sekitar 2.000 bp (Gambar 8).
Gambar 8 Peta plasmid pMSH/κ-Car: gen κ-Carrageenase (κ-Car) tersisip pada situs NotI dan SpeI di daerah multiple cloning site (MCS) pada vektor pMSH. Panjang total sekuen dari p35S hingga terminator Nos pada plasmid pMSH/κ-Car adalah 2.000 bp
3.3.2 Identifikasi Transforman Escherichia coli DH5α
Koloni bakteri E. coli DH5α hasil transformasi yang ditumbuhkan pada media selektif ditunjukkan pada Gambar 9A, E. coli DH5α yang bukan hasil transformasi pada Gambar 9B, sedangkan E. coli DH5α yang ditumbuhkan pada media tanpa antibiotik ditunjukkan pada Gambar 9C. Kemampuan koloni bakteri E. coli DH5α hasil transformasi untuk tumbuh pada media selektif menunjukkan bahwa bakteri tersebut mengandung pMSH/κ-Car atau disebut sebagai bakteri E. coli DH5α transforman. Bakteri transforman dapat hidup pada media selektif karena plasmid pMSH/κ-Car mengandung gen neomycin phosphotransferase II (NPT II) penyandi resistensi terhadap kanamisin, dan hygromycin phosphotransferase (HPT) penyandi resistensi higromisin. Sebaliknya, E. coli
17
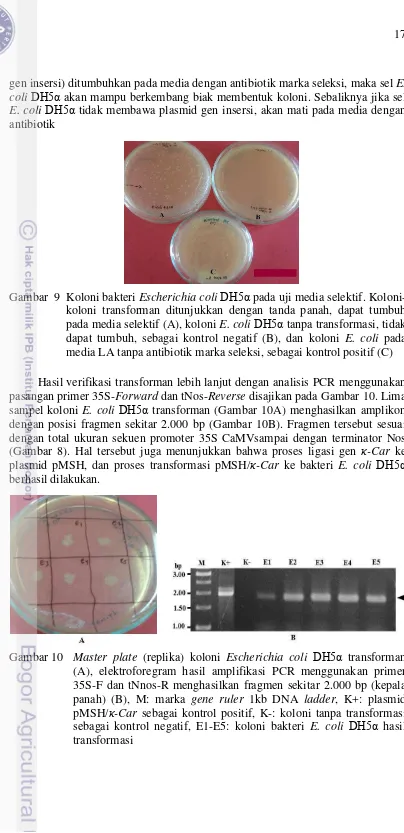
[image:39.595.104.508.9.842.2]gen insersi) ditumbuhkan pada media dengan antibiotik marka seleksi, maka sel E. coli DH5α akan mampu berkembang biak membentuk koloni. Sebaliknya jika sel E. coli DH5α tidak membawa plasmid gen insersi, akan mati pada media dengan antibiotik
Gambar 9 Koloni bakteri Escherichia coli DH5α pada uji media selektif. Koloni-koloni transforman ditunjukkan dengan tanda panah, dapat tumbuh pada media selektif (A), koloni E. coli DH5α tanpa transformasi, tidak dapat tumbuh, sebagai kontrol negatif (B), dan koloni E. coli pada media LA tanpa antibiotik marka seleksi, sebagai kontrol positif (C) Hasil verifikasi transforman lebih lanjut dengan analisis PCR menggunakan pasangan primer 35S-Forward dan tNos-Reverse disajikan pada Gambar 10. Lima sampel koloni E. coli DH5α transforman (Gambar 10A) menghasilkan amplikon dengan posisi fragmen sekitar 2.000 bp (Gambar 10B). Fragmen tersebut sesuai dengan total ukuran sekuen promoter 35S CaMVsampai dengan terminator Nos (Gambar 8). Hal tersebut juga menunjukkan bahwa proses ligasi gen κ-Car ke plasmid pMSH, dan proses transformasi pMSH/κ-Car ke bakteri E. coli DH5α berhasil dilakukan.
18
Setelah proses transformasi, berlangsung integrasi plasmid rekombinan di dalam sel inang bakteri Escherichia coli DH5α, selanjutnya plasmid target bereplikasi seiring replikasi sel E. coli DH5α. Vektor bereplikasi menghasilkan banyak salinan atau turunan yang identik dan pada proses yang sama selain vektor menggandakan diri juga menggandakan plasmid gen yang dibawanya.
3.3.3 Identifikasi Agrobacterium tumefaciens Transforman
Uji keberhasilan konjugasi dengan metode tri-parental mating (TPM) untuk transformasi pMSH/κ-Car ke Agrobacterium tumefaciens ditunjukkan pada Gambar 11. Pada kultur tunggal, ketiga bakteri tidak tumbuh (Gambar 11B), sedangkan bakteri A. tumefaciens yang dikonjugasi dan diinkubasi pada media selektif berhasil tumbuh (Gambar 11A).
Gambar 11 Koloni A. tumefaciens transforman hasil konjugasi dapat tumbuh pada media selektif (tanda panah) yang mengindikasikan proses tri-parental mating/TPM berhasil dilakukan (A), sedangkan kultur tunggal masing-masing: Escherichia coli DH5α/donor (1), E. coli DH1 (pRK2013)/helper (2), Agrobacterium tumefaciens/resipien (3) tidak tumbuh pada media selektif, sebagai kontrol negatif (B)
Agrobacterium tumefaciens transforman mampu tumbuh di media selektif yang ditambahkan antibiotik marka seleksi (kanamisin, higromisin dan streptomisin), karena selain memiliki gen marka seleksi sendiri (streptomisin), juga telah membawa gen marka seleksi kanamisin dan higromisin yang terdapat pada konstruksi pMSH/κ-Car. Sementara kultur tunggal (donor, helper dan resipien) tidak dapat tumbuh, karena donor E. coli DH5α maupun helper E. coli DH1 (pRK2013) hanya membawa gen marka seleksi kanamisin dan higromisin saja, tetapi tidak membawa marka seleksi streptomisin.
19
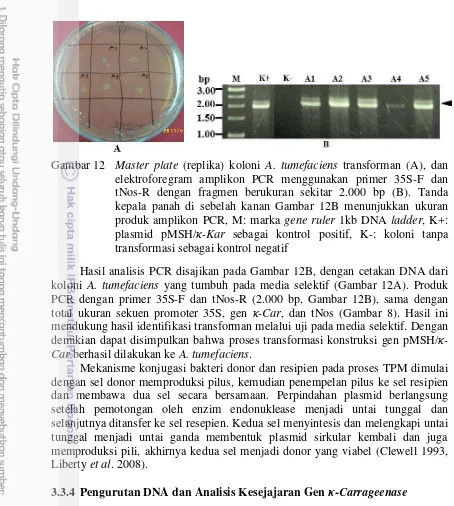
Gambar 12 Master plate (replika) koloni A. tumefaciens transforman (A), dan elektroforegram amplikon PCR menggunakan primer 35S-F dan tNos-R dengan fragmen berukuran sekitar 2.000 bp (B). Tanda kepala panah di sebelah kanan Gambar 12B menunjukkan ukuran produk amplikon PCR, M: marka gene ruler 1kb DNA ladder, K+: plasmid pMSH/κ-Kar sebagai kontrol positif, K-: koloni tanpa transformasi sebagai kontrol negatif
Hasil analisis PCR disajikan pada Gambar 12B, dengan cetakan DNA dari koloni A. tumefaciens yang tumbuh pada media selektif (Gambar 12A). Produk PCR dengan primer 35S-F dan tNos-R (2.000 bp, Gambar 12B), sama dengan total ukuran sekuen promoter 35S, gen κ-Car, dan tNos (Gambar 8). Hasil ini mendukung hasil identifikasi transforman melalui uji pada media selektif. Dengan demikian dapat disimpulkan bahwa proses transformasi konstruksi gen pMSH/κ -Car berhasil dilakukan ke A. tumefaciens.
Mekanisme konjugasi bakteri donor dan resipien pada proses TPM dimulai dengan sel donor memproduksi pilus, kemudian penempelan pilus ke sel resipien dan membawa dua sel secara bersamaan. Perpindahan plasmid berlangsung setelah pemotongan oleh enzim endonuklease menjadi untai tunggal dan selanjutnya ditansfer ke sel resepien. Kedua sel menyintesis dan melengkapi untai tunggal menjadi untai ganda membentuk plasmid sirkular kembali dan juga memproduksi pili, akhirnya kedua sel menjadi donor yang viabel (Clewell 1993, Liberty et al. 2008).
3.3.4 Pengurutan DNA dan Analisis Kesejajaran Gen κ-Carrageenase
Pengurutan DNA dan analisis kesejajaran gen κ-Carrageenase (κ-Car) berdasarkan urutan nukleotida dengan data gen di gene bank dengan menggunakan program Basic Local Alignment Search Tool (BLAST) menunjukkan bahwa fragmen κ-Car mempunyai kesamaan 76% dengan a carrageenovora genes cgkA and cgkB, dan 76% dengan Pseudoalteromonas tetraodonis cgk-k142a gene for kappa-carrageenase, serta 73% dengan Pseudoalteromonas sp. LL1 kappa-carrageenase gene (Tabel 1).
20
Tabel 1 Analisis kesejajaran fragmen nukleotida gen κ-Carrageenase menggunakan program BLAST
No Aksesi Deskripsi Skor Query
cover
E-value
Kesa- maan 1 X71620.1 A carrageenovora genes
cgkA and cgkB, partial
608 94% 5e-170
76% 2 GU38634
2.1
Pseudoalteromonas
tetraodonis cgk-k142a gene for kappa-carrageenase, complete cds
579 90% 3e-161
76%
3 GU38634 2.1
Pseudoalteromonas sp. LL1 kappa-carrageenase gene, complete cds
281 64% 1e-71 73%
Bakteri A. tumefaciens transforman yang membawa konstruksi pMSH/κ-Car telah siap digunakan untuk perlakuan ke rumput laut Kappaphycus alvarezii atau rumput laut jenis lainnya untuk pembuatan transgenik. Proses transfer gen pada rumput laut K. alvarezii, telah dilakukan dengan menggunakan metode elektroporasi (Rajamuddin et al. 2014), juga telah dapat dilakukan menggunakan metode perantara A. tumefaciens (Daud et al. 2013; Fajriah et al. 2014; Handayani et al. 2014).
Sebagai kelanjutan dari tahap ini, dilakukan pembuatan Kappaphycus alvarezii transgenik gen κ-Carrageenase menggunakan metode mediasi A. tumefaciens. Rumput laut yang mengekspresikan gen κ-Carrageenase diharapkan akan memiliki kandungan kappa-karagenan lebih banyak (over-ekspresi) daripada non-transgenik.
3.4 Simpulan
[image:42.595.33.488.20.820.2]4
TRANSFORMASI GEN KAPPA(Κ)-CARRAGEENASE
PADA RUMPUT LAUT Kappaphycus alvarezii
ABSTRAK
Teknik transformasi gen asing telah diaplikasikan untuk meningkatkan karakter penting pada organisme akuatik. Sebagai langkah awal menuju peningkatan kandungan kappa( )-karagenan, dalam penelitian ini gen κ-Carrageenase (κ-Car) ditransformasi ke rumput laut Kappaphycus alvarezii melalui mediasi Agrobacterium tumefaciens. Pada penelitian ini digunakan konstruksi plasmid biner pMSH (pMSH/κ-Car) yang dikendalikan oleh promoter 35S CaMV (35S) dan terminator Nos (tNos). Analisis DNA untuk identifikasi K. alvarezii transgenik dilakukan dengan metode PCR menggunakan dua set primer. Hasil pemeliharaan eksplan pascatransformasi menunjukkan bahwa 36% eksplan lulus hidup dan bertunas sebesar 88,9%, dan 100% dari jumlah tunas yang disampling membawa gen κ-Car. Ukuran fragmen DNA produk PCR menggunakan primer 35S-F dan tNos-R adalah 2.000 bp, ukuran sama dengan produk PCR dari kontrol positif dengan cetakan plasmid pMSH/κ-Car, sementara tidak ada produk amplifikasi pada K. alvarezii non-transformasi (kontrol negatif). Selanjutnya, analisis PCR menggunakan primer 35S-F dan 35S-R menunjukkan produk amplifikasi 300 bp, ukuran yang sama seperti sekuen promotor 35S CaMV. Dengan demikian, K. alvarezii transgenik yang membawa κ-Car telah dihasilkan.
Keywords: gen Kappa(κ)-Carrageenase, Kappaphycus alvarezii, transformasi gen
TRANSFORMATION OF KAPPA (
κ
)-CARRAGEENASE GENE
TO SEAWEED Kappaphycus alvarezii
ABSTRACT
Foreign gene transformation techniques have been applied to improve the valuable traits of farmed organism. As the first step towards increasing of kappa
( )-carrageenan content, in this study κ-Carrageenase gene (κ-Car) was transferred into K. alvarezii by mediation of Agrobacterium tumefaciens. The pMSH/κ-Car binary plasmid construct controlled by 35S CaMV promoter (35S) and Nos terminator (tNos) was used in this study. DNA analysis to identify the transgenic was conducted by PCR method using two sets of primer. The result showed that 36% transformed explants were survived, 88.9% sprouted and 100% of the sprouted explants were having the κ-Car gene. The size of amplified DNA fragment from K. alvarezii transgenic using 35S-F and tNos-R set primers was 2,000 bp, the same size as PCR product of the template of pMSH/κ-Car plasmid, while no amplification product in non-transformated explants (negative control) was found. Furthermore, PCR analysis using 35S-F and 35S-R set primers showed amplification product of 300 bp, the same size as the length of 35S CaMV promoter sequence. Thus, K. alvarezii transgenic carrying κ-Car had been generated.
22
4.1 Pendahuluan
Rumput laut Kappaphycus alvarezii termasuk kelompok alga merah Rhodophyceae (Doty 1987) dengan produk utama berupa hidrokoloid kappa( ) -karagenan (Neish 2005a). Karagenan memiliki kegunaan sangat luas bagi industri (McHugh 2003) sehingga diprediksi kebutuhan karagenan akan terus meningkat di masa datang.
-karagenan dalam tubuh K. alvarezii merupakan bentuk akhir dari bentuk prekursornya, µ-karagenan (Campo et al. 2009). Pembentukan -karagenan