INTRODUKSI GEN DENGAN PERANTARA
Agrobacterium
tumefaciens
DAN PERFORMA RUMPUT LAUT
Kappaphycus
alvarezii
TRANSGENIK
MmCu/Zn-SOD
ST. HIDAYAH TRIANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul “Introduksi Gen dengan Perantara Agrobacterium tumefaciens dan Performa Rumput Laut
Kappaphycus alvareziii Transgenik MmCu/Zn-SOD” adalah benar karya bersama dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
St. Hidayah Triana
RINGKASAN
ST. HIDAYAH TRIANA. Introduksi Gen dengan Perantara Agrobacterium tumefaciens dan Performa Rumput Laut Kappaphycus alvarezii Transgenik
MmCu/Zn-SOD. Dibimbing oleh ALIMUDDIN, UTUT WIDYASTUTI dan
SUHARSONO.
Rumput laut Kappaphycus alvarezii merupakan salah satu komoditas budidaya laut andalan Indonesia. Masalah serius yang masih sering dihadapi dalam budidaya Kappaphycus alvarezii adalah penurunan hasil panen yang disebabkan oleh penyakit ice-ice (bercak putih). Penyakit ini diawali dengan cekaman sebagai respons terhadap perubahan lingkungan ekstrim yang berlangsung dalam waktu cukup lama. Tujuan penelitian ini adalah (1) mendapatkan metode introduksi gen yang optimal pada Kappaphycus alvarezii,
dan (2) menghasilkan K. alvarezii tahan terhadap salinitas rendah dan tinggi dengan mengintroduksi gen penyandi MmCu/Zn-SOD.
Penelitian dilakukan dalam tiga tahap. Penelitian tahap pertama dilakukan untuk mendapatkan konsentrasi Agrobacterium tumefaciens OD600, lama waktu
inokulasi, dan lama kokultivasi untuk menghasilkan eksplan K. alvarezii
transgenik yang membawa gen penyandi MmCu/Zn-SOD. Hasil penelitian tahap pertama menunjukkan bahwa eksplan transgenik ditemukan pada metode transformasi menggunakan OD600 sebesar 0,4 dan 0,5 dengan durasi inokulasi 30
dan 60 menit dan periode kokultivasi 3 dan 4 hari. Efisiensi regenerasi terbesar (46,67%) ditemukan pada perlakuan OD600 sebesar 0,5 dengan durasi inokulasi 30
menit dan lama waktu kokultivasi 4 hari. Namun demikian, efisiensi transformasi dan tunas putatif tertinggi diperoleh pada durasi inokulasi 60 menit, lama waktu kokultivasi 3 hari, dan OD600 sebesar 0,5. Metode tersebut menghasilkan efisiensi
transformasi dan efisiensi tunas putatif masing-masing 100%. Analisis PCR menunjukkan adanya pita DNA produk amplifikasi pada eksplan transgenik yang membuktikan bahwa gen penyandi MmCu/Zn-SOD berhasil diintroduksi ke eksplan K. alvarezii. Pada kontrol non-transgenik, tidak ada produk amplifikasi PCR dan memiliki efisiensi regenerasi sebesar 33,33%. Jumlah eksplan transgenik yang diperoleh relatif sedikit, yakni sembilan (9) eksplan.
Pada penelitian tahap kedua, perbaikan metode introduksi gen dilakukan untuk meningkatkan efektifitas transgenesis dengan menggunakan media ko-kultivasi, media pemulihan dan lama waktu pemulihan berbeda. Hasil penelitian menunjukkan bahwa metode terbaik adalah menggunakan media kokultivasi dan pemulihan cair dengan lama pemulihan 10 hari. Pada perlakuan tersebut diperoleh persentase transformasi yang tinggi (90%), efisiensi regenerasi 90%, 100% efisiensi tunas putatif, dan 100% tunas transgenik. Total jumlah eksplan transgenik yang diperoleh adalah 75,0% (30 dari 40 eksplan putatif), sedangkan eksplan non-transgenik rumput laut tidak menunjukkan produk amplifikasi.
Sebagai kesimpulan adalah optimalisasi metode introduksi gen telah diperoleh untuk K. alvarezii, dan introduksi gen penyandi MmCu/Zn-SOD dapat meningkatkan daya adaptasi K. alvarezii terhadap cekaman salinitas. Pada penelitian selanjutnya, perlu dilakukan analisis ekspresi dan pola integrasi gen penyandi MmCu/Zn-SOD yang dapat menjelaskan perbedaan kemampuan adaptasi antar eksplan K. alvarezii transgenik. Selain itu, mekanisme kerja
MmCu/Zn-SOD pada K. alvarezii transgenik juga menarik untuk diteliti.
SUMMARY
ST. HIDAYAH TRIANA. Transfer and Expression of MmCu/Zn-SOD gene on the Red Seaweed Kappaphycus alvarezii Mediated by Agrobacterium
tumefaciens. Supervised by ALIMUDDIN, UTUT WIDYASTUTI and
SUHARSONO.
The red seaweed of Kappaphycus alvarezii is one of the mainstay mariculture commodities in Indonesia. Serious problem that often encountered in the cultivation of Kappaphycus alvarezii is the declining yields caused by ice-ice disease (white spots). This disease is commenced by stress response on the extreme environmental changes that take place in a long time. The goals of study were: (1) to obtain a suitable transgenesis method for K. alvarezii, and (2) to produce high tolerant of K. alvarezii to low and high water salinities by introducing foreign MmCu/Zn-SOD gene.
Research was performed in three steps. First study was performed to obtain Agrobacterium tumefaciens OD600 level, inoculation duration and
co-cultivation period to produce K. alvarezii explant transgenic carrying MmCu/Zn-SOD gene. The results of the first study demonstrated that the transgenic explants were found at the transformation method using OD600 of 0.4 and 0.5 with the
inoculation duration of 30 and 60 min and a co-cultivation period of 3 and 4 days. The highest regeneration efficiency (46.67%) was found on the OD600 of 0.5
treatment, the inoculation duration of 30 minutes and 3 days of co-cultivation period. However, highest transformation efficiency and putative bud count were obtained in the inoculation duration of 60 minutes and 3 days of co-cultivation period with OD600 of 0.5. It produced 100% transformation and putative bud
efficiencies. Results of PCR analyses showed the presence of MmCu/Zn-SOD
gene in the transgenic explants. On the non-transgenic control, the regeneration efficiency was 33.33%, but no amplification PCR product was found. There were a few number of transgenic explants obtained relatively, ie nine (9) explants.
Second study was conducted to increase transgenesis effectiveness by using different co-cultivation media, recovery media, and recovery period. The results demonstrated that the best method was by using the liquid co-cultivation media, liquid recovery media and 10 days duration of recovery. Those treatment allowed higher transformation percentage (90%), regeneration efficiency (90%), putative bud efficiency (100%), number of buds and explants sprouted, and transgenic explant (100%). In total, of PCR analyses demonstrated that 75% (30 out of 40 putative explants) were carrying MmCu/Zn-SOD gene), whereas the non-transgenic explants seaweed showed no amplification product.
Third study was carried out to examine the adaptability of transgenic explants carrying MmCu/Zn-SOD to low (15 g/L) and high water salinities (45 g/L) for 14 days of challenge test. The results demonstrated that the transgenic explants were tolerant to low and high salinities with 100% survival, while all the non-transgenic explants were dead.
explain the differences of adaptability among K. alvarezii transgenic explants. In addition, the working mechanism of MmCu/Zn-SOD in transgenic K. alvarezii is also interesting to study.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Akuakultur
INTRODUKSI GEN DENGAN PERANTARA
Agrobacterium
tumefaciens
DAN PERFORMA RUMPUT LAUT
Kappaphycus
alvarezii
TRANSGENIK
MmCu/Zn-SOD
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Penguji pada Ujian Tertutup: 1. Dr Ir Odang Carman, MSc
Dosen Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB
2. Dr Drh Angela Mariana Lusiastuti, MSi. Instalasi Litbang Pengendalian Hama dan Penyakit Ikan. Balai Penelitian dan
Pengembangan Budidaya Air Tawar (BPPBAT) Bogor
Penguji pada Sidang Promosi:1. Dr Ir Odang Carman, MSc
Dosen Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB
2. Dr Drh Angela Mariana Lusiastuti, MSi. Instalasi Litbang Pengendalian Hama dan Penyakit Ikan. Balai Penelitian dan
Judul Disertasi : Introduksi Gen dengan Perantara Agrobacterium tumefaciens
dan Performa Rumput LautKappaphycus alvarezii Transgenik
MmCu/Zn-SOD
Nama : St. Hidayah Triana NIM : C161090031
Disetujui oleh Komisi Pembimbing
Dr Alimuddin, SPi, MSc Ketua
Prof Dr Ir Suharsono, DEA Anggota
Dr Ir Utut Widyastuti, MSi Anggota
Diketahui oleh
Ketua Program Studi
Dr Ir Widanarni, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2011 ini ialah “Introduksi Gen dengan Perantara Agrobacterium tumefaciens dan Performa Rumput Laut
Kappaphycus alvarezii Transgenik MmCu/Zn-SOD”.
Disertasi ini memuat hasil dari tiga tahapan riset. Hasil riset tahap pertama telah dibuat menjadi karya ilmiah berjudul “The method of Agrobacterium tumefaciens-Mediated MmCu/Zn-SOD Gene Transformation in the Red Seaweed Kappaphycus alvarezii”, dan telah disubmit ke jurnal Pakistan J Biotechnology.
Hasil riset kedua telah ditulis menjadi manuskrip berjudul “Perbaikan Metode Introduksi Gen pada Kappaphycus alvarezii”, dan telah disubmit ke Jurnal Ilmu dan Teknologi Kelautan Tropis.
Terima kasih penulis ucapkan kepada Bapak Dr Alimuddin, SPi MSc; Ibu Dr Ir Utut Widyastuti, MSi dan Bapak Prof Dr Ir Suharsono, DEA selaku pembimbing yang banyak memberi saran dan masukan selama penelitian dan penulisan naskah disertasi. Penulis juga mengucapkan terima kasih kepada penguji Bapak Dr Ir Odang Carman, MSc dan Ibu Dr Drh Angela Mariana Lusiastuti, MSi atas saran dan masukan dalam penulisan disertasi. Selain itu, penulis mengucapkan terima kasih kepada Bapak Prof Dr Ir Suharsono, DEA yang telah memberikan konstruksi pGWB-MmCu/Zn-SOD yang digunakan pada penelitian ini. Penghargaan yang sama penulis sampaikan kepada Ibu Dra Emma Suryati, MSi dan Bapak Dr Ir Andi Parenrengi, MSc dari Balai Penelitian dan Pengembangan Budidaya Air Payau, Maros (Sul-Sel) yang telah mendanai dan memfasilitasi penelitian ini melalui kerjasama dengan Pusat Penelitian Sumberdaya Hayati dan Biologi (PPSHB) a.n. Dr Ir Utut Widyasuti, MSi. Ucapan terima kasih tak terhingga buat Pusat Penelitian Sumberdaya Hayati dan Biologi (PPSHB), LPPM IPB, khususnya Laboratorium Biorin dan Laboratorium Biologi Molekuler dan Seluler Tanaman yang telah menyediakan fasilitas penelitian.
Terima kasih juga penulis sampaikan kepada Universitas Muslim Indonesia yang telah memberikan izin untuk menempuh pendidikan S3 ini, juga kepada Departemen Riset dan Teknologi, Direktorat Jenderal Pendidikan Tinggi RI yang telah memberikan beasiswa melalui Beasiswa Pendidikan Pascasarjana (BPPS) periode tahun 2009-2013. Juga terima kasih kepada keluarga besar Laboratorium Biorin dan Laboratorium Biologi Molekuler dan Seluler Tanaman, Mbak Pepi Elvavina, Mbak Nia Dahniar, SP, Mbak Sarah, Pak Abdul Mulya, Pak Asep, Pak Iri, Dr Asri P. Paserang, SSi MSi, Alias Rajamuddin, SPi MSi, Siti Ifadatin, SSi MSi, Ristanti F. Daud, SPi MSi, Ulia Fajriah, SPi MSi, Nurul Fitriah, SSi MSi, Destik Wulandari, MSi, Tiwi Purbosari, MSi, Hadijah Nadeak, MSi, Hayatul Fajrie, SSi MSi, Wiwin Widiarti, SP, Ahya Alifuddin, SPi MSi, Yusdar, SSi, Seni Kurnia, SSi dan seluruh rekan yang tidak bisa saya sebutkan satu persatu atas segala bantuan dan dukungan selama penelitian dan penyusunan disertasi ini.
dorongan moril yang diberikan selama ini. Ucapan terima kasih tak terhingga untuk Hasan Nasrullah, SPi, Marlina Ahmad, SPi MSi, Khaerun Nisa, SPi MSi atas segala bantuan dan dukungan kepada penulis hingga karya ilmiah ini selesai.
Ungkapan terima kasih sebesar-besarnya juga disampaikan kepada orang tua Abbah A.R Tassakka (Alm) dan Ummi St. Raehana, saudara-saudaraku Dr Muh.Asnal, SpBd, Ir Kifaya, MT, Ir Fitriani EC, Ir Muh Amri, MSc dan Asmi Citra Malina, MAgr PhD, serta pamanku Ir Fikhrin Arfah dan seluruh keluarga atas bantuannya baik moril maupun material selama studi, dan terima kasih juga kepada suami Ir Mahir S Gani, MSi beserta putra-putriku ananda Badrul, Aisyah, Azizah dan Imam yang selalu menemani dan memberikan semangat selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2016
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
Kebaruan (Novelty) 3
TINJAUAN PUSTAKA 5
Rumput Laut 5
Transfer Gen 6
Kultur In vitro 6
Bakteri Agrobacterium tumefaciens 9
Gen Penyandi SOD 11
EVALUASI EFEK KONSENTRASI Agrobacterium tumefaciens, DURASI INOKULASI DAN KOKULTIVASI DALAM INTRODUKSI
GEN PENYANDI MmCu/Zn-SOD PADA Kappaphycus alvarezii 14
Abstract 14
Pendahuluan 14
Bahan dan Metode 15
Waktu dan Tempat Penelitian 15
Prosedur Introduksi Gen Dimediasi oleh Agrobacterium tumefaciens 15
Identifikasi Transgenik Menggunakan PCR 17
Parameter Uji dan Analisis Data 17
Hasil 18
Penampilan Visual Eksplan 18
Efisiensi Regenerasi 18
Efisiensi Tunas Putatif 19
Efisiensi Transformasi 20
Identifikasi Eksplan Transgenik 21
Pembahasan 22
Simpulan 24
PENGEMBANGAN METODE INTRODUKSI GEN PADA Kappaphycus
alvarezii 25
Abstract 25
Bahan dan Metode 26
Waktu dan Tempat Penelitian 26
Rancangan Percobaan 26
Introduksi Gen Penyandi MmCu/Zn-SOD 26
Identifikasi Eksplan Transgenik 27
Parameter Uji dan Analisis Data 27
Hasil 27
Pengaruh Media Kultur 27
Pengaruh Lama Waktu Pemulihan 29
Pengaruh Interaksi Media Kultur dan Lama Waktu Pemulihan 30
Analisis PCR 32
Pembahasan 34
Simpulan 36
PERFORMA RUMPUT LAUT Kappaphycus alvarezii TRANSGENIK
MmCu/Zn-SOD TERHADAP CEKAMAN SALINITAS 37
Abstract 37
Pendahuluan 37
Bahan dan Metode 38
Waktu dan Tempat Penelitian 38
Prosedur Penelitian 38
Parameter Uji dan Analisis Data 39
Hasil 39
Tingkat Kerusakan Eksplan 39
Kelangsungan Hidup Eksplan 40
Pembahasan 42
Simpulan 44
PEMBAHASAN UMUM 45
SIMPULAN UMUM DAN SARAN 49
UCAPAN TERIMA KASIH 49
DAFTAR PUSTAKA 50
LAMPIRAN 57
DAFTAR TABEL
1 Hasil transformasi genetik pada rumput laut K.alvarezii berdasarkan
beberapa sumber 23
2 Jumlah eksplan bertunas, jumlah tunas dan tunas positif PCR pada
rumput laut Kappaphycus alvarezii 33
DAFTAR GAMBAR
1 Kerangka alur penelitian 4
2 Interaksi sel tanaman dengan Agrobacterium...(Sheng & Citovski 1996) 10 3 Konstruksi plasmid biner pGWB5 yang membawa gen penyandi
MmCu/Zn-SOD (Hannum 2012) 16
4 Penampilan visual dari rumput laut K. alvarezii 18 5 Efisiensi regenerasi pada durasi inokulasi 15, 20, 30, dan 60 menit, dan
waktu kokultivasi 3 dan 4 hari pada OD600 0,4 (A) dan 0,5 (B) 19
6 Efisiensi tunas putatif pada durasi inokulasi 15, 20, 30 dan 60 menit, dan waktu kokultivasi 3 dan 4 hari pada OD600 0,4 (A) dan 0,5 (B) 20
7 Efisiensi transformasi pada durasi inokulasi 15,20,30 dan 60 menit, dan waktu kokultivasi 3 dan 4 hari pada OD600 0,4 (A) dan 0,5 (B) 21
10 Penampilan visual eksplan pada media kokultivasi-pemulihan (KP) cair-cair (A,B,C), padat-cair (D,E,F), padat-padat (G,H,I) 29 11 Persentase transfomasi (PT), efisiensi regenerasi (ER) dan efisiensi
tunas (ETP) pada waktu pemulihan 10, 20, dan 30 hari 30 12 Performa eksplan pada media kokultivasi (K) dan pemulihan (P). KP
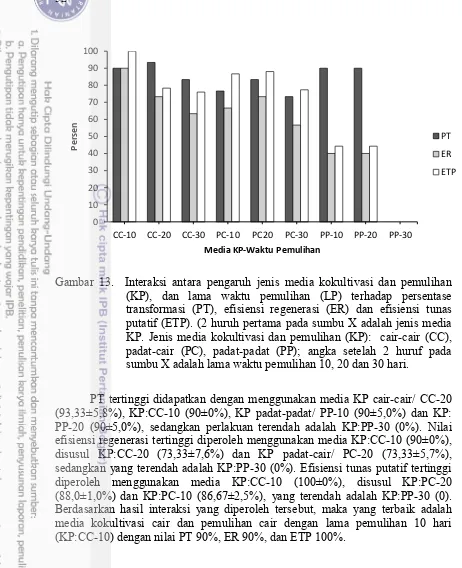
cair-cair (i), dan padat-padat (ii), dengan lama waktu pemulihan 10 hari (A, B, C), 20 hari (D, E, F) dan 30 hari (G, H, I) 31 13 Interaksi antara pengaruh jenis media kokultivasi dan pemulihan (KP),
dan lama waktu pemulihan (LP) terhadap persentase transformasi (PT), efisiensi regenerasi (ER), dan efisiensi tunas putatif (ETP) 32 14 Elektroforegram produk PCR dengan DNA genom rumput laut
Kappaphycus alvarezii transgenik MmCu/Zn-SOD dan kontrol non-
transgenik 33
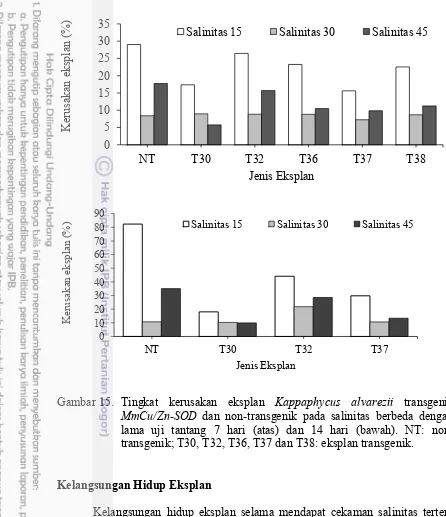
15 Tingkat kerusakan eksplan Kappaphycus alvarezii transgenik
MmCu/Zn-SOD dan non-transgenik pada salinitas berbeda dengan lama
uji tantang 7 hari (atas) dan 14 hari (bawah) 40
16 Kelangsungan hidup Kappaphycus alvarezii transgenik MmCu/Zn-SOD
dan non-transgenik pada salinitas berbeda dengan lama uji tantang 7
hari (atas) dan 14 hari (bawah) 41
17 Penampilan visual eksplan pada salinitas 15 g/L (A), 30 g/L (B) dan 45
DAFTAR LAMPIRAN
1 Komposisi media Prevasoli Enrichment Seawater (PES) 58 2 Hasil transformasi gen MmCu/Zn-SOD pada rumput laut K. alvarezii 59 3 Hasil uji ANOVA dan uji lanjut Duncan’s pada parameter Persentase
Transformasi (PT), Efisiensi Regenerasi (ER) dan Efisiensi Tunas Putatif
(ETP) serta uji korelasi antar parameter 60
PENDAHULUAN
Latar Belakang
Salah satu jenis rumput laut yang sudah dibudidayakan secara intensif di Indonesia adalah Kappaphycus alvarezii (Euchema cottonii). Budidaya rumput laut K. alvarezii bertujuan untuk meningkatkan hasil dalam jumlah yang cukup besar dan kontinu dengan kualitas yang baik. Masalah serius dalam budidaya rumput laut adalah penurunan hasil panen yang disebabkan oleh penyakit ice-ice
(bercak putih). Pengendalian penyakit ice-ice pada K. alvarezii di Indonesia belum tertangani dengan baik yang berakibat produksi rumput laut menurun sekitar 70-100 % (Vairappan et al. 2008).
Perubahan lingkungan yang ekstrim yang berlangsung dalam waktu cukup lama sehingga rumput laut mengalami cekaman. Rumput laut yang mengalami cekaman akibat perubahan kondisi lingkungan seperti perubahan salinitas, suhu air, intensitas cahaya dan pH akan memudahkan infeksi patogen dan merupakan faktor utama yang memacu timbulnya penyakit ice-ice (Arisandi et al. 2011). Rumput laut yang mengalami cekaman akan membebaskan substansi organik yang menyebabkan talus berlendir dan merangsang bakteri tumbuh melimpah di sekitar lokasi budidaya (Santoso dan Nugraha 2008). Tanda awal rumput laut terserang penyakit ice-ice adalah pertumbuhan yang lambat, perubahan warna talus menjadi pucat atau warna tidak cerah, dan kemudian sebagian atau seluruh talus pada beberapa cabang menjadi putih dan membusuk (Parenrengi et al. 2010).
Salah satu upaya menanggulangi penyakit adalah dengan peningkatan mutu genetik rumput laut melalui pemuliaan. Proses pemuliaan tanaman biasanya diawali dengan mendapatkan variabilitas genetik yang tinggi, dan melakukan kegiatan seleksi pada sumber genetik tersebut, melakukan persilangan-persilangan dan seleksi lanjutan, kemudian masih dilanjutkan dengan proses seperti pemurnian, uji generasi, percobaan varietas, dan akhirnya pelepasan varietas (Mangunwidjojo 2003). Banyaknya kegiatan yang harus dilakukan tentunya akan memerlukan waktu relatif lama untuk mendapatkan kultivar dengan sifat dan bentuk baru yang diinginkan.
Upaya dalam memperoleh kultivar tanaman dengan sifat dan bentuk baru yang diinginkan dalam waktu yang lebih singkat diduga dapat dicapai dengan menggunakan teknik transformasi genetik (transgenesis). Teknik ini dilakukan dengan cara mengintroduksi gen dari tanaman atau organisme lain (Datta 2007). Penerapan teknik transgenesis sangat membantu dalam perakitan varietas unggul.
Tanaman hasil transgenesis adalah tanaman yang mengandung gen hasil transformasi. Keberhasilan dalam transfer gen pada tanaman memerlukan: (a) ketersediaan gen yang akan diintroduksi, (b) metode introduksi gen yang efektif, (c) metode regenerasi tanaman secara in vitro yang efektif, dan (d) ekspresi gen yang diintroduksi pada tanaman (Sudarsono 1994).
Introduksi gen pada rumput laut telah dilakukan pada Laminaria japonica
Gracilaria changii menggunakan metode senjata gen dengan gen LacZ
menunjukkan bahwa promoter SV40 merupakan promoter yang efektif (Gan et al.
2003). Pada Porphyra yezoensis (red algae) transfer gen dilakukan menggunakan metode senjata gen dengan gen Gus yang dikendalikan oleh promoter PyAct1 (Hirata et al. 2011). Kuang et al. (1998) juga berhasil mentransfer gen Gus
menggunakan metode elektroporasi pada Porphyra yezoensis. Begitu pula Cheney et al. (2001) mengintroduksi gen Gus dan GFP dengan promoter 35S CaMV dengan perantara Agrobacterium pada Porphyra yezoensis memperlihat-kan ekspresi gen pada generasi T1 dan T2. Wang et al. (2010a) berhasil mentransfer gen LacZ pada rumput laut Kappaphycus alvarezii Doty (red algae) menggunakan metode senjata gen. Perakitan rumput laut K. alvarezii transgenik telah dilakukan oleh Daud et al. (2013) dengan mengintroduksi gen sitrat sintase, Handayani et al. (2014) dengan gen lisozim-C, dan Fajriah et al. (2015) dengan gen metallothionein tipe II. Namun ketiga penelitian tersebut belum mendapatkan hasil yang memuaskan dan metode optimal dalam mengintroduksi gen menggunakan Agrobacterium tumefaciens. Pada penelitian ini, gen yang diintroduksi adalah gen penyandi superoksida dismutase (SOD) yang berasal dari tanaman Melastoma malabathricum (MmSOD) hasil konstruksi Hannum (2012). SOD merupakan enzim yang mengkatalisis dismutase radikal anion superoksida (O2-) menjadi hidrogen peroksida (H2O2) dan molekul oksigen (O2). Gen ini
memiliki peranan penting dalam sistem pertahanan tubuh, terutama terhadap aktivitas senyawa oksigen reaktif yang dapat menyebabkan cekaman. Introduksi gen SOD dilakukan menggunakan metode mediasi A. tumefaciens.
Perumusan Masalah
Perubahan kondisi perairan yang ekstrim dapat menginduksi penyakit ice-ice pada K. alvarezii. Untuk mencegah serangan penyakit tersebut, maka daya tahan rumput laut terhadap perubahan ekstrim lingkungan perlu ditingkatkan. Peningkatan daya tahan rumput laut terhadap perubahan kondisi lingkungan dapat ditingkatkan melalui aplikasi teknologi transgenesis. Salah satu gen yang berpotensi mampu meningkatkan adaptasi rumput laut terhadap cekaman adalah gen SOD. Ekspresi gen SOD meningkat pada tanaman kedelai Glycine max yang mendapat cekaman kekeringan (Hindarta, 2008). Introduksi gen MmCu/Zn-SOD
membuat tembakau Nicotiana benthamiana dan Nicotiana tabacum toleran terhadap cekaman aluminium (Hannum 2012). Berdasarkan hasil tersebut, maka pada penelitian ini dilakukan introduksi gen MmCu/Zn-SOD pada K. alvarezii
yang bertujuan untuk meningkatkan ketahanan terhadap cekaman lingkungan, khususnya salinitas.
Metode transfer yang digunakan dalam penelitian ini adalah transfer gen yang dimediasi oleh bakteri A. tumefaciens. Kelebihan dari teknik transformasi gen melalui Agrobacterium adalah relatif lebih sederhana, dalam beberapa kasus lebih efisien dan lebih ekonomis dibandingkan teknik protoplas dan senjata gen (Loedin 1994).
transgenik dari jaringan atau sel tanaman yang telah ditransformasi. Untuk memperoleh pertumbuhan optimal dari jaringan yang ditanam secara in vitro
diperlukan media tanam dengan komposisi nutrisi yang tepat. Pada rumput laut media yang pernah dicobakan di antaranya adalah media PES dan Conwy (Suryati
et al. 2010a). Pada penelitian ini berbagai perlakuan diuji untuk mendapatkan metode optimal dalam transgenesis K. alvarezii.
Tujuan Penelitian
Penelitian bertujuan untuk: (1) mendapatkan metode introduksi gen yang optimal pada rumput laut Kappaphycus alvarezii, (2) menghasilkan Kappaphycus alvarezii tahan terhadap salinitas rendah (15 g/L) dan tinggi (45 g/L).
Manfaat Penelitian
Manfaat dari penelitian ini, adalah: (1) metode introduksi gen yang diperoleh dapat menjadi dasar pembuatan transgenik pada rumput laut jenis lainnya, dan (2) kegagalan budidaya rumput laut akibat cekaman salinitas dapat dicegah dengan membudidayakan rumput laut transgenik MmCu/Zn-SOD.
Ruang Lingkup Penelitian
Penelitian dilakukan dalam tiga tahap seperti disajikan pada Gambar 1. Penelitian tahap pertama dilakukan untuk mendapatkan metode introduksi gen
MmCu/Zn-SOD pada rumput laut Kappaphycus alvarezii. Pada penelitian ini dilakukan introduksi gen MmCu/Zn-SOD, berbeda dengan gen sitrat sintase yang digunakan oleh Daud et al. (2013). Penelitian tahap pertama dilakukan untuk mendapatkan konsentrasi OD600 A. tumefaciens, durasi inokulasi dan waktu
ko-kultivasi yang dapat menghasilkan K. alvarezii transgenik. Penelitian tahap kedua dilakukan untuk mengoptimasi metode introduksi gen MmCu/Zn-SOD. Pada penelitian tahap ketiga, K. alvarezii transgenik yang telah dihasilkan selanjutnya diuji tantang dengan salinitas rendah dan tinggi untuk menguji efek introduksi gen
MmCu/Zn-SOD terhadap kemampuan adaptasi K. alvarezii terhadap cekaman salinitas.
Kebaruan (Novelty)
Kebaruan (novelty) dalam penelitian ini adalah: (1) metode transformasi genetik rumput laut K. alvarezii yang optimal dapat digunakan untuk merakit rumput laut transgenik lainnya, dan (2) K. alvarezii transgenik MmCu/Zn-SOD
Gambar 1. Kerangka alur penelitian
TINJAUAN PUSTAKA
Rumput Laut
Rumput laut tergolong tanaman berderajat rendah, umumnya tumbuh melekat pada substrat tertentu, tidak mempunyai akar, batang maupun daun sejati; tetapi hanya menyerupai batang yang disebut talus. Rumput laut tumbuh di alam dengan melekatkan dirinya pada karang, lumpur, pasir, batu, benda keras lainnya. Selain benda mati, rumput laut juga dapat melekat pada tumbuhan lain secara epifitik (Anggadireja et al. 2010). Untuk pertumbuhan, rumput laut mengambil nutrisi dari sekitarnya secara difusi melalui dinding talusnya.
Perkembangbiakan rumput laut baik dari kelompok Gracilaria maupun
Kappaphycus dikenal dalam dua bentuk reproduksi, yakni seksual (generatif) dan aseksual (vegetatif). Perbanyakan secara generatif dikembangkan melalui spora, baik alamiah maupun melalui budidaya. Pertemuan dua gamet membentuk zigot yang selanjutnya berkembang menjadi sporofit. Individu baru inilah yang mengeluarkan spora dan berkembang melalui pembelahan dalam sporogenesis menjadi gametofit. Perbanyakan secara vegetatif dikembangkan dengan cara stek, yaitu potongan talus yang kemudian tumbuh menjadi tanaman baru (Anggadireja
et al. 2010).
Rumput laut adalah organisme laut yang memiliki syarat-syarat lingkungan tertentu agar dapat hidup dan tumbuh dengan baik. Semakin sesuai kondisi lingkungan perairan dengan kebutuhan rumput laut, maka akan semakin baik pertumbuhan dan hasil yang akan diperoleh. Sulistijo (1996) melaporkan bahwa kondisi ekologis yang meliputi parameter lingkungan fisika, kimia dan biologi sangat menentukan keberhasilan budidaya. Parameter fisika dan kimia perairan yang berperan dalam budidaya rumput laut antara lain suhu, salinitas, kecerahan, kecepatan arus, kedalaman perairan, kandungan nutrien, jenis substrat, kekeruhan air dan pH, sedangkan dari parameter biologi yaitu hama dan penyakit (Syahputra 2005).
Penyebab kegagalan budidaya rumput laut adalah masalah hama dan penyakit sehingga menimbulkan kerusakan dan kematian tanaman. Penyakit yang sering timbul pada rumput laut, khususnya pada jenis Kappaphycus sp dikenal dengan nama ice-ice yang menyebabkan tanaman tampak memutih. Hal ini disebabkan terjadi perubahan lingkungan (arus, suhu, salinitas dan kecerahan) yang ekstrim sehingga memudahkan bakteri hidup. Oleh karena itu, diperlukan monitor lingkungan yang cermat untuk mencegah kegagalan budidaya akibat penyakit ice-ice (Syahputra 2005).
Penyakit pada rumput laut ini ditunjukkan dengan gejala timbulnya bercak-bercak pada sebagian talus, lama-kelamaan akan kehilangan warna sampai menjadi putih dan terputus (Amiluddin 2007). Selanjutnya dijelaskan bahwa penyakit ice-ice pada tanaman rumput laut terjadi karena infeksi mikrob pada saat tanaman menjadi rentan. Kondisi ini disebabkan karena adanya perubahan lingkungan yang ekstrim dan tidak dapat ditoleransi sehingga tanaman menjadi lemah (tidak sehat). Rumput laut yang terkena penyakit ice-ice ini sebelumnya memperlihatkan adanya gejala pertumbuhan yang lambat, permukaan talus menjadi kasar dan pucat.
Transfer Gen
Dalam upaya menghasilkan tanaman transgenik ada beberapa faktor yang berperan, diantaranya adalah metode efisien dalam mengklon gen, ketersediaan konstruksi gen, teknik transfer, sistem regenerasi tanaman, sistem vektor yang terus dikembangkan serta promoter yang spesifik untuk ekspresi gen pada organ tertentu (Aswidinoor 1995). Introduksi gen asing pada tanaman memerlukan suatu sistem regenerasi tanaman yang efisien dan dapat diulang (Rueb et al. 1994). Akan tetapi, masalah utama yang sering dihadapi dalam transfer gen pada beberapa tanaman adalah kesulitan meregenerasikan tanaman dalam kultur in vitro (Park et al. 1996). Sistem regenerasi yang tepat pada kultur in vitro
memungkinkan diperolehnya tanaman transgenik dari jaringan atau sel tanaman. Salah satu bahan tanam yang dibutuhkan untuk introduksi gen pada tanaman melalui Agrobacterium adalah kalus embriogenik. Kemampuan memproduksi sejumlah kalus embriogenik merupakan salah satu faktor penting untuk menghasilkan transformasi yang efisien (Hiei et al. 1997).
Kultur In vitro
Regenerasi adalah perbanyakan tanaman yang secara alamiah bertujuan untuk mempertahankan siklus hidupnya (regenerasi in vivo). Secara in vitro,
Perkembangan teori regenerasi in vitro dilandasi oleh teori totipotensi yang dikemukakan oleh Schwan dan Schleiden (Bhojwani dan Razdan 1983). Dari teori tersebut dikemukakan bahwa setiap sel tanaman memiliki potensi untuk tumbuh dan berkembang menjadi tanaman utuh. Hal ini karena sel-sel tersebut mengandung informasi genetik dan organel-organel yang potensial untuk beregenerasi. Menurut Wattimena (1992), sekarang ini teknik kultur jaringan telah berkembang sedemikian rupa sehingga telah dirasakan manfaatnya didalam budidaya pertanian seperti penyediaan bibit bagi tanaman-tanaman yang sulit beregenerasi secara in vitro serta dapat menghasilkan bibit yang seragam dalam jumlah yang besar. Di samping itu, teknik ini juga dapat menyelamatkan plasma nutfah yang terancam punah.
Ada beberapa metode yang dapat ditempuh dalam regenerasi in vitro, yaitu melalui induksi organogenesis dan induksi embrio somatik (ES). Organogenesis adalah regenerasi yang berasal dari organ atau jaringan tanpa terlebih dulu membentuk ES. Cara ini dapat dikerjakan melalui multiplikasi tunas dari mata tunas aksilar, dan melalui pembentukan tunas adventif baik secara langsung maupun tidak langsung (Wattimena 1992). Menurut Bhojwani dan Razdan (1983), ES adalah suatu proses perkembangan non-seksual yang menghasilkan suatu embrio bipolar yang berasal dari jaringan somatik.
Regenerasi rumput laut K. alvarezii dapat dilakukan melalui induksi talus dan induksi embrio somatik (ES). Teknik ini lebih baik dan lebih mudah perkembangannya karena berasal dari satu sel pada jaringan somatik yang perkembangannya serupa dengan embrio normal (Suryati et al. 2010a). Regenerasi ES berkembang melalui beberapa tahapan yang dibedakan berdasarkan morfologi dan perkembangan organ menghasilkan anak yang terbentuk pada kondisi media yang berbeda, baik media cair maupun media semi- solid (Suryati dan Mulyaningrum 2009).
Untuk memperoleh pertumbuhan optimal dari jaringan yang ditanam secara in vitro diperlukan media tanam dengan komposisi nutrisi yang tepat. Umumnya media kultur jaringan dibedakan menjadi media dasar dan media perlakuan. Media dasar terdiri atas unsur hara makro (N, P, K, Ca, Mg dan S), unsur hara mikro (Fe, Mn, Zn, Cu dan Mo), vitamin (tiamin, asam nikotinat dan piridoksin), mio-inositol, asam amino atau suplemen nitrogen lain (casein hidrosilat, glutamin, asparagin, adenin, dll.) serta gula. Gula yang digunakan dalam media berfungsi menggantikan energi yang biasanya diperoleh melalui proses fotosintesis. Vitamin diperlukan dalam sistem enzim (George dan Sherrington 1984). Tiamin (B1) merupakan vitamin yang mutlak diperlukan dalam kultur in vitro. Vitamin lain yang sering digunakan adalah niacin, piridoksin (B6), sedangkan biotin, asam pantotenat dan riboflavin jarang digunakan (Gunawan 1988).
Media tumbuh dapat berbentuk cair atau padat. Pemilihan jenis media tergantung dari jenis tanaman, faktor aerasi, bentuk pertumbuhan dan diferensiasi yang diinginkan (Pierik 1987). Bila digunakan media padat dapat diperoleh beberapa keuntungan, yaitu eksplan mudah terlihat, eksplan berada di permukaan media, tunas dan akar tumbuh teratur. Berbagai jenis media telah banyak digunakan, tetapi media yang umum digunakan adalah MS (Murashige dan Skoog 1962). Pada rumput laut media yang pernah dicobakan diantaranya media PES,
Kehadiran zat pengatur tumbuh sangat nyata pengaruhnya pada teknik kultur jaringan. Torres (1989) menyatakan bahwa tipe morfogenesis pada kultur in vitro tergantung pada rasio serta kondisi auksin dan sitokinin. Auksin yang paling banyak digunakan pada kultur in vitro adalah indole-3-acetic acid (IAA), α -naphtalenacetic acid (α-NAA), dan 2,4-dichlorophenoxyacetic acid (2,4-D). Sitokinin yang paling banyak digunakan pada kultur in vitro adalah kinetin, benziladenin (BA atau BAP), dan zeatin.
Faktor lain yang penting diperhatikan adalah derajat kemasaman (pH). Derajat kemasaman harus diatur sedemikian rupa sehingga tidak mengganggu fungsi membran sel dan fungsi sitoplasma (Gunawan 1992). Diperkuat oleh George dan Sherrington (1984) bahwa media pH kultur sangat berpengaruh terhadap pertumbuhan dan perkembangan kultur karena pH mempengaruhi penyerapan nutrisi dan zat tumbuh dari media.
Faktor lingkungan selain pH, seperti cahaya, kelembaban dan suhu juga harus diperhatikan. Menurut George dan Sherrington (1984), ada tiga unsur cahaya yang sangat berpengaruh terhadap pertumbuhan dan morfogenesis pada kultur in vitro adalah lama penyinaran, intensitas dan kualitas cahaya. Pengaturan ketiga unsur tersebut sangat bergantung pada jenis tanaman uji.
Penggunaan teknik kultur jaringan dalam pembibitan rumput laut diharapkan mampu menghasilkan bibit yang berkualitas dalam skala massal dan dalam waktu yang relatif singkat, untuk memenuhi ketersediaan bibit tanpa dibatasi siklus musiman, menemukan teknik kultur jaringan yang adaptif dan efisien, sehingga dapat dilakukan oleh seluruh lapisan. Suryati dan Mulyaningrum (2009) menjelaskan bahwa kultur jaringan rumput laut K. alvarezii menggunakan media kultur antara lain pupuk yang digunakan pada makroalgae, seperti Conwy
dan SSW sebagai kontrol, dengan zat pengatur tumbuh IAA 1 ppm. Hasil yang diperoleh rata-rata pertumbuhan panjang tunas dan tingkat kelangsungan hidup eksplan rumput laut K. alvarezii yang dipelihara selama 8 minggu dengan menggunakan media Conwy tanpa penambahan IAA lebih tinggi dibandingkan dengan yang menggunakan media Conwy dengan penambahan IAA. Panjang tunas eksplan pada media Conwy tanpa IAA relatif lebih tinggi 26,2% dan tingkat kelangsungan hidup lebih tinggi 17,92%.
Induksi kalus rumput laut K. alvarezii untuk produksi sel ES dengan beberapa rasio ZPT IAA dan kinetin, dengan konsentrasi agar media induksi 0,6%, 0,8%, 1,0% dan 1,5%, diperoleh hasil rasio IAA:kinetin = 1,0:1,0 mg/L dengan konsentrasi agar media 0,8% dan 1,0% menghasilkan persentase induksi kalus tertinggi (90%). Pada media cair, perkembangan sel ES dari single cell
ukuran 3-4 mm menjadi filamen ukuran rata-rata 0,5 mm dapat dicapai dalam satu bulan kultur (Rajamuddin et al. 2010).
Kelangsungan hidup rumput laut K. alvarezii yang ditumbuhkan pada media padat yang diperkaya dengan pupuk PES 1/20 dan Conwy (Liao et al.
1983) memberikan kelangsungan hidup 45-80%. Media kultur yang diperkaya dengan media PES 1/20 memperlihatkan pertumbuhan dan pembentukan embrio yang lebih kompak dan filamen yang lebih pendek dibandingkan dengan embrio yang dihasilkan dari media Conwy (Suryati et al. 2010b).
Bakteri Agrobacterium tumefaciens
Agrobacterium adalah bakteri gram negatif yang bersifat pathogen dan dapat menyebabkan penyakit crown gall (tumor) atau hairy root (akar rambut) pada tanaman terinfeksi, terutama pada tanaman dikotil (Glick et al. 2010).
Agrobacterium penyebab penyakit tumor pada tanaman termasuk ke dalam spesies A. tumefaciens, sedangkan yang menyebabkan penyakit akar rambut adalah A. rhizogenes.
Analisis molekuler menunjukkan bahwa Ti-plasmid mengandung lima sekuen penting, di mana dua sekuen berperan dalam pembentukan tumor pada tanaman, yaitu T-DNA (transferred DNA) dan vir (virulence), sedangkan tiga sekuen lainnya berperan dalam katabolisme opin, transfer konjugatif dan replikasi Ti-plasmid dalam Agrobacterium (Old dan Primrose 2003).
T-DNA berukuran 10-20 kb atau 5-10% dari ukuran Ti-plasmid, di mana daerah ini homolog dengan sekuen target yang ada pada sel tanaman yang mengalami transformasi. T-DNA dibatasi oleh 25 pb sekuen berulang (repeated sequence) pada ujung kiri (LB) dan ujung kanan (RB). Peranan sekuen berulang dalam proses transfer T-DNA telah dipelajari melalui analisis mutasi pada sekuen nukleotida yang mengaktifkan RB dan LB dan terhambatnya proses transfer T-DNA (Wang et al. 1987). Van Haren et al. (1987) mengemukakan bahwa delesi RB akan mengakibatkan Agrobacterium menjadi tidak virulen, sedangkan delesi LB tidak berpengaruh terhadap virulensi Agrobacterium.
Sekuen lain yang berperan dalam proses transformasi selain dari T-DNA adalah vir gen (virulence), akan tetapi sekuen ini tidak ditransfer ke sel tanaman (Close et al. 1987). Sekuen vir berukuran sekitar 30 kb DNA, yang terdiri atas enam operon vir, empat operon vir (virA, virB, virD dan virG) sangat diperlukan dalam proses transformasi, sedangkan dua operon lainnya (virC dan virE) diperlukan untuk meningkatkan efisiensi transformasi. Masing-masing operon memiliki fungsi yang berbeda dalam proses transformasi, misalnya virA berperan dalam pengenalan proses lingkungan yang diberikan oleh jaringan tanaman yang luka, sehingga tanaman yang luka akan mengeluarkan senyawa fenol seperti
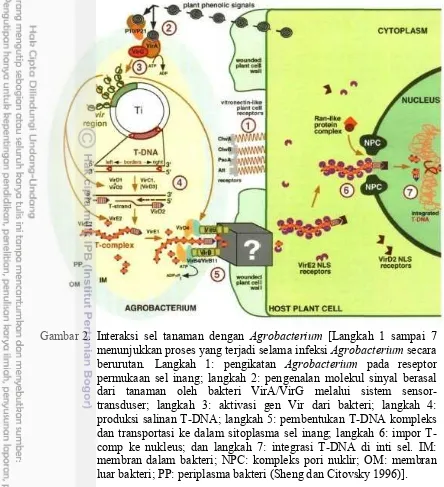
Gambar 2. Interaksi sel tanaman dengan Agrobacterium [Langkah 1 sampai 7 menunjukkan proses yang terjadi selama infeksi Agrobacterium secara berurutan. Langkah 1: pengikatan Agrobacterium pada reseptor permukaan sel inang; langkah 2: pengenalan molekul sinyal berasal dari tanaman oleh bakteri VirA/VirG melalui sistem sensor-transduser; langkah 3: aktivasi gen Vir dari bakteri; langkah 4: produksi salinan T-DNA; langkah 5: pembentukan T-DNA kompleks dan transportasi ke dalam sitoplasma sel inang; langkah 6: impor T-comp ke nukleus; dan langkah 7: integrasi T-DNA di inti sel. IM: membran dalam bakteri; NPC: kompleks pori nuklir; OM: membran luar bakteri; PP: periplasma bakteri (Sheng dan Citovsky 1996)]. Kemampuan A. tumefaciens untuk membentuk tumor pada tanaman disebabkan oleh adanya suatu mega plasmid yang berukuran 150-800 kilo pasang basa (kb), plasmid tersebut dikenal dengan Ti-plasmid (tumor inducing). Pada Ti-plasmid terdapat gen-gen onc (oncogen), yaitu tmsl, tms2, tms3. Onkogen tersebut menyandikan auksin (tmsl, tms2) dan sitokinin (tms3). Selain itu terdapat juga gen yang menyandikan enzim-enzim yang berperan dalam sintesis opin, yakni nopalin, oktopin, manopin, agrosinopin dan agropin (Griffiths et al. 1993).
generasi berikutnya. Segregasi T-DNA yang terintegrasi pada genom tanaman terjadi mengikuti segregasi Mendel (Glover 1984).
Perkembangan teknik-teknik molekuler seperti lokalisasi dan delesi gen onkogen T-DNA, penggunaan marker yang dapat digunakan untuk menyeleksi sel transforman, pengembangan vektor plasmid dan prosedur yang dapat meng-integrasikan gen target ke dalam T-DNA dan pengembangan teknik-teknik kultur jaringan yang dapat meningkatkan efisiensi infeksi dan regenerasi sel me-mungkinkan dapat diintroduksinya gen dengan T-DNA ke dalam sel tanaman dan gen tersebut dapat berintegrasi dengan genom tanaman sehingga diperoleh tanaman transgenik (Gelvin 2000).
Pada Gambar 2 terlihat proses transformasi genetik (reaksi utama seluler dalam transportasi T-DNA) menggunakan Agrobacterium terdiri atas 7 tahap utama, yakni: (1) pengenalan dan pelekatan Agrobacterium pada sel inang, (2) penginderaan sinyal tanaman yang spesifik oleh dua komponen sistem transduksi sinyal pada Agrobacterium yaitu VirA/VirG, (3) ekspresi daerah vir menghasilkan protein-protein Vir yang memulai proses transfer T-DNA, (4) salinan T-DNA yang akan dipindahkan ke tanaman diproduksi oleh kerja protein VirD1/D2, (5) T-DNA dihantarkan dalam bentuk kompleks VirD2-DNA, bersama-sama dengan beberapa protein Vir lainnya ke dalam sitoplasma sel inang, (6) VirE2 berasosiasi dengan utas T-DNA dan bergerak menuju sitoplasma sel inang, dan (7) kompleks T-DNA dimasukkan ke dalam inti sel inang melalui proses impor aktif, setelah berada di dalam inti sel, T-DNA dibawa menuju ke titik tempat integrasi DNA pada kromosom, protein-protein pengawal DNA terlepas dan DNA akhirnya terintegrasi ke dalam genom inang (Sheng dan Citovsky 1996).
Proses transformasi juga dapat berlangsung bila T-DNA dan vir terdapat pada vektor plasmid yang berbeda dalam satu Agrobacterium (Hoekema 1983). Temuan tersebut dapat dijadikan sebagai dasar dalam menggunakan sistem vector binary dengan menggunakan plasmid yang lebih kecil dan lebih mudah untuk dimanipulasi. Ti-plasmid dari tipe liar (non-disarmed) atau Ti-plasmid yang gen onkogen sudah didelesi (disarmed) yang membawa regulon vir berfungsi sebagai
helper. T-DNA yang membawa gen yang akan ditransfer memiliki ori (origin of replication) yang kompatibel dalam Escherichia coli dan Agrobacterium terdapat pada plasmid yang lain. Dua kategori Ti-plasmid kointegrasi dalam plasmid biner (Van Wordragen dan Dons 1992).
Penggunaan Agrobacterium tumefaciens sebagai vektor dalam transfer gen pada mikroalga Schizochytrium telah dilakukan oleh Cheng et al. (2011), pada jamur/cendawan laut Blastocladiella emersonii oleh Vieira dan Camilo (2011), pada alga merah Porphyra yezoensis oleh Cheney et al. (2001). Pemakaian
cefotaxime dan kanamisin dalam menghambat proliferasi dan diferensiasi talus
Porphyra dan Agrobacterium tumefaciens telah juga dicobakan oleh Wang et al. (2010b).
Gen Penyandi Superoksida Dismutase
dan tetrazolium oksidase (McCord dan Fridovitch 1969). Enzim SOD berfungsi sebagai katalisator reaksi dismutase dari anion superoksida menjadi hidrogen peroksida (H2O2) dan oksigen (O2).
Enzim SOD melindungi sel-sel tubuh dan mencegah terjadinya proses peradangan yang diakibatkan oleh radikal bebas. Enzim ini telah berada dalam tubuh, agar tembaga bisa bekerja. Enzim SOD terdapat dalam semua organisme aerob dan sebagian besar berada dalam tingkat subseluler (intraseluler). Organisme aerob selalu membutuhkan oksigen untuk keberlangsungan hidupnya, namun dalam setiap aktivitasnya dapat menimbulkan senyawa oksigen reaktif atau radikal bebas oksigen (Hindarta 2008).
Aktif oksigen spesies (AOS) atau reaktif oksigen spesies (ROS) adalah merupakan senyawa radikal bebas yang sangat berbahaya bagi makhluk hidup, contohnya seperti radikal superoksida (O2-), radikal hidroksil (OH-) dan hidrogen
peroksida (H2O2). Pada tanaman senyawa ini terbentuk dalam sel melalui
beberapa cara, yaitu : (1) produksi fotokimia di atmosfer akibat dari pencemaran udara, (2) penyumbangan elektron langsung ke oksigen ketika terjadi fotosintesis terutama pada saat kondisi cahaya yang tinggi dan konsentrasi CO2 pada kloroplas
yang rendah, dan (3) respons terhadap kondisi cekaman seperti suhu tinggi, kekeringan, salinitas, ozon dan serangan mikrob patogen (Pritchard et al. 2000). Molekul O2- (superoksida) merupakan radikal bebas yang sangat reaktif. Molekul
ini akan berusaha melepaskan elektron bebasnya dan akan bereaksi dengan H+ membentuk H2O2. Proses selanjutnya hidrogen peroksida ini bereaksi dengan
superoksida membentuk radikal hidroksil (OH-). Keberadaan ion besi dan ion metal lainnya dapat memacu terbentuknya senyawa-senyawa AOS di dalam tanaman. Ion Fe2+ bila bereaksi dengan peroksida hidrogen akan membentuk radikal-radikal hidroksil (McKersie et al. 1996).
Untuk menghadapi efek negatif dari akumulasi AOS, tumbuhan memiliki suatu mekanisme sistem pertahanan antioksidan yang efisien, melibatkan baik enzim-enzim maupun senyawa-senyawa non-enzim (Loggini et al. 1999). Mekanisme pertahanan ini pada dasarnya dapat dikelompokkan menjadi tiga, yaitu : (1) reaksi yang melibatkan metabolit tertentu khususnya asam askorbat dan glutation, (2) mekanisme penyelamatan AOS yang melibatkan enzim-enzim seperti superoksida dismutase (SOD), katalase (CAT), glutation peroksidase
(GPX) dan askorbat peroksidase (APX) dan (3) mekanisme yang melibatkan enzim-enzim untuk regenerasi antioksidan seperti glutation reduktase (GR) dan
monodehidroascorbate reduktase (MDHAR) (Roxas et al. 2000).
Tanaman yang mengalami cekaman oksidatif karena adanya tekanan dari lingkungan baik itu berupa cekaman kekeringan, temperatur yang tinggi maupun faktor lain, maka tumbuhan akan menunjukkan overekspresi dari enzim-enzim yang berperan dalam perlindungan dari tekanan oksidatif tersebut, yaitu enzim
SOD, GPX, APX dan GR terutama pada tanaman tembakau yang masih muda menunjukkan overekspresi enzim yang lebih besar (Gupta et al. 1993). Overekspresi dari enzim-enzim tersebut karena berkaitan dengan proses detoksifikasi dari senyawa-senyawa AOS.
dikelompokkan menjadi tiga, yaitu Cu/Zn-SOD, Mn-SOD dan Fe-SOD (Bannister
et al. 1987). Secara subseluer, isoenzim-isoenzim ini terdistribusi di tempat-tempat yang berbeda. Mn-SOD ditemukan dalam mitokondria sel eukariot, sedangkan beberapa Cu/Zn-SOD ditemukan dalam sitosol dan kloroplas tanaman tingkat tinggi. Seringkali Fe-SOD tidak terdeteksi, namun ketika dicermati lebih lanjut ditemukan berkaitan dengan bagian kloroplas (Bowler et al. 1992).
Menurut Hannum (2012), gen penyandi SOD telah diisolasi dari jagung, tomat, sawi dan Nicotiana plumbaginifolia. Pada Arabidopsis thaliana, telah diisolasi tiga gen Cu/Zn-SOD, yaitu: CSD1, CSD2 dan CSD3. CSD1 dan CSD2
EVALUASI EFEK KONSENTRASI Agrobacterium tumefaciens, DURASI INOKULASI DAN KOKULTIVASI DALAM INTRODUKSI GEN
PENYANDI MmCu/Zn-SOD PADA Kappaphycus alvarezii
Evaluation of Agrobacterium tumefaciens Concentration, Inoculation Duration and Cocultivation Period Effect on Introducing MmCu/Zn-SOD
Gene in The Red Seaweed Kappaphycus alvarezii
ABSTRACT
Superoxide dismutase (SOD) has an important role in the defense system of the body, especially the activity of reactive oxygen compounds that can cause stress. This study was conducted to determine the optic density-600 (OD600) level of
Agrobacterium tumefaciens, duration of inoculation and co-cultivation to generate
Kappaphycus alvarezii transgenic carrying the SOD gene from Melastoma malabatrichum (MmCu/Zn-SOD). Six levels of A. tumefaciens OD600 (0.3, 0.4,
0.5, 0.6, 0.7 and 0.8), four duration of inoculation (10, 20, 30 and 60 min) and two periods of co-cultivation (3 and 4 days) were tested. The results demonstrated that the highest putative bud (100%) and transformation (100%) efficiencies were obtained by using inoculation duration of 60 minutes and 3 days of co-cultivation with OD600 of 0.5. However, regeneration efficiency of explants (6.67%) was
lower than the non-transgenic control (33.33%). The results of PCR analyses demonstrated the presence of MmCu/Zn-SOD gene in the transgenic explants, whereas the non-transgenic explants seaweed showed no amplification product. As conclusion, transgenic K. alvarezii could be produced by Agrobacterium tumefaciens-mediated method.
Keywords: Agrobacterium tumefaciens, co-cultivation, inoculation, introducing,
MmCu/Zn-SOD gene, Kappaphycus alvarezii.
PENDAHULUAN
Upaya yang dapat dilakukan untuk memperoleh kultivar tanaman dengan sifat dan bentuk baru yang diinginkan dalam waktu yang lebih singkat adalah dengan menggunakan teknik transformasi genetik. Teknik ini dilakukan dengan cara mengintroduksi gen penyandi sifat target yang diisolasi dari organisme lain (Datta, 2007).
Pada penelitian ini, gen yang diintroduksi adalah gen penyandi
superoksida dismutase (MmCu/Zn-SOD) yang berasal dari tanaman Melastoma malabathricum (Hannum 2012). SOD merupakan enzim yang mengkatalisis dismutase radikal anion superoksida (O2-) menjadi hidrogen peroksida (H2O2) dan
molekul oksigen(O2). Gen ini berperan penting dalam sistem pertahanan tubuh,
Gen MmCu/Zn-SOD telah ditransformasi pada tanaman Nicotiana benthamiana dan Nicotiana tabacum (Hannum 2012), tanaman jarak (Theresia, 2012) dan tanaman padi (Davis, 2012). Hanum (2012) berhasil memperoleh tanaman N. benthamiana dan N. tabacum transgenik dan gen MmCu/Zn-SOD ini berperan dalam toleransi terhadap cekaman aluminium. Theresia (2012) berhasil merakit tanaman jarak Jatropha curcas transgenik, dan Davis (2012) juga berhasil meregenerasi padi transgenik. Berdasarkan hasil tersebut, maka penelitian ini dilakukan untuk mengintroduksi gen MmCu/Zn-SOD pada K. alvarezii dalam rangka meningkatkan kemampuan adaptasi rumput laut terhadap cekaman lingkungan (salinitas).
Metode introduksi gen yang digunakan dalam penelitian ini adalah metode transfer DNA yang diperantarai bakteriAgrobacterium tumefaciens. Keberhasilan introduksi gen pada tanaman menggunakan Agrobacterium ditentukan oleh strain
Agrobacterium, konsentrasi Agrobacterium dalam satuan optic density (OD), durasi inokulasi, waktu kokultivasi, periode pre-kultur, konsentrasi asetosiringon dan antibiotik lainnya dalam media, tipe dan genotipe eksplan yang digunakan (Wu et al. 2006). Perakitan rumput laut K. alvarezii transgenik telah dilakukan Daud et al. (2013) dengan mengintroduksi gen penyandi sitrat sintase, Handayani
et al. (2014) dengan gen penyandi lisozim-C, dan Fajriah et al. (2015) dengan gen
metallothionein tipe II. Namun demikian, keberhasilan introduksi gen masih rendah. Oleh karena itu, pada penelitian ini dilakukan introduksi gen penyandi
MmCu/Zn-SOD untuk mendapatkan lama waktu inokulasi, kokultivasi dan OD yang dapat meningkatkan efektivitas transgenesis pada K. alvarezii.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Oktober 2012 hingga Desember 2013 di Laboratorium Biotechnology Research Indonesia-The Netherland (BIORIN) dan Laboratorium Biologi Molekuler dan Seluler Tanaman (BMST), Pusat Penelitian Sumberdaya Hayati dan Biologi (PPSHB) IPB, Bogor.
Prosedur Introduksi Gen Dimediasi oleh
Agrobacterium tumefaciens
Rumput Laut dan Preparasi Eksplan
Penyiapan Bakteri Agrobacterium tumefaciens
Dalam percobaan ini digunakan isolat A. tumefaciens LBA 4404 yang membawa plasmid pGWB5 dan mengandung gen penyandi MmCu/Zn-SOD yang dikendalikan oleh promoter 35S CaMV (Gambar 3). Bakteri diperbanyak dengan menumbuhkan koloni tunggal di dalam10 mL media Luria Broth (LB) cair yang mengandung 50 ppm kanamisin, 50 ppm streptomisin atau 50 ppm higromisin, digoyang dengan kecepatan 160 rpm pada suhu ruang selama 18 jam. Selanjut-nya, bakteri dipanen sebanyak 1,5 mL dan disentrifugasi dengan kecepatan 5000 rpm selama 5-10 menit pada suhu 28°C. Endapan Agrobacterium diresuspensi menggunakan media inokulasi (air laut dengan salinitas 28 g/L, 20 mL/L PES dan 0,1 mM asetosiringon hingga mencapai OD (λ=600 nM) yang dibutuhkan untuk perlakuan.
Gambar 3. Konstruksi plasmid biner pGWB5 yang membawa gen penyandi
MmCuZn-SOD (Hannum 2012).
Inokulasi dan Kokultivasi
Inokulasi dilakukan dengan cara merendam eksplan rumput laut dalam suspensi A. tumefaciens dengan OD600 0,3; 0,4; 0,5; 0,6; 0,7 dan 0,8 selama 15,
20, 30 dan 60 menit. Eksplan digoyang pada kecepatan 100 rpm, pada suhu ruang. Setelah itu, eksplan ditiriskan di atas kertas saring steril.
Kokultivasi dilakukan dengan cara menanam eksplan ke dalam media ko-kultivasi padat (28 g/L air laut; 0,3% gelrite; 0,1 mM asetosiringon) selama 3 dan 4 hari pada suhu 20-25 °C di ruang gelap. Jumlah eksplan yang digunakan setiap perlakuan adalah 10 eksplan dan setiap perlakuan terdiri atas 3 ulangan.
Pemulihan dan Seleksi Eksplan
cair (20 ml/L PES dan 28 g/L air laut steril) di ruang kultur hingga beregenerasi membentuk tunas.
Identifikasi Transgenik Menggunakan PCR
Ekstraksi DNA Genom Rumput Laut
Ekstraksi DNA genom rumput laut dilakukan mengikuti metode Edwards
et al. (1991) dengan sedikit modifikasi. Reaksi dilakukan dengan menggerus 1 mm tunas rumput laut tahan higromisin dalam microtube 1,5 mL yang berisi 50 µL bufer ekstraksi (200 mM Tris-HCl pH 7,5); 250 mM NaCl; 25 mM EDTA; 0,5% SDS) menggunakan spatula. Setelah halus, hasil gerusan ditambahkan dengan 100 µL etanol absolut dan dihomogenasi dengan vorteks selama 3 menit. Sampel selanjutnya disentrifugasi dengan kecepatan 10000 rpm suhu 4 °C selama 15 menit. Supernatan ditiriskan dengan membalikkan microtube pada kertas tisu selama 1 menit. Hasil endapan ditambahkan 50 µL bufer tris-EDTA (10 mM Tris-HCL pH 7,5; 1 mM EDTA) lalu dihomogenasi dengan vorteks selama 5 menit. Amplifikasi PCR dan Elektroforesis
Rumput laut transgenik diidentifikasi menggunakan PCR dengan primer spesifik MmSOD-F1: 5’-ATGGTGAAGGCTGTGGTTGT-3’ dan MmSOD-R2:
5’-CATCTCCAACGGTGACATTG-3’, dan 35S-F2: 5’-AAACCTCCTCGGAT- TCCATT-3’ dan MmSOD-R2: 5’-CATCTCCAACGGTGACATTG-3’ (Hannum 2012). Komposisi PCR yang digunakan untuk volume satu campuran reaksi PCR berjumlah 10 µL, terdiri atas: 50-100 ng DNA; 0,25 µL primer forward (10 pmol); 0,25 µL primer reverse (10 pmol); 5 µL Dream TaqTMGreen PCR Master Mix; dan 3,5 µL akuabides. Amplifikasi DNA target dilakukan menggunakan mesin PCR (Applied Biosystem). Proses PCR dilakukan sebanyak 40 siklus dengan kondisi pra-PCR pada 94 °C selama 15 detik, denaturasi 94 °C selama 2 menit, penempelan primer 55 °C selama 30 detik; ekstensi 72 °C selama 1 menit, dan ekstensi akhir 72 °C selama 5 menit.
Elektroforesis hasil PCR dilakukan pada gel agarosa 1% (b/v) pada tegangan 100 volt selama 30 menit. Gel diwarnai dalam larutan etidium bromida (0,5 mg/L) dan visualisasi hasil PCR diamati pada UV transiluminator. Dokumentasi fotografi dilakukan dengan perangkat gel doc.
Parameter Uji dan Analisis Data
HASIL
Penampilan Visual Eksplan
Dalam penelitian ini, konsentrasi Agrobacterium berdasarkan nilai OD600
dari 0,3-0,8 telah diuji. Namun demikian, eksplan hanya mampu bertahan di OD600 0,4 (3,2x108 CFU/mL) dan 0,5 (4,0x108 CFU/mL), sehingga kepadatan
bakteri OD600 0,4 dan 0,5 yang dapat digunakan untuk menghasilkan rumput laut
transgenik.
Percobaan pada OD600 0,4 dan 0,5 dengan durasi inokulasi 30-60 menit
dan kokultivasi selama 3-4 hari, menghasilkan tingkat kelangsungan hidup 100% (Gambar 4A). Eksplan mulai ditumbuhi tunas pada media pemulihan/recovery
(Gambar 4B); beberapa eksplan menunjukkan perubahan warna menjadi hijau, pucat dan kemudian akhirnya mati pada media seleksi higromisin (Gambar 4C). Secara umum, dari total 480 eksplan yang diintroduksi pada seluruh perlakuan, terdapat 198 eksplan tahan higromisin (41,25%), 118 eksplan yang telah bertunas (59,60%) dan ditemukan sebanyak 9 eksplan transgenik (Lampiran 2, Gambar 4D dan 4E). Dari total 30 eksplan non-transgenik, ada 10 eksplan yang menghasilkan tunas (Lampiran 2). Hal ini mengakibatkan efisiensi regenerasi talus non-transgenik (pada media non-seleksi) adalah 33,33%. Talus dari non-non-transgenik pada media seleksi seluruhnya mati (Gambar 4F).
Gambar 4. Penampilan visual dari rumput laut Kappaphycus alvarezii. A: eksplan pada media kokultivasi; B: eksplan pada media pemulihan; C: eksplan pada media seleksi; D: eksplan pada media PES cair; E: eksplan transgenik pada media PES cair; F: kontrol non-transgenik; ukuran skala warna putih: 1 cm.
Efisiensi Regenerasi
Secara umum pada OD600 0,4, efisiensi regenerasi (ER) menurun dengan
meningkatnya lama waktu inokulasi. Akan tetapi, tidak terjadi pada OD600 0,5.
perlakuan kokultivasi 3 hari dan pada 4 hari sebesar 33,33% (Gambar 5A). kultivasi 4 hari semua eksplan mati sehingga ERnya tidak ada atau sama dengan nol (Gambar 5A dan 5B).
Gambar 5. Efisiensi regenerasi pada durasi inokulasi 15, 20, 30 dan 60 menit dan waktu kokultivasi 3 dan 4 hari pada OD600 0,4 (A), dan 0,5 (B)
Efisiensi Tunas Putatif
Pengaruh perlakuan terhadap efisiensi tunas putatif disajikan pada Gambar 6. Efisiensi tunas putatif (ETP) terbesar (100%) diperoleh pada perlakuan OD600
0,4, lama inokulasi 20 menit dan waktu kokultivasi 4 hari (Gambar 6A), dan OD600 0,5, lama inokulasi 60 menit dan waktu kokultivasi 3 hari (Gambar 6B).
diperoleh nilai ETP terendah pada waktu kokultivasi 3 hari, sedangkan pada waktu kokultivasi 4 hari semua eksplan mati sehingga ETPnya tidak ada (Gambar 6A), sedangkan dengan OD600 0,5 diperoleh nilai ETP tertinggi pada waktu
ko-kultivasi 3 hari, adapun pada waktu koko-kultivasi 4 hari semua eksplan mati sehingga ETPnya juga tidak ada (Gambar 6B).
Gambar 6. Efisiensi tunas putatif pada durasi inokulasi 15, 20, 30 dan 60 menit dan waktu kokultivasi 3 dan 4 hari pada OD600 0,4 (A) dan 0,5 (B)
Efisiensi Transformasi
Efek perlakuan OD, lama waktu inokulasi dan kokultivasi terhadap efisiensi transformasi (ET) disajikan pada Gambar 7. Dengan menggunakan OD600 0,4 (Gambar 7A). ET tertinggi diperoleh pada perlakuan inokulasi 30 menit
kultivasi 3 hari. Sementara itu pada OD600 0,5 (Gambar 7B), ET tertinggi
diperoleh pada perlakuan inokulasi 60 menit dengan kokultivasi 3 hari (100,0%). ET pada perlakuan inokulasi 30 menit, kokultivasi 4 hari dan menggunakan OD600
0,5 adalah 10,0%, sedangkan pada inokulasi 30 menit, kokultivasi 3 hari hanya
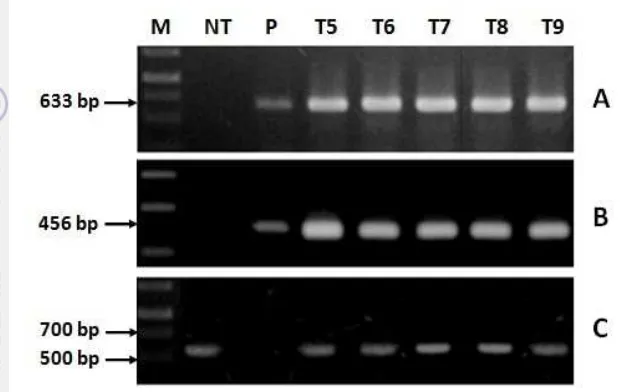
Keberadaan gen penyandi MmCu/Zn-SOD pada eksplan dikonfirmasi dengan metode PCR menggunakan tiga pasang primer (Gambar 8). Reaksi PCR dengan primer 35S-F dan MmCu/Zn-SOD R2 menghasilkan amplifikasi yang diharapkan pada setiap analisis transgenik. Sampel eksplan transgenik (kolom T5, T6, T7, T8 dan T9) memperlihatkan fragmen DNA berukuran 633 bp dengan menggunakan primer 35S-F dan MmCu/ZnSOD R2 (Gambar 8A), dan 456 bp menggunakan primer MmCu/Zn-SOD-F dan MmCu/Zn-SOD-R2 (Gambar 8B).
Selain itu, PCR menggunakan primer aktin kedelai sebagai kontrol internal
loading DNA genom rumput laut menghasilkan fragmen dengan ukuran sekitar 600 pb di kolom non-transgenik NT, dan kolom T5, T6, T7, T8 dan T9 (Gambar 8C). Dengan demikian, eksplan T5, T6, T7, T8 dan T9 adalah transgenik. Hal ini menunjukkan bahwa gen eksogen MmCu/Zn-SOD telah masuk ke dalam genom rumput laut.
Gambar 8. Hasil analisis DNA genom dari Kappaphycus alvarezii mengguna-kan PCR dengan 3 set primer. A: menggunamengguna-kan primer
35SF-MmSODR2; B: primer MmSODF–MmSODR2, dan C: menggunakan primer aktin kedelai; M: marker 1 kb DNA; NT: kontrol non-transgenik rumput laut; P: kontrol plasmid pGWB5- MmCU/Zn-SOD; T5-T9: rumput laut transgenik.
PEMBAHASAN
Pada studi pendahuluan, seluruh eksplan mengalami kematian bila menggunakan OD600 kurang dari 0,4 (3,2x108 CFU/mL) dan di atas OD600 0,5
(4x108 CFU/mL). Hal ini mungkin disebabkan OD600 > 0,5 (di atas 0,5) terjadi
pertumbuhan bakteri berlebih. Hal tersebut didukung oleh Siregar (1999) bahwa penggunaan tingkat populasi bakteri yang tinggi cenderung menurunkan jumlah eksplan yang hidup. Sementara itu, konsentrasi A. tumefaciens di bawah OD600
0,4, diduga tidak cukup untuk menginfeksi eksplan rumput laut. Menurut Gustian (2002), Agrobacterium sebagai alat transformasi membutuhkan kondisi tertentu (kepadatan tertentu) dalam proses transformasi gen yang optimal ke dalam sel atau jaringan tanaman.
Studi introduksi gen penyandi SOD telah dilakukan pada tanaman jarak menggunakan OD600 0,4-0,5 (Theresia, 2012), OD600 0,01 pada padi Japonica
(Davis 2012), dan OD600 0,5-0,8 pada N. benthamiana dan N. tabacum (Hannum
2012). Introduksi gen pada rumput laut telah diteliti dengan memasukkan gen yang berbeda menggunakan OD600 dari 0,5-1 oleh Handayani et al. (2014), Daud
secara umum rumput laut transgenik diproduksi menggunakan OD600 0,5. Hasil
tersebut berbeda dengan Kumar et al. (2010) yang melaporkan efisiensi tertinggi pada tanaman jatropa diperoleh pada perlakuan yang menggunakan OD600 0,6.
Menurut Siregar (1999) penggunaan populasi bakteri yang tinggi dalam proses transformasi perlu diperhatikan karena berhubungan dengan fase pertumbuhan bakteri dan kerentanan eksplan pada waktu inokulasi serta kokultivasi.
Efisiensi transformasi hanya ditemukan pada durasi inokulasi 30 dan 60 menit, baik pada OD600 0,4 dan 0,5 dengan lama waktu kokultivasi 3 hari. Namun
demikian, tidak diperoleh pada 4 hari kokultivasi dengan durasi inokulasi 60 menit. Hasil ini menunjukkan bahwa gen MmCu/Zn-SOD tidak masuk ke dalam genom rumput laut pada durasi inokulasi kurang dari 30 menit, dan hanya terjadi pada 30 dan 60 menit. Berbeda dengan tanaman jatropa yang menghasilkan efisiensi tertinggi pada durasi inokulasi 20 menit (Kumar et al. 2010). Perbedaan tersebut diduga disebabkan karena dinding sel rumput laut yang mengandung alginat yang memainkan peran penting dalam menjaga struktur jaringan alga (Rasyid 2003), sehingga butuh waktu lebih lama bagi Agrobacterium untuk bisa
Seperti halnya dengan efisiensi transformasi, efisiensi regenerasi yang diperoleh pada durasi inokulasi 30 menit (26,67%) lebih besar daripada yang dilaporkan oleh Handayani et al. (2014) yakni 23,56% (pada durasi inokulasi yang sama 30 menit). Hal tersebut diduga karena konsentrasi higromisin yang digunakan pada penelitian ini lebih rendah (10 µg/ml) dibandingkan penelitian Handayani (20 µg/ml). Dosis higromisin yang lebih rendah dapat mendukung pemulihan eksplan, yang ditunjukkan oleh jumlah eksplan bertunas yang di-hasilkan lebih banyak. Selanjutnya, efisiensi tunas putatif pada durasi inokulasi 60 menit mencapai 100%. Hasil ini juga lebih besar daripada yang dilaporkan oleh Handayani et al. (2014) sebesar 11,32%, dan Fajriah et al. (2015) sebesar 27,60%. Hal ini diduga karena lama waktu inokulasi (60 menit) lebih lama daripada yang digunakan Handayani et al. (2014), dan Fajriah et al. (2015), yaitu 30 menit.