PELABUHAN TANJUNG PRIOK
MADE ARY ANGGRENI SARASWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa Tesis Analisis Residu Antibiotika dalam Daging Sapi yang Diimpor Melalui Pelabuhan Tanjung Priok adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Imported Beef through Tanjung Priok Port. Under direction of HADRI LATIF and HERWIN PISESTYANI
Antibiotics are natural products of a microorganism, identical synthetic products or similar semi synthetic products that inhibit the growth of or destroy microorganisms. In veterinary medicine antibiotics are used for therapeutic, prophylactic, metaphylactic and nutritive purposes. The presence of antibiotics or their metabolites in food is potentially hazardous to health as it may cause allergic reactions in people and antibiotic resistance in pathogenic microorganisms. In addition antibiotics may influence starter cultures in food industry and lead to economic damage.
The aims of this research were to detect antibiotic residue in imported beef and to analyze the effectivenes of rapid test as screening method to detect antibiotic residue in imported beef as a part of quarantine inspection. Samples size was calculated using detect disease formula and selected by random sampling. Datas regarding the proportion of antibiotic positive samples were analyzed descriptively. Rapid test showed that, 24 of the 70 samples (34.29%) contained antibiotic residue, while 17 (24.29%) samples contained antibiotic residue detected by using bioassay. Bioassay showed that samples contained beta lactams, tetracycline, macrolide, and aminoglycoside.
Daging Sapi yang Diimpor melalui Pelabuhan Tanjung Priok. Dibimbing oleh HADRI LATIF dan HERWIN PISESTYANI
Daging merupakan produk pangan asal hewan yang dibutuhkan manusia sebagai sumber protein hewani, namun pangan asal hewan dapat terkontaminasi oleh bahaya biologis, kimiawi, atau fisik yang dapat mengakibatkan foodborne disease. Oleh karena itu, keamanan pangan asal hewan dan produknya merupakan persyaratan mutlak yang perlu mendapat perhatian, karena berkaitan dengan kesehatan masyarakat. Untuk memenuhi kebutuhan daging sapi, Indonesia masih mengimpor daging yang berasal dari Australia dan Selandia Baru. Daging impor ini berisiko mengandung residu antibiotika karena negara asal masih menggunakan antibiotika dalam hal pengobatan dan terapi.
Penelitian ini bertujuan untuk mengetahui keberadaan residu antibiotika dalam daging sapi impor, sebagai bagian dari tindak karantina di tempat pemasukan selain itu, untuk mengetahui efektifitas dan daya kerja rapid test sebagai uji tapis dalam mendeteksi residu antibiotika dalam daging sapi impor. Jumlah sampel dihitung menggunakan rumus deteksi penyakit (detect disease) yang ditetapkan oleh Martin et al. (1987). Pengujian dilakukan secara pararel dengan menggunakan rapid test dan bioassay (SNI 2008). Data dari penelitian ini dianalisa secara deskriptif untuk mengetahui efektifitas rapid test sebagai uji tapis untuk mendeteksi residu antibiotika dalam daging sapi impor.
Sebanyak 24 dari 70 sampel yang diuji (34.29%) menunjukkan hasil positif dengan pengujian rapid test dan 17 (24.29 %) sampel menunjukkan adanya residu antibiotika dengan bioassay. Hasil pengujian dengan bioassay memperlihatkan 14 sampel mengandung residu antibiotika golongan beta laktam, 12 sampel mengandung residu tetrasiklin, 2 sampel mengandung residu makrolida dan 1 sampel mengandung residu aminoglikosida. Hasil pengujian bioassay menunjukkan bahwa 1 sampel positif pada empat golongan antibiotika (beta laktam, tetrasiklin, makrolida, dan aminoglikosida), 1 sampel menunjukkan positif pada tiga golongan antibiotika (beta laktam, tetrasiklin, dan makrolida) dan 8 sampel positif pada 2 golongan antibiotika (beta laktam dan tetrasiklin). Luas hambatan pertumbuhan yang terbentuk pada bioassay dibaca dengan membandingkan kurva standar masing-masing golongan. Hasil yang diperoleh memperlihatkan bahwa konsentrasi residu setiap golongan masih berada di bawah batas maksimum residu (BMR) yang ditetapkan dalam SNI No. 01-6366-2000.
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PELABUHAN TANJUNG PRIOK
MADE ARY ANGGRENI SARASWATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kesehatan Masyarakat Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NIM : B251100124
Disetujui Komisi Pembimbing
Dr. drh. Hadri Latif, M.Si drh. Herwin Pisestyani, M.Si
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Kesehatan Masyarakat Veteriner
Dr. drh. Denny Widaya Lukman, M.Si Dr. Ir. Dahrul Syah, M.Sc. Agr
Puji dan syukur penulis panjatkan kepada Ida Sang Hyang Widi Wasa, Tuhan Yang Maha Esa atas segala karuniaNya sehingga tesis ini berhasil diselesaikan, walaupun harus melewati banyak rintangan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2011 sampai dengan April 2012 ini adalah Analisis Residu Antibiotika dalam Daging Sapi yang Diimpor melalui Pelabuhan Tanjung Priok.
Penghargaan setinggi-tingginya penulis ucapkan kepada ibu Kepala Badan Karantina Pertanian (Ir. Banun Harpini, M.Sc) beserta jajarannya yang telah memberikan kesempatan penulis untuk menempuh pendidikan ini, bapak Sekretaris Badan Karantina Pertanian (drh. Mulyanto, MM), dan bapak Kepala Pusat Karantina Hewan Badan Karantina Pertanian (drh. Sujarwanto, MM) atas arahan dan bimbingannya. Terima kasih juga penulis ucapkan kepada bapak Dr. drh. Hadri Latif, M.Si dan ibu drh. Herwin Pisestyani, M.Si selaku komisi pembimbing atas segala dukungan, bimbingan, dan arahan terhadap penelitian dan penulisan tesis. Penulis sampaikan terima kasih kepada bapak Dr. drh. Denny Widaya Lukman, M.Si selaku ketua Program Studi Kesehatan Masyarakat Veteriner, bapak drh. Chaerul Basri, M.Epid selaku side Manajer Program Studi kelas khusus karantina hewan, Prof. Dr. drh. Hj. Mirnawati B. Sudarwanto selaku penguji luar komisi, serta bapak Agus Haryanto S.E yang telah membantu kelancaran studi ini. Selain itu, terima kasih juga penulis ucapkan kepada bapak drh. Maton Hernowo (Kepala SKP Kelas I Sumbawa Besar), bapak drh. Agus Sunanto, M.P (Kepala BBKP Tanjung Priok), bapak drh. Saiful Muhtadin, M.M (Kepala BKP Kelas I Denpasar), bapak Dr. Ir. Antarjo Dikin, M.Sc (Kepala BUTTMKP) yang telah banyak memberikan fasilitas, kemudahan, dan saran, drh Arum Kusnila Dewi, M.Si, teman-teman laboratorium BBKP Tanjung Priok, bapak drh. Suparno, M.M, M.P (Kepala BPMPP) yang telah memberikan ijin untuk melakukan pengujian di BPMPP beserta staf (drh. Nuraini Triwijayanti, Riska Desitania, S.Si, Attya Asuh Insani, ST, dan Atzahar Reza siregar, S.TP, drh. Armin Riandi). Terima kasih juga kepada rekan-rekan kelas khusus karantina hewan (Gatot Santoso, Platika Widiani, Trifera Melaningrum, Hari Yuwono Ady, Doni Muksydayan, Helmi, Wulandari, Fitria Kusumaningrum, Endah Kusumawati, Endang Sri Pertiwi, Agus Jaelani, Amanatin, Siti Khadijah, Teuku Ali Imran) atas kebersamaan dan kekompakannya selama ini.
Akhirnya terima kasih yang dalam kepada bapak, ibu dan ibu mertua atas segala doanya. Suamiku tercinta, permata hatiku Nathan atas segala pengertian, kesabaran, doa, dan kasih sayangnya.
Atas segala kebaikan yang telah penulis terima, semoga Ida Sang Hyang Widi Wasa, Tuhan Yang Maha Esa melimpahkan rahmat dan karuniaNya kepada kita semua. Harapan penulis semoga tulisan ini dapat bermanfaat untuk mendukung kegiatan karantina di Indonesia.
Penulis dilahirkan di Denpasar pada tanggal 08 September 1979 dari ayah Ketut Suartana, BA dan ibu Dra. Nyoman Sunaryati. Penulis merupakan putri kedua dari empat bersaudara.
Halaman
Penggunaan Antibiotika di Peternakan ... 12
Dampak Residu Antibiotika ... 14
Reaksi Alergi ... 16
Efek Toksik ... 17
Mengganggu Keseimbangan Flora Usus ... 17
Efek Biologis ... 18
Metode Pengujian Residu Antibiotika ... 20
Rapid Test ... 20
Bioassay (Uji Tapis) ... 22
High Performance Liquid Chromatography (HPLC) ... 22
BAHAN DAN METODE
Metode Pengambilan Sampel ... 24
Pengujian Sampel ... 25
Rapid Test ... 25
Bioassay (Uji Tapis) ... 26
Pembuatan Kurva Baku ... 29
Persiapan Sampel ... 29
Persiapan Bakteri Uji ... 30
Pelaksanaan Pengujian... 31
Analisis Data ... 32
HASIL DAN PEMBAHASAN Jumlah dan Jenis Sampel ... 33
Hasil Pengujian Sampel dengan Rapid Test... 34
Hasil Pengujian Sampel dengan Bioassay ... 36
Rapid Test dan Bioassay dalam Pengujian Residu Antibiotika ... 39
Bahaya Residu Antibiotika dalam Daging Sapi Impor terhadap Kesehatan Masyarakat Indonesia ... 41
SIMPULAN DAN SARAN Simpulan ... 45
Saran ... 45
DAFTAR PUSTAKA ... 47
DAFTAR TABEL
Halaman
1 Komposisi kimiawi otot skelet mamalia
(persen berat daging segar) ... 5 2 Golongan antibiotika beserta turunannya ... 7 3 Karakteristik dan struktur kimia turunan Beta Laktam ... 8 4 Survei residu antibiotika di Amerika Serikat tahun 2008
dengan jumlah total sampel 32 890 ekor ... 13 5 Data survei residu antibiotika pada daging segar dan
daging olahan di beberapa daerah di Indonesia ... 14 6 Batas Maksimum Residu (BMR) antibiotika ... 15 7 Lama waktu henti (withdrawal time) antibiotika yang
digunakan pada ternak sapi di Canada... 16 8 Limit deteksi Premi® Test (ppb) ... 21 9 Hasil pengujian residu antibiotika dalam daging sapi impor
menggunakan rapid test ... 35 10 Hasil pengujian residu antibiotika dalam daging sapi impor
dengan bioassay ... 38 11 Hasil pengujian residu antibiotika dalam daging sapi impor
DAFTAR GAMBAR
Halaman
DAFTAR LAMPIRAN
Halaman
1 Hasil pengujian sampel dengan rapid test dan bioassay ... 55
2 Kurva standar antibiotika golongan tetrasiklin ... 57
3 Kurva standar antibiotika golongan makrolida ... 59
4 Kurva standar antibiotika golongan aminoglikosida... 61
PENDAHULUAN
Latar Belakang
Daging sapi merupakan sumber bahan pangan hewani yang mengandung gizi tinggi. Kebutuhan daging sapi di Indonesia terus meningkat dari tahun ke tahun. Sejak tahun 2007 sampai dengan 2008, pemenuhan daging dari produksi lokal dilaporkan lebih rendah dibandingkan jumlah daging yang dikonsumsi oleh masyarakat Indonesia (Ditjennak 2010). Untuk memenuhi kebutuhan daging dalam negeri, pemerintah mengeluarkan kebijakan impor daging sapi antara lain dari Australia dan Selandia Baru (Subagyo 2009).
Berdasarkan laporan tahunan Balai Besar Karantina Pertanian Tanjung Priok diperoleh data bahwa volume pemasukan daging sapi impor yang masuk melalui pelabuhan laut Tanjung Priok pada tahun 2009 sebesar 82 912.6 ton dan meningkat menjadi sebesar 99 281.7 ton pada tahun 2010 (BBKP Tanjung Priok 2010). Impor daging yang semakin meningkat, perlu mendapat perhatian dan pengawasan agar tidak merugikan konsumen. Salah satu tindakan pengawasan terhadap kualitas dan keamanan daging adalah dengan melakukan pengawasan terhadap keberadaan residu antibiotika.
Rumusan Masalah
Antibiotika banyak digunakan untuk mengobati penyakit dan sebagai Antibiotic Growth Promoters (AGP) dalam pakan ternak untuk memacu pertumbuhan ternak sehingga tumbuh lebih besar dalam waktu yang lebih pendek, serta untuk pengobatan terhadap infeksi bakteri. Residu obat dan metabolitnya terakumulasi dan disimpan dalam sel, jaringan, organ selama obat tersebut digunakan (Angulo et al. 2004; Dandy 2008).
Beta laktam, tetrasiklin, makrolida, dan aminoglikosida merupakan antibiotika yang penting saat ini baik untuk pengobatan manusia maupun hewan. Penggunaan antibiotika yang kurang tepat selama beberapa dekade terakhir, menimbulkan peningkatan resistensi mikroorganisme terhadap antibiotika. Resistensi mikroorganisme mengakibatkan pengobatan menjadi kompleks, proses penyembuhan lebih lama, dan penyakit menjadi semakin parah, bahkan pada beberapa kasus menimbulkan kematian. Tahun 2002 Centers for Disease Control and Prevention (CDC) melaporkan bahwa 99 000 orang meninggal akibat penyakit infeksius, pada anak-anak dan orang dewasa yang terinfeksi mikroorganisme yang resisten terhadap antibiotika (Klevens et al. 2007; Xian et al. 2007).
Bahaya yang ditimbulkan oleh residu antibiotika pada pangan asal hewan antara lain efek toksik, alergi, dan munculnya resistensi mikroorganisme terhadap antibiotika perlu mendapat perhatian serius dari karantina sebagai barisan pertahanan terdepan yang mempunyai peran penting dalam menjamin keamanan pangan asal hewan yang diimpor dari negara lain. Untuk itu diperlukan metode pengujian yang cepat, tepat, efisien, dan akurat untuk menjamin keamanan pangan dan memberikan pelayanan yang maksimal kepada pengguna jasa (importir daging).
Tujuan Penelitian
residu antibiotika dalam daging sapi impor sebagai bagian dari tindak karantina di tempat pemasukan.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah tersedianya data dan informasi mengenai gambaran residu antibiotika yang terkandung di dalam daging sapi impor. Manfaat lainnya adalah tersedianya metode pengujian yang cepat, tepat, akurat, dan efektif untuk mendeteksi keberadaan residu antibiotika dalam daging sapi, guna mendukung pelaksanaan tindak karantina di tempat pemasukan.
Hipotesis Penelitian
1. Tidak ditemukan residu antibiotika pada daging sapi yang diimpor dari Australia dan Selandia Baru.
TINJAUAN PUSTAKA
Daging
Daging merupakan salah satu hasil ternak yang tidak dapat dipisahkan dari kehidupan manusia. Menurut Soeparno (2005), daging didefinisikan sebagai semua jaringan hewan dan semua produk hasil pengolahan jaringan-jaringan tersebut yang sesuai untuk dimakan serta tidak menimbulkan gangguan kesehatan bagi yang mengonsumsinya. Organ-organ yang termasuk kategori daging adalah hati, ginjal, paru-paru, jantung, limpa, dan pankreas.
Protein merupakan komponen bahan kering terbesar yang terkandung di dalam daging, disamping komponen penting lainnya (Tabel 1).
Tabel 1 Komposisi kimiawi otot skelet mamalia (persen berat daging segar)
No Komponen Jumlah (%)
1 Air 75
2 Protein 18.5
3 Lipid 3
4 Substansi non protein nitrogen 1.5
5 Karbohidrat dan substansi non nitrogen 1 6 Konstituen anorganik (potasium, sulfur, klorin,
sodium, dll) dan vitamin 1
Sumber : Soeparno (2005)
Berdasarkan keadaan fisik, daging dapat dikelompokkan menjadi 6 yaitu : (1) daging segar yang dilayukan atau tanpa pelayuan; (2) daging segar yang dilayukan kemudian didinginkan (daging dingin); (3) daging segar yang dilayukan, didinginkan kemudian dibekukan; (4) daging masak; (5) daging asap; (6) daging olahan (Soeparno 2005).
hormon. Antibiotika yang sering ditambahkan di dalam pakan adalah penisilin, klortetrasiklin, dan oksitetrasiklin (Lawrie 2003; Soeparno 2005).
Antibiotika
Antibiotika adalah suatu zat kimia yang dapat membunuh atau menghambat pertumbuhan bakteri, yang diproduksi oleh mikroorganisme seperti cendawan (penisilin), bakteri (tetrasiklin dan eritromisin), atau bahan sintetik (sulfonamide dan florkuinolon) atau semi sintetik (amoksisilin, klarithromisin dan doksisiklin) (Guardabassi dan Kruse 2008). Menurut spektrum aktivitasnya, antibiotika dibagi menjadi dua yaitu antibiotika berspektrum sempit dan antibiotika berspektrum luas. Antibiotika berspektrum sempit antara lain penisilin, eritromisin, dan oleandomisin yang efektif terhadap bakteri Gram positif serta gentamisin dan streptomisin yang efektif terhadap bakteri Gram negatif. Berbeda dengan antibiotika berspektrum sempit yang hanya berefek sebagai anti bakteri terhadap beberapa jenis bakteri, antibiotika berspektrum luas mempunyai efek anti bakteri lebih luas baik terhadap bakteri Gram positif maupun Gram negatif. Contoh antibiotika berspektrum luas adalah kloramfenikol dan tetrasiklin (Wattimena et al. 1991).
Tabel 2 Golongan antibiotika beserta turunannya Golongan Turunan
Beta Laktam Penisilin, Benzyl Penisilin, Amoksisilin, Ampisilin, Kloksasilin, Diklosasilin, Mesilinam, Nafsilin, Cephalonium, Cephazolin, Asam klavulanat Aminoglikosida Apramisin, Destomisin A, Dihidrostreptomisin,
Fradiomisin, Hygromisin B, Gentamisin, Kanamisin, Streptomisin, Neomisin, Amikasin, Kanamisin sulfat, Framisetin
Tetrasiklin Klortetrasiklin, Doksisiklin, Oksitetrasiklin HCL, Minosiklin HCL
Makrolida Eritromisin, Kitasamisin, Mirosamisin, Spiramisin, Tylosin, Roxithromisin, Azithromisin
Peptida Avoparcin, Bacitracin, Kolistin, Thiopeptin, Virginamisin Polieter Flavophospholipol, Lasalosid, Monensin, Salinomisin,
Avilamisin
Kloramfenikol Kloramfenikol, Tiamfenikol Sumber : Oka et al. (1995)
Beta Laktam
Antibiotika golongan beta laktam diberi nama berdasarkan adanya cincin beta laktam. Sifat-sifat dari antibiotika beta laktam sangat tergantung dari ikatan cincin beta laktam dan ikatan gugus asam pada karbon yang terikat pada nitrogen beta laktam. Cincin beta laktam merupakan kunci aktifitas antibiotika golongan beta laktam. Jika salah satu cincin tersebut tidak ada atau terlepas, maka antibiotika tidak mampu untuk menghambat enzim transpeptidase pada pembentukan lapisan peptidoglikan dinding sel bakteri. Antibiotika beta laktam telah banyak dikembangkan dan ditemukan turunan baru dari golongan tersebut yang memiliki kemampuan menghambat bakteri yang lebih baik. Beberapa turunan beta laktam dengan strukturnya ditampilkan pada Tabel 3 (Morin dan Gorman 1995; Madigan et al. 2006).
Tabel 3 Karakteristik dan struktur kimia turunan Beta Laktam
Sumber : Madigan et al. (2006)
Karakteristik Struktur kimia
Penisilin Alami
Benzylpenisilin (penisilin G)
-bekerja efektif terhadap bakteri Gram positif -sensitif terhadap enzim beta laktamase Penisilin Semisintetik
Methisilin
-stabil terhadap asam
-resisten terhadap enzim beta laktamase Ampisilin
-spektrum luas (terutama Gram negatif) -stabil terhadap asam
-sensitif terhadap enzim beta laktamase Carbenisilin
-spektrum luas terutama Pseudomonas aeruginosa
-stabil terhadap asam, namun tidak efektif diberikan melalui oral
Mekanisme kerja antibiotika beta laktam dengan cara menghambat sintesis dinding sel bakteri. Pada proses pembentukan dinding sel, terjadi reaksi transpeptidase yang dikatalis oleh enzim transpeptidase (Penicillin binding proteins = PBPs) dan menghasilkan ikatan silang antara dua rantai peptida dan glukan. Enzim transpeptidase yang terletak pada membran sitoplasma bakteri tersebut juga dapat mengikat antibiotika beta laktam sehingga menyebabkan enzim ini tidak mampu mengkatalisis reaksi transpeptidase, walaupun dinding sel tetap terus dibentuk. Dinding sel yang terbentuk tidak memiliki ikatan silang dan peptidoglikan yang terbentuk tidak sempurna sehingga lebih lemah dan mudah terdegradasi. Pemberian secara oral hanya 5-30% dari dosis yang diserap, tergantung pada stabilitas asam dan ikatan pada makanan. Setelah penyerapan, penisilin tersebar luas dalam jaringan dan cairan tubuh (Adam 2002).
Aminoglikosida
Aminoglikosida merupakan golongan antibiotika dengan sifat kimia, antimikrobial, farmakologi, dan toksisitas yang sama serta mempunyai polar basa organik. Golongan antibiotika ini dihasilkan oleh bakteri dari golongan Streptomyces dan Micromonospora (Tjay dan Rahardja 2008). Golongan antibiotika ini terdiri dari streptomisin, kanamisin, gentamisin, tobramisin, apramisin, amikasin, dihidrostreptomisin, dan neomisin. Antibiotika golongan aminoglikosida banyak digunakan pada pengobatan manusia maupun hewan. Antibiotika ini efektif terhadap bakteri Gram negatif maupun bakteri Gram positif, diantaranya adalah bakteri Escherichia coli, Staphylococcus aureus, Klabsiela, Proteus, Seratia, dan Salmonella (Hisao et al. 1995).
pernafasan. Pada penggunaan secara oral, nausea, muntah, dan diare khususnya pada pemberian dosis tinggi. Aminoglikosida dapat melewati plasenta dan merusak ginjal serta menimbulkan ketulian pada bayi, sehingga antibiotika ini tidak dianjurkan selama kehamilan (Salyers dan Whitt 2005; Tjay dan Rahardja 2008).
Aminoglikosida bersifat larut di dalam air, stabil pada pH asam maupun basa, serta tahan terhadap pemanasan. Antibiotika ini biasanya digunakan sebagai feed additives yang dicampurkan pada pakan atau air minum atau dapat pula diberikan melalui injeksi (Hisao et al. 1995). Resistensi bakteri terhadap antibiotika golongan aminoglikosida dapat terjadi akibat kemampuan bakteri menghasilkan enzim yang dapat merombak struktur antibiotika. Resistensi bakteri terhadap streptomisin dan kanamisin dilaporkan sering terjadi, dengan pemberian yang dikombinasikan bersama antibiotika beta laktam dapat menghambat terjadinya resistensi dan pemberian kombinasi tersebut dapat saling memperkuat potensi obat (Tjay dan Rahardja 2008).
Makrolida
Tetrasiklin
Tetrasiklin adalah antibiotika yang umum digunakan sebagai obat hewan dan diisolasi dari bakteri Streptomyces aureofaciens. Antibiotika golongan tetrasiklin yang pertama kali ditemukan adalah klortetrasiklin dari Streptomyces aurofaciens, kemudian oksitetrasiklin dari Streptomyces rimosus. Golongan ini merupakan antibiotika yang bersifat bakteriostatik dan bekerja dengan jalan menghambat sintesis protein mikroba. Tetrasiklin memiliki spektrum yang luas, artinya antibiotika ini memiliki kemampuan melawan sejumlah bakteri patogen (Yuningsih et al. 2005). Antibiotika golongan tetrasiklin biasanya digunakan pada infeksi saluran pernafasan dan paru-paru, saluran kemih, kulit, dan mata (Tjay dan Rahardja 2008).
Sekitar 30-80% tetrasiklin diserap dalam saluran cerna. Absorpsi sebagian besar berlangsung di lambung dan usus halus, di dalam plasma semua jenis tetrasiklin terikat oleh protein plasma dalam jumlah yang bervariasi. Dalam cairan cerebrospinal (CSS) kadar antibiotika golongan tetrasiklin hanya 10-20% dalam serum. Penetrasi ke CSS ini tidak tergantung dari adanya meningitis. Penetrasi ke cairan tubuh lain dan jaringan tubuh cukup baik. Obat golongan ini ditimbun di hati, limpa, dan sumsum tulang serta di sentin dan email gigi (Karlina et al. 2009).
Efek samping penggunaan antibiotika golongan tetrasiklin adalah sifat penyerapannya pada jaringan tulang dan gigi yang sedang tumbuh pada janin dan anak-anak sehingga semua golongan tetrasiklin dilarang untuk diberikan pada usia kehamilan setelah bulan keempat, ibu menyusui serta anak-anak sampai usia mencapai delapan tahun. Pembentukan kompleks tetrasiklin-kalsiumfosfat dapat menimbulkan gangguan pada struktur kristal gigi serta pewarnaan dengan kuning kecoklatan yang lebih mudah berlubang (caries), efek lain adalah fotosensitasi yaitu kulit menjadi lebih peka terhadap cahaya, menjadi kemerahan dan gatal (Tjay dan Rahardja 2008).
Penggunaan Antibiotika di Peternakan
Penggunaan antibiotika pada hewan sama seperti pada manusia, yaitu untuk mengobati infeksi bakteri, membasmi agen penyakit, menyelamatkan hewan dari kematian, mengembalikan kondisi hewan untuk berproduksi dalam waktu yang relatif singkat dan mencegah penyebaran mikroorganisme ke lingkungan sekitarnya yang dapat mengancam kesehatan hewan dan manusia (Butaye et al. 2003).
Ditemukannya residu antibiotika pada karkas juga dapat terjadi karena penambahan antibiotika pada pakan ternak. Residu antibiotika ini menimbulkan dampak yang lebih besar bila antibiotika digunakan sebagai pemacu pertumbuhan. Efek yang dihasilkan dengan penambahan antibiotika pada pakan yang utama adalah peningkatan deposit protein, biasanya terkait dengan penurunan penggunaan lemak dan meningkatkan produksi daging. Hal ini terjadi akibat meningkatnya efisiensi konversi pakan menjadi daging. Residu antibiotika yang ditimbulkan pada produk asal ternak, berakibat buruk bagi kesehatan manusia (Reig dan Toldra 2008).
Tabel 4 Survei residu antibiotika di Amerika Serikat tahun 2008 dengan
Antibiotika olaquinodik, basitrasin, tilosin, dan virginiamisin sudah dilarang penggunaannya sebagai imbuhan pakan di Eropa sejak tahun 1999. Berdasarkan Feed Additive Compendium, ada beberapa antibiotika yang direkomendasikan sebagai imbuhan pakan pada pakan unggas dan hewan lain, seperti penisilin, basitrasin, streptomisin, eritromisin, tilosin, neomisin, tetrasiklin, oksitetrasiklin, klortetrasiklin, linkomisin, spiramisin, dan virginiamisin (Butaye et al. 2003).
Beberapa peneliti melaporkan bahwa dibutuhkan antibiotika dalam jumlah banyak untuk pengobatan, pencegahan, dan sebagai pemacu pertumbuhan pada ternak penghasil daging. Di Australia, penggunaan antibiotika pada peternakan masih digunakan sebagai pengobatan yang disebabkan oleh infeksi mikroorganisme seperti bakteri, protozoa, dan jamur (NRS 2010).
Tabel 5 Data survei residu antibiotika pada daging segar dan daging olahan di beberapa daerah di Indonesia
Jenis antibiotika
2004 (n = 572)
2003 (n = 412)
2002 (n = 100) Bali, NTB, NTT NTB dan NTT Kab. Badung
Penisilin 31 (5.4%) 8 (1.9%) 10 (10%)
Tetrasiklin 2 (0.3%) 7 (1.7%) 3 (3%)
Aminoglikosida 18 (3.1%) 6 (1.4%) 2 (2%)
Makrolida 83 (14.5%) 4 (0.9%) 4 (4%)
Sumber : Dewi et al. (2002); Handayani et al.(2003); Handayani et al. (2004)
Laporan World Health Organization (WHO) menyebutkan munculnya resistensi bakteri patogen terhadap antibiotika menjadi permasalahan di seluruh dunia. Munculnya fenomena resistensi bakteri patogen tersebut diantaranya disebabkan oleh penggunaan antibiotika yang tidak tepat pada ternak. Resistensi bakteri patogen terhadap antibiotika pada hewan dapat ditularkan ke manusia, akibat terbawanya gen resisten tersebut dalam bahan pangan asal hewan seperti daging, telur, dan susu yang dikonsumsi (Barber et al. 2003; WHO 2011).
Dampak Residu Antibiotika
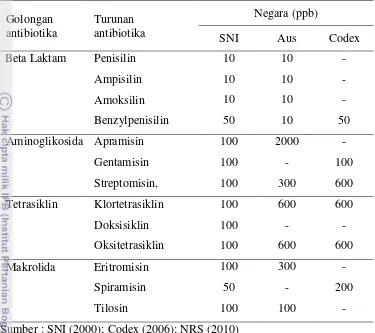
Tabel 6 Batas Maksimum Residu (BMR) antibiotika
Aminoglikosida Apramisin 100 2000 -
Gentamisin 100 - 100
Streptomisin, 100 300 600
Tetrasiklin Klortetrasiklin 100 600 600
Doksisiklin 100 - -
Pakan yang mengandung antibiotika akan berinteraksi dengan jaringan (organ) dalam tubuh ternak, walaupun dalam jumlah kecil tetapi akan berefek kronis dan tetap berada dalam tubuh ternak. Senyawa induk dan metabolitnya sebagian akan dikeluarkan dari tubuh melalui urin dan feses, tetapi sebagian lagi akan tetap tersimpan di dalam jaringan (organ tubuh) yang disebut sebagai residu. Jika pakan dicampur antibiotika secara terus menerus, maka residu antibiotika tersebut akan terakumulasi di dalam jaringan dengan konsentrasi yang bervariasi diantara organ tubuh (Adam 2002).
Tabel 7 Lama waktu henti (withdrawal time) antibiotika yang digunakan pada
Oksitetrasiklin Imbuhan pakan 28
Klortetrasiklin Bervariasi 18
Gentamisin Bervariasi 30
Neomisin Imbuhan pakan 7
Tilosin Bervariasi 21
Eritromisin Bervariasi 14
Tilmikosin Suntikan 21
Sumber: Oka et al. (1995)
Residu antibiotika dalam pangan asal hewan dapat menyebabkan gangguan kesehatan pada manusia diantaranya menyebabkan reaksi alergi, efek toksik, mengganggu keseimbangan flora usus, dan efek biologis resistensi mikroorganisme (Bahri et al. 2005).
Reaksi Alergi
Efek Toksik
Antibiotika dapat mempengaruhi kesehatan manusia secara langsung maupun tidak langsung. Secara langsung antibiotika memiliki sifat toksik bagi manusia, sebagai contoh khloramfenikol memiliki efek samping yang cukup serius, yaitu penekanan aktivitas sumsum tulang yang berakibat pada gangguan pembentukan sel-sel darah merah. Kondisi ini dapat menyebabkan aplastik anemia yang secara potensial berakibat fatal (Naim 2002). Efek toksik pada manusia akibat residu antibiotika yang terdapat dalam bahan pangan asal hewan, erat hubungannya dengan dosis dan jangka waktu pengunaan antibiotika pada ternak (Focosi 2005).
Mengganggu Keseimbangan Flora Usus
Penggunaan antibiotika tidak hanya menyebabkan resistensi pada bakteri patogen yang sedang ditangani tetapi juga pada mikroorganisme lain yang ada dalam saluran pencernaan. Kemungkinan lain adalah adanya gangguan terhadap flora normal yang ada pada saluran pencernaan manusia karena adanya residu antibiotika pada makanan. Berkurangnya flora normal dalam saluran pencernaan akan mengakibatkan berkembangnya bakteri patogen (Reig dan Toldra 2008). Penambahan antibiotika dalam pakan akan menekan mikroorganisme dalam usus sehingga dapat membantu memperbaiki pertumbuhan dan meningkatkan bobot ternak. Namun, pengunaan antibiotika sebagai feed additive dikhawatirkan merubah proporsi dari bakteri spesifik di dalam saluran pencernaan (seperti Enterococcus faecium, Campylobacter spp., E. coli) yang terus membentuk koloni lebih banyak dari spesies bakteri yang tidak berbahaya, sehingga menekan pertumbuhan bakteri yang tidak berbahaya (Metzler et al. 2005).
ditimbulkan dari residu antibiotika pada pangan segar asal hewan adalah dampak yang ditimbulkan terhadap mikroflora normal yang terdapat dalam saluran pencernaan manusia yang secara normal berfungsi sebagai barier terhadap bakteri patogen. Akibat adanya residu antibiotika pada makanan yang dikonsumsi akan mengurangi jumlah mikroflora normal yang terdapat dalam saluran pencernaan manusia (Reig dan Toldra 2008).
Berkurangnya mikroflora normal dalam saluran pencernaan akan mengakibatkan bakteri patogen yang tidak diinginkan tumbuh semakin banyak. Residu antibiotika akan mengakibatkan terjadinya resistensi bakteri patogen seperti Salmonella sp, Clostridum difficele, Campylobacter sp, Entero-Phatogenic E. coli, Staphylococcus aureus, Candida sp terhadap antibiotika. Berkembangnya bakteri patogen ini akan mengakibatkan diare atau enterocolitis. Residu antibiotika ini juga dapat mengakibatkan meningkatnya ketebalan dan atau aktifitas enzim beberapa bakteri di dalam usus, namun belum diketahui akibatnya secara pasti (Corpet 2000).
Efek Biologis
Masalah resistensi mikroba terhadap antibiotika bukanlah masalah yang baru. Sejak tahun 1963, WHO telah mengadakan pertemuan tentang aspek kesehatan masyarakat dari penggunaan antibiotika dalam makanan dan bahan makanan. Penggunaan antibiotika sebagai pemacu pertumbuhan mengakibatkan pertumbuhan bakteri yang resisten terhadap antibiotika yang umum digunakan untuk terapi. Konferensi WHO pada tahun 1997 di Berlin membahas tentang dampak medis akibat penggunaan antibiotika pada pakan ternak (Angulo 2004).
dosis antibiotika yang diberikan, spesies agen penyakit, mekanisme farmakokinetik antibiotika, status pertahanan tubuh inang, dan konsentrasi antibiotika yang dapat mencapai bakteri dalam organ atau jaringan tubuh inang (EMEA 1999; Fluit et al. 2001).
Munculnya resistensi bakteri terhadap antibiotika dipengaruhi oleh adanya gen resistensi yang terdapat dalam plasmid, transposon, atau dalam kromosom bakteri. Resistensi beta laktam umumnya diakibatkan oleh kemampuan mikroba mensintesis enzim penisilinase yang mampu memecah cincin beta laktam penisilin menjadi penicilloic acid yang tidak aktif (Nastasi et al. 2000). Gen bakteri yang mengendalikan sifat resistensi antibiotika umumnya spesifik terhadap antibiotika atau golongan antibiotika tertentu, tapi beberapa gen resisten dapat mengendalikan satu jenis atau golongan antibiotika yang sama. Sebagai contoh, pada golongan beta laktam terdapat paling sedikit 25 gen resisten, golongan aminoglikosida terdapat 18 gen resisten, golongan ampisilin terdapat 4 gen resisten, golongan tetrasiklin terdapat 24 gen resisten, golongan kloramfenikol terdapat 7 gen resisten, dan golongan trimetoprim-sulfametoksasol terdapat 15 gen resisten (Salyers dan Whitt 1994; Fluit et al. 2001; Cabrera et al. 2004; Chen et al. 2004)
Konsekuensi dari penggunaan antibiotika dalam dunia peternakan adalah kemungkinan terjadinya transfer dari gen-gen resisten yang berasal dari isolat hewan pada bakteri patogen dalam tubuh manusia. Hal ini menjadi masalah utama dalam kesehatan masyarakat karena adanya suatu penemuan yang memperlihatkan bahwa bakteri tersebut dapat masuk ke dalam rantai makanan manusia dan dapat menyebabkan terjadinya resistensi pada mikroba dalam tubuh manusia yang akhirnya akan mempengaruhi kesehatan (Nicholls 2000; Barber et al. 2003).
Salmonella enteritidis yang resisten terhadap fluorokuinolon (Piddock 1995; Wain et al. 1997).
Penggunaan antibiotika sebagai pemacu pertumbuhan dilarang sejak tahun 1986, sejak saat itu antibiotika hanya diijinkan digunakan oleh dokter hewan sebagai terapi untuk penyembuhan atau pencegahan penyakit. Kemudian pada tahun 1999, European Union Scientific Steering Committee telah meninjau ulang penggunaan antibiotika sebagai pengobatan dan non pengobatan dalam European Commission Health and Consumer Protection Directorate 2003. Sebagai konsekuensinya maka penggunaan antibiotika dalam pakan di Eropa telah dilarang pada tahun 1999 sebagai sebuah tindakan percobaan pengukuran untuk meminimalisir risiko peningkatan bakteri yang resisten dan untuk menjaga efektivitas kegunaan beberapa antibiotika dalam pengobatan (Metzler et al. 2005).
Selama beberapa dekade, peningkatan bakteri yang resisten terhadap antibiotika menimbulkan persoalan tentang penggunaan antibiotika, terkait dengan residu pada bahan pangan dan peningkatan resistensi bakteri terhadap antibiotika. Berbagai usaha terus dilakukan untuk mengawasi penggunaan antibiotika baik sebagai terapi maupun pemacu pertumbuhan (Reig dan Toldra 2008).
Metode Pengujian Residu Antibiotika
Pengujian residu antibiotika dapat dilakukan dengan beberapa cara mulai dari pengujian rapid test, screening test sampai uji konfirmasi. Beberapa pilihan rapid test diantaranya Premi® Test, Beta star, SNAP. Pemeriksaan residu dengan metode screening dapat dilakukan dengan menggunakan bioassay, ELISA, TLC. Sedangkan untuk uji konfirmasi digunakan HPLC atau HPLC/MS/M) (Nisha 2008).
Rapid Test
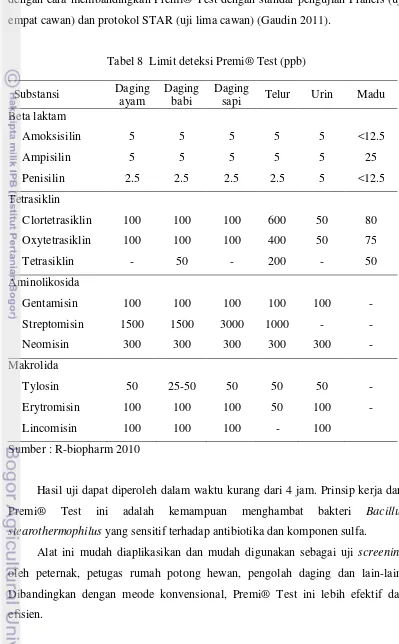
golongan beta laktam, tetrasiklin, makrolida dan sulfonamide. Premi® Test telah diakreditasi oleh AFNOR (asosiasi kenormalan Prancis). Validasi dilakukan dengan cara membandingkan Premi® Test dengan standar pengujian Prancis (uji empat cawan) dan protokol STAR (uji lima cawan) (Gaudin 2011).
Tabel 8 Limit deteksi Premi® Test (ppb) Substansi Daging
Hasil uji dapat diperoleh dalam waktu kurang dari 4 jam. Prinsip kerja dari Premi® Test ini adalah kemampuan menghambat bakteri Bacillus stearothermophilus yang sensitif terhadap antibiotika dan komponen sulfa.
Bioassay (Uji Tapis)
Bioassay merupakan suatu pengujian menggunakan mikroorganisme untuk mendeteksi senyawa antibiotika yang masih aktif. Uji tapis dengan menggunakan bioassay pada daging, telur, dan susu dapat dilakukan untuk mendeteksi residu antibiotika golongan penisilin, tetrasiklin, aminoglikosida, dan makrolida. Prinsip pengujian ini adalah bahwa residu antibiotika akan menghambat pertumbuhan mikroorganisme pada media agar. Penghambatan dapat dilihat dengan terbentuknya daerah hambatan di sekitar kertas cakram. Untuk pengujian residu penisilin digunakan bakteri Bacillus stearothermophilus American Type Culture Collection (ATCC) 7953, untuk pengujian residu tetrasiklin digunakan Bacillus cereus ATCC 11778, untuk pengujian residu aminoglikosida digunakan Bacillus subtilis ATCC 6633, dan untuk pengujian residu makrolida digunakan Kocuria rizophila (Micrococcus luteus) ATCC 9341.
High Performance Liquid Chromatography (HPLC)
METODE PENELITIAN
Tempat Penelitian
Pengambilan sampel daging sapi impor untuk penelitian ini dilakukan di Instalasi Karantina Produk Hewan (IKPH). Pengujian sampel dilakukan di laboratorium Balai Besar Karantina Pertanian (BBKP) Tanjung Priok, Balai Uji Terap Teknik dan Metode Karantina Pertanian (BUTTMKP), dan Balai Pengujian Mutu Produk Peternakan (BPMPP).
Waktu Penelitian
Penelitian dilaksanakan pada bulan Juni 2011 sampai dengan bulan April 2012.
Bahan dan Alat
Bahan
Bahan yang digunakan dalam penelitian ini adalah daging sapi yang diimpor melalui pelabuhan Tanjung Priok, akuabides steril, alkohol, plastik sampel, mikropipet, Kit Premi® test (R-Biopharm AG, Jerman), Bacillus stearothermophilus ATCC 7953, larutan baku pembanding penisilin G, yeast extract, peptone, bacto agar, dextrose, Bacillus cereus ATCC 11778, larutan baku pembanding oksitetrasiklin hidroklorida, beef extract, Bacillus subtilis ATCC 6633, larutan baku pembanding kanamisin sulfat, Kocuria rizophila (Micrococcus luteus) ATCC 9341, larutan baku pembanding tilosin-tartrat, glucose, media cair Heart Infusion Broth (HIB), kalium hidrogen fosfat (KH2PO4), dinatrium
hidrogen fosfat (Na2HPO4), asam fosfat (H3PO4), natrium hidroksida (NaOH),
dikalium hidrogen fosfat (K2HPO4), asam klorida (HCl), natrium klorida (NaCl),
Alat
Alat yang digunakan pada penelitian ini adalah cawan Petri 100 x 12 mm, tabung reaksi ukuran 7 ml, 20 ml, 50 ml, tabung sentrifus ukuran 50 ml, labu ukur 50 ml, 100 ml, gelas ukur 100 ml, 500 ml, Erlenmeyer 250 ml, 500 ml, pipet volumetrik ukuran 10 ml, pengocok tabung, sentrifus, penangas air, homogenizer, autoklaf, refrigerator, freezer, timbangan analitik, inkubator, magnet pengaduk, pH meter, mikropipet 50-300 µl, jangka sorong, pinset, gunting, bunsen, ose.
Metode Pengambilan Sampel
Sampel yang diambil berupa daging sapi tanpa tulang dan tanpa lemak. Jumlah sampel dihitung berdasarkan rumus deteksi penyakit (detect disease) yang ditetapkan oleh Martin et al. (1987):
n = [1- (1-a) 1/D] [N-(D-1)/2] Keterangan :
N = Jumlah populasi n = Ukuran sampel
a = Tingkat kepercayaan (95%)
D = Nilai dugaan populasi yang sakit (D=PxN, dengan asumsi P: 5%)
Perhitungan sampel berdasarkan jumlah daging sapi yang diimpor pada tahun 2010 (BBKP Tanjung Priok 2010) yaitu sebesar 99 281 690 kg dikonversi ke dalam boks dengan berat rata-rata setiap boks adalah 27.2 kg, maka jumlah komoditi menjadi sebesar 3 650 062 boks. Hasil perhitungan besaran sampel dengan perangkat Win Episcope 2.0 diperoleh sampel sebanyak 59 dan dibulatkan menjadi 70 sampel.
sampel yang diinginkan. Sampel diuji menggunakan rapid test dan Bioassay, seperti yang ditampilkan pada Gambar 1.
Gambar 1 Skema penelitian.
Pengujian Sampel
Semua sampel daging diperiksa terhadap kandungan residu antibiotika menggunakan rapid test dan bioassay. Sebelum dilakukan pengujian, sampel diambil sebanyak 150 g, daging dipotong menjadi ukuran kecil dicampur hingga homogen, kemudian ditimbang sesuai kebutuhan masing-masing pengujian.
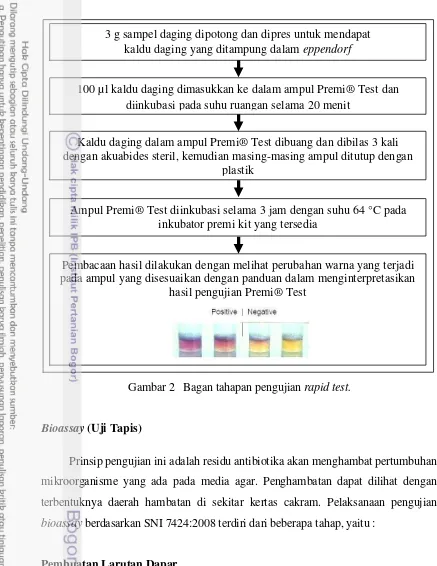
Rapid Test
Prinsip kerja rapid test adalah antibiotika akan menghambat pertumbuhan bakteri Bacillus stearothermophilus. Tahapan pengujian rapid test disajikan dalam bagan pada Gambar 2.
SAMPEL
RAPID TEST BIOASSAY
golongan beta laktam
golongan tetrasiklin
golongan makrolida
Gambar 2 Bagan tahapan pengujian rapid test.
Bioassay (Uji Tapis)
Prinsip pengujian ini adalah residu antibiotika akan menghambat pertumbuhan mikroorganisme yang ada pada media agar. Penghambatan dapat dilihat dengan terbentuknya daerah hambatan di sekitar kertas cakram. Pelaksanaan pengujian bioassay berdasarkan SNI 7424:2008 terdiri dari beberapa tahap, yaitu :
Pembuatan Larutan Dapar
Larutan dapar fosfat nomor 1 dibuat dengan menimbang 7 g KH2PO4 dan 6 g
Na2HPO4 yang dilarutkan dalam akuabides sampai 1 000 ml, dengan mengatur pH
hingga menjadi 6.0 ± 0.1, lalu disterilisasi menggunakan autoklaf pada suhu 121 ± 1 ºC, 15 psi atau 1.03421 x 105 pascal selama 15 menit.
Larutan dapar fosfat nomor 2 dibuat dengan menimbang 6.4 g KH2PO4 dan
3 g sampel daging dipotong dan dipres untuk mendapat kaldu daging yang ditampung dalam eppendorf
100 µl kaldu daging dimasukkan ke dalam ampul Premi® Test dan diinkubasi pada suhu ruangan selama 20 menit
Kaldu daging dalam ampul Premi® Test dibuang dan dibilas 3 kali dengan akuabides steril, kemudian masing-masing ampul ditutup dengan
plastik
Ampul Premi® Test diinkubasi selama 3 jam dengan suhu 64 °C pada inkubator premi kit yang tersedia
Pembacaan hasil dilakukan dengan melihat perubahan warna yang terjadi pada ampul yang disesuaikan dengan panduan dalam menginterpretasikan
18.9 g Na2HPO4 yang dilarutkan dalam akuabides sampai 1 000 ml, dengan
mengatur pH hingga menjadi 7.0 ± 0.1, kemudian disterilisasi dengan autoklaf pada suhu 121 ± 1 ºC, dengan tekanan 15 psi atau 1.03421 x 105 pascal selama 15 menit.
Larutan dapar fosfat nomor 3 dibuat dengan menimbang 3.5 g KH2PO4 dan 3
g Na2HPO4 yang dilarutkan dalam akuabides sampai 1 000 ml, dengan mengatur pH
hingga menjadi 6.0 ± 0.1, kemudian disterilisasi dengan autoklaf pada suhu 121 ± 1 ºC, dengan tekanan 15 psi atau 1.03421 x 105 pascal selama 15 menit.
Pembuatan Media
Pembuatan media biakan Bacillus stearothermophilus untuk golongan penisilin dilakukan dengan menimbang peptone 5 g, yeast extract 12 g, bacto agar 15 g, dextrose 1 g dan akuabides 1 000 ml. Peptone, dextrose, dan yeast extract dilarutkan dalam sebagian akuabides, setelah tercampur rata ditambahkan bacto agar dan ditambahkan akuabides hingga volume keseluruhan menjadi 1 000 ml. Sesuaikan pada pH 5.7 ± 0.1 dan dididihkan sampai bacto agar terlarut.
Media biakan Bacillus subtilis untuk golongan aminoglikosida dibuat dengan menimbang peptone 5 g, beef extract 3 g, bacto agar 15 g dan akuabides 1 000 ml. Peptone dan beef extract dilarutkan dalam sebagian akuabides kemudian ditambahkan bacto agar, selanjutnya ditambahkan akuabides hingga volume keseluruhan menjadi 1 000 ml. Sesuaikan pada pH 8.5 ± 0.1 dan dididihkan sampai bacto agar terlarut.
Media biakan Bacillus cereus untuk golongan tetrasiklin dibuat dengan menimbang peptone 6 g, beef extract 1.5 g, yeast extract 3 g, KH2PO4 1.35 g, bacto
agar 15 g dan akuabides 1 000 ml. Peptone, beef extract, yeast extract dan KH2PO4
dilarutkan dalam sebagian akuabides, kemudian ditambahkan bacto agar, selanjutnya ditambahkan akuabides hingga volume menjadi 1 000 ml. Sesuaikan pada pH 5.7 ± 0.1 dan dididihkan sampai bacto agar terlarut.
ditambahkan bacto agar, selanjutnya ditambahkan akuabides hingga volume menjadi 1 000 ml. Sesuaikan pada pH 8.5 ± 0.1 dan dididihkan sampai bacto agar terlarut.
Media biakan bakteri (media nomor 1) dibuat dengan menimbang peptone 10 g, beef extract 5 g, NaCl 2.5 g, bacto agar 20 g dan akuabides 1 000 ml. Peptone, beef extract danNaCl dilarutkan dalam sebagian akuabides, kemudian ditambahkan bacto agar, selanjutnya ditambahkan akuabides hingga volume menjadi 1 000 ml. Sesuaikan pada pH 6.5 ± 0.1 dan dididihkan sampai bacto agar terlarut.
Semua media biakan disterilisasi dalam autoklaf pada suhu 121 ± 1 ºC, dengan tekanan 15 psi atau 1.03421 x 105 pascal selama 15 menit.
Pembuatan Larutan Stok Baku Pembanding
Sebelum melakukan penimbangan, perlu diperhitungkan potensi dari masing-masing standar yang tertera pada label. Pembuatan larutan baku pembanding penisilin dilakukan dengan menimbang sejumlah baku penisilin G kemudian dilarutkan dalam dapar nomor 1 hingga didapatkan konsentrasi 1 000 IU/ml.
Larutan baku pembanding oksitetrasiklin dibuat dengan menimbang sejumlah baku pembanding oksitetrasiklin hidroklorida kemudian dilarutkan dalam akuabides hingga diperoleh konsentrasi 1 000 µg/ml. Pembuatan larutan baku pembanding kanamisin dilakukan dengan menimbang sejumlah baku pembanding kanamisin sulfat kemudian dilarutkan dalam dapar nomor 3 hingga diperoleh konsentrasi 1 000 µg/ml. Larutan baku pembanding tilosin dibuat dengan menimbang sejumlah baku pembanding tilosin tartrat dilarutkan 10% methanol dalam akuabides hingga diperoleh konsentrasi 1 000 µg/ml.
Pembuatan Larutan Baku Kerja
digunakan sebagai larutan kurva baku adalah konsentrasi 0.04 IU/ml, 0.02 IU/ml, 0.01 IU/ml, 0.005 IU/ml, dan 0.0025 IU/ml.
Pembuatan larutan baku kerja untuk oksitetrasiklin, kanamisin, dan tilosin dilakukan dengan cara yang sama yaitu masing-masing larutan stok baku diambil 2 ml, diencerkan dengan dapar nomor 2 sampai dengan 20 ml untuk memperoleh larutan baku kerja 100 µg/ml. Selanjutnya dilakukan pengenceran serial dengan konsentrasi 10 µg/ml, 4 µg/ml, 2 µg/ml, 1 µg/ml, 0.5 µg/ml, dan 0.25 µg/ml. Konsentrasi yang digunakan sebagai larutan kurva baku standar adalah konsentrasi 4 µg/ml, 2 µg/ml, 1 µg/ml, 0.5 µg/ml, dan 0.25 µg/ml.
Pembuatan Kurva Baku
Media cair yang telah disiapkan ditambahkan 1 ml bakteri (dengan konsentrasi 1.1 × 108 cfu/ml) sesuai golongan antibiotika yang akan diuji, sebanyak 8 ml dituang ke dalam masing-masing cawan. Didiamkan pada suhu kamar hingga mengeras. Larutan baku kerja yang akan digunakan untuk setiap golongan antibiotika dan larutan dapar fosfat digunakan sebagai kontrol negatif, diteteskan masing-masing sebanyak 75 µl pada kertas cakram dengan diameter 8 mm, biarkan sampai meresap sebelum diletakkan pada media sesuai golongan antibiotika. Diinkubasi pada suhu 55 ± 1 ºC untuk penisilin, suhu 30 ± 1 ºC untuk oksitetrasiklin, suhu 36 ± 1 ºC untuk kanamisin dan tilosin. Inkubasi dilakukan selama 16-18 jam.
Diameter daerah hambat diukur dengan menggunakan jangka sorong. Dari luas daerah hambat dibuat kurva yang menyatakan hubungan (linier regresi) antara konsentrasi antibiotika dengan daerah hambatan. Kurva baku digunakan sebagai dasar pengujian untuk memperkirakan konsentrasi residu yang terkandung dalam sampel yang diuji jika terbentuk daerah hambatan.
Persiapan Sampel
Persiapan Bakteri Uji
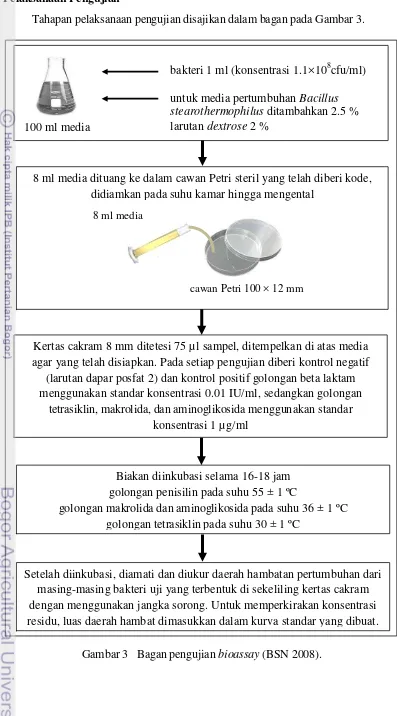
Pelaksanaan Pengujian
Tahapan pelaksanaan pengujian disajikan dalam bagan pada Gambar 3.
Gambar 3 Bagan pengujian bioassay (BSN 2008).
Kertas cakram 8 mm ditetesi 75 µl sampel, ditempelkan di atas media agar yang telah disiapkan. Pada setiap pengujian diberi kontrol negatif
(larutan dapar posfat 2) dan kontrol positif golongan beta laktam menggunakan standar konsentrasi 0.01 IU/ml, sedangkan golongan
tetrasiklin, makrolida, dan aminoglikosida menggunakan standar konsentrasi 1 µg/ml
bakteri 1 ml (konsentrasi 1.1×108cfu/ml) untuk media pertumbuhan Bacillus stearothermophilus ditambahkan 2.5 % larutan dextrose 2 %
100 ml media
8 ml media dituang ke dalam cawan Petri steril yang telah diberi kode, didiamkan pada suhu kamar hingga mengental
cawan Petri 100 × 12 mm 8 ml media
Biakan diinkubasi selama 16-18 jam golongan penisilin pada suhu 55 ± 1 ºC
golongan makrolida dan aminoglikosida pada suhu 36 ± 1 ºC golongan tetrasiklin pada suhu 30 ± 1 ºC
Analisis Data
HASIL DAN PEMBAHASAN
Jumlah dan Jenis Sampel
Daging sapi merupakan salah satu sumber protein hewani yang banyak dikonsumsi masyarakat Indonesia. Namun daging sapi berisiko mengandung bahan kimia berbahaya yang dapat merugikan kesehatan orang yang mengonsumsi daging tersebut. Hasil survei residu antibiotika pada daging sapi yang dilakukan baik di dalam negeri maupun di luar negeri, ternyata masih ditemukan residu antibiotika, oleh sebab itu perlu dilakukan pemeriksaan terhadap keamanan daging sapi khususnya residu antibiotika.
Sampel yang diperoleh dari daging sapi yang diimpor melalui pelabuhan Tanjung Priok dengan rincian sebagai berikut, 31 sampel berasal dari Australia dan 39 sampel berasal dari Selandia Baru. Daging sapi yang diimpor dari Australia dan Selandia Baru diangkut menggunakan kapal besar yang didisain khusus sebagai alat pengangkut barang/kontainer. Daging disimpan dalam kontainer dengan suhu -20 ºC, bersama-sama dengan produk hewan lainnya seperti jantung, hati, lidah, dan ekor (buntut). Di dalam kontainer, komoditi tersebut disusun rapi dan disegel menggunakan kunci dengan kode nomor tertentu yang tercatat dalam dokumen impor. Kunci didisain khusus sehingga selama perjalanan kontainer tersebut tidak dapat dibuka. Suhu kontainer tersebut harus tetap terjaga, stabil dan tercatat selama dalam perjalanan sampai dilakukan pembongkaran kontainer di instalasi karantina produk hewan (IKPH).
Pengambilan sampel dilakukan terhadap setiap daging impor yang masuk melalui pelabuhan Tanjung Priok, dilakukan pengambilan satu sampel untuk setiap satu dokumen impor, hingga terpenuhi 70 sampel yang diinginkan. Kegiatan impor daging dan pengambilan sampel ditampilkan pada Gambar 4.
Gambar 4 Kegiatan pemeriksaan dan pengambilan sampel daging sapi impor.
Hasil Pengujian Sampel dengan Rapid Test
Tabel 9 Hasil pengujian residu antibiotika dalam daging sapi impor menggunakan rapid test
Jumlah sampel (n) n positif Persentase
70 24 34.29%
Keberadaan residu antibiotika dalam daging sapi dapat dideteksi dengan menggunakan Premi® Test sebagai uji tapis. Alat ini memiliki kemampuan mendeteksi residu antibiotika dari beberapa golongan antibiotika antara lain golongan beta laktam, tetrasiklin, aminoglikosida, makrolida, dan sulfonamida dengan deteksi limit yang berbeda-beda.
Hasil negatif dapat diartikan bahwa sampel yang diuji tidak mengandung antibiotika atau konsentrasi residu yang terkandung di dalam sampel lebih rendah dari limit deteksi Premi® Test. Untuk sampel yang menunjukkan hasil positif dapat diartikan bahwa sampel yang diperiksa mengandung residu antibiotika dengan konsentrasi sama dengan atau di atas limit deteksi dari Premi® Test. Konsentrasi residu pada sampel yang menunjukkan hasil positif dapat berada di bawah atau dapat pula berada di atas BMR yang ditetapkan dalam SNI No. 01-6366-2000 tentang batas maksimal cemaran mikroba dan batas residu dalam bahan pangan asal hewan.
memperbanyak diri dan memproduksi asam. Proses ini ditandai dengan perubahan indikator pH yang sebelumnya berwarna ungu berubah menjadi kuning.
Metode pengujian yang dapat digunakan untuk mendeteksi keberadaan residu antibiotika sangatlah beragam dengan sensitifitas dan spesifisitas yang bervariasi. Berkembangnya metode pengujian residu antibiotika dengan waktu pengujian yang relatif cepat, mulai digunakan sebagai pilihan uji tapis, karena waktu yang dibutuhkan dan tahapan pengujian yang sederhana.
Gambar 5 Pengujian Premi® Test : (a) starter kit Premi® Test; (b) kit Premi® Test; (c) sampel dimasukkan dalam ampul Premi® Test; (c) inkubasi 3 jam; (e) hasil pengujian.
Pengujian dengan menggunakan Premi® Test merupakan pengujian screening dengan hasil yang bersifat kualitatif, sehingga hasil positif pada pengujian tersebut harus dikonfirmasi lebih lanjut.
Hasil Pengujian Sampel dengan Bioassay
Bioassay yang juga dikenal dengan “four plate method” merupakan metode
deteksi residu antibiotika yang banyak digunakan saat ini. Metode ini masih digunakan di laboratorium di Eropa dalam rangka pengawasan bahan pangan asal hewan. Variasi dari metode ini dengan perbedaan pada jumlah dan jenis strain bakteri akan mempengaruhi jumlah cawan yang digunakan, periode inkubasi, pH dari media dan jumlah media yang digunakan sebagai media yang optimal untuk
a b c d
pertumbuhan bakteri, yang seluruhnya memiliki perbedaan terhadap tingkat
deteksinya (Kirbiš 2010).
Gambar 6 Pengujian bioassay : (a) sampel yang telah ditimbang; (b) persiapan media agar; (c) meletakkan kertas cakram yang telah ditetesi sampel di atas agar; (d) luas hambatan yang terbentuk pada kontrol dan sampel.
Pengujian terhadap 70 sampel daging sapi impor dengan menggunakan bioassay diperoleh hasil bahwa 17 sampel menunjukkan adanya hambatan pertumbuhan kuman, yaitu 14 sampel mengandung residu dari golongan beta laktam, 12 sampel mengandung residu dari golongan tetrasiklin, 2 sampel mengandung residu dari golongan makrolida, dan 1 sampel mengandung residu dari golongan aminoglikosida. Dari pengujian bioassay juga diperoleh hasil bahwa 1 sampel menunjukkan terjadi hambatan pada empat golongan antibiotika (beta laktam, tetrasiklin, makrolida, dan aminoglikosida), 1 sampel menunjukkan terjadinya hambatan pada tiga golongan antibiotika (beta laktam, tetrasiklin, dan makrolida) dan 8 sampel menunjukkan terjadinya hambatan pada 2 golongan antibiotika (beta laktam dan tetrasiklin). Hasil pengujiian bioassay selengkapnya ditampilkan pada Tabel 10.
a b
c d
Tabel 10 Hasil pengujian residu antibiotika dalam daging sapi impor dengan bioassay
Identitas sampel
Konsentrasi hasil uji (ppm)
Beta laktam Tetrasiklin Makrolida Aminoglikosida
1 3.5 45 28 36
sebesar 100 ppm, golongan makrolida adalah 100 ppm, dan golongan aminoglikosida (neomisin) adalah 50 ppm.
Adanya residu antibiotika golongan beta laktam, tetrasiklin, makrolida, dan aminoglikosida dalam daging sapi impor dari Australia dan Selandia Baru kemungkinan disebabkan tingginya penggunaan antibiotika pada sapi potong di negara tersebut. Hal ini terkait dengan kejadian penyakit yang terjadi di negara-negara tersebut.
Konsentrasi residu antibiotika dalam sampel daging sapi impor yang diperiksa, menandakan bahwa telah diperhatikannya waktu henti obat (withdrawal time) sebelum ternak dipotong, sehingga konsentrasi residu antibiotika yang terdapat dalam daging tidak melebihi standar BMR (SNI No.01-6366-2000) yang ditetapkan.
Rapid test dan Bioassay dalam Pengujian Residu Antibiotika
Hasil pengujian yang diperoleh dengan menggunakan rapid test dan bioassay menunjukkan hasil yang berbeda diantara kedua metode tersebut. Pada pengujian residu antibiotika menggunakan rapid test diperoleh 24 sampel positif, sedangkan pada pengujian menggunakan bioassay diperoleh 17 sampel yang menunjukkan adanya hambatan kuman, sehingga terdapat 7 sampel yang menunjukkan hasil yang berbeda pada pengujian dengan menggunakan rapid test dan bioassay.
di dalam sampel tersebut merupakan antibiotika di luar golongan yang diuji menggunakan bioassay. Kedua, Premi® Test memiliki limit deteksi yang lebih rendah dibandingkan bioassay, sehingga sampel yang positif menggunakan rapid test, namun negatif menggunakan bioassay. Hal ini kemungkinan disebabkan oleh konsentrasi antibiotika yang terkandung dalam sampel lebih rendah dari limit deteksi bioassay. Ketiga, perbedaan hasil pengujian yang diperoleh dari dua metode tersebut dikarenakan adanya gabungan dari beberapa golongan antibiotika dengan konsentrasi rendah yang terdapat dalam satu sampel sehingga masih dapat terbaca sebagai sampel positif pada rapid test. Pada Tabel 11 dapat sdilihat perbedaan hasil pengujian antara rapid test dan bioassay.
Berdasarkan hasil pengujian yang telah diperoleh, rapid test (Premi® Test) dapat direkomendasikan untuk digunakan oleh Badan Karantina Pertanian sebagai uji tapis terhadap adanya residu antibiotika dalam daging sapi impor maupun domestik, karena memiliki sensitifitas yang baik. Hal ini terlihat dari semua hasil positif pada pengujian dengan bioassay juga positif pada pengujian dengan Premi® Test. Menurut Salman (2008) dalam memilih metode uji untuk keperluan uji tapis, maka metode yang memiliki sensitifitas yang tinggi menjadi pertimbangan utama karena semakin tinggi nilai sensitifitas, maka semakin kecil kemungkinan diperoleh negatif palsu.
Keuntungan lain dari penggunaan rapid test sebagai uji tapis, berdasarkan waktu pengujian, rapid test membutuhkan waktu 3.5-4 jam, sedangkan bioassay membutuhkan waktu 20-22 jam, sehingga dengan pengujian menggunakan rapid test dapat menghemat waktu 16.5-18 jam. Disamping itu dari segi ekonomi, pengujian rapid test lebih murah dibandingkan dengan bioassay. Pengujian menggunakan rapid test jauh lebih efisien dibandingkan dengan bioassay dan rapid test tidak membutuhkan Sumber Daya Manusia (SDM) yang memiliki keahlian khusus dalam pengerjaannya. Sedangkan, pengerjaan pengujian dengan bioassay memerlukan SDM dengan keahlian khusus dalam melakukan beberapa tahapan yang dibutuhkan, diantaranya persiapan sampel, persiapan media, persiapan larutan baku kerja, dan penanganan kuman yang akan digunakan dalam pengujian. Dalam penggunaan rapid test perlu diperhatikan beberapa hal penting, diantaranya penanganan dan masa kadaluarsa kit rapid test.
Bahaya Residu Antibiotika dalam Daging Sapi Impor terhadap Kesehatan Masyarakat Indonesia
dari golongan tersebut. Konsentrasi residu yang terdapat dalam daging sapi yang diperiksa masih berada di bawah standar BMR, menunjukkan bahwa telah diperhatikannya masa henti obat dalam penggunaan antibiotika di negara pengekspor.
Konsentrasi yang terdeteksi masih berada di bawah BMR, namun harus mendapat perhatian yang sangat serius karena menyangkut keamanan pangan. Berdasarkan Undang Undang Pangan nomor 7 tahun 1996, keamanan pangan merupakan kondisi dan upaya yang diperlukan untuk mencegah pangan dari kemungkinan cemaran biologis, kimia, dan benda lain yang dapat mengganggu, merugikan dan membahayakan kesehatan manusia. Indonesia menetapkan standar maksimum residu dalam produk asal ternak yang dituangkan dalam SNI No. 01-6366-2000. Standar tersebut berlaku untuk produk asal hewan baik impor maupun dalam negeri.
Penggunaan antibiotika pada ternak dapat mengakibatkan residu pada produk ternak yang dihasilkan seperti daging, susu, dan telur yang dikonsumsi manusia. Antibiotika yang digunakan sebagai terapi akibat penyakit yang disebabkan infeksi bakteri harus memperhatikan waktu henti obat pada saat ternak dipotong. Penggunaan antibiotika sebagai pemacu pertumbuhan akan menghasilkan akumulasi residu dalam produk hewan, yang akan berakibat buruk terhadap kesehatan manusia karena bersifat racun, mengakibatkan perubahan mikroflora normal dalam saluran pencernaan, dan mengakibatkan munculnya resistensi bakteri terhadap antibiotika (Nisha 2008).
mengalami perkembangan dan mutasi yang menyebabkan resistensinya terhadap antibiotika beta laktam semakin kuat. TEM-1 dan SME-1 merupakan salah satu contoh beta laktamase hasil mutasi. Dilaporkan bahwa tiga generasi terbaru antibiotika beta laktam mampu dihidrolisis oleh TEM-1 beta laktamase, sehingga mengakibatkan pengobatan menggunakan beta laktam tidak efektif lagi, proses penyembuhan lebih lama, dosis yang dibutuhkan lebih tinggi, dan penyakit menjadi semakin parah (Kang et al. 2000).
Melihat dampak buruk yang ditimbulkan akibat penggunaan antibiotika sebagai pemacu pertumbuhan, WHO sebagai badan kesehatan dunia sejak tahun 2006 telah melarang penggunaan antibiotika sebagai pemacu pertumbuhan pada ternak. Antibiotika hanya digunakan sebagai terapi dengan pengawasan dokter hewan. WHO menghimbau untuk meminimalisir penggunaan antibiotika pada peternakan dengan cara peningkatan kesehatan ternak melalui peningkatan biosecurity, pencegahan penyakit melalui program vaksinasi, menerapkan manajemen, praktik, dan higiene yang baik pada peternakan (WHO 2011).
Jaminan keamanan pangan di Indonesia menjadi tanggung jawab semua pihak yang terkait, antara lain pemerintah, pelaku industri, kensumen, dan media. Pemerintah bertanggung jawab terhadap penyediaan peraturan, undang-undang dan penegakan hukum, memberikan bimbingan dan pendidikan keamanan pangan, melakukan surveilan dan pengumpulan data.
teliti dalam memilih produk dan bahan pangan yang aman untuk dikonsumsi. Media juga ikut bertanggung jawab memberikan informasi yang benar terhadap semua aspek yang berkaitan dengan keamanan pangan.
SIMPULAN DAN SARAN
Simpulan
Dari penelitian ini dapat disimpulkan :
1. Daging sapi yang diimpor dari Australia dan Selandia Baru melalui Pelabuhan Laut Tanjung Priok mengandung residu antibiotika.
2. Sebanyak 24 dari 70 sampel positif mengandung residu antibiotika menggunakan rapid test. Pengujian menggunakan bioassay menunjukkan 17 sampel mengandung residu antibiotika yang terdiri dari 14 sampel golongan beta laktam, 12 sampel golongan tetrasiklin, 2 sampel golongan makrolida, dan 1 sampel golongan aminoglikosida.
3. Pengawasan terhadap residu antibiotika dalam daging sapi impor oleh Badan Karantina Pertanian, dapat direkomendasikan untuk menggunakan rapid test (Premi® Test) sebagai uji tapis.
Saran
1. Perlu dilakukan evaluasi lebih lanjut terhadap hasil pengujian Premi® Test dengan metode konfirmasi yaitu HPLC atau LCMS untuk mengetahui sensitifitas dan spesifisitas alat tersebut.
DAFTAR PUSTAKA
Adam R. 2002. Veterinary pharmacology and therapeutics. IOWA State: University Pr. 29 (1): 62.
[AHS] Animale Health Survailance. 2011. Newsletter of Australia’s national
animale health information system. Animale health Australia. Quarterly report 1 Juli to 30 September 2011 vol. 16 issue 3.
Angulo FJ, Nunnery JA, Blair HD. 2004. Antimicrobial resistance in zoonotic enteric pathogens. Rev sci Tech Off Int Epiz 23 (2): 485-496.
Bahri S, Masbulan E, Kusumaningsih A. 2005. Proses praproduksi sebagai faktor penting dalam menghasilkan produk ternak yang aman untuk manusia. J Litbang Pertanian 24 (1): 27-35.
Barber DA, Miller GY, McNamara PE. 2003. Models of antimicrobial resistance and foodborne illness: examining assumption and practical applications. J Food Prot 66 (4): 700-709.
[BBKP] Balai Besar Karantina Pertanian Tanjung Priok. 2010. Laporan tahunan balai besar karantina pertanian tanjung priok 2010.
Brian ID. 1987. Beta-Lactam antibiotics in systemic infections. Phil J Microbiol Infect Dis 16 (2): 61-64.
[BSN] Badan Standardisasi Nasional. 2000. Standar Nasional Indonesia No. 01-6366-2000 tentang batas maksimal cemaran mikroba dan batas residu dalam bahan pangan asal hewan.
[BSN] Badan Standardisasi Nasional. 2008. Standar Nasional Indonesia No.7424:2008 tentang metode uji tapis (screening test) residu antibiotik pada daging, telur dan susu secara bioassay.
Butaye P, Devriese A, Haesebrouck F. 2003. Antimicrobial growth promotors used in animal feed: effects of less well known antibiotics on Gram- positive bacteria. Clin Microbiol Rev 16 (2): 175-188.
Cabrera R et al. 2004. Mechanism of resistance to several antimicrobial agents in salmonella clinical isolats causing traveler’s diarrhea. Antimicrobiol Agents Chem 48 (10): 3934-3939.