STRUKTUR KOMUNITAS MEIOFAUNA INTERSTISIAL
DI SUBSTRAT PADANG LAMUN PULAU PRAMUKA,
KEPULAUAN SERIBU
NOVI DWI INDRIYANI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Struktur Komunitas Meiofauna Interstisial di Substrat Padang Lamun Pulau Pramuka, Kepulauan Seribu adalah benar karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada Perguruan Tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
NOVI DWI INDRIYANI. Struktur Komunitas Meiofauna Interstisial di Substrat Padang Lamun Pulau Pramuka, Kepulauan Seribu. Dibimbing oleh DIETRIECH GEOFFREY BENGEN dan ADRIANI SUNUDDIN.
Meiofauna yang hidup dalam ruang interstisial memiliki peranan penting dalam berbagai proses ekologis di padang lamun. Penelitian ini bertujuan untuk (1) Mengetahui struktur komunitas meiofauna interstisial (2) Mengetahui keterkaitan antara kelimpahan meiofauna dengan karakteristik fisika-kimia lingkungan padang lamun. Penelitian ini dilaksanakan pada bulan Maret – Juli 2014 yang bertempat di Pulau Pramuka, sebelah Selatan (Stasiun 1) dan Tenggara (Stasiun 2) serta Laboratorium FPIK IPB. Pengambilan sampel meiofauna dilakukan dengan cara membenamkan pipa paralon (corer) dengan diameter 4.5 cm dan tinggi 15 cm di sekitar plot pengamatan lamun dengan menggunakan transek 1 x 1 m2.Analisis struktur komunitas meiofauna dan lamun menggunakan perhitungan indeks ekologi. Analisis Komponen Utama digunakan untuk mengetahui hubungan meiofauna dengan parameter fisika-kimia substrat dan vegetasi lamun. Kondisi kualitas perairan Pulau Pramuka secara umum dalam keadaan baik untuk menunjang kehidupan lamun dan meiofauna. Berdasarkan hasil penelitian, meiofauna interstisial yang ditemukan pada substrat pasir padang lamun terdiri dari 6 filum, 8 kelas, 22 ordo, 50 famili dan 55 genera. Komunitas meiofauna didominasi oleh Famili Oxystominidae, (Filum Nematoda). Substrat dengan karakteristik fisika-kimia lingkungan akan mempengaruhi keberadaan jenis meiofauna yang hidup diantara rongga-rongga sedimen.
Kata kunci: Struktur komunitas, meiofauna, lamun, substrat, Pulau Pramuka
ABSTRACT
NOVI DWI INDRIYANI. Community Structure of Meiofauna Interstitial in Substrate of Seagrass Bed at Pramuka Island, Kepulauan Seribu. Supervised by DIETRIECH GEOFFREY BENGEN and ADRIANI SUNUDDIN.
in the substrate of seagrass consisted of 6 phyla, 8 classes, 22 orders, 50 families, and 55 genera. Meiofauna family dominated Oxystominidae, which is a part of nematode phylum. Substrates with certain physical-chemical characteristics of the environment would affect the existence of the meiofauna who lived between sediment cavities.
.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan
pada
Departemen Ilmu dan Teknologi Kelautan
STRUKTUR KOMUNITAS MEIOFAUNA INTERSTISIAL DI
SUBSTRAT PADANG LAMUN PULAU PRAMUKA,
KEPULAUAN SERIBU
NOVI DWI INDRIYANI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Struktur Komunitas Meiofauna Interstisial di Substrat Padang Lamun Pulau Pramuka, Kepulauan Seribu
Nama : Novi Dwi Indriyani NIM : C54100093
Tanggal Lulus:
Disetujui oleh
Prof Dr Ir Dietriech G Bengen, DEA Adriani Sunuddin, SPi, MSi Pembimbing I Pembimbing II
Diketahui oleh
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Topik yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2014 ini ialah meiofauna, dengan judul Struktur Komunitas Meiofauna Interstisial di Substrat Padang Lamun Pulau Pramuka, Kepulauan Seribu.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Dietriech G Bengen, DEA dan Ibu Adriani Sunuddin, SPi, MSi selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada Ibu Siti Nursiyamah laboran Laboratorium Bio Mikro I, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB atas bantuan saat menganalisis sampel di laboratorium. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Lokasi dan Waktu 2
Bahan 4
Alat 4
Pengambilan Sampel dan Pengukuran Parameter Lingkungan 5
Prosedur Analisis Data 6
HASIL DAN PEMBAHASAN 10
Karakteristik Fisika dan Kimia Perairan di Pulau Pramuka 10 Karakteristik Fisika – Kimia Substrat Padang Lamun di Pulau Pramuka 12
Karakteristik Vegetasi Lamun 15
Komunitas Meiofauna Interstisial di Pulau Pramuka 17 Hubungan Meiofauna dengan Karakteristik Fisika-Kimia Substrat
dan Vegetasi Lamun 23
SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN 28
DAFTAR TABEL
1 Parameter fisika-kimia air laut dan sedimen yang diukur dan alat serta
metode pengukurannya 4
2 Parameter fisika kimia di masing – masing stasiun penelitian 11
DAFTAR GAMBAR
1 Gambar Peta Lokasi Pengambilan Sampel Meiofauna di Pulau Pramuka,
Kepulauan Seribu 3
2 Gambar Karakteristik Fisika Sedimen Padang Lamun 13 3 Gambar Karakteristik Kimia Sedimen Padang Lamun 14 4 Gambar Kerapatan Lamun di Pulau Pramuka, (a) Stasiun 1
(b) Stasiun 2 15
5 Gambar Penutupan Lamun di Pulau Pramuka, (a) Stasiun 1
(b) Stasiun 2 17
6 Gambar Grafik Kelimpahan Meiofauna di Pulau Pramuka 19 7 Gambar Indeks Keanekaragaman Meiofauna di Pulau Pramuka 20 8 Gambar Nilai Keseragaman Meiofauna di Pulau Pramuka 21 9 Gambar Nilai Dominasi Meiofauna di Pulau Pramuka 22 10 Gambar Hasil Analisis Komponen Utama (PCA) antara Kelimpahan
Meiofauna dengan Karakteristik Fisika-Kimia Substrat dan Vegetasi
Lamun 23
DAFTAR LAMPIRAN
1 Dokumentasi Alat dan Bahan yang digunakan untuk Penyaringan dan
Mengawetkan Sampel Meiofauna 28
2 Dokumentasi Proses Pengambilan Sampel Meiofauna di Substrat
Lamun 28
3 Dokumentasi Proses Penyaringan Sampel Meiofauna 29 4 Dokumentasi Proses Pengawetan dan Pemberian rose bangle
pada Sampel Meiofauna 30
5 Parameter Fisika-Kimia Substrat di Pulau Pramuka 30 6 Hasil Perhitungan Kerapatan (Di), Frekuensi (Fi), Penutupan (Ci)
dan Indeks Nilai Penting (INP) pada Lamun di Stasiun Penelitian,
Pulau Pramuka 31
7 Kelimpahan Meiofauna di Lokasi Penelitian (Stasiun 1) 31 8 Kelimpahan Meiofauna di Lokasi Penelitian (Stasiun 2) 33 9 Hasil Analisis Komponen Utama (Principal Component Analisis)
Kelimpahan Meiofauna dengan Parameter Fisika – Kimia Substrat dan
Vegetasi Lamun 37
10 Dokumentasi Spesimen Meiofauna 38
11 Hasil Perhitungan Indeks Kesamaan Taksa (IS) Meiofauna di Stasiun
PENDAHULUAN
Latar Belakang
Sebagai ekosistem, laut terdiri atas komponen biotik dan abiotik yang saling mempengaruhi dan merupakan kesatuan yang tidak dapat dipisahkan satu sama lain. Dari seluruh komponen biotik yang ada, salah satu diantaranya yang dikaji adalah meiofauna interstisial, yang merupakan kelompok hewan yang berukuran antara 63-1000 µm yang lolos pada saringan 0.063-1 mm (Linhart et al 2002). Meiofauna hidup dalam ruang interstisial yang merupakan ruang di antara partikel sedimen atau di sela-sela butiran sedimen. Padang lamun merupakan salah satu ekosistem yang penting pada daerah pesisir yang ditumbuhi oleh lamun sebagai vegetasi yang dominan. Peranan padang lamun berperan penting sebagai produsen dalam jaring makanan di daerah pesisir (Susetiono 2004). Peranan lain dari padang lamun adalah sebagai tempat hidup bagi berbagai kelompok hewan seperti plankton, nekton, bentos, detritus dan meiofauna.
Meiofauna memiliki peran ekologis yang berperan dalam keberadaan biota laut lain. Peranan penting dari meiofauna antara lain: (1) sumber makanan bagi meiofauna lainnya; (2) berperan aktif dalam penguraian bahan organik berupa serasah yang melimpah di lamun, terutama dalam proses biodegradasi sisa-sisa tumbuhan yang berlanjut ke proses mineralisasi oleh mikroorganisme (Metcalfe 2005); (3) sebagai makanan bagi tingkat trofik yang lebih tinggi. Luas tutupan dan kerapatan lamun juga berpengaruh pada kepadatan meiofauna interstisial yang menghuni substratnya.
Kepadatan meiofauna interstisial cenderung menurun seiring dengan semakin kecilnya luas tutupan lamun. Kepadatan meiofauna tertinggi berada pada lokasi dengan luas tutupan padang lamun terbesar, sedangkan jumlah kepadatan terendah berada pada lokasi yang tanpa tutupan lamun (Pujiyanti 2008). Kondisi substrat yang berbeda akan mempengaruhi keragaman jenis serta struktur komunitas meiofauna interstisial yang hidup di dalamnya (Zulkifli 2008). Hal tersebut terkait dengan mekanisme adaptasi yang mereka lakukan terhadap lingkungan tempat tinggalnya. Penelitian ini dilakukan untuk mengetahui hubungan antara jenis substrat padang lamun yang memiliki karakteristik berbeda dengan meiofauna interstisial yang hidup di padang lamun Pulau Pramuka.
Perumusan Masalah
2
Tujuan Penelitian
Penelitian ini bertujuan untuk (1) mengetahui struktur komunitas meiofauna interstisial pada substrat padang lamun Pulau Pramuka, Kepulauan Seribu; (2) mengetahui keterkaitan antara kelimpahan meiofauna dengan karakteristik fisika-kimia lingkungan padang lamun.
Manfaat Penelitian
Hasil penelitian ini dapat digunakan sebagai informasi dasar tentang keanekaragaman hayati meiofauna interstisial di substrat padang lamun Pulau Pramuka, Kepulauan Seribu. Penelitian ini dapat mengeksplorasi peranan penting meiofauna di dalam dinamika trofik di lingkungan ekosistem padang lamun.
METODE
Lokasi dan Waktu Penelitian
Gambar 1 Peta Lokasi Pengambilan Sampel Meiofauna di Pulau Pramuka, Kepulauan Seribu
Bahan
Bahan yang digunakan pada penelitian ini adalah sampel meiofauna interstisial, sampel air laut, sampel substrat, sampel lamun, gliserol, kertas label formalin dan rose bangle (Lampiran 1).
Alat
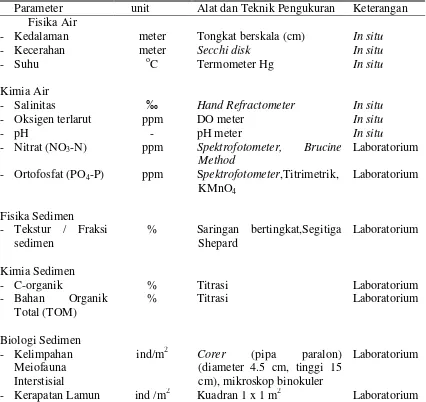
Alat dan teknik pengukuran parameter fisika-kimia air laut dan sedimen, dapat dilihat pada Tabel 1.
Tabel 1. Parameter fisika-kimia air laut dan sedimen yang diukur dan alat serta metode pengukurannya.
Parameter unit Alat dan Teknik Pengukuran Keterangan Fisika Air
- Kedalaman meter Tongkat berskala (cm) In situ
- Kecerahan meter Secchi disk In situ
- Suhu oC Termometer Hg In situ
Kimia Air
- Salinitas ‰ Hand Refractometer In situ
- Oksigen terlarut ppm DO meter In situ
- pH - pH meter In situ
- Nitrat (NO3-N) ppm Spektrofotometer, Brucine Method
Laboratorium - Ortofosfat (PO4-P) ppm Spektrofotometer,Titrimetrik,
KMnO4
- C-organik % Titrasi Laboratorium
5 Pengambilan Sampel dan Pengukuran Parameter Lingkungan
Penentuan Stasiun
Stasiun penelitian ditentukan melalui survei pendahuluan yakni dengan berjalan sejajar dengan garis pantai dan snorkling pada daerah yang telah ditentukan pada peta. Di dalam satu stasiun dibuat 3 plot berupa transek garis dan di dalam 1 transek garis terdapat 3 kuadran, dengan jarak antara transek garis yang satu terhadap transek garis berikutnya ± 50 m, sedangkan jarak kuadran satu terhadap kuadran berikutnya adalah 10 m.
Pengambilan Sampel Meiofauna dan Pengamatan Lamun
Pengamatan biologi yang dilakukan meliputi lamun, sampel substrat dan meiofauna yang dilakukan setiap stasiun pengamatan. Pengambilan sampel meiofauna diambil dengan cara membenamkan pipa paralon (corer) dengan diameter 4.5 cm dan tinggi 15 cm di sekitar plot pengambilan lamun dengan menggunakan transek 1 x 1 m2 (Lampiran 2). Contoh sedimen yang berisi meiofauna diambil dari tiga stasiun, pengambilan dilakukan sebanyak tiga kali ulangan setiap plot/kuadran. Sampel yang berhasil diambil dimasukkan ke dalam kantung plastik sampel dan diberi larutan formalin 4% agar awet, kemudian diberi label dengan kode stasiun, plot tempat pengambilan sampel serta ulangan.
Pengambilan Sampel Parameter Perairan dan Sedimen
Pengukuran parameter fisika meliputi suhu, kedalaman, dan kecerahan. Pengukuran parameter kimia meliputi salinitas, oksigen terlarut, pH secara insitu. Untuk mendapatkan parameter kimia maka diambil 1 botol air sampel pada masing-masing stasiun. Sampel air yang dibawa kemudian dianalisis di laboratorim. Pengukuran suhu, pH dan salinitas air dilakukan sebelum pengamatan lapangan. Parameter fisika-kimia sedimen yang diukur dan dianalisa meliputi fraksinasi sedimen, kandungan bahan organik (C-organik dan TOM). Pengambilan contoh sedimen dilakukan dengan menggunakan corer dengan diameter 4.5 cm dan tinggi 15 cm, sedimen dasar diambil sebanyak ± 200 gram. Pengukuran bahan organik pada sedimen dianalisa di Laboratorium Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, IPB.
Perlakuan Sampel Meiofauna di Laboratorium
Sampel yang telah diambil dilokasi kemudian diberi rose bengal untuk mengawetkan sampel tersebut serta memberi warna merah untuk mempermudah proses sortir dan identifikasi. Sampel yang telah diberi rose bengal kemudian dituang ke dalam gelas ukur yang berisi air tawar, kemudian sedimen disaring dengan saringan berukuran 1 mm (Susetiono 1995) bertujuan untuk memisahkan sampel dengan makrofauna, butiran pasir yang besar, serta potongan akar lamun. Sampel meiofauna dan pasir halus yang melayang-layang diatas permukaan air disaring menggunakan saringan 0.032 mm, tahapan ini diulang sebanyak lima kali (Lampiran 3). Sampel meiofauna dari hasil peyaringan kemudian diawetkan menggunakan larutan formalin 10% yang berisi rose bengal (Lampiran 4)
6
study of meiofauna (Higgins dan Thiel 1988) dan Meiobenthology the microscopic fauna in aquatic sediments (Giere 1993). Setelah diidentifikasi dan dicacah sampel dimasukkan ke dalam botol sampel yang diisi larutan gliserol, dan diberi label untuk digunakan penelitian lebih lanjut.
Prosedur Analisis Data
Struktur Komunitas Lamun a. Kerapatan Jenis Lamun
Kerapatan jenis lamun adalah jumlah total individu suatu jenis lamun dalam satu unit area yang dihitung. Kerapatan jenis lamun dihitung berdasarkan rumus (English et al 1997) sebagai berikut:
Keterangan :
Di = Kerapatan jenis ke-i (ind/m2)
Ni = Jumlah total individu jenis ke-i (ind)
A = Luas area total pengambilan contoh (m2) b. Persentase Penutupan Jenis Lamun
Persentase penutupan jenis lamun yaitu luasan area yang tertutupi oleh tumbuhan lamun. Penutupan lamun ditentukan berdasarkan rumus (English et al 1997) sebagai berikut :
Keterangan :
Ci = Penutupan jenis ke-i (ind/m2)
Mi = Persentase nilai tengah kelas ke-i
Fi = Frekuensi (jumlah jenis ke-i)
= Jumlah total frekuensi jenis ke-i Struktur Komunitas Meiofauna
Data hasil identifikasi dan perhitungan yang diperoleh kemudian ditabulasi untuk dianalisis serta mengetahui kelimpahan, keanekaragaman, keseragaman, dominasi, dan kesamaan taksa meiofauna.
a. Kelimpahan
7 Keterangan :
D = Kelimpahan meiofauna (ind/m2)
a = Jumlah meiofauna yang di hitung (individu)
b = Luas lingkaran corer (cm2) nilai 10.000 adalah nilai konversi dari cm2 ke m2 b. Indeks Keanekaragaman (H’)
Keanekaragaman jenis digunakan untuk mengetahui keanekaragaman hayati biota yang akan diteliti. Bila nilai indeks semakin tinggi, berarti komunitas biota perairan itu makin beragam dan tidak hanya didominasi oleh satu atau dua taksa
saja. Keanekaragaman jenis ditentukan dengan Indeks Shannon–Wiener (Krebs 1972) yang persamaannya adalah sebagai berikut :
Keterangan :
H’ = Indeks Keanekaragaman pi = ni / N
ni = Jumlah individu pada taksa ke-i
N = Jumlah individu seluruh taksa S = Jumlah taksa
Kriteria hasil indeks keanekaragaman menurut Brower et al 1989 yaitu sebagai berikut :
H’< 3.32 = Indeks keanekaragaman rendah artinya penyebaran jumlah individu tiap spesies dalam kestabilan komunitas rendah 3.32 < H’ < 9.97 = Indeks keanekaragaman sedang artinya penyebaran jumlah
individu tiap spesies dalam kestabilan sedang atau moderat. H’ > 9.97 = Indeks keanekaragaman tinggi artinya penyebaran jumlah
individu tiap spesies dalam kestabilan komunitas tinggi c. Keseragaman (E)
Keseragaman digunakan untuk mengetahui pola penyebaran individu tiap taksa. Rumus indeks keseragaman (Index Evenness) ditentukan dengan persamaan (Krebs 1972) sebagai berikut:
Keterangan :
E = Indeks keseragaman (Index Evenness) H’ = Indeks keanekaragaman Shanon & Wiener H maks = Keragaman maksimum (ln S)
S = Banyaknya taksa (jumlah individu yang ditemukan)
8
terjadi dominasi jenis (Brower et al 1977). Penggolongan nilai keseragaman menurut Pielou (1977) adalah sebagai berikut :
a) 0.00 – 0.25 tidak merata
Ada tidaknya dominasi dari suatu taksa tertentu yang ditentukan dengan indeks Simpson (Brower et al 1989) dengan persamaannya sebagai berikut :
Keterangan :
D = Indeks dominansi Pi= ni/N
ni = Jumlah individu dari taksa ke-i
N = Jumlah keseluruhan dari individu
Nilai indeks dominasi berkisar antara 0 hingga 1. Jika indeks dominasi mendekati 0 berarti hampir tidak ada taksa yang mendominasi dan biasanya diikuti dengan indeks keseragaman yang besar. Apabila indeks dominasi mendekati 1 berarti ada salah satu taksa yang mendominasi dan diikuti dengan nilai keseragaman yang semakin kecil (Odum 1997).
Kriteria indeks dominasi dibagi kedalam tiga bagian menurut Legendre (1983) sebagai berikut :
C < 0.4 = Dominasi rendah 0.4 < C < 0.6 = Dominasi sedang C > 0.6 = Dominasi tinggi e. Indeks Kesamaan Taksa (IS)
Indeks Kesamaan taksa menggambarkan kesamaan taksa meiofauna di dua daerah yang berbeda, dihitung berdasarkan indeks kesamaan jenis Sorensen (Magurran 1988) sebagai berikut :
Keterangan :
IS = Indeks kesamaan taksa Sorensen A = Jumlah taksa di Stasiun 1
B = Jumlah taksa di Stasiun 2
C = Jumlah taksa yang sama di kedua Stasiun 1 dan 2
Penilaian indeks kesamaan dalam penelitian ini ditentukan dengan : Jika IS < 50% maka dinyatakan berbeda
9 Data hasil perhitungan tersebut kemudian ditabulasi untuk dapat mengetahui pola struktur komunitas meiofauna interstisial seperti komposisi, nilai keanekaragaman, keseragaman, kesamaan serta jenis yang mendominasi pada habitat padang lamun. Asosiasi antara jenis substrat dan keseragaman kelompok meiofauna interstisial dapat diketahui dengan membandingkan sampel substrat dengan jumlah ragam kelompok meiofauna yang ditemukan dalam substrat. Sedimen
Analisis TOM sedimen bertujuan untuk mengetahui kandungan total bahan organik yang terdapat pada sedimen. Cara kerja untuk analisis TOM adalah sebagai berikut :
a.Timbang cawan kosong guna mengetahui berat dari cawan. b.Masukkan sampel sedimen ke dalam cawan.
c.Cawan yang telah berisi sampel dimasukkan ke dalam oven dengan suhu 70 0
C selama 24 jam.
d.Dinginkan sampel, kemudian ditimbang untuk mendapatkan nilai berat kering sampel.
e.Masukkan ke dalam tanur untuk proses pengabuan dengan suhu 600 0C selama 4 jam.
f. Timbang kembali dan hasilnya dikurangi dengan berat cawan untuk mendapatkan nilai berat pengabuan. Selanjutnya hitung persentase berat TOM dengan rumus :
Analisis fraksi sedimen (grain size) dan TOM sedimen dilakukan di Laboratorium. Analisis ukuran fraksi sedimen ditujukan untuk mengetahui komposisi sedimen. Cara kerja untuk analisis fraksi sedimen adalah sebagai berikut:
a. Sampel dikeringkan menggunakan oven 70 °C selama 24 jam. b. Sampel disaring menggunakan saringan bertingkat.
c. Timbang sampel yang sudah disaring dari mulai ukuran 2 - 0.063 mm. d. Substrat yang telah diketahui persentasenya tersebut selanjutnya dianalisis
dan ditentukan tipe substratnya.
Hubungan Meiofauna dengan Karakteristik Fisika Kimia Substrat dan Vegetasi Lamun
Adanya interaksi suatu organisme dengan karakteristik habitat tertentu dapat dipakai sebagai indikasi hadir tidaknya organisme tersebut pada suatu tempat dengan kepadatan yang tertentu pula. Untuk menentukan hubungan meiofauna dengan karakteristik fisika-kimia substrat dan vegetasi lamun digunakan suatu pendekatan analisis stastistik multivariabel yang didasarkan kepada Analisis Komponen Utama (Principal Component Analysis) (Legendre 1983) ( Bengen et al 1998).
10
penelitian sebagai individu (baris), meiofauna, karakteristik fisika-kimia substrat dan vegetasi lamun sebagai variabel (kolom). Analisis Komponen Utama menggunakan indeks yang menunjukkan ragam stasiunnya yang maksimum. Indeks ini disebut komponen utama pertama yang merupakan sumbu utama 1 (F1). Suatu proporsi tertentu dari ragam total stasiun yang dijelaskan oleh komponen utama pertama. Selanjutnya dicari komponen utama kedua (F2) yang memiliki korelasi nihil dengan komponen utama pertama. Komponen utama kedua memberikan informasi terbesar kedua sebagai pelengkap komponen utama pertama. Proses ini berlanjut terus hingga komponen ke-p, yaitu menuju pada bagian informasi yang semakin kecil.
Prinsip Analisis Komponen Utama menggunakan pengukuran jarak Euclidiean, yaitu jumlah kuadrat antara stasiun untuk parameter yang berkoresponden pada data jarak Euclidan yang didasarkan pada rumus :
Keterangan :
d2 = jarak Euclidiean i,i’ = dua stasiun pada baris
j = kelimpahan meiofauna, parameter fisika-kimia substrat dan vegetasi lamun pada kolom (bervariasi dari 1 hingga p)
Analisis komponen utama tidak menghasilkan dua grafik yang independen, akan tetapi hanya satu grafik unik dimana baris dan kolom dipresentasekan pada yang sama. Analisis komponen utama menggunakan software MiniTab.
HASIL DAN PEMBAHASAN
Karakteristik Fisika dan Kimia Perairan di Pulau Pramuka
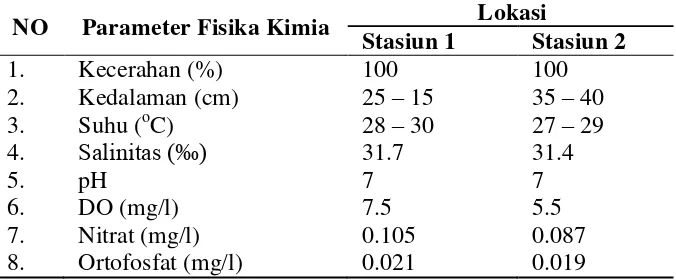
11 Tabel 2 Parameter fisika kimia di masing – masing stasiun penelitian
NO Parameter Fisika Kimia Lokasi
Stasiun 1 Stasiun 2
Nilai kecerahan di stasiun penelitian memiliki nilai yang sama yaitu 100%, hal tersebut terlihat dari substrat dasar perairan yang terlihat dengan jelas. Hal ini juga yang menyebabkan penetrasi cahaya matahari masih dapat menembus hingga dasar perairan. Semakin rendah intensitas cahaya matahari yang masuk dalam kolom perairan mengakibatkan semakin rendah laju fotosintesis. Padang lamun membutuhkan intensitas cahaya matahari yang tinggi untuk membantu proses fotosintesis. Cahaya merupakan faktor pembatas pertumbuhan dan produksi lamun di perairan pantai yang keruh (Hutomo 1997). Umumnya lamun membutuhkan kisaran tingkat kecerahan 4 – 29% untuk dapat tumbuh dengan rata-rata 11% (Hemminga dan Duarte 2000).
Kedalaman perairan pada stasiun penelitian kurang dari 1 meter. Kedalaman perairan dapat membatasi distribusi lamun secara vertikal. Lamun hidup pada daerah perairan dangkal yang masih dapat dijumpai sampai kedalaman 40 meter dengan penetrasi cahaya yang masih baik (Hemminga dan Duarte 2000). Semakin dalam suatu perairan maka intensitas cahaya matahari untuk menembus dasar perairan menjadi terbatas dan kondisi ini akan menghambat laju fotosintesis lamun di dalam air.
Hasil pengukuran suhu perairan di masing – masing stasiun selama penelitian berkisar antara 27 – 30 ⁰C. Kisaran nilai tersebut memperlihatkan bahwa suhu perairan di stasiun penelitian berada dalam kisaran suhu normal untuk daerah tropis. Suhu yang optimum untuk perkembangan meiofauna adalah 20 – 30 ⁰C, hal ini menunjukkan bahwa kisaran suhu diperairan Pulau Pramuka dapat mendukung kehidupan meiofauna (Heip et al 1985). Suhu merupakan faktor penting bagi kehidupan organisme di perairan khususnya lautan, karena pengaruhnya terhadap aktivitas metabolisme dari organisme tersebut. Suhu mempengaruhi proses fisiologi yaitu fotosintesis, laju respirasi, dan pertumbuhan. Lamun dapat tumbuh pada kisaran 5 – 35 ⁰C, dan tumbuh dengan baik pada kisaran suhu 25 – 30 ⁰C (Marsh et al 1986) sedangkan pada suhu di atas 45 ⁰C lamun akan mengalami stres dan dapat mengalami kematian (McKenzie 2008).
12
(Zulkifli 2008). Kisaran nilai salinitas pada stasiun penelitian termasuk nilai yang optimum untuk pertumbuhan meiofauna.
Nilai pH atau derajat keasaman pada stasiun penelitian tidak bervariasi yaitu 7. Derajat keasaman merupakan salah satu faktor yang mempengaruhi kehidupan meiofauna, hal ini sesuai dengan pernyataan Odum (1997) yaitu, umumnya derajat keasaman atau pH perairan berkisar antara 4 – 9 masih layak untuk kehidupan biota air termasuk meiofauna karena pH berperan dalam pengaturan respirasi dan sistem enzim. Fluktuasi pH dipengaruhi oleh fotosintesa dan dekomposisi bahan organik.
Nilai pengukuran DO pada stasiun penelitian berkisar antara 5.5 - 7.5 mg/l. Kandungan DO di suatu peraiaran sangat terkait dengan proses fotosintesis dan sumberdaya lamun serta biota yang hidup di sekitar padang lamun. Parameter DO di lokasi penelitian dapat memenuhi kriteria yang baik bagi biota laut yaitu > 5 mg/l (Kep. MENLH No.51 Tahun 2004)
Hasil pengukuran konsentrasi nitrat (NO3-N) dan ortofosfat (PO4-P) pada stasiun penelitian berkisar antara 0.087 – 0.105 mg/l dan 0.019 – 0.021 mg/l. Nitrat merupakan bentuk utama nitrogen di perairan alami dan merupakan nutrien bagi pertumbuhan tanaman dan alga. Menurut MenLH (2004) baku mutu untuk nitrat adalah sebesar 0.008 mg/l. Apabila kadar nitrat lebih dari 0.2 mg/l, maka akan terjadi pengayaan organik dalam perairan yang selanjutnya memicu pertumbuhan alga secara pesat (blooming). Jika kadar nitrat lebih dari 5 mg/l mengindikasikan bahwa terjadinya pencemaran antropogenik yang berasal dari aktifitas manusia dan tinja hewan, namun nitrat tidak bersifat toksik terhadap organisme akuatik (Effendi 2003).
Ditinjau dari kadar zat hara fosfat di perairan Pulau Pramuka, dapat dikatakan bahwa perairan ini relatif subur karena masih berada pada kisaran zat hara fosfat di perairan laut yang normal yaitu 0.10 – 1.68 µg A/l (Sutamihardja 1978). Kep. MENLH No.51 Tahun 2004 menetapkan ambang batas kandungan ortofosfat untuk kehidupan biota laut sebesar 0.015 mg/l. Hal ini berarti nilai yang didapat menunjukkan bahwa nilai tersebut masih dapat atau masih memenuhi untuk kehidupan biota laut.
Karakteristik Fisika – Kimia Substrat Padang Lamun di Pulau Pramuka
13
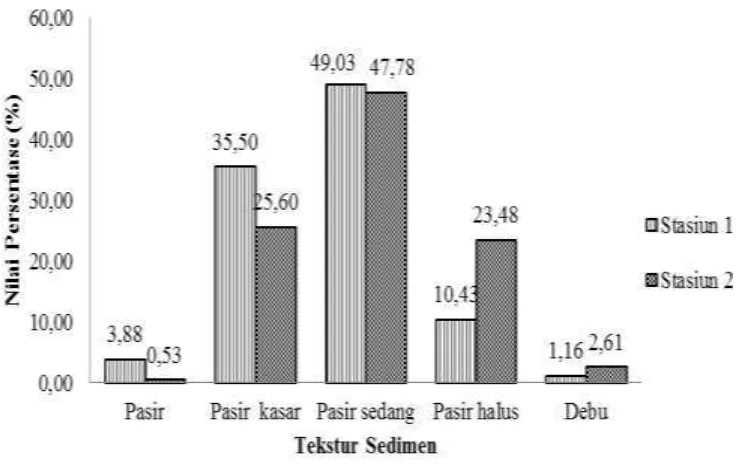
Gambar 2 Karakteristik Fisika Sedimen di Padang Lamun
Berdasarkan data yang diperoleh dari hasil penelitian, diketahui bahwa pasir sedang mendominasi komposisi sedimen di seluruh titik pada stasiun penelitian. Jenis sedimen di lokasi penelitian sangat penting diketahui, karena merupakan faktor pembatas penyebaran meiofauna. Jenis sedimen ini erat kaitannya dengan konsentrasi oksigen dan ketersediaan bahan organik dalam sedimen. Menurut Zulkifli (2008) pada sedimen berbutir kasar (berpasir), konsentrasi oksigen relatif lebih besar dibandingkan dengan sedimen yang lebih halus (berlumpur). Hal ini disebabkan oleh sedimen berbutir kasar terdapat pori udara yang memungkinkan terjadinya percampuran yang lebih intensif dengan air diatasnya. Pada tipe sedimen yang mendominasi Stasiun 1 adalah pasir berbutiran sedang sebanyak 49.03%, baru diikuti oleh pasir kasar (35.50%), pasir halus (10.43%), pasir (3.88% ) dan debu sebanyak 1.16%. Stasiun 2 memiliki komposisi sedimen yang tidak jauh berbeda dengan Stasiun 1 yaitu komposisi sedimen yang mendominasi adalah pasir sedang sebesar 47.78%, pasir kasar 25.60%, pasir halus 23.48%, debu 2.61% dan pasir 0.53% (Lampiran 5). Komposisi butiran sedimen juga mempengaruhi jenis meiofauna interstisial yang berada di padang lamun. Pada Stasiun 1 dan 2 jenis meiofauna yang paling banyak ditemukan adalah Filum Nematoda, hal ini dipengaruhi oleh komposisi sedimen. Stasiun 1 dan 2 mempunyai kandungan pasir sedang/kerikil yang paling tertinggi (Gambar 2). Hasil ini sesuai dengan penelitian sebelumnya bahwa keragaman Nematoda tinggi pada sedimen kasar (Gourbault et al 1995) (Steyaert et al 1999)
14
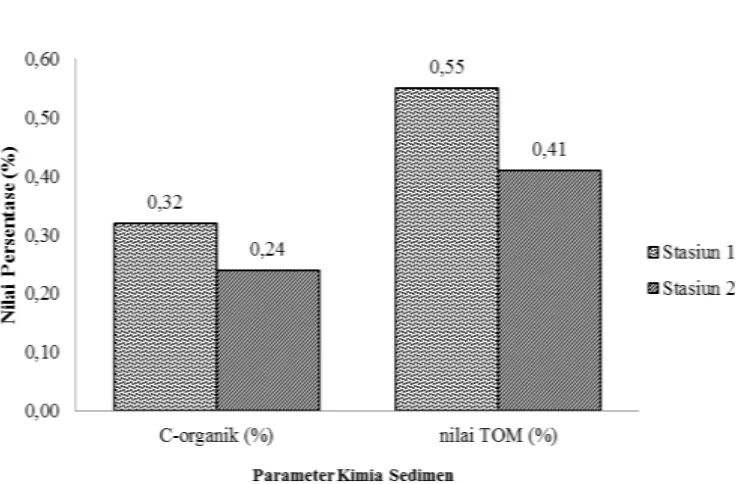
Gambar 3 Karakteristik Kimia Sedimen di Padang Lamun
Berdasarkan hasil penelitian kandungan C-organik pada lokasi penelitian berkisar antara 0.24% - 0.32% (Lampiran 5). Keberadaan kandungan bahan organik terkait dengan ukuran partikel sedimen. Pada sedimen halus, persentase bahan organik lebih tinggi daripada sedimen kasar (Koster dan Meyer-Reil 2001). Kandungan C-organik yang paling tinggi berada pada Stasiun 1 sebesar 0.32%, hal ini dikarenakan kandungan sedimen di Stasiun 1 memiliki persentase paling tinggi dan kelimpahan meiofauna yang tinggi. Kandungan C-organik yang rendah berada pada Stasiun 2 dengan nilai C-organik sebesar 0.24%. Bahan organik yang tersedimentasi merupakan sumber makanan bagi meiofauna, jasad renik dan organisme bentos lainnya. Menurut Libes (1992) organisme tersebut mampu mengubah karakteristik fisika, kimia dan geologi sedimen.
15 Karakteristik Vegetasi Lamun
Berdasarkan hasil pengamatan di stasiun penelitian ditemukan 5 jenis lamun yang tersebar di dua stasiun penelitian. Vegetasi lamun di Pulau Pramuka termasuk vegetasi campuran (mixed seagrass beds), hal ini terlihat adanya asosiasi antara dua atau tiga jenis lamun pada beberapa transek kuadran pengambilan data. Padang lamun di perairan Indonesia umumnya termasuk padang lamun vegetasi campuran (Nienhuis et al 1989).
Jenis lamun yang ditemukan di perairan Pulau Pramuka yaitu Enhalus acoroides, Cymodocea rotundata, Thalasia hemprichii, Halodule uninerys, Syringodium isoetifolium. Jenis lamun Cymodocea rotundata dan Thalassia hemprichii paling mendominasi kerapatan lamun di Stasiun 1 dan 2. Hal ini sesuai dengan penelitian Azkab (2006) bahwa tercatat terdapat kurang lebih 12 jenis lamun di perairan Indonesia yang termasuk dalam 7 genera dan 2 famili. Jenis Cymodocea rotundata dan Thalasia hemprichii merupakan jenis lamun yang juga ditemukan di Pulau Pramuka.
Kerapatan Lamun
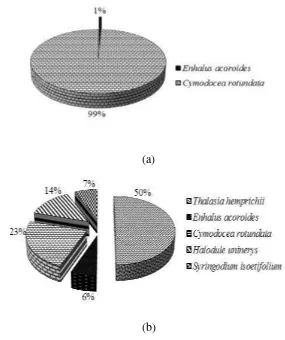
Berdasarkan hasil penelitian diperoleh hasil kerapatan lamun dari setiap stasiun. Hasil Kerapatan lamun di Pulau Pramuka dapat disajikan pada Gambar 4 .
(a)
(b)
16
Dua jenis lamun yang ditemukan pada Stasiun 1, yakni Cymodocea rotundata dengan kerapatan paling tinggi sebesar 99% dan Enhalus acoroides dengan kerapatan hanya 1% (Lampiran 6). Jenis lamun Thalasia hemprichii, Halodule uninerys, Syringodium isoetifolium tidak ditemukan di Stasiun 1. Hal ini dipengaruhi oleh kondisi lingkungan yang berbeda, yakni pada Stasiun 1 kondisi perairannya dangkal dan komposisi substrat sedimen kasar yang mengandung banyak patahan karang. Menurut Kiswara (1997) bahwa lamun jenis Syringodium isoetifolium dapat tumbuh subur pada perairan yang selalu tergenang oleh air dan sulit tumbuh di daerah yang dangkal.
Pada Stasiun 2 ditemukan 5 jenis lamun yaitu Enhalus acoroides, Cymodocea rotundata, Thalasia hemprichii, Halodule uninerys, Syringodium isoetifolium, dengan kerapatan tertinggi pada jenis Thalassia hemprichii sebesar 50 % (Lampiran 6). Kerapatan rata-rata lamun terendah ditemukan di Stasiun 1, hal ini dikarenakan sedikitnya jenis lamun yang terukur pada plot pengambilan data di stasiun tersebut serta perbedaan kerapatan jenis lamun setiap stasiun yang disebabkan oleh perbedaan kondisi faktor lingkungan di setiap stasiun penelitian. Sedikitnya jenis lamun yang ditemukan pada Stasiun 1 juga disebabkan oleh jenis substratnya. Stasiun 1 didominasi oleh substrat hamparan karang mati dan rubble yang memungkinkan lamun sulit tumbuh, meskipun lamun dapat tumbuh pada dasar lumpur, pasir, dan kerikil karang diantara karang hidup, cekungan batu karang maupun pada dasar dan lumpur di bawah naungan mangrove (Kiswara dan Winardi 1994).
Persentase Penutupan Lamun
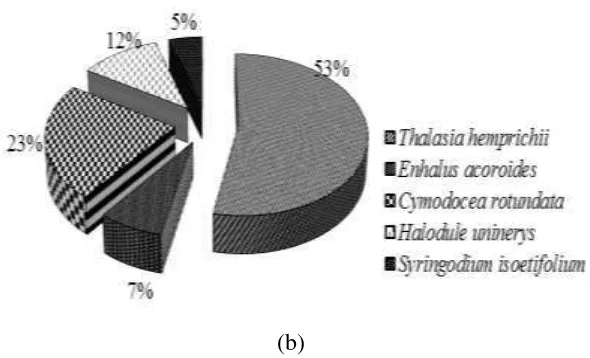
Persentase penutupan lamun menggambarkan luas daerah yang tertutupi oleh lamun. Nilai penutupan tidak hanya bergantung pada kerapatan jenis lamun, namun dipengaruhi juga oleh morfologi jenis lamun tersebut. Persentase penutupan lamun merupakan suatu metode untuk melihat status dan untuk mendeteksi perubahan dari sebuah vegetasi (Hemminga dan Duarte 2000). Hasil persentase penutupan lamun di Pulau Pramuka disajikan pada Gambar 5.
17
(b)
Gambar 5 Penutupan Lamun di Pulau Pramuka, (a) Stasiun 1 (b) Stasiun 2 Berdasarkan hasil penelitian bahwa penutupan lamun di Stasiun 1 yang tertinggi adalah Cymodocea rotundata sebesar 98% dan Enhalus acoroides memiliki persentase penutupan relatif terendah sebesar 1% (Lampiran 4). Hal ini dikarenakan bahwa Cymodocea rotundata mempunyai pengaruh paling besar dan dominan di Stasiun 1. Menurut Tomascik et al (1997) jenis lamun Cymodocea rotundata mampu hidup pada daerah dangkal yang tertutup karang dan mempunyai toleransi yang tinggi pada daerah tidak terendam air. Oleh karena itu lamun jenis ini memiliki kerapatan dan penutupan yang cukup tinggi di Stasiun 1. Pada Stasiun 2 Thalasia hemprichii merupakan jenis lamun yang memiliki persentase penutup lamun tertinggi yaitu sebesar 53%. Penutupan relatif terendah di Stasiun 2 adalah jenis lamun Syringodium isoetifolium sebesar 5% (Lampiran 6), hal ini dikarenakan Thalassia hemprichii adalah jenis lamun yang paling dominan dan memiliki luas persebaran terbanyak di Stasiun 2. Secara umum, Thalassia hemprichii memiliki penutupan paling tinggi karena merupakan jenis yang umum ditemui dan tersebar luas di seluruh perairan Indonesia, termasuk di Pulau Pramuka serta kemampuan tumbuhnya di berbagai macam tipe substrat seperti pasir berlumpur, pasir berukuran sedang dan kasar, hingga pecahan karang mati (Taka dan Azkab 2010).
Komunitas Meiofauna Interstisial di Pulau Pramuka
18
Nematoda merupakan kelompok meiofauna interstisial yang mendominasi baik jumlah jenis maupun kelimpahan jumlah individu di seluruh lokasi penelitian. Hal ini dikarenakan kesesuaian habitat dan adanya beberapa keunggulan yang dimiliki oleh Nematoda, seperti keunggulan morfologi, fisiologi dan perilaku. Nematoda hidup dengan tipe habitat yaitu habitat lumpur berpasir dan lumpur yang kaya akan bahan organik. Biasanya habitat lumpur berpasir dan lumpur kaya bahan organik memiliki kadar oksigen rendah atau miskin oksigen. Menurut Higgins dan Thiel (1998) dan Giere (1993), Nematoda cukup toleran dan dapat beradaptasi dengan baik dengan kondisi kadar oksigen rendah atau miskin oksigen. Selain itu, Nematoda juga banyak ditemukan di habitat berpasir, hal ini sesuai dengan melimpahnya jumlah individu yang terdapat di stasiun penelitian.
Polychaeta merupakan kelompok meiofauna interstisial yang menempati urutan kedua komposisi terbanyak di lokasi penelitian. Komposisi Polychaeta yang cukup besar dikarenakan beberapa faktor yang mendukung keberadaannya, yakni bentuk tubuh, sistem pencernaan dan adaptasi fisiologi pada Polycaheta. Menurut Nybakken dan Bertness (2005) bahwa Kelas Polychaeta sebagai organisme penggali dan pemakan deposit cenderung melimpah pada sedimen lumpur lunak, dikarenakan habitat lumpur lunak merupakan daerah yang banyak mengandung bahan organik sehingga sumber makanan bagi Polychaeta mencukupi. Beberapa Polychaeta menempati celah-celah sedimen, yaitu dengan cara menggali sedimen lunak dengan mendorong partikel-partikel sedimen untuk membuat tempat tinggalnya (Westbeide 1988) (Funch et al 2002).
Kelimpahan Meiofauna
Gambar 6 Kelimpahan Meiofauna di Pulau Pramuka
Menurut Zulkifli (2008) tipe habitat, kedalaman sedimen dan musim berperan penting dalam menentukan komunitas meiofauna interstisial. Perbedaan kondisi padang lamun berpengaruh terhadap terjadinya perbedaan komunitas meiofauna interstisial di habitat tersebut.
Komposisi genus dan kelimpahan individu meiofauna dapat dipengaruhi oleh beberapa faktor yaitu faktor fisika, kimia dan biologi. Hal ini sesuai dengan pernyataan Rosa dan Bemvenuti (2005) bahwa faktor-faktor tersebut di antaranya ukuran parikel sedimen, suhu, dan arus (faktor fisika), salinitas, oksigen, pH dan EH sedimen, dan bahan organik sedimen (faktor kimia), bioturbasi dan pemangsaan/predator (faktor biologi).
Famili meiofauna yang memiliki kelimpahan famili yang tertinggi di Pulau Pramuka yaitu Famili Oxystominidae (Lampiran 10) dengan nilai kelimpahan sebesar 6960 ind/m2 (Gambar 6). Famili Oxystominidae memiliki kelimpahan meiofauna yang tinggi (Lampiran 7 dan 8), Famili Oxystominidae merupakan bagian dari Filum Nematoda. Menurut Danovaro et al (2002) bahwa laju produksi harian meiofauna mengalami peningkatan pada bulan Fabruari - Maret (21.3 mgC/m2/hari), Mei - Juni (31.4 mgC/m2/hari), dan Oktober - Desember (44.6-52.0 mgC/m2/hari).
Jika dibandingkan dengan hasil penelitian lainnya di wilayah Indonesia, maka perairan pantai Kuta Lombok Tengah tercatat hanya 6 taksa dengan kelimpahan tertinggi adalah kelompok Nematoda, Foraminifera, Copepoda, Ostracoda, Turbellaria dan Polychaeta (Susetiono 1994 dalam Zulkifli 2008). Di perairan Pulau Pari pada substrat padang lamun ditemukan 8 kelompok meiofauna yaitu kelompok Nematoda yang memiliki kelimpahan terbanyak, kemudian diikuti oleh kelompok Polychaeta, Oligochaeta, Copepoda, Amphipoda, Foraminifera, Gnathostomulida dan Turbellaria (Trisnawati 2012)
Keanekaragaman Meiofauna
Indeks keanekaragaman merupakan perbandingan antara jumlah marga dengan jumlah total individu dalam suatu komunitas.
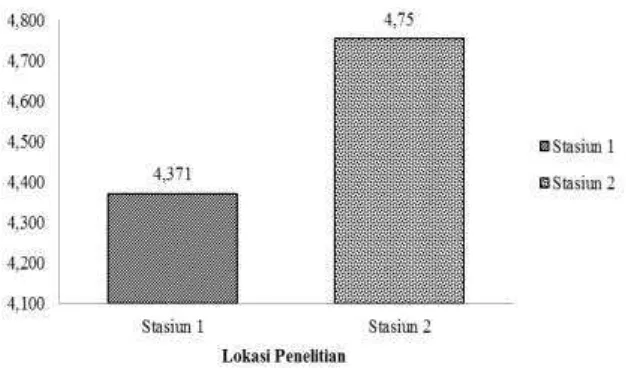
21 Indeks keanekaragaman yang digunakan dalam penelitian ini yaitu indeks keanekaragaman yang menggambarkan keadaan populasi organisme secara matematis agar mempermudah menganalisa informasi jumlah individu masing-masing jenis pada suatu komunitas. Stasiun 2 memiliki keanekaragaman meiofauna yang lebih tinggi dari pada Stasiun 1. Indeks keanekaragaman jenis meiofauna interstisial berkisar antara 4.371 – 4.753 ind/m2 (Gambar 7). Nilai keanekaragaman meiofauna pada Stasiun 2 sebesar 4.753 ind/m2 dan pada Stasiun 1 nilai keanekaragamannya sebesar 4.371 ind/m2. Indeks keanekaragaman meiofauna pada kedua stasiun penelitian dikategorikan sedang, karena nilai H’ yang diperoleh berada diantara 3.32 < H’ < 9.97 . Nilai H’ 3.32 < H’ < 9.97 menunjukkan keanekaragaman sedang (Brower et al 1989). Indeks keanekaragaman sedang artinya penyebaran jumlah individu tiap spesies dalam kestabilan sedang atau moderat. Hal ini terjadi karena jumlah jenis dari meiofauna di stasiun penelitian memiliki proporsi jumlah kepadatan sedang yang menyusun komunitas.
Indeks Keseragaman Meiofauna
Indeks keseragaman adalah indeks yang menunjukkan tingkat keseragaman individu tiap spesies di dalam suatu komunitas (Hawkes 1978). Nilai indeks keseragaman berkisar antara 0 sampai dengan 1. Jika indeks keseragaman mendekati 0, maka semakin kecil pula keseragaman biotanya sehingga dalam ekosistem tersebut ada kecenderungan terjadi dominasi spesies tertentu. Semakin besar nilai keseragaman yaitu mendekati 1 dapat diartikan bahwa dalam komunitas tersebut tidak didominasi oleh satu spesies. Hal ini menunjukkan bahwa ekosistem dalam kondisi yang relatif baik, yaitu jumlah individu tiap spesies relatif sama (Odum 1997).
Gambar 8 Nilai Keseragaman Meiofauna di Pulau Pramuka
22
komunitas tersebut memiliki persebaran jenis atau kelompok yang merata. Semakin tinggi nilai indeks keanekaragaman jenis atau kelompok, maka semakin merata persebarannya (Magurran 1988 dalam Trisnawati 2012).
Dominasi Meiofauna
Indeks dominasi merupakan indeks yang digunakan untuk memperoleh informasi mengenai jenis meiofauna yang mendominasi pada suatu komunitas pada setiap habitat. Berdasarkan nilai indeks dominasi pada stasiun peneltian berkisar antara 0.046 – 0.068 (Gambar 9).
Gambar 9 Nilai Dominasi Meiofauna di Pulau Pramuka
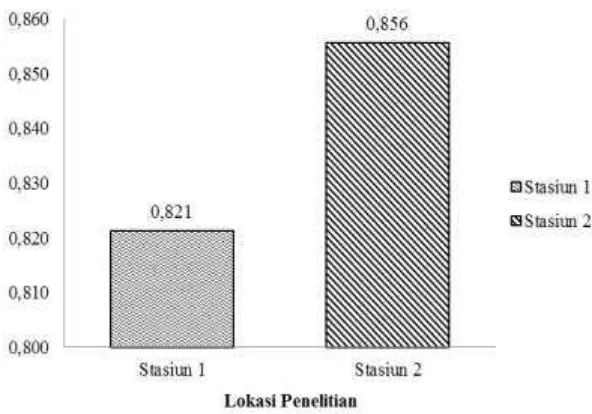
Staiun 1 memiliki nilai dominasi sebesar 0.068 dan Stasiun 2 sebesar 0.046, Stasiun 1 memiliki dominasi yang lebih besar dibandingkan dengan stasiun 2 (Gambar 9). Indek dominasi meiofauna pada kedua stasiun penelitian memiliki nilai dominasi rendah, karena nilai C yang diperoleh adalah C < 0.4. Nilai indeks dominasi C < 0.4 menunjukkan nilai indeks dominasi rendah (Legendre 1983). Hal ini menandakan bahwa komunitas meiofauna di Pulau Pramuka berada dalam kondisi stabil dan tidak ada dominasi oleh suatu jenis spesies dalan komunitas.
Nilai indeks dominasi berkisar antara 0 – 1, nilai indeks dominasi yang mendekati 0 berarti hampir tidak ada dominasi oleh suatu jenis spesies dalam komunitas. Nilai indeks dominasi yang mendekati 1 berarti ada dominasi oleh suatu spesies dalam komunitas tersebut (Odum 1997)
Indeks Kesamaan Taksa (IS)
23 Hubungan Meiofauna dengan Karakteristik Fisika-Kimia Substratdan
Vegetasi Lamun
Hubungan antara meiofauna dengan karakteristik fisika-kimia substrat dan vegetasi lamun menggunakan Analisis Komponen Utama (Principal Component Analysis) yang dapat dilihat hasilnya pada Gambar 10. Parameter yang digunakan dalam analisis PCA adalah kelimpahan meiofauna, kerapatan vegetasi lamun dan parameter fisika-kmia substrat (pasir, debu dan TOM). Hasil analisis ini dapat mengeksplorasi hubungan antara meiofauna dengan karakteristik fisika-kimia substrat dan vegetasi lamun di stasiun penelitian di perairan Pulau Pramuka.
Gambar 10 Hasil Analisis Komponen Utama (PCA) antara Kelimpahan Meiofauna dengan Karakteristik Fisika-Kimia Substrat dan Vegetasi Lamun
24
faktor yang berperan sebagai pensuplai bahan organik dalam jumlah besar. Sumber utama bahan organik sedimen di ekosistem padang lamun adalah jaringan tumbuhan lamun, baik yang berupa serasah maupun sisa – sisa tumbuhan lamun. Sebaliknya pada Stasiun 2 menunjukkan korelasi negatif tinggi yaitu dengan adanya hubungan antara garis yang membentuk sudut melebar pada parameter fisika-kimia substrat (debu) (Lampiran 9). Pada Stasiun 2 tidak ada keterkaitan antara kelimpahan meiofauna dengan parameter fisika – kimia substrat dan vegetasi lamun, hal ini disebabkan oleh tidak adanya faktor – faktor yang berperan sebagai pensuplai bahan organik dalam jumlah besar ke lokasi yang berfungsi sebagai sumber makanan bagi meiofauna. Hal ini dikarenakan kondisi lapang yang berbeda ditinjau dari jenis substrat pada stasiun penelitian.
SIMPULAN DAN SARAN
Simpulan
Meiofauna interstisial yang ditemukan pada substrat padang lamun di Pulau Pramuka terdiri dari 6 filum, 8 kelas, 22 ordo, 50 famili dan 55 genera. Famili meiofauna yang mendominasi di stasiun penelitian yaitu Oxystominidae yang merupakan bagian dari Filum Nematoda. Kelimpahan meiofauna memiliki hubungan yang erat dengan parameter kimia substrat, jika parameter fisika-kimia substrat meningkat maka kelimpahan meiofauna meningkat pula. Substrat dengan karakteristik fisika-kimia lingkungan akan mempengaruhi keberadaan jenis meiofauna yang hidup diantara rongga-rongga sedimen.
Saran
25
DAFTAR PUSTAKA
Azkab MH. 2006. Ada apa dengan lamun. Oseana. 31(3) : 45-55.
Brower J, J Zar, CN von Ende. 1989. Field and laboratory methods for general ecology. Brown Company Publisher
Brower JE, JH Zar. 1977. Fields and laboratory methods for general ecology. Wn. C. Brown Publs, Dubuque, USA.
Danovaro R, Fraschetti S. 2002. Meiofaunal vertical zonation on hard-bottoms: comparison with soft-bottom meiofauna. Mar Ecol Progr Ser 230:159-169 Danovaro R, Gambi C, Mirto S. 2002. Meiofaunal production and energy transfer
efficiency in a seagrass Posidonia oceanica bed in the Western Mediterranean. Mar Ecol Progr Ser 234:95-104
Effendi H. 2003. Telaah Kualitas Air Bagi Pengelola Sumberdaya dan Lingkungan Perairan.Yogyakarta (ID).Penerbit Kanisius
EnglishS, Wilkinson, C, Baker V. 1997. Survey Manual for Tropical Marine Resources, 2nd Edition. Townsville: Australian Institute of Marine Science Funch P, Nielsen NEK, Graf S, Buttler F. 2002. Marine meiofauna. [Internet].
[Waktu dan tempat tidak diketahui]. [diunduh 2014 mei 2010]. Tersedia pada http://www.uft.uni-bremen.de/oekologie/Meiofauna Report.pdf Giere O. 1993. Meiobenthology: The microscopic fauna in aquatic sediment.
Spinger- Verlag. Berlin.
Gourbault A, Warwick RM, Helleouet MN. 1995. A survey of intertidal meiobenthos (especially Nematoda) in coral sandy beaches pf Moorea (French Polynesia). Bull Mar Sci. 57:476-488
Hawkes A. 1978. Invertebrate as Indicator of river Water Quality. In: A. James and L. Evinson (Eds). Biological Indocators of Water Qualiti John Wiley and Sons. Toronto.
Heip C, M Vincx, G Vranken. 1985. The ecology of marine nematodes. Oceanogr Mar. Bio. Ann. Rev. 21: 67-175
Hemminga MA, CM Duarte. 2000. Seagrass ecology. Cambridge (UK).Cambridge University Press.
Higgins RP, H Thiel. 1988. Prospectus. Dalam Higgins R.P, & Thiel, H. (ed). Introduction to the study of meiofauna. London: Smithsonian. Institution Pr Hutomo. H. 1997. Padang Lamun Indonesia: Salah Satu Ekosistem Laut Dangkal
yang belum banyak dikenal. Jurnal Puslitbang Oseanologi – LIPI. Jakarta, Indonesia.
Kiswara W, Winardi. 1994. Keanaekaragaman dan Sebaran Lamun di Teluk Kuta dan Teluk Gerupuk, Lombok Selatan. W Kiswara (eds.). Struktur Komunitas Biologi Padang Lamun di Pantai Lombok Selatan dan Kondisi Lingkungannya. Lembaga Ilmu Pengetahuan Indonesia. Jakarta (ID): hal 11-25
Kiswara W. 1997. Pertumbuhan dan Produksi daun Enhalus acoroides di Pulau Mapor, Kepulauan Riau. Prosiding Seminar Nasional Biologi XV. Lampung: Perhimpunan Biologi Indonesia Cabang Lampung – Universitas Lampung.
26
Krebs CJ. 1972. The Experimental Analysis of Distribution and Abudance. New York (NY). Harper and Row Publisher.
Legendre L, P Legendre. 1983. Numerical ecology. Amsterdam. Elsevier Publishing Co.
Libes SM. 1992. An Introduction to Marine Biogeochemistry. New York (NY): John Wiley & Sons Inc.
Linhart J, Vickovd S, Uvira V. 2002. Moss-dweling meiobenthos and flow velocity in low-order streams. Biologica 39-40:111-122
Magurran AE. 1988. Ecological Diversity and its Measurement. Princetown Press. New Jersey: 185 h.
Marhaeni B. 1999. Ekostruktur dan Distribusi Meiofauna di Substrat Hutan Mangrove Tritih, Cilacap, Jawa Tengah. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Marsh JA, Dennison WC, Alberte RC. 1986. Effects of Temperature on Photosynthesis and Respiration in Eslgrass (Zostera marina L.) Journal Exp Mar Biol Ecol. 101: 257-267.
Mc Kenzie. L. 2008. Seagrass Watch. Prosiding of Workshop for Mapping Seagrass Habitats in North East Arnhem Land, Northern Territory. 18-20 Oktober. Cairns, Australia. Hal : 9-16
[MENLH] Menteri Negara Lingkungan Hidup . 2004. Keputusan Kantor Menteri Negara Lingkungan Hidup No. Kep 51 / MENLH / 1 / 2004 tentang Pedoman Penetapan Baku Mutu Lingkungan. Jakarta (ID): Menteri Negara Lingkungan Hidup.
Menteri Negara Lingkungan Hidup. 2004. Baku mutu air laut untuk biota laut. Keputusan Menteri Lingkungan Hidup No. 51 tahun 2004.
Metcalfe WJ. 2005. Meiofauna abundance and distribution in Chesapeake Bay : Relationships with environmental stressors, sediment toxicity and macrofauna. [thesis]. Virginia : The Faculty of the School of Marine Science, The Collage of Willian and Mary in Virginia.
Nienhuis PH, Coosen J, Kiswara W.1989. Community structure and Biomass distribution of seagrasses and macrofauna in the Flores Sea, Indonesia. Sea Research. 23(2): 197-214.
Nybakken JW, Bertness MD. 2005. Marine Biology: An Ecological Approach. 3rd edition. New York (NY): Pearson Benjamin Cummings.
Odum EP. 1997. Fundamental of Ecology, 3rd Edition. Saunders College Publishing: Philadelphia. 474p
Pielou EC. 1977. Mathematical Ecology. John Wiley & Sons. Tronoto.
Pujianti S. 2008. Distribusi vertikal meiofauna interstisial pada padang lamun di Pulau Kambing, Teluk Banten. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rosa LC, Bemvenuti CE. 2005. Effects of burrowing crab Chasmagnathus granulata (Dana) on meiofauna of estuarine intertidal habitats of Patos Lagoon, Southerm Brazil. J Braz Arch Biol Tech 48(2):267-274
27 Susetiono 1994. Struktur dan kelimpahan meiofauna di antara vegetasi lamun Enhalus acoroides di Pantai Kuta, Lombok Tengah. Perairan Maluku dan sekitarnya 9:13-24
Susetiono. 1995. Meiofaunal Community Structure in the Kotania Bay, Seram Island, Indonesia. Perairan Maluku dan Sekitarnya, 9:35-47
Susetiono. 2004. Fauna padang lamun Tanjung Merah, Selat Lembeh. Jakarta (ID): Pusat Penelitian Oseanografi – LIPI.
Sutamihardja RTM. 1978. Kualitas Pencemaran Lingkungan. Sekolah Pascasarjana Jurusan Pengelolaan Sumberdaya Alam dan Lingkungan. Bahan Kuliah. Bogor (ID): Institut Pertanian Bogor.
Taka K, MH Azkab. 2010. Struktur komunitas lamun di Pulau Talise, Sulawesi Utara. Jakarta (ID): Oseanologi dan Limnologi Indonesia.
Tomascik TAJ, Mah A Nontji, MK Moosa. 1997. The Ecology of the Indonesian Seas, Part One. Periplus Edition. 656 h.
Trisnawati N. 2012. Struktur komunitas meiofauna interstisial di substrat padang lamun Pulau Pari Kepulauan Seribu [skripsi]. Jakarta (ID): Universitas Indonesia.
Westbeide W. 1988. Polychaeta. In: Higgins RP, Thiel H, editors. Introduction to the Study of Meiofauna. Washington DC: Smithsonian Institution Press. Pp. 380-388
28
LAMPIRAN
Lampiran 1 Dokumentasi Alat dan bahan yang digunakan untuk penyaringan dan mengawetkan sampel
Lampiran 2 Dokumentasi Pengambilan Sampel Meiofauna di Substrat Lamun
29
Lampiran 3 Dokumentasi Proses Penyaringan Sampel Meiofauna
30
Lampiran 4 Dokumentasi Proses Pengawetan dan Pemberian rose bangle pada Sampel Meiofauna
Lampiran 5 Parameter Fisika-Kimia Substrat di Pulau Pramuka
Stasiun Tekstur sedimen (%) C-organik (%) TOM (%)
Pasir Pasir kasar Pasir sedang Pasir halus Debu
1 3,88 35,50 49,03 10,43 1,16 0,32 0,55
31
Lampiran 6 Hasil perhitungan Kerapatan (Di), Frekuensi (Fi), Penutupan (Ci) dan Indeks Nilai Penting (INP) pada Lamun di Stasiun Penelitian, Pulau Pramuka
Stasiun Jenis Lamun (Spesies) Di Rdi (%) Fi RFi (%) Ci RCi (%) INP
1 Enhalus acoroides 8 0,72 0,01 1,23 0,14 2,59 4,55
Cymodocea rotundata 1104 99,28 0,71 98,77 5,22 97,41 295,45
2 Thalasia hemprichii 263 50,13 0,31 45,39 6,64 62,64 158,16
Enhalus acoroides 32 6,11 0,08 12,50 0,29 2,75 21,36
Cymodocea rotundata 121 23,16 0,16 23,68 2,39 22,54 69,38
Halodule unineyis 72 13,74 0,08 11,18 0,94 8,91 33,84
Syringodium isoetifolium 36 6,87 0,05 7,24 0,33 0,15 14,26
Lampiran 7 Kelimpahan Meiofauna di Lokasi Penelitian (Stasiun 1)
Ordo Famili Garis 1 Garis 2 Garis 3
T1 T2 T3 T1 T2 T3 T1 T2 T3
Filum : Canalipalpata Acrocirridae 1 2 7 2 6 3 2 1 0
Annelida Kelas
Not assigned Capitellidae 2 1 2 3 1 4 0 1 0
Polychaeta Canalipalpata Ctenodrilidae 0 0 0 0 0 0 1 1 1
Aciculata Dorvilleidae 18 5 16 31 64 29 26 15 10
Canalipalpata Fauveliopsidae 0 0 0 3 1 5 6 3 1
Aciculata Nerillidae 0 0 0 0 0 0 2 1 0
Canalipalpata Oweniidae 3 0 0 18 16 12 0 0 0
Aciculata Phyllodocidae 0 0 0 0 0 0 3 1 0
32
Lampiran 7 Lanjutan
Ordo Famili Garis 1 Garis 2 Garis 3
T1 T2 T3 T1 T2 T3 T1 T2 T3
Canalipalpata Sabellidae 1 0 1 0 0 1 1 0 0
Aciculata Sphaerodoridae 0 0 1 5 14 8 0 0 0
Phyllodocida Syllidae 4 13 15 9 39 18 4 4 4
Haplotaxida Tubificidae 0 0 0 0 0 0 0 1 2
Filum : Podocopida Bythocytheridae 1 0 4 9 39 18 4 4 4
Crustacea Harpacticoida Cletodidae 0 0 0 2 21 8 0 1 2
Kelas : Podocopida Cyprididae 0 1 5 2 8 10 7 8 10
Ostracoda Platycopida Cytherellidae 13 12 42 9 62 34 5 3 5
Maxillopoda Harpacticoida Diosaccidae 1 0 1 2 14 8 3 4 10
Harpacticoida Harpacticidae 1 7 7 28 13 9 8 10 11
Harpacticoida Laophontidae 1 0 0 6 11 5 1 1 0
Harpacticoida Leptastacidae 0 0 0 3 9 6 4 2 1
Podocopida Loxoconchidae 0 5 6 1 0 2 4 2 4
Harpacticoida Miraciidae 0 0 0 0 1 2 5 4 6
Harpacticoida Paramesochridae 0 0 0 7 19 13 0 2 1
Harpacticoida Phyllodocidae 0 0 0 2 3 2 0 0 0
Harpacticoida Porcellidiidae 8 8 5 11 4 2 1 1 1
Filum : Diptera Heleomyzidae 0 0 0 1 1 1 6 4 7
Hexapoda Enoplida Anticomidae 0 0 0 4 17 13 4 3 5
Kelas :
33
Lampiran 7 Lanjutan
Ordo Famili Garis 1 Garis 2 Garis 3
T1 T2 T3 T1 T2 T3 T1 T2 T3
Filum : Enoplida Anticomidae 0 0 0 4 17 13 4 3 5
Nematoda Desmodorida Chromadoridae 7 4 12 49 62 43 17 16 12
Kelas : Chromadorida Desmoscolecidae 4 0 0 0 0 0 0 0 0
Adenophorea Hologonia Enoplidae 6 2 6 12 31 8 7 6 3
Araeolaimida Leptolaimidae 2 0 0 61 64 39 17 24 17
Enoplida Leptosomatidae 5 2 6 25 35 17 6 5 1
Monhysterida Linhomoeidae 10 30 57 38 50 36 16 17 14
Desmodorida Microlaimidae 3 3 3 6 8 14 12 7 11
Enoplida Oncholaimidae 1 12 27 56 45 30 14 15 14
Filum : Nemertodermatida Nemertodermatidae 0 0 0 2 13 3 1 1 0
Xenacoelomorpha
Kelas :
Acoelomorpha
Lampiran 8 Kelimpahan Meiofauna di Lokasi Penelitian (Stasiun 2)
Ordo Famili Garis 1 Garis 2 Garis 3
T1 T2 T3 T1 T2 T3 T1 T2 T3
Filum : Canalipalpata Acrocirridae 0 0 0 2 1 0 1 0 0
34
Lampiran 8 Lanjutan
Ordo Famili Garis 1 Garis 2 Garis 3
T1 T2 T3 T1 T2 T3 T1 T2 T3
Kelas : Canalipalpata Ctenodrilidae 1 0 0 0 1 0 2 0 0
Polychaeta Aciculata Dorvilleidae 11 5 5 31 19 2 28 10 4
Clitellata Canalipalpata Fauveliopsidae 0 1 0 5 5 0 1 1 0
Aciculata Hesionidae 1 1 1 0 1 1 0 1 0
Aciculata Nerillidae 3 3 3 11 5 2 2 2 0
Not assigned Parergodrilidae 1 0 0 1 1 1 0 1 1
Aciculata Phyllodocidae 0 0 0 0 1 1 1 1 1
Not assigned Questidae 6 6 5 9 10 3 6 5 2
Canalipalpata Sabellidae 0 1 0 1 0 0 1 0 0
Aciculata Sphaerodoridae 1 1 2 6 4 1 3 1 1
Filum : Canalipalpata Acrocirridae 0 0 0 2 1 0 1 0 0
Annelida Not assigned Capitellidae 2 1 2 0 1 0 0 1 0
Kelas : Canalipalpata Ctenodrilidae 1 0 0 0 1 0 2 0 0
Polychaeta Aciculata Dorvilleidae 11 5 5 31 19 2 28 10 4
Clitellata Canalipalpata Fauveliopsidae 0 1 0 5 5 0 1 1 0
Aciculata Hesionidae 1 1 1 0 1 1 0 1 0
Aciculata Nerillidae 3 3 3 11 5 2 2 2 0
Not assigned Parergodrilidae 1 0 0 1 1 1 0 1 1
Aciculata Phyllodocidae 0 0 0 0 1 1 1 1 1
Not assigned Questidae 6 6 5 9 10 3 6 5 2
35
Lampiran 8 Lanjutan
Ordo Famili Garis 1 Garis 2 Garis 3
T1 T2 T3 T1 T2 T3 T1 T2 T3
Aciculata Sphaerodoridae 1 1 2 6 4 1 3 1 1
Phyllodocida Syllidae 4 4 3 4 8 2 8 4 3
Haplotaxida Tubificidae 7 1 1 34 7 7 12 8 1
Filum : Amphipoda Ampithoidae 0 1 0 0 1 0 0 0 0
Arthropoda Bathynellacea Bathynellidae 1 1 1 1 0 1 1 0 0
Kelas : Isopoda Expanathuridae 1 0 0 1 1 1 0 0 0
Malacostraca Amphipoda Ingolfiellidae 1 1 1 2 0 0 1 0 1
Isopoda Microcerberidae 1 1 1 1 1 0 1 0 1
Decapoda Pasiphaeidae 1 1 0 0 1 0 1 0 0
Tanaidacea Tanaidae 1 1 1 1 1 0 0 0 0
Filum : Podocopida Bythocytheridae 2 6 3 13 7 5 10 2 5
Crustacea Harpacticoida Canuellidae 1 1 1 1 1 0 1 0 1
Kelas : Harpacticoida Cletodidae 3 1 3 7 5 4 3 1 0
Ostracoda Podocopida Cyprididae 5 7 6 11 8 14 13 7 9
Maxillopoda Platycopida Cytherellidae 10 7 7 12 9 13 12 6 7
Harpacticoida Diosaccidae 1 1 0 1 2 0 3 0 1
Harpacticoida Harpacticidae 2 0 3 5 3 2 7 1 2
Harpacticoida Laophontidae 3 1 1 4 4 1 9 2 5
Harpacticoida Leptastacidae 2 1 1 7 1 0 3 1 3
36
Lampiran 8 Lanjutan
Ordo Famili Garis 1 Garis 2 Garis 3
T1 T2 T3 T1 T2 T3 T1 T2 T3
Harpacticoida Paramesochridae 1 4 1 9 5 6 1 0 1
Harpacticoida Porcellidiidae 3 2 1 4 3 0 1 1 0
Filum : Diptera Heleomyzidae 1 1 0 1 1 1 16 11 16
Hexapoda
Kelas :
Insecta
Filum : Enoplida Anticomidae 8 6 11 9 9 18 23 18 21
Nematoda Desmodorida Chromadoridae 18 12 12 31 20 30 11 6 10
Kelas : Hologonia Enoplidae 7 0 5 7 11 12 20 18 14
Adenophorea Araeolaimida Leptolaimidae 19 12 10 12 18 23 9 4 5
Enoplida Leptosomatidae 16 4 3 6 7 14 18 11 16
Monhysterida Linhomoeidae 17 12 7 15 15 18 12 9 11
Desmodorida Microlaimidae 9 8 6 10 12 14 20 12 15
Enoplida Oncholaimidae 16 9 8 14 19 18 14 10 10
Enoplida Oxystominidae 14 11 8 12 12 17 2 2 3
Desmodorida Richtersiidae 1 0 2 5 4 3 21 9 15
37
Lampiran 8 Lanjutan
Lampiran 9 Hasil Analisis Komponen Utama (Principal Component Analisis) Kelimpahan Meiofauna dengan Parameter Fisika – Kimia Substrat dan Vegetasi Lamun
Variabel PC1 PC2 PC3 PC4 PC5
Eigenvalue 3.2644 0.8116 0.6598 0.2641 0.0001
Proportion 0.653 0.162 0.132 0.053 0.000
Cumulative 0.653 0.815 0.947 1.000 1.000
Variabel PC1 PC2 PC3 PC4 PC5
Kelimpahan Meiofauna 0.356 0.753 -0.339 0.438 -0.014
Kerapatan Lamun 0.422 -0.606 -0.032 0.671 -0.056
Pasir 0.535 -0.100 -0.172 -0.374 0,731
Debu -0.357 -0.226 -0.906 -0.021 0,007
TOM 0.530 -0.075 -0.185 -0.466 -0.680
Ordo Famili Garis 1 Garis 2 Garis 3
T1 T2 T3 T1 T2 T3 T1 T2 T3
Filum : Nemertodermatida Nemertodermatidae 2 1 5 11 5 6 7 4 3
Xenacoelomopha
Kelas :
38
Lampiran 10 Foto – Foto Spesimen Meiofauna
Anticomidae
Cytherellidae
Dorvilleidae
Fauveliopsidae
Oncholaimidae
Leptolaimidae
Linhomoeidae
39
Leptastacidae
Tubificidae
Enoplidae
Richtersiidae
Dorvilleidae
Nemertodermatidae
Paramesochridae
40
Chromadoridae
Hesionidae
Oxystominidae
Xylidae
Ctenodrilidae
Dorvilleidae
Cyprididae
41 Lampiran 11 Hasil Perhitungan Indeks Kesamaan Taksa (IS) Meiofauna di
Stasiun penelitian
ST 1 ST2 IS
Acrocirridae Acrocirridae 85,057
Anticomidae Ampithoidae
Bythocytheridae Anticomidae
Capitellidae Bathynellidae
Chromadoridae Bythocytheridae
Cletodidae Canuellidae
Ctenodrilidae Capitellidae
Cyprididae Chromadoridae
Cytherellidae Cletodidae
Desmoscolecidae Ctenodrilidae
Diosaccidae Cyprididae
Dorvilleidae Cytherellidae
Enoplidae Diosaccidae
Fauveliopsidae Dorvilleidae
Harpacticidae Enoplidae
Heleomyzidae Expanathuridae Laophontidae Fauveliopsidae Leptastacidae Harpacticidae
Leptolaimidae Heleomyzidae
Leptosomatidae Hesionidae
Linhomoeidae Ingolfiellidae
Loxoconchidae Laophontidae
Microlaimidae Leptastacidae
Miraciidae Leptolaimidae
Nemertodermatidae Leptosomatidae
Nerillidae Linhomoeidae
Oncholaimidae Loxoconchidae
Oweniidae Microcerberidae
Oxystominidae Microlaimidae
Paramesochridae Miraciidae
Phyllodocidae Nemertodermatidae
Porcellidiidae Nerillidae
Questidae Oncholaimidae
Richtersiidae Oxystominidae
Sabellidae Paramesochridae
Sphaerodoridae Parergodrilidae
Syllidae Pasiphaeidae
Tripyloididae Phyllodocidae
42
Lampiran 11 Lanjutan
ST 1 ST2 IS
Xyalidae Questidae 85,057
Richtersiidae
Sabellidae
Sphaerodoridae
Syllidae
Tanaidae
Tubificidae
Xyalidae
= 85.057 % Keterangan :
A jumlah taksa di Stasiun 1 40
B jumlah taksa di Stasiun 2 47
C taksa yang sama di kedua Stasiun 1 dan 2 37
43
RIWAYAT HIDUP
Penulis dilahirkan di Sumenep, Madura, Jawa Timur pada tanggal 5 November 1991 sebagai anak ke dua dari tiga bersaudara pasangan Bapak Drs H M Nurhasan, MSi dan Ibunda Hj Nurhayati. Pada tahun 2010 penulis lulus dari SMA Negeri I Sumenep, Madura, Jawa Timur. Penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur SNMPTN di Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan pada tahun 2010.
Selama mengikuti perkuliahan, penulis aktif di Himpunan Mahasiswa Ilmu dan Teknologi Kelautan (HIMITEKA) mulai dari tahun 2012-2013 dan sebagai anggota BPH divisi Kesekretariatan. Penulis juga aktif menjadi asisten praktikum Dasar-dasar Penginderaan Jauh Kelautan 2014. Penulis juga pernah melakukan Praktek Kerja Lapang (PKL) di PPP Muncar, Banyuwangi.