PRODUKSI EMBRIO
IN VITRO
DARI OOSIT HASIL
AUTOTRANSPLANTASI HETEROTOPIK
OVARIUM MENCIT
NURBARIAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Produksi Embrio In Vitro dari Oosit Hasil Autotransplantasi Heterotopik Ovarium Mencit adalah benar hasil karya saya sendiri dengan arahan dari komisi pembimbing dan belum pernah dipublikasikan kepada perguruan tinggi manapun. Sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2007
ABSTRAK
NURBARIAH. Produksi Embrio In Vitro dari Oosit Hasil Autotransplantasi Heterotopik Ovarium Mencit. Dibimbing oleh ITA DJUWITA dan IMAN SUPRIATNA.
Penelitian ini dilakukan untuk mempelajari kemampuan oosit yang dikoleksi dari ovarium transplan heterotopik untuk produksi embrio in vitro dan mengetahui pengaruh induksi pregnant mare’s serum gonadotrophin (PMSG) terhadap peningkatan jumlah oosit dari ovarium transplan heterotopik. Teknik transplantasi yang digunakan adalah heterotopik autotransplantasi pada kapsula ginjal mencit betina umur empat minggu dengan perlakuan oosit hasil transplan ovarium (OT) dan oosit hasil transplan ovarium dan induksi PMSG (OTP). Dilakukan perlakuan pembanding tanpa transplantasi ovarium (OSO) dengan mencit yang diinduksi PMSG dan human chorionic gonadothropin (hCG) masing-masing dengan dosis 5 IU intraperitoneal (i.p.) interval 48 jam untuk mendapatkan oosit matang in vivo. Induksi PMSG dilakukan 48 jam dan hCG 14 jam sebelum koleksi oosit. Koleksi oosit dari ovarium transplan dilakukan pada hari ke-21 setelah transplantasi kemudian dimatangkan secara in vitro selama 24 jam. Oosit hasil pematangan in vivo dan in vitro difertilisasi in vitro dengan sperma vas deferen mencit jantan dilanjutkan dengan kultur perkembangan embrio. Pematangan dan fertilisasi oosit serta kultur embrio in vitro menggunakan medium kalium simplex optimized medium (KSOM) pada inkubator CO2 5% suhu
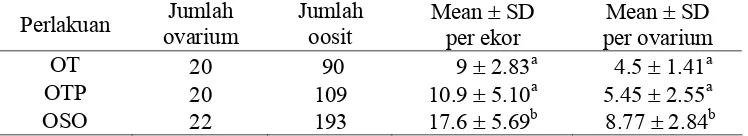
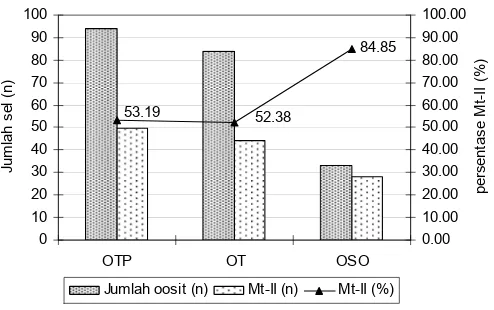
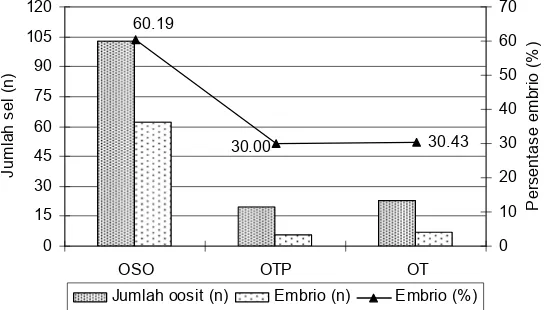
37 ºC. Hasil yang diperoleh menunjukkan bahwa jumlah oosit yang dikoleksi dari perlakuan OT dan OTP tidak berbeda secara signifikan namun kedua perlakuan tersebut menunjukkan perbedaan yang signifikan dengan perlakuan OSO. Oosit yang mencapai metafase II (Mt-II) pada perlakuan OT (52.38%) dan OTP (53.19%) secara signifikan tidak berbeda namun menunjukkan perbedaan signifikan dengan perlakuan OSO (84.85%). Tingkat fertilisasi tidak berbeda secara signifikan diantara ketiga perlakuan namun perkembangan embrio menunjukkan perbedan signifikan antara perlakuan OSO (60.19%) dengan OT (30.43%) dan OTP (30%). Berdasarkan hasil penelitian yang diperoleh disimpulkan bahwa dari ovarium transplan heterotopik dapat dihasilkan oosit yang dapat digunakan untuk produksi embrio in vitro. Induksi dengan menggunakan PMSG tidak mempengaruhi perolehan jumlah oosit yang dikoleksi dari ovarium transplan. Oosit hasil transplantasi ovarium menunjukkan kemampuan untuk matang in vitro mencapai tahap Mt-II dan setelah difertilisasi mampu berkembang menjadi embrio.
ABSTRACT
NURBARIAH. Embryo In Vitro Production Using Oocytes Collected from Heterotopic Autografted Mice Ovary. Under the direction of ITA DJUWITA and
IMAN SUPRIATNA.
The aim of this study was to examine the capability of oocyte collected from heterotopic autografted mice ovary in embryo in vitro production and the influenced of pregnant mare’s serum gonadotrophin (PMSG) induction on the number of oocytes collected from heterotopic autografted mice ovary. Ovarian tissue from four weeks old mice were transplanted under the kidney capsules of ovariectomized mice. The grafted mice were grouped into two; group one was mice without induction PMSG (OT) and group two treated with 5 IU PMSG induction (OTP). The third group was mice without grafted ovary and treated with PMSG and human chorionic gonadothropin (hCG) induction (OSO). Induction of PMSG was injected 48 hours before oocytes collection while hCG was injected 14 h before oocytes collection. Tweenty one days after grafting or fourty eight h after PMSG injection, oocytes were collected from the two groups and matured in vitro for 24 h. Matured oocytes were then fertilized in vitro with vas deferens sperm followed by embryo in vitro development. Oocytes in vitro maturation and fertilization and embryo in vitro development were done in kalium simplex optimized medium (KSOM) in 5% CO2 incubator. The results showed that the
number of oocytes collected from group OT and OTP were not significantly different, but both showed significantly different with the OSO group. Under in vitro culture conditions, the number of matured oocytes that reached metaphase-II stage in group OT (52.38%) and OTP (53.19%) were not significantly different, but significantly different with those from group OSO (84.85%). Although the oocytes fertilization rate were not significantly different among the three groups, the embryo development rate showed significantly different between OSO (60.19%) with OT (30.43%) and OTP (30%). In conclusion, the oocytes collected from heterotopic grafted ovary can be used in embryo in vitro production after sequential matured and fertilized in vitro. The induction of PMSG on the mice with grafted ovary did not increased the collected number of oocytes.
RINGKASAN
NURBARIAH. Produksi Embrio In Vitro dari Oosit Hasil Autotransplantasi Heterotopik Ovarium Mencit. Dibimbing oleh ITA DJUWITA dan IMAN SUPRIATNA.
Transplantasi jaringan ovarium dapat digunakan sebagai metoda alternatif penyimpanan dan penyelamatan ovarium dalam rangka penyelamatan fungsi reproduksi dan salah satu upaya mendukung konservasi satwa langka. Ovarium dapat ditransplantasi pada kapsula ginjal karena memiliki sistem vaskularisasi yang baik sehingga akan mempercepat persembuhan ovarium dan perkembangan folikel pascatransplantasi sehingga ovarium masih dapat digunakan dalam program produksi embrio in vitro. Perkembangan folikel pada ovarium dapat diinduksi dengan hormon gonadotrophin eksogenous sehingga penyuntikan pregnant mare’s serum gonadothropin (PMSG) sebelum pengambilan ovarium transplan dapat mengoptimalkan perolehan oosit untuk digunakan dalam produksi embrio in vitro. Oleh karena itu tujuan dari penelitian ini adalah mempelajari kemampuan oosit yang dikoleksi dari ovarium transplan heterotopik untuk produksi embrio in vitro dan mengetahui pengaruh induksi PMSG terhadap peningkatan jumlah oosit dari ovarium transplan heterotopik.
Teknik transplantasi yang digunakan adalah heterotopik autotransplantasi pada kapsula ginjal mencit betina umur empat minggu dengan perlakuan oosit hasil transplan ovarium (OT) dan oosit hasil transplan ovarium dan induksi PMSG (OTP). Dilakukan perlakuan pembanding tanpa transplantasi ovarium (OSO) dengan mencit yang diinduksi PMSG dan human chorionic gonadothropin (hCG) masing-masing dengan dosis 5 IU intraperitoneal (i.p.) interval 48 jam untuk mendapatkan oosit matang in vivo. Induksi PMSG dilakukan 48 jam dan hCG 14 jam sebelum koleksi oosit. Koleksi oosit dari ovarium transplan dilakukan pada hari ke-21 setelah transplantasi kemudian dimatangkan secara in vitro selama 24 jam. Oosit yang mencapai tahap metafase II (Mt-II) ditandai dengan terbentuknya polar bodi I. Tingkat pematangan dihitung dari jumlah oosit yang mencapai Mt-II per jumlah oosit yang dikultur. Oosit hasil pematangan in vivo dan in vitro difertilisasi in vitro dengan sperma vas deferen mencit jantan dilanjutkan dengan kultur perkembangan embrio. Keberhasilan fertilisasi ditandai dengan terbentuknya pronukleus jantan dan betina. Tingkat fertilisasi dihitung dari jumlah oosit yang terfertilisasi per jumlah oosit yang diinseminasi. Perkembangan embrio diperoleh dengan menghitung jumlah embrio yang berhasil membelah dibandingkan dengan jumlah yang dikultur. Pematangan dan fertilisasi oosit serta kultur embrio in vitro menggunakan medium kalium simplex optimized medium (KSOM) pada inkubator CO2 5% suhu 37 ºC. Data yang diperoleh dari hasil
penelitian dianalisis dengan sidik ragam menggunakan general linear method (GLM). Perbedaan antar perlakuan diuji dengan Duncan multiple range test (DMRT).
ovarium) tidak berbeda secara signifikan namun kedua perlakuan tersebut menunjukkan perbedaan yang signifikan dengan perlakuan OSO (17.6±5.69 per ekor dan 8.77±2.84 per ovarium). Secara alamiah oosit yang dapat diovulasikan oleh mencit tanpa induksi gonadotrophin adalah 7-13 oosit tergantung strain. Hasil tersebut menunjukkan bahwa induksi PMSG tidak meningkatkan jumlah oosit pada ovarium transplan heterotopik. Hal ini disebabkan kemungkinan lokasi transplantasi ovarium (heterotopik) tidak dapat memberikan respon terhadap induksi gonadotrophin secara normal. Namun demikian, dengan teknik transplantasi ovarium heterotopik memungkinkan ovarium digunakan sebagai sumber oosit untuk dapat dipergunakan lebih lanjut.
Oosit yang mencapai metafase II (Mt-II) pada perlakuan OT (52.38%) dan OTP (53.19%) secara signifikan tidak berbeda namun menunjukkan perbedaan signifikan dengan perlakuan OSO (84.85%). Hal ini menunjukkan bahwa oosit dari ovarium transplan heterotopik memiliki viabilitas untuk matang in vitro mencapai Mt-II selain itu tidak terdapat perbedaan secara signifikan hasil oosit yang mencapai Mt-II antara perlakuan OT (52.38%) dan OTP (53.19%) diduga bahwa induksi PMSG secara in vivo terhadap ovarium transplan heterotopik tidak mempengaruhi jumlah dan kualitas oosit yang terkoleksi sehingga tidak mempengaruhi tingkat pematangan oosit secara in vitro. Dalam kultur pematangan oosit in vitro, kualitas oosit dan medium mempengaruhi tingkat pematangan oosit. Oosit yang dikoleksi dari perlakuan OT dan OTP hanya oosit yang dikelilingi oleh sel-sel kumulus kompak, karena keberadaan sel-sel kumulus dapat mendukung proses pematangan in vitro oosit sehingga inti oosit dapat mencapai tahap Mt-II. Medium yang digunakan dalam pematangan oosit in vitro dapat memberikan pengaruh bukan hanya pada oosit tapi juga terhadap perkembangan embrio.
Jumlah oosit yang terfertilisasi in vitro (tingkat fertilisasi) pada perlakuan OT (52.50%), OTP (66.67%) dan OSO (64.38%) tidak menunjukkan perbedaan yang signifikan. Hal ini menunjukkan bahwa oosit yang diperoleh dari ovarium transplan heterotopik dan matang secara in vitro mampu terfertilisasi. Tidak semua oosit yang telah matang baik secara in vitro maupun in vivo mampu terfertilisasi. Kegagalan fertilisasi dapat dipengaruhi oleh tingkat pematangan oosit (baik inti dan sitoplasma), kemampuan sperma membuahi oosit (kapasitasi dan reaksi akrosom) dan kegagalan sperma mengalami kondensasi dalam sitoplasma oosit sehingga terjadi kegagalan pembentukan pronukleus (PN) jantan. Oleh karena itu walaupun oosit yang berasal dari pematangan in vivo (OSO) telah mengalami pematangan inti dan sitoplasma namun tingkat fertilisasi in vitro juga dipengaruhi oleh kualitas dan kemampuan sperma yang digunakan. Keberhasilan fertilisasi sangat ditentukan oleh interaksi antara oosit dengan sperma dan medium. Kemampuan oosit respon terhadap aktivasi sperma menunjukkan keberhasilan pematangan oosit. Sehingga meskipun sperma mampu memasuki oosit namun ketidakcukupan pematangan pada oosit akan menyebabkan proses selanjutnya terhambat sehingga menyebabkan kegagalan fertilisasi. Kemampuan oosit untuk merespon penetrasi sperma diperoleh secara bertahap sebelum ovulasi ketika oosit mengalami pematangan inti dan sitoplasma.
dibandingkan dengan perlakuan OSO (60.19%) menunjukkan perbedaan yang signifikan. Terdapat perbedaan persentase antara perlakuan OT (30.43%) dan OTP (30.00%) akan tetapi setelah diuji secara statistik perkembangan embrio yang diperoleh secara signifikan tidak berbeda. Hal ini diduga karena oosit yang diperoleh pada perlakuan OT dan OTP berasal dari pematangan in vitro. Diduga bahwa dalam proses pematangan oosit in vitro terjadi ketidaksempurnaan pematangan terutama pematangan sitoplasma. Pematangan inti dapat diamati secara jelas yang ditandai dengan pengeluaran polar bodi namun pematangan sitoplasma dapat diketahui dari kemampuan oosit terfertilisasi dan kemampuan perkembangan embrio. Ketidakcukupan proses pematangan sitoplasma pada oosit akan mempengaruhi perpindahan atau pertukaran kontrol perkembangan maternal ke embrio dan akan mempengaruhi perkembangan embrio. Pada penelitian ini tingkat perkembangan embrio yang diperoleh dari perlakuan transplantasi masih sangat rendah. Seperti hasil dari koleksi oosit, pematangan dan fertilisasi in vitro pada penelitian ini, pemberian PMSG pada ovarium transplan heterotopik tidak memberikan pengaruh yang berbeda termasuk dalam perkembangan embrio. Hal ini diduga karena perkembangan embrio in vitro dipengaruhi oleh kualitas oosit dan medium yang digunakan. Perbedaan kondisi kultur mempengaruhi faktor-faktor sitoplasma sehingga mempengaruhi kemampuan oosit untuk terfertilisasi dan keberhasilan embriogenesis. Perkembangan tahap awal embrio tergantung pada lingkungan pematangan oosit, ketika sistem pematangan in vitro tidak memberikan lingkungan yang cocok bagi oosit walaupun dapat terbentuk kematangan inti dan terjadi fertilisasi namun hasil akhir adalah rendahnya perkembangan embrio yang diperoleh. Oleh karena itu kualitas embrio dapat ditingkatkan dengan kultur pada kondisi lingkungan yang optimal.
Berdasarkan hasil yang diperoleh maka disimpulkan bahwa dari ovarium transplan heterotopik dapat dihasilkan oosit yang memiki potensi untuk digunakan dalam produksi embrio in vitro. Induksi dengan menggunakan PMSG tidak mempengaruhi perolehan jumlah oosit yang dikoleksi dari ovarium transplan heterotopik. Oosit hasil transplantasi ovarium menunjukkan kemampuan untuk matang in vitro mencapai tahap metafase II dan setelah difertilisasi mampu berkembang menjadi embrio.
© Hak cipta milik Institut Pertanian Bogor, tahun 2007
Hak cipta dilindungi
PRODUKSI EMBRIO
IN VITRO
DARI OOSIT HASIL
AUTOTRANSPLANTASI HETEROTOPIK
OVARIUM MENCIT
NURBARIAH
Tesis
Sebagai salah satu syarat memperoleh gelar Magister Sains pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Produksi Embrio In Vitro dari Oosit Hasil Autotransplantasi Heterotopik Ovarium Mencit
Nama : Nurbariah
NRP : B051040021
Disetujui
Komisi Pembimbing
Dr. drh. Ita Djuwita, M.Phil Dr. drh. Iman Supriatna
Ketua Anggota
Diketahui
Ketua Program Studi Biologi Reproduksi
Dr. drh. Tuty L. Yusuf, M.S
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Alhamdulillah, puji syukur senantiasa kehadirat Allah SWT atas segala
limpahan karunia dan rahmat-Nya sehingga penelitian dan penulisan tesis ini
berhasil diselesaikan. Penelitian yang telah dilaksanakan mengangkat tema
mengenai transplantasi dengan judul Produksi Embrio In Vitro dari Oosit Hasil
Autotransplantasi Heterotopik Ovarium Mencit.
Penulis mengucapkan terimakasih dan penghargaan yang tinggi kepada
Ibu Dr. drh Ita Djuwita, M.Phil dan Bapak Dr. drh. Iman Supriatna selaku ketua
dan anggota komisi pembimbing yang telah meluangkan waktu untuk
memberikan bimbingan, nasehat, masukan dan saran serta dorongan semangat
yang begitu besar sehingga penulis dapat menyelesaikan penelitian dan
merampungkan tesis ini. Ungkapan terima kasih juga ditujukan pada Bapak Dr.
drh. Agus Setiadi sebagai penguji luar komisi yang telah memberikan masukan
dan saran kepada penulis. Terima kasih kepada Ibu Dr. drh. Tuty L. Yusuf, M.S,
selaku Ketua Program Studi Biologi Reproduksi beserta seluruh staf pengajar
Program Studi Biologi Reproduksi, Departemen Klinik, Reproduksi dan Patologi
FKH IPB. Terima kasih kepada Laboratorium Embriologi, Departemen Anatomi,
Fisiologi dan Farmakologi FKH IPB serta Unit Pelaksana Teknis (UPT) Hewan
Laboratorium FKH IPB atas bantuan fasilitas pendukung sehingga penelitian
dapat berjalan dengan baik.
Penulis juga menyampaikan rasa terima kasih yang mendalam kepada drh.
Wahono Esthi Prasetyaningtyas M.Si, drh. Hamny, M.Si, Dr. drh. I Wayan Batan,
M.Si, Ir. Thomas Mata Hine, M.Si, Ir. Bayu Rosadi, M.Si, Wito Prawigit, M.Si,
Suparmin Fathan, M.Si, Heppi Iromo, M.Si, Roza Helmita, S.Si, Yanie P.
Ritonga, M.Si, Yuli Erina, M.Si, Elita Agustina, M.Si, Dhona Arianti, M.Si,
Adnan Albahry, M.Si, Bonita Ayu Novelani, M.Si, Nurul, M.Si, Anovia, SP, Ida,
S.Si, Nadia, S.Pi, drh. Ena, drh. Rini, Evi, S.Pi, Rinrin, SP, Uca, S.Pi, Silvi, S.Hut,
rekan-rekan mahasiswa Program Studi Biologi Reproduksi, keluarga besar
Laboratorium Embriologi dan berbagai pihak yang tidak dapat disebutkan satu
Terima kasih tak terhingga selamanya kepada yang tercinta ayahanda dan
ibunda serta saudaraku tersayang (Kak Fitri, Iir dan Beni) atas segala cinta, doa,
dukungan semangat, dukungan moril dan materil yang tiada henti diberikan
kepada penulis selama ini.
Akhir kata penulis mengharapkan semoga tesis ini dan apa yang telah
dihasilkan dapat bermanfaat bagi pengembangan ilmu pengetahuan, bagi pembaca
pada umumnya dan penulis pada khususnya.
Bogor, Mei 2007
RIWAYAT HIDUP
Penulis dilahirkan di Banda Aceh pada tanggal 25 Oktober 1978 dari
pasangan H. Poniman Usman dan Dra. Hj. Sarwati Hamzah. Penulis merupakan
putri ke dua dari empat bersaudara.
Pendidikan sarjana ditempuh di Program Studi Biologi, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Universitas Syiah Kuala, Banda Aceh
dan gelar sarjana diraih pada tahun 2003. Pada tahun 2004, penulis diterima
sebagai mahasiswa program master pada Program Studi Biologi Reproduksi,
DAFTAR ISI
Autotransplantasi Heterotopik Ovarium ... 8
Superovulasi... 10
Pematangan Oosit In Vitro... 12
Fertilisasi In Vitro... 14
Perkembangan Embrio In Vitro... 18
BAHAN DAN METODE
Autotransplantasi Heterotopik ... 22
Koleksi Oosit dari Ovarium Transplan Heterotopik ... 22
Pematangan Oosit In Vitro... 23
Fertilisasi Oosit In Vitro... 23
Perkembangan Embrio In Vitro... 24
Evaluasi Data ... 24
Analisis Data ... 24
HASIL DAN PEMBAHASAN Koleksi Oosit dari Ovarium Transplan Heterotopik ... 25
DAFTAR TABEL
Halaman
1 Jumlah oosit terkoleksi dari ovarium transplan dengan dan tanpa induksi
PMSG... 25
DAFTAR GAMBAR
Halaman
1 Perkembangan folikel ... 6
2 Aktivitas meiosis pada oosit ... 7
3 Proses rekrutmen, seleksi dan dominan pada ovarium selama perkembangan folikel... 11
4 Interaksi oosit-sperma dalam proses fertilisasi ... 15
5 Perubahan pada sperma selama reaksi akrosom ... 17
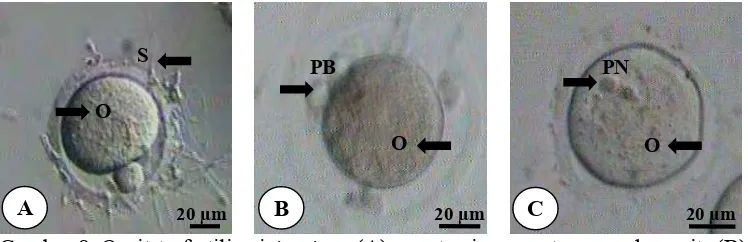
6 Oosit yang mampu mencapai kematangan tahap metafase II ... 27
7 Pematangan oosit secara in vitro... 29
8 Oosit terfertilisasi in vitro... 30
9 Perbandingan perkembangan embrio in vitro dari perlakuan transplantasi dan tanpa transplantasi ... 32
DAFTAR LAMPIRAN
Halaman
1 Komposisi medium koleksi ovarium dan oosit (phosphate buffered
saline)... 45
2 Komposisi medium KSOM... 46
PENDAHULUAN
Latar Belakang
Reproduksi merupakan aktivitas yang penting bagi keberlangsungan hidup
suatu spesies. Aktivitas reproduksi dapat berhadapan dengan kendala yang
menyebabkan prosesnya terganggu antara lain akibat campur tangan manusia pada
suatu populasi spesies dan kematian mendadak pada hewan langka yang
menyebabkan berkurangnya jumlah populasi suatu spesies hewan tertentu. Pada
wanita, organ reproduksi dapat terganggu karena pengaruh efek samping dari
kemo- atau radioterapi pada pengobatan penyakit kanker yang dapat
mempengaruhi ovarium sebagai organ reproduksi primer.
Dalam fungsinya sebagai organ reproduksi primer, ovarium merupakan
penghasil sel telur (oosit) dan hormon. Oosit pada ovarium berkembang
bersamaan dengan perkembangan folikel. Saat lahir pada korteks ovarium
mamalia terdapat banyak kumpulan folikel primordial sebagai sumber oosit yang
akan berkembang dan dapat mencapai tahap ovulasi saat pubertas (Fortune 1994).
Pada hewan langka yang mati atau hewan ternak yang dipotong, pada korteks
ovarium masih dapat ditemukan folikel primordial dalam jumlah banyak dan
dapat digunakan lebih lanjut. Bahkan pada wanita muda pasien kanker yang akan
menjalani kemo- atau radioterapi dilakukan ovariektomi sebelum terapi agar
ovarium dapat disimpan beku dan digunakan kembali kemudian hari pascaterapi.
Koleksi jaringan ovarium yang mengandung folikel primordial dapat dilakukan
setiap saat tanpa memperhatikan usia atau siklus estrus dan pemanfaatan folikel
primordial merupakan salah satu cara untuk penyimpanan oosit dalam jumlah
besar (Shaw et al. 2000).
Terdapat beberapa metoda pemanfaatan ovarium yang telah dikembangkan
untuk penyelamatan fertilitas antara lain penyimpanan jaringan ovarium yang
mengandung folikel primordial secara in vitro dalam bentuk beku untuk jangka
waktu yang lama atau penyimpanan secara in vivo dengan teknik transplantasi
(Sonmezer & Oktay 2004) dan kultur in vitro jaringan ovarium atau folikel
preantral (Wu et al. 2001). Transplantasi ovarium merupakan pemindahan
penyimpanan ovarium dan perkembangan folikel secara in vivo. Folikel preantral
terutama folikel primordial dan primer dari ovarium beku atau segar dapat
dipergunakan kembali dengan menumbuhkan secara in vivo menggunakan teknik
transplantasi atau dikultur in vitro untuk perkembangan mencapai folikel antral
dan menghasilkan oosit matang (Liu et al. 2000, Newton & Illingworth 2001).
Oosit yang dikoleksi dari folikel antral ovarium hasil transplantasi masih dapat
dimatangkan, difertilisasi dan dikultur in vitro hingga diperoleh embrio
selanjutnya embrio dapat ditransfer ke induk resipien untuk menghasilkan
keturunan (Liu et al. 2001). Selain itu beberapa penelitian yang telah dilakukan
menunjukkan keberhasilan transplantasi ovarium ternyata dapat memulihkan
fungsi reproduksi pada mencit (Candy et al. 2000, Mohammad et al. 2004),
primata (Schnorr et al. 2002) dan manusia (Silber et al. 2005).
Berdasarkan hubungan donor dan resipien, transplantasi dapat dilakukan
pada individu yang sama (autotransplantasi); individu yang berbeda tapi masih
satu spesies (allotransplantasi) atau individu yang berbeda dari spesies yang
berbeda (xenotransplantasi). Pada autotransplantasi hampir tidak ada penolakan
jaringan oleh tubuh resipien karena ovarium yang ditransplantasikan merupakan
jaringan individu sendiri. Berdasarkan tempat transplantasi, ovarium dapat
ditransplantasikan di tempat semula (ortotopik) pada bursa ovarium (Candy et al.
2000) dan di tempat lain (heterotopik) diluar bursa ovarium seperti subkutan
(Mohammad et al. 2003, Schnorr et al. 2002), kapsula ginjal (Gook et al. 2001,
Liu et al. 2001) dan intraperitoneal (Rosendahl et al. 2006, Salehnia 2002).
Transplantasi secara ortotopik umum dilakukan jika ingin melihat viabilitas
ovarium sampai dihasilkan keturunan. Pada transplantasi heterotopik meskipun
evaluasi tidak dapat dilakukan sampai dihasilkan keturunan karena tidak
memungkinkan untuk terjadi ovulasi dan fertilisasi secara in vivo, akan tetapi
masih dapat dikoleksi folikel atau oosit dari ovarium transplan dan dapat
dikembangkan secara in vitro.
Daerah kapsula ginjal merupakan salah satu tempat yang sering digunakan
untuk transplantasi heterotopik. Pada daerah kapsula ginjal, besar dan jumlah
potongan jaringan ovarium yang dapat ditransplantasikan terbatas akan tetapi
ovarium pada kapsula ginjal dapat mengembalikan fungsi reproduksi pada hari
ketujuh setelah transplantasi dengan kembalinya siklus estrus, morfologi dan
jumlah folikel (Mohamad 2003).
Hormon gonadotrophin eksogenous umum digunakan pada manusia dan
hewan untuk menginduksi perkembangan folikel sehingga meningkatkan jumlah
oosit yang dapat dipergunakan dalam bidang biologi dan teknologi reproduksi
bantuan (Zudova et al. 2004). Oleh karena itu penyuntikan pregnant mare’s
serum gonadotrophin (PMSG) sebelum pengambilan ovarium transplan
heterotopik dapat mengoptimalkan perolehan oosit untuk digunakan dalam
produksi embrio in vitro. Berdasarkan pengamatan histologis, perlakuan dengan
induksi PMSG terhadap ovarium transplan heterotopik terbukti dapat
meningkatkan jumlah folikel tersier (Setiadi 2004). Namun demikian gambaran
histologis hanya memberikan informasi tentang perkembangan folikel. Untuk
dapat dipergunakan pada produksi embrio in vitro maka harus diketahui viabilitas
oosit yang dapat diperoleh dari ovarium setelah transplantasi. Sehingga diperlukan
kajian lebih lanjut untuk mengetahui pengaruh induksi PMSG terhadap jumlah
dan viabilitas oosit dari ovarium transplan heterotopik. Hal ini akan memberikan
informasi tambahan potensi ovarium sebagai sumber oosit sehingga dapat
digunakan untuk produksi embrio in vitro.
Tujuan Penelitian
Tujuan dari penelitian ini adalah mempelajari kemampuan oosit yang
dikoleksi dari ovarium autotransplantasi heterotopik untuk produksi embrio in
vitro dan mengetahui pengaruh induksi PMSG terhadap peningkatan jumlah oosit
dari ovarium autotransplantasi heterotopik.
Manfaat Penelitian
Hasil dari penelitian diharapkan dapat memberikan informasi mengenai
transplantasi ovarium dan viabilitas oosit yang diperoleh. Sehingga dapat
diaplikasikan untuk mendukung pemanfaatan ovarium bagi pembentukan bank
gamet/embrio serta mendukung salah satu upaya konservasi satwa langka melalui
TINJAUAN PUSTAKA
Perkembangan Folikel dan Oosit
Secara anatomis, organ reproduksi betina terdiri atas sepasang ovarium
dan saluran reproduksi yaitu tuba Falopii, uterus, serviks dan vagina. Ovarium
merupakan organ reproduksi primer dengan ukuran yang bervariasi antara spesies.
Sebagai organ reproduksi primer, ovarium berfungsi untuk menghasilkan oosit
yang berkembang bersama dengan perkembangan folikel. Oleh karena itu folikel
ovarium disebut juga sebagai unit struktural dan fungsional dari ovarium yang
merupakan lingkungan yang penting bagi pertumbuhan dan perkembangan oosit
(Itoh et al. 2002). Selain menghasilkan oosit, ovarium juga menghasilkan hormon
reproduksi seperti estrogen dan progesteron. Ovarium terletak di dalam rongga
pelvis pada ventral ginjal terbungkus dalam suatu bursa ovarium yang transparan,
menggantung dan bertaut melalui mesovarium ke uterus. Berdasarkan dari
gambaran histologis terlihat bahwa ovarium terbagi atas dua bagian yaitu korteks
(bagian lateral) dan medula (bagian medial). Pada korteks ovarium dapat
ditemukan kumpulan folikel dengan berbagai tahapan perkembangan.
Folikel-folikel ini akan berkembang menjadi Folikel-folikel matang dan mengovulasikan oosit
sedangkan pada bagian medula ovarium terdapat pembuluh darah, saraf dan
jaringan ikat (Senger 1999). Bagian korteks dilapisi oleh satu lapisan epitelium
kuboid rendah dan stroma pada bagian korteks terdiri atas jaringan ikat longgar.
Perkembangan folikel di dalam ovarium dikenal dengan nama
folikulogenesis merupakan proses perkembangan folikel yang berawal dari
terbentuknya folikel primordial sampai berkembang menjadi folikel matang dan
siap melakukan proses ovulasi. Folikel primordial akan berkembang menjadi
folikel primer, sekunder, tersier, de Graaf dan pada akhirnya oosit akan
diovulasikan. Proses folikulogenesis ini disertai dengan proses pertumbuhan dan
pematangan oosit yang merupakan bagian dari proses oogonesis yaitu proses yang
menghasilkan oosit yang haploid. Perkembangan folikel pada ovarium
dipengaruhi oleh endokrin dan mekanisme intraovarian yang mengatur proses
pertumbuhan oosit dan proliferasi serta diferensiasi sel somatik (Itoh et al. 2002,
Thomas & Van der Hayden 2006). Perkembangan folikel tergantung pada
folikel dari peristiwa apoptosis. Faktor yang mempengaruhi perkembangan folikel
antara lain gonadotrophin, hormon steroid dan beberapa faktor pertumbuhan
(Quirk et al. 2004). Follicle stimulating hormone (FSH) merupakan
gonadotrophin yang berperan dalam proses proliferasi dan diferensiasi folikel
sedangkan estrogen adalah hormon yang dihasilkan oleh sel granulosa dan sel teka
diketahui berperan dalam pembentukan rongga folikel. Diantara beberapa faktor
pertumbuhan yang berperan dalam perkembangan folikel adalah epidermal
growth factor (EGF), transforming growth factor (TGF), basic fibroblast-like
growth factor (bFGF), vascular epithelial growth factor (VEGF) dan nerve
growth factor (NGF) (Van den Hurk et al. 1997).
Perkembangan folikel berdasarkan morfologinya dapat dibedakan atas
folikel preantral dan folikel antral. Folikel preantral merupakan tahapan folikel
yang belum memiliki antrum sedangkan folikel antral merupakan tahapan folikel
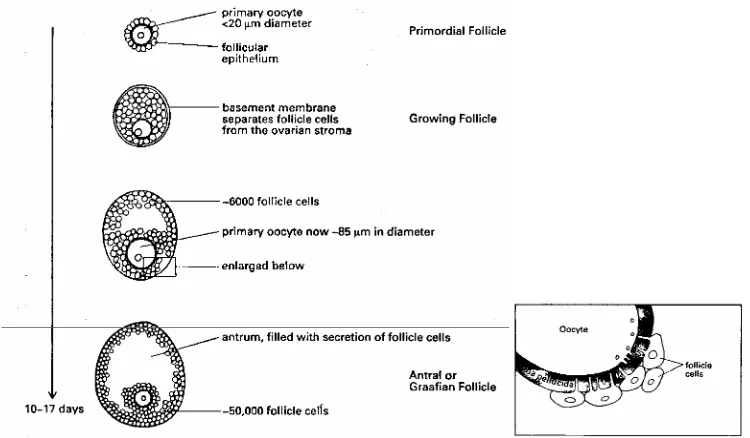
yang telah memiliki antrum. Saat lahir pada korteks ovarium mamalia terdapat
banyak kumpulan folikel primordial dan dapat dipergunakan sebagai sumber
oosit. Folikel primordial yang terdapat pada korteks ovarium memiliki jumlah
yang lebih banyak dibanding folikel antral. Folikel primordial merupakan bentuk
awal dari folikel yang mengandung oosit diselaputi oleh selapis sel somatis
berbentuk pipih. Folikel primordial akan mengalami pertumbuhan menjadi folikel
primer dan sekunder, ketiga bentuk folikel ini digolongkan ke dalam folikel
preantral. Tahap pertama pertumbuhan folikel primordial adalah pembesaran oosit
yang meningkat diameternya menjadi dua sampai tiga kali lipat. Kemudian diikuti
dengan perubahan bentuk lapisan sel-sel granulosa yang mengelilingi oosit dari
bentuk pipih menjadi kuboid dan tahapan folikel ini disebut folikel primer.
Selanjutnya tahapan pembentukan folikel sekunder adalah proliferasi dari sel
kuboid akan membentuk beberapa lapisan sel granulosa dan terbentuk sebuah
membran (zona pelusida) yang mengelilingi oosit. Oosit dan sel granulosa
berperan dalam proses pembentukan zona pelusida yang mengandung
glikoprotein yang berperan pada proses pelekatan spermatozoa pada oosit (Robker
& Richard 1998).
Pada tahapan folikel primordial dan primer, komunikasi antara oosit
banyaknya vesikel dan celah pada oosit (Gambar 1) dan setelah memasuki tahap
folikel sekunder, komunikasi dilakukan melalui gap junction yang terbentuk
diantara oosit dan sel granulosa (Hyttel et al. 1997, Hogan et al. 1994).
Komunikasi diantara sel granulosa dan oosit bertanggung jawab terhadap
perubahan biokimia yang penting bagi potensi perkembangan dan proses meiosis
oosit. Nutrisi dan elemen pengatur yang bertanggung jawab terhadap
pertumbuhan oosit dan mempertahankan istirahat meiosis dan juga substrat untuk
pertumbuhan dan pematangan dilewatkan melalui gap junction (Barnes 2000).
Gambar 1 Perkembangan folikel (Hogan et al. 1994).
Sesudah tahap awal pertumbuhan proliferasi, massa sel granulosa
mensekresi cairan folikular yang mengandung estrogen dalam konsentrasi tinggi.
Penumpukan cairan ini menyebabkan munculnya antrum di dalam massa sel
granulosa, tahap ini disebut folikel tersier (Van den Hurk et al. 1997). Diameter
folikel semakin meningkat akibat adanya proliferasi sel granulosa serta
pembentukan antrum folikuli yang semakin membesar karena produksi cairan
folikuli yang semakin meningkat pula sehingga oosit terdesak ke bagian tepi
folikel. Pertumbuhan folikel pada tahap ini akan tergantung pada hormon
gonadotrophin untuk mencapai folikel de Graaf sehingga oosit dapat diovulasikan
tersier dan de Graaf maka perkembangan folikel tahap ini digolongkan ke dalam
folikel antral.
Proses folikulogenesis disertai dengan proses oogenesis yaitu
pertumbuhan dan perkembangan oosit mencapai pematangan. Pertumbuhan oosit
antara lain peningkatan diameter oosit dan pertambahan ukuran dari
organel-organel. Pertumbuhan oosit disertai dengan perubahan atau perkembangan pada
inti dan sitoplasma. Pada saat lahir, semua oosit primer berada pada fase profase
tahap diploten pembelahan meiosis dan akan tetap bertahan dalam fase ini sampai
mengalami pubertas (Telfer 1996). Diameter oosit pada mencit saat berada dalam
fase profase meiosis I berukuran 20 µm meningkat mencapai diameter 85 µm
pada oosit primer dalam folikel de Graaf (Hogan et al. 1994). Umumnya
perkembangan oosit pada mamalia sampai dengan diovulasikan mengalami dua
fase istirahat yaitu pada tahap profase meiosis I dan tahap metafase II pada
meiosis II (Whitaker 1996). Inti oosit pada folikel berada dalam keadaan istirahat
pada fase G2 atau tahap germinal vesicle (GV) pada pembelahan meiosis I.
Kemudian proses meiosis tersebut akan berlanjut diawali dengan robeknya
membran inti dikenal dengan tahap germinal vesicle breakdown (GVBD), terjadi
kondensasi kromosom inti kemudian oosit memasuki tahap istirahat pada
metafase II dan mengeluarkan polar bodi I (Kidson 2005). Pengeluaran polar bodi
I (Gambar 2) digunakan sebagai ciri atau bukti kematangan inti oosit dan tahapan
ini disebut oosit sekunder (Schramm & Bavister 1999).
Tahap istirahat oosit pada metafase II karena tingginya aktivitas
maturation/m-phase promoting faktor (MPF) yang bertanggung jawab terhadap
kondensasi kromatin, pecahnya membran inti (GVBD) dan pembentukan
kumparan sitoskeleton. Aktivitas MPF tergantung pada interaksi antara protein
cyclin dan P34cdc2 (Alberior et al. 2001, Barnes 2000). Pembelahan meiosis II
yaitu tahapan metafase II akan berlanjut jika ada sperma yang mampu
mempenetrasi dan membuahi oosit (fertilisasi). Selesainya pembelahan meiosis II
ditandai dengan dilepaskan polar bodi II (Moore 1989). Selain perkembangan inti
selama proses perkembangan oosit juga terjadi penambahan kandungan
sitoplasma oosit dengan meningkatnya jumlah organel seperti retikulum
endoplasmik, ribosom, granul kortek, lipid droplet dan komplek golgi serta
akumulasi mRNA (Hyttel et al. 1997, Cha & Chian 1998).
Autotransplantasi Heterotopik Ovarium
Transplantasi ovarium merupakan tindakan pemindahan sebagian atau
seluruh jaringan ovarium ke daerah yang diinginkan. Berdasarkan hubungan
antara donor dan resipien maka transplantasi ovarium dapat dibedakan atas auto-,
allo- dan xenotransplantasi. Autotransplantasi ovarium adalah pemindahan
jaringan ovarium dilakukan pada individu yang sama (Mohammad et al. 2004),
jaringan ovarium yang dipindahkan dari donor ke individu yang berbeda tapi
masih satu spesies disebut allotransplantasi (Waterhouse et al. 2004) sedangkan
pada xenotransplantasi ovarium pemindahan jaringan ovarium dilakukan pada
individu dengan spesies yang berbeda (Kagawa et al. 2005). Berdasarkan tempat
transplantasi, ovarium dapat ditransplantasikan di tempat semula (orthotopic
transplantation) yaitu bursa ovarium (Candy et al. 2000) dan di tempat lain selain
bursa ovarium (heterotopic transplantation) seperti di daerah subkutan
(Mohammad et al. 2003, Schnorr et al. 2002), kapsula ginjal (Gook et al. 2001,
Liu et al. 2001) dan intraperitoneal (Rosendahl et al. 2006, Salehnia 2002).
Masing-masing tempat transplantasi (ortotopik atau heterotopik) memiliki
keuntungan dan keterbatasan. Transplantasi ortotopik memiliki teknik yang sulit
karena harus dilakukan hati-hati agar bursa ovarium tidak rusak. Transplantasi
dihasilkan keturunan akan tetapi teknik transplantasi ini memungkinkan tersisanya
jaringan ovarium asal sehingga menyulitkan evaluasi apakah ovarium yang
berkembang berasal dari jaringan ovarium asal yang tersisa atau ovarium donor
yang ditransplantasikan. Pada transplantasi heterotopik meskipun evaluasi tidak
dapat dilakukan sampai dihasilkan keturunan akan tetapi teknik pengerjaan lebih
mudah dan didapatkan kepastian bahwa ovarium yang berkembang hanya berasal
dari ovarium donor.
Keberhasilan transplantasi ortotopik telah dilaporkan mampu
menghasilkan keturunan melalui perkawinan alamiah (Candy et al. 2000). Pada
transplantasi heterotopik evaluasi tidak dapat dilakukan sampai dihasilkan
keturunan karena tidak memungkinkan untuk terjadi ovulasi dan fertilisasi secara
in vivo. Namun dari beberapa penelitian menunjukkan bahwa pada ovarium hasil
transplantasi heterotopik dapat mengalami perkembangan folikel dan resipien
ovarium transplan mampu mengalami siklus estrus secara normal (Schmidt et al.
2003, Schnorr et al. 2002, Mohamad et al. 2004). Keturunan dari transplantasi
heterotopik telah berhasil diperoleh secara in vitro dengan mengkoleksi oosit dari
ovarium transplan dilanjutkan dengan maturasi, fertilisasi dan kultur in vitro
sampai dihasilkan embrio selanjutnya embrio in vitro ditransfer ke induk resipien
dan menghasilkan keturunan (Liu et al. 2001).
Keberhasilan transplantasi ovarium dapat dipengaruhi oleh lokasi
transplantasi, sistem vaskularisasi, besar potongan jaringan serta umur donor dan
resipien. Ovarium mencit telah berhasil ditransplantasikan dengan berbagai
ukuran mulai dari ovarium fetal sampai ovarium dewasa (Cox et al. 1996,
Waterhouse et al. 2004). Pada ovarium dengan ukuran yang lebih besar seperti
domba (Gosden et al. 1994) dan manusia (Callejo et al. 2001), transplantasi
dilakukan menggunakan potongan kortek ovarium dengan ukuran kecil. Pada
daerah kortek ovarium terdapat banyak kumpulan folikel primordial dan
penggunaan potongan daerah kortek ovarium memungkinkan semakin banyak
folikel primordial yang dapat ditransplantasikan. Lokasi transplantasi di bursa
ovarium atau di daerah lain yang kaya dengan pembuluh darah memungkinkan
keberhasilan transplantasi lebih baik dibanding daerah dengan vaskularisasi
ginjal lebih baik dibandingkan di subkutan karena sistem vaskularisasi ginjal lebih
baik dibanding subkutan, sehingga pemulihan fungsi ovarium lebih cepat.
Superovulasi
Individu betina pada saat dilahirkan memiliki sumber oosit dalam jumlah
banyak yang terdapat pada folikel dikedua ovarium namun yang berkembang dan
dapat diovulasikan hanya beberapa karena sisa folikel yang lain akan mengalami
atresia. Hal ini terjadi karena dalam tahap perkembangan folikel antral terdapat
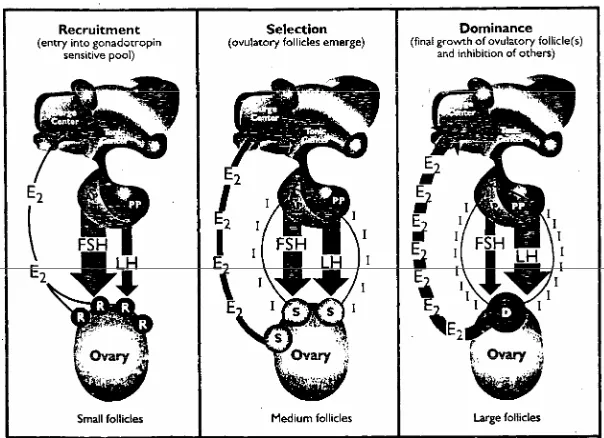
peristiwa rekrutmen, seleksi dan dominan (Savio et al. 1993). Rekrutmen adalah
fase pada pertumbuhan folikel dimana sekelompok folikel antral kecil mulai
tumbuh dan memproduksi estrogen. Setelah melalui rekrutmen, sekelompok
folikel yang sedang tumbuh dan tidak mengalami atresia terseleksi. Folikel yang
terseleksi dapat menjadi dominan atau mengalami atresia. Folikel dominan yang
terseleksi meningkatkan produksi jumlah estrogen dan juga inhibin. Folikel
dominan mengontrol pertumbuhan atau perkembangan folikel lainnya dengan
memproduksi hormon seperti estrogen, inhibin, aktivin dan produk sekresi lainnya
seperti faktor pertumbuhan dan penghambat (Savio et al. 1993, Senger 1999).
Proses perkembangan folikel, ovulasi dan pembentukan corpus luteum
(CL) pada ovarium dipengaruhi oleh sirkulasi hormon reproduksi dalam tubuh.
Gonadotrophin releasing hormone (GnRH) yang dihasilkan oleh hipotalamus
berfungsi untuk merangsang pengeluaran follicle stimulating hormone (FSH) dan
luteinizing hormone (LH) oleh hipofisa anterior sebagai respon terhadap estrogen
atau progesteron. Selama proses pertumbuhan folikel antral kecil atau tahap
rekrutmen, konsentrasi FSH dan LH mulai meningkat sehingga merangsang
perkembangan folikel dan mulai menghasilkan estrogen dan sejumlah kecil
inhibin. Saat memasuki tahap seleksi, konsentrasi inhibin yang diproduksi oleh
folikel mulai meningkat memberikan efek umpan balik negatif terhadap anterior
hipofisa sehingga menghambat pelepasan FSH. Saat ini peranan FSH dan LH
mulai berubah, konsentrasi FSH mulai menurun dan LH meningkat (Gambar 3).
Folikel yang terseleksi dapat menjadi folikel dominan atau mengalami atresia.
LH, folikel berukuran besar atau dominan mulai memproduksi estrogen dalam
jumlah besar.
Gambar 3 Proses rekrutmen, seleksi dan dominan pada ovarium selama perkembangan folikel (Senger 1999).
Konsentrasi FSH berkurang karena hambatan dari inhibin yang bersifat
umpan balik negatif terhadap pelepasan FSH dari hipofisa anterior, hal ini
menyebabkan folikel antral lain mengalami atresia. Dari peristiwa ini
menyebabkan terjadi perkembangan folikel dominan yang bersifat ovulatoris dan
non ovulatoris atau disebut folikel pendamping dan hanya beberapa folikel yang
mampu berkembang menjadi dominan ovulatoris dan menekan folikel
pendamping lainnya (Sunderland et al. 1994). Penekanan pertumbuhan oleh
folikel dominan terhadap folikel pendamping selain karena pengaruh inhibin juga
disebabkan oleh estrogen yang dihasilkan pada folikel dominan akan memberi
respon positif terhadap pembentukan reseptor FSH pada sel granulosa sehingga
meningkatkan rangsangan FSH terhadap folikel dominan (Fortune 1994). Folikel
dominan yang mengandung estrogen dan inhibin dengan konsentrasi tinggi
berhubungan dengan penekanan konsentrasi FSH dalam sirkulasi darah dan
kombinasi antara produksi inhibin oleh folikel dominan serta penurunan
perkembangan folikel (Senger 1999). Penyuntikan hormon pregnant mare’s
serum gonadotrophin (PMSG) yang analog dengan FSH akan mencegah atresi
folikel pendamping yang berukuran besar karena peningkatan konsentrasi FSH
akan meningkatkan jumlah ikatan reseptor FSH pada folikel sehingga merangsang
perkembangan folikel dan meningkatkan jumlah folikel dominan. Apabila
konsentrasi estrogen yang dihasilkan oleh folikel dominan telah mencapai batas
maksimal maka akan memicu lonjakan pengeluaran LH oleh hipofisa anterior
sehingga menyebabkan terjadi ovulasi oosit.
Ovulasi didefinisikan sebagai pelepasan oosit dari folikel dominan dan
panjang waktu ovulasi dapat berbeda-beda diantara hewan tergantung pada siklus
estrusnya. Panjang siklus estrus dan waktu ovulasi dapat dipengaruhi oleh banyak
faktor lingkungan dan dapat pula diinduksi secara buatan dengan penyuntikan
hormon. Untuk meningkatkan jumlah oosit yang akan dikoleksi dapat dilakukan
dengan induksi superovulasi menggunakan PMSG yang memiliki daya kerja
seperti FSH dan human chorionic gonadotropin (hCG) yang memiliki daya kerja
seperti LH. Secara fisiologis hCG tidak berpengaruh terhadap pertumbuhan
folikel tapi berfungsi membantu pecahnya folikel yang matang sehingga terjadi
ovulasi. Induksi superovulasi pada mencit menggunakan PMSG dan hCG
diberikan dengan dosis sebanyak 5 IU/ekor secara intraperitonial (i.p.) dalam
interval waktu 48 jam (Hogan et al. 1994). Efisiensi dari induksi ovulasi
dipengaruhi beberapa faktor seperti perbedaan genetik (Spearow & Barkley 1999)
yaitu strain mencit dan juga respon superovulasi dapat berbeda-beda tergantung
pada spesies, umur dan berat badan (Hogan et al. 1994, Kon et al. 2005).
Pematangan Oosit In Vitro
Pematangan oosit baik secara in vivo atau in vitro meliputi pematangan inti
dan sitoplasma. Proses pematangan inti dan sitoplasma merupakan hal yang
penting bagi oosit untuk mendukung keberhasilan fertilisasi dan perkembangan
embrio (Rodriguez & Farin 2004). Oosit mamalia setelah dilepaskan dari folikel
ovarium dapat melanjutkan pematangan inti secara spontan di dalam medium
kultur secara in vitro. Pematangan oosit secara in vitro dilakukan agar oosit primer
sekunder yang haploid dan mempunyai kemampuan untuk berhasil terfertilisasi
dan mendukung perkembangan embrio selanjutnya (Hyttel et al. 1997).
Proses pematangan inti ditandai dengan perubahan inti dari tahap diploten
profase meiosis I ke metafase II (Whitaker 1996) yang ditunjukkan dengan
kemampuan membran inti melewati germinal vesicle, kondensasi kromosom,
pelepasan polar bodi I dan istirahat pada metafase II. Pada saat diovulasikan oosit
berada pada tahap istirahat metafase II sampai terjadi aktivasi pada oosit untuk
melanjutkan perkembangan. Inisiasi atau awal meiosis pada oosit dikontrol oleh
maturation/m-phase promoting faktor (MPF) yang aktivitasnya meningkat pada
saat germinal vesicle breakdown (GVBD), maksimum pada metafase I dan
menurun pada metafase II (Crozet et al. 2000). Proses pematangan sitoplasma
melibatkan akumulasi mRNA maternal dan perubahan molekuler dan struktural
antara lain peningkatan yang pesat terhadap jumlah dan ukuran organel seperti
ribosom, butir lemak, golgi, mitokondria dan butir korteks sehingga oosit
memiliki kemampuan untuk mendukung proses fertilisasi dan perkembangan
embrio (Ebner et al. 2003). Kedua pematangan ini harus terjadi sehingga oosit
mempunyai kemampuan untuk mendukung perkembangan setelah fertilisasi.
Efisiensi kematangan sitoplasma termasuk kemampuan oosit untuk menghambat
penetrasi sperma lebih dari satu dan juga mendukung dekondensasi kepala sperma
pada ooplasma saat oosit terfertilisasi. Kematangan inti dapat dievaluasi dengan
pewarnaan sederhana seperti aceto orcein sedangkan pematangan sitoplasma
dapat diketahui secara tidak langsung antara lain dari jumlah blastosis yang
dihasilkan, kandungan glutation pada oosit dan persentase pembentukan
pronukleus jantan (Kidson 2005).
Proses pematangan oosit in vivo dapat ditiru secara in vitro dengan
menggunakan medium dan keadaan yang meniru kondisi in vivo. Sistem kultur in
vitro melibatkan beberapa faktor seperti sumber gas CO2, medium sebagai nutrisi,
substrat (wadah) dan suhu. Medium yang digunakan dalam pematangan oosit
dapat memberikan pengaruh bukan hanya pada oosit tapi juga terhadap
perkembangan embrio. Kondisi kultur suboptimal selama pematangan in vitro
akan menyebabkan abnormalitas oosit yang dapat mempengaruhi pre- atau
sumber nutrisi untuk mendukung pematangan oosit dapat berupa medium racikan
sederhana dan medium komersial. Berbagai medium yang umum digunakan untuk
pematangan oosit antara lain tissue culture medium (TCM-199) (Mattioli et al.
1994), potassium simplex optimized medium (KSOM) (Gardner & Lane 2000),
Ham’s F10 (Wu et al. 2001), minimal essential medium (MEM) (Waterhouse et
al. 2004), Charles Rosenkrans (CR1aa) (Yulnawati 2006) dan lain sebagainya.
Untuk menunjang keberhasilan proses pematangan sejumlah penelitian telah
dilakukan dengan menambahkan berbagai macam bahan dalam medium untuk
menciptakan medium yang optimum bagi proses pematangan seperti penambahan
protein, hormon gonadotrophin serta antibiotik. Umumnya medium diberi
tambahan protein seperti fetal calf serum (FCS), fetal bovineserum (FBS), bovine
serum albumine (BSA), follicle stimulating hormone (FSH) dan luteinizing
hormone (LH). Faktor pertumbuhan berperan penting pada pematangan oosit in
vitro seperti penambahan EGF dan TGF mempengaruhi pematangan oosit
(Kobayashi et al. 1994).
Dalam kultur pematangan oosit in vitro selain faktor medium, kualitas
folikel dan oosit juga mempengaruhi tingkat pematangan oosit in vitro.
Keberadaan sel kumulus yang mengelilingi oosit berperan penting untuk
mendukung proses pematangan oosit secara in vitro. Terdapat korelasi positif dari
keberadaan lapisan sel granulosa pada kumulus dan kemampuan perkembangan
embrio (Cobo et al. 1999) karena fungsi sel kumulus menyediakan nutrisi untuk
oosit selama perkembangan folikel. Gonadotrophin berperan untuk menstimuli
proses meiosis pada oosit mamalia dan ekspansi sel kumulus. Ekspansi sel
kumulus merupakan salah satu indikator keberhasilan pematangan oosit secara in
vitro dan menjadi kriteria pemilihan oosit yang akan digunakan dalam proses
fertilisasi in vitro.
Fertilisasi In Vitro
Fertilisasi merupakan proses yang penting dalam kehidupan makhluk
hidup. Proses fertilisasi menandakan dimulainya kehidupan organisme baru
dengan terjadinya penggabungan informasi genetik jantan dan betina melalui
penggabungan informasi genetik jantan dan betina saja, akan tetapi dalam proses
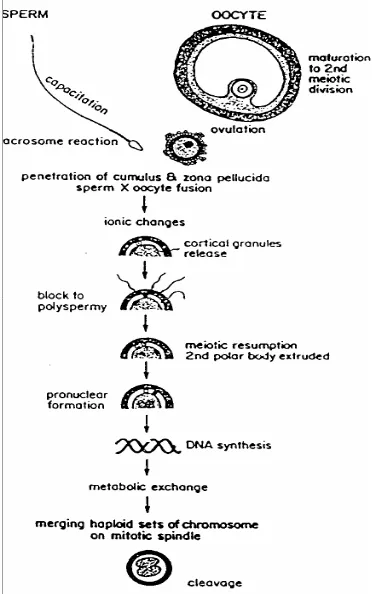
ini melibatkan banyak hal yang sangat komplek. Proses yang terkait dalam
fertilisasi (Gambar 4) antara lain kapasitasi, reaksi akrosom, pengikatan sperma
dengan oosit, penetrasi sperma ke zona pelusida pada oosit, peleburan antara
membran sperma dan oosit, pencegahan polispermia dan diakhiri dengan
peleburan pronukleus sperma dan oosit (Tulsiani et al. 1997).
Gambar 4 Interaksi oosit-sperma dalam proses fertilisasi (Hafez & Hafez 2000).
Secara in vivo fertilisasi terjadi di tuba Falopii saluran kelamin betina
sedangkan proses fertilisasi secara in vitro dapat dilakukan pada medium yang
dikondisikan. Hambatan dalam teknik fertilisasi in vitro adalah kondisi yang tidak
sesuai dengan in vivo sehingga harus diatasi dengan menggunakan medium yang
sesuai dengan kondisi in vivo. Dalam proses fertilisasi secara in vitro, sumber
oosit dapat berasal dari induk betina yang mengalami ovulasi atau superovulasi
atau dari folikel preantral dan antral setelah melalui tahapan kultur in vitro untuk
untuk fertilisasi in vitro dapat berasal dari epididimis atau sperma ejakulat. Agar
sperma mampu melakukan fertilisasi dengan oosit, sperma harus mengalami
serangkaian perubahan yaitu pematangan dan kapasitasi. Sperma mengalami
pematangan selama berada di epididimis sebelum diejakulasikan. Perubahan yang
terjadi pada sperma selama pematangan antara lain penghilangan sisa sitoplasma
(cytoplasmic droplet), perubahan permukaan plasma membran dan memperoleh
kemampuan motilitas. Setelah mengalami pematangan, sperma masih belum siap
untuk membuahi oosit. Sperma harus melalui tahap kapasitasi agar mempunyai
kemampuan untuk penetrasi ke dalam oosit (Garner & Hafez 2000).
Kapasitasi secara in vivo terjadi pada saluran kelamin betina dan proses
kapasitasi dapat dilakukan secara in vitro dengan inkubasi di dalam suatu medium
tertentu. Awal mula proses kapasitasi in vitro dilakukan menggunakan cairan
oviduk, cairan folikel atau serum darah namun kemajuan dan kemudahan
kapasitasi in vitro dapat dilakukan atau berhasil dilakukan menggunakan
chemically defined medium (Yanagimachi 1988) yang mengandung bovine serum
albumine (BSA) dan sumber energi seperti glukosa dan piruvat (Tulsiani et al.
1997). Medium kapasitasi dan fertilisasi in vitro yang telah digunakan antara lain
seperti KSOM (Summers et al. 2000), Whittingham’s medium (Bagis et al. 2001),
Tyrode’s medium (Waterhouse et al. 2004) pada mencit, Ham’s F10 medium pada
manusia (Wu et al. 2001), CR1aa pada domba (Yulnawati 2006) dan lain
sebagainya. Penambahan suplemen seperti kafein atau heparin dalam medium
kapasitasi dapat meningkatkan kemampuan kapasitasi sperma (Tatham 2000,
O’Flaherty et al. 2006).
Dalam proses kapasitasi terjadi perubahan pada sperma antara lain
perubahan pergerakan sperma menjadi lebih aktif (hiperaktivasi), perubahan
permeabilitas membran sperma, perubahan konsentrasi ion intraseluler, perubahan
akrosom dan perubahan membran plasma (Yanagimachi 1988). Perubahan
permeabilitas membran menyebabkan ion–ion kalsium (Ca2+) ekstraseluler dapat
masuk dan menyebabkan peningkatan kalsium intraseluler. Disamping
peningkatan Ca2+ juga terjadi perubahan konsentrasi kalium (K+) dan natrium
(Na+) intraseluler. Kalsium merupakan komponen yang penting dalam proses
bertanggung jawab terhadap sistem adenylate cyclase-cyclic AMP sehingga
meningkatkan konsentrasi cAMP. Kalsium juga terlibat dalam aktivasi perubahan
proakrosin menjadi akrosin pada reaksi akrosom. Peningkatan konsentrasi Ca2+
intraseluler merupakan hal yang penting dalam fusi atau peleburan membran
antara sperma dengan oosit dan hal ini berhubungan dengan reaksi akrosom
(Fraser 1982).
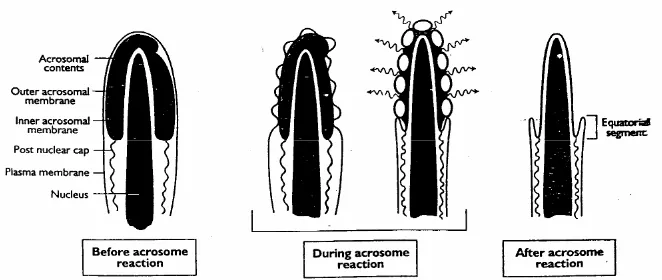
Setelah proses kapasitasi, sperma dapat melakukan eksositosis akrosom
(reaksi akrosom) dengan tujuan agar dapat menembus zona pelusida serta
melakukan peleburan dengan plasma membran oosit. Reaksi akrosom adalah
proses yang ditandai dengan peleburan membran luar akrosom dengan plasma
membran sperma. Peleburan ini menyebabkan pelepasan isi akrosom dan
membukanya membran dalam akrosom (Brown et al. 2002). Peleburan antara
kedua membran ini disebut proses vesikulasi dengan terbentuknya banyak vesikel
kecil (Gambar 5). Adanya proses vesikulasi membran akrosom menandakan
terjadinya reaksi akrosom (Senger 1999). Selanjutnya setelah reaksi akrosom,
terjadi interaksi baru antara membran dalam akrosom dengan zona pelusida.
Pelepasan enzim akrosom (termasuk hialuronidase dan akrosin) bersama dengan
motilitas sperma yang hiperaktif memungkinkan penetrasi sperma melalui zona
diikuti pelekatan sperma pada oolema (plasma membran oosit).
Gambar 5 Perubahan pada sperma selama reaksi akrosom (Senger 1999).
Selama penetrasi sperma ke dalam oosit, peningkatan konsentrasi Ca2+
intraseluler mengakibatkan peleburan kortikal granul dengan lapisan terluar
distribusi kortikal granul setelah penetrasi sperma in vitro dapat mempengaruhi
pembentukan lapisan kortikal granul dan menyebabkan tidak efektifnya
penahanan terhadap polispermi (Kim et al. 1996). Penetrasi sperma ke dalam oosit
akan menyebabkan penyelesaian pembelahan meiosis II yang ditandai dengan
terbentuknya polar bodi II. Selanjutnya kromosom oosit akan membentuk
pronukleus betina dan kepala sperma akan mengalami dekondensasi dan
kemudian membentuk pronukleus jantan. Perangsangan oleh sperma pada oosit
matang akan menyebabkan peningkatan kalsium intraseluler sehingga
menurunkan aktifitas maturation/m-phase promoting faktor (MPF) dan
mitogen-activated protein (MAP) kinase. Inaktifasi dari MPF dan MAP kinase saat
fertilisasi berhubungan dengan pelepasan polar bodi II dan pembentukan
pronukleus (Kikuchi et al. 2000).
Kondisi pematangan oosit, ekspansi sel kumulus dan sistem kapasitasi
sperma in vitro yang kurang memadai bertanggung jawab terhadap penundaan dan
rendahnya angka penetrasi. Pematangan sitoplasma melibatkan sejumlah
modifikasi struktur dan metabolik yang dipersiapkan untuk rangkaian fertilisasi
(Ebner et al. 2003). Keberhasilan fertilisasi in vitro dari oosit yang berasal dari
pematangan in vitro tergantung pada metode dan kondisi kultur pematangan.
Kondisi kultur pematangan mempengaruhi faktor sitoplasmik yang
mempengaruhi kemampuan oosit untuk melalui fertilisasi dan berhasilnya
embriogenesis (Cobo et al. 1999).
Perkembangan Embrio In Vitro
Oosit yang dihasilkan melalui proses pematangan dan fertilisasi in vitro
telah berhasil dikembangkan secara in vitro menjadi embrio di dalam medium
kultur seperti KSOM (Liu et al. 2001), TCM-199 (Laurincik et al. 1994), CR1aa
(Yulnawati 2006), synthetic oviduct fluid (SOF) (Krisher et al. 1999) atau medium
dengan komposisi bahan kimia tertentu (chemically defined medium) (Erbach et
al. 1994, Yoshioka et al. 2002) dan lain sebagainya. Metode kultur embrio secara
in vitro sangat mempengaruhi keberhasilan perkembangan embrio lebih lanjut dan
proses implantasi pada resipien (Petters 1992). Hambatan dalam produksi embrio
Hambatan ini sering terjadi pada tahap awal perkembangan embrio atau tahap
embrio preimplantasi. Pada embrio tikus dan mencit, hambatan perkembangan
terjadi pada tahap dua sel sedangkan embrio sapi dan domba mengalami hambatan
perkembangan pada tahap delapan sel.
Usaha yang telah dilakukan untuk mengatasi hambatan perkembangan
pada embrio antara lain penggunaan sistem ko-kultur dengan sel-sel somatis
seperti monolayer sel-sel kumulus (Malekshah & Moghaddam 2005), sel-sel
epitel tuba Falopii (Hendri 1997) atau penggunaan chemically defined medium
yang diberi tambahan asam amino (Booth et al. 2005) dan bahan-bahan growth
factor tertentu. Menurut Gordon (1994) terdapat beberapa faktor yang
mempengaruhi keberhasilan perkembangan embrio in vitro seperti jenis medium
yang digunakan, penambahan serum, substrat energi, sistem inkubasi (suhu, fase
gas, pH, osmolalitas medium, kualitas air), penggunaan ko-kultur sel epitel tuba
Falopii dan sel kumulus.
Medium kultur yang digunakan dapat mempengaruhi metabolisme dari
embrio yang dihasilkan (Krisher et al. 1999). Pada beberapa penelitian terhadap
perkembangan embrio, hambatan perkembangan embrio in vitro tergantung pada
substrat energi seperti tahap awal pembelahan pada embrio babi dipengaruhi oleh
piruvat dan pada mencit atau hamster dipengaruhi oleh glukosa (Kiernan et al.
1991). Selama perkembangan awal embrio preimplantasi, glukosa berada dalam
jumlah yang rendah pada embrio mencit dan manusia. Setelah aktifasi genom
embrio pada tahap 2-4 sel pada mencit dan 4-8 sel pada manusia, terdapat
penurunan piruvat pada mencit tapi tidak pada manusia dan lonjakan glukosa pada
keduanya (Conaghan et al. 1993). Gangguan metabolisme embrio, kemampuan
kapasitasi, kemampuan signaling dan perkembangan maternal berhubungan
dengan lingkungan yang suboptimal baik secara in vivo atau in vitro yang akan
mengaktifkan kondisi stres atau tekanan hal ini akan merangsang embrio untuk
mempertahankan keseimbangan homeostatik (Fleming et al. 2004).
Perkembangan tahap awal embrio tergantung pada lingkungan mikro
pematangan oosit (Kidson 2005). Ketika proses pematangan oosit in vitro tidak
memberikan lingkungan yang cocok bagi oosit, walaupun dapat terbentuk
rendahnya nilai kualitas blastosis/embrio yang dihasilkan (Lucidi et al. 2003).
Tidak cukup proses pematangan sitoplasma pada oosit akan mempengaruhi
perpindahan atau pertukaran kontrol perkembangan maternal ke embrio dan
menghasilkan perkembangan yang salah (Vassena et al. 2003). Menurut Laurincik
et al. (2000) tahap pembelahan 1-3 sel tergantung pada maternal genom dan lebih
dari 3 sel akan tergantung pada embrionik genom, tahapan ini merupakan keadaan
MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Desember 2005 sampai dengan
November 2006. Tempat pelaksanaan penelitian adalah di Laboratorium
Embriologi Departemen Anatomi, Fisiologi dan Farmakologi. Pemeliharaan
hewan percobaan dilakukan di Unit Pelaksana Teknis (UPT) Hewan
Laboratorium, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Materi Penelitian
Materi penelitian yang digunakan adalah mencit (Mus musculus albinus)
betina strain DDY yang biasa dipakai dalam penelitian bidang reproduksi karena
merupakan mencit fertil (high ovulator). Umur mencit yang digunakan empat
minggu dan belum mencapai umur dewasa kelamin (prapubertas). Mencit
dipelihara dalam kandang plastik yang diberi alas sekam dan dilengkapi dengan
penutup kawat. Pakan dan air minum diberikan ad libitum.
Rancangan Percobaan
Penelitian ini menggunakan rancangan acak lengkap (RAL) dengan tiga
perlakuan yaitu (1) oosit hasil ovarium transplan (OT); (2) oosit hasil ovarium
transplan dan induksi PMSG (OTP); (3) oosit hasil superovulasi in vivo (OSO)
tanpa transplantasi ovarium. Ovarium dari setiap mencit pada perlakuan
transplantasi dikoleksi dengan cara ovariektomi dan dibelah menjadi dua bagian
yang sama besar. Potongan ovarium kemudian ditransplantasi ke kapsula ginjal.
Pada hari ke-19 transplantasi, mencit pada perlakuan OTP diinduksi dengan 5
IU/ekor PMSG intraperitoneal (i.p.). Pada hari ke-21 dilakukan pengkoleksian
oosit dari ovarium transplan dan dikultur untuk mengetahui tingkat pematangan,
fertilisasi dan perkembangan embrio secara in vitro. Pada perlakuan kontrol tanpa
transplantasi (OSO) dilakukan induksi PMSG dan hCG masing-masing dengan
dosis 5 IU/ekor dengan interval waktu 48 jam. Setelah induksi hCG, 14 jam
kemudian oosit yang matang in vivo dikoleksi dengan menoreh ampula tuba
Metode Penelitian Koleksi Ovarium
Pengambilan ovarium atau ovariektomi dilakukan menurut metoda yang
telah dilaporkan oleh Mohammad et al. (2004) yaitu melalui bedah punggung.
Sebelum pembedahan, mencit dibius dengan xylazine sebanyak 0.3 mg/ekor
intraperitoneal (i.p.) dikombinasi dengan ketamine sebanyak 1.5 mg/ekor
intramuscular (i.m.). Setelah mencit terbius, kulit daerah punggung dibersihkan
dengan alkohol 70% dan rambut di daerah orientasi pembedahan dicukur sampai
bersih. Kemudian kulit punggung di daerah orientasi pembedahan disayat
sepanjang 1-1.5 cm secara horizontal sejajar dengan tulang punggung. Kulit
jaringan subkutan dikuakkan dan daerah abdomen disayat dengan orientasi tepat
di atas ginjal karena akan dilakukan transplantasi pada kapsula ginjal. Ovarium
diambil dan dipisahkan dari bursa ovarium dengan bantuan pinset. Selanjutnya
ovarium dicuci dalam medium phosphate buffered saline (PBS) dan dibelah
menjadi dua bagian yang sama besar.
Autotransplantasi Ovarium Heterotopik
Autotransplantasi ovarium mencit dilakukan di kapsula ginjal berdasarkan
metode yang telah dilaporkan oleh Mohammad et al. (2004). Ginjal dikeluarkan
dari ruang abdomen dengan cara menekan daerah perut dari arah ventral ke atas.
Selanjutnya dengan menggunakan pinset berujung runcing, kapsula ginjal ditusuk
tanpa melukai korteks ginjal dan diperlebar sebesar ovarium yang akan
ditransplantasikan. Ovarium dimasukkan ke dalam kapsula ginjal dengan hati-hati
dan didorong menjauhi daerah sayatan. Ginjal dimasukkan kembali ke dalam
ruang abdomen. Abdomen dan kulit punggung dijahit dan diberi antibiotik
neomycin sulfate (Nebacetin) untuk persembuhan.
Koleksi Oosit dari Ovarium Transplan Heterotopik
Setelah mengalami proses transplantasi, mencit dibiarkan pulih selama
beberapa hari. Pada hari ke-19 setelah transplantasi, mencit perlakuan OTP
disuntik dengan 5 IU PMSG per ekor secara intraperitoneal(i.p.). Pada hari ke-21
dengan cara dislocatio cervicalis kemudian ginjal diambil dan ovarium dari
kapsula ginjal dipindahkan ke medium PBS. Isolasi oosit dari folikel ovarium
dilakukan dibawah mikroskop stereo secara mekanik dengan cara menoreh folikel
antral pada ovarium menggunakan jarum berukuran 27 G yang dihubungkan
dengan spuit 1 cc. Oosit dikeluarkan dari folikel kemudian dicuci tiga kali
berturut-turut dalam PBS dan dua kali di dalam medium kultur yang akan
digunakan. Oosit yang digunakan untuk tahap selanjutnya adalah oosit yang
dilapisi oleh sel-sel kumulus. Untuk perlakuan kontrol tanpa transplantasi (OSO),
mencit diinjeksi PMSG dan hCG masing-masing 5 IU/ekor dengan interval 48
jam. Koleksi oosit dari tuba Falopii dilakukan dengan menoreh ampula tuba
Falopii.
Pematangan Oosit In Vitro
Oosit yang berasal dari mencit pada perlakuan OT dan OTP yang
digunakan dalam pematangan in vitro hanya oosit yang dikelilingi oleh sel-sel
kumulus kompak. Selanjutnya setelah pencucian dalam PBS dan medium kultur,
oosit yang dikoleksi dari mencit pada perlakuan OT dan OTP dimatangkan dalam
20 µl medium tetes kalium simplex optimized medium (KSOM) yang telah
ditambah dengan follicle stimulating hormone (FSH) 10 µg/ml, gentamycin
sulphate 50 µg/ml, BSA 2% (w/v) dan ditutup dengan mineral oil. Pematangan
oosit dilakukan dalam inkubator CO2 5% pada suhu 37 ºC selama 24 jam.
Fertilisasi Oosit In Vitro
Sperma yang digunakan berasal dari vas deferen mencit jantan dewasa dari
strain yang sama. Preparasi sperma dilakukan dalam medium KSOM yang telah
ditambah dengan BSA 2% (w/v), kafein 2.5 mM dan gentamycin sulphate 50
µg/ml. Suspensi sperma 10 µl ditambahkan ke dalam 90 µl medium drop KSOM
fertilisasi dan diinkubasi dalam inkubator CO2 5% pada suhu 37 ºC selama 30
menit untuk proses kapasitasi. Oosit yang telah mengalami pematangan in vitro
dan in vivo dicuci dua kali dalam medium fertilisasi dan digabungkan ke dalam
100 µl drop medium fertilisasi (konsentrasi sperma 2x106/ml) kemudian
Perkembangan Embrio In Vitro
Oosit yang telah terfertilisasi in vitro dicuci dan dipindahkan ke dalam
medium drop KSOM 20 µl yang telah ditambah dengan BSA 3% (w/v),
gentamycin sulphate 50 µg/ml dan ditutup dengan mineral oil. Kemudian dikultur
dalam inkubator CO2 5% pada suhu 37 ºC untuk melihat perkembangan embrio.
Evaluasi Data
Jumlah dan kualitas oosit yang diperoleh dari ovarium transplan
heterotopik setelah isolasi secara mekanik dari folikel antral diamati dengan
mikroskop inverted. Evaluasi dilakukan terhadap pematangan inti oosit yang telah
mengalami pematangan in vitro. Oosit yang telah matang adalah oosit pada tahap
metafase II (Mt-II) yang ditandai dengan terbentuknya polar bodi I. Untuk
mengetahui tingkat pematangan oosit dilakukan penghitungan terhadap jumlah
oosit yang mencapai tahap Mt-II per jumlah oosit yang dikultur. Selanjutnya
dilakukan fertilisasi in vitro pada oosit yang telah matang in vitro dan in vivo.
Pengamatan terhadap keberhasilan fertilisasi in vitro ditandai dengan
terbentuknya pronukleus jantan dan betina. Tingkat fertilisasi dihitung dari jumlah
oosit yang terfertilisasi per jumlah oosit yang diinseminasi. Hasil fertilisasi in
vitro dikultur untuk mengetahui perkembangan embrio. Tingkat perkembangan
embrio in vitro diperoleh dengan menghitung jumlah embrio yang berhasil
membelah dibandingkan dengan jumlah yang dikultur.
Analisis Data
Data yang diperoleh dari hasil penelitian dianalisis dengan sidik ragam
menggunakan general linear model procedure (GLM). Perbedaan antar perlakuan