ABSTRACT
BIODEGRADATION OF CELLULOSE IN SOLID STATE FERMENTATION PRE-TREATED RICE STRAW BY
ACTINOMYCETES AcP-1 AND AcP-7 ISOLATE
By
Ahmad Ruzki
Cellulose is primary component of plant cells wall, in which in rice straw the content of reach 34% repectively. Efforts to increase the economic value of rice straw is done by converting the polymer into simple sugars that could be utilized as a transition in the field of biotechnology products. This study was conducted to optimize rice straw pre-treated hydrolysis process and to characterize reducing sugar content that release in process. Two condition in fermentation has been set up, each time of incubation and different pH, to obtain optimum condition fermentation by two isolate actinomycetes AcP-1 and AcP-7. Result of this treatment show that optimum condition were reached at 12nd day fermentation in pH 7,5. Some of chemical parameter which are used as guide to obtain the optimum fermentation condition have reached the peak at this condition. Fermentation by actinomycetes AcP-1 isolat has optimum performance on decreasing of cellulose content was 10,595%, and cellulase activity was 1,164 U mL-1 respectively. On the other hand, fermentation by actinomycetes AcP-7 isolat has optimum performance on decreasing of cellulose content was 10,580%, and cellulase activity was 0,997 U mL-1 respectively. Reducing sugar which analyzed by DNS method shows that hydrolysis by AcP-1 isolate release reducing sugar at15,134 mg mL-1, and AcP-7 isolate at 14,803 mg mL-1. In addition, retention time of glucose from both of fermentation filtrates was slighty different. Chromatogram from HPLC analyze shows for AcP-1 filtrate the retention time peak at 8,911 minute, however AcP-7 filtrate at 8,911.
ABSTRAK
BIO-DEGRADASI SELULOSA HASIL BIO-PRETREATMENT JERAMI PADI SECARA FERMENTASI PADAT MENGGUNAKAN ISOLAT
ACTINOMYCETES AcP-1 DAN AcP-7
Oleh
Ahmad Ruzki
Selulosa merupakan komponen utama penyusun dinding sel tanaman. Seperti pada limbah jerami padi, diketahui kandungan selulosa mencapai 34,2% berat kering. Upaya peningkatan nilai ekonomis dari jerami padi banyak dilakukan antara lain memanfaatkanya sebagai sumber gula pereduksi yang dapat digunakan sebagai transisi produk senyawa kimia lainnya seperti etanol, asam sitrat, asam asetat dan produk fermentasi lainnya. Penelitian dilakukan untuk mengetahui adanya gula pereduksi yang dihasilkan dari substrat jerami padi hasil bio-pretreatment yaitu dengan mendegradasi kandungan. Dua perlakuan diberikan masing-masing waktu fermentasi dan variasi pH dengan perbandingan substrat:buffer (1:3) untuk memperoleh kondisi optimum dengan melihat beberapa parameter kimia sebagai indikator. Dua isolat Actinomycetes AcP-1 dan AcP-7, yang digunakan masing-masing sebagai agen biologi menunjukkan waktu optimum yang sama yaitu pada hari ke-12 dan pada pH 7,5. Kesimpulan ini diambil dari parameter kimia yang menunjukkan nilai optimum pada waktu dan pH parameter yang diujikan. Hasil pengukuran beberapa parameter kimia pada kondisi fermentasi optimum oleh isolat AcP-1 untuk kandungan selulosa pada substrat menurun 10,595 % dan aktivitas enzim selulase optimum sebesar 1,164 U/mL. Sedangkan hasil pengukuran beberapa parameter kimia oleh isolat AcP-7 untuk kandungan selulosa pada substrat menurun 10,580 %, aktivitas selulase optimum sebesar 0,997 U/mL. Berdasarkan kondisi optimum yang diperoleh produk fermentasi dianalisis dengan metode DNS dan KCKT. Hasil analisis gula pereduksi total dilakukan dengan metode DNS oleh isolat AcP-1 sebesar 15,134 mg/mL dan oleh isolat AcP-7 sebesar 14,803 mg/mL. Sementara dengan metode KCKT diperoleh glukosa pada waktu retensi 8,911 menit untuk isolat AcP-1 dan 8,904 menit untuk isolat AcP-7.
DAFTAR ISI
H. Kromatografi Cair Kinerja Tinggi (KCKT) atau High Performance Liquid Chromatography (HPLC) ... 21
III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian ... 25
C. Prosedur Penelitian ... 26
1. Pembuatan Inokulum ... 26
2. Optimasi Fermentasi Substrat Jerami ... 26
3. Pengukuran Parameter Fermentasi Fase Padat ... 27
3.1 Pengukuran Kadar Selulosa ... 27
3.2 Pengukuran Aktivitas Enzim Selulase ... 28
4. Pengukuran Gula Pereduksi Total dengan Metode DNS ... 29
4.1 Pengukuran Gula Pereduksi Total dengan Metode DNS . 29 4.2 Pengukuran Produk Fermentasi dengan KCKT ... 29
5. Pembuatan Media ... 30
B. Pengukuran Parameter Fermentasi Fase Padat ... 35
a. Pengukuran Kadar Selulosa ... 35
b. Pengukuran Aktivitas Enzim Selulase ... 38
C. Pengukuran Hasil Produk Fermentasi ... 41
1. Pengukuran Gula Pereduksi Total dengan Metode DNS ... 41
2. Pengukuran Produk Fermentasi dengan Metode KCKT ... 44
V. SIMPULAN DAN SARAN A. Simpulan ... 47
B. Saran ... 48
DAFTAR PUSTAKA ... 49
I. PENDAHULUAN
A. Latar Belakang
Selulosa merupakan komponen utama penyusun dinding sel tanaman.
Keberadaan selulosa biasa ditemukan pada limbah pertanian seperti jerami padi,
jerami jagung, jerami gandum, jerami tongkol, tandan kosong kelapa sawit dan
bagase tebu. Seperti pada limbah jerami padi, diketahui kandungan selulosa
mencapai 34,2% berat kering (Wyman et al., 2002). Selulosa berpotensi tinggi
untuk didegradasi menjadi produk akhir yang berguna seperti glukosa dan
gluko-oligosakarida.
Secara kimia selulosa merupakan senyawa polimer glukosa yang tersusun dari
unit-unit β-1,4-glukosa yang dihubungkan dengan ikatan β–1,4-D-glikosida (Han
et al., 1995). Ikatan ini dapat didegradasi dengan baik secara Fermentasi Fase Padat (Solid State Fermentation/SSF) dan hidrolisis enzim dengan menggunakan enzim selulase.
Enzim selulase merupakan kelompok enzim yang diproduksi mikroorganisme dalam degradasi selulosa. Enzim ini berperan dalam hidrolisis selulosa dengan
memecah ikatan β-1,4-D-glikosida untuk menghasilkan oligosakarida maupun
menjadi komponen gula sederhana, seperti glukosa (Onsori, Zamani, Mottalebi., 2005).
Enzim selulase dapat dihasilkan dari beberapa genus bakteri pendegradasi selulosa salah satunya adalah Actinomycetes. Beberapa spesies Actinomycetes yang diketahui memiliki kemampuan untuk mendegradasi selulosa adalah Streptomyces sp. AT7 (Al-Tai et al., 1989), Streptomycesviridosporus (Pasti et al., 1990),
Microbispora bispora (Waldron et al., 1986), Streptomycesmurinus (Howard et al., 2003), Thermomonas sp. (George, 2001), Micromonospora chalcea,
Streptomycesroselflavus dan Nacardiodes fulvus (Abdulla & El-Shatoury, 2006).
Untuk memproduksi enzim selulase dapat dilakukan dengan menggunakan metode Fermentasi Fase Padat (Solid State Fermentation/SSF) yang merupakan proses fermentasi yang melibatkan zat padat dalam suatu fasa cair (Moo-Young et al., 1983). Proses SSF sebenarnya hampir sama dengan proses hidrolisis dan proses fermentasi, tetapi proses hidrolisis dan fermentasi pada SSF dilakukan dalam satu tempat. Proses SSF membutuhkan bahan mentah alami sebagai sumber karbon. Untuk proses fermentasi ini dapat dilihat berdasarkan
karakteristik (pH, perbandingan substrat: buffer dan waktu inkubasi), aktifitas enzim selulase ditentukan berdasarkan pada glukosa dengan metode kolonimetri DNS (Adney dan Baker, 2008).
Berdasarkan uraian di atas maka pada penelitian ini telah dilakukan biodegradasi
melakukan pengukuran beberapa parameter meliputi pengukuran APPL, kadar
selulosa aktivitas enzim selulase dan kandungan gula pereduksi selama proses
fermentasi jerami padi oleh isolat Actinomycetes AcP-1dan AcP-7.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Mendapatkan kondisi fermentasi optimum dalam biodegradasi selulosa jerami
padi secara Fermentasi Fase Padat (Solid State Fermentation/SSF) oleh isolat
Actinomycetes AcP-1dan AcP-7.
2. Mengkarakterisasi beberapa parameter dalam biodegradasi selulosa seperti
kadar selulosa, aktivitas enzim selulase dan kandungan gula pereduksi hasil
biodegradasi jerami padi oleh isolat Actinomycetes AcP-1dan AcP-7.
3. Menganalisis produk biodegradasi optimum jerami padimenggunakan
Kromatografi Cair Kinerja Tinggi (KCKT).
C. Manfaat Penelitian
Penelitian ini diharapkan mampu memberikan informasi tentang karakteristik
degradasi lignoselulosa pada umumnya dan optimasi biodegradasi selulosa jerami
padi secara Fermentasi Fase Padat (Solid State Fermentation/SSF) menggunakan
isolat Actinomycetes AcP-1 dan AcP-7. Gula pereduksi hasil fermentasi
alkohol, asam sitrat, asam glutamat dan lainnya, sehingga mampu meningkatkan
II. TINJAUAN PUSTAKA
A. Selulosa
Selulosa merupakan komponen utama penyusun dinding sel tanaman. Kandungan
selulosa pada dinding sel tanaman tingkat tinggi sekitar 35-50% dari berat kering
tanaman (Saha, 2004). Selulosa merupakan polimer glukosa dengan ikatan β-1,4 glukosida dalam rantai lurus. Bangun dasar selulosa berupa suatu selobiosa yaitu
dimer dari glukosa. Rantai panjang selulosa terhubung secara bersama melalui
ikatan hidrogen dan gaya van der Waals (Perez et al. 2002).
Selulosa mengandung sekitar 50-90% bagian berkristal dan sisanya bagian amorf
(Aziz et al., 2002). Selulosa hampir tidak pernah ditemui dalam keadaan murni di
alam, melainkan selalu berikatan dengan bahan lain seperti lignin dan
hemiselulosa. Selulosa terdapat dalam tumbuhan sebagai bahan pembentuk
dinding sel dan serat tumbuhan. Molekul selulosa merupakan mikrofibil dari
glukosa yang terikat satu dengan lainnya membentuk rantai polimer yang sangat
panjang. Adanya lignin serta hemiselulosa di sekeliling selulosa merupakan
hambatan utama untuk menghidrolisis selulosa (Sjostrom, 1995).
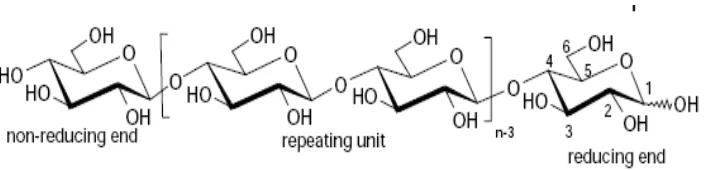
Selulosa merupakan polisakarida yang terdiri atas satuan-satuan dan mempunyai
Rumus molekul selulosa adalah (C6H10O5)n. Selulosa merupakan komponen
utama penyusun dinding sel tanaman yaitu senyawa polimer glukosa yang
tersusun dari nit-unit β-1,4-glukosa yang dihubungkan dengan ikatan β -1,4-D-glikosida (Han et al., 1995).
Gambar 1. Struktur Kimia Selulosa (Sixta, 2006).
Ikatan β-1,4 glukosida pada serat selulosa dapat dipecah menjadi monomer glukosa dengan cara hidrolisis asam atau enzimatis. Kesempurnaan pemecahan
selulosa pada saluran pencernaan ternak tergantung pada ketersediaan enzim
pemecah selulosa yaitu selulase. Saluran pencernaan manusia dan ternak non
ruminansia tidak mempunyai enzim yang mampu memecah ikatan β-1,4 glukosida
sehingga tidak dapat memanfaatkan selulosa. Ternak ruminansia dengan bantuan
enzim yang dihasilkan mikroba rumen dapat memanfaatkan selulosa sebagai
sumber energi. Pencernaan selulosa dalam sel merupakan proses yang kompleks
yang meliputi penempelan sel mikroba pada selulosa, hidrolisis selulosa dan
fermentasi yang menghasilkan asam lemak.
Hidrolisis sempurna selulosa akan menghasilkan monomer selulosa yaitu glukosa,
sedangkan hidrolisis tidak sempurna akan menghasilkan disakarida dari selulosa
yaitu selobiosa (Fan dkk, 1982). Selulosa dapat dihidrolisis menjadi glukosa
Selanjutnya glukosa yang dihasilkan dapat difermentasi menjadi menjadi produk
fermentasi yang nantinya dapat diolah lagi menjadi etanol.
B. Enzim
Enzim merupakan protein sel hidup yang berperan sebagai biokatalisator dalam
proses biokimia, baik yang terjadi di dalam sel maupun di-luar sel. Enzim
merupakan katalisator sejati yang dapat meningkatkan kecepatan reaksi kimia
spesifik dengan nyata, suatu reaksi kimia akan berlangsung sangat lambat tanpa
adanya enzim. Enzim tidak mampu mengubah titik keseimbangan dari reaksi
yang dikatalisisnya dan enzim juga tidak akan habis dipakai atau diubah secara
permanen oleh reaksi-reaksi tersebut (Lehninger, 1982).
Menurut Poedjiadi (1994), enzim merupakan protein dengan struktur tiga dimensi
yang kompleks yang aktif di bawah kondisi khusus dan hanya dengan substrat
spesifik. Enzim adalah molekul biopolimer yang tersusun dari serangkaian asam
amino dalam komposisi dan susunan rantai yang teratur dan tetap. Enzim
merupakan produk protein sel hidup yang berperan sebagai biokatalisator dalam
proses biokimia, baik yang terjadi di dalam sel maupun di luar sel.
Enzim merupakan katalisator sejati yang meningkatkan kecepatan reaksi kimia
spesifik dengan nyata, tanpa enzim, suatu reaksi kimia akan berlangsung amat
lambat. Enzim tidak dapat mengubah titik kesetimbangan reaksi yang
dikatalisisnya; enzim juga tidak akan habis dipakai atau diubah secara permanen
C. Enzim Selulase
Enzim selulase merupakan kumpulan dari beberapa enzim yang bekerja bersama
untuk hidrolisis selulosa. Mikroorganisme tertentu menghasilkan partikel yang
dinamakan selulosom. Partikel inilah yang akan terdisintegrasi menjadi
enzim-enzim, yang secara sinergis mendegradasi selulosa (Belitz dkk, 2008).
Menurut Salam dan Gunarto (1999), selulase merupakan enzim yang dapat
memutuskan ikatan glukosida β-1,4 di dalam selulosa. Dalam menghidrolisis senyawa selulosa, kemampuan selulase sangat digantungkan pada substrat yang di gunakan.
Enzim selulase merupakan salah satu kelompok enzim yang termasuk dalam suatu
sistem yang diproduksi mikroorganisme dalam degradasi material sel tumbuhan.
Enzim ini termasuk dalam famili glikosil hidrolase. Enzim selulase berperan
dalam hidrolisis selulosa dengan memecah ikatan β-1,4-D-glikosida untuk menghasilkan oligosakarida maupun glukosa. Berdasarkan aktivitasnya terhadap berbagai substrat, selulase diklasifikasikan menjadi tiga tipe, yaitu endoglukanase (endo- β-1,4-glucanase, EC 3.2.1.4), β-glukosidase (β-D-glucoside
glucohydrolase, EC 3.2.1.21) dan selobiohidrolase atau eksoglukanase (exo-β
-1,4-glucanase, EC 3.2.1.91) (Zhang et al., 2006; Doi et al., 2003).
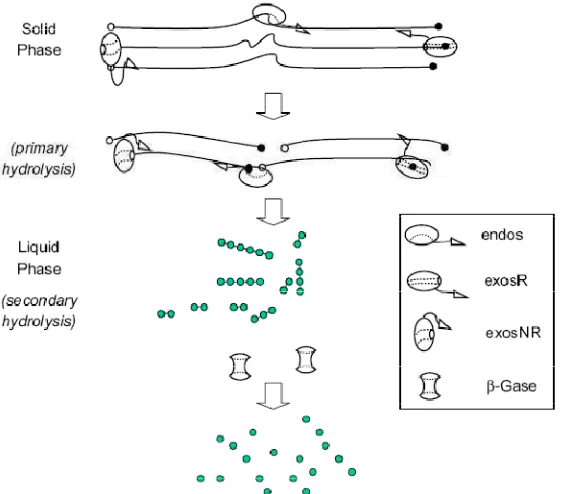
Endoglukanase menghidrolisis ikatan internal β-1,4-D-glikosida secara random pada situs amorf dari rantai polisakarida selulosa untuk menghasilkan
oligosakarida dan menambah ujung rantai yang baru, eksoglukanase
menghasilkan selobiosa atau glukosa sebagai produk utama, dan glikosidase
menghidrolisis selobiosa menjadi glukosa untuk mengeliminasi penghambatan
selobiosa (Gambar 2).
Gambar 2. Skema hidrolisis selulosa oleh sistem selulase non-kompleks (Zhang et al. 2006).
Fungsi terpenting dari enzim adalah kemampuannya menurunkan energi aktivasi
suatu reaksi kimia. Kemampuan enzim dalam mendegradasi substrat dipengaruhi
oleh beberapa faktor, antara lain konsentrasi enzim, konsentrasi substrat, pH serta
D. Hidrolisis
Hidrolisis meliputi proses pemecahan polisakarida di dalam biomassa
lignoselulosa, yaitu: selulosa dan hemiselulosa menjadi monomer gula
penyusunnya (glukosa & xilosa). Hidrolisis sempurna selulosa menghasilkan
glukosa, sedangkan hemiselulosa menghasilkan beberapa monomer gula pentosa
(C5) dan heksosa (C6). Secara umum teknik hidrolisis dibagi menjadi dua, yaitu:
hidrolisis dengan enzim dan hidrolisis dengan asam.
1. Hidrolisis Enzim
Hidrolisis enzim merupakan proses penguraian suatu polimer yang kompleks
menjadi monomer penyusunnya dengan menggunakan enzim (Perez et al., 2002).
Hidrolisis enzimatis memiliki beberapa keuntungan dibandingkan hidrolisis asam,
antara lain: tidak terjadi degradasi gula hasil hidrolisis, kondisi proses yang lebih
lunak (suhu rendah, pH netral), berpotensi memberikan hasil yang tinggi, dan
biaya pemeliharaan peralatan relatif rendah karena tidak ada bahan yang korosif
(Taherzadeh & Karimi, 2008) (Hamelinck et al., 2005). Beberapa kelemahan dari
hidrolisis enzimatis antara lain adalah membutuhkan waktu yang lebih lama, dan
kerja enzim dihambat oleh produk. Di sisi lain harga enzim saat ini lebih mahal
daripada asam sulfat, namun demikian pengembangan terus dilakukan untuk
menurunkan biaya dan meningkatkan efisiensi hidrolisis maupun fermentasi
2. Hidrolisis asam
Di dalam metode hidrolisis asam, biomassa lignoselulosa dipaparkan dengan asam
pada suhu dan tekanan tertentu selama waktu tertentu dan menghasilkan monomer
gula dari polimer selulosa dan hemiselulosa. Beberapa asam yang umum
digunakan untuk hidrolisis asam antara lain adalah asam sulfat (H2SO4), asam
perklorat, dan HCl. Asam sulfat merupakan asam yang paling banyak diteliti dan
dimanfaatkan untuk hidrolisis asam (Taherzadeh and Karimi, 2008). Hidrolisis
asam dapat dikategorikan melalui dua pendekatan umum, yaitu hidrolisis asam
konsentrasi tinggi pada suhu rendah dan hidrolisis asam konsenrasi rendah pada
suhu tinggi. Pemilihan antara dua cara tersebut pada umumnya didasarkan pada
beberapa hal yaitu laju hidrolisis, hasil total hidrolisis, tingkat degradasi produk
dan biaya total proses produksi (Kosaric et al., 1983).
E. Actinomycetes
Actinomycetes merupakan mikroorganisme tanah yang umum dijumpai pada
berbagai jenis tanah. Populasinya berada pada urutan kedua setelah bakteri,
bahkan kadang-kadang hampir sama (Alexander, 1961; Elberson et al., 2000).
Actinomycetes hidup sebagai safrofit dan aktif mendekomposisi bahan organik
sehingga dapat meningkatkan kesuburan tanah (Nonomura and Ohara, 1969).
Actinomycetes merupakan salah satu mikroorganisme yang mampu mendegradasi
selulosa di samping bakteri, kapang, dan khamir (Abe et al., 1979; Nakase et al.,
Jenis Actinomycetes tergantung pada tipe tanah (Davies and Williams, 1970),
karakteristrik fisik, kadar bahan organik, dan pH lingkungan (Xu et al., 1996).
Jumlah Actinomycetes meningkat dengan adanya bahan organik yang mengalami
dekomposisi (Nonomura and Ohara, 1971).
Actinomycetes merupakan genus bakteri yang filamentous yang membentuk
miselia, bersifat gram positif, dan sebagian besar membentuk spora.
Actinomycetes adalah mikroorganisme peralihan antara bakteri dan jamur karena
mikroorganisme ini mempunyai sifat-sifat seperti bakteri dan jamur. Oleh sebab
itu, lingkungan yang menjadi habitat bagi bakteri dan jamur adalah lingkungan
yang tepat bagi kelangsungan hidup Actinomycetes. Sehingga Actinomycetes
tersebar luas di alam (Paul and Clark, 1989).
Walaupun Actinomycetes dikatakan sebagai mikroorganisme peralihan antara
bakteri dan fungi (Alexander, 1977), tetapi Actinomycetes mempunyai ciri yang
khas, yang cukup membatasinya menjadi satu kelompok yang jelas berbeda. Pada
medium cair, pertumbuhan Actinomycetes ditandai dengan keruhnya medium dan
terbentuk lapisan tipis di permukaan medium. Menurut Rao (1994), pada
lempeng agar, Actinomycetes dapat dibedakan dengan mudah dari bakteri, dimana
koloni bakteri tumbuh dengan cepat dan berlendir, sedangkan Actinomycetes
muncul perlahan dan berbubuk serta melekat erat pada permukaan agar.
Umumnya, Actinomycetes tidak toleran terhadap asam dan jumlahnya menurun
pada pH 5,0 (Jiang dan Xu, 1985; Jiang et al., 1988). Rentang pH yang cocok
untuk pertumbuhan Actinomycetes ini sekitar 6,5–8,0 dan 25-300C (Nonomura
Actinomycetes adalah 25-30ºC, tetapi ada beberapa Actinomycetes termofilik yang
dapat tumbuh pada temperatur sekitar 55–650C seperti Streptomyces dan
Thermoactinomycetes (Rao, 1994).
Medium yang baik untuk menumbuhkan Actinomycetes adalah medium yang
mengandung glukosa, gliserol atau tepung sebagai sumber karbon; nitrat atau
kasein sebagai sumber nitrogen dan mineral-mineral tertentu seperti NaCl,
K2HPO4, MgSO4.7H2O, CaCO3, FeSO4.7H2O, inkubasi biasanya selama 2-7 hari
(Fithria, 2007).
Berdasarkan klasifikasinya, Actinomycetes termasuk kelas Schizomycetes, ordo
Actinomycetales yang dikelompokkan menjadi empat familia, yaitu:
Mycobacteriaceae, Actinomycetaeceae, Streptomyceae dan Actinoplanaceae.
Genus yang paling banyak dijumpai adalah Streptomyces (hampir 70%),
Nocardia, dan Micronospora. Koloni Actinomycetes muncul perlahan,
menunjukkan konsistensi berbubuk dan melekat erat pada permukaaan media.
Pengamatan di bawah mikroskop menunjukkan adanya miselium ramping bersel
satu yang bercabang membentuk spora aseksual untuk perkembang biakannya
(Lechevalier dan Lechevalier, 1967; Nonomura dan Ohara, 1971).
Beberapa spesies dari genus Actinomycetes memiliki peranan penting dalam
mendekomposisi beberapa jenis polimer dan kemampuan kapasitas biodegradasi
makromolekul ini didukung oleh produksi enzim ekstraseluler yang beragam
(Wendishch dan Kutzner, 1992; Ramachandra et al., 1987; Yamac dan Tamer,
F. Fermentasi Fase Padat (Solid State Fermentation / SSF)
Fermentasi pertumbuhan mikroba dan pembentukan produk bergantung dari
permukaan pada substrat padat. Subtrat tradisional yang dapat digunakan dalam
fermentasi berupa hasil produk agrikultur seperti beras, tepung, maisena, tebu,
dan lain-lain. Substrat tersebut mendukung organisme miselium untuk tumbuh
pada konsentrasi nutrisi yang tinggi, dan menghasilkan berbagai macam enzim
ekstraseluler seperti sejumlah filamen jamur dan beberapa bakteri (Actinomycetes
dan satu strain dari Bacillus) (Pandey et al., 2008).
Fermentasi fase padat atau sering disebut Solid State Fermentation (SSF) pertama
kali dikenalkan oleh Takagi et al., (1977), yang telah berhasil mengkombinasikan
enzim selulase dan yeast Sacharomyces cerevisiae untuk fermentasi gula menjadi
etanol. Fermentasi fase padat dapat didefinisikan sebagai proses fermentasi yang
melibatkan zat padat dalam suatu fasa cair (Moo-Young et al., 1983). Proses SSF
sebenarnya hampir sama dengan proses hidrolisis dan proses fermentasi, tetapi
proses hidrolisis dan fermentasi pada SSF dilakukan dalam satu tempat. Proses
SSF membutuhkan bahan mentah alami sebagai sumber karbon dan bahan inert
sebagai matriks padatan. Substrat padat (matrik) harus cukup akan kelembaban
dan memiliki area permukaan substrat yang lebar.
Berdasarkan dari sifat fisik Fermentasi Fase Padat dibagi menjadi dua kelompok,
antara lain:
2. Fermentasi padatan tersuspensi dalam kolom dengan sirkulasi larutan. Jamur
yang digunakan biasanya aerob obligat.
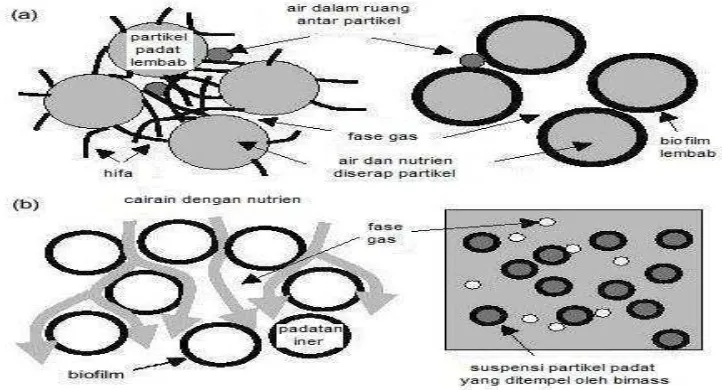
Gambar 3. Proses Fermentasi Fase Padat.
Konsentrasi air sebagai moisture (pelembab) sangat menentukan jalannya
fermentasi padat. Perubahan partikel padat yang lembab dan fase gas dalam
sistem Fermentasi Fase Padat melibatkan hifa dan organisme uniseluler yang di
tunjukkan oleh Gambar 3a. Sedangkan sistem lain yang melibatkan pertumbuhan
pada zat padat, tetapi tidak didefinisikan sebagai Fermentasi Fase Padat selama
jumlah air antara partikel besar (Moo-Young et al., 1983).
1. Proses Fermentasi Fase Padat
Mitchel et al. (2006) juga menjelaskan tahapan-tahapan proses Fermentasi Fase
Padat secara umum, antara lain:
1.1. Persiapan Substrat, dimana substrat harus dipotong, digiling,
dan nutrisi disebut dengan pra-perawatan substrat untuk menambah
ketersediaan gizi.
1.2. Persiapan Inokulum, tipe dan persiapan inokulum tergantung pada
mikroorganisme yang digunakan. Banyak proses fermentasi fase padat
melibatkan hifa khamir, maka digunakan spora hasil inokulasi. Tujuan
dari langkah ini untuk mengembangkan sebuah inokulum dengan
tingkat kelangsungan hidup mikoorganisme yang tinggi.
1.3. Persiapan Wadah, dimana wadah harus dibersihkan setelah fermentasi
sebelumnya dan perlu disterilkan sebelum penambahan substrat.
1.4. Inokulasi dan Pengerjaan, pengerjaan tahapan ini dengan menyebarkan
substrat pada media yang telah disterilkan secara hati-hati untuk
menghindari kontaminasi dari mikroorganisme yang tidak diinginkan.
1.5. Proses Fermentasi Fase Padat, pada proses ini banyak hal yang harus
diperhatikan antara lain pH medium, suhu, dan waktu inkubasi,
kelembaban.
1.6. Kultivasi, pada tahapan ini memerlukan bantuan mekanis untuk
memisahkan substrat padat dari medium. Penggunaan kertas saring dan
sentrifugasi dapat dipakai untuk memisahkan substrat.
2. Keuntungan Fermentasi Fase Padat
Fermentasi fase padat memiliki beberapa keuntungan, antara lain biaya lebih
murah, media produksi dapat menggunakan residu agroindustri, menggunakan
sedikit air, limbah yang dihasilkan sedikit, proses sederhana, menggunakan wadah
3. Aplikasi Fermentasi Fase Padat
Holker et al., (2004) dan Pandey (2000) menguraikan beberapa aplikasi dari SSF
secara tradisional yang digunakan oleh banyak negara, antara lain :
1.1. Tempe, dimana tempe melibatkan kultivasi dari khamir Rhizopus
oligosporus pada kedelai yang direbus, kemudian digoreng dan dimakan
sebagai pengganti daging. Makanan fermentasi ini sangat terkenal di
Indonesia.
1.2. Tahapan koji dalam pembuatan kecap yang melibatkan kultivasi dari
khamir Aspergillus oryzae dalamkedelai rebus. Proses SSF miselium
khamir menutupi kedelai dan menginjeksikan ke dalam campuran enzim.
Kedelai hasil fermentasi kemudian dipindahkan ke dalam air asin selama
beberapa bulan sehingga akan menghasilkan saus yang berwarna coklat
tua.
1.3. “ang-kak” atau anggur merah melibatkan kultivasi dari khamir Monascus
purpureus pada beras yang direbus. Produksi khamir menghasilkan
pigmen berwarna merah gelap, pada tahap akhir fermentasi beras hasil
fermentasi dikeringkan dan dihaluskan menjadi bubuk yang akan
digunakan sebagai pewarna saat memasak.
Selain aplikasi di atas, lebih dari tiga dekade banyak ketertarikan pada proses
teknologi SSF. Kebanyakan dari aplikasi tersebut menghasilkan produk-produk
seperti enzim, pigmen, senyawa aromatik, senyawa kimia, antibiotik, dan agen
dalam SSF sebagai bagian dari proses perantara, yaitu pewarnaan zat warna,
biobleaching, biopulping, dan bioremediation.
G. Analisis Gula Reduksi
Gula reduksi hasil hidrolisis asam dapat dianalisis secara kualitatif untuk
mengidentifikasi apakah sampel mengandung gula reduksi atau tidak dan secara
kuantitatif untuk menentukan kadar gula reduksi yang terbentuk. Untuk maksud
tersebut, analisis gula reduksi secara kualitatif dapat dilakukan dengan uji
Benedict, uji Fehling, uji Barfoed, uji Tollens, dan uji Molisch (Mathews, 2000).
Analisis gula reduksi secara kuantitatif dapat dilakukan dengan berbagai cara,
antara lain dengan metode Luff Schoorl (Kowalski et al., 2013), Nelson-Somogyi
(Woiciechowski et al., 2002) dan DNS (Lone et al., 2012). Metode DNS
merupakan metode yang paling banyak digunakan untuk menentukan kadar gula
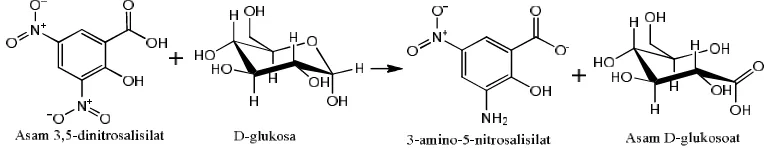
reduksi. Dalam metode DNS digunakan reagen dinitro salisilat (DNS).
Bahan-bahan kimia yang diperlukan untuk membuat reagen DNS adalah asam
3,5-dinitrosalisilat, NaOH, Na2SO3, Na-K-tartarat, fenol, dan akuades. DNS
merupakan senyawa aromatis yang dapat bereaksi dengan gula reduksi
membentuk asam 3-amino-5-nitrosalisilat, suatu senyawa yang mampu menyerap
radiasi gelombang elektromagnetik pada panjang gelombang maksimum 540 nm
(Adney and Baker, 2008). Semakin tinggi kadar gula reduksi yang terdapat dalam
sampel, maka akan semakin banyak pula molekul asam 3-amino-5- nitrosalisilat
Reaksi antara gula reduksi dengan DNS merupakan reaksi redoks pada gugus
aldehid gula dan teroksidasi menjadi gugus karboksil. Sementara itu, DNS
sebagai oksidator akan tereduksi membentuk asam 3-amino dan 5- nitrosalisilat.
Reaksi ini berlangsung dalam suasana basa dan suhu tinggi sekitar 90-100 °C.
Bila terdapat gula reduksi pada sampel, maka larutan DNS yang awalnya
berwarna kuning akan bereaksi dengan gula reduksi sehingga menimbulkan warna
jingga kemerahan (Kusmiati dan Agustini, 2010).
Reaksi antara DNS dengan glukosa adalah sebagai berikut :
Gambar 4. Reaksi glukosa dengan DNS.
Sampel yang telah direaksikan dengan DNS selanjutnya ditentukan kadar gula
reduksinya menggunakan spektrofotometer UV-vis. Spektrofotometer UV-vis
adalah alat untuk mengukur transmitan atau absorbansi suatu sampel sebagai
fungsi panjang gelombang. Alat ini menggunakan dua buah sumber cahaya yang
berbeda, yaitu sumber cahaya UV menggunakan lampu Hidrogen atau Deuterium
dan sumber cahaya tampak menggunakan lampu Tungsten. Larutan sampel yang
akan dianalisis diukur absorbansi sinar ultra violet atau sinar tampaknya.
Konsentrasi larutan sampel yang dianalisis akan sebanding dengan jumlah sinar
yang diserap oleh zat yang terdapat dalam larutan tersebut. Prinsip kerja
spektrofotometer UV-Vis ini didasarkan pada Hukum Lambert-Beer yang
larutan. Secara sistematik, Hukum Lambert-Beer dapat dinyatakan dengan
persamaan berikut.
A = - log T = log = ε . b . c Dimana:
A = absorbansi T = transmitansi
I0 = intensitas cahaya masuk
It = intensitas cahaya yang diteruskan oleh larutan sampel
ε = absorbtivitas molar (Lmol-1cm-1)
b = ketebalan lapisan larutan sampel (panjang jalur absorbsi) (cm) c = konsentrasi sampel (mol L-1)
Agar dapat menentukan kadar gula reduksi pada sampel, terlebih dahulu dibuat
kurva standar menggunakan larutan glukosa. Kurva standar dibuat dengan
mengalurkan absorbansi pada panjang gelombang 540 nm dengan konsentrasi
larutan standar (Adney and Baker, 2008). Dari kurva standar tersebut akan
didapatkan persamaan garis, yang menunjukkan hubungan antara konsentrasi dan
absorbansi dengan persamaan umum:
y = ax + b, dimana y merupakan absorbansi, a merupakan slope, x
merupakan konsentrasi sampel, dan b merupakan intersep. Dengan mensubstitusi
nilai absorbansi sampel ke persamaan tersebut dan kemudian diplotkan terhadap
kurva standar, maka dapat diketahui konsentrasi atau kadar gula reduksi pada
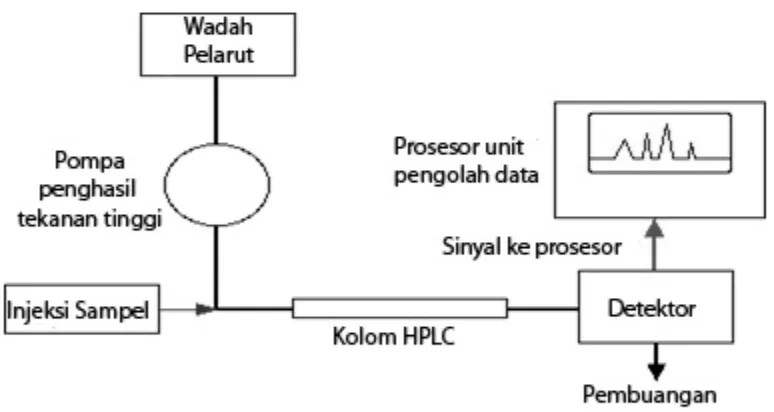
H. Kromatografi Cair Kinerja Tinggi (KCKT) atau High Performance
Liquid Chromatography (HPLC)
Kromatografi Cair Kinerja Tinggi (KCKT) atau High Pressure Liquid
Chromatography (HPLC) adalah salah satu metode kimia dan fisikokimia.
KCKT termasuk metodeanalisis terbaru yaitu suatu teknik kromatografi dengan
fase gerak cairan dan fase diamcairan atau padat. KCKT merupakan suatu teknik
kromatografi yang menggunakan fasa gerak cair untuk pemisahan sekaligus untuk
analisis senyawa berdasarkan kekuatan atau kepolaran fasa geraknya.
Berdasarkan polaritas relatif fasa gerak dan fasa diamnya, KCKT dibagi menjadi
dua, yaitu fasa normal yang umumnya digunakan untuk identifikasi senyawa
nonpolar sehingga fasa gerak yang digunakan kurang polar dibandingkan fasa
diam dan fasa terbalik yang umumnya digunakan untuk identifikasi senyawa
polar, menggunakan fasa gerak lebih polar dibandingkan fasa diam (Gritter dkk,
1991). Prinsip pemisahan senyawa menggunakan KCKT adalah perbedaan
distribusi komponen diantara fasa diam dan fasa geraknya. Semakin lama
Gambar 5. Diagram alat HPLC (Clark, 2007).
Pada Kromatografi Cair Kinerja Tinggi (KCKT) efisiensi waktu dan tingkat
kemurnian senyawa yang akan diisolasi dapat dilakukan dengan cepat dan
maksimal. Hal ini terkait dari beberapa kelebihan dari teknik KCKT yang
digunakan (Johnson dan Stevenson, 1991; Snyder and Kirkland, 1979).
Kelebihan itu antara lain :
a. Cepat : waktu analisis umumnya kurang dari 1 jam. Banyak analisis yang
dapat diselesaikan sekitar 15-30 menit, bahkan untuk analisis yang tidak
rumit (uncomplicated) dapat dicapai waktu kurang dari 5 menit.
b. Resolusi : berbeda dengan kromatografi gas (KG), kromatografi cair
mempunyai dua fasa dimana interaksi selektif dapat terjadi. Kemampuan zat
padat berinteraksi secara selektif dengan fasa diam dan fasa gerak pada
KCKT memberikan parameter tambahan untuk mencapai pemisahan yang
diinginkan.
c. Sensitivitas detektor : detektor absorpsi UV yang biasa digunakan dalam
bermacam-macam zat. Detektor-detektor Fluorosensi dan Elektrokimia dapat
34 mendeteksi sampai picogram (10-12 gram). Dan beberapa detektor lain
juga dapat digunakan dalam KCKT seperti spektrofotometer massa, Indeks
refraksi, ELSD dan lain sebagainya.
d. Kolom yang dapat digunakan kembali : Berbeda dengan kolom kromatografi
klasik, kolom KCKT dapat digunakan kembali. Hal ini disebabkan karena
keseluruhan sampel yang disuntikkan kedalam kolom dapat terdorong keluar
oleh tekanan yang tinggi.
e. Mudah rekoveri sampel : umumnya detektor yang digunakan dalam KCKT
tidak menebabkan destruktif (kerusakan) terhadap komponen sampel yang
diananlisis, oleh karena itu sampel tersebut dapat dengan mudah dikumpulkan
setelah melewati detektor. Pelarutnya dapat dihilangkan dengan cara
menguapkannya.
Kromatografi cair kinerja tinggi merupakan salah satu metode pemisahan yang
memanfaatkan teknologi dalam proses pemisahan suatu senyawa campuran atau
suatu analit.
Secara umum metoda kromatografi cair kinerja tinggi mempunyai prinsip kerja
yang sama seperti kromatografi kolom, dimana proses pemisahan senyawa terjadi
akibat adanya keseimbangan distribusi antara zat terlarut (sampel) yang di
adsorbsi adsorben dan pelarut yang mengalir melewati kolom. Hal yang
membedakan sistem kromatografi ini adalah proses pemisahan komponen sampel
di dalam kolom dilakukan pada sistem tekanan tinggi dengan tingkat ukuran
menggunakan beberapa macam detektor yang dapat diganti. Metode kromatografi
kinerja tinggi sangat efisien untuk memisahkan campuran senyawa yang memiliki
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Maret sampai bulan Agustus 2013 di
Laboratorium Instrumentasi dan Laboratorium Biokimia Jurusan Kimia FMIPA
Universitas Lampung.
B. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah neraca analitik, pH meter,
shaker inkubator (inkubator goyang), autoklaf model S-90N, Laminar air flow
CRUMA model 9005-FL, Kromatografi Cair Kinerja Tinggi (KCKT) KNAUER
HPLC FLD & RID, Inkubator P-Selecta, spektrofotometer UV-VIS Hitachi
U-2010, oven, lemari pendingin, magnetic stirrer, penangas air, jarum ose, kertas
saring, Erlenmeyer, cawan petri, mikropipet, tabung reaksi dan peralatan umum
laboratorium lainnya.
Bahan-bahan yang digunakan adalah jerami padi hasil bio-pretretment dengan
ukuran ± 40 mesh, Isolat Actinomycetes Acp-1 dan AcP-7, medium YMA (Yeast
Na2HPO4, KH2PO4, MgSO4.7H2O, NaCl, CaCl2.2H2O, larutan mineral), buffer
fosfat, buffer sitrat-fosfat, DNS, akuades, NaCl, antibiotik (Nistatine dan
Streptomycine), bircwood xylan (Sigma Chemical Co.), CMC (Sigma Chemical
Co), asam asetat glasial 80%, asam nitrat pekat dan kertas saring.
C. Prosedur Penelitian
1. Pembuatan Inokulum
Inokulum isolat actinomycetes AcP-1 dan Acp-7 dibuat menggunakan
media yeast maltosa cair (YM) dengan komposisi 4 g ekstrak khamir
ditambahkan 10 g ekstrak malt dan 15 g glukosa dalam 1 liter media,
kemudian disterilkan pada suhu 121ºC dengan tekanan 1 atm selama 15
menit. Ke dalam 10 mL media inokulum diinokulasikan 1 ose isolat dan
dinkubasi selama 96–120 jam hingga jumlah sel mencukupi.
2. Optimasi Fermentasi Substrat Jerami
Sebanyak 10 mL inokulum isolat Actinomycetes Acp-1 dan AcP-7 yang
telah ditumbuhkan pada media YM selama 96–120 jam diinokulasikan ke
dalam media fermentasi steril yang berisi 10 g substrat jerami padi hasil
bio-pretreatment dengan ukuran ± 40 mesh, yang telah ditambahkan
dengan 30 mL buffer fosfat sebagai moisture (pelembab) dengan membuat
variasi pH media masing-masing pH: 6,5; 7,0; 7,5; 8,0; 8,5, kemudian
dengan menggunakan wadah kaca dengan memperhatikan sisa ruang di
atasnya untuk memberikan suasana fakultatif aerobik. Hal yang harus
diperhatikan dalam fermentasi adalah perubahan substrat jerami secara
fisik hingga semua substrat terdekomposisi untuk mendapatkan gambaran
kondisi fermentasi yang ideal. Setiap selang waktu 3 hari dilakukan
pemanenan dengan menambahkan 100 mL akuades yang telah disterilkan
dan disaring untuk memisahkan filtratnya untuk diamati beberapa
parameter fermentasi yang diuraikan pada prosedur 3.
3. Pengukuran Parameter Fermentasi
3.1. Pengukuran Kadar Selulosa
Sebanyak 1 g substrat jerami padi hasil bio-pretreatment berukuran ±
40 mesh dimasukkan ke dalam labu bundar, tambahkan 15 mL asam
asetat 80% dan 1,5 mL asam nitrat 14 M, kemudian direfluks selama
20 menit. Selanjutnya dilakukan penyaringan dengan menggunakan
kertas saring Whatman No. 91 yang telah diketahui bobotnya (A).
Setelah dilakukan penyaringan, padatan hasil dari refluks dicuci
dengan etanol. Erlenmeyer dan corong dibilas dengan air suling
sebanyak 3 kali. Kertas saring beserta residu dikeringkan pada oven
dengan suhu 100-105oC selama 1-2 jam. Kertas saring didinginkan
dan ditimbang bobotnya (B). Kertas saring dengan residu diabukan
Keterangan :
B = Bobot kertas saring dan residu setelah dioven (g)
A = Bobot kertas saring (g)
C = Bobot abu (g) (Soest and Wine, 1967)
3.2. Pengukuran Aktivitas Enzim Selulase
Aktivitas selulase diujikan dengan melihat aktivitas endoglukanase
dengan pengujian enzim pada substrat karboksimetil selulosa (CMC,
Sigma). Sebanyak 1 mL substrat 0,5% CMC ditambahkan 0,9 mL
0,02 M buffer fosfat pH optimum. Kemudian larutan ini ditambahkan
0,1 mL filtrat hasil fermentasi (ekstrak kasar enzim) dihomogenisasi
dan diinkubasi pada suhu 30oC selama 30 menit lalu ditambahkan 2
mL pereaksi DNS dan dipanaskan pada suhu 100oC selama 15 menit,
kemudian didinginkan pada suhu ruang. Kontrol: sebanyak 1 mL
substrat 0,5% karboksimetil selulosa (CMC, sigma) ditambahkan 0,9
mL 0,2 M buffer fosfat pH optimum lalu diinkubasi pada suhu 30oC
selama 30 menit. Kemudian ditambahkan 0,1 mL ekstrak enzim dan 2
mL filtrat hasil fermentasi dan 2 mL pereaksi DNS dan segera
dipanaskan pada suhu 100oC selama 15 menit dan didinginkan pada
suhu ruang. Pengukuran absorbansi masing-masing larutan dilakukan
pada λ 540 nm (Miller, 1959).
Satu unit aktivitas enzim selulase didefinisikan sebagai jumlah 1 µ mol
glukosa yang dihasilkan per menit untuk setiap mL enzim pada
Keterangan :
V = Volume sampel (mL)
FP = Faktor pengenceran (g)
4. Pengukuran Hasil Produk Fermentasi
4.1. Pengukuran Gula Pereduksi Total dengan Metode DNS
Sebanyak 2 mL filtrat hasil fermentasi dihomogenisasi lalu
ditambahkan 2 mL pereaksi DNS dan dipanaskan pada suhu 100oC
selama 15 menit, lalu didinginkan pada suhu ruang. Pengukuran
absorbansi masing-masing larutan dilakukan pada λ 540 nm (Miller, 1959).
4.2. Pengukuran Produk Fermentasi dengan KCKT
Filtrat dianalisis dengan menggunakan KCKT pada kondisi reaksi
sebagai berikut :
- Kolom : Karbohidrat
- Detektor : Indeks bias
- Pelarut : Akuabides
- Konsentrasi Standar : 400 ppm
- Volume injeksi : 10-20 µL
- Temperatur kolom : Suhu ruang
5. Pembuatan Media
5.1. Pembuatan media YMA (Yeast Malt Agar)
Medium YMA terdiri dari 4 g ekstrak khamir, 10 g ekstrak malt, 15 g
glukosa, 15 g agar-agar per 1 liter media, diautoklaf selama 15 menit
pada suhu 121ºC dan tekanan 2 atm, kemudian ditambahkan dengan
50 µg/L Nistatine dan 25 µg/L Streptomycine.
5.2. Pembuatan media inokulum YM (Yeast Malt)
Medium YM terdiri dari 4 g ekstrak khamir, 10 g ekstrak malt dan 15
g glukosa dalam 1 liter media, kemudian diautoklaf selama 15 menit
pada suhu 121ºC dan tekanan 2 atm.
5.3. Pembuatan media fermentasi
Sebanyak 10 g jerami padi dan buffer fosfat dengan variasi pH 6, 7
dan 8, serta perbandingan substrat: volume yaitu 1:1, 1:2 dan 1:3,
kemudian diautoklaf selama 15 menit pada suhu 121ºC dengan
tekanan 1 atm (Yamac dan Tamer, 2008).
6. Pembuatan Pereaksi
6.1. Pembuatan Buffer Fosfat
6.1.1. Larutan Stok A (NaH2PO4·2H2O 0,2 M)
Sebanyak 27,8 g NaH2PO4·2H2O dilarutkan dengan air suling
6.1.2. Larutan Stok B (Na2HPO4·2H2O 0,2 M)
Sebanyak 35,6 g Na2HPO4·2H2O dilarutkan dengan air suling
hingga volume 1000 mL.
6.2. Pembuatan Buffer Sitrat-Fosfat
6.2.1. Larutan Stok A (Asam Sitrat 0,1 M)
Sebanyak 19,21 g asam sitrat dilarutkan dengan air suling
hingga volume 1000 mL.
6.2.2. Larutan Stok B (Na2HPO4·2H2O 0,2 M)
Sebanyak 35,6 g Na2HPO4·2H2O dilarutkan dengan air suling
hingga volume 1000 mL.
6.3. Pembuatan Pereaksi DNS
Larutan A : 3 g NaOH; 0,6 g fenol; 3 g DNS dalam 240 mL air suling.
Larutan B : 0,25 g Na-sulfit; 2 g Na-K-tartarat dan 5 mL air suling.
Sebanyak 3 mL larutan B ditambahkan pada 240 mL larutan A dan
ditambahkan air suling hingga volume 300 mL.
6.4. Pembuatan NaCl 0,85%
Sebanyak 0,85 g NaCl dilarutkan dengan air suling hingga volume
100 mL.
7. Pembuatan Kurva Standar Glukosa
Konsentrasi gula pereduksi diperoleh dengan menggunakan kurva standar
mg/mL. Sebanyak 2 mL larutan standar ditambahkan 2 mL pereaksi DNS
dan dipanaskan pada suhu 100oC selama 15 menit, lalu didinginkan pada
suhu ruang. Absorbansi larutan dibaca menggunakan spektrofotometri
UV-Vis pada λ 540 nm. Hasil yang diperoleh diplotkan untuk mempeoleh kurva regresi linier dengan absorbansi sebagai y dan konsentrasi larutan
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa : 1. Kondisi fermentasi optimum didapat pada waktu 12 hari dan pH 7,5 ditinjau dari
aktivitas selulase tertinggi.
2. Karakterisasi parameter-parameter hasil fermentasi dilihat pada kondisi optimum : a. Pengukuran kadar selulosa yang hilang untuk isolat AcP-1 sebesar 10,595 %
dan 10,580 % untuk isolat AcP-7.
b. Pengukuran aktivitas enzim selulase untuk isolat AcP-1 sebesar 1,164 U/mL dan 0,997 U/mL untuk isolat AcP-7.
3. Hasil produk fermentasi berdasarkan kondisi optimum yang didapat : a. Pengukuran gula pereduksi total dengan metode DNS untuk isolat AcP-1
sebesar 15,134 mg/mL dan sebesar 14,803 mg/mL untuk isolat AcP-7.
b. Pengukuran glukosa dengan metode KCKT menunjukkan waktu retensi untuk
B. Saran
DAFTAR PUSTAKA
Abe, S., Horii, S., and Kameoka, K. 1979. Application of enzymatic analysis with glucoamylase, pronase and cellulase to various fedds for cattle. Journal of Animal Science. 48: 1483-1490.
Adney, B., and Baker, J. 2008. Measurement of Cellulase Activities-Laboratory Analytical Procedur (LAP). Technical Report.
Alexander, M. 1961. Introduction to Soil Microbiology. 1nd ed. New York: J Wiley and Sons.
Alexander, M. 1977. Introduction of soil Microbiology. 2nd ed. New York: J Wiley and Sons.
AL-Tai, A.M., Abdul-Razzak S., Al-Ittiyah, S.S., Abdul-Noer, B.A. 1989. Cellulase Production from Actinomycetes isolated from iraqi soils: II. cel growth and cellulase activity of Streptomycetes sp. strain AT7 at different temperature. Journal of Islamic Academy of Science. 2: 185-188.
Aziz, A.A., Husin, M., and Mokhtar, A. 2002. Preparation of cellulose from oil palm empty fruit bunches via ethanol digestion: effect of acid and alkali catalysts.Journal of Oil Palm Research. 14: 9-14.
Beg, Q.K., Kapoor, M., Mahajan, K., Hoondal, G.S. 2000. Microbial Xylanases and their industrial applications. Journal of Appl Microbiol Biotechnol. 56: 326-338.
Belitz, H.D., Grosch, W., and Schieberle, P. 2008. Food Chemistry, 4th ed. Berlin: Springer-Verlag. 327-337.
Clark, J. 2007. Kromatografi Cair kinerja Tinggi (HPLC). http://www.Chem-is-try.org. [10 September 2011].
Dashtban. 2009. Fungal Bioconversion of Lignocellulosic Residue: Opportunities and Perspectives. Journal of Biology Science. 17: 578-595.
Davies, F.L., and Williams, S.T.1970. Studies on the ecology of Actinomycetes in soil. I. The occurrence and distribution of Actinomycetes in a pine forest soil. Soil Biology and Biochemistry. 2: 227-238.
Doi, R.H., Kosugi, A., Murashima, K., Tamaru, Y., and Han, S.O. 2003. Cellulosomes from Mesophilic Bacteria. Journal of Bacteriol. 185: 907-4914.
Efendy, D.L.P. 2004. Kromatografi Cair Kinerja Tinggi Dalam Bidang Farmasi.
http://epository.usu.ac.id/bitstream/123456789/3616/1/farmasi-effendy2.pdf. [22 April 2011].
Ekawati, I. 2008. Dekomposisi Komponen Lignoselulosa Jerami Padi Oleh Beberapa Isolat Bakteri. Jurnal Natural 7.
Elberson, M.A., Malekzadeh, F., Yazdi, M.T., Kameranpour, N., Noori-Dloii, M.R., Matte, M.H., Shahamat, M., Colwell, R.R., and Sowers, K.R. 2000. Cellulomonas persica sp. nov. and Cellulomonas iranensis sp. nov., mesophilic cellulose-degrading bacteria isolated from forest soil.
International Journal on Systematic and Evolution Microbiology. 50: 993-996.
Fan, L.T., Lee, Y.H., and Gharpuray, M.M. 1982. The Nature of Lignocellulosics
and Their Pretreatment for Enzymatic Hydrolysis. Advances in
Bichemical. Engineering. 23: 158–187.
Fithria, N. 2007. Uji Antibakteri Isolat Actinomycetes dari Callispongia sp. yang Terdapat Di Pulau Tegal dan Pulau Tangkil Perairan Teluk Lampung. [Skripsi] Jurusan Biologi FMIPA Universitas Lampung. Bandar Lampung.
George, S.P. 2001. Molecular and Biochemical Aspects of extremophilic Actinomycetes. Division of Biochemical Sciences National Chemical Laboratory Pune. India.
Gritter. 1991. Pengantar Kromatografi. ITB. Bandung. 34-35, 186.
Gritter, R.J., Bobbit, J.M., and Schwarting, A.E. 1991. Pengantar Kromatografi. 2nd ed. ITB. Bandung. 108-109, 160-179.
Hakim, L.I. 2009. Studi Hidrolisis Selulosa Jerami Padi Menggunakan
Actinomycetes Isolat Lokal. [Skripsi] Jurusan Kimia FMIPA Universitas Lampung. Bandar Lampung.
Hamelinck, C.N., Hooijdonk, Gv., Faaij, A.P.C. 2005. Ethanol from
Han, S.J., Yoo, Y.J., Kang, H.S. 1995. Characterizatin of Bifunctional Cellulase and its Structural Gene. Journal of Biological Chemistry. 270: 26012-26019.
Holker, U., Hofer, M., and Lenz, J. 2004. Biotechnological advantages of laboratory-scale solid state fermentation with fungi. Applied Microbiology and Biotechnology. 64: 175–186.
Howard, R.L., Abosti, E., Rensburg, E.L.Jv., Howard, S. 2003. Lignocellulose biotechnology: issues of bioconversion and enzyme production. African Journal Biotechnology. 2: 602-619.
Jhonson, E.L., and Stevenson, R. 1991. Dasar-dasar Kromatografi Cair. Diterjemahkan oleh Kosasih Padmawinata. ITB. Bandung. 50-55.
Jiang, C.L., and Xu, L.H. 1985. Isolation methods for study of actinomycete population. Microbiology. 12: 218-220.
Jiang, C.L., Xu, L.H., and Guo, G.Y. 1988. The investigation on actinomycete population and resources in some areas in Yunnan. V. The actinomycetes in the frigid mountains. Acta Microbiologica Sinica. 28: 198-205.
Kosaric, N., Wieczorek, A., Cosentino, G.P., Magee, R.J., and Prenosil, J.E. 1983. Ethanol fermentation. In Biotechnology. H.-J. Rehm & G. Ree, H. Dellweg. Verlag Chemie, Weinheim. 3: 257-385.
Kowalski, S., Marcin L., and Wiktor, B. 2013. Applicabality of Physico-chemical Parameters of Honey for Identification of The Botanical Origin. Acta Scientiarum Polonorum. 2: 51-59.
Kusmiati dan Agustini N.W.S. 2010. Pemanfaatan Limbah Onggok untuk Produksi Asam Sitrat dengan Penambahan Mineral Fe dan Mg pada Substrat Menggunakan Kapang Trichoderma Sp dan Aspergillus Niger. Seminar Nasional Biologi. 856-866.
Lechevalier, M.P., and Lechevalier, H.A. 1980. The chemotaxonomy of Actinomycete. In: Dietz, A. and W.D. Thayer ed. Actinomycetes
Taxonomy. Special publication no. 6. Arlington, Va.: Society for Industrial Microbiology.
Lehninger, A.L. 1982. Dasar-dasar Biokimia. Alih Bahasa oleh Maggy Thenawijaya. Erlangga. Jakarta. 235-277.
Maranatha, B. 2008. Aktivitas Enzim Selulase Isolat Asal Indonesia Pada Berbagai Substrat Limbah Pertanian. [Skripsi] Departemen Biologi FMIPA Institut Pertanian Bogor. Bogor.
Mathews, Hv. and Ahern. 2000. Biochemistry, 3rd Edition. San Francisco. Benjamin/Cummings. 278-310.
Miller, G.L. 1952. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar, Analytical Chemistry. 31: 426-428.
Mitchel, D., Krieger, N., and Berovic, M. 2006. Solid-State Fermentation Bioreactors. Springer-Verlag Berlin. Heidelberg.
Moore, H.K. 1919. Process of Making Ethyl Alcohol from Wood.United State of America. 217: 323-540.
Moo-Young, M., Moriera, A., and Tengerdy, R. 1983. Principles of solid state
fermentation, Dalam The Filamentous Fungi, Fungal Technology.
London: JE Smith, DR Berry, & B Kritiansen , Edward Arnold.
Nakase, T., Matofumi, S., Masako, T., Makiko, H., Takushi, H., and Sakuzo, F. 1994. A taxonomic study on cellulolytic yeasts and yeast-like
microorganisms isolated in Japan I. Ascomycetous yeasts genera Candida and Williopsis, and a yeast-like genus Prototheca. Journal ofGenetical Applied Microbiology. 40: 519-531.
Noermala, S.R., Purbowatiningrum, R.S., Nies, S.M. 2013. Aktivitas Fusarium oxysporum dalam Menghidrolisis Enceng Gondok (Eichhornia crassipes) dengan Variasi Temperatur. 1: 220-225.
Nonomura, H., and Ohara, Y. 1969. Distribution of soil actinomycetes. The isolation and classification of genus Streptosporangium. Journal of Fermentation Technology. 38: 405-709.
Nonomura, H., and Ohara, Y. 1971. Distribution of soil actinomycetes. Green spore group of Microtetraspora, its preferential isolation and taxonomic characteristics. 49: 1-912.
Onsori, H., Zamani, M.R., Motalebbi, M. 2005. Identification of Over Producer Strain of endo- β-1,4-gluconase in Aspergillus Species; Characterization of Crude Carboxymethyl Cellulose. African Journal of Biotechnology. 41: 26-30.
Pasti, M.B., Pametto, A.L., Nuti, M.P., Crawford, D.L. 1990. Lignin-Solubilizing Ability of Actinomycetes Isolated from Termite (Termitidae) Gut. App. And Env. Microb. 56: 2213-2218.
Paul, E.A., and Clark, F.E. 1989. Soil Microbiology and Biochemistry. 2nd ed. Academic. London.
Perez, J., Munoz-Dorado, J., Rubia, Td., Martinez, J. 2002. Biodegradation and biological treatments of cellulose, hemicellulose and lignin: an overview. Int. Microbiol. 5: 53-63.
Poedjiadi, A. 1994. Dasar-dasar Biokimia. Universitas Indonesia. Jakarta. 427.
Ramachandra, M., Crawford, D.L., Pametto, A.L. 1987. Extracellular enzyme activities during lignocellulose degradation by Streptomyces spp.: a comparative study of wild-type genetically manipulated strains. App. And Env. Microb. 53: 2754-2760.
Rao, N.S.S. 1994. Soil Microorganisms and Plant Growth. Oxford and IBM Publishing Co. London.
Rimbani, M. 2013. Optimasi Bio-Pretreatment Jerami Padi Secara Fermentasi Fase Padat Oleh Isolat ActinomycetesAcP-1 dan AcP-7. [Skripsi] Jurusan Kimia FMIPA Universitas Lampung. Bandar Lampung.
Saha, B.C. 2004. Lignocellulose Biodegradation and Application in Biotechnology. US Government Work. American Chemical Society. 2-14.
Salam, dan Gunarto. 1999. Enzim Selulase Dari Trichoderma spp. Jurnal Mikrobiologi Indonesia. 2.
Sanchez, O.J., and Cardona, C.A. 2007. Trends in biotechnological production of fuel ethanol from different feedstocks., Bioresource Technology, p. doi: 10.1016/jbiortech.2007.11.013 Article in Press.
Sjostrom, E. 1995. Kimia Kayu, Dasar-Dasar dan Penggunaan. 2nd ed. Sastrohamidjojo H, penerjemah. Gadjah Mada University. Yogyakarta.
Snyder, L.R., and Kirkland, J.J. 1979. Introduction to Modern Liquid Chromatography. 2nd ed. New York: J Wiley and Sons.
Taherzadeh, M., and Karimi, K. 2008. Pretreatment of lignocellulosic waste to improve ethanol and biogas production. International Journal Molecular Science. 9: 1621-1651.
Soest, P.Jv., and Wine, R.H. 1967. Use of detergents in the analysis of fibrous feed. IV. Determination of plant cell-wall contituents. Journal of the Association Analytical Chemist. 50: 50-55.
Wendish, F.K., and Kurtzner, H.J. 1992. Role of Streptomycetaceae in biodegradation. The Procaryotes, A Handbook on The Bacteria:
Ecophysiology, Isolaton, Identification, Application. Springer-Verlag. 2nd ed. New York: Balow A, Truper H, Dworkin M, Harder W, Schleifer KH.
Winarno, F.G. 2004. Kimia Pangan dan Gizi. PT Gramedia Pustaka Utama. Jakarta. 224.
Woiciechowski, A.L., Nitsche S., Pandey A., and Soccol, C.R. 2002. Acid and Enzymatic Hydrolysis to Recover Reducing Sugar from Cassava Baggase: An Economic Study. Brazilian Archieves of Biology and Technology, An International Journal. 45: 393-400.
Woldron, Jr.C.R., Becker-Vallone, C.A., Eveleigh, D.E. 1986. Isolation and characterization of cellulolytic actinomycete Microbispora bispora. Applied Microbiology Biotechnol. 24: 477-486.
Wyman, C.E. 2002. Potential Synergies and Challenges in Refining Cellulosic Biomass to Fuels. Biotechnol Progress.
Xu, L.H., Li, Q.R., and Jiang, C.L. 1996. Diversity of soil Actinomycetes in Yunnan, China. Applied Environmental Microbiology. 62: 244-248.
Yamac, M., and Tamer, A.U. 2008. Lignin degradation and acid precipitable polymeric lignin (APPL) accumulation by selected Streptomyces strain in submerged and solid state culture system. JABS. 2: 55-61.