ABSTRACT
BIO-PRETREATMENT OPTIMIZATION IN RICE STRAW SOLID STATE FERMENTATION BY ACTINOMYCETES
AcP-1 AND AcP-7 ISOLATE
By
MAJID RIMBANI
Rice straw waste is most abundant ligno-cellulosic biomass in Indonesia. Efforts to increase the economic value of rice straw is done by converting the polymer into simple sugars that could be utilized as a transition in the field of biotechnology products. This study was conducted to reduce the lignin content in rice straw in which hemicellulose and cellulose hydrolysis in order to be more effective. Two condition in fermentation has been set up, each time of incubation and different pH, to obtain optimum condition fermentation by two isolate Actinomycetes Acp-1 and AcP-7. Result of this treatment show that optimum condition reach at 15th day fermentation and pH 7,5. Some of chemical parameter which are used as guide to obtain the optimum fermentation condition have reached the peak at this condition. Fermentation by Actinomycetes AcP-1 isolat has optimum performance on APPL was 33,2 mg g-1 substrate, decrease of lignin content was 7,15 %, decrease of cellulose content was 10,4 %, ligninase activity 1,05 UmL-1 xylanase activity was 0,58 UmL-1, and cellulase activity was 0,77 UmL-1 respectively. On the other hand, fermentation by Actinomycetes AcP-7 isolat has optimum performance on APPL was 35,8 mg g-1 substrate, decrease of lignin content was 8,66 %, decrease of cellulose content was 10,91 %, ligninase activity 0,71 U mL-1 xylanase activity was 0,48 U mL-1, and cellulase activity was 0,63 U mL-1 respectively.
ABSTRAK
OPTIMASI BIO-PRETREATMENT JERAMI PADI SECARA FERMENTASI FASE PADAT OLEH ISOLAT
ACTINOMYCETES AcP-1 DAN AcP-7
Oleh
MAJID RIMBANI
Jerami padi merupakan biomassa berlignoselulosa yang banyak ditemukan di Indonesia. Upaya peningkatan nilai ekonomis dari jerami padi banyak dilakukan antara lain dengan memanfaatkannya sebagai sumber gula pereduksi yang dapat digunakan sebagai transisi produk senyawa kimia lainnya seperti etanol, asam sitrat, asam asetat dan produk fermentasi lainnya. Penelitian ini dilakukan untuk memecahkan permasalahan pretreatment jerami padi secara biologi yaitu dengan mengurangi kandungan lignin pada jerami padi sehingga proses hidrolisis hemiselulosa dan selulosa menjadi lebih efektif. Dua perlakuan diberikan masing-masing waktu fermentasi dan perbedaan pH untuk memperoleh kondisi optimum dengan melihat beberapa parameter kimia sebagai indikator. Dua isolat Actinomycetes AcP-1 dan AcP-7, yang digunakan masing-masing sebagai agen biologi bio-pretreatment menunjukkan waktu optimum yang sama yaitu pada hari ke-15 dan pada pH 7,5. Kesimpulan ini diambil dari parameter kimia yang menunjukkan nilai optimum pada waktu dan pH parameter yang diujikan. Hasil pengukuran beberapa parameter kimia pada kondisi fermentasi optimum oleh isolat AcP-1 untuk pencapaian APPL sebesar 33,2 mg/g substrat, kandungan lignin pada substrat menurun 7,15%, kandungan selulosa pada substrat menurun 10,4 %, aktivitas ligninase optimum sebesar 1,05 U/mL, aktivitas xilanase optimum sebesar 0,575 U/mL, aktivitas selulase optimum sebesar 0,77 U/mL. Sedangkan hasil pengukuran beberapa parameter kimia oleh isolat AcP-7 untuk pencapaian APPL sebesar 35,8 mg/g substrat, kandungan lignin pada substrat menurun 8,66 %, kandungan selulosa pada substrat menurun 10,91 %, aktivitas ligninase optimum sebesar 0,71 U/mL, aktivitas xilanase optimum sebesar 0,48 U/mL, aktivitas selulase optimum sebesar 0,63 U/mL.
DAFTAR ISI
Halaman
LEMBAR PENGESAHAN ... i
DAFTAR ISI ... ii
DAFTAR GAMBAR ... v
DAFTAR TABEL ... vi
I. PENDAHULUAN A.Latar Belakang ... 1
B.Tujuan Penelitian ... 3
C.Manfaat Penelitian ... 3
II. TINJAUAN PUSTAKA A.Jerami Padi ... 5
B.Pra-Perlakuan Jerami Padi ... 6
1. Pra-Perlakuan Secara Fisika Kimia ... 6
2. Pra-Perlakuan Secara Kimia ... 7
3. Pra-Perlakuan Secara Biologi ... 8
C.Lignoselulosa ... 9
1. Lignin ... 10
2. Hemiselulosa ... 11
3. Selulosa ... 12
D. Hidrolisis ... 13
1. Hidrolisis Enzim ... 14
2. Hidrolisis Asam ... 14
E. Actinomycetes ... 15
F. Fermentasi Fase Padat (Solid State Fermentation / SSF) ... 16
a. Pesiapan Substrat ... 18
b. Persiapan Inokulum ... 18
c. Persiapan Wadah ... 18
d. Inokulasi ... 19
e. Proses Fermentasi ... 19
f. Kulturasi ... 19
2. Keuntungan Fermentasi Fase Padat ... 19
G. Metode Pengukuran APPL (Acid Pricncipitable Polymeric Lignin) .. 19
H. Analisis Struktur Permukaan dengan Mikroskop ... 20
1. Mikroskop Cahaya ... 20
2. Mikroskop Stereo ... 22
3. Mikroskop Elektron ... 23
III. METODOLOGI PENELITIAN A.Waktu dan Tempat Penelitian ... 24
B.Alat dan Bahan ... 24
C.Prosedur Penelitian ... 25
1. Optimasi Fermentasi Fase Padat ... 25
2. Parameter Fermentasi Fase Padat ... 26
a. Pengukuran APPL ... 26
b. Pengukuran Kadar Lignin ... 26
c. Kadar Selulosa ... 27
d. Pengukuran Aktivitas Enzim Ligninase ... 28
e. Pengukuran Aktivitas Enzim Xilanase ... 29
f. Pengukuran Aktivitas Enzim Selulase ... 30
3. Analisis Struktur Permukaan dengan Mikroskop ... 30
4. Pembuatan media ... 31
a. Pembuatan Media YMA ... 31
b. Pembuatan Media YM ... 31
c. Pembuatan Media Fermentasi ... 31
5. Pembuatan pereaksi ... 32
a. Pembuatan Buffer Fosfat ... 32
b. Pembuatan Pereaksi DNS ... 32
IV. HASIL DAN PEMBAHASAN A. Optimasi Fermentasi Fase Padat... 34
1. Pengukuran APPL ... 35
2. Penurunan Kadar Lignin Fermentasi ... 37
3. Penurunan Kadar Selulosa Fermentasi ... 39
4. Pengukuran Aktivitas Ligninase ... 42
5. Pengukuran Aktivitas Xilanase ... 44
6. Pengukuran Aktivitas Selulase ... 46
C. Hasil Analisis Struktur Permukaan Substrat Hasil Fermentasi ... 49
V. KESIMPULAN A. Simpulan ... 51
B. Saran ... 52
DAFTAR PUSTAKA ... 53
I. PENDAHULUAN
A. Latar Belakang
Jerami padi merupakan limbah hasil pertanian tanaman padi yang jumlahnya melimpah di Provinsi Lampung. Menurut data BPS Provinsi Lampung pada periode 2009-2012 terjadi peningkatan produksi padi rata-rata 1,73 % pertahun dan pada tahun 2012 dihasilkan 3.101.455 ton padi. Dengan banyaknya produksi padi disetiap tahunnya, berarti terjadi pula peningkatan limbah jerami padi. Limbah jerami padi ini belum dimanfaatkan secara optimal, selama ini jerami padi dimanfaatkan oleh petani sebagai pakan ternak sekitar 22 %, pupuk kompos sekitar 20-29 % dan sisanya dibakar untuk menghindari penumpukkan (Ikhsan dkk., 2009).
Untuk memanfaatkan senyawa hemiselulosa dan selulosa yang terdapat pada jerami padi, perlu upaya untuk menghilangkan senyawa lignin, karena lignin dan hemiselulosa menghalangi degradasi selulosa. Proses penghilangan senyawa lignin dari ikatan hemiselulosa dan selulosa disebut pretreatment (Dashtban et al., 2009). Pretreatment dapat dilakukan dengan tiga cara yaitu secara fisika, kimia, dan biologi. Secara fisika dengan memperkecil ukuran bahan seperti menggiling dan memotong, secara kimia seperti perendaman dengan NaOH dan secara biologi dengan menggunakan mikroba penghasil enzim yang dapat menghidrolisis
lignoselulosa (Vadiveloo et al., 2009).
Pretreatment secara biologi atau bio-pretreatment, belum banyak digunakan dalam proses hidrolisis lignoselulosa dibanding proses pretreatmen secara kimia dan fisika. Penelitian ini dilakukan untuk mengembangkan perlakuan pendahuluan lignoselulosa dengan bio-pretreatment. Beberapa pertimbangan yang digunakan antara lain, perlakuan bio-pretreatment relatif memerlukan biaya yang lebih murah dan juga lebih aman bagi lingkungan, walaupun kelemahanya, perlakuan bio-pretreatment memerlukan waktu yang lebih lama untuk mendegradasi senyawa lignoselulosa (Hendriks and Zeeman, 2009).
Proses bio-pretreatment yang dilakukan pada penelitian ini menggunakan isolat Actinomycetes AcP-1 dan AcP-7 dengan metode fermentasi fase padat. Optimasi fermentasi meliputi optimasi pH pengukuran beberapa parameter yang dilihat dari pengukuran APPL, kadar lignin, kadar selulosa, aktivitas enzim ligninase,
aktivitas enzim xilanase, aktivitas enzim selulase, selama proses fermentasi jerami padi oleh isolat Actimomycetes AcP-1dan AcP-7.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mendapatkan kondisi fermentasi optimum dalam bio-pretreatment jerami padi oleh isolat Actinomycetes AcP-1dan AcP-7.
2. Mengkarakterisasi beberapa parameter dalam bio-pretreatment seperti pengukuran APPL, kadar lignin, kadar selulosa, aktivitas enzim ligninase, aktivitas enzim xilanase dan aktivitas enzim selulase, jerami padi oleh isolat Actimomycetes AcP-1dan AcP-7.
3. Mengetahui pengaruh bio-pretreatment terhadap permukaan jerami padi melalui analisis mikroskop.
C. Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. Jerami Padi
Jerami padi merupakan biomassa yang secara kimia merupakan senyawa
berlignoselulosa. Menurut Saha (2004) komponen terbesar penyusun jerami padi adalah selulosa (35-50 %), hemiselulosa (20-35 %) dan lignin (10-25 %) dan zat lain penyusun jerami padi.Selulosa dan hemiselulosa merupakan senyawa yang bernilai ekonomis jika dikonversi menjadi gula-gula sederhana. Gula-gula hasil konversi tersebut selanjutnya dapat difermentasi untuk menghasilkan produk-produk bioteknologi seperti bioetanol, asam glutamat, asam sitrat dan lainnya.
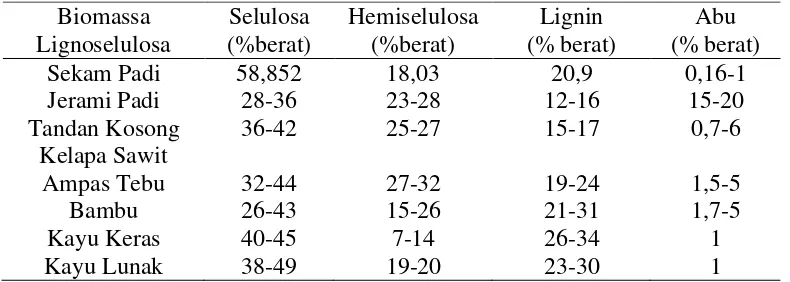
[image:13.595.119.514.589.730.2]Perbandingan komposisi kimia jerami padi dengan biomassa lainnya dapat dilihat pada Tabel 1.
Tabel 1. Komposisi kimia beberapa biomassa Biomassa Lignoselulosa Selulosa (%berat) Hemiselulosa (%berat) Lignin (% berat) Abu (% berat)
Sekam Padi 58,852 18,03 20,9 0,16-1
Jerami Padi 28-36 23-28 12-16 15-20
Tandan Kosong Kelapa Sawit
36-42 25-27 15-17 0,7-6
Ampas Tebu 32-44 27-32 19-24 1,5-5
Bambu 26-43 15-26 21-31 1,7-5
Kayu Keras 40-45 7-14 26-34 1
Kayu Lunak 38-49 19-20 23-30 1
B. Pra-Perlakuan Jerami Padi
Menurut Fridia (1989), proses pra-perlakuan atau pretreatment merupakan perlakuan pendahuluan terhadap bahan lignoselulosa sehingga mempermudah pelepasan hemiselulosa dan selulosa. Ingram dan Doran (1995), menyatakan bahwa struktur senyawa lignoselulosa merupakan bentuk kompleks dari
hemiselulosa dan selulosa yang terikat kuat dengan lignin. Fungsi lignin adalah mengikat sel-sel tanaman satu dengan lainnya dan sebagai pengisi dinding sel sehingga dinding sel tanaman menjadi keras dan kaku (Dellweg, 1983).
Perlakuan pretreatment dapat dilakukan secara fisik (penggilingan, pemanasan dengan uap, radiasi atau pemanasan dengan udara kering), secara kimia (pelarut, larutan pengembang, gas SO2) dan secara biologis dengan menggunakan
mikroorganisme yang dapat menghidrolisi lignoselulosa (Vadiveloo et al., 2009).
1. Pra-Perlakuan Secara Kimia Fisika
Proses pra-perlakuan secara kimia fisika meliputi sistem uap, serat amonia dan penguapan denganCO2. Dalam proses penguapan, biomassa di treatment dengan sistem jenuh pada tekanan tinggi yang menyebabkan bahan mengalami
2. Pra-Perlakuan Secara Kimia
Metode kimia digunakan untuk pretreatment biomassa adalah ozonolisis, hidrolisis asam, hidrolisis basa dan delignifikasi oksidasi. Diantara metode-metode ini hidrolisis asam dan hidrolisis basa biasa digunakan untuk
mentreatment biomassa. Ozon dapat digunakan untuk mendegradasi lignin dan hemiselulosa pada kebanyakan bahan-bahan biomassa seperti residu hasil pertanian, bagase, jerami, batang jagung dan potongan kayu(Vidal and Molinier, 1988). Walaupun proses ini mahal, proses ini sangat efektif menghilangkan lignin dan proses tidak menghasilkan residu beracun. Dalam hidrolisis asam, biasanya menggunakan asam sulfat dan asam klorida pekat untuk mentreatment bahan biomassa, tetapi asam pekat adalah beracun, korosif, dan berbahaya dan juga proses tidak ekonomis dalam aplikasi secara komersial (Sivers dan Zacchi, 1995).
Hidrolisis asam encer telah digunakan dengan sukses untuk pretreatment biomassa selolusa. Hidrolisis asam encer menghasilkan kondisi kurang baik selama pretreatment dan menghasilkan yield konversi hemiselulosa/xilan menjadi xilosa tinggi. Karena kebanyakan biomassa mempunyai kandungan hemiselulosa hingga sepertiga dari total karbohidrat, proses ini memperbaiki produksi etanol secara keseluruhan dan proses menjadi ekonomis (Hinman et aI., 1992).
amonia sering digunakan untuk pretreatment biomassa dan pengaruh pretreatment tergantung pada kandungan lignin didalam batang tanaman (Bjerre et aI., 1996).
3. Pra-Perlakuan Secara Biologi
Proses pra-perlakuan secara biologi dilakukan menggunakan mikroorganisme untuk menghilangkan lignin dan hemiselulose. Terdapat beberapa kelompok mikroorganisme yang dapat mendegradasi lignin seperti kelompok Actinomycetes yang dapat menghasilkan enzim ligninase yang dapat menghidrolisis lignin. Dan kelompok jamur seperti Aspergillus niger yang dapat menghasilkan enzim xilanase (Gawande dan Kamat, 1999). Enzim xilanase dapat mendegradasi hemiselulosa sehingga ikatan antara lignin dan selulosa dapat diputus.
Hatakka (1983) menggunakan jamur pelapuk putih untuk mentreatment batang tanaman anggur dan memperoleh 35 % batang dapat dikonversikan menjadi gula reduksi dalam 5 minggu. Akin et al (1995) juga menyampaikan penggunaan jamur pelapuk putih untuk mendegradasi lignin dari rumput. Enzim lain seperti polifenol oksidase, lactase, enzim penghasil H2O2 dan enzim mereduksi quinon dapat juga digunakan untuk menghilangkan lignin. Walaupun proses pretreatment secara biologi memerlukan enegi rendah dan dampak lingkungan kurang, proses pretreatment memerlukan waktu yang panjang (Sun and Cheng,2002).
Tujuan dari pretreatment adalah untuk membuka struktur lignoselulosa agar selulosa menjadi lebih mudah diakses oleh enzim yang memecah polymer polisakarida menjadi monomer gula. Tujuan pretreatment secara skematis ditunjukkan pada Gambar 1.
Gambar 1. Skema pretreatment biomassa lingoselulosa (Mosier et al., 2005).
C. Lignoselulosa
Bahan lignoselulosa merupakan biomassa yang berasal dari tanamandengan
komponen utama lignin, hemiselulosadan selulosa (Fujita and Harada,1991).
Ketersediaannya yang cukup melimpah, terutama sebagai limbahpertanian,
perkebunan, dan kehutanan, menjadikan bahan ini berpotensi sebagaisalah satu
sumber energi melalui proses konversibaik proses fisika, kimiamaupun biologis.
1. Lignin
[image:18.595.173.456.358.462.2]Lignin merupakan zat organik yang memiliki polimer banyak dan merupakan hal yang penting dalam dunia tumbuhan. Lignin tersusun atas jaringan polimer fenolik yang berfungsi merekatkan serat selulosa dan hemiselulosa sehingga menjadi sangat kuat (Sun dan Cheng, 2002). Berbeda dengan selulosa yang terbentuk dari gugus karbohidrat, struktur kimia lignin sangat kompleks dan tidak berpola sama. Gugus aromatik ditemukan pada lignin, yang saling dihubungkan dengan rantai alifatik, yang terdiri dari 2-3 karbon. Proses pirolisis lignin menghasilkan senyawa kimia aromatis berupa fenol, terutama kresol.
Gambar 2. Satuan penyusun lignin (Sixta, 2006).
Dalam kayu, kandungan lignin berkisar antara 20 % hingga 40 %. Kayu lunak normal mengandung 26-32 % lignin sedangkan kandungan lignin kayu keras adalah 35-40 %. Lignin yang terdapat dalam kayu keras sebagian larut selama hidrolisis asam. Pada batang lignin berfungsi sebagai bahan pengikat komponen penyusun lainnya, sehingga suatu pohon bisa berdiri tegak (seperti semen pada sebuah batang beton).
Kandungan lignin dalam kayu daun jarum lebih tinggi daripada dalam kayu daun
daun jarum dan dalam kayu daun lebar (Fengel dan Wegener, 1995).Selain itu
lignin merupakan tandon karbon utama di dalam biofer, kalau dihitung kira-kira 30% dari 14 x 1012 kg karbon disimpan di dalam lignin tanaman setiap tahunnya. Lignin merupakan salah satu komponen utama sel tanaman, karena itu lignin juga memiliki dampak langsung terhadap karakteristik tanaman. Misalnya saja, lignin sangat berpengaruh pada proses pembuatan pulp dan kertas. Struktur kimia lignin mengalami perubahan di bawah kondisi suhu yang tinggi dan asam. Pada reaksi dengan temperatur tinggi mengakibatkan lignin terpecah menjadi partikel yang lebih kecil dan terlepas dari selulosa (Taherzadeh dan Karimi, 2008).
2. Hemiselulosa
Hemiselulosa merupakan polisakarida yangmempunyai berat molekul lebih kecil daripada selulosa.Berbeda denganselulosa yang hanya tersusun atas glukosa, hemiselulosa tersusun dari bermacam-macamjenis gula. Lima gula netral, yaitu glukosa, mannosa, dan galaktosa (heksosan) serta xilosa dan arabinosa (pentosan)
merupakan konstituen utama hemiselulosa (Fengel dan Wegener, 1995). Berbeda
dari selulosa yang merupakan homopolisakarida dengan monomer glukosa dan
derajat polimerisasi yang tinggi (10.000–14.000 unit), rantai utama hemiselulosa
dapat terdiri atas hanya satu jenis monomer (homopolimer), seperti xilan, atau
terdiri atas dua jenis atau lebih monomer (heteropolimer), seperti glukomannan.
Gambar 3. (a) Struktur xilan dan (b) glukomannan yang merupakan hemiselulosa dominan pada graminiceae dan tumbuhan (Sixta, 2006)
Molekul hemiselulosalebih mudah menyerap air, bersifat plastis, dan mempunyai permukaan kontakantar molekul yang lebih luas dari selulosa. Hemiselulosa merupakan istilah umum bagi polisakarida yang larut dalam alkali. Hemiselulosa
sangat dekat asosiasinya dengan selulosa dalam dinding sel tanaman (Fengel dan
Wegener, 1995).
3. Selulosa
Selulosa merupakan polimer yang tersusun dari unit-unit β-1,4-glukosa yang dihubungkan dengan ikatan β-1,4-D-glikosida. Selulosa merupakan polisakarida
[image:20.595.152.474.90.248.2]yang terdiri atas satuan-satuan dan mempunyai massa molekul relatif yang sangat tinggi, tersusun dari 2.000-3.000 glukosa. Rumus molekul selulosa adalah (C6H10O5)n.
[image:20.595.123.503.663.726.2]Sifat fisik selulosa adalah zat yang padat, kuat, berwarna putih, dan tidak larutdalam alkohol dan eter. Kayu terdiri dari 50 % selulosa, daun kering mengandung 10-20 % selulosa, sedangkan kapas mengandung 90 % selulosa. Selulosa digunakan dalam industri pulp, kertas, dan krayon.
Selulosa adalah unsur struktural dan komponen utamadinding sel dari pohon dan tanaman tinggi lainnya. Senyawa ini juga dijumpai dalamtumbuhan rendah seperti paku, lumut, ganggang, dan jamur. Serat alami yang palingmurni ialah serat kapas, yang terdiri dari sekitar 98% selulosa. Selulosa hampir tidak pernah ditemui dalam keadaan murni di alam,melainkan selalu berikatan dengan bahan lain seperti lignin dan hemiselulosa.
Molekul selulosa merupakan mikrofibildari glukosa yang terikat satu dengan lainnya membentuk rantai polimer yangsangat panjang. Adanya lignin serta hemiselulosa di sekeliling selulosamerupakan hambatan utama untuk
menghidrolisis selulosa (Sjostrom,1995). Selulosa dapat dihidrolisis
menjadiglukosa dengan menggunakan media air dan dibantu dengan katalis asam atauenzim. Selanjutnya glukosa yang dihasilkan dapat difermentasi menjadi produk fermentasi yang nantinya dapat diolah lagi menjadi etanol.
D. Hidrolisis
Hidrolisis meliputi proses pemecahan senyawa polisakarida di dalam biomassa lignoselulosa, yaitu: selulosa dan hemiselulosa menjadi monomer gula
glukosa, sedangkan hemiselulosa menghasilkan beberapa monomer gula pentosa (C5) dan heksosa (C6). Secara umum teknik hidrolisis dibagi menjadi dua, yaitu: hidrolisis dengan enzim dan hidrolisis dengan asam.
1. Hidrolisis Enzim
Hidrolisis enzim merupakan proses penguraian suatu polimer yang kompleks menjadi monomer penyusunnya dengan menggunakan enzim (Perez et al., 2002). Hidrolisis enzimatis memiliki beberapa keuntungan dibandingkan hidrolisis asam, antara lain: tidak terjadi degradasi gula hasil hidrolisis, kondisi proses yang lebih lunak (suhu rendah dan pH netral), berpotensi memberikan hasil yang tinggi dan biaya pemeliharaan peralatan relatif rendah karena tidak ada bahan yang korosif (Taherzadeh and Karimi, 2008).
Beberapa kelemahan dari hidrolisis enzimatis antara lain adalah membutuhkan waktu yang lebih lama dan kerja enzim dihambat oleh produk. Di sisi lain harga enzim saat ini lebih mahal daripada asam sulfat, namun demikian pengembangan terus dilakukan untuk menurunkan biaya dan meningkatkan efisiensi hidrolisis maupun fermentasi (Sanchez and Cardona, 2007).
2. Hidrolisis asam
Di dalam metode hidrolisis asam, biomassa lignoselulosa dipaparkan dengan asam pada suhu dan tekanan tertentu selama waktu tertentu, dan menghasilkan
asam perklorat, dan HCl. Asam sulfat merupakan asam yang paling banyak diteliti dan dimanfaatkan untuk hidrolisis asam (Taherzadeh and Karimi,
2008).Hidrolisis asam dapat dikategorikan melalui dua pendekatan umum, yaitu hidrolisis asam konsentrasi tinggi pada suhu rendah dan hidrolisis asam
konsenrasi rendah pada suhu tinggi. Pemilihan antara dua cara tersebut pada umumnya didasarkan pada beberapa hal yaitu laju hidrolisis, hasil total hidrolisis, tingkat degradasi produk dan biaya total proses produksi (Kosaric et al., 1983).
E. Actinomycetes
Actinomycetes merupakan genus bakteri berfilament yang membentuk miselia, bersifat gram positif, dan sebagian besar membentuk spora.Actinomycetessering dikelompokkan kedalam mikroorganisme peralihan antara bakteri dan jamur karena mikroorganisme ini mempunyai sifat-sifat seperti bakteri dan jamur.Oleh sebab itu, lingkungan yang menjadi habitat bagi bakteri dan jamur adalah
lingkungan yang tepat bagi kelangsungan hidup Actinomycetes, sehingga Actinomycetesdapat tersebar luas di alam (Paul and Clark, 1989).
Walaupun Actinomycetes dikatakan sebagai mikroorganisme peralihan antara bakteri dan fungi (Alexander, 1977), tetapi Actinomycetes mempunyai ciri yang khas, yang cukup membatasinya menjadi satu genus yang jelas berbeda. Pada medium cair, pertumbuhan Actinomycetes ditandai dengan keruhnya medium dan terbentuk lapisan tipis di permukaan medium. Menurut Rao (1994), pada
koloni bakteri tumbuh dengan cepat dan berlendir sedangkan Actinomycetes muncul perlahan dan berbubuk serta melekat erat pada permukaan agar. Umumnya, Actinomycetes tidak toleran terhadap asam dan jumlahnya menurun pada pH 5,0. Rentang pH dan temperatur yang cocok untuk pertumbuhan Actinomycetes ini sekitar 6,5–8,0 dan 25–30oC. Namun, ada beberapa
Actinomycetes termofilik yang dapat tumbuh pada temperatur sekitar 55–65oC seperti Thermoactinomycetes dan Streptomyces. Genus bakteri ini memiliki keragaman fisiologis yang tinggi, hal ini dapat dilihat dari berbagai enzim ekstraseluler yang dihasilkannya serta ribuan metabolit yang dapat memberikan efek penghambatan terhadap mikroba di sekitarnya (Ensign, 1992).
Medium yang baik untuk menumbuhkan Actinomycetes adalah medium yang mengandung glukosa, gliserol atau tepung sebagai sumber karbon; nitrat atau kasein sebagai sumber nitrogen dan mineral–mineral tertentu seperti NaCl,
K2HPO4, MgSO4.7H2O, CaCO3, FeSO4.7H2O. Inkubasi biasanya selama 2-7 hari.
F. Fermentasi Fase Padat (Solid State Fermentation / SSF)
ekstraseluler seperti sejumlah filamen jamur dan beberapa bakteri (Actinomycetes dan satu strain dari Bacillus) (Pandey et al., 2008).
Fermentasi fase padat atau sering disebut Solid State Fermentation (SSF) pertama kali dikenalkan oleh Takagi et al(1977), yang telah berhasil mengkombinasikan enzim selulase dan yeast Sacharomyces cerevisiae untuk fermentasi gula menjadi etanol. Fermentasi fase padat dapat didefinisikan sebagai proses fermentasi yang melibatkan zat padat dalam suatu fasa cair (Moo-Young et al.,1983). Proses SSF sebenarnya hampir sama dengan proses hidrolisis dan proses fermentasi, tetapi proses hidrolisis dan fermentasi pada SSF dilakukan dalam satu tempat. Proses SSF membutuhkan bahan mentah alami sebagai sumber karbon dan bahan inert sebagai matriks padatan. Substrat padat (matrik) harus cukup akan kelembapan dan memiliki area permukaan substrat yang lebar.
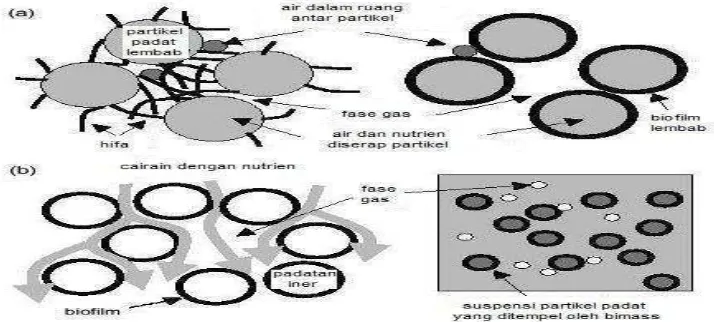
Berdasarkan dari sifat fisik Fermentasi Fase Padat dibagi menjadi dua kelompok, antara lain:
1. Fermentasi padatan dengan kelembaban rendah atau dengan agitasi berkala. 2. Fermentasi padatan tersuspensi dalam kolom dengan sirkulasi larutan. Jamur
Gambar 5. Proses fermentasi fase padat (a) perubahan partikel padat yang lembab dan fase gas dalam sistem Fermentasi Fase Padat melibatkan hifa dan organisme uniseluler, (b) Sistem lain yang melibatkan pertumbuhan pada zat padat, tetapi tidak didefinisikan sebagai Fermentasi Fase Padat selama jumlah air antar partikel besar (Moo-Young et al.,1983).
1. Proses Fermentasi Fase Padat
Mitchel et al(2006) juga menjelaskan tahapan-tahapan proses Fermentasi Fase Padat secara umum, antara lain:
a. Persiapan substrat, dimana substrat harus dipotong, digiling, dipecahkan, atau dibuat menjadi butiran kecil. Dengan penambahan air dan nutrisi disebut dengan pra-perawatan substrat untuk menambah ketersediaan gizi. b. Persiapan Inokulum, tipe dan persiapan inokulum tergantung pada
mikroorganisme yang digunakan. Banyak proses fermentasi fase padat melibatkan hifa khamir, maka digunakan spora hasil inokulasi. Tujuan dari langkah ini untuk mengembangkan sebuah inokulum dengan tingkat
kelangsungan hidup mikoorganisme yang tinggi.
d. Inokulasi dan pengerjaan, pengerjaan tahapan ini dengan menyebarkan substrat pada media yang telah disterilkan secara hati-hati untuk menghindari kontaminasi dari mikroorganisme yang tidak diinginkan.
e. Proses Fermentasi Fase Padat, pada proses ini banyak hal yang harus
diperhatikan antara lain pH medium, suhu, dan waktu inkubasi, kelembaban. f. Kultirasi, pada tahapan ini memerlukan bantuan mekanis untuk memisahkan substrat padat dari medium. Penggunaan kertas saring dan sentrifugasi dapat dipakai untuk memisahkan substrat.
2. Keuntungan Fermentasi Fase Padat
Fermentasi fase padat memiliki beberapa keuntungan, antara lain biaya lebih murah, media produksi dapat menggunakan residu agroindustri, menggunakan sedikit air, limbah yang dihasilkan sedikit, proses sederhana, menggunakan wadah dalam jumlah kecil tetapi menghasilkan konsentrasi produk tinggidan proses aerasi lebih mudah.
G. Metode Pengukuran APPL (Acid Principitable Polymeric Lignin)
menghasilkan polimer lignin bebas yang larut dalam air. Dengan penambahan asam, lignin akan mengendap dan menghasilkan kadar APPL sehingga analisis gravimetri dapat digunakan untuk mengkuantifikasi biokonversi lignin tersebut (Yamac and Tamer, 2008).
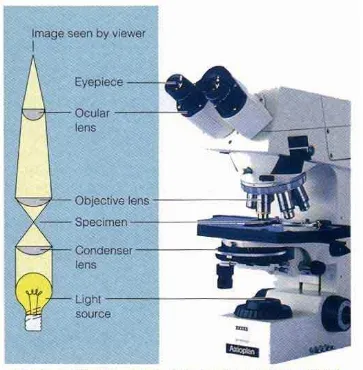
H. Analisis Permukaan Sampel dengan Mikroskop
Mikroskop merupakan alat bantu yang memungkinkan kita dapat mengamati obyek yang berukuran sangat kecil. Hal ini membantu memecahkan persoalan manusia tentang organisme yang berukuran kecil.Ada dua jenis mikroskop berdasarkan pada kenampakan obyek yang diamati, yaitu mikroskop dua dimensi atau mikroskop cahaya dan mikroskop tiga dimensi atau mikroskop
stereo.Berdasarkan sumber cahayanya, mikroskop dibedakan menjadi mikroskop cahaya dan mikroskop elektron.
1. Mikroskop Cahaya
Di bawah tabung mikroskop terdapat meja mikroskop yang merupakan tempat preparat.Sistem lensa yang ketiga adalah kondensor.Kondensor berperan untuk menerangi obyek dan lensa-lensa mikroskop yang lain.
Pada mikroskop konvensional, sumber cahaya masih berasal dari sinar matahari yang dipantulkan dengan suatu cermin datar ataupun cekung yang terdapat dibawah kondensor.Cermin ini akan mengarahkan cahaya dari luar kedalam kondensor. Pada mikroskop modern sudah dilengkapi lampu sebagai pengganti sumber cahaya matahari.
Lensa obyektif bekerja dalam pembentukan bayangan pertama.Lensa ini menentukan struktur dan bagian renik yang akan terlihat pada bayangan akhir. Ciri penting lensa obyektif adalah memperbesar bayangan obyek dan mempunyai nilai apertura (NA).Nilai apertura adalah ukuran daya pisah suatu lensa obyektif yang akan menentukan daya pisah spesimen, sehingga mampu menunjukkan struktur renik yang berdekatan sebagai dua benda yang terpisah.
Lensa okuler, merupakan lensa mikroskop yang terdapat di bagian ujung atas tabung, berdekatan dengan mata pengamat.Lensa ini berfungsi untuk
memperbesar bayangan yang dihasilkan oleh lensa obyektif.Perbesaran bayangan yang terbentuk berkisar antara 4-25 kali.
menjadi satu. Perbesaran akan kurang bermanfaat jika daya pisah mikroskop kurang baik.
2. Mikroskop Stereo
Mikroskop stereo merupakan jenis mikroskop yang hanya bisa digunakan untuk benda yang berukuran relatif besar.Mikroskop stereomempunyai perbesaran 7 hingga 30 kali.Benda yang diamati dengan mikroskop ini dapat terlihat secara tiga dimensi.Komponen utama mikroskop stereo hampir sama dengan mikroskop cahaya.Lensa terdiri atas lensa okuler dan lensa obyektif. Beberapa perbedaan dengan mikroskop cahaya adalah:
1. Ruang ketajaman lensa mikroskop stereo jauh lebih tinggi dibandingkan dengan mikroskop cahaya sehingga kita dapat melihat bentuk tiga dimensi benda yang diamati.
2. Sumber cahaya berasal dari atas sehingga obyek yang tebal dapat diamati.
Perbesaran lensa okuler biasanya 10 kali, sedangkan lensa obyektif menggunakan sistem zoom dengan perbesaran antara 0,7 hingga 3 kali, sehingga perbesaran total obyek maksimal 30 kali. Pada bagian bawah mikroskop terdapat meja
3. Mikroskop Elektron
Sebagai gambaran mengenai mikroskop elektron kita uraikan sedikit dalam buku ini. Mikroskop elektron mempunyai perbesaran sampai 100 ribu kali, elektron digunakan sebagai pengganti cahaya. Mikroskop elektron mempunyai dua tipe, yaitu mikroskop elektron scanning (SEM) dan mikroskop elektron transmisi (TEM). SEM digunakan untuk studi detil arsitektur permukaan sel (atau struktur renik lainnya), dan obyek diamati secara tiga dimensi. Sedangkan TEM
[image:31.595.133.496.334.704.2]digunakan untuk mengamati struktur detil internal sel.
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini sudah dilaksanakan dari bulan Februari sampai bulan Juli 2013 di Laboratorium Instrumentasi dan Biokimia Jurusan Kimia FMIPA Unila.
B. Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini antara lain autoclave model S-90N, Laminar air flow CRUMA model 9005-FL, Inkubator P-Selecta,
Spektrofotometer UV-VIS Hitachi U-2010, Mikroskop Cahaya Binokuler Double Layer XSZ 107T Blesindo, shaker inkubator, oven, lemari pendingin, neraca analitik, jarum ose, magnetic stirrer, penangas air, pH meter, Erlenmeyer, cawan Petri, tabung reaksi, mikropipet, dan peralatan umum laboratorium lainnya.
Sulfat (H2SO4) pekat, Asam Nitrat (HNO3) pekat, Asam Asetat Glasial 80 %, veratil alkohol, buffer fosfat, DNS, H2O2, akuades, dan kertas saring.
C. Prosedur Penelitian
1. Optimasi Fermentasi Fase Padat
2. Parameter Fermentasi Fase Padat
a. Pengukuran APPL
Sebanyak 10 mL filtrat yang diperoleh dari hasil fermentasi ditambahkan 0,5 mL HCl 12 M. Lalu disentrifugasi pada 16.000 rpm selama 30 menit. Filtrat
kemudian dibuang, endapan yang diperoleh dicuci dengan HCl encer dan dikeringkan pada 100-105 ºC selama 1-2 jam. Berat APPL yang diperoleh dikonversikan sebagai persentase APPL per-gram substrat selama periode fermentasi (Yamac and Tamer, 2008).
Untuk menghitung % APPL per-gram substrat persamaan berikut:
Keterangan:
A = Berat lignin yang terendapkan + tabung (g) B = Berat tabung (g)
C = Berat sampel jerami padi (g)
b. Pengukuran Kadar Lignin
Sebanyak 1 g serbuk jerami padi hasil fermentasi berukuran ± 40 mesh yang sudah dikeringkan, selanjutnya dimasukkan ke dalam Erlenmeyer 250 mL
kemudian ditambahkan 0,2 mL H2SO4 16 M. Kemudian didiamkan selama 2 jam dan dikocok perlahan-lahan. Sampel dilarutkan dalam 250 mL akuades,
Kertas saring beserta residu dipanaskan pada suhu 100-105 ºC selama 1-2 jam. Kertas saring didinginkan dan ditimbang bobotnya (B). Kertas saring dengan residu diabukan dengan muffle furnace pada suhu 600 ºC kemudian didinginkan dan ditimbang bobotnya (C).
Keterangan:
B = Bobot kertas saring dan residu setelah dioven (g) A = Bobot kertas saring (g)
C = Bobot abu (g) (AOAC, 1982).
c. Pengukuran Kadar Selulosa
Sebanyak 1 g serbuk jerami padi hasil fermentasi berukuran ± 40 mesh yang sudah dikeringkan, selanjutnya dimasukkan ke dalam labu bundar, tambahkan 15 mL asam asetat 80 % dan 1,5 mL asam nitrat 14 M, kemudian direfluks selama 20 menit. Selanjutnya dilakukan penyaringan dengan menggunakan kertas saring Whatman No. 91 yang telah diketahui bobotnya (A). Setelah dilakukan penyaringan, padatan hasil dari refluks dicuci dengan etanol. Erlenmeyer dan corong dibilas dengan air suling sebanyak 3 kali. Kertas saring beserta residu dikeringkan pada oven dengan suhu 100-105 oC selama 1-2 jam. Kertas saring didinginkan dan ditimbang bobotnya (B). Kertas saring dengan residu diabukan pada suhu 540 oC, lalu didinginkan ditimbang bobotnya (C).
Keterangan:
B = Bobot kertas saring dan residu setelah dioven (g) A = Bobot kertas saring (g)
C = Bobot abu (g)
d. Pengukuran Aktivitas Enzim Ligninase
Pengukuran aktivitas enzim ligninase dilakukan dengan cara mengambil 1,6 mL campuran 2,0 mM veratil alkohol, 0,4 mM H2O2 dan 50 mM buffer fosfat pH optimum. Larutan ditambahkan 0,4 mL filtrat hasil fermentasi, diinkubasi 5 menit pada suhu 25 ºC. Selanjutnya dipanaskan pada suhu 100 ºC dan pengukuran absorbansi dilakukan pada 310 nm.
Satu unit lignin peroksidase didefinisikan sebagai jumlah enzim yang dapat
mengubah 1 mol veratil alkohol menjadi veratraldehid pada kondisi optimumnya. Untuk menentukan konsentrasi veratraldehid digunakan persamaan berikut:
Keterangan: A = Absorbansi
ε = Ekstensi molar veratraldehid (λ300 M-1
cm-1) b = Tebal kuvet (1 cm)
c = Konsentrasi (M), (Yadav and Yadav, 2005)
Untuk menentukan aktivitas unit enzim digunakan persamaan berikut:
Keterangan:
c = konsentrasi ( mol / mL) v = volume sampel
FP = faktor pengenceran.
e. Pengukuran Aktivitas Xilanase
Pengukuran aktivitas enzim dilakukan untuk mengetahui enzim dalam menghasilkan xilosa per menit. Aktivitas xilanase diujikan dengan substrat birchwood xilan. Sampel: Sebanyak 1 mL substrat 0,5 % birchwood xilan ditambahkan 0,9 mL buffer fosfat 0,02 M pH optimum. Kemudian larutan ini ditambahkan 0,1 mL filtrat hasil fermentasi (ekstrak kasar enzim) dihomogenisasi dan diinkubasi pada suhu 30 oC selama 30 menit selanjutnya ditambahkan 2 mL pereaksi DNS dan dipanaskan pada 100 oC selama 15 menit dan didinginkan pada suhu ruang. Kontrol : Sebanyak 1 mL substrat 0,5 % birchwood xilan
ditambahkan 0,9 mL 0,2 M buffer fosfat pH optimum lalu diinkubasi pada suhu 30 oC selama 30 menit. Kemudian ditambahkan 0,1 mL ekstrak enzim dan 2 mL pereaksi DNS dan segera dipanaskan pada suhu 100 oC selama 15 menit dan didinginkan pada suhu ruang. Pengukuran absorbansi masing-masing larutan dilakukan pada 540 nm.
Satu unit aktivitas enzim xilanase didefinisikan sebagai jumlah mol xilosa yang diihasilkan per menit untuk setiap mL enzim pada kondisi optimumnya.
( )
f. Pengukuran Aktivitas Selulase
Pengukuran aktivitas enzim selulase diuji dengan melihat aktivitas endoglukanase dengan pengujian enzim pada substrat karboksimetil selulosa (CMC, Sigma). Substrat: Sebanyak 1 mL substrat 0,5 % CMC ditambahkan 0,9 mL buffer fosfat 0,02 M pH optimum. Kemudian larutan ini ditambahkan 0,1 mL filtrat hasil fermentasi (ekstrak kasar enzim) dihomogenisasi dan diinkubasi pada suhu 30 oC selama 30 menit selanjutnya ditambahkan 2 mL pereaksi DNS dan dipanaskan pada 100 oC selama 15 menit dan didinginkan pada suhu ruang. Kontrol:
Sebanyak 1 mL substrat 0,5 % karboksimetil selulosa (CMC, Sigma) ditambahkan 0,9 mL 0,2 M buffer fosfat pH optimum lalu diinkubasi pada suhu 30 oC selama 30 menit. Kemudian ditambahkan 0,1 mL ekstrak enzim dan 2 mL pereaksi DNS dan segera dipanaskan pada suhu 100 oC selama 15 menit dan didinginkan pada suhu ruang. Pengukuran absorbansi masing-masing larutan dilakukan pada 540 nm.
Satu unit aktivitas enzim selulase didefinisikan sebagai jumlah mol glukosa yang diihasilkan per menit untuk setiap ml enzim pada kondisi optimumnya.
(
)
3. Analisis Permukaan dengan Mikroskop Cahaya
antara sampel yang sudah difermentasi dan sampel yang belum difermentasi ±0,01 mm, bila perlu setipis mungkin sehingga dengan mudah kita melihat struktur permukaanya. Sampel diletakkan pada preparat dan diatur perbesaranya 100 x.
4. Pembuatan Media
a. Pembuatan Media YMA (Yeast Malt Agar)
Medium YMA terdiri dari 4 g ekstrak khamir, 10 g ekstrak malt, 15 g glukosa, 15 g agar-agar per 1 Liter media, dimasukkan ke dalam autoklaf selama 15 menit pada suhu 121 ºC dan tekanan 2 atm, kemudian ditambahkan 50 µg/L Nistatine dan 25 µg /L Streptomycine, dan secara aseptis dimasukkan ke cawan petri.
b. Pembuatan Media Inokulum YM (Yeast Malt)
Medium YM terdiri dari 4 g ekstrak khamir, 10 g ekstrak malt dan 15 g glukosa per 1 Liter media, dimasukkan ke dalam autoklaf selama 15 menit pada suhu 121 ºC dan tekanan 2 atm.
c. Pembuatan Media Fermentasi
Medium fermentasi terdiri dari 2 g jerami padi, 6 g ekstrak khamir, 5,3 g Na2HPO4, 1,98 g KH2PO4, 0,2 g MgSO4.7H2O, 0,2 g NaCl, 0,05 g
5. Pembuatan pereaksi
a. Pembuatan Buffer fosfat
1. Larutan Stok A (NaH2PO4·2H2O 0,2 M)
Sebanyak 27,8 g NaH2PO4·2H2O dilarutkan ke dalam 1000 mL akuades. 2. Larutan Stok B (Na2HPO4·2H2O 0,2 M)
Sebanyak 35,6 g Na2HPO4·2H2O dilarutkan ke dalam 1000 mL akuades.
b. Pembuatan Pereaksi DNS
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa: 1. Fermentasi optimum untuk perlakuan bio-pretreatment terhadap substrat
jerami padi menggunakan isolat AcP-1 dan AcP-7 dicapai pada hari ke 15 dan pH 7,5.
2. Hasil pengukuran beberapa parameter menunjukkan pada kondisi optimum fermentasi menggunakan isolat AcP-1 menghasilkan APPL sebesar 29,6 mg/g substrat, kadar lignin sebesar 9,25 %, kadar selulosa sebesar 20,72 %,
aktivitas enzim ligninase sebesar 0,71 U/mL, aktivitas enzim xilanase sebesar 0,57 U/mL dan aktivitas enzim selulase sebesar 0,77 U/mL.
4. Hasil analisis permukaan jerami padi menggunakan mikroskop dengan perbesar 100x menunjukkan isolat AcP-1 dan AcP-7 mampu mendegradasi senyawa lignin.
B. Saran
Berdasarkan hasil penelitian yang diperoleh pada penelitian ini, maka untuk menyempurnakan hasil yang diperoleh, penelitian selanjutnya disarankan untuk mempelajari karakteristik enzim ligninase, xilanase maupun selulase yang dimiliki oleh isolat Actinomycetes AcP-1 dan AcP-7 agar lebih spesifik. Saran ini
dilatarbelakangi oleh peningkatan efektifitas penguraian senyawa lignoselulosa pada jerami padi berdasarkan beberapa parameter optimum, agar enzim-enzim
DAFTAR PUSTAKA
Akin, DE., Rigsby, LL., Sethuaman, A., Morrison, WH., Gamble, GR., Eriksson, KEL. 1995. Alteration in structure, chemistry, and biodegradability of grass lignocelluloses treated with the white rot fungi Ceriporiopsis
subvermispora and Cyathus stercoreus. Appl Environ Microbiol 61: 1591-1598.
Alexander, M. 1977. Introduction to Soil Microbiology, 2nd ed. Wiley J, and Sons. Inc. New York.
AOAC. 1982. Official Method of Analyysis of The Association of Official Analytical Chemist Vol 2A AOAC Int. Washington.
Badan Pusat Statistika (BPS) Provinsi Lampung. 2012.
http://www.lampung.bps.go.id/?r=brs/index&brs=43. diakses tanggal 13 September 2012 jam 18:45.
Beg, QK., Bhushan, B., Kapoor, M., Hoondal, GS. 2000. Production and
characterization of thermostable xylanase from a Streptomyces sp. QG-11-33. J Ind Microbiol Biotechnol 24: 396-402.
Bjerre, AB., Olesen, AB., Fernqvist, T. 1996. Pretreatment of wheat straw using combined wetoxidation and alkaline hydrolysis resulting in convertible cellulose and hemicelluloses. Biotechnol and Bioeng 49: 568-577.
Cahela, DR., Lee, YY., Chambers, RP. 1983. Modeling of percolation process in hemicellulose hydrolysis. Biotechnol Bioeng 25: 3–17.
Campbell, NA. 1999. Biology, Ed. ke-2, Erlangga. Jakarta 3: 361-363 Dashtban et al., 2009. Fungal Bioconversion of Lignocellulosic Residue:
Opportunities and Perspectives. Int J Biol Sci 17: 578-595.
Datta, R. 1981. Acidogenic fermentation of lignocellulose-acid yield and conversionof components. Biotechnol and Bioeng 23: 2167-2170.
Ensign, JC. 1992. Introduction to the Actinomycetes in: Balows, A., Truper, H., Drowkin, M., Harder, W., Schleifer, KH., editor. The Procaryotes, A Handbook on The Bacteria: Ecophysiol, Isolat, Identificat, Application. Vol 1 2nd ed. Springer-Verlag. New York.
Fengel, D., and Wegener, G. 1995. Kayu: Kimia, Ultra Struktur, Reaksi. Penerjemah Hardjono Sastrohamidjojo, Gadjah Mada University Press. Yogyakarta 129: 317-446.
Fridia, T. 1989. Pengaruh Cara Delignifikasi Terhadap Sakarifikasi Limbah Lignoselulosik. [Skripsi] Fateta IPB. Bogor.
Fujita, M., and Harada, H. 1991. Ultrastructure and formation of wood cell wall. p. In Hon, DNS and Shiraishi, N. Ed. Wood and Cellulosic Chemistry. Inc. New York. Marcel Dekker 56: 3–57.
Gawande, PV., and Kamat, MY. 1999. Production of Aspergillus Xylanase by Lignocellulosic Waste Fermentation and its Application. J of Appl Microbiol 87: 511 – 519.
Hatakka, AI. 1983. Pretreatment of wheat straw by whiterot fungi for enzymatic saccharification of cellulose. Appl Microbiol and Biotechnol 18: 350-357. Hendriks, ATWM., and Zeeman, G. 2009. Pretreatments to Enhance the
Digestibility of Lignocellulose Biomass. Biores Technol 8: 10-18. Hakim, LI. 2009. Studi Hidrolisis Selulosa Jerami Padi Menggunakan
Actinomycetes Isolat Lokal. [Skripsi] Jurusan Kimia FMIPA Universitas Lampung. Bandar Lampung.
Hinman, ND., Schell, DJ., Riley, CJ., Bergeron, PW., Walter, PJ. 1992.
Preliminary estimate of the cost of ethanol production for SSF technology. Appl Biochem Biotechnol 10: 639–649.
Ikhsan, D., Yulianto, ME., Hartati, I. 2009. Hidrolisis Enzimatis untuk Produksi Bioetanol dari Biomassa Jerami Padi. J Pengembangan Bioreaktor. Ingram, LO., and Doran, JB. 1995. Conversion of Cellulosic Materials to
Ethanol. FEMS Microbiol Reviews Elsevier 6: 235-241.
Jeffries, TW. 1994. Biodegradation of lignin and hemicelluloses. dalam: Ratledge C. (ed). Biochem of Microbial Degradation. Kluwer Academic Publishers Netherlands pp 44: 233–277.
Jonathan et al., 2008. Fermentation of soybean hulls to ethanol while preserving protein value. Thayer School of Engineering, Dartmouth College,
Kosaric, NA., Wieczorek, GP., Cosentino, RJ., Magee, JE., Prenosil. 1983. Ethanol fermentation. In Biotechnology, ed. Rehm HJ. and Ree G, ed. Dellweg H, Verlag Chemie. Weinheim, pp 128: 257-385
Miller, GL. 1959. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar, Analytical Chemistry 2: 426-428.
Mitchel, D., Krieger, N., and Berovic, M. 2006. Solid-State Fermentation Bioreactors. Springer-Verlag Berlin Heidelberg.
Moo-Young, M., Moriera, A., Tengerdy, R. 1983. Principles of solid state fermentation, Dalam The Filamentous Fungi. Fungal Technol, Smith JE, Berry DR, Kristiansen B, Vol, 4 eds, Edward Arnold Publishers. London. Moore, HK. 1919. Process of Making Ethyl Alcohol from Wood. United State of
America 217: 323-540
Mosier, N., Wayman, C., Dale, B., Elander, R., Lee, YY., Holtzapple, M., Ladisch M. 2005. Features of Promising Technologies for Pretreatment of
Lignocellulose. Biores Technol 13: 673-686.
Mulder, M. 1996. Basic Principles of Membrane Technology, 2nd Edition. Kluwer Academic Publishers.
Pandey, A., Ricardo, C., Larroche, C. 2008. Current Developments in Solid-state Fermentation, Asiatech Publishers. Inc. New Delhi.
Paul, EA., and Clark, FE. 1989. Soil Microbiology and Biochemistry. 2nd Edition. Academic press. London.
Pasti, BM., Pometto, L., Anthony, N., Marco, P., Crawford, LD. 1990. Lignin-Solubilizing Ability of Actinomycetes Isolated from Termite (Termitidae) Gut, University of Padua. Italy.
Perez, J., Munoz-Dorado, J., dela, RT., Martinez, J. 2002. Biodegradation and biological treatments of cellulose, hemicellulose and lignin: an overview. Int Microbiol 10: 53-63.
Rao, NSS. 1994. Soil Microorganisms and Plant Growth, Oxford and IBM Publishing Co. London.
Saha, BC. 2004. Lignocellulose Biodegradation and Application in
Biotechnology. US Government Work. American Chemical Society 12: 2-14.
Septiyana. 2010. Studi Hidrolisis Hemiselulosa Jerami Padi Menggunakan Actinomycetes Isolat Lokal. [Skripsi] jurusan Kimia FMIPA Universitas Lampung. Bandar Lampung.
Sivers, MV., and Zacchi, G. 1995. A techno-economical comparison of three processes for the production of ethanol from pine. Bioresour Technol 9: 43-52.
Sixta, H. 2006. Multistage kraft pulping, handbook of pulp. ed. Wiley-VCH 40: 325-365.
Sjostrom, E. 1995. Kimia Kayu, Dasar-Dasar dan Penggunaan. Ed 2. Sastrohamidjojo H, penerjemah, Gadjah Mada University Press. Yogyakarta.
Sun, Y., and Cheng, JJ. 2002. Hydrolysis Of Lignocellulosic Materials For Ethanol Production: A Review. Bioresc Technol 10: 1–11.
Taherzadeh, M., and Karimi, K. 2008. Pretreatment of lignocellulosic waste to improve ethanol and biogas production, a review. Int J Mol Sci 30: 1621-1651.
Takagi, M., Abe, S., Suzuki, G., Emert, G., Yata, N. 1977. A method for production of alcohol direct from cellulose using cellulase and yeast. Proceedings of the Bioconvers Symposium IIT. Delhi 20: 551-571. Vadiveloo, J., Nurfariza, B., Fadel, JG. 2009. Nutritional improvement of rice
husks. Anim Feed Sci Technol 56: 299-355.
Vidal, PF., and Molinier, J. 1988. Ozonolysis of lignin – improvement of in vitro digestibility of poplar sawdust. Biomass 16 1–17.
Widiastuti, dan Panji, T. 2008. Pola Aktivitas Enzim Lignolitik Pleurotus Ostreatus Pada Limbah Sludge Pabrik Kertas. Balai Penelitian Bioteknologi Perkebunan Indonesia. Bogor 16151. Indonesia
Yadav, M., Yadav, KDS. 2005. Enzymatic characteristic of ligninperoxidases from Penicillium citrinum, Fusarium oxysporum and Aspergillus terreus using n-propanol as substrate. J Ind of Biochem and Biophys 3: 48-51. Yamac, M., and Tamer, AU. 2008. Lignin degradation and acid precipitable
polymeric lignin (APPL) accumulation by selected Streptomyces strain in submerged and solid state culture system. JABS 6:55-61.