RESPONS ESTRUS HASIL SINKRONISASI
MENGGUNAKAN HORMON PROGESTERON
DAN KOMBINASINYA DENGAN PMSG PADA RUSA
TIMOR (
Cervus timorensis
)
SUPARMIN FATHAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Respons Estrus Hasil Sinkronisasi Menggunakan Hormon Progesteron dan Kombinasinya dengan PMSG pada Rusa Timor (Cervus timorensis) adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, Agustus 2006
ABSTRAK
SUPARMIN FATHAN. Respons Estrus Hasil Sinkronisasi Menggunakan Hormon Progesteron dan Kombinasinya dengan PMSG pada Rusa Timor (Cervus timorensis). Dibimbing oleh TUTY LASWARDI YUSUF sebagai ketua komisi pembimbing dan AMROZI sebagai anggota.
Rusa timor (Cervus timorensis) merupakan salah satu satwa yang dapat dimanfaatkan sebagai salah satu komoditas baru selain ternak lain yang telah di domestikasi sebelumnya. Upaya pengembangbiakan rusa di luar habitatnya (penangkaran) tanpa introduksi teknologi reproduksi masih kurang memuaskan. Sinkronisasi estrus merupakan hal yang berkaitan dengan penerapan teknologi reproduksi (Inseminasi Buatan) pada rusa betina, diantaranya dengan menggunakan hormon progesteron (CIDR-G) dan PMSG.
Penelitian ini dilaksanakan di Taman Margasatwa Ragunan (TMR) Jakarta sejak Januari sampai Juli 2006 dengan tujuan untuk menentukan metode sinkronisasi estrus yang tepat pada rusa betina, pola tingkah laku reproduksi pada rusa betina estrus yang diberi hormon progesteron dan kombinasinya dengan PMSG serta efisiensi penggunaan pemberian hormon progesteron dan kombinasinya dengan PMSG.
Materi penelitian menggunakan 6 ekor rusa yang berumur 2 - 4 tahun dengan tiga perlakuan dan dua ulangan. Perlakuan pertama adalah pemberian hormon progesteron selama 14 hari, perlakuan kedua pemberian hormon progesteron 14 hari dikombinasikan dengan PMSG 150 IU dan perlakuan ketiga dikombinasikan dengan PMSG 300 IU yang diberikan dua hari sebelum hormon progesteron dilepas dan dilanjutkan dengan pengamatan respons estrus selama 4 hari berturut turut (06.00 – 18.00) setelah hormon progesteron dilepas. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL), untuk mengetahui perbedaan nilai tengah perlakuan dilakukan uji Duncan pada a = 0,05.
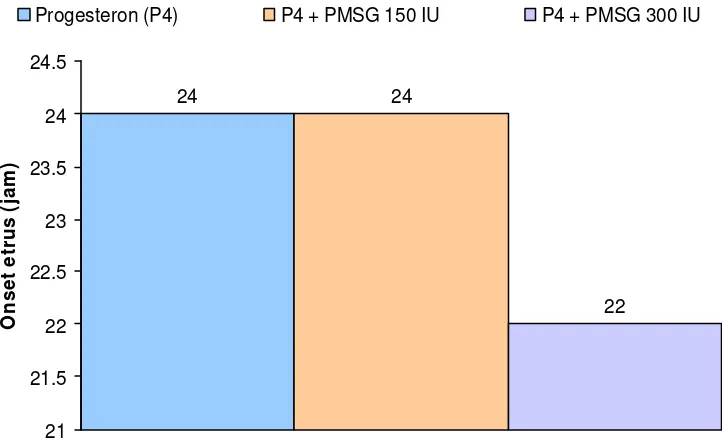
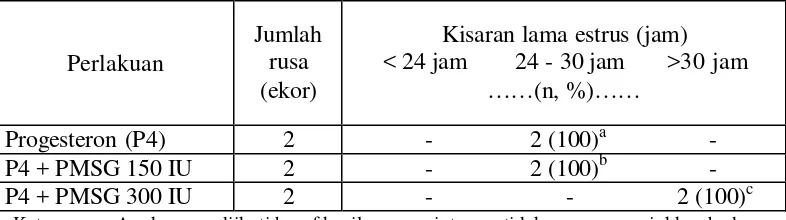
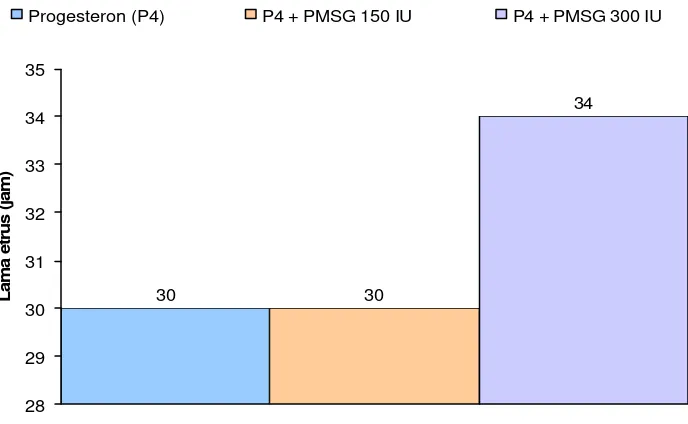
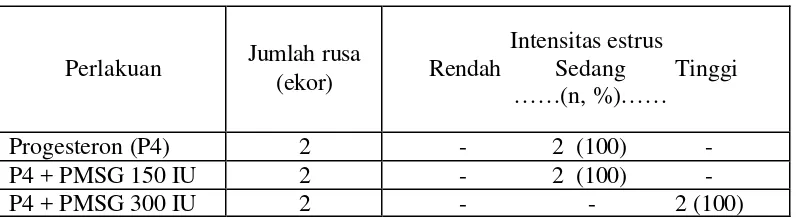
Hasil penelitian menunjukkan bahwa pemberian hormon progesteron atau kombinasinya dengan PMSG 150 diperoleh rataan onset estrus 24 jam, persentase estrus 100%, lama estrus 30 jam yang berbeda nyata secara statistik (P < 0,05), sedangkan intensitas estrus dengan skor dua (kategori sedang). Perlakuan hormon progesteron dan kombinasinya dengan PMSG 300 IU diperoleh rataan onset estrus 22 jam, persentase estrus 100%, lama estrus 34 jam yang berbeda nyata secara statistik (P < 0,05) dan intensitas estrus dengan skor tiga (kategori tinggi).
Secara umum dapat disimpulkan bahwa kombinasi pemberian hormon progesteron dengan kombinasi PMSG 300 IU memberikan respons estrus (onset, lama, persentase dan intensitas) yang lebih baik daripada perlakuan hormon progesteron secara tunggal maupun kombinasinya dengan PMSG 150 IU.
Kata kunci : Sinkronisasi estrus, hormon progesteron, PMSG, rusa timor
© Hak cipta milik Institut Pertanian Bogor, tahun 2006
Hak cipta dilindungi
RESPONS ESTRUS HASIL SINKRONISASI
MENGGUNAKAN HORMON PROGESTERON
DAN KOMBINASINYA DENGAN PMSG PADA RUSA TIMOR
(
Cervus timorensis
)
Oleh
SUPARMIN FATHAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Respons Estrus Hasil Sinkronisasi Menggunakan Hormon Progesteron dan Kombinasinya dengan PMSG pada Rusa Timor (Cervus timorensis)
Nama : Suparmin Fathan
NRP : B 051040011
Disetujui Komisi Pembimbing
Dr. drh. Tuty Laswardi Yusuf, M.S. Dr. drh. Amrozi Ketua Anggota
Diketahui Ketua Program Studi
Biologi Reproduksi
Dekan Sekolah Pascasarjana Institut Pertanian Bogor
Dr. drh. Tuty Laswardi Yusuf, M.S.
Tanggal Ujian: 30 Agustus 2006
Dr. Ir. Khairil Anwar Notodiputro, M.S.
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas karunia Rahmat dan Hidayah-Nya sehingga penulis bisa menyelesaikan karya ilmiah ini dengan baik. Shalawat dan salam penulis haturkan kepada junjungan kita Nabi Muhammad SAW atas keteladanannya. Judul dari penelitian yang dilaksanakan pada bulan Januari sampai dengan Juli 2006 ini adalah Respons Estrus Hasil Sinkronisasi Menggunakan Hormon Progesteron dan Kombinasinya dengan PMSG pada Rusa Timor (Cervus tomorensis).
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ibu Dr. drh. Tuty Laswardi Yusuf, MS. sebagai ketua komisi pembimbing dan Ketua Program Studi Biologi Reproduksi Institut Pertanian Bogor, Bapak Dr. drh. Amrozi sebagai anggota komisi dan Bapak Prof. Dr. drh. Mozes R. Toelihere, M.Sc. (Alm) atas arahan dan bimbingan serta diskusi-diskusi yang sangat berharga. Apresiasi yang tinggi juga penulis sampaikan kepada seluruh Civitas Akademika Fakultas Pertanian Universitas Negeri Gorontalo, keluarga besar Fathan-Dalu dan Akantu-Palilati, Bapak Hi. Usman D. Dalu, BA. sekeluarga dan keluarga Bapak Udin Palilati serta seluruh staf Taman Margasatwa Ragunan (TMR) Jakarta atas semua fasilitas yang diberikan selama studi dan penelitian.
Ucapan terima kasih disampaikan kepada teman-teman seangkatan BRP-2004: Wito Prawigit, A.Md.Vet., S.Pt., Heppi Iromo, S.Pi., M.Si., Syafriadi Idris, S.Pi. dan Nurbariyah, S.Si. juga kepada rekan-rekan staf pengajar Jurusan Teknologi Peternakan Universitas Negeri Gorontalo yang tidak dapat disebutkan satu persatu.
Tak lupa juga penulis meghaturkan terima kasih kepada Ayahanda Dahlan Akantu (alm) dan Ibunda Ruiyah Palilati, saudara-saudara iparku Sudarman Akantu sekeluarga, Norma Dahlan Akantu sekeluarga, Mastin Akantu, Alyun Akantu sekeluarga dan Syarif Dahlan Akantu sekeluarga atas motivasi dan doa yang tulus kepada penulis.
Dengan penuh haru dan bangga penulis persembahkan tulisan ini kepada isteri tercinta Almun Dahlan Akantu dan anak-anakku yang tersaya ng Nurrohmah Syahbana Fathan dan Ikhlasul Amal Fathan yang begitu berarti dalam suksesnya studi penulis yang kadang tersisikan dan terabaikan kebahagiaan mereka hanya karena jauhnya tempat penulis untuk studi, juga kepada orang-orang yang selalu memberikan perhatian dan kasih sayang sehingga penulis bisa menyelesaikan studi dengan baik.
Bogor, Agustus 2006
RIWAYAT HIDUP
Penulis dilahirkan di Kabila Kabupaten Gorontalo pada tanggal 3 April 1971 dari Ayah Umar Fathan dan Ibu Hapisah Dalu. Penulis merupakan putra ketiga dari lima bersaudara.
Pendidikan Sekolah Dasar diselesaikan di Sekolah Dasar Negeri III Tamboo Kecamatan Kabila Kabupaten Gorontalo lulus tahun 1983. Lulus pada Sekolah Menengah Pertama Negeri Bongoime Kecamatan Kabila Kabupaten Gorontalo pada tahun 1986 dan pada tahun 1989 penulis menyelesaikan pendidikan di Sekolah Menengah Atas Negeri Kabila Kabupaten Gorontalo. Pada tahun yang sama penulis terdaftar sebagai mahasiswa di Jurusan Peternakan Fakultas Pertanian Universitas Tadulako.
Pendidikan sarjana ditempuh di Jurusan Peternakan Fakultas Pertanian Universitas Tadulako Palu Sulawesi Tengah melalui jalur Ujian Masuk Perguruan Tinggi Negeri (UMPTN), lulus tahun 1996. Pada tahun 2004 penulis diterima di Program Studi Biologi Reproduksi pada Sekolah Pascasarjana Institut Pertanian Bogor. Beasiswa Pendidikan Pascasarjana diperoleh dari BPPS Dirjen Dikti Departemen Pendidikan Nasional.
Sejak tahun 2000-2002 penulis bekerja sebagai staf pengajar (tenaga honorer) dan tahun 2002 diangkat sebagai staf pengajar tetap di Jurusan Teknologi Peternakan Fakultas Pertanian Universitas Negeri Gorontalo dan aktif dalam berbaga i kegiatan akademik serta kerjasama dengan Pemerintah Provinsi Gorontalo maupun Pemerintah Kabupaten/Kota dalam pengembangan peternakan.
Pada tahun 1998 penulis menikah dengan Almun Dahlan Akantu dan telah dikaruniai dua orang anak, masing- masing Nurrohmah Syahbana Fathan dan
DAFTAR ISI
Halaman
DAFTAR TABEL... xi
DAFTAR GAMBAR... xii
DAFTAR LAMPIRAN... xiii
PENDAHULUAN... 1
Latar Belakang... 1
Kerangka Pemikiran... 3
Tujuan Penelitian... 4
Manfaat Pene litian... 4
Hipotesis... 5
TINJAUAN PUSTAKA... 6
Ciri-ciri Rusa Timor (Cervus timorensis)... 6
Tingkah Laku Seksual... 7
Siklus Estrus pada Betina... 8
Siklus Estrus dan Profil Hormon Reproduksi pada Rusa Betina... 14
Gelombang Folikel... 19
Sinkronisasi Estrus... 20
Sinkronisasi Estrus dengan Hormon Progesteron dan PMSG... 21
BAHAN DAN METODE... 28
Waktu dan Tempat Penelitian... 28
Materi Penelitian... 27
Metode Penelitian... 30
Kegiatan Penelitian... 31
Perlakuan... 31
Pengamatan Estrus... 33
Peubah yang Diamati... 33
Analisis Statistik... 34
HASIL DAN PEM BAHASAN... 35
Kondisi Lokasi dan Rusa Penelitian... 35
Pengaruh Pemberian Hormon Progesteron (CIDR-G) dan Kombinasinya dengan PMSG... 37
Respons Timbulnya Estrus... 37
Lama Estrus dan Intensitas Estrus... 43
SIMPULAN DAN SARAN... Simpulan... Saran...
DAFTAR TABEL
Halaman 1 Perlakuan pemberian hormon progesteron dan kombinasinya dengan
PMSG... 32
2 Tanda-tanda estrus pada rusa percobaan... 33
3 Pengaruh pemberian hormon progesteron dan kombinasinya dengan PMSG terhadap persentase estrus... 39
4 Pengaruh pemberian hormon progesteron dan kombinasinya dengan PMSG terhadap onset (timbulnya) estrus... 40
5 Pengaruh pemberian hormon progesteron dan kombinasinya dengan PMSG terhadap lama estrus... 43
6 Pengaruh pemberian hormon progesteron dan kombinasinya dengan PMSG terhadap intensitas estrus... 45
DAFTAR GAMBAR
Halaman 1
2
Kandang dan rusa betina penelitian...
Denah kandang penelitian... 28
29
3 A. CIDR-G (Agriculture Devition, CHH Plastic products Ltd, Hamilton)... B. PMSG (Laboratorios Hipra, S.A., Spain)...
30 30
4 Bagan prosedur kerja penelitian... 32
5 Rataan onset (timbulnya ) estrus pada setiap perlakuan... 41
DAFTAR LAMPIRAN
Halaman 1 Jadual penelitian di lokasi Taman Margasatwa Ragunan (TMR)
Jakarta... 57
2 Respons intensitas estrus setelah perlakuan... 59
3 Hasil pengamatan gejala estrus pada rusa timor betina selama 4 hari berturut-turut (06.00 - 18.00) yang diberi perlakuan hormon progesteron 14 hari... 60
4 Hasil pengamatan gejala estrus pada rusa timor betina selama 4 hari berturut-turut (06.00 - 18.00) yang diberi perlakuan hormon progesteron 14 hari + PMSG 150 IU (H-2)... 64
5 Hasil pengamatan gejala estrus pada rusa timor betina selama 4 hari berturut-turut (06.00 - 18.00) yang diberi perlakuan hormon progesteron 14 hari + PMSG 300 IU (H-2)... 68
6 Hasil analisis statistik dan uji lanjut untuk persentase estrus... 72
7 Hasil analisis statistik dan uji lanjut untuk onset (timbulnya) estrus... 73
8 Hasil analisis statistik dan uji lanjut untuk lama estrus... 74
9 Keadaan lokasi dan rusa timor penelitian... 75
PENDAHULUAN
Latar Belakang
Rusa termasuk satwa ruminansia yang memiliki banyak anak jenis ( sub-spesies) yaitu sebesar 196, 42 jenis (spesies) yang berasal dari bangsa (ordo) Artiodacthyla, suku (family) Cervidae serta anggota 17 marga (genus). Suatu jumlah yang sangat besar untuk dikembangkan sebagai suatu komoditas baru di dunia peternakan. Sebenarnya jenis rusa asli di Indonesia hanya empat, yaitu rusa sambar (Cervus unicolor), rusa timor (Cervus timorensis), rusa bawean (Axis kuhlii) dan muncak (Muntiacus muntjak). Namun sejak pra kemerdekaan (sekitar tahun 1814) telah didatangkan satu jenis rusa dari India, yaitu rusa totol (Axis axis) yang berkembang pesat dan penyebarannya hanya terbatas dihalaman Istana kepresidenan Bogor. Rusa yang penyebarannya paling luas di pulau-pulau di Indonesia dan bahkan di luar negeri adalah jenis rusa timor.
Rusa merupakan salah satu satwa liar yang dilindungi oleh undang-undang terhadap perburuan dan pemanfaatannya. Namun hal ini dapat dimungkinkan dengan adanya Undang-undang Nomor 5 Tahun 1990 tentang Konservasi Sumber Daya Alam Hayati dan Ekosistimnya, menyebutkan bahwa pemanfaatan satwa liar Indonesia dimungkinkan dilakukan baik dalam bentuk; (a) pengkajian, penelitian dan pengembangan; (b) penangkaran; (c) perburuan; (d) perdagangan; (e) peragaan; (f) pertukaran; (g) budidaya tanaman obat-obatan dan (h) pemeliharaan untuk kesenangan (Pasal 36 ayat 1). Aturan teknis untuk pelaksanaan pemanfaatan ini tercantum dalam Peraturan Pemerintah No. 8 Tahun 1999 tentang Pemanfaatan Jenis Tumbuhan dan Satwa Liar. Menurut aturan teknis ini pemanfaatan satwa liar bertujuan agar dapat didayagunakan secara lestari untuk sebesar-besarnya kemakmuran rakyat (Pasal 2 ayat 1).
itu diperlukan langkah- langkah strategis untuk pengembangannya di Indonesia sebagai komoditas penghasil daging.
Salah satu keunggulan rusa timor dibanding dengan ternak ruminansia lain adalah kemampuannya menghasilkan karkas dengan persentase yang relatif lebih tinggi, yaitu antara 56 sampai 63%, ketebalan lemak 8 - 18 mm, imbangan daging dan tulang 4,7 : 1,0 (Semiadi dan Nugraha 2004). Sedangkan produk sampingannya dapat bersumber dari tanduk muda (velvet antler) dan kulit. Dari kedua produk yang dihasilkan ternyata dapat memberi kontribusi yang cukup besar bagi pendapatan peternak di Australia. Harga setiap kg karkas sebesar $ 4,4 dan valvet dapat mencapai $ 100 serta kulit $ 50 (Arifin 2005).
Di Indonesia khususnya di Provinsi Kalimantan Timur sebagai salah satu daerah yang melakukan perburuan setiap tahunnya tidak kurang dari 5000 ekor rusa sambar, dan produksi ini menghasilkan sekitar 412.500 kg karkas (Semiadi 2002). Melihat potensi rusa, Dirjen Produksi Peternakan saat ini tengah berupaya mengadopsi metode pemeliharan rusa yang telah dikembangkan di luar negeri untuk dimodifikasi pada kondisi Indonesia. Oleh karena itu perlu dipelajari proses pengembangbiakan rusa di luar habitatnya melalui teknologi reproduksi, yang juga bermanfaat sebagai salah satu upaya untuk konservasi dan mencegah kepunahan maupun untuk meningkatkan pemanfaatan rusa sebagai ternak harapan sumber protein.
masing- masing daerah mempunyai masa kelahiran yang spesifik (Semiadi et al. 1994; Semiadi 1998).
Hal yang berkaitan dengan penerapan teknologi inseminasi buatan (IB) pada rusa betina adalah proses sinkronisasi estrus dengan menggunakan hormon sintetik dalam suatu Controlled Internal Drug Release-Goat (CIDR-G), Pregnant Mare Serum Gonadotropin (PMSG). Penggunaan hormon progesteron (CIDR-G)
dimaksudkan untuk memacu sinkronisasi estrus dan fertilitas melalui penekanan aktivitas ovarium dengan menghambat lonjakan LH (Luteinizing Hormone) dari hipofisis anterior melalui mekanisme umpan balik negatif. PMSG adalah hormon eksogenus yang sengaja diberikan dengan tujuan untuk memperoleh sel telur dalam jumlah yang banyak yang daya kerjanya seperti hormon FSH (Follicle Stimulating Hormone)serta dapat mencegah terjadinya sel telur yang atresi (Cahil 1982; Jillella 1982; Hogan et al. 1986 dalam Margawati dan Mulyaningsih 1996).
Tujuan utama dari semua metode ini adalah untuk mengkondisikan semua betina yang akan diinseminasi berada dalam satu status fisiologi reproduksi yang seragam, yaitu berahi. Berdasarkan hal tersebut di atas, maka telah dilakukan penelitian mengenai penggunaan hormon progesteron (CIDR-G) dan kombinasinya dengan PMSG guna memperoleh suatu kondisi dimana sekelompok rusa betina berada dalam keadaan berahi dan siap untuk diinseminasi.
Kerangka Pemikiran
Perkembangbiakan rusa secara cepat dan masal dapat dilakukan dengan metode sinkronisasi estrus pada sekelompok ternak betina untuk dapat diinseminasi secara serempak pada waktu yang hampir bersamaan. Penyerentakan berahi pada hewan betina dimaksudkan untuk lebih mengefisienkan waktu dan tenaga dalam pelaksanaan program inseminasi buatan. Makin banyak betina yang dapat diinseminasi pada suatu saat secara serempak, makin meningkatkan suatu proses produksi yang efisien dalam waktu yang relatif singkat.
progesteron selama masa implantasi intravaginalnya, akan beredar di dalam sistem sirkulasi darah dan akan menghambat lonjakan LH untuk mencegah terjadinya ovulasi. Setelah hormon progesteron dilepas dari implantasinya di dalam vagina, maka hambatan tersebut akan hilang dari gonadotropin dan akan terjadi lonjakan LH dan estrogen. Dengan demikian hewan- hewan perlakuan akan memperlihatkan tanda-tanda berahi secara bersamaan beberapa hari kemudian.
PMSG (Pregnant Mare Serum Gonadotropin) yang disuntikkan secara intramuskuler (im) memiliki aktivitas biolo gis yang menyerupai FSH dan LH, namun lebih dominan peranan FSH- nya. PMSG atau equine Chorionic Gonadotropin (eCG) adalah hormon FSH dan LH eksogenus yang akan memperjelas pengaruh FSH dan LH endogen dalam penyerentakan berahi bila diberikan sebelum hormo n progesteron dilepas. Hal ini akan mempengaruhi aktivitas ovarium dengan terjadinya pertumbuhan dan perkembangan folikel, sehingga pemberian dalam jumlah yang cukup bersama dengan progesteron diharapkan akan lebih meningkatkan pertumbuhan dan perkembanga n gelombang folikel dan ovulasi pada rusa timor.
Pendekatan aspek biologi reproduksi yang dapat dilakukan melalui penelitian ini adalah pengkajian tingkah laku estrus pada rusa betina setelah pemberian hormon progesteron secara tunggal dan kombinasinya dengan PMSG untuk kesiapannya diinseminasi.
Tujuan Penelitian
Tujuan dari pelaksanaan penelitian ini adalah untuk :
1. Menentukan metode sinkronisasi estrus yang lebih baik pada rusa betina. 2. Mempelajari pola tingkah laku estrus pada rusa betina yang diberi hormon
progesteron (CIDR-G) dan kombinasinya dengan PMSG.
3. Membandingkan efisiensi penggunaan pemberian hormon progesteron dan kombinasinya dengan PMSG.
Manfaat Penelitian
1. Memberikan informasi tentang metode sinkronisasi estrus yang lebih baik dan efektif dalam mempengaruhi/menimbulkan respon estrus dari rusa timor (Cervus timorensis) yang diberi perlakuan hormon progesteron dan kombinasinya dengan PMSG.
2. Mendapatkan data dasar untuk penelitian dan kerangka kerja lebih lanjut dalam rangka pengembangan rusa timor sebagai komoditas ternak baru serta pengembangan teknologi reproduksi itu sendiri.
Hipotesis
1. Pemberian hormon progesteron tunggal secara intravaginal dapat menggertak pemunculan estrus pada rusa timor.
TINJAUAN PUSTAKA
Ciri-ciri Rusa Timor (Cervus timorensis)
Rusa timor (Cervus timorensis) merupakan rusa tropis kedua terbesar setelah rusa sambar. Dibandingkan rusa tropis Indonesia lainnya, rusa timor memiliki banyak keunikan yaitu sebagai kelompok rusa yang mempunyai banyak anak jenis, sebagai rusa dengan nama daerah yang cukup beragam dan sebagai rusa yang paling tersebar luas di luar negeri. Berat badan rusa timor berkisar antara 40 - 120 kg, tergantung pada anak jenisnya (Semiadi dan Nugraha 2004). Rusa timor mempunyai ciri-ciri fisik berupa warna kulit coklat kemerah- merahan sampai coklat gelap (Drew et al. 1982), lebih lanjut dijelaskan bahwa berat badan dewasa rusa timor mencapai 60 kg sampai 100 kg, panjang badan berkisar 1,95 - 2,10 meter dan tinggi badan 1,00 - 1,10 meter. Jantan mempunyai ranggah, dengan panjang maksimum 0,87 meter, yang berkembang sesuai dengan pertambahan umur. Ukuran tubuh betina lebih kecil, ramping, padat dan kakinya lebih kecil daripada jantan.
Sedangkan menurut Syarif (1974) rusa timor mempunyai ciri-ciri berbadan ramping, berwarna coklat kemerah-merahan sampai coklat gelap, dengan bobot badan rata-rata 45 - 60 kg. Rusa umumnya lebih menyukai hutan terbuka atau padang rumput dan hidup pada daerah sampai ketinggian 2600 meter di atas permukaan laut (der Zo n 1979). Pada jenis yang besar (Cervus Timorensis russa) tinggi badan mencapai 110 cm, panjang tubuh dan kepala 190 - 210 cm, dengan bobot badan dapat mencapai 140 kg (Hardjosentono 1978).
Tingkah Laku Seksual
Pada umumnya rusa mempunyai daya adaptasi tinggi terhadap lingkungan baru sehingga sangat memungkinkan untuk didomestikasi. Pernyataan ini tentunya harus didukung dengan penelitian yang mengkaji kemampuan secara fisiologis. Tentunya menjadi suatu pemikiran apabila kemampuan adaptasi tidak diikuti dengan kemampuan reproduksi yang menjadi sala h satu tujuan dari suatu peternakan. Berdasarkan penelitian yang telah dilakukan di negara sub tropik pada rusa-rusa tropik yang ditranslokasi, bahwa rusa tropik mempunyai kemampuan reproduksi yang cukup baik. Asumsi yang muncul dari penelitian yang ada di daerah tropik mengacu pada kondisi sub tropik yaitu aktivitas reproduksi berkaitan dengan tahap ranggah keras.
Hafez (1993) mendefinisikan tingkah laku seksual (sexual behaviour) adalah beberapa variasi pola tingkah laku diawali dengan percumbuan, daya tarik dan aktivitas motorik yang bertujuan untuk mendekatkan jantan dan betina sehingga terjadi perkawinan dan akhirnya menghasilkan keturunan. Sedangkan Austine dan Short (1985) menyatakan bahwa tingkah laku seksual tidak hanya menyangkut koitus saat gamet jantan ditransfer ke betina tetapi juga bagaimana membawa jantan dan betina tersebut untuk bertemu dan melakukan percumbuan serta menentukan perkawinan pada waktu fertil yang optimal. Tingkah laku seksual yang sinkron antara jantan dan betina terjadi akibat adanya hormon gonadal dalam darah pada level tertentu, dan dibantu oleh aktivitas susunan syaraf pusat sehingga tingkah laku merupakan indikator respon otak terhadap stimulasi humoral.
Tingkah laku lain adalah dengan membentuk mahkota. Ranggah merupakan pertanda dominasi seekor rusa jantan dalam suatu kelompok. Sifat jantan yang akan mengawini betina dan keberhasilan perkawinan tergantung pada tingkat dominasi jantan (agresivitas), daya tarik antara jantan dan betina yang sedang estrus, tahapan interaksi tingkah laku (kesiapan untuk mating) dan reaksi jantan untuk menaiki betina (Anonimous 1995). Sebaliknya pada betina pemilihan pasangan dan kemampuan melahirkan tergantung pada latihan fisik. Tingkah laku seksual pada betina terjadi secara periodik dan hanya muncul pada periode tertentu dalam kehidupannya. Tingkah laku ini terjadi akibat konsentrasi hormon gonadal di dalam plasma darah sampai tingkat yang kritis. Sekresi hormon ini dipengaruhi oleh lingkungan seperti cahaya, nutrisi, bau khas dari pasangan, rangsangan dari perabaan, rangsangan sosial dan temperatur (Becker et al. 1992).
Takandjandji dan Sinaga (1997) menyatakan bahwa, tingkah laku reproduksi lainnya pada rusa timor yang muncul mencakup : melenguh (roaring) dengan suara keras pada waktu-waktu tertentu pada pagi/sore hari, ciri-ciri lain adalah berkubang (berendam dalam lumpur), berjalan tegak dengan kepala mendatar, menyeringai (flehmen) kearah betina yang sedang estrus, mengikuti jejak betina dan menciumi urine.
Siklus Estrus pada Betina
Penelitian pada hewan laboratorium yang diberi estrogen ternyata meningkatkan keinginan seksual untuk mendekati jantan dan merangsang penampakan seksual yang dikenal dengan proceptive behaviour. Pada betina, proceptive behaviour ditandai dengan pendekatan, orientasi dan lari menjauh dari pejantan. Selain menimbulkan tingkah laku proceptiv pada betina, estrogen juga akan menyebabkan betina menjadi lebih menarik untuk jantan, seperti menimbulkan bau-bauan yang khas estrus, suara dan perubahan fisik. Pada betina, tingkah laku percumbuan tidak hanya menerima jantan secara seksual tapi juga menghasilkan bau khas, suara dan stimulasi fisik yang menandakan betina tersebut dalam kondisi estrus.
Becker et al. (1992) membagi tingkah laku reproduksi menjadi dua, yaitu tingkah laku pra kopulasi dan tingkah laku kopulasi. Tingkah laku pra kopulasi penting untuk terjadinya kopulasi dan biasanya disebut dengan tingkah laku percumbuan. Tingkah laku kopulasi biasanya ditandai dengan postur badan yang khas untuk penerimaan jantan. Bentuk badan yang siap untuk kopulasi disebut lordosis (membentuk lengkungan di bagian punggung).
Tingkah laku percumbuan ditandai dengan seleksi untuk mendapatkan pasangan. Diferensiasi seks pada gamet (sel telur dan sel sperma) berhubungan dengan strategi reproduksi. Sebagai contoh betina yang berovulasi pada suatu periode (siklus) reproduksi, sebaliknya pada jantan relatif konstan dalam memproduksi sel sperma. Sebagai konsekuens inya betina mempunyai keterbatasan dalam waktu kawin dibandingkan dengan jantan.
Secara umum, siklus estrus dibagi menjadi empat fase. Keempat fase ini juga dapat digolongkan kedalam dua fase yaitu folikuler estrogenik (proesterus dan estrus) serta metestrus atau progestational (estrus dan diestrus). Fase estrus atau periode seksual (D0) diikuti dengan fase metestrus atau pasca ovulasi (D1-4),
fase diestrus (D5-18) yang sesuai dengan fase luteal dan fase proestrus (D18-21) yang
merupakan periode sebelum estrus (Toelihere 1997).
Proestrus merupakan periode persiapan yang ditandai dengan pertumbuhan folikel oleh FSH dari hipofisis anterior (Salisbury dan Bagnara 1985; McDonald 1989). Folikel yang sedang tumbuh menghasilkan cairan folikel dan estradiol yang lebih banyak. Menurut Elmer et al. (1981), cairan folikel menyebabkan ukuran ovum meningkat. Produksi estrogen yang tinggi menyebabkan perkembangan uterus, vagina, oviduk dan folikel- folikel meningkat, serta meningkatkan suplai darah kedalam saluran alat kelamin (Elmer et al. 1981; Salisbury dan Bagnara 1985). Pada akhir proses proestrus, estrus dimulai (McDonald 1989). Fase ini merupakan aktivitas penerimaan seksual pada betina (Elmer et al. 1981), dan lama pelayanan bervariasi (McDonald 1989).
Partodihardjo (1992) menyatakan bahwa estrus ternak ditandai sebagai periode dimana betina akan menerima dan diam untuk dikawini. Kejadian estrus dapat dijadikan dasar yang lebih baik dalam menerangkan fisiologi kelamin dan dapat digunakan sebagai titik permulaan dari suatu siklus berahi. Estrus pada betina adalah fase yang sangat penting yang ditandai dengan terjadinya kopulasi. Ovulasi terjadi pada fase ini, CL (Corpus Luteum) mulai terbentuk pada saat LH (Luteinizing Hormone) dari hipofisis anterior meningkat dan FSH menurun. Jika hewan betina menolak untuk kopulasi meskipun tanda-tanda estrus terlihat dengan jelas, maka penolakan tersebut memberi pertanda bahwa hewan betina masih dalam fase proestrus atau fase estrus telah lewat.
kejadian yang teratur kecuali ternak tersebut mengalami kebuntingan atau sedang mengalami ketidaknormalan atau ketidakseimbangan hormonal serta sebab-sebab patologik lainnya.
Metestrus adalah fase setelah ovulasi, dimana CL mulai berfungsi (McDonald 1989). Corpus luteum dipertahankan oleh LTH (Luteotropic Hormone) atau prolaktin dari hipofisis anterior. Metestrus ditandai oleh terhentinya estrus yang sekonyong-konyong. Rongga folikel segera berangsur mengecil dan pengeluaran lendir terhenti. Selama metestrus, epitel vagina melepaskan sebagian sel-sel barunya yang terbentuk (Salisbury dan Bagnara 1985). Lamanya fase ini tergantung pada lamanya waktu hipofisis anterior mengsekresikan LTH (Elmer et al. 1981).
Diestrus adalah periode terakhir dari siklus estrus. Corpus luteum berkembang dengan sempurna, dan pengaruh hormon progesteron tampak pada dinding uterus (Salisbury dan Bagnara 1985). Perkembangan otot uterus dan ukuran kelenjar terus meningkat. Kelenjar uterus mensekresikan cairan yang kental untuk ketersediaan makanan bagi zigot (McDonald 1989). Jika terjadi kebuntingan, fenomena ini akan diperpanjang selama kebuntingan dan CL tetap utuh. Kehidupan CL selama kebuntingan dipertahankan oleh LTH yang disekresikan oleh plasenta.
Hafez (1993) menjelaskan bahwa secara morfologik proses ovulasi dapat dijelaskan akibat menipisnya dinding folikel karena semakin bertambahnya cairan folikel sehingga tidak terjadi vaskularisasi pada bagian yang semakin menipis dan dinding folikel pada bagian tersebut pecah. Keadaan ini dimanfaatkan oleh cairan antrum folikel untuk menyusup masuk menggantikan tempat rupturnya sel-sel granulosa. Akibat tekanan yang makin kuat, dinding folikel pecah sehingga cairan antrum bersama ovum akan terlontar ke luar dan peristiwa ini disebut ovulasi. Secara hormonal, ovulasi diawali dengan pelepasan LH oleh hipofisis anterior yang mengakibatkan pembentukan PGF2a (Prostaglandin F2a) dan PGE2 oleh
stratum granulosum folikel de Graaf.
Selanjutnya PGE2 akan merangsang plasminogen aktivator dan PGF2a.
menyebabkan terbentuknya stigma. PGF2a menyebabkan konstriksi ovarium dan
folikel sehingga mengakibatkan pecahnya folikel dan terlontarnya oosit keluar folikel (Toelihere 1985). Setelah proses ovulasi terbentuk CL pada bekas folikel yang telah pecah dan mulai mensekresikan progesteron. CL terbentuk dari diferensiasi sel-sel folikel preovulatoris setelah lonjakan pelepasan LH (Davis et al. 1996). Selanjutnya Fortune (1993) menyatakan bahwa pada fase luteal inipun tetap terjadi pertumbuhan folikel yang dapat mencapai folikel de Graaf akan tetapi pertumbuhan folikel pada fase ini berlangsung lambat sehingga ukuran maksimal seperti layaknya folikel de Graaf lambat tercapai.
Menurut Hafez (1993) terjadinya siklus estrus pada ternak merupakan proses interaksi antara hipotalamus melalui (Gonadotrophin Releasing Hormone/Gn-RHnya), hipofisis (dengan FSH dan LH), ovarium (estrogen, progesteron dan inhibin) dan uterus (PGF2a). Interaksi kerja antara keempat organ
tersebut sangat erat kaitannya dengan hormon-hormon yang diproduksinya. Hormon- hormon tersebut akan saling memberikan umpan balik, baik umpan balik positif (positive feed-back mechanism) maupun negatif (negative feed-back mechanism).
merangsang reseptor LH menjelang terjadinya lonjakan sekresi LH untuk proses ovulasi.
Mekanisme kerja FSH pada ovarium menurut McDonald (1989) diawali dengan mengaktifkan reseptornya sendiri dan reseptor LH pada sel-sel granulosa. FSH akan berikatan dengan reseptornya dan mengaktifkan enzim adenilatsiklase sehingga terjadi peningkatan cAMP intraseluler. Peningkatan cAMP dapat mengaktifkan proteinkinase yang akan berperan dalam merangsang sintesis hormon steroid. Efek kerja cAMP diatur oleh fosfoprotein melalui perantaraan reaksi fosforilase-defosforilase protein. Efek cAMP yang dikendalikan melalui reaksi tersebut adalah proses sekresi, metabolisme protein dan lemak, induksi enzim, pengangkutan ion dan pengaturan pertumbuhan dan pematangan serta replikasi sel.
Hipofisis dapat pula menghasilkan LH disamping FSH, yang dapat dikendalikan oleh hormon progesteron dan estrogen. Frekuensi pulsa LH meningkat pada saat terjadi penurunan konsentrasi progesteron dan peningkatan estrogen. Hormon estrogen berperan pula dalam merangsang ternak untuk memperlihatkan atau mengekspresikan tingkah laku kawin pada ternak betina sehingga ternak jantan atau inseminator dapat mengetahui gejala-gejala estrus dan waktu kawin atau inseminasi dapat dilakukan pada waktu yang tepat. Antara LH dan hormon estrogen terdapat mekanisme kerja yang saling merangsang. Sekresi LH yang meningkat akibat penurunan kadar progesteron akan merangsang sekresi estrogen melalui peningkatan pema tangan folikel de Graaf sebagai sumber estrogen endogen. Selanjutnya estrogen dapat menimbulkan lonjakan sekresi LH yang diperlukan untuk ovulasi dan mengawali pembentukan sel-sel luteal.
(Elmer et al. 1981). Regresi CL (luteolisis) terjadi karena rangsangan bahan luteolitik yang disekresikan oleh hipofisis anterior atau uterus tidak bunting yaitu PGF2a . Corpus luteum akan mengalami regresi atau lisis pada hari ke-17 sampai
hari ke-20 siklus estrus yang berakibat pada menurunnya konsentrasi progesteron. Progesteron memainkan perana n utama dalam pengaturan respon kekebalan uterus dimana induksi progesteron menghasilkan uterine milk protein
(UTMP) atau protein susu uterus yang menghambat aktivitas limfosit di dalam uterus (Hansen 1997). Disamping itu progesteron mempunyai fungsi yang cukup penting yaitu bekerja secara sinergis dengan estrogen untuk merangsang sekresi alveoli dan pertumbuhan kelenjar mammae (McDonald 1989).
Siklus Estrus dan Profil Hormon Reproduksi pada Rusa Betina
Siklus estrus pada rusa betina seperti pada ruminansia lainnya selalu dihubungkan dengan waktu pubertas. Pubertas pada rusa lebih berhubungan dengan berat badan daripada umur. Sebagai contoh, rusa betina dapat kawin dan bunting pada berat badan 55 sampai 59 kg. Semiadi (1998) menyatakan bahwa umur pubertas pada rusa betina dicapai pada umur 18 bulan, sedangkan Takandjandji (1997) menyatakan pada umur antara 15 sampai 18 bulan rusa betina akan mengalami pubertas dengan masa reproduksi aktif sampai 12 tahun. Rusa timor sendiri akan mencapai pubertas pada umur 7 hingga 9 bulan dengan awal waktu bereproduksi secara optimal pada umur 17 sampai 18 bulan.
Sampai saat ini informasi panjang siklus estrus untuk rusa-rusa di Indonesia masih sangat terbatas. Panjang siklus estrus pada rusa tropik berkisar antara 10 dan 23 hari, yang paling pendek adalah pada rusa timor (10 - 18 hari) dan paling panjang pada rusa totol antara 12 sampai 23 hari (Semiadi 1995). Penelitian mengenai profil hormon reproduksi pada rusa tropik masih sangatlah terbatas. Namun profil hormon ini selalu berhubungan erat dengan siklus musim, berat badan, jumlah pakan yang diserap, tingkat metabolisme dan musim kawin.
Adam et al. (1985) telah mencoba mempelajari profil hormon progesteron pada rusa merah betina selama musim kawin, bunting dan tidak estrus. Hasil penelitian tersebut menunjukkan bahwa konsentrasi hormon progesteron di dalam plasma perifer pada tingkat basal selama masa laktasi dan tidak estrus bermusim adalah < 1ng/ml, dan meningkat dengan cepat pada awal musim kawin, mencapai lebih dari 1 ng/ml. Diduga pula bahwa ovulasi pertama terjadi pada hari dimana konsentrasi progesteron meningkat di atas 1 ng/ml dan tetap dipertahankan selama beberapa hari. Rata-rata lama siklus dari ovulasi pertama ke ovula si kedua adalah 21 ± 1,3 hari dengan puncak progesteron yang dicapai 4,5 ± 0,43 ng/ml sesudah 14,0 ± 0,8 hari. Indikator dimulainya periode estrus dan ovulasi kedua adalah dengan menurunnya konsentrasi progesteron plasma di bawah 1 ng/ml (artinya ovulasi dianggap telah terjadi pada saat progesteron plasma rendah).
Progesteron merupakan hormon yang dihasilkan oleh CL, plasenta dan kelenjar adrenal. Progesteron diangkut melalui peredaran darah karena ikatannya dengan globulin dan pengaturan sekresi progesteron kemungkinan karena rangsangan LH (Toelihere 1985). Progesteron mempunyai peranan mempersiapkan lingkungan uterus untuk implantasi dan memelihara kebuntingan melalui peningkatan sekresi kelenjar endometrium dan menghambat motilitas miometrium. Selain itu progesteron menghambat sel-sel limfosit yang dapat menolak jaringan dan merupakan immuno supresif alami yang mencegah penolakan maternal terhadap fetus (Hansen dan Liu 1996).
selama fase luteal. Pada hewan yang tidak bunting level ini akan menurun secara cepat setelah hari ke-16 sampai level basal akibat regresinya CL oleh PGF2a yang
secara bertahap diproduksi uterus selama fase luteal. Level basal progesteron dalam peredaran darah lebih rendah dari 1 ng/ml. Setelah perkembangan CL pada awal fase luteal siklus, konsentrasi progesteron plasma meningkat sampai 7 ng/ml dan selama kebuntingan konsentrasi progesteron plasma dapat mencapai 20 ng/ml atau lebih. Tingginya konsentrasi progesteron plasma pada fase luteal siklus dapat menekan pelepasan LH yang berhubungan dengan pematangan folikel dominan. Jika folikel dominan matang mencapai ukuran lebih besar dari 9 mm, sementara konsentrasi progesteron plasma di atas 4 ng/ml, maka folikel dominan berangsur-angsur hilang (atresia) dan terbentuk folikel baru. Ketika konsentrasi progesteron plasma turun ke level sub- luteal (kurang dari 2 ng/ml), LH meningkat dan cukup untuk memelihara pematangan folikel dominan, folikel dominan tetap bertahan tanpa ovulasi (Anonimous 1996).
Stabenfeldt dan Edqvis (1997) menyatakan bahwa ukuran CL telah mencapai maksimum pada hari ke-7 sampai hari ke-9 dengan ukuran 2,5 cm bahkan sampai 3 cm. Toelihere (1985) menyatakan bahwa CL biasanya berukuran 1,9 sampai 3,2 cm dan CL kebuntingan serta CL matang pada setiap siklus estrus berukuran berat 3 sampai 9 gram atau rata-rata 5 sampai 6 gram. CL dapat bertahan pada ovarium 8 sampai 14 hari jika tidak terjadi kebuntingan, sedangkan bila terjadi kebuntingan CL tetap berfungsi sampai akhir masa kebuntingan (McDonald 1989).
Jika ovum tidak dibuahi, hewan tidak bunting, proses perkembangan folikel, ovulasi dan pembentukan CL akan terjadi secara teratur. Umur CL dibatasi oleh uterus yang pada hari- hari terakhir siklus pada hewan tidak bunting memproduksi PGF2a secara pulsasi kedalam versa uterus, lalu ditransfer ke arteri
ovari melalui mekanisme perembesan langsung. Di bawah pengaruh PGF2a , CL
mengalami regresi dan produksi progesteron terhenti. Selain itu, PGF2a akan
Stanbenfeldt dan Edqvist (1997) menyatakan bahwa PGF2a sangat cepat
mengalami degradasi dan hancur menjadi metabolitnya. Oleh karena itu kadar PGF2a di dalam plasma darah diukur berdasarkan metabolitnya yaitu 13.14
dihidro-15 keto. Kerja PGF2a endogen ini dapat ditiru dengan pemberian PGF2a
eksogenus pada ternak selama pertengahan siklus baik secara intramuskuler maupun intrauterin. Pemberian PGF2a pada fase luteal dimana terdapat CL yang
aktif akan memperpendek siklus estrus.
Estrogen mempunyai banyak fungsi. Fungsi pertama adalah merubah sifat sekresi yang dihasilkan oleh kelenjar hipofisis anterior. Estrogen berpengaruh pada otak yang ada hubungannya dengan tingkah laku estrus atau berahi. Estrogen juga mengontrol perubahan pada alat kelamin betina, produksi mucus, pada uterus merubah aktivitas metabolismenya, kesemuanya itu dimaksudkan guna mempersiapkan uterus untuk menerima ovum dan spermatozoa. Estradiol yang diproduksi dari aktivitas gelombang folikel selama fase luteal siklus, menginisiasi luteolisis. Hal ini dimediasi dari pembentukan reseptor oksitosin di dalam endometrium ternak yang sudah dikondisikan dahulu oleh progesteron selama tujuh hari. Keluarnya oksitosin dari CL mengikat reseptor oksitosin di dalam endometrium, menghasilkan PGF2a dan terjadi luteolisis. Pada sapi yang bunting,
pengeluaran PGF2a dihambat dan memperpanjang hidup CL (Anonimous 1996).
Keluarnya oksitosin dari CL mengikat reseptor oksitosin di dalam endometrium, menghasilkan PGF2a dan terjadi luteolisis. Produksi estradiol
selama fase luteal menginisiasi luteolisis. Hal ini dimediasi dari pembentukan reseptor oksitosin dalam endometrium dari ternak yang sudah dipersiapkan oleh progesteron selama tujuh hari. Keluarnya oksitosin dari CL mengikat reseptor menghasilkan PGF2a dan terjadi luteolisis. Pada sapi yang bunting keluarnya
PGF2a dihambat dan memperpanjang hidup CL (Anonimous 1996). Terdapat
korelasi positif antara konsentrasi estradiol dan level reseptor oksitosin uterus (Parkinson et al. 1990 dalam Beard et al. 1994).
Konsentrasi estradiol pada rusa betina bunting dengan 1 corpus luteum dan 3 corpora lutea tidak berbeda, demikian juga pada rusa betina yang tidak bunting. Pada rusa merah betina bunting dan yang tidak bunting konsentrasi estradiol terus menurun dan mencapai nilai terendah pada umur kebuntingan 160 sampai 190 hari pada bulan November dengan konsentrasi estradiol 5 - 10 pg/ml (Kelly et al.
1982). Selanjutnya konsentrasi estradiol meningkat secara bertahap dan secara signifikan me ncapai konsentrasi tertinggi 35,0 pg/ml menjelang kelahiran. Sementara itu betina yang tidak bunting menunjukkan perubahan yang sama, konsentrasi estradiol tetap menurun sampai bulan Januari dan meningkat secara gradual hingga mencapai 12 pg/ml hingga awal Februari.
Efek estrogen pada poros hipotalamus dapat bersifat positif dan negatif. Efek negatif dapat bervariasi tergantung pada musim, pubertas, me nyusui dan nutrisi. Kehadiran progesteron pada fase luteal siklus estrus, meningkatkan efek negatif pada estrogen dalam pelepasan LH dan FSH sehingga pematangan folikel dan ovulasi terhambat. Umpan balik positif dengan peningkatan produksi estrogen dalam ketidakhadiran progesteron meningkatkan sekresi LH ke dalam peredaran darah. Selanjutnya di bawah pengaruh serta peran LH yang disekresikan dari hipofisis anterior terjadilah ovulasi.
sesuai dengan pertumbuhan (Anonimous 1996). Konsentrasi estrogen di dalam folikel de Graaf mencapai kira-kira 160 pg/ml (Pineda dan Bowen 1989).
Gelombang Folikel
Menurut Hafez (1993) proses pertumbuhan dan pematangan folikel merupakan suatu seri berurutan transformasi subseluler dan molekuler dari berbagai komponen folikel seperti oosit, sel-sel granulosa dan theca. Proses ini dipengaruhi oleh berbagai faktor intraovarial, intra folikuler dan isyarat hormonal, yang menuju pada sekresi androgen dan estrogen.
Menurut Adam et al. (1994), perkembangan gelombang folikel pada sapi digambarkan sebagai pertumbuhan sejumlah besar folikel- folikel kecil yang diikuti oleh seleksi satu folikel dominan dan folikel selebihnya beregresi. Rata-rata gelombang folikel dideteksi pada hari ke-0 (hari ovulasi), hari ke-10 untuk yang mempunyai dua gelombang atau hari kesembilan dan ke-16 untuk yang mempunyai tiga gelombang. Jadi rata-rata interval waktu antara setiap gelombang folikel berkisar antara tujuh sampai sembilan hari.
Dari pengamatan memakai ultrasonografi dengan jelas telah dinyatakan bahwa perkembangan folikuler ovarium selama siklus estrus ditandai oleh dua atau tiga gelombang folikuler berurutan per siklus (Pierson dan Ginther 1987; Sirois dan Fortune 1990). Gelombang folikuler terdiri atas suatu kelompok folikel dengan diameter lima milimeter atau lebih yang muncul rata-rata setiap tujuh hari. Siklus estrus dengan tiga gelombang akan lebih panjang dan memiliki fase luteal yang lebih panjang. Hal ini memberi kesan bahwa jumlah gelombang per siklus diukur oleh waktu regresi luteal.
intrafolikuler (aktivin dan inhibin) atau faktor- faktor pertumbuhan yang mungkin meningkatkan respon terhadap FSH dan atau potensi pertumbuhan folikel- folikel dominan yang terseleksi.
Fase pertumbuhan folikel terdiri atas folikel primer, sekunder, tertier dan folikel de Graaf. Folikel primer dibentuk selama perkembangan foetal atau segera setelah kelahiran. Folikel primer berasal dari satu sel epitel benih yang membelah diri. Sel-sel ini selanjutnya menebal dan membentuk sel-sel granulosa. Oosit terdapat di dalam folikel tersebut. Pertumbuhan folikel primer menjadi folikel sekunder merupakan pertumbuhan tahap kedua yang terjadi waktu ternak menjalani proses pendewasaan tubuh. Folikel sekunder berkembang ke arah stroma korteks. Pada stadium ini terbentuk suatu zona pelusida. Tidak semua folikel primer menjadi folikel sekunder.
Selanjutnya folikel sekunder berkembang menjadi folikel tertier. Folikel yang telah terseleksi akan berkembang dengan ciri spesifik, yaitu terjadinya pemisahan sel- sel folikel dengan terbentuknya antrum, suatu rongga yang akan terisi cairan folikel. Cairan folikuler ini kaya akan protein dan estrogen. Tanpa tahap ini fo likel tidak akan berovulasi karena sekresi estrogen sangat penting sebagai umpan balik positif terhadap sekresi LH dari hipofisis anterior atau Gn-RH-LH dari hipotalamus. Folikel tertier berkembang menjadi folikel de Graaf. Pertumbuhan terakhir ini lebih cenderung disebut proses pematangan folikel, sebab folikel tertier hanya berbeda besarnya dari filokel de Graaf (Barros et al. 1992).
Sinkronisasi Estrus
menyatakan bahwa sinkronisasi estrus ini mengarah pada hambatan ovulasi dan penundaan aktivitas corpus luteum.
Macmillan dan Peterson (1993) membagi tujuan sinkronisasi dalam dua tujuan utama, yaitu: (1) mendapatkan seluruh ternak yang diberikan perlakuan mencapai estrus dalam waktu yang diketahui dengan pasti sehingga masing-masing ternak tersebut dapat diinseminasi dalam waktu yang bersamaan dan (2) untuk menghasilkan angka kebuntingan yang sebanding atau lebih baik dibanding dengan kelompok yang tidak mendapat perlakuan yang dikawinkan secara alamiah (pejantan) atau dengan inseminasi buatan. Selanjutnya Toelihere (1985) menyatakan bahwa keserentakan estrus dan ovulasi sedikitnya akan mempertinggi kemungkinan pertemuan ovum dan sperma dalam proses pembuahan untuk memulai pertumbuhan dan perkembangan individu baru.
Sinkronisasi Estrus dengan Hormon Progesteron dan PMSG
Secara alamiah hormon progesteron dihasilkan oleh corpus luteum, plasenta dan kelenjar adrenal. Berdasarkan sifat kimiawinya hormon ini merupakan hormon steroid. Dari segi fungsinya hormon ini dapat mempersiapkan uterus untuk memelihara kebuntingan. Kasus-kasus aborsi pada kebuntingan muda di bawah tiga bulan lebih banyak ditimbulkan oleh pengaruh kekurangan produksi hormon ini.
Dikenal beberapa metode pemberian progesteron yaitu melalui injeksi setiap hari, secara oral melalui makanan (CAP, MAP, MGA), spiral intravaginal dan implan subkutan. Penggunaan progesteron dalam sinkronisasi estrus pertama kali dilaporkan oleh Ulberg et al. (1951) dalam Toelihere (1985) yang menyatakan bahwa apabila dimulai kira-kira pada 15 hari sesudah akhir estrus, penyuntikan 50 mg progesteron dalam minyak setiap hari atau 500 mg dalam bentuk repositol setiap 10 hari akan menghambat estrus dan ovulasi pada sapi. Estrus terjadi dalam waktu lima samp ai enam hari dengan rata-rata 5,2 hari setelah penghentian penyuntikan.
gonadotropin (LH) dari hipofisis anterior dengan memperpanjang atau mempertahankan fase corpus luteum sehingga ternak berada pada periode luteal (Tomaszewska 1991). Terdapat dua cara yang umum dipakai dalam penggunaan progesteron, yaitu metode pemberian jangka pendek dan jangka panjang. Kehadiran hormon progesteron dapat menimbulkan umpan balik negatif terhadap sekresi hormon lain terutama GnRH yang menghambat lonjakan sekresi LH. Konsekuensi dari mekanisme ini adalah tidak terjadi pematangan folikel serta ovulasi. Atas dasar mekanisme kerjannya, hormon ini kemudian digunakan sebagai salah satu preparat untuk memanipulasi aktivitas reproduksi pada ternak. Selama konsentrasi hormon progesteron masih tinggi di dalam sirkulasi darah, folikel dominan dari gelombang pertama dan kedua sulit mencapai folikel ovulatori. Hal ini disamping karena lonjakan sekresi LH yang sulit terjadi, juga disebabkan karena folikel- folikel dominan menurun fertilitasnya.
Kadar hormon progesteron meningkat pada ternak yang bersiklus normal setelah mendapat implan progesteron (CIDR), yakni sebesar 6,7 ng/ml pada saat 6 jam setelah imp lan, kemudian menurun menjadi 4,9 ng/ml pada saat pencabutan implan tersebut (Macmillan et al. 1991). Sedangkan hasil penelitian Peterson dan Henderson (1990) yang memberikan implan progesteron selama 15 hari pada ternak yang diovariektomi diperoleh konsentrasi hormon progesteron sebesar 0,3 ng/ml pada saat implan, kemudian meningkat menjadi 8,6 ng/ml 6 jam setelah implan. Selanjutnya turun menjadi 2,3 ng/ml pada saat pencabutan implan progesteron. Sementara apabila penggunaan implan progesteron dilakukan di awal siklus estrus (hari kedua atau ketiga), akan meningkatkan konsentrasi hormon progesteron dari 0,5 ng/ml sehari setelah impalan menjadi 6,5 ng/ml pada saat pencabutan implan progesteron. Hal ini membuktikan bahwa tidak ada perbedaan yang berarti antara konsentrasi hormon progesteron sehari setelah implan dengan konsentrasinya pada saat pencabutan implan.
lebih tepat (Beal 1996; Macmillan dan Peterson 1993; Odde 1990). Macmillan dan Peterson (1993) menyatakan bahwa konsentrasi atau kandungan hormon progesteron di dalam kemasan CIDR (Controlled Internal Drug Release) adalah sebesar 1,9 gram untuk sapi dan domba/kambing 0,3 gram.
Menurut Kinder et al. (1996) terdapat korelasi negatif antara konsentrasi progesteron plasma dan level reseptor oksitosin. Progesteron bertanggung jawab untuk menstimulasi beberapa faktor yang berhubungan dengan produksi PGF2a
seperti prostaglandin sintetase dan menekan perkembanga n reseptor oksitosin di dalam uterus (Mann dan Lamming 1995).
Lebih lanjut Flint (1995) menyatakan bahwa terdapat autoregulasi reseptor progesteron di dalam endometrium yang berhubungan dengan luteolisis. Reseptor progesteron pada sel-sel epitel luminal endometrium meninggi sesaat sebelum estrus di bawah pengaruh stimulasi estrogen ovulatoris, selanjutnya progesteron yang disekresikan oleh CL menyebabkan perubahan-perubahan di endometrium, termasuk pengendalian penurunan reseptor progesteron, dan sesudah kurang lebih sembilan hari, konsentrasi reseptor progesteron menurun. Regulasi penurunan reseptor progesteron menyebabkan hilangnya efek penghambatan progesteron terhadap aktivitas reseptor estrogen, sehingga estrogen yang diproduksi selama gelombang folikuler ketiga menyebabkan reseptor oksitosin berpasangan dengan sistem second massenger yang mengontrol produksi PGF2a pada akhir fase luteal
siklus estrus. Sekresi oksitosin oleh CL yang distimulasi oleh sekresi PGF2a uterin
menimbulkan gelombang produksi PGF2a pada interval rata-rata enam jam
melalui hubungan umpan balik positif antara ovarium dan uterus.
Penelitian-penelitian tentang penggunaan hormon progesteron dalam kegiatan sinkronisasi estrus telah dilakukan dan lebih diarahkan pada penentuan program sinkronisasi yang berhasil pada ternak. Hormon progesteron seperti
Melangosterol Asetate (MGA), Controlled Internal Drug Release Bovine (CIDR-B), Progesterone Releasing Intravaginal Device (PRID) dan Norgestomet Implant
dengan umur keberadaan CL (16 sampai 18 hari) untuk mendapatkan sinkronisasi yang efektif pada dua sampai empat hari setelah implan atau perlakuan dihentikan. Perlakuan ini tidak akan berpengaruh terhadap keberadaan fungsi CL akan tetapi lebih pada penekanan output gonadotropin oleh hipofisis anterior. CL yang terbentuk setelah ovulasi akan tumbuh dan menghasilkan progesteron sebagaimana siklus normal. Selanjutnya CL akan mulai regresi pada hari ke-16 siklus estrus.
Percobaan dengan menggunakan preparat progesteron eksogenus dalam bentuk apa saja, jika dilakukan lebih dari tujuh hari (antara 12 sampai 16 hari atau rata-rata 14 hari) akan menghasilkan respons sinkronisasi estrus yang lebih bagus, bahkan mencapai persentase estrus pada ternak sebesar 100% (Kaneko et al.
1991), akan tetapi angka konsepsi yang diperlihatkan dari inseminasi pada saat estrus hasil sinkronisasi tersebut masih rendah (Jochle 1993; Macmillan et al. 1991; Savio et al. 1993; Stock and Fortune 1993; dan Wehrman et al. 1993). Penyebab rendahnya fertilitas ternak tersebut disebabkan oleh perpanjangan waktu perkembangan folikel dominan yang ada saat perlakuan, yang mengakibatkan menurunnya viabilitas oosit yang dikandung folikel dominan tersebut (Sirois and Fortune 1990). Bervariasinya respons ternak terutama konsepsinya terhadap kegiatan sinkronisasi estrus, kadang disebabkan oleh konsentrasi progesteron pada saat inseminasi.
Fenomena ini disebabkan karena pada saat implan progesteron dicabut, CL pada ternak tersebut masih fungsional. Masalah ini hanya dapat didekati melalui penggunaan zat luteolitik atau dengan melakukan implantasi progesteron lebih lama dari masa fungsional CL. Sehingga ketika implan progesteron dihentikan CL telah beregresi.
Selain itu horse Anterior Pituitary (hAP) merupakan ekstrak hipofisis anterior kuda mengandung FSH yang dimurnikan dimana terikat LH dengan konsentrasi yang sangat kecil. Tujuan penggunaan hormon gonadotropin PMSG adalah untuk menginduksi pematangan folikel, estrus dan ovulasi. PMSG sering digunakan setelah pemberian progesteron untuk menstimulasi estrus dan ovulasi.
Pregnant Mare Serum Gonadotropin adalah hormon gonadotropin yang terdapat di dalam serum kuda bunting. PMSG akhir-akhir ini lebih dikenal dengan sebutan eCG atau equine Chorionic Gonadotropin (Hafez 1993). Tujuan penggunaan hormon gonadotropin adalah untuk menginduksi pematangan folikel, estrus dan ovulasi. Menurut Hendrics dan Hill (1978) bahwa PMSG dapat digunakan untuk meningkatkan jumlah folikel de Graaf dan jumlah ovulasi. Walaupun demikian terdapat variasi pada setiap ternak terhadap keragaman respons. McDonald (1989) melaporkan bahwa sumber PMSG adalah mangkok endometrium kuda bunting pada umur kebuntingan 40 sampai 140 hari. Kadar PMSG di dalam serum darah mencapai puncaknya pada umur kebuntingan 60 sampai 110 hari, sedangkan Allen dan Stewart (1978) mengemukakan bahwa kadar tertinggi tercapai pada kebuntingan hari ke-55 sampai hari ke-75.
Menurut Reeves (1987) secara kimiawi PMSG mempunyai struktur yang mirip dengan FSH dan LH. PMSG merupakan hormon glikoprotein dengan berat molekul 60.000 Dalton yang terdiri atas dua sub unit, yaitu sub unit a dan sub unit ß. PMSG memiliki kandungan karbohidrat yang tinggi terutama pada gugus asam sialat. Konsentrasi asam sialat yang tinggi ini diduga menyebabkan masa paruh PMSG cukup panjang bila dibandingkan dengan hormon gonadotropin yang lainnya.
Moore (1984) dan Alfuraiji et al. (1993) menyatakan bahwa keuntungan menggunakan PMSG untuk merangsang peningkatan pertumbuhan folikel preovulatoris adalah tersedia dalam jumlah yang besar dengan harga murah dan penggunaannya cukup hanya diberikan satu kali saja karena memiliki masa paruh yang panjang. Waktu paruh PMSG menurut Papkoff (1978) dan Reeves (1987) berkisar antara enam sampai tujuh hari.
menyebabkan pertumbuhan folikel dan sedikit luteinisasi (Toelihere 1985). Dari beberapa hasil penelitian penggunaan hormon progesteron tunggal dalam sinkronisasi estrus memberi respons estrus yang tinggi jika dilakukan dalam waktu yang panjang sesuai umur corpus luteum, namun angka konsepsi yang dicapai umumnya rendah (Jochle 1993; Savio et al. 1993; Stock dan Fortune 1993; Wehrman et al. 1993).
Improvisasi yang dapat dilakukan pada spesies cervidae adalah sinkronisasi estrus dengan menggunakan berbagai preparat hormon sintetik. Beberapa metode sinkronisasi estrus pada ungulata yang dapat diaplikasikan pada rusa betina yaitu induksi progesteron. Dengan perlakuan ini masa hidup corpus luteum diperpanjang, sehingga membutuhkan waktu yang cukup lama 12 - 14 hari baru menunjukkan gejala estrus. Pada domba pemberian progesteron dapat dilakukan dengan metode spons dan implan intravaginal. Spons intravaginal mengandung 30 - 40 mg flurogestone acetate (FGA: clorolone) atau 60 mg
medroxy progesterone acetate (MPA).
Implan CIDR pada fallow deer dan red deer umumnya dilakukan selama 12 - 14 hari, secara umum sangat efektif untuk merangsang terjadinya estrus yang sinkron dalam waktu 48 jam setelah pencabutan CIDR. Cara ini juga telah berhasil dilakukan dengan sukses pada chital deer, elk deer dan rusa sambar (Asher et al. 2000). Penggunaan CIDR pada beberapa penelitian dikombinasikan dengan hormon lain untuk meningkatkan efeknya dalam menimbulkan estrus dan ovulasi. Kombinasi dengan hormon equine Chorionic Gonadotropin (eCG atau
Pregnant Mare Serum Gonadotropin) diberikan pada saat atau mendekati pencabutan CIDR (Agro et al. 1992; Asher et al. 2000); dikombinasikan dengan 300 IU PMSG pada hari pencabutan CIDR (Anonim 1995; Jabbour et al. 1993; Mylrea et al. 1992); kombinasi dengan FSH atau cloprostenol (Asher et al. 1992). Metode yang sering dipakai yaitu Progesterone Intravaginal Device
(PRID), dalam kemasan spons yang mengandung Medroxy Progesterone Acetate
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini telah dilaksanakan selama bulan Januari 2006 sampai dengan Juli 2006 berlokasi di Taman Margasatwa Ragunan (TMR) Jakarta. Pelaksanaan penelitian ini melibatkan kerjasama dengan laboratorium di lingkungan Institut Pertanian Bogor (IPB) antara lain dengan Unit Rehabilitasi Reproduksi (URR) Departemen Klinik, Reproduksi dan Patologi Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH-IPB).
Materi Penelitian
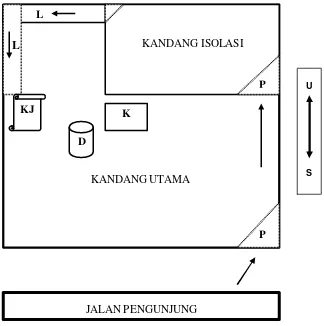
Hewan percobaan yang digunakan adalah rusa timor (Cervus timorensis) yang berada di Taman Margasatwa Ragunan (TMR) Jakarta. Rusa yang ditranslokasi terdiri atas 6 ekor rusa betina. Secara umum rusa harus dan telah memenuhi kualifikasi tubuh sehat, tidak bunting, tidak cacat dan ukuran tub uh proporsional dengan kisaran umur 2 - 4 tahun. Rusa betina ditempatkan dalam kandang (satu unit) dengan ukuran 10 x 10 meter dan didalam kandang tersebut terdapat pula kandang isolasi (4 x 6 meter) untuk mempermudah penanganan rusa memasuki lorong menuju kandang jepit. Alat kelengkapan dalam kandang, yakni tempat pakan, tempat minum, kandang jepit dan kubangan.
K
JALAN PENGUNJUNG
KANDANG UTAMA
JALAN PENGUNJUNG K
KANDANG ISOLASI
L
D
U
S
Gambar 2 Denah kandang penelitian Keterangan :
1. Kandang utama 10 x 10 meter 2. Kandang isolasi 4 x 6 meter 3. Kubangan (K)
4. Drum tempat minum (D) 5. Kandang jepit (KJ)
6. Lorong dengan lebar 50 cm (L) 7. Pintu (P)
8. Tempat pakan (konsentrat)
Pakan yang diberikan pada rusa selama penelitian adalah hijauan segar yang telah tersedia di lokasi penelitian seperti rumput gajah, rumput lapangan dan leguminosa sebanyak 5 - 7 kg/ekor/hari yang diberikan tiga kali sehari, yaitu pada pagi, siang dan sore. Sedangkan pakan lain yang diberikan berupa konsentrat (GALAC) sebanyak 3 kg/hari yang diselingi dengan campuran konsentrat dan
L
KJ
dedak dengan perbandingan 2 : 3, pemberiannya dilakukan pada jam 08.00 - 09.00. Selain itu pakan tambahan lain berupa campuran dari pepaya, jagung, ubi jalar, singkong, kacang panjang, buncis, wortel, pisang dan ketimun yang telah dipotong-potong dengan ukuran kecil dan diberikan setelah pemberian konsentrat sebanyak 2 - 3 kg/hari. Preparat hormon yang digunakan pada penelitian adalah dalam bentuk CIDR-G (Agriculture Devition, CHH Plastic products Ltd, Hamilton) yang mengandung 0,3 gram progesteron untuk implan intravaginal, aplikator (gun) dan PMSG (Laboratorios Hipra, S.A., Spain) yang disuntikkan secara intramuskuler.
A B
Gambar 3 A. CIDR-G (Agriculture Devition, CHH Plastic products Ltd, Hamilton); B. PMSG (Laboratorios Hipra, S.A., Spain)
Metode Penelitian
Tahapan selanjutnya adalah melakukan masa adaptasi di kandang penelitian selama tiga bulan. Tujuannya untuk membiasakan rusa berada di kandang kecil dan melewati lorong yang disediakan serta mengadaptasikan dirinya dengan lingkungan dan teknisi di lapangan untuk mencegah stres selama perlakuan. Memasuki bulan keempat rusa-rusa tersebut dimasukkan dalam kandang isolasi (4 x 6 meter) yang terdapat di dalam kandang pengamatan agar mudah dikendalikan pada saat perlakuan. Adaptasi ini dilakukan selama dua bulan. Selama masa adaptasi ini, seleksi terhadap rusa yang dicurigai bunting atau kondisi tubuhnya tidak layak untuk diberi perlakuan tetap dilakukan, sehingga pada waktu perlakuan rusa yang digunakan benar-benar dalam kondisi baik.
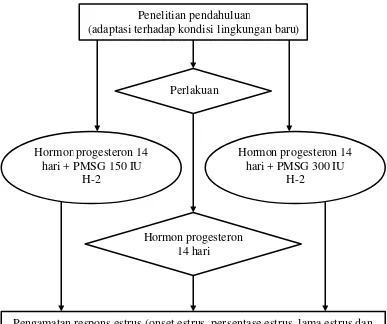
Pada saat rusa betina akan diberi perlakuan hormon progesteron dan kombinasinya dengan PMSG digiring satu per satu ke arah kandang jepit kemudian dilakukan sinkronisasi dengan menggunakan hormon progesteron secara intravaginal dan dihitung hari ke-0. Setelah 14 hari untuk perlakuan pertama (2 ekor rusa betina) hormon progesteron dilepas. Untuk perlakuan kedua dan ketiga (masing- masing 2 ekor rusa betina) perlakuannya sama denga n perlakuan pertama akan tetapi 2 hari sebelum hormon progesteron dilepas, dilakukan penyuntikan PMSG masing- masing 150 IU dan 300 IU secara intramuskuler (im). Untuk selanjutnya pengamatan estrus sebagai respons sinkronisasi dilaksanakan setiap jam selama 4 hari berturut-turut (06.00 - 18.00) terutama setelah hormon progesteron dilepas.
Kegiatan penelitian:
I. Perlakuan pemberian hormon progesteron dan kombinasinya dengan PMSG. II. Pengamatan respons estrus yang terdiri dari: pemunculan (onset) estrus,
persentase estrus, lama estrus dan intensitas estrus.
Perlakuan
Perlakuan
Hormon progesteron 14 hari Hormon progesteron 14
hari + PMSG 150 IU H-2
Hormon progesteron 14 hari + PMSG 300 IU
H-2 Penelitian pendahuluan
(adaptasi terhadap kondisi lingkungan baru)
Pengamatan respons estrus (onset estrus, persentase estrus, lama estrus dan intensitas estrus) setiap jam selama 4 hari berturut-turut (06.00 - 18.00)
setelah hormon progesteron dilepas
Tabel 1 Perlakuan pemberian hormon progesteron dan kombinasinya dengan PMSG
Kelompok perlakuan Perlakuan
(hormon dan waktu pemberiannya)
Banyaknya rusa (ekor) I. Progesteron
II. Progesteron + PMSG 150 IU H-2
III. Progesteron + PMSG 300 IU H-2
Progesteron intravaginal 14 hari
Progesteron intravaginal 14 hari dan 150 IU PMSG 2 hari sebelum pencabutan progesteron
Progesteron intravaginal 14 hari dan 300 IU PMSG 2 hari sebelum pencabutan progesteron
2
2
2
Jumlah rusa 6
Keterangan: H-2 adalah penyuntikan PMSG 2 hari sebelum hormon progesteron dilepas
Pengamatan Estrus
Pengamatan estrus dilakukan setiap jam selama 4 hari berturut-turut (06.00 - 18.00) setelah perlakuan, khususnya setelah hormon progesteron dicabut. Penentuan rusa betina yang estrus didasarkan pada tanda-tanda yang nampak dari luar (Tabel 2). Inventarisasi tanda-tanda estrus dilakukan selama fase estrus.
Tabel 2 Tanda-tanda estrus pada rusa percobaan
No. Tanda-tanda estrus
1 2 3 4 5 6 7 8 9 10
Nafsu makan menurun
Mendekati betina lain (gelisah) Mengeluarkan suara khas Urinasi
Mengintip pejantan (kandang lain) Vulva merah, bengkak dan basah Lendir transparan
Jika dipegang punggung diam (menaiki betina lain) Tidak menolak jika vulva dipegang
Diam dinaiki sesama rusa lain
Peubah yang Diamati
1. Persentase estrus, yaitu banyaknya rusa yang estrus dibagi jumlah rusa yang diberi perlakuan dikali seratus persen.
2. Onset estrus (jam), yaitu interval waktu antara sesudah perlakuan sampai gejala estrus terlihat.
3. Lama estrus (jam), yaitu interval antara munculnya gejala estrus sampai estrus tidak tampak terlihat.
4. Intensitas estrus, yaitu tingkat aktivitas tingkah laku estrus yang muncul selama fase estrus berlangsung yang dilakukan secara visual. Tingkat intensitas dibagi dalam tiga kategori, yaitu:
b. Intensitas sedang (skor dua), rusa memperlihatkan beberapa tanda-tanda estrus kecuali gejala diam dina iki (standing heat).
c. Intensitas tinggi (skor tiga), rusa memperlihatkan semua tanda-tanda estrus terutama diam dinaiki.
Analisis Statistik
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL). Untuk mengetahui pengaruh perlakuan, dilakukan analisis sidik ragam dengan Statistical Analysis System (SAS), selanjutnya untuk mengetahui perbedaan nilai tengah perlakuan dilakukan uji Duncan pada a = 0,05 (Steel dan Torrie 1995).
HASIL DAN PEMBAHASAN
Kondisi Lokasi dan Rusa Penelitian
Kondisi lokasi penelitian yang berada di Taman Margasatwa Ragunan (TMR) Jakarta merupakan tempat yang sangat ideal dalam melakukan penelitian, dimana telah terdapat fasilitas pendukung berupa kandang permanen yang terbuat dari bahan-bahan (besi) yang sengaja dibuat untuk jangka waktu pemakaian yang cukup lama dan lebih pada jaminan keselamatan satwa itu sendiri dan bagi para pengunjung yang ingin menambah wawasan pengetahuan terhadap berbagai macam satwa (yang dilindungi maupun yang tidak) di TMR tersebut. Disis i lain fasilitas penanganan kesehatan hewanpun telah cukup memadai dengan disediakannya tempat-tempat isolasi bagi satwa baru atau yang dicurigai mengidap suatu penyakit dan satwa yang mengalami kecelakaan sehingga perlu penanganan khusus untuk proses penyembuhan.
Jaminan terhadap kesehatan satwa didukung pula oleh tenaga-tenaga perawat dan tenaga-tenaga medis yang cukup trampil dalam menangani satwa itu sendiri. Sementara untuk pemberian pakan telah terorganisir dengan baik dengan disediakannya fasilitas angkutan dan lahan hijauan yang cukup luas sebagai cadangan pakan. Pengadaan rusa yang digunakan pada penelitian ini adalah rusa timor yang berada dalam satu kelompok dalam jumlah banyak yang terdiri dari jantan, betina serta anak-anak rusa yang dipisahkan dari kelompok rusa lain yang spesiesnya berbeda untuk menghindari adanya perkawinan antar rusa yang berbeda spesiesnya.
Dari awal pelaksanaan seleksi terhadap rusa betina yang akan digunakan sebagai materi penelitian diperoleh 15 ekor yang dilanjutkan dengan pemeriksaan kebuntingan (USG). Rusa yang dalam kondisi bunting tidak dimasukkan dalam kandang penelitian yang telah disediakan sebelumnya (terpisah dari kelompok). Rusa yang dicurigai tidak bunting langsung dipindahkan, dari 15 ekor diperoleh sebanyak 13 ekor. Dari jumlah tersebut kemungkinan akan berkurang dengan adanya seleksi lanjutan di kandang penelitian. Untuk melihat status reproduksi rusa betina di kandang penelitian dilakukan pengamatan siklus estrus alamiah, disamping itu proses adaptasi (penjinakan) terus dilakukan. Seiring dengan berjalannya waktu ternyata ditemukan beberapa rusa yang tidak layak sebagai materi penelitian yang disebabkan oleh kondisi rusa yang tidak dapat beradaptasi dengan lingkungan baru dikembalikan dan dikembalikan ke kelompok asalnya. Dari proses adaptasi yang dilakukan selama beberapa bulan diperoleh rusa-rusa betina yang telah memenuhi kriteria untuk diberi perlakuan dalam penelitian. Sedangkan pada saat mendekati perlakuan masih didapati rusa yang dalam kondisi sulit untuk dikendalikan dan sering membuat rusa lainnya yang telah jinak sering terus ik, inipun tetap dikeluarkan dan dikembalikan pada kelompok asalnya. Pada akhirnya diperoleh jumlah rusa (enam ekor) yang sesuai dengan kebutuhan penelitian.
Dengan penanganan yang tekun dan sabar, proses adaptasi terhadap rusa bisa dilaksanakan dengan cara memahami karakter dari rusa itu sendiri. Beberapa kiat yang bisa dilakukan antara lain adalah (1) rusa dipuasakan pada saat pertama memasuki kandang penelitian (adaptasi) dengan harapan pada saat membutuhkan makanan rusa telah mengenal perawat yang datang dengan membawa makanan; (2) diusahakan kandang yang digunakan tidak terlalu luas untuk menghindari ruang gerak dari rusa, sehingga dalam kondisi tersebut rusa tidak mempunya i kesempatan untuk menabrak dinding kandang; (3) beberapa hari pertama dikandang adaptasi selalu tersedia pakan yang cukup dan air minum secara ad-libitum; (4) tidak melakukan gerakan-gerakan yang dapat membuat rusa curiga; (5) berusaha untuk selalu memegang punggung rusa atau kepalanya (dalam kandang) untuk mempermudah penaganan setela h dikandang yang lebih luas; (6) menggunakan peralatan kandang yang sama setiap hari dengan warna yang cenderung gelap; (7) menyediakan tempat kubangan pada kandang yang lebih luas, ini berhubungan dengan sifat rusa itu sendiri yang selalu berkubang pada kondisi cuaca panas; (8) hijauan yang diberikan diusahan dalam bentuk segar, hijauan yang segar akan selalu merangsang konsumsi hijauan yang baik pada rusa; (9) pemberian pakan tambahan (konsentrat) maupun jenis kacang-kacangan dan ubi- ubian sangat membantu pemenuhan kebutuhan nutrisi rusa dalam kandang adaptasi; (10) sesering mungkin berada disekitar kandang rusa untuk lebih membiasakan rusa mengenal perawat dan (11) melakukan adaptasi rusa yang paling efektif agar mudah penanganannya adalah dengan memisahkan anak-anak rusa yang masih berumur dua bulan dan ditempatkan dalam kandang tersendiri, sehingga akan diperoleh rusa yang jinak karena penangan yang lebih awal.
Pengaruh Pemberian Hormon Progesteron dan Kombinasinya dengan PMSG
Respons Timbulnya Estrus