SELEKSI CENDAWAN POTENSIAL PENGHASIL
ENZIM ENDOGLUKANASE (KARBOKSIMETIL SELULASE)
DAN ISOLASI GEN PENYANDINYA
NEO ENDRA LELANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul Seleksi Cendawan Potensial Penghasil Enzim Endoglukanase (Karboksimetil Selulase) dan Isolasi Gen Penyandinya adalah karya saya bersama dengan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2009
ABSTRACT
NEO ENDRA LELANA. Selection of Potential Fungal for Endoglucanase (Carboxymethyl Cellulase) Producer and Isolation of Its Gene. Supervised by UTUT WIDYASTUTI and NAMPIAH SUKARNO
Cellulose is the most renewable resources in the earth. Enzymatic hydrolysis of cellulose can be achieved by synergistic action of three types of cellulase enzyme, namely endoglucanases, exoglucanases/cellobiohydrolases and glucanases. Filamentous fungi, particularly Aspergillus and Trichoderma, are well
known as efficient producers of cellulolytic enzymes.
The aims of the research were to screen endoglucanases or carboxymethyl cellulase (CMCase) from Aspergillus niger and Trichoderma isolates and to
isolate and characterize gene encoding endoglucanase from selected isolate. Fungal isolates were screened by plate screening method in agar medium containing 1% carboxymethyl cellulose with congo red staining and the fungal cellulase activity was measured by dinitrosalicilic acid (DNS) methods from seven days filtrate culture. Trichoderma reesei was used as a standard isolate for
cellulase enzyme activity test. Gene encoding endoglucanase of A. niger IPB1,
designated eglA, was isolated from RNA to obtain coding sequence (CDS) with
RT-PCR using specific primer EAF and EAR. The resulting fragment coding
eglA was cloned into pGEM-T Easy plasmid, introduced into E. coli DH5α and
sequenced by ABI Prism 310 automated DNA sequencer. Characterization of
eglA gene was carried out by using several software programs from webserver
that available online.
Quantitative assay of cellulolytic activity showed that A. niger IPB1 had
highest value of specific activity, 5.74 U/mg, compared to other isolates and standard isolate tested and had been chosen as an isolate for isolation gene encoding endoglucanase. The full length of CDS region of eglA gene from A. niger IPB1 had been successfully isolated and cloned into pGEM-T Easy plasmid.
The gene was 720 bp in length and encoding 239 amino acids. The result of BLAST analysis of this gene showed high similarity, 97 (E-value 1.1e-148) - 99% (E-value 3.7e-152 ) , with other A. niger endoglucanases obtained from database.
Based on deduced amino acids sequenced, eglA of A. niger IPB1 was a secreted
protein belonging to glycoside hydrolase (GH) family 12. This enzyme lacked of carbohydrate binding moduls (CBM). From sequence comparisons with GH12 homolog with known sequence in which the catalytic residue had been identified, the identities of the catalytic nucleophile and the acid-base of eglA A. niger IPB1
were Glu116 and Glu 204, respectively. Glucosyl binding site were Trp (22, 49, 51, 85, 120, 144), Tyr (61, 98, 115) and Phe (163, 179). Phylogeny analysis showed that the eglA of A. niger IPB1 had close relationship with another Aspergillus group.
RINGKASAN
NEO ENDRA LELANA. Seleksi Cendawan Potensial Penghasil Enzim Endoglukanase (Karboksimetil Selulase) dan Isolasi Gen Penyandinya. Dibimbing oleh UTUT WIDYASTUTI dan NAMPIAH SUKARNO
Selulosa merupakan sumber daya terbarukan yang paling berlimpah di alam. Secara enzimatik, selulosa dapat dihidrolisis oleh kerja sinergis tiga tipe enzim selulase, yaitu endoglukanase, eksoglukanase/selobiohidrolase dan glukosidase. Kelompok cendawan berfilamen, terutama Aspergillus dan Trichoderma diketahui merupakan organisme penghasil selulase yang efisien
Penelitian ini bertujuan untuk melakukan skrining terhadap enzim endoglukanase atau karboksimetil selulase (CMCase) dari beberapa isolat
Aspergillus niger dan Trichoderma koleksi Bagian Mikologi Departemen Biologi
F.MIPA Institut Pertanian Bogor dan Pusat Penelitian Sumber Daya Hayati dan Bioteknologi Institut Pertanian Bogor serta mengisolasi dan mengkarakterisasi gen penyandi endoglukanase dari isolat cendawan potensial terpilih. Seleksi endoglukanase dilakukan dengan skrining pada media agar CMC menggunakan pewarnaan congo red dan pengujian aktivitas enzim menggunakan metode DNS
(asam dinitrosalisilat). T. reesei digunakan sebagai isolat standar dari aktivitas
enzim endoglukanase. Isolat potensial terpilih selanjutnya digunakan untuk isolasi gen penyandi endoglukanase. Daerah coding sequence (CDS) diisolasi
menggunakan RT-PCR dengan primer spesifik EAF (5’-CTCTAACGCCCAACA TGAAG-‘3) dan EAR (5’-TCTAGAACCCTAGTTGACACTGG-‘3) dari RNA total. Produk amplifikasi yang diharapkan ialah sebesar 743 bp. Gen eglA yang
diperoleh selanjutnya diklon ke dalam plasmid pGEMT-Easy dan diintroduksikan
ke dalam E. coli DH5α. Hasil klon kemudian di urutkan nukleotidanya dengan
ABI Prism 310 automated DNA sequencer dan dikarakterisasi menggunakan
beberapa software yang tersedia secara online.
Berdasarkan uji kualitatif, A. niger IPB1 menghasilkan nisbah selulolitik
lebih besar dari isolat Trichoderma dan beberapa A. niger tetapi lebih kecil dari A. niger KB12 dan A. niger TSR52. Namun uji kuantitatif dengan metode DNS
menunjukkan isolat A. niger IPB1 mempunyai aktivitas spesifik tertinggi
dibanding isolat-isolat lainnya termasuk T. reesei, yaitu 5.74 U/mg. Isolat ini
selanjutnya dipilih untuk dilakukan isolasi terhadap gen penyandi endoglukanasenya. Gen eglA berhasil diisolasi dan di klon ke dalam plasmid
pGEM-T Easy. Gen ini terdiri atas 720 bp dan mengkodekan 239 asam amino. Analisis BLAST menunjukkan eglA mempunyai kemiripan yang tinggi, yaitu 97
(E-value 1.1e-148) - 99% (E-value 3.7e-152) dengan endoglukanase A. niger
lainnya dari database. Berdasarkan deduksi asam aminonya, eglA termasuk ke
dalam famili glikosida hidrolase famili 12. Enzim ini tidak mengandung
carbohydrate binding moduls (CBM). Berdasarkan perbandingan struktur
homolog dengan struktur endoglukanase lain yang sudah diketahui, residu-residu yang berperan dalam fungsi katalitik EglA A.niger maupun pengikatan
diprediksikan tersusun atas residu Trp (posisi 22, 49, 51, 85, 120, 144), Tyr (61, 98, 115) dan Phe (163, 179). Analisis filogenetik menunjukkan eglA A. niger
IPB1 mempunyai kedekatan dengan kelompok Aspergillus lainnya.
© Hak cipta milik IPB, tahun 2009
Hak cipta dilindungi undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tesis tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar Institut Pertanian Bogor
SELEKSI CENDAWAN POTENSIAL PENGHASIL
ENZIM ENDOGLUKANASE (KARBOKSIMETIL SELULASE)
DAN ISOLASI GEN PENYANDINYA
NEO ENDRA LELANA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Seleksi Cendawan Potensial Penghasil Enzim Endoglukanase (Karboksimetil Selulase) dan Isolasi Gen Penyandinya
Nama Mahasiswa : Neo Endra Lelana NIM : P052060101
Disetujui
Komisi Pembimbing
Dr. Ir. Utut Widyastuti, MS Ketua
Dr. Ir. Nampiah Sukarno Anggota
Diketahui
Ketua Program Studi Bioteknologi
Dr. Ir. Muhammad Jusuf, DEA
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil A. Notodiputro, MS
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT dimana hanya atas karunia dan ijinNyalah karya ilmiah ini dapat diselesaikan. Penelitian ini mengambil tema Seleksi Cendawan Potensial Penghasil Enzim Endoglukanase (Karboksimetil Selulase) dan Isolasi Gen Penyandinya dan telah dilaksanakan sejak bulan September 2007 sampai bulan Desember 2008. Dalam kesempatan ini penulis ingin mengucakan terima kasih yang tak terhingga kepada :
1. Dr. Utut Widyastuti dan Dr. Nampiah Sukarno selaku pembimbing yang telah memberikan bimbingan dan arahan selama berlangsungnya penelitian dan penulisan karya ilmiah ini.
2. Dr. Aris Tjahjoleksono selaku penguji luar komisi yang telah memberikan arahan dan masukan dalam penulisan karya ilmiah ini.
3. Departemen Kehutanan atas beasiswa yang diberikan kepada penulis dalam menempuh studi S2 ini.
4. Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Institut Pertanian Bogor atas semua fasilitas laboratoriumnya.
5. Proyek Kerjasama Kemitratan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) antara Departemen Pertanian dan Pusat Penelitian Sumber Daya Hayati dan Bioteknologi Institut Pertanian Bogor atas dana penelitiannya. 5. Seluruh staf pengajar di Program Studi Bioteknologi Sekolah Pascasarjana
IPB atas segala ilmu yang diberikan, beserta seluruh staf administrasi dan staf laboratorium atas segala bantuannya selama penulis menjalankan tugas belajar di IPB.
6. Ayah-Ibu tercinta, Bapak-Ibu mertua, Istriku Ika Prasasty dan anakku Ahmad Aulya Lathief tersayang, dan seluruh keluarga atas segala dukungan dan kesabaran dalam mendampingi penulis.
8. Teman-teman Lab. Biorin dan Genetika Molekuler : Pak Ulung, Pak Muzuni, Pak Hadi, Pak Mulya, Rizki, Mbak Pepi, Bu Srilis, Bu Yohana, Bu Ratna, Yulia, Niken, Nindya dan sebagainya atas dukungan yang diberikan.
9. Semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah memberikan bantuan kepada penulis dalam menyelesaikan penelitian ini.
Penulis menyadari bahwa tesis ini masih belum sempurna. Namun demikian penulis berharap semoga penelitian ini dapat berguna bagi pihak-pihak yang memerlukannya.
RIWAYAT HIDUP
Penulis dilahirkan di Sukoharjo pada tanggal 6 November 1978 dari pasangan Bapak Banendro dan Ibu Sriyati. Penulis merupakan anak pertama dari empat bersaudara.
Tahun 1996 penulis lulus dari SMA Negeri 7 Surakarta dan pada tahun berikutnya lulus seleksi masuk UNS melalui jalur UMPTN dan selesai pada tahun 2002. Tahun 2006 penulis diterima di Program Studi Bioteknologi Sekolah Pascasarjana IPB dengan beasiswa dari Departemen Kehutanan Republik Indonesia.
DAFTAR ISI
2.2.2 Struktur organisasi enzim selulase ... 7
2.2.3 Mekanisme hidrolisis oleh selulase ... 8
2.3 Glikosida Hidrolase Famili 12 ... 9
2.4 Mikroorganisme Penghasil Selulase ... 10
2.5 Sistem Selulolitik pada Cendawan ... 12
III. BAHAN DAN METODE ... 14
3.1 Waktu dan Tempat ... 14
3.2 Bahan Penelitian ... 14
3.3 Metode ... 14
3.3.1 Pemeliharaan biakan... 15
3.3.2 Uji aktivitas selulolitik... 15
3.3.2.1 Uji aktivitas selulolitik secara kualitatif ... 15
3.3.2.2 Uji aktivitas enzim endoglukanase secara kuantitatif . 16 3.3.3 Isolasi gen penyandi endoglukanase A. niger IPB1 ... 17
3.3.3.1 Isolasi RNA total ... 17
3.3.3.2 Sintesis cDNA total ... 18
3.3.3.3 Isolasi fragmen cDNA eglA ... 19
3.3.3.4 Pengklonan fragmen cDNA eglA ... 19
3.3.3.5 Seleksi transforman rekombinan ... 20
3.3.3.6 Analisis cDNA sisipan ... 20
3.3.4 Pengurutan nukleotida dan analisis urutan nukleotida ... 21
IV HASIL DAN PEMBAHASAN ... 23
4.1 Uji Aktivitas Selulolitik ... 23
4.1.1 Uji aktivitas selulolitik secara kualitatif ... 23
4.1.2 Uji aktivitas enzim endoglukanase secara kuantitatif ... 24
4.2 Isolasi Gen eglA A. niger IPB1... 25
4.2.1 Isolasi RNA total dari ... 25
4.2.3 Isolasi gen eglA... 27
4.2.4 Pengklonan gen eglA... 27
4.2.5 Verifikasi pengklonan gen eglA... 28
4..3 Pengurutan dan Karakterisasi Gen eglA A. niger IPB1... 29
4.3.1 Pengurutan gen eglA dan deduksi asam aminonya ... 29
4.3.2 Analisis kesejajaran urutan nukleotida eglA dengan database di GenBank... 30
4.3.3 Analisis situs pemotongan gen eglA ... 31
4.3.4 Analisis domain EglA... 32
4.3.5 Analisis hidrofobisitas EglA ... 34
4.3.6 Kekerabatan EglA A.niger IPB1 dengan endoglukanase organisme anggota famili GH12 lainnya berdasarkan struktur asam aminonya ... 36
V. SIMPULAN DAN SARAN ... 38
5.1 Simpulan ... 38
5.2 Saran ... 38
DAFTAR TABEL
Halaman 1 Kandungan selulosa dari berbagai sumber ... 4
2 Substrat selulosa dan turunannya ... 6
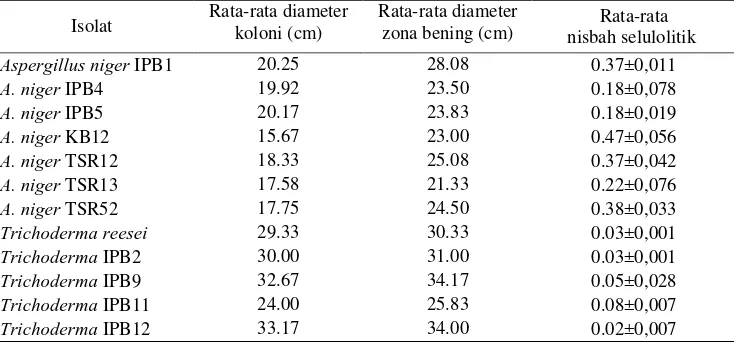
3 Nisbah selulolitik isolat A. niger dan Trichoderma setelah 24 jam
inkubasi pada suhu ruang ... 24
4 Aktivitas CMCase A. niger dan Trichoderma pada suhu 50oC yang
dipanen setelah 7 hari inkubasi ... 25
DAFTAR GAMBAR
Halaman 1 Struktur molekuler selulosa (Hilden & Johansson 2004) ... 5
2 Mekanisme hidrolisis oleh selulase. (a). Retaining mechanism (b). Inverting mechanism ... 9
3 Arsitektur domain famili glikosida hidrolase famili 12 (GH12) ... 10
4 Sinergisme hidrolisis selulosa oleh selulase non-kompleks (Lynd et al.
2002) ... 11
5 Skema urutan tahapan penelitian ... 15
6 Aktivitas selulolitik A. niger yang ditunjukkan dengan terbentuknya
zona bening disekeliling koloni setelah inkubasi 24 jam pada suhu ruang... 23
7 Hasil isolasi RNA total A. niger IPB1 yang diisolasi dari miselium
setelah inkubasi 3 hari yang dideteksi dengan elektroforesis menggunakan gel agarosa 1% (b/v). ... 26
8 Hasil amplifikasi gen aktin dengan PCR yang dideteksi dengan elektroforesis menggunakan gel agarosa 3% (b/v). Lajur 1. Penanda
ΦX174RF DNA/HaeIII Fragments ; 2. Gen aktin ... 27
9 Hasil amplifikasi eglA dengan PCR yang dideteksi dengan
elektroforesis menggunakan gel agarosa 1% (b/v). Lajur 1. Penanda 1 kb; 2. eglA hasil PCR... 27
10 Koloni E. coli hasil transformasi yang ditumbuhkan dalam media
selektif yang mengandung ampicilin, X-gal dan IPTG ... 28
11 Hasil amplifikasi eglA dengan PCR yang dideteksi dengan
elektroforesis menggunakan gel agarosa 1% (b/v). Lajur 1. Penanda 1 kb; 2. eglA hasil PCR... 28
12 Hasil pemotongan DNA plasmid rekombinan dengan EcoRI yang
dideteksi dengan elektroforesis menggunakan gel agarosa 1% (b/v). Lajur 1. Penanda 1 kb; 2. Plasmid rekombinan yang dipotong; 3. Plasmid rekombinan yang tidak dipotong... 29
13 Urutan nukleotida eglA A. niger IPB1 dan deduksi asam aminonya ... 30
14 Perbandingan domain EglA dari berbagai organisme berdasarkan
database pfam ... 32
16 Domain umum cellulase yang terdiri dari domain katalitik dan CBM yang dihubungkan oleh daerah penghubung (linker) ……….... 33
17 Kesejajaran urutan asam amino empat enzim GH 12. Posisi residu nukleofil dan donor proton ditunjukkan dengan tanda anak panah hitam dan putih secara berturut-turut. ... 34
18 Profil hidrofobisitas menggunakan skala Kyte & Doolittle (Protscale) .... 35
19 Prediksi segmen transmembran (TMHMM) ... 36
DAFTAR LAMPIRAN
Halaman
1 Kurva standar glukosa dan bovine serum albumin (BSA) ... 45
2 Peta plasmid pGEM-T Easy (Promega) ... 46
3 Hasil pengurutan sisipan eglA dengan primer T7 dan SP6 ... 47
4 Urutan nukleotida sisipan eglA dan deduksi asam aminonya ... 51
5 Hasil penyejajaran urutan nukleotida eglA dengan database di GenBank menggunakan program BLAST ... 52
6 Hasil penyejajaran urutan nukleotida eglA dengan database di GenBank menggunakan program BLAST ... 55
7 Matrik kesamaan urutan asam amino gen eglA A . niger dengan gen endoglukanase dari organisme lain ... 58
8 Matrik jarak urutan asam amino gen eglA A . niger dengan gen endoglukanase dari organisme lain ... 59
I. PENDAHULUAN
1.1 Latar Belakang
Biomassa tumbuhan merupakan sumber daya terbarukan yang paling banyak ditemukan di alam. Biomassa ini banyak dihasilkan dari kegiatan di bidang kehutanan, perkebunan dan pertanian, namun demikian sumber daya ini belum termanfaatkan secara optimal. Komponen utama penyusun biomassa tumbuhan adalah selulosa, hemiselulosa dan lignin. Dari ketiga komponen ini, kandungan selulosa adalah yang tertinggi. Selulosa merupakan polimer glukosa yang tersusun dari unit-unit glukosa yang dihubungkan dengan ikatan β
-1,4-D-glikosidik (Kroon-Batenburg & Kroon 1997; Saxena & Brown 2005) sehingga hidrolisis selulosa dapat menghasilkan glukosa. Hidrolisis selulosa dapat dilakukan secara kimiawi maupun biologis (enzimatik). Secara kimiawi, selulosa dapat dihidrolisis dengan senyawa asam, sedangkan secara enzimatik oleh enzim selulase. Hidrolisis secara kimiawi dapat mengakibatkan degradasi produk monosakarida yang dihasilkan sehingga produk yang dihasilkan rendah, sedangkan hidrolisis secara enzimatik berjalan secara spesifik dan efisien sehingga produk yang dihasilkan lebih tinggi serta berpotensi menghasilkan produksi monosakarida dengan biaya lebih rendah.
Selain berperan dalam hidrolisis selulosa, enzim selulase digunakan juga untuk keperluan dalam berbagai macam industri, seperti industri pulp dan kertas untuk deinking dan modifikasi serat; industri tekstil untuk pelembut katun dan
tahap finishing denim; industri deterjen untuk perawatan warna, pembersih dan
antideposisi; dan industri makanan sebagai pelunak makanan (Zhang et al. 2006).
Bersama-sama dengan hemiselulase kebutuhan selulase mencapai 20% dari total pasar enzim dunia (Coral et al. 2002). Potensi pasar selulase ke depan diprediksi
akan meningkat cukup signifikan dengan meningkatnya isu mengenai konversi bahan-bahan selulosa menjadi bioetanol.
Enzim selulase diklasifikasikan menjadi tiga tipe, yaitu endoglukanase (endo-β-1,4-glucanase, EC 3.2.1.4), selobiohidrolase atau eksoglukanase (exo-β
-1,4-glucanase, EC 3.2.1.91) dan glukosidase (β-D-glucoside glucohydrolase, EC
secara sinergis dari ketiga kelompok enzim tersebut. Endoglukanase menghidrolisis ikatan internal selulosa untuk memproduksi ujung rantai baru, eksoglukanase menghidrolisis ujung rantai selulosa untuk menghasilkan selobiosa atau glukosa, dan glukosidase menghidrolisis selobiosa menjadi glukosa. Hidrolisis selulosa oleh endoglukanase bersifat random sehingga degradasi selulosa dapat berlangsung dengan cepat.
Beberapa mikroorganisme mempunyai kemampuan untuk memproduksi enzim selulase. Cendawan merupakan mikroorganisme utama penghasil selulase walaupun beberapa jenis bakteri dan aktinomycetes juga menghasilkannya. Kelompok cendawan berfilamen seperti Aspergillus dan Trichoderma diketahui
merupakan penghasil selulase yang efisien (Gielkens 1999) dan saat ini sebagian besar produksi komersial enzim selulase di dunia dihasilkan dari kedua kelompok cendawan tersebut (Kirk et al. 2002). Aktivitas selulase dari A. niger (Hurst 1977;
Coral et al. 2002; Onsori et al. 2004), dan Trichoderma (Ross et al. 1983; Gosh et
al. 1984) sudah dipelajari dan dikarakterisasi, termasuk beberapa gen yang
menyandikannya. Namun demikian aktivitas selulase tersebut menunjukkan variasi yang cukup tinggi pada isolat yang berbeda. Sistem selulolitik pada T.
reesei mengandung dua gen yang menyandi selobiohidrolase, cbh1 (Teeri et
al.1983) dan cbh2 (Chen et al.1997); empat gen yang menyandi endoglukanase,
egl1 (Penttila et al. 1986), egl2 (Saloheimo et al. 1988), egl3 dan egl5 (Saloheimo
et al. 1994); dan satu gen yang menyandi glukosidase (Barnett et al. 1991).
Sementara itu pada Aspergillus niger, terdiri dari tiga gen yang menyandi
endoglukanase, eglA, eglB (van Peij 1998) dan eglC (Hasper et al. 2002) dan dua
gen yang menyandi selobiohidrolase, cbhA dan cbhB (Gielkens 1999).
30, CL-847, dan VTT-D yang dihasilkan dari T. reesei QM 6a tipe liar (Howard et
al. 2003). Oleh karena itu penyediaan data dan informasi mengenai urutan suatu
gen yang menyandikan enzim selulase dan organisasinya sangatlah diperlukan dalam pengembangan teknologi enzim berbasis teknologi DNA rekombinan. Kendala pengembangan industri enzim selulase di Indonesia adalah belum adanya strain lokal yang efektif sehingga penelitian untuk mengeksplorasi strain-strain lokal maupun peningkatan kemampuannya dengan teknologi berbasis genetika molekuler perlu dilakukan.
Pada penelitian sebelumnya, Bagian Mikologi Departemen Biologi F.MIPA Institut Pertanian Bogor dan Pusat Penelitian Sumber Daya Hayati dan Bioteknologi Institut Pertanian Bogor telah memperoleh beberapa isolat cendawan yang mempunyai aktivitas enzim selulase. Namun aktivitas enzim selulase isolat-isolat tersebut belum terkarakterisasi dengan baik. Oleh karena itu perlu penelitian mengenai aktivitas enzim selulase terhadap isolat-isolat koleksi tersebut dengan menggunakan isolat T. reseei sebagai standar aktivitas enzim
selulase serta isolasi gen penyandi enzim selulase dari isolat potensial yang dihasilkan.
1.2 Tujuan
Penelitian ini bertujuan untuk:
1. Melakukan skrining terhadap enzim endoglukanase dari beberapa isolat Aspergillus niger dan Trichoderma, dan
2. Mengisolasi dan mengkarakterisasi gen penyandi enzim endoglukanase dari isolat cendawan potensial terpilih.
1.3 Manfaat
Manfaat yang dapat diambil dari penelitian ini adalah diperolehnya informasi dasar mengenai aktivitas spesifik enzim endoglukanase cendawan potensial terpilih dan gen yang menyandikannya sebagai dasar dalam pengembangan isolat potensial untuk keperluan industri.
II. TINJAUAN PUSTAKA
2.1 Selulosa
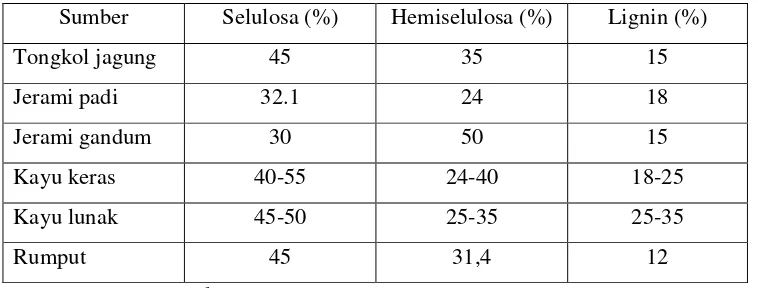
Selulosa merupakan komponen utama penyusun dinding sel tumbuhan bersama-sama dengan hemiselulosa dan pektin. Komposisi selulosa dalam tumbuhan dapat mencapai 40-50% dari massa tumbuhan sehingga selulosa merupakan biopolimer terbarukan yang paling berlimpah di alam (Milala 2005). Produksi selulosa setiap tahun diperkirakan mencapai 4 x 1010 ton (Coughlan 1985). Selain pada tumbuhan, selulosa juga disintesis oleh berbagai jenis organisme lainnya, seperti bakteri, alga dan cendawan. Kandungan selulosa dari berbagai sumber disajikan pada Tabel 1.
Tabel 1 Kandungan selulosa dari berbagai sumber
Sumber Selulosa (%) Hemiselulosa (%) Lignin (%)
Tongkol jagung 45 35 15
Jerami padi 32.1 24 18
Jerami gandum 30 50 15
Kayu keras 40-55 24-40 18-25
Kayu lunak 45-50 25-35 25-35
Rumput 45 31,4 12
Sumber : Howard et al. (2003)
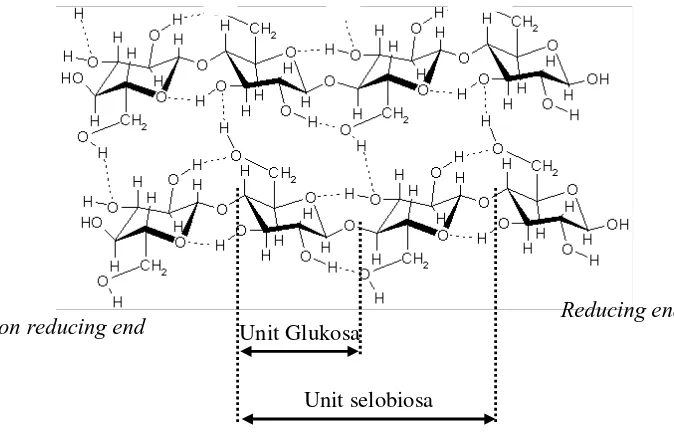
Selulosa merupakan polimer glukosa yang tersusun dari unit-unit glukosa yang dihubungkan dengan ikatan β-1,4-D-glikosidik. Polimer ini tersusun secara
Gambar 1 Struktur molekuler selulosa (Hilden & Johansson 2004)
Selulosa mempunyai struktur kimia yang sederhana, namun demikian sifat-sifat fisiknya, seperti bentuk kristalin, derajat kristalinitas dan berat molekuler mempunyai variasi yang cukup tinggi. Di alam, kebanyakan selulosa diproduksi sebagai kristalin. Struktur ini terdiri dari dua bentuk yang berbeda, yaitu triclinic cellulose (Iα) dan monoclinic cellulose (Iβ). Kedua bentuk ini
dibedakan berdasarkan pengemasan kristal, konformasi molekuler dan pola ikatan hidrogen intramolekuler. Perbedaan ini mungkin berpengaruh terhadap sifat-sifat fisik selulosa. Disamping struktur kristalin, selulosa juga tersusun dari struktur non kristalin (amorf). Jumlah dan perbandingan antara struktur kristalin dan non kristalin ini berbeda-beda tergantung organismenya (Saxena & Brown 2005).
2.2. Enzim Selulase
Enzim selulase merupakan salah satu kelompok enzim yang termasuk dalam sistem enzim lignoselulotik yang diproduksi mikroorganisme yang berperan dalam degradasi material sel tumbuhan. Enzim ini termasuk dalam famili glikosida hidrolase (GH). Enzim selulase berperan dalam hidrolisis selulosa
Unit selobiosa Unit Glukosa
dengan memecah ikatan β-1,4-D-glikosidik untuk menghasilkan oligosakarida
maupun glukosa.
2.2.1 Klasifikasi enzim selulase
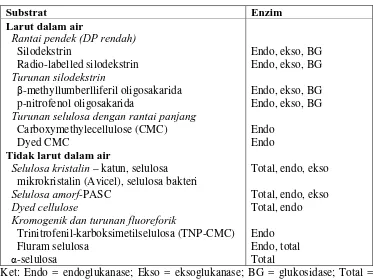
Enzim selulase dapat diklasifikasikan berdasarkan spesifisitas terhadap substrat, mekanisme reaksi atau kemiripan strukturnya. Berdasarkan struktur proteinnya, enzim selulase termasuk ke dalam famili glikosida hidrolase (GH). GH merupakan kelompok enzim yang mempunyai aktivitas memotong ikatan glikosisik antara dua atau lebih karbohidrat. GH diklasifikasikan berdasarkan similaritas urutan dan struktur asam aminonya (Henrissat 1991; Henrissat & Bairoch 1993; Henrissat & Bairoch 1996). Saat ini terdapat 113 famili GH yang dilaporkan secara online di website (http://www.cazy.org.) (Cantarel et al. 2009).
Untuk selulase, saat ini tersebar sedikitnya ke dalam 11 famili GH, yaitu famili 5-9, 12, 26, 44, 45, 48 dan 61.
β-methyllumberlliferil oligosakarida
p-nitrofenol oligosakarida
Turunan selulosa dengan rantai panjang Carboxymethylecellulose (CMC) Dyed CMC
Tidak larut dalam air
Selulosa kristalin – katun, selulosa
mikrokristalin (Avicel), selulosa bakteri Selulosa amorf-PASC
Dyed cellulose
Kromogenik dan turunan fluoreforik
Aktivitas masing-masing enzim selulase dapat diuji menggunakan berbagai substrat selulosa maupun turunannya. Pada umumnya substrat ini dibagi menjadi dua kategori berdasarkan kelarutannya dalam air, yaitu substrat yang larut dalam air dan substrat yang tidak larut dalam air (Tabel 2). Substrat larut dalam air meliputi selodekstrin dengan DP (degree of polymerization) rendah dari 2
sampai 6 unit gula dan turunannya. Sementara itu substrat tidak larut meliputi selulosa yang hampir murni seperti katun, kertas saring Whatman no.1 dan selulosa bakteri, serta selulosa yang tidak murni seperti α-selulosa. Aktivitas
enzim endoglukanase pada umumnya dapat diuji dengan substrat CMC (carboxymethyl cellulose) sehingga enzim endoglukanase juga dikenal dengan
istilah CMCase. Sementara itu aktivitas enzim selobiohidrolase atau eksoglukanase seringkali diuji dengan substrat avicel sehingga enzim eksoglukanase disebut juga avicelase (Zhang et al. 2006).
2.2.2 Struktur organisasi enzim selulase
Pada umumnya enzim selulase terdiri dari dua domain utama, yaitu domain katalitik dan carbohydrate binding moduls (CBM). Kedua domain ini
biasanya dihubungkan oleh suatu penghubung yang pendek dan fleksibel (linker).
Domain katalitik merupakan bagian terbesar dari enzim dan merupakan tempat dimana hidrolisis selulosa terjadi. Enzim selulase sedikitnya mempunyai satu domain katalitik dan ukurannya bervariasi tiap organisme, dari yang berukuran pendek seperti CelS Erwinia corotovora (232 AA) sampai yang berukuran
panjang seperti CelBb Caldochellum saccharolyticum (1.011 AA) (Gilkes 1991).
Carbohydrate binding modul (CBM) sebelumnya dikenal dengan cellulose
binding domain. Saat ini CBM diklasifikasikan menjadi 45 famili berdasarkan
Daerah penghubung (linker) merupakan daerah yang menghubungkan
antara CBM dan domain katalitik (Gilkes 1991). Linker mempunyai ukuran yang
pendek dan sangat bervariasi, dari 6-59 asam amino. Daerah ini kaya prolin, treonin dan serin. Linker berperan dalam menjaga jarak antara domain katalitik
dan CBM. Percobaan yang dilakukan dengan menghilangkan daerah linker pada
Cel7A T. reesei menunjukkan penurunan kecepatan degradasi selulosa kristalin
secara drastis (Srisodsuk et al. 1993).
2.2.3 Mekanisme hidrolisis oleh selulase
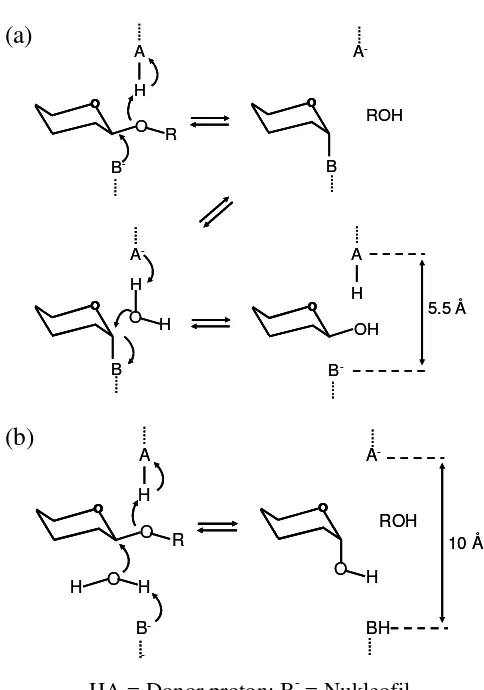
Hidrolisis enzimatik ikatan glikosidik oleh golongan glikosil hidrolase biasanya dilakukan melalui katalisis asam atau basa yang memerlukan dua residu, yaitu donor proton (HA) dan nukleofil/ basa (B-). Aktivitas katalitik ini disediakan oleh residu asam aspartat atau glutamat. Terdapat dua mekanisme yang dapat dibedakan, yaitu retaining mechanism dan inverting mechanism (Gambar 2)
(Davies & Henrissat 1995).
Pada retaining mechanism, reaksi tejadi melalui mekanisme penggantian
ganda. Pada tahap pertama, salah satu gugus karboksilat berfungsi sebagai katalis asam yang memprotonisasi oksigen dan secara bersamaan karbon C1 diserang oleh nukleofil (B-) dari gugus karboksilat kedua, menghasilkan bentuk antara enzim-glikosil. Pada tahap kedua, gugus karboksilat pertama sekarang berfungsi sebagai katalis basa yang mengaktifkan molekul air. Aktivasi ini menghasilkan nukleofil yang menghidrolisis bentuk antara enzim-glikosil, menghasilkan produk yang mempunyai stereokimia yang sama dengan substrat. Retaining mechanism
ini biasanya terjadi pada dua karboksilat yang berjarak 5.5 Å. Sementara itu, pada
inverting mechanism, terjadi pengubahan konfigurasi pada karbon C1 anomerik
setelah pemutusan ikatan glikosidik. Reaksi terjadi melalui mekanisme penggantian tunggal. Basa (B-) melakukan deprotonasi molekul air yang
kemudian menyerang karbon C1 dari cincin glukosa, menghasilkan pembalikan konfigurasi pada karbon C1 anomerik. Inverting mechanism ini biasanya terjadi
Gambar 2 Mekanisme hidrolisis oleh selulase. (a). Retaining mechanism (b). Inverting mechanism
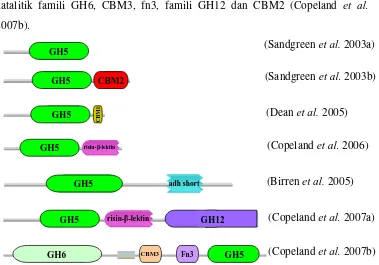
2.3 Glikosida Hidrolase Famili 12
GH12 merupakan salah satu famili Glikosida hidrolase yang mempunyai aktivitas endoglukanase dan xyloglukan hidrolase. Mekanisme katalisisnya adalah
retaining dengan Glutamat (Glu) sebagai basa nukleofil maupun donor protonnya.
Berdasarkan database pfam, sampai saat ini GH12 mempunyai sekitar 151 anggota dengan 7 arsitektur domain yang berbeda (Gambar 3). Arsitektur pertama hanya terdiri dari domain katalitik famili GH12 (Sandgreen et al. 2003a),
arsitektur kedua terdiri dari domain katalitik famili GH12 dan domain CBM2 (Sandgreen et al. 2003b), arsitektur ketiga terdiri dari domain katalitik famili
GH12 dan CBM1 (Dean et al. 2005), arsitektur keempat terdiri dari domain
katalitik famili GH12 dan risin-β-lektin (Copeland et al. 2006), arsitektur kelima
terdiri dari domain katalitik famili GH12 dan adh short (Birren et al. 2005),
arsitektur keenam terdiri dari domain katalitik famili GH12, risin-β-lektin dan
famili GH5 (Copeland et al. 2007a), dan arsitektur ketujuh terdiri dari domain
katalitik famili GH6, CBM3, fn3, famili GH12 dan CBM2 (Copeland et al.
2007b).
Gambar 3 Arsitektur domain GH famili 12
2.4 Mikroorganisme Penghasil Enzim Selulase
Di alam, enzim selulase banyak dihasilkan oleh berbagai jenis cendawan dan bakteri. Namun demikian beberapa jenis organisme, seperti rayap (Watanabe & Tokuda 2001), remis (Xu et al. 2000) dan arabidobsis (Williamson et al. 2002)
juga menghasilkannya. Beberapa contoh genus bakteri yang mempunyai aktivitas selulotik adalah Clostridium, Ruminococcus, Caldicellulosiruptor, Butyrivibrio,
Fibrobacter, Cellulomonas, Thermobifida, Cytophaga, dan Sporocytophaga,
Sementara itu beberapa genus cendawan yang mempunyai aktivitas selulolitik adalah Bulgaria, Chaetomium, Helotium, Coriolus, Phanerochaete, Poria,
Schizophyllum, Serpula, serta Aspergillus, Cladosporium, Fusarium, Geotrichum,
Myrothecium, Paecilomyces, Penicillium, dan Trichoderma.
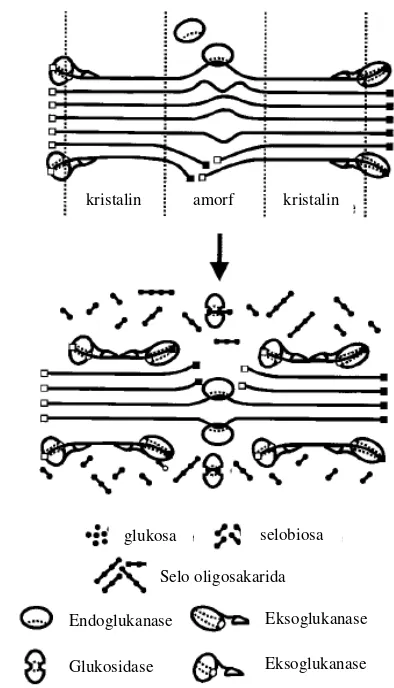
terdiri dari endoglukanase, eksoglukanase dan glukosidase yang bekerja secara sinergis untuk menghidrolisis selulosa (Gambar 4). Berbeda dengan mikroorganisme aerobik, mikroorganisme anaerobik menghasilkan enzim selulase kompleks yang disebut selulosom (Doi et al. 2003; Bayer et al. 2004). Walaupun
mikroorganisme anaerobik hanya menyumbang sekitar 5-10% dari biodegradasi total selulosa di alam, namun peranannya sangat penting, karena bertanggung jawab terhadap degragasi daerah anoksik pada danau, laut, dan saluran pencernaan hewan pemamah biak maupun rayap, yang tidak dapat dilakukan mikroorganisme aerobik (Zhang et al. 2006).
Gambar 4 Sinergisme hidrolisis selulosa oleh selulase non-kompleks (Lynd et al.
2002)
kristalin amorf kristalin
glukosa selobiosa
Glukosidase Endoglukanase
Kelompok cendawan merupakan agen yang paling baik dalam mendekomposisi komponen organik, seperti selulosa, dibandingkan dengan bakteri. Kemampuan hidup dan daya saing yang tinggi (Landecker 1972) menjadikan cendawan lebih berperan dalam proses dekomposisi komponen organik di alam. Disamping itu, cendawan juga dikenal sebagai organisme penghasil selulase yang baik, sehingga banyak digunakan dalam produksi enzim selulase secara komersial. Kelompok cendawan berfilamen seperti Aspergillus dan
Trichoderma diketahui merupakan penghasil enzim selulase yang efisien
(Gielkens 1999) dan saat ini sebagian besar produksi komersial enzim selulase di dunia dihasilkan dari kedua kelompok cendawan ini.
2.5 Sistem Selulolitik pada Cendawan
Cendawan mempunyai sistem selulolitik yang berbeda dengan bakteri. Pada cendawan, enzim selulase diproduksi hanya jika diperlukan sedangkan pada bakteri enzim selulase diproduksi secara terus-menerus (konstitutif). Sistem selulolitik pada cendawan yang paling banyak dipelajari dan saat ini dijadikan model sistem selulolitik cendawan adalah sistem selulolitik pada Trichoderma
reesei. Sistem ini mengandung dua gen yang menyandi selobiohidrolase, cbh1
(Teeri et al.1983) dan cbh2 (Chen et al.1997); empat gen yang menyandi
endoglukanase egl1 (Penttila et al. 1986), egl2 (Saloheimo et al. 1988), egl3 dan
egl5 (Saloheimo et al. 1994); dan satu gen yang menyandi glukosidase (Barnett et
al. 1991). Sementara itu pada Aspergillus niger, tiga gen yang menyandi
endoglukanase, eglA, eglB (van Peij 1998) dan eglC (Hasper et al. 2002) dan dua
gen yang menyandi selobiohidrolase, cbhA dan cbhB (Gielkens 1999), sudah
dikarakterisasi. Gen-gen penyandi enzim selulase, pada cendawan maupun bakteri, terletak dalam kromosom. Gen-gen ini biasanya terdistribusi secara acak pada genom dan masing-masing mempunyai elemen regulasi sendiri. Pada umumnya gen-gen ini merupakan multidomain, kecuali beberapa gen seperti EGIII dari T. reesei dan EG28 dari P. chysosporium (Lynd 2002).
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium BIORIN Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Institut Pertanian Bogor dari bulan Agustus 2007 - Desember 2008.
3.2 Bahan Penelitian
Bahan yang digunakan adalah beberapa isolat A. niger dan Trichoderma
koleksi Bagian Mikologi Departemen Biologi F.MIPA dan Pusat Penelitian Sumber Daya Hayati dan Bioteknologi, primer spesifik EAF (5’-CTCTAACGCC CAACATGAAG-‘3) dan EAR (5’-TCTAGAACCCTAGTTGACACTGG-‘3) untuk amplifikasi gen endoglukanase yang didesain menggunakan program Primer3 versi 0.4.0 (http://frodo.wi.mit.edu/primer3/input.htm) berdasarkan gen endoglukanase A Aspergillus niger dari GenBank dengan nomor aksesi AJ225451
(posisi primer EAF= basa ke-14 sebelum kodon awal sampai basa ke-3 setelah kodon awal, primer EAR= basa ke-9 sebelum kodon akhir sampai basa ke-11 setelah kodon akhir) dengan produk yang diharapkan sebesar 743 bp, primer ActF
(5’-ATGGCAGATGCCGAGGATAT-‘3) dan ActR2 (5’-TCGAGGTCGGCCAA
CAATAC-‘3) untuk amplifikasi gen aktin (posisi primer ActF = 20 basa pertama
dari ekson 1, primer ActR2 = basa ke 44 – basa ke 63 dari ekson 2) dengan produk
yang diharapkan sebesar 123 bp, pGEM-T Easy sebagai vektor pengklonan dan E.
coli galur DH5α sebagai inang vektor rekombinan.
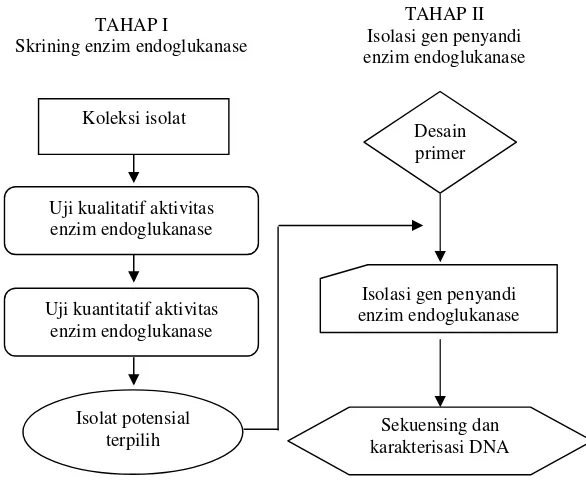
3.3 Metode
Penelitian dilakukan dalam dua tahap (Gambar 5). Tahap pertama ialah seleksi aktivitas enzim endoglukanase dari beberapa isolat A. niger dan
Trichoderma dan dilanjutkan dengan tahap kedua, yaitu melakukan isolasi gen
3.3.1 Pemeliharaan biakan cendawan
Isolat-isolat Aspergillus niger dan Trichoderma dipelihara dalam media
agar CMC (carboxymethyl cellulose) dan diinkubasikan pada suhu ruang selama 7
hari yang selanjutnya digunakan sebagai sumber inokulum.
Gambar 5 Skema urutan tahapan penelitian
3.3.2 Uji aktivitas selulolitik
3.3.2.1 Uji aktivitas selulolitik secara kualitatif
Uji kualitatif aktivitas enzim endoglukanase dilakukan sesuai dengan metode Onsori et al. (2004) yang dimodifikasi dengan mengukur zona bening
yang terbentuk pada media agar CMC (CMC 1% (b/v), ekstrak yeast 0.05% (b/v), MgSO4 0.05% (b/v), NaNO3 0.2% (b/v) dan KH2PO4 0.1% (b/v), KCl 0.05%
(b/v), agar 1.5% (b/v)). Sebagai standar digunakan isolat Trichoderma reesei yang
merupakan standar aktivitas enzim selulase. Secara garis besar metode yang digunakan adalah sebagai berikut. Koloni dengan diameter sepuluh mm dari masing-masing isolat hasil peremajaan diinokulasikan ke dalam media agar CMC. Kultur kemudian diinkubasi pada suhu ruang selama satu hari. Untuk mengetahui aktivitas selulolitik cendawan, biakan berumur 1 hari diwarnai dengan pewarna
congo red 1 % (b/v) selama 0.5-1 jam, diikuti destaining dengan larutan NaCl 1
M selama 15 menit. Adanya aktivitas enzim endoglukanase ditandai dengan terbentuknya zona bening. Untuk masing-masing isolat digunakan tiga ulangan. Diameter koloni dan zona bening yang terbentuk diukur. Nisbah selulolitik dihitung menggunakan rumus sebagai berikut:
3.3.2.2 Uji aktivitas enzim endoglukanase secara kuantitatif
Sebanyak 2 x 106 spora/ml A. niger dan Trichoderma yang diproduksi pada media
agar CMC diinokulasikan ke dalam 50 ml media CMC cair dalam erlenmeyer 250 ml (Narashima et al. 2006). Untuk masing-masing isolat digunakan tiga ulangan.
Kultur diinkubasi dalam inkubator beragitasi selama 7 hari pada kecepatan 150 rpm. Kultur di panen pada umur 7 hari setelah inokulasi. Pemisahan enzim kasar dari biomassa cendawan dilakukan dengan cara menyaring filtrat kasar cendawan dengan kertas saring. Filtrat yang dihasilkan digunakan sebagai ekstrak kasar enzim. Aktivitas enzim endoglukanase diukur berdasarkan produk gula yang dihasilkan dengan metode DNS (asam dinitrosalisilat) (Ghose 1987). Sebanyak 0.5 ml filtrat (ekstrak kasar enzim) dicampur dengan 0.5 ml CMC 1% (b/v) dalam bufer sitrat 50 mM pH 4,8 dan diinkubasikan selama 30 menit pada suhu 50oC.
Reagen DNS sebanyak 3 ml ditambahkan ke dalam tabung reaksi. Setelah itu tabung reaksi dipanaskan dalam air mendidih selama 15 menit, kemudian didinginkan pada suhu kamar dan dihitung nilai rapat optis (O.D) pada λ540 nm
Pengukuran kadar protein total dilakukan dengan metode Lowry (Ghose, 1987). Sebanyak 0.5 ml ekstrak kasar enzim dimasukkan kedalam tabung reaksi dan setelah itu ditambahkan 5 ml reagen C. Reagen C dibuat dengan mencampur 100 ml reagen A (Na2CO3 2% (b/v) dalam NaOH 0.1N) dan 2 ml reagen B
(CuSO4.5H2O 0.5% (b/v) dalam K Tartarat 1% (b/v)). Tabung kemudian
divorteks dan didiamkan pada suhu kamar selama 10 menit. Setelah itu, ke dalam tabung dimasukkan 0.5 ml Reagen D (reagen folin Ciocalteau yang telah diencerkan dengan air sampai 1N). Tabung kemudian divorteks dan didiamkan pada suhu kamar selama 30 menit. Nilai rapat optis (O.D) setiap isi tabung dibaca dengan menggunakan spektrofotometer pada λ750 nm terhadap blanko. Hasil
pengukuran kemudian dimasukkan ke dalam persamaan kurva standar bovine
serum albumin (BSA) yang telah dibuat untuk mengukur kadar protein (Lampiran
1). Selanjutnya aktivitas spesifik enzim dapat ditentukan berdasarkan unit/ml aktivitas enzim dan kadar protein yang didapat dengan rumus sebagai berikut.
(mg/ml)
3.3.3 Isolasi gen penyandi endoglukanase A. niger IPB1 3.3.3.1 Isolasi RNA total
Isolasi asam ribonukleat (RNA) total A. niger IPB1 dilakukan pada biakan
yang berumur 3 hari. Miselium dari biakan A. niger IPB1 yang ditumbuhkan pada
media cair dipanen. Sebanyak 1 g miselium digerus dengan bantuan nitrogen cair dalam mortal sampai terbentuk bubuk halus, kemudian diekstrak dengan 800 l reagen TRIzol (Invitrogen). Inkubasi dilakukan selama 5 menit pada suhu ruang,
selanjutnya ditambahkan 200 l kloroform, dibolak-balik selama 30 detik. Campuran diinkubasi selama 3 menit pada suhu ruang, selanjutnya disentrifugasi pada 9000 rpm (Jouan BR4i) selama 15 menit pada suhu 6oC. Supernatan yang
diperoleh dipindahkan ke dalam tabung baru dan ditambahkan 500 l isopropil alkohol, kemudian diinkubasikan selama 10 menit pada suhu ruang dan disentrifugasi pada 9000 rpm (Jouan BR4i) selama 10 menit pada suhu 6oC.
disentrifugasi pada 5700 rpm (Jouan BR4i) selama 5 menit pada suhu 6oC.
Endapan yang didapat dikeringkan dengan vakum selama 6 menit dan dilarutkan dalam 20 l ddH2O yang mengandung diethylpyrocarbonate (DEPC) 0.1% (v/v).
Kuantifikasi dilakukan dengan melarutkan 1 l suspensi RNA total dalam 700 l air DEPC 0.1% (v/v), selanjutnya dibaca nilai rapat optisnya dengan spektrofotometer pada panjang gelombang 260 nm (Sambrook et al. 1989).
Keutuhan RNA dianalisis secara kualitatif menggunakan elektroforesis, dengan memigrasikan RNA pada gel agarosa di dalam bufer morpholinopropanesulfonic
acid (MOPS) 1% (v/v) (4,2 g/l 3-morpholinopropanesulfonic acid (C7H15NO4),
0.41 g/l Na-Asetat, 0.37 g/l Na2EDTA.H2O) pada tegangan 100 volt selama 35
menit. Visualisasi RNA dilakukan di atas UV transiluminator GelDoc (Labquip).
3.3.3.2 Sintesis cDNA total
Sintesis cDNA total dilakukan melalui proses transkripsi balik. Sebanyak 500 ng RNA total dicampur dengan 4 l 5x reverse transcriptase (RT) bufer, 1
unit Enzim reverse transcriptase (Invitrogen), 10 pmol primer oligo d(T), 2 l
dithiothreitol (DTT) (0.1 M), 2 l dNTPmix 2 mM dan ddH2O DEPC 0.1% steril
(konsentrasi final) dalam volume 20 l. Reaksi transkripsi balik dilakukan pada suhu 30oC selama 10 menit, diikuti oleh suhu 42oC selama 60 menit dan 95oC selama 5 menit.
Evaluasi terhadap keberhasilan sintesis cDNA total dilakukan dengan mengamplifikasi gen penyandi aktin dengan menggunakan primer spesifik gen aktin dan cDNA total sebagai cetakannya. Komposisi reaksi PCR (polymerase
chain reaction) ialah 0.75 l cDNA total, 1x bufer Taq, 0.25 unit Taq DNA
polimerase, 2 mM MgCl2, 0.2 mM dNTPs, 15 pmol dari masing-masing primer
ActF dan ActR2, dimethyl sulfoxide DMSO 4% (v/v) (konsentrasi final) dan
ddH2O dengan volume reaksi 15 l. Reaksi PCR dilakukan dengan kondisi
3.3.3.3 Isolasi fragmen cDNA eglA
Fragmen cDNA eglA diisolasi dengan PCR menggunakan primer spesifik
gen endoglukanase yang telah didesain. Komposisi PCR ialah 1 l cDNA total, 1x bufer Taq, 0.25 unit Taq DNA polimerase, 2 mM MgCl2, 0.2 mM dNTPs, 20
selama 5 menit dan pendinginan 15oC selama 5 menit.
3.3.3.4 Pengklonan fragmen cDNA eglA
Fragmen cDNA eglA yang telah diisolasi disisipkan ke dalam vektor
pengklonan pGEM-T Easy (Promega, Madison, WI, USA) (Lampiran 2) dan
diintroduksikan ke dalam E. coli galur DH5α. Hasil PCR diligasikan dengan
pGEM-T Easy mengikuti petunjuk produsen (Promega) yaitu dengan mencampur
7.5 ng hasil PCR, 10 ng pGEM-T Easy, 0.3 Weiss Unit T4 DNA ligase dan 1x
bufer ligasi dengan volume reaksi 10 l, kemudian diinkubasi pada suhu 4oC selama semalam. Hasil ligasi diintroduksikan ke dalam E. coli galur DH5α
menggunakan metode Suharsono (2002). Metode ini dilakukan dalam dua tahap, yaitu pembuatan sel kompeten dan transformasi bakteri. Sel kompeten dibuat dengan membiakkan koloni tunggal E.coli DH5α dalam 2 ml media LB
(Luria-Bertani) cair (tripton 1% (b/v), ekstrak yeast 0.5% (b/v), NaCl 1% (b/v)) pada suhu 37oC selama semalam dalam inkubator beragitasi (250 rpm). Sebanyak 100 l biakan E.coli DH5α kemudian dibiakkan kembali dalam 10 ml media LB cair
sampai mencapai OD600=O.5 (densitas sel 4.107 – 7.107 sel/ml. Sebanyak 1.5 ml
biakan bakteri diendapkan dengan senrifugasi pada kecepatan 5000 rpm, suhu 4oC
selama 10 menit. Endapan bakteri kemudian disuspensikan dalam 600 l bufer transformasi (TB) (10 mM PIPES, 15 mM CaCl2.2H2O, 250 mM KCl, 55 mM
MnCl2, pH 6,7) dan diinkubasikan dalam es selama 20 menit. Setelah
diinkubasikan dalam es selama 20 menit. Transformasi dilakukan dengan mencampur sel bakteri kompeten yang dihasilkan dengan 10 l plasmid hasil ligasi dan diinkubasi dalam es selama 30 menit. Campuran kemudian diberikan kejutan panas dengan diinkubasi pada suhu 42oC selama 1 menit dan setelah itu
diinkubasikan kembali dalam es selama 5 menit. Campuran kemudian ditambah dengan 200 l media YT (16 g/l tripton, 10 g/l ekstrak yeast, 5 g/l NaCl, pH 7,0) dan diinkubasikan pada suhu 37oC selama 60 menit. Bakteri kemudian disebar dalam media agar LB yang mengandung 50 g/ml ampisilin, 10 l 100 mM isopropiltio-β-galaktosida (IPTG) dan 50 l 2% (b/v) X-gal (5-bromo-4-chloro
-3-indolyl-β-D-galactoside) dan diinkubasi pada suhu 37oC selama semalam.
3.3.3.5 Seleksi transforman rekombinan
E. coli DH5α yang mengandung vektor rekombinan diseleksi
menggunakan seleksi resistensi terhadap ampisilin dan seleksi biru putih. Koloni yang tumbuh berarti bakteri transforman, sebab E. coli DH5α baru memiliki gen
amp (ketahanan terhadap ampisilin) setelah ditransformasi oleh pGEM-T Easy.
Ada dua jenis warna koloni yang tumbuh yaitu koloni biru dan putih. Koloni biru berarti bakteri transforman pGEM-T Easy non rekombinan, sehingga
gen lacZ masih utuh dan menghasilkan enzim β-galaktosidase untuk memotong
substrat X-gal yang tidak berwarna menjadi berwarna biru. Koloni putih berarti bakteri transforman yang mengandung pGEM-T Easy rekombinan, karena gen
lacZ menjadi rusak karena tersisipi oleh fragmen DNA (insertional inactivation)
dan tidak akan menghasilkan enzim β-galaktosidase.
3.3.3.6 Analisis cDNA sisipan
Analisis cDNA sisipan dilakukan melalui PCR terhadap koloni putih yang dihasilkan dan pemotongan plasmid rekombinan dengan enzim restriksi EcoRI.
Koloni putih yang terbentuk digunakan sebagai cetakan untuk reaksi PCR dalam mendeteksi keberadaan gen endoglukanase. Koloni putih diambil dengan tusuk gigi steril kemudian disuspensikan ke dalam 7.42 l ddH2O dan dipanaskan dalam
menit. Reaksi PCR dilakukan dengan campuran dan kondisi reaksi yang sama dengan isolasi cDNA eglA.
Koloni putih yang menghasilkan pita sesuai dengan ukuran fragmen cDNA sisipan setelah PCR terhadap koloni digunakan sebagai bahan untuk isolasi plasmid yang akan dianalisis lebih lanjut. Plasmid diisolasi dari E. coli DH5α
transforman rekombinan menggunakan prosedur Suharsono (2002). E. coli
ditumbuhkan dalam 2 ml media LB dan diinkubasi dalam inkubator beragitasi (250 rpm) pada suhu 37oC semalam. Kultur bakteri di sentrifugasi dengan kecepatan 12000 rpm pada suhu 4oC selama 10 menit. Pelet disuspensikan dengan
100 l coldTEG buffer (50 mM glukosa, 25 mM Tris pH 8, 10 mM EDTA),
ditambahkan 200 l NaOH/SDS buffer (1 N NaOH, 1% SDS), dibolak-balik perlahan dan diinkubasi dalam es selama 5 menit, selanjutnya ditambahkan 300 l
icecalsal buffer (3 M NaOAc, 11.5% asam asetat glasial, ddH2O), dihomogenkan
dan disimpan dalam es selama 3 menit. Larutan disentrifugasi 12000 rpm pada suhu 4oC selama 10 menit. Supernatan disuspensikan dengan 1x volume PCI
(fenol:kloroform:isoamil alkohol (25:24:1)), diinkubasi selama 10 menit pada suhu ruang dan selanjutnya disentrifugasi 12000 rpm selama 10 menit. Supernatan ditambah 2x volume etanol absolut, diinkubasi selama 2 jam di freezer dan
selanjutnya disentrifugasi 12000 rpm selama 10 menit. Pelet dikeringkan dan kemudian ditambahkan 30 l ddH2O. RNA didegradasi dengan menambahkan
100 ppm RNAse dan diinkubasi pada suhu 37oC selama 30 menit. Plasmid
dielektroforesis di agarosa 1% (b/v) dalam bufer TAE 1x (40 mM Tris-asetat, 1 mM EDTA) pada tegangan 100 volt selama 30 menit.
3.3.4 Pengurutan nukleotida dan analisis urutan nukleotida
Pengurutan fragmen cDNA eglA dilakukan menggunakan DNA sequencer
ABI Prism Model 3100 versi 3.7 di Badan Pengkajian dan Penerapan Teknologi. Urutan nukleotida gen endoglukanase yang dihasilkan dianalisis menggunakan beberapa program yang tersedia. Analisis homologi urutan nukleotida yang dihasilkan terhadap organisme lain dilakukan menggunakan program BLAST2 (basic local alignment search tool) (http://www.ebi.ac.uk/blast2), deduksi asam
(http://expasy.ch/tools/translate) (Gasteiger et al. 2003), analisis situs pemotongan
dilakukan dengan menggunakan program NEBcutter (http://tools.neb.com/ NEBcutter) (Vincze et al. 2003), analisis hidrofobisitas dilakukan dengan
menggunakan program ProtScale pada
http://www.expasy.ch/cgi-bin/protscale.pl dan TMHMM (http://cbs.dtu.dk/services/TMHMM-2.0) (Claverie & Notredame 2003; Gasteiger et al. 2003), analisis domain dilakukan dengan
menggunakan program Pfscan (http://hits.isb-sib.ch/cgi-bin/PFSCAN) (Claverie & Notredame 2003), multiple sequence alignment dilakukan dengan program Tree
based Consistency Objective Function For alignmEnt Evaluation (T-COFFEE)
(Notredame et al. 2000), visualisasi multiple sequence alignment dengan program
Chroma (Goodstadt & Ponting 2001) dan konstruksi pohon filogenetik dengan program phylogeny inference package (PHYLIP) (http://bioweb.pasteur.fr/
IV. HASIL DAN PEMBAHASAN
4.1 Uji Aktivitas Selulolitik
4.1.1 Uji aktivitas selulolitik secara kualitatif
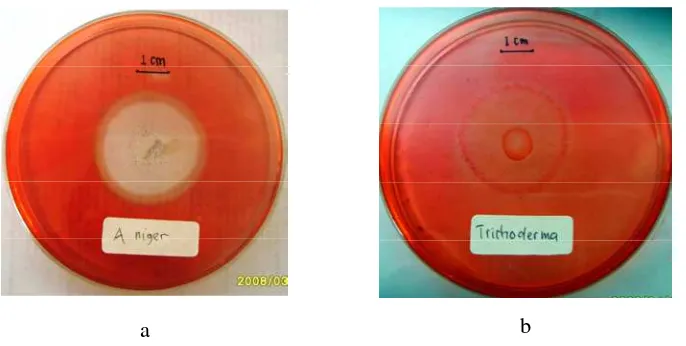
Aktivitas selulolitik beberapa isolat A. niger dan Trichoderma diuji pada
media agar CMC. Adanya aktivitas selulolitik ditandai dengan terbentuknya zona bening disekeliling koloni cendawan (Gambar 6). Pewarna Congo Red
berinteraksi secara kuat dengan polisakarida yang mengandung ikatan β-(1,4) dan
β-(1,3) glikosidik membentuk kompleks warna-glukan (Teather & Wood 1982).
Zona bening yang terbentuk mengindikasikan tidak adanya kompleks warna-glukan akibat terjadinya hidrolisis ikatan glikosidik CMC. Sedangkan daerah yang masih berwarna merah mengindikasikan masih adanya kompleks warna-glukan yang mengindikasikan tidak terjadi hidrolisis substrat CMC.
Rata-rata nisbah selulolitik terbesar ditunjukkan oleh isolat A. niger KB12
sebesar 0.47 dan terkecil ditunjukkan oleh isolat Trichoderma IPB12 sebesar 0.02
(Tabel 3). Besarnya nisbah selulolitik ini seringkali tidak berkorelasi dengan besarnya aktivitas selulase. Hal ini kemungkinan disebabkan adanya variasi kecepatan pertumbuhan cendawan.
Gambar 6 Aktivitas selulolitik yang ditunjukkan dengan terbentuknya zona bening disekeliling koloni setelah inkubasi 24 jam pada suhu ruang. (a)
A. niger, (b) Trichoderma.
Tabel 3 Nisbah selulolitik A. niger dan Trichoderma setelah 24 jam inkubasi
pada suhu ruang
Isolat Rata-rata diameter koloni (cm) Rata-rata diameter zona bening (cm) nisbah selulolitik Rata-rata Aspergillus niger IPB1 20.25 28.08 0.37±0,011 A. niger IPB4 19.92 23.50 0.18±0,078 Trichoderma reesei 29.33 30.33 0.03±0,001 Trichoderma IPB2 30.00 31.00 0.03±0,001 Trichoderma IPB9 32.67 34.17 0.05±0,028 Trichoderma IPB11 24.00 25.83 0.08±0,007 Trichoderma IPB12 33.17 34.00 0.02±0,007
4.1.2 Uji aktivitas enzim endoglukanase secara kuantitatif
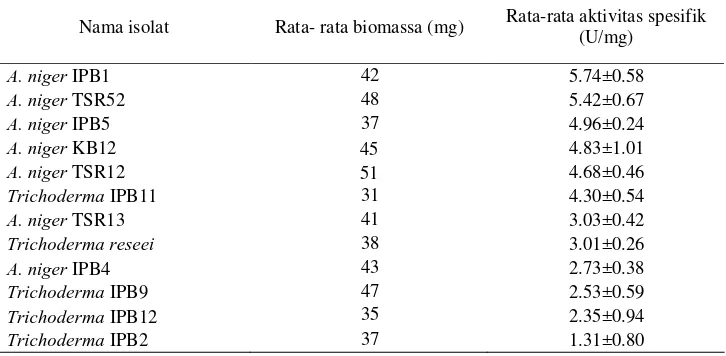
Rata-rata aktivitas spesifik tertinggi ditunjukkan oleh isolat A. niger IPB1
sebesar 5.74 U/mg dan terkecil ditunjukkan oleh isolat Trichoderma IPB2 sebesar
1.31 U/mg (Tabel 4). Beberapa isolat A. niger dan Trichoderma, seperti A. niger
IPB1, A. niger TSR52, A. niger IPB5, A niger KB12, A. niger TSR12, A. niger
TSR13 menunjukkan aktivitas yang lebih tinggi dibandingkan isolat T. reesei
yang merupakan standar aktivitas enzim selulase. Elshafei et al. (1990)
melaporkan bahwa aktivitas enzim endoglukanase A. terreus lebih tinggi
dibandingkan Trichoderma viride yang merupakan standar aktivitas enzim
selulase, sedangkan Pothiraj et al. (2006) melaporkan aktivitas enzim
endoglukanase A. niger lebih tinggi dibandingkan A. terraus. Namun demikian
pembandingan secara langsung hasil ini sulit dilakukan karena banyaknya faktor yang mempengaruhi, seperti komposisi media dan pemilihan substrat yang dapat mempengaruhi aktivitas enzim (Sharma et al. 1986).
Banyak faktor terlibat dalam kinerja suatu enzim, seperti suhu dan pH. Pada penelitian ini digunakan metode yang umum digunakan untuk sistem enzim selulase T. reesei (Ghose 1987) sehinggga tidak menutup kemungkinan aktivitas
beberapa isolat A. niger pada uji ini belum mencapai aktivitas optimalnya.
Beberapa laporan menunjukkan aktivitas enzim endoglukanase A. niger
(Hong et al. 2001). pH optimum aktivitas enzim endoglukanase A. niger
dilaporkan berkisar 4.5 dan 7.5 (Coral et al. 2002), antara 6.0 dan 7.0 (Akiba et al.
1995), dan 6.0 (Hong et al. 2001).
Tabel 4 Aktivitas enzim endoglukanase A. niger dan Trichoderma pada suhu
50oC yang diukur setelah 7 hari inkubasi
Nama isolat Rata- rata biomassa (mg) Rata-rata aktivitas spesifik (U/mg)
A. niger IPB1 42 5.74±0.58
4.2 Isolasi Gen eglA A. niger IPB1 4.2.1 Isolasi RNA total
Isolasi RNA total dilakukan pada isolat yang mempunyai aktivitas spesifik tertinggi, yaitu isolat A. niger IPB1. RNA total berhasil diisolasi dari miselium A.
niger IPB1 yang ditumbuhkan dalam medium induksi CMC. Kuantitas RNA total
yang dihasilkan berdasarkan pengukuran dengan spektrofotometer pada panjang gelombang 260 nm adalah 176.4 g tiap gram miselium. Selanjutnya berdasarkan nilai rasio OD260/OD280, yaitu sebesar 1.72, maka RNA total yang dihasilkan
mempunyai kemurnian yang cukup tinggi (Tabel 5). Manchester (1996) menyatakan bahwa kemurnian RNA yang tinggi ditunjukkan dengan nilai rasio OD260/OD280 antara 1.8 dan 2.0. Hasil elektroforesis menunjukkan RNA total
Tabel 5 Hasil isolasi RNA total
Absorban Bahan
λ260 λ280 λ260/ λ280
Total RNA ( g/ g miselium) Miselium A. niger IPB1 0.210 0.122 1.72 176.4
Gambar 7 Hasil isolasi RNA total A. niger IPB1 yang diisolasi dari miselium
setelah inkubasi 3 hari yang dideteksi dengan elektroforesis menggunakan gel agarosa 1% (b/v).
4.2.2 Sintesis cDNA total
Sintesis cDNA dilakukan menggunakan RNA total yang telah diisolasi sebagai cetakan melalui proses transkripsi balik. Proses ini menggunakan primer oligo(dT) sehingga hanya mRNA yang akan disintesis menjadi cDNA karena adanya ekor poli(A) pada ujung 3’. Sebagai kontrol keberhasilan sintesis cDNA, dilakukan amplifikasi terhadap gen aktin menggunakan primer spesifik (ActF dan
ActR2).
Hasil amplifikasi gen aktin dengan cDNA sebagai cetakan menghasilkan satu pita DNA yang berukuran 123 bp (Gambar 8). Hasil ini menunjukkan bahwa sintesis cDNA total telah berlangsung dengan baik. Selain itu, hasil ini juga menunjukkan RNA yang dihasilkan tidak terkontaminasi oleh DNA genom. Adanya kontaminasi oleh DNA akan ditunjukkan dengan adanya dua pita DNA yang dihasilkan, yaitu pita berukuran 123 bp yang menunjukkan hasil amplifikasi cDNA dan pita berukuran 223 bp yang menunjukkan hasil amplifikasi DNA
rRNA 28S
genom. Pada DNA genom terdapat intron antara ekson1 dan ekson2 sehingga fragmen yang dihasilkan lebih besar.
Gambar 8 Hasil amplifikasi gen aktin dengan PCR yang dideteksi dengan elektroforesis menggunakan gel agarosa 3% (b/v). Lajur 1. Penanda
ΦX174RF DNA/HaeIII Fragments; 2. Gen aktin
4.2.3 Isolasi gen eglA
Hasil sintesis cDNA selanjutnya digunakan sebagai cetakan untuk mengisolasi gen eglA. Isolasi gen eglA dilakukan dengan amplifikasi
menggunakan PCR dengan primer spesifik EAF dan EAR. Amplifikasi gen eglA
A. niger IPB1 menghasilkan pita sekitar 750 bp sesuai dengan hasil prediksi dari
database (Gambar 9).
Gambar 9 Hasil amplifikasi eglA dengan PCR yang dideteksi dengan
elektroforesis menggunakan gel agarosa 1% (b/v). Lajur 1. Penanda 1 kb; 2. eglA hasil PCR
4.2.4 Pengklonan gen eglA
Gen eglA hasil isolasi disisipkan dalam plasmid pGEM-T Easy, ditengah
gen lacZ dengan bantuan enzim ligase. Hasil ligasi kemudian diintroduksikan ke
dalam E. coli galur DH5α yang selanjutnya ditumbuhkan dalam media seleksi
yang mengandung ampisilin, X-gal dan IPTG. Keberhasilan pengklonan gen eglA
dapat diketahui dengan terbentuknya koloni putih (Gambar 10). 310 bp
194 bp
123 bp 1 2
118 bp
750 bp 750bp
1000 bp
Koloni E. coli galur DH5α yang dapat tumbuh pada media yang
mengandung ampisilin adalah koloni yang mengandung plasmid pGEM-T Easy.
Plasmid ini mempunyai gen resistensi ampisilin yang mengekspresikan β
-lactamase yang merusak cincin β-lactame sehingga bakteri yang mengandung
plasmid ini dapat hidup dalam media yang mengandung ampisilin. Adanya gen
eglA yang menyisip ke dalam gen lacZ dibuktikan dengan warna koloni yang
putih. Gen lacZ merupakan gen yang menyandi β-galaktosidase yang mengubah
substrat X-gal yang tidak berwarna menjadi berwarna biru. Adanya penyisipan gen eglA pada gen lacZ mengakibatkan ekspresi gen lacZ terganggu dan β
-galaktosidase tidak diekspresikan, sehingga tidak ada perubahan warna pada substrat X-gal dan koloni yang dihasilkan berwarna putih.
Gambar 10 Koloni E. coli hasil transformasi yang ditumbuhkan dalam media
selektif yang mengandung ampisilin, X-gal dan IPTG.
Gambar 11 Hasil amplifikasi eglA dengan PCR yang dideteksi dengan
elektroforesis menggunakan gel agarosa 1% (b/v). Lajur 1. Penanda 1 kb; 2. eglA hasil PCR
4.2.5 Verifikasi pengklonan gen eglA
Untuk memastikan bahwa sisipan pada gen lacZ adalah gen eglA maka
dilakukan verifikasi dengan menggunakan PCR-koloni menggunakan primer Koloni putih Koloni biru
1 2
750 bp 1000 bp
750 bp
spesifik eglA maupun pemotongan DNA plasmid dengan enzim EcoRI.
PCR-koloni pada PCR-koloni putih menghasilkan pita yang berukuran sekitar 750 bp yang sesuai dengan ukuran eglA (Gambar 11).
DNA plasmid dari koloni putih diisolasi dan selanjutnya di potong dengan menggunakan EcoRI. Enzim ini dipilih karena situs pemotongannya mengapit
sisipan sehingga diharapkan pemotongan akan menghasilkan dua pita, yaitu DNA sisipan dan vektor pembawanya. Hasil pemotongan DNA plasmid menunjukkan adanya dua pita yang berukuran sekitar 3000 bp dan 750 bp (Gambar 12). Ukuran sekitar 3000 bp sesuai dengan ukuran pGEM-T Easy, yaitu sebesar 3015 bp,
sedangkan ukuran sekitar 750 bp sesuai dengan ukuran produk amplifikasi eglA.
Dari dua hasil verifikasi ini dapat dipastikan bahwa DNA yang menyisip dalam gen lacZ plasmid pGEM-T Easy adalah gen eglA A. niger IPB1.
Gambar 12 Hasil pemotongan DNA plasmid rekombinan dengan EcoRI yang
dideteksi dengan elektroforesis menggunakan gel agarosa 1% (b/v). Lajur 1. Penanda 1 kb; 2. Plasmid rekombinan yang dipotong; 3. Plasmid rekombinan yang tidak dipotong
4.3 Pengurutan dan Karakterisasi Gen eglA A. niger IPB1 4.3.1 Pengurutan gen eglA dan deduksi asam aminonya
Pengurutan gen eglA A. niger IPB1 pada pGEM-T Easy dilakukan
menggunakan ABI Prism 3100 versi 3.7 dengan primer sp6 dan T7 (Lampiran 4). Dari hasil pengurutan diperoleh gen eglA A. niger IPB1 sebesar 720 bp yang
menyandi 239 asam amino (Gambar 13).
1 2 3
vektor
750 bp 1000 bp 3000 bp
Gambar 13 Urutan nukleotida eglA A. niger IPB1 dan deduksi asam aminonya
4.3.2 Analisis kesejajaran urutan nukleotida dan asam amino eglA A. niger IPB1 dengan database di GenBank
Analisis kesejajaran urutan nukleotida dan asam amino eglA A. niger IPB1
dengan database di GenBank dilakukan menggunakan program BLAST (Basic
Local Alignment Search Tool). Hasil penyejajaran nukleotida menunjukkan
sekuen eglA A. niger IPB1 mempunyai kemiripan 99% dengan sekuen 14 dari
paten WO2004018662 (E-value 3.7e-152 ), 98% dengan sekuen 1 dari paten
WO9713853 (E-value 1.7e-151 ), WO9713862 (E-value 1.7e-151 ), US6190890 (
E-value 1.7e-151 ), US6306635 (E-value 1.7e-151 ), dan 97% dengan sekuen 13 dari
paten WO2004018662 (E-value 4.5e-149) dan eglA Aspergillus niger CBS 513.88
(E-value 1.1e-148) yang semuanya merupakan gen endoglukanase dari Aspergillus
niger. Sementara itu hasil penyejajaran urutan asam amino menunjukkan urutan
eglA mempunyai kemiripan 99% dengan endoglukanase A atau eglA dari
Aspergillus nigerA. niger (E-value7.1e-127) , 87% dengan endoglukanase A atau cekA dari Aspergillus kawachi (E-value 1.9e-126 ), 81% dengan endoglukanase A
dari Aspergillus terreus (E-value 6.9e-113) dan 75% dengan endoglukanase atau
celA dari Aspergillus oryzae (E-value 4.8e-105) (Lampiran 5 dan 6).
BLAST merupakan program pencari similaritas suatu urutan nukleotida atau asam amino dengan database yang berbasis local alignment, yaitu
penyejajaran pada suatu segmen sekuen yang lebih pendek dengan derajat similaritas yang sangat tinggi. Similaritas mengindikasikan homologi suatu gen atau protein. Jika kedua urutan gen atau protein homolog maka dapat dikatakan bahwa keduanya mempunyai leluhur, fungsi dan struktur yang sama. Dua gen atau fragmen DNA dikatakan homolog jika 70% urutan nukleotidanya atau 25% urutan asam aminonya identik (panjang urutan minimal 100) (Claviere & Notredame 2003). Berdasarkan hal diatas maka dapat dipastikan bahwa eglA merupakan gen
eglA dari Aspergillus niger.
Gambar 14 Peta situs pemotongan eglA dengan menggunakan program NEBcutter
4.3.3 Analisis situs pemotongan gen eglA
fragmen DNA. Pada analisis peta pemotongan gen eglA terlihat tidak terdapat
situs pemotongan EcoRI yang digunakan untuk mengeluarkan DNA sisipan dari
plasmid pGEM-T Easy sebagai vektornya (Gambar 14). Hasil ini sekaligus dapat
digunakan untuk verifikasi keberhasilan pengklonan gen eglA pada plasmid
pGEM-T Easy. Selain itu terdapat beberapa situs pemotongan yang terdapat pada
gen eglA dan situs pengklonan (MCS) pGEM-T Easy, seperti ApaI, NcoI, PstI
dan NsiI, sehingga enzim-enzim ini tidak dapat digunakan untuk mengeluarkan
DNA sisipan dari plasmid, karena akan memotong DNA sisipan juga (Gambar 14).
Gambar 15 Perbandingan domain EglA dari berbagai organisme berdasarkan
database pfam
4.3.4 Analisis domain EglA
Analisis domain EglA dilakukan menggunakan program Pfscan
berdasarkan database Pfam. EglA memiliki katalitik domain yang termasuk dalam A. niger (Glyco hydro 12: 82-239)
T. reesei (Glyco hydro 12: 81-234)
S. lividans (Glyco hydro 12: 111-261; CBM 2 : 279-378)