SI
FAKU
INTESIS
(Na
ULTAS MA
DAN PE
a
2Ti
2O
4(O
TITA
DEP
ATEMATI
INSTITU
ENCIRIAN
OH)
2) BER
ANIUM D
LIA LIST
PARTEME
IKA DAN I
UT PERTA
BOGO
2013
N NATRI
RBAHAN
DIOKSIDA
TRIA
EN KIMIA
ILMU PEN
ANIAN BOG
OR
3
IUM TIT
N DASAR
A
NGETAHU
GOR
TANAT
ABSTRAK
LIA LISTRIA. Sintesis dan Pencirian Natrium Titanat (Na
2Ti
2O
4(OH)
2) Berbahan
Dasar Titanium Dioksida. Dibimbing oleh SRI MULIJANI dan ARMI
WULANAWATI.
TiO
2dapat dimanfaatkan sebagai bahan dasar pembuatan natrium titanat
(Na
2Ti
2O
4(OH)
2). Penelitian bertujuan menyintesis dan mencirikan natrium titanat
dengan bahan dasar TiO
2rutil. Natrium titanat dibuat dengan metode hidrotermal
pada suhu 130
°
C dengan mencampurkan bahan dasar serbuk TiO
2rutil dengan
larutan NaOH 5 M dan 10 M kemudian masing-masing dikalsinasi pada suhu 700
°
C. Hasil analisis sinar-X dispersif energi membuktikan bahwa natrium titanat
berhasil dibentuk. Hasil tersebut juga didukung oleh hasil analisis gugus fungsi
menggunakan spektrofotometer inframerah transformasi Fourier yang
menunjukkan pita vibrasi Ti-O-Na pada bilangan gelombang 989.42 cm
-1.
Pembentukan natrium titanat dipengaruhi oleh keadaan reaksi pembuatan, yaitu
suhu, lama waktu reaksi, dan konsentrasi NaOH. Foto mikroskop elektron
pemayaran menunjukkan bahwa natrium titanat yang dibentuk pada suhu 130
°
C
dengan lama waktu reaksi 20 jam serta penambahan NaOH 10 M memiliki ukuran
kristal 99.37 nm.
Kata kunci: natrium titanat, Na
2Ti
2O
4(OH)
2, titanium dioksida, TiO
2ABSTRACT
LIA LISTRIA. Synthesis and Characterization of Sodium Titanate
(Na
2Ti
2O
4(OH)
2) from Titanium Dioxide Basic Material. Supervised by SRI
MULIJANI and ARMI WULANAWATI.
TiO
2can be utilized as basic material for synthesis of sodium titanate
(Na
2Ti
2O
4(OH)
2). This research was purposed to synthesize and characterize
sodium titanate from TiO
2rutile powder as a basic material. Sodium titanate was
synthesized by hydrothermal process at temperature 130
°
C by mixing TiO
2rutile
powder with 5 M and 10 M NaOH solution, then each was calcinated at
temperature 700
°
C. The energy dispersive X-ray analysis showed that sodium
titanate has been successfully synthesized. This result was also supported by
functional group analysis with Fourier transform infrared (FTIR) spectrofotometer
showing the existence of Ti-O-Na vibration band at 989.42 cm
-1. The formation of
sodium titanate was depend on the reaction condition such as temperature,
reaction time, and NaOH concentration. Scanning electron microscope image
indicated that sodium titanate synthesized at 130
°
C in 20 hours reaction time with
10 M NaOH had crystal size of 99.37 nm.
Key words: sodium titanate, Na
2Ti
2O
4(OH)
2, titanium dioxide,
TiO
2SINTESIS DAN PENCIRIAN NATRIUM TITANAT
(Na
2Ti
2O
4(OH)
2) BERBAHAN DASAR
TITANIUM DIOKSIDA
LIA LISTRIA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
Skripsi : Sintesis dan Pencirian Natrium Titanat (Na
2Ti
2O
4(OH)
2)
Berbahan Dasar Titanium Dioksida
Nama
: Lia Listria
NIM :
G44086009
Disetujui
Pembimbing I
Dr Sri Mulijani, MSi
NIP 19630401 199103 2 001
Pembimbing II
Armi Wulanawati, SSi, MSi
NIP 19690725 200003 2 001
Diketahui
Ketua Departemen Kimia
Prof Dr Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Shalawat dan salam semoga
selalu tercurah kepada Nabi Muhammad SAW, keluarga, para sahabatnya dan
seluruh pengikutnya hingga akhir zaman. Judul yang dipilih dalam penelitian
ialah Sintesis dan Pencirian Natrium Titanat (Na
2Ti
2O
4(OH)
2) Berbahan Dasar
Titanium Dioksida.
Penulis mengucapkan terima kasih kepada Ibu Dr Sri Mulijani, MSi dan Ibu
Armi Wulanawati, SSi, MSi yang telah membantu dan membimbing dalam
penelitian ini. Ucapan terima kasih juga penulis sampaikan kepada Mamah, Ayah,
Kakakku, Adikku, dan Tanteku tersayang atas doa dan kasih sayang yang
diberikan tanpa henti. Terima kasih juga atas dorongan dan semangatnya untuk
rekan-rekan seperjuangan Rania, Rima, Asha, Desi, Lany, dan Marta.
Penulis berharap karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu
pengetahuan.
.
Bogor,
Maret
2013
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 6 Januari 1983 dari Ayah H Tata
Kusdiar dan Ibu Hj Holis Maesaroh, SPd (Alm.). Penulis merupakan anak ketiga
dari 4 bersaudara.
Tahun 2004 penulis lulus dari D3 Analisis Kimia, Fakultas Matematika dan
Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB). Tahun 2008 penulis
melanjutkan pendidikan pada Program Ekstensi S-1 Kimia, Fakultas Matematika
dan Ilmu Pengetahuan Alam, IPB.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
BAHAN DAN METODE
Alat dan Bahan ... 1
Metode Penelitian ... 1
HASIL DAN PEMBAHASAN
Produk Natrium Titanat ... 1
Morfologi Permukaan Natrium Titanat ... 2
Spektrum FTIR Natrium Titanat ... 2
Difraktogram Natrium Titanat ... 3
SIMPULAN DAN SARAN ... 4
DAFTAR PUSTAKA ... ... 4
DAFTAR GAMBAR
Halaman
1 Morfologi permukaan natrium titanat hasil reaksi dengan NaOH 5 M dan
kalsinasi pada 700
°
C, perbesaran 10 000
×
(a) dan dengan NaOH 10 M dan
kalsinasi pada 700
°
C, perbesaran 5000
×
(b) ... 2
2 Spektrum FTIR TiO
2rutil ... 2
3 Spektrum FTIR natrium titanat hasil reaksi dengan NaOH 10 M dan kalsinasi
pada 700
°
C ... 3
4 Pola difraksi TiO
2rutil ... 3
5 Pola difraksi natrium titanat hasil reaksi konsentrasi NaOH 5 M dan kalsinasi
pada 700
°
C ... 3
6 Pola difraksi natrium titanat hasil reaksi dengan NaOH 10 M dan kalsinasi
pada 700
°
C ... 3
DAFTAR LAMPIRAN
Halaman
1 Spektrum EDX natrium titanat dan penentuan rumus molekul natrium titanat
hasil reaksi dengan NaOH 10 M dan kalsinasi pada 700
°
C ... 6
2 Standar JCPDS TiO
2rutil nomor 21-1276 ... 7
3 Data ukuran kristal sampel TiO
2hasil analisis XRD ... 8
1
PENDAHULUAN
Aplikasi TiO2 banyak digunakan untuk
pengolahan limbah, kesehatan, dan kimia. Menurut Lu et al. (2012) TiO2 memiliki 3
struktur kristal, yaitu anatase, rutil, dan brukit. Anatase dan rutil merupakan struktur TiO2
yang cukup stabil, sedangkan TiO2 brukit
biasanya hanya diperoleh dalam mineral dan sulit dimurnikan. TiO2 rutil lebih stabil pada
suhu tinggi dan merupakan bahan dasar
nanotube yang lebih baik. TiO2 anatase dan
rutil yang dicampurkan dapat membentuk
nanotube dengan diameter 8 nm dan panjang 100 nm (Kasuga et al. 1999), sedangkan TiO2
anatase menghasilkan ukuran yang lebih besar dengan diameter 10−30 nm dan panjang 500 nm sampai beberapa μm (Zarate et al. 2008).
Salah satu pemanfaatan TiO2 adalah
sebagai bahan pembuatan natrium titanat. Ali (2004), Li et al. (2012), dan Stengl et al. (2007) meneliti kegunaan natrium titanat sebagai fotokatalis serta adsorben yang potensial dengan kapasitas penukar ion yang baik untuk mengurangi limbah. Zhang et al. (2004) membuat natrium titanat menggunakan metode hidrotermal dengan mencampurkan serbuk TiO2 anatase dalam larutan NaOH 10
M pada suhu 110 °C membentuk senyawa natrium titanat (Na2Ti2O4(OH)2). Larutan
NaOH digunakan dalam sintesis natrium titanat karena lebih mudah, efisien, dan hemat dibandingkan dengan bahan lain. Penggunaan Na2CO3 memerlukan suhu yang tinggi, yaitu
1100−1150 °C (Ali 2004) dan penggunaan NaCl memerlukan suhu 850 °C (Zarate et al. 2008).
Natrium titanat yang dibuat dengan metode hidrotermal memiliki kristal berukuran nanometer. Kemurnian, homogenitas, dan derajat kristanilitas yang dihasilkan tinggi, sementara energi yang dibutuhkan rendah (Lu et al. 2012). TiO2 rutil
sebagai bahan dasar diharapkan dapat menghasilkan natrium titanat dengan ukuran yang lebih baik. Berdasarkan hal tersebut, penelitian bertujuan menyintesis dan mencirikan natrium titanat berbahan dasar TiO2 rutil.
METODE
Alat dan Bahan
Alat-alat yang digunakan selama penelitian ini adalah alat-alat kaca, penangas minyak, neraca analitik, tanur, dan pH-meter. Natrium titanat hasil sintesis dianalisis dengan
spektrofotometer inframerah transformasi fourier (FTIR) Hitachi di Laboratorium Biofarmaka IPB, Bogor, mikroskop elektron pemayaran (SEM) Bruker Zeiss EVO, sinar-X dispersif energi (EDX) Bruker Zeiss EVO, dan difraktometer sinar-X (XRD) Shimadzu di Laboratorium Pengujian Hasil Hutan, Balai Pusat Penelitian dan Pengembangan Keteknikan Kehutanan dan Pengolahan Hasil Hutan (P3KKPHH), Bogor. Bahan-bahan yang digunakan adalah serbuk TiO2 rutil
Merck dan NaOH p.a Merck.
Metode Penelitian
Pembuatan Natrium Titanat (Zhang et al. 2004)
Enam gram serbuk TiO2 direaksikan
dengan masing-masing 300 mL larutan NaOH 5 M dan 10 M pada suhu 130 °C secara hidrotermal dan diaduk dengan pengaduk magnet selama 20 jam. Campuran didinginkan lalu dicuci dengan akuades dan dicek pH hingga 13.5. Endapan putih yang dihasilkan disaring. Vakum, kemudian dikalsinasi dalam tanur bersuhu 700 °C.
Pencirian Natrium Titanat
Analisis EDX digunakan untuk menentukan komposisi kimia natrium titanat dengan tegangan 10 kV. Analisis SEM bertujuan mengamati morfologi permukaan natrium titanat dengan perbesaran 1000−10 000 ×. Analisis FTIR digunakan untuk menentukan pembentukan ikatan kimia antara TiO2 dan NaOH pada jangkauan bilangan
gelombang (ν ) 400−4000 cm-1. Analisis XRD dilakukan untuk mendapatkan ukuran kristal natrium titanat dengan sudut hamburan 10−80°, tegangan 40 kV, dengan laju baca 0.02 °/detik dan arus generator 30 mA.
HASIL DAN PEMBAHASAN
Produk Natrium Titanat
Natrium titanat berhasil dibuat dengan mereaksikan TiO2 dengan larutan NaOH 10 M
dan proses kalsinasi pada 700 °C. Hasil analisis EDX membuktikan komposisi unsur O 33.36%, Ti 33.05%, dan Na 10.35% (Lampiran 1), menunjukkan bahwa struktur senyawa yang terbentuk ialah NaTi2O5.
Menurut Razali et al. (2012), dengan metode hidrotermal, rumus struktur natrium titanat yang dihasilkan masih belum pasti. Reaksi TiO2 dengan NaOH belum tentu
2
dengan rumus yang diharapkan, yaitu Na2Ti2O4(OH)2. Berdasarkan hasil EDX,
NaTi2O4(OH)2 yang terbentuk merubah
menjadi NaTi2O5 setelah dikalsinasi pada
suhu 700 °C. Hasil ini sesuai dengan hasil penelitian Peng et al. (2008).
Pembuatan natrium titanat diawali dengan mendidihkan larutan NaOH 5 M dan 10 M pada suhu 130 °C. Serbuk TiO2 dimasukkan
saat larutan NaOH mendidih. Hal ini dilakukan agar TiO2 dan NaOH mudah
bereaksi membentuk natrium titanat (Li et al. 2007) dengan reaksi sebagai berikut:
2TiO2+ 2NaOH → Na2Ti2O4(OH)2
Na2Ti2O4(OH)2→ Na2Ti2O5 + H2O
Morfologi Permukaan Natrium Titanat
Morfologi natrium titanat hasil reaksi dengan larutan NaOH 5 M dan kalsinasi pada 700 °C berbentuk lonjong (Gambar 1a). Hal ini menunjukkan bahwa natrium titanat sudah mulai terbentuk. Dengan larutan NaOH 10 M dan kalsinasi pada 700 °C, terlihat bentuk menyerupai ikat pinggang yang diduga
nanobelt (Gambar 1b), sesuai hasil penelitian Bela et al. (2010).
Gambar 1 Morfologi permukaan natrium titanat hasil reaksi dengan NaOH 5 M dan kalsinasi pada 700 °C, perbesaran 10 000 × (a) dan dengan NaOH 10 M dan kalsinasi pada 700 °C, perbesaran 5000 × (b).
Natrium titanat yang dihasilkan belum sebaik Bela et al. (2010) yang membuat natrium titanat pada suhu 210 °C selama 24 jam. Suhu dan waktu pembuatan dalam penelitian ini adalah 130 °C selama 20 jam. Menurut Viana et al. (2009), pembentukan struktur natrium titanat dipengaruhi oleh keadaan lingkungan reaksi (suhu dan waktu) dan konsentrasi NaOH.
Spektrum FTIR Natrium Titanat
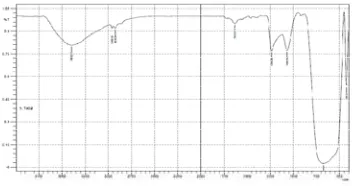
Spektrum FTIR natrium titanat yang diperoleh dengan NaOH 10 M dan kalsinasi pada 700 °C dibandingkan dengan spektrum FTIR TiO2 rutil. Maira et al. (2001)
melaporkan bilangan gelombang (ν ) pada rentang 3600−2500 cm-1 sebagai ν untuk regang OH. Pada hasil penelitian, pita vibrasi yang lebar pada ν 3398.37 cm-1 ditunjukkan oleh spektrum TiO2 rutil (Gambar 2) dan
bergeser ke 3431.16 cm-1 setelah bereaksi dengan larutan NaOH 10 M (Gambar 3). Vibrasi tekuk OH ditunjukkan oleh ν 1640 cm-1 menurut Ali (2004) dan 1623 cm-1 menurut Maira et al. (2001). Pada hasil penelitian, vibrasi ini ditunjukkan pada ν 1633.61 cm-1 dalam spektrum TiO2 rutil
(Gambar 2) dan 1635.54 cm-1 dalam spektrum natrium titanat hasil reaksi dengan NaOH 10 M (Gambar 3).
Pita vibrasi pada ν 1068.50 cm-1 berasal dari gugus Ti-O pada TiO2 rutil (Gambar 2)
dan sesudah membentuk ikatan dengan Na+ dari NaOH, bergeser ke 989.42 cm-1 (Gambar 3). Berdasarkan pergeseran ini, dapat disimpulkan bahwa natrium titanat telah terbentuk. Hal ini sesuai dengan yang dilaporkan oleh Ali (2004): ν 1007−530 cm-1 sebagai pita vibrasi Ti-O-Na dan 1083 cm-1 sebagai pita vibrasi Ti-O. Selain itu, menurut Wijaya et al. (2006), terdapat ν 420.5 cm-1 yang merupakan pita vibrasi Ti-O-Ti dari TiO2. Pada hasil penelitian diperoleh pita
vibrasi tersebut pada ν 426.92 cm-1 untuk TiO2 (Gambar 2) dan 426.58 cm-1 untuk
natrium titanat (Gambar 3).
Gambar 2 Spektrum FTIR TiO2 rutil.
a
b
3
Gambar 3 Spektrum FTIR natrium titanat hasil reaksi dengan NaOH 10 M dan kalsinasi pada 700 °C.
Difraktogram Natrium Titanat
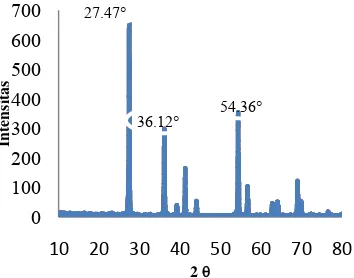
Puncak-puncak difraktogram TiO2 rutil
berada pada sudut 2θ 27.47°, 54.36°, dan 36.12° (Gambar 4). Hasil ini sesuai dengan standar Joint Committee Powder Diffraction Standard (JCPDS) TiO2 rutil nomor 21-1276
(Lampiran 2). Nilai intensitas relatif (IR) secara berurutan adalah 100.00%, 61.87%, dan 47.28% dengan ukuran rerata kristal 58.79 nm.
Gambar 4 Pola difraksi kristal TiO2 rutil.
Difraktogram natrium titanat hasil reaksi dengan NaOH 5 M dan kalsinasi pada 700 °C (Gambar 5) memperlihatkan puncak-puncak kristal yang hampir sama pada sudut 2θ 27.44°, 54.33°, dan 36.10° dengan IR secara berurutan adalah 100.00%, 61.33%, dan 51.33%. Namun, terdapat 2 puncak baru pada sudut 2θ 56.89° dan 76.57° dengan IR masing-masing 3.33%. Kedua puncak ini diduga sebagai natrium titanat dengan ukuran rerata kristal 65.91 nm.
Gambar 5 Pola difraksi natrium titanat hasil reaksi dengan NaOH 5 M dan kalsinasi pada 700 °C.
Difraktogram natrium titanat hasil reaksi dengan NaOH 10 M dan kalsinasi pada 700
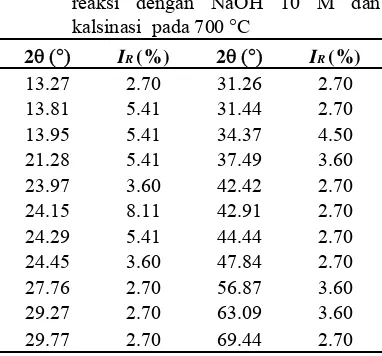
°C (Gambar 6) memiliki rerata ukuran kristal 99.37 nm dan memperlihatkan 3 puncak TiO2
pada sudut 2θ 27.45°, 54.33°, dan 36.10° dengan IR berturut-turut adalah 100.00%, 65.77%, dan 47.75%. Selain itu, muncul juga puncak-puncak lain seperti ditunjukkan pada Tabel. Intensitas puncak-puncak tersebut lebih tinggi dibandingkan dengan hasil reaksi dengan NaOH 5 M yang menunjukkan bahwa besarnya konsentrasi NaOH memengaruhi pembentukan natrium titanat. Dibandingkan dengan hasil yang diperoleh Kim et al. (2006) dengan ukuran kristal 10−500 nm, ukuran rerata kristal natrium titanat hasil penelitian lebih baik, yaitu 65.91 nm dengan NaOH 5 M dan 99.37 nm dengan NaOH 10 M.
Gambar 6 Pola difraksi natrium titanat hasil reaksi dengan NaOH 10 M dan kalsinasi pada 700 °C.
0 100 200 300 400 500 600 700
10 20 30 40 50 60 70 80
Intensitas
2 θ
27.47°
36.12° 54.36°
0 50 100 150 200 250
10 20 30 40 50 60 70 80
Intensitas
2 θ
27.44° 36.10° 54.33° 56.89° 76.57° 0 50 100 150 200
10 20 30 40 50 60 70 80
Intensitas
2θ
27.45°
36.10°
4
Tabel Nilai sudut 2θ natrium titanat hasil reaksi dengan NaOH 10 M dan kalsinasi pada 700 °C
2θ (°) IR(%) 2θ (°) IR(%)
13.27 2.70 31.26 2.70 13.81 5.41 31.44 2.70 13.95 5.41 34.37 4.50 21.28 5.41 37.49 3.60 23.97 3.60 42.42 2.70 24.15 8.11 42.91 2.70 24.29 5.41 44.44 2.70 24.45 3.60 47.84 2.70 27.76 2.70 56.87 3.60 29.27 2.70 63.09 3.60 29.77 2.70 69.44 2.70
Puncak-puncak lain yang berbeda dengan JCPDS 21-2176 dan data kristalografi sampel TiO2 rutil (Lampiran 2 dan 3) pada data
kristalografi sampel natrium titanat hasil reaksi dengan NaOH 5 M atau 10 M dan kalsinasi pada 700 °C kemungkinan berasal dari kristal natrium titanat. Namun, intensitas puncak-puncak tersebut kecil dan semakin besarnya konsentrasi NaOH juga memengaruhi ukuran kristal natrium titanat. Pembentukan natrium titanat selain dipengaruhi oleh konsentrasi NaOH (Kim et al. 2006) juga dipengaruhi lingkungan reaksi (suhu dan waktu) (Viana et al. 2009).
SIMPULAN DAN SARAN
SimpulanNatrium titanat yang terbentuk melalui proses hidrotermal adalah NaTi2O5 sesuai
dengan hasil EDX, yaitu komposisi O 33.36%, Ti 33.05%, dan Na 10.35%. Produk tersebut diperoleh dengan mereaksikan TiO2
dan larutan NaOH 5 M dan 10 M pada suhu 130 °C. Foto SEM memperlihatkan bentuk
nanobelt pada penggunaan NaOH 10 M. Spektrum FTIR menunjukkan pita vibrasi Ti-O-Na pada ν 989.42 cm-1. Pola XRD menunjukkan bahwa natrium titanat telah terbentuk dengan rerata ukuran kristal 65.91 nm dengan NaOH 5 M dan 99.37 nm dengan NaOH 10 M.
Saran
Perlu dilakukan variasi suhu dan waktu reaksi dalam pembuatan natriumtitanat untuk memperoleh hasil yang lebih baik.
DAFTAR PUSTAKA
Ali IM. 2004. Synthesis and sorption behaviour of semicrystalline sodium titanate as a new cation exchanger. J Radioanal Nuc Chem 260:149-157.
Bela S, Wong ASW, Ghim WH. 2010. Hydrolysis and ion exchange of titania nanoparticles towards large scale titania and titanate nanobelts for gas sensing aplications. J Phys 43:1-7.
Kasuga T et al. 1999. Titania nanotubes prepared by chemical processing. Adv Mater 11:1307-1311.
Kim GS, Kim YS, Seo HK, Shin HS. 2006. Hydrothermal synthesis of titanate nanotube followed by electrodeposition process. J Kor Chem 23:1037-1045.
Li G, Zhang L, Ming F. 2012. Facile fabrication of sodium titanate nanostructures using metatitanic acid (TiO2.H2O) and its adsorption property. J
Nanomat. [terhubung berkala].
www.hindawi.com/journals/jnm/2012/875 295/[3 Mar 2013].
Li Q et al. 2007. n/p Type changeable semiconductor TiO2 prepared from NTA. J Nanopar Res 9:951-957.
Lu HB et al. 2012. Effects of hydrothermal temperature on formation and decoloration characteristics of anatase TiO2
nanoparticles. Sci Chin Pr 55:894-902.
Maira AJ et al. 2001. Fourier transform infrared study of the performance of nanostructured TiO2 particles for the
photocatalytic oxidation gaseous. J Cat
202:413-420.
Peng et al. 2008. Interconversion of rutile TiO2 and layered ramsdellite-like titanates:
new route to elongated mesoporous rutile nanoplates. Crys Grow Des 8:3555-3559.
Razali MH, Noor Mohd AF, Mohamed AR, Sreekantan S. 2012. Morphological and structural studies of titanate and titania nanostructured materials obtained after heat treatments of hydrothermally produced layered titanate. J Nanomat
5
http://downloads.hindawi.com/journals/jn m/2012/962073.pdf [3Mar 2013].
Stengl V et al. 2007. Preparation and characterization of titania based nanowires. J Nanopar Res 9:455-470.
Viana BC et al. 2009. Structural. morphological. and vibrational properties of titanate nanotube and nanoribbons. J Braz Chem Soc 20:167-175.
Wijaya K et al. 2006. Utilisasi TiO2-zeolit dan
sinar UV untuk fotodegradasi zat warna
congo red. TEKNOIN 11:199-209.
Zarate RA, Fuentes S, Cabrera AL, Fuenzalida VM. 2008. Structural characterization of single crystals of sodium titanate nanowires prepared by hydrothermal process. J Crys Grow
310:3630-3637.
6
Lampiran 1 Spektrum EDX natrium titanat dan penentuan rumus molekul natrium titanat hasil reaksi dengan NaOH 10 M dan kalsinasi pada 700 °C
Penentuan rumus molekul natrium titanat berdasarkan spektrum EDX:
Na
. 0.45Ti
. .9 0.69O
. 2.09Rumus molekul natrium titanat Na:Ti:O
. . : . 9 . : . 9 .
7
Lampiran 2 Standar JCPDS TiO
2rutil nomor 21-1276
8
Lampiran 3 Data ukuran kristal sampel hasil analisis XRD
Sampel 2θ (°) β (°) 2θ (rad) θ (rad) cos θ β (rad) L (nm)
TiO
2
Rutil
27.1026 0.1066 0.4730 0.2365 0.9722 0.0019 76.6296
27.4658 0.2000 0.4794 0.2397 0.9714 0.0035 40.8750
35.9134 0.0960 0.6268 0.3134 0.9513 0.0017 86.9576
36.1213 0.1600 0.6304 0.3152 0.9507 0.0028 52.2053
39.2111 0.1734 0.6844 0.3422 0.9420 0.0030 48.6161
41.2748 0.1700 0.7204 0.3602 0.9358 0.0030 49.9167
44.0716 0.1733 0.7692 0.3846 0.9269 0.0030 49.4353
54.3550 0.1780 0.9487 0.4743 0.8896 0.0031 50.1509
54.5639 0.1000 0.9523 0.4762 0.8888 0.0017 89.3524
56.6660 0.1757 0.9890 0.4945 0.8802 0.0031 51.3495
62.7953 0.1720 1.0960 0.5480 0.8536 0.0030 54.0907
64.0944 0.1582 1.1187 0.5593 0.8476 0.0028 59.2227
69.0422 0.1629 1.2050 0.6025 0.8239 0.0028 59.1680
69.8475 0.1760 1.2191 0.6095 0.8199 0.0031 55.0314
rerata 58.7858
N a tr iu m ti ta na t h a sil rea ks i d e ng an N a OH
5 M da
n
ka
lsinasi pa
da 70
0 °C
27.0327 0.1000 0.4718 0.2359 0.9723 0.0017 81.6751
27.4446 0.1860 0.4790 0.2395 0.9715 0.0032 43.9496 35.8753 0.1200 0.6261 0.3131 0.9514 0.0021 69.5586
36.0971 0.1443 0.6300 0.3150 0.9508 0.0025 57.8813 39.2111 0.1466 0.6844 0.3422 0.9420 0.0026 57.5036
41.2620 0.1605 0.7202 0.3601 0.9359 0.0028 52.8690
44.0723 0.1280 0.7692 0.3846 0.9269 0.0022 66.9309 54.3291 0.1756 0.9482 0.4741 0.8897 0.0031 50.8304
54.5239 0.0800 0.9516 0.4758 0.8889 0.0014 111.6704
56.6267 0.1471 0.9883 0.4942 0.8804 0.0026 61.3218 56.8781 0.0900 0.9927 0.4964 0.8793 0.0016 100.3460
62.7614 0.2200 1.0954 0.5477 0.8537 0.0038 42.2815 64.0610 0.1600 1.1181 0.5590 0.8478 0.0028 58.5458
69.0237 0.1600 1.2047 0.6023 0.8240 0.0028 60.2337
69.8220 0.1450 1.2186 0.6093 0.8200 0.0025 66.7863
76.5679 0.1400 1.3364 0.6682 0.7849 0.0024 72.2639
rerata 65.9155
13.2693 0.0400 0.2316 0.1158 0.9933 0.0007 199.8710
13.8076 0.1600 0.2410 0.1205 0.9927 0.0028 49.9956
13.9471 0.0800 0.2434 0.1217 0.9926 0.0014 100.0060 21.2832 0.3000 0.3715 0.1857 0.9828 0.0052 26.9342
9
Sampel 2θ(°) β (°) 2θ (rad) θ (rad) cos θ β (rad) L (nm)
Natrium tita
na
t
hasil
rea
ksi
deng
an NaOH
10
M dan
ka
lsina
si pada 7
0
0
°C
24.1548 0.1650 0.4216 0.2108 0.9779 0.0029 49.2185
24.2871 0.0000 0.4239 0.2119 0.9776 0.0000 0.0000
24.4518 0.0900 0.4268 0.2134 0.9773 0.0016 90.2843
27.0228 0.0800 0.4716 0.2358 0.9723 0.0014 102.0918
27.4494 0.1811 0.4791 0.2395 0.9714 0.0032 45.1392
27.7617 0.0400 0.4845 0.2423 0.9708 0.0007 204.5047
29.2698 0.0600 0.5109 0.2554 0.9676 0.0010 136.7932
29.7693 0.1000 0.5196 0.2598 0.9664 0.0017 82.1702
31.2576 0.0800 0.5455 0.2728 0.9630 0.0014 103.0773
31.4374 0.0400 0.5487 0.2743 0.9626 0.0007 206.2453
34.3747 0.1200 0.6000 0.3000 0.9553 0.0021 69.2709
36.0973 0.1680 0.6300 0.3150 0.9508 0.0029 49.7160
37.4922 0.1600 0.6544 0.3272 0.9470 0.0028 52.4135
39.1511 0.1400 0.6833 0.3417 0.9422 0.0024 60.2033
39.2660 0.1500 0.6853 0.3427 0.9419 0.0026 56.2098
41.2489 0.2117 0.7199 0.3600 0.9359 0.0037 40.0808
42.4192 0.0600 0.7404 0.3702 0.9323 0.0010 141.9717
42.9089 0.0400 0.7489 0.3745 0.9307 0.0007 213.3132
44.0733 0.1900 0.7692 0.3846 0.9269 0.0033 45.0904
44.4431 0.0500 0.7757 0.3878 0.9257 0.0009 171.5686
47.8365 0.1400 0.8349 0.4175 0.9141 0.0024 62.0523
54.3310 0.1660 0.9483 0.4741 0.8897 0.0029 53.7705
55.9734 0.0600 0.9769 0.4885 0.8831 0.0010 149.8828
56.6292 0.1480 0.9884 0.4942 0.8804 0.0026 60.9496
56.8664 0.0600 0.9925 0.4963 0.8794 0.0010 150.5106
62.7714 0.1400 1.0956 0.5478 0.8537 0.0024 66.4459
63.0913 0.0600 1.1012 0.5506 0.8522 0.0010 155.3055
64.116 0.1500 1.1190 0.5595 0.8475 0.0026 62.4676
69.0917 0.1520 1.2059 0.6029 0.8237 0.0027 63.4298
69.4446 0.0300 1.2120 0.6060 0.8219 0.0005 322.0620
69.8220 0.1450 1.2186 0.6093 0.8200 0.0025 66.7863
. rerata 97.8711
Contoh perhitungan ukuran kristal TiO
2dan
I
RUkuran kristal dicari dengan menggunakan persamaan Scherrer:
.9
λ
cos
θ
10
lanjutan Lampiran 3
.9 . .
.
. .9
nm
L
=
76.6296 nm
Keterangan:
L
= Ukuran kristal (nm)
λ
= Panjang gelombang sinar-X (nm)
β
=
Full width half maximum
(FWHM) (radian)
cos
θ
= cos sudut difraksi
θ
(radian)
Nilai
I
RTiO
2rutil:
I
R=
(
I
b⁄
I
a)
×
100 %
=
(284
⁄
459)
×
100 %
=
62 %
Keterangan:
I
R= Intensitas relatif
I
a= Intensitas puncak tertinggi
I
b= Intensitas puncak ke-
n