ABSTRAK
RESTI SITI MUTHMAINAH. Karakterisasi dan Penentuan Parameter Kinetik
Enzim
β-galaktosidase dari
Enterobacter cloacae
. Dibimbing oleh DJAROT
SASONGKO H.S dan TATIK KUSNIATI.
Enzim
β-galaktosidase merupakan enzim yang dapat mengubah laktosa
menjadi glukosa dan galaktosa. Enzim
β-galaktosidase dihasilkan dari berbagai
organisme meliputi tanaman, hewan, dan mikrorganisme. Tujuan dari penelitian ini
adalah untuk mengkarakterisasi (aktivitas, pH optimum, suhu optimum, aktivator,
inhibitor dan tingkat pemurnian) serta menentukan parameter kinetik (V
maksdan
K
M) enzim
β-galaktosidase dari
Enterobacter cloacae
. Bakteri ditumbuhkan pada
media laktosa, pepton, dan ekstrak khamir (LPY) yang mengandung laktosa 2%,
pepton 1%, ekstrak khamir 2%, dan NaCl 1% dalam 1 liter akuades. Kondisi
optimum
β-galaktosidase dari
Enterobacter cloacae
pada waktu produksi 18 jam,
pH 7 dan suhu 35°C. Ion-ion logam (Ca
2+, Hg
+, Cu
2+, Co
2+, Zn
2+, Mg
2+, dan Mn
2+)
merupakan inhibitor enzim
β-galaktosidase, sedangkan ion Mg
2+dan Mn
2+diketahui berperan sebagai aktivator enzim. Hasil penentuan parameter kinetik dari
enzim β-galaktosidase yang dimurnikan dengan pengendapan ammonium sulfat dan
dialisis diperoleh V
makssebesar 8.850 µmol/menit dan K
Msebesar 0.274 mM,
sedangkan untuk pembandingnya ekstrak kasar enzim didapatkan nilai V
maks29.412
µmol/menit dan K
M1.118 mM.
ABSTRACT
RESTI SITI MUTHMAINAH. Characterization and Determination of Kinetic
Parameters
β-galactosidase enzyme from
Enterobacter cloacae
. Supervised by
DJAROT SASONGKO H.S and TATIK KUSNIATI.
β-galactosidase is an enzyme that can convert lactose into glucose and
galactose. Β-galactosidase enzyme produced from various organisms include plants,
animals and microorganisms. The purpose of this study was to characterize (activity,
optimum pH, optimum temperature, activators, inhibitors and the level of
purification) as well as determine the kinetic parameters (V
maxand K
M)
β-galactosidase enzyme from
Enterobacter cloacae
. Bacteria were grown in lactose
media, peptone, and yeast (LPY) that contain lactose 2%, peptone 1%, 2% yeast
extract, and 1% NaCl in 1 liter of distilled water. The optimum condition of
β-galactosidase from
Enterobacter cloacae
was on production time 18 hours, pH 7 and
temperature 35 °C. Metal ions (Ca
2+, Hg
+, Cu
2+, Co
2+, Zn
2+, Mg
2+, and Mn
2+) is an
inhibitor of the enzyme β-galactosidase, whereas Mg
2+and Mn
2+are known role as
an enzyme activator. The result of the determination of kinetic parameters of
β-galactosidase enzyme which was purified by ammonium sulfate precipitation and
dialysis V
maxobtained at 8.850 mol / min and K
Mat 0.274 mM, whereas the crude
PENDAHULUAN
Laktosa merupakan gula pereduksi yang terdapat pada atom C pertama dari molekul glukosa. Seperti diketahui laktosa merupakan disakarida yang tersusun dari glukosa dan galaktosa dengan ikatan 1-4. Di dalam tubuh, laktosa disintesis di dalam kelenjar susu (Belitz
et al. 2009). Laktosa merupakan karbohidrat utama dengan proporsi 4.7% dari total susu (Chaplin 2004).
β-galaktosidase termasuk kelompok enzim glikosidase yang mampu menghidrolisis gugus
β-D-galaktosil terminal dari polimer β -D-galaktosida. Enzim β-galaktosidase termasuk dalam kelompok metaloenzim dan merupakan enzim tetramer dengan empat subunit yang identik (Jacobson et al. 1994).
Enzim β-D-galaktosidase ini berfungsi dalam memecah laktosa yang terdapat di mukosa usus halus. Enzim tersebut bekerja memecah laktosa menjadi monosakarida yang siap untuk diserap oleh tubuh yaitu glukosa dan galaktosa. Apabila ketersediaan β -D-galaktosidase tidak mencukupi, laktosa yang terkandung dalam susu tidak akan mengalami proses pencernaan dan akan dipecah oleh bakteri di dalam usus halus. Proses fermentasi yang terjadi dapat menimbulkan gas yang menyebabkan kembung dan rasa sakit di perut. Sedangkan sebagian laktosa yang tidak dicerna akan tetap berada dalam saluran cerna dan tidak terjadi penyerapan air dari feses sehingga penderita akan mengalami diare. Gejala ini dinamakan laktosa intoleran, dimana suatu kondisi ketidakmampuan mencerna laktosa menjadi glukosa dan galaktosa karena enzim β -D-galaktosidase yang rendah pada mukosa usus halus. Penderita laktosa intoleran di Amerika sekitar 95%, Eropa 50%, Asia 80%, dan Afrika 80% (Rusynyk & Still 2001).
Enzim β-galaktosidase banyak digunakan untuk biosintesis galaktooligosakarida dan laktulosa yang merupakan senyawa prebiotik, pemacu pertumbuhan mikrob probiotik, dan yang terpenting dalam keseimbangan mikroflora dalam usus pencernaan manusia. Manfaat lain dari β-galaktosidase adalah untuk mengkonversikan limbah industri susu hewani menjadi substrat untuk bioindustri (Gonzalec Siso et al.1996).
Enzim β-galaktosidase dapat dihasilkan dari tanaman, hewan, dan mikroorganisme. Salah satunya adalah Enterobacter cloacae.
Enterobacter cloacae menghasilkan β -galaktosidase dengan aktivitas transglikosilasi sebesar 55% (Liu et al. 2009). Bidang Mikrobiologi LIPI Cibinong telah mengidentifikasi kemampuan E. cloacae
dalam memproduksi enzim ini. Namun demikian, karakterisasi dan penentuan parameter kinetik enzim β-galaktosidase dari bakteri Enterobacter cloacae belum diteliti. Penelitian ini bertujuan mengkarakterisasi (aktivitas, pH optimum, suhu optimum, aktivator, inhibitor dan tingkat pemurnian) serta menentukan parameter kinetik (Vmaks dan KM)
enzim β-galaktosidase dari Enterobacter cloacae. Hipotesis penelitian ini adalah bakteri Enterobacter cloacae menghasilkan
β-galaktosidase yang terkarakterisasi. Selain itu, dihasilkan β-galaktosidase dari
Enterobacter cloacae yang terukur parameter kinetik (Vmaks dan KM) dan tingkat
pemurniannya. Penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai berbagai bakteri Enterobacter cloacae yang menghasilkan β-galaktosidase yang terkarakterisasi. Selain itu, diharapkan juga dapat memberikan informasi ilmiah mengenai parameter kinetik (Vmaks dan KM) dan tingkat
pemurnian enzim β-galaktosidase dari bakteri
Enterobacter cloacae.
TINJAUAN PUSTAKA
β-Galaktosidase
β-galaktosidase (EC 3.2.1.23) termasuk enzim hidrolase yang dapat menghidrolisis ikatan β-D-galaktosida pada ujung nonreduksi residu β-D-galaktosa (Gambar 1). Nama sistematiknya adalah β-D-galaktosida galaktohidrolase. Enzim ini mempunyai nama lain yaitu laktase. Enzim β-galaktosidase bersifat intraseluler pada bakteri dan khamir, tetapi bersifat ekstraseluler pada fungi. Enzim
β-galaktosidase juga bersifat induktif, karena akan diproduksi jika terdapat induser berupa laktosa (Mahoney 2004).
Enzim β-galaktosidase dari bakteri seperti
Lactobacillus bulgaricus bersifat aktif pada pH rendah (dibawah pH 5.5) dengan suhu berkisar 30-60ºC. Enzim β-galaktosidase dari yeast
seperti Kluyveromyces lactis dan
Kluyveromyces fragilis bersifat aktif pada pH netral sekitar 6-8 dengan suhu berkisar 25-40ºC. Enzim yang sama hasil produksi dari fungi seperti Aspergillus niger dan Aspergillus oryzae aktif pada pH rendah berkisar 2.5-6.0 serta bersifat termostabil (Mahoney 2004). β -galaktosidase terdapat pada usus halus manusia yang dapat menghidrolisis laktosa menjadi glukosa dan galaktosa serta mempunyai pH optimum 6 (Campbell et al. 2000)
PENDAHULUAN
Laktosa merupakan gula pereduksi yang terdapat pada atom C pertama dari molekul glukosa. Seperti diketahui laktosa merupakan disakarida yang tersusun dari glukosa dan galaktosa dengan ikatan 1-4. Di dalam tubuh, laktosa disintesis di dalam kelenjar susu (Belitz
et al. 2009). Laktosa merupakan karbohidrat utama dengan proporsi 4.7% dari total susu (Chaplin 2004).
β-galaktosidase termasuk kelompok enzim glikosidase yang mampu menghidrolisis gugus
β-D-galaktosil terminal dari polimer β -D-galaktosida. Enzim β-galaktosidase termasuk dalam kelompok metaloenzim dan merupakan enzim tetramer dengan empat subunit yang identik (Jacobson et al. 1994).
Enzim β-D-galaktosidase ini berfungsi dalam memecah laktosa yang terdapat di mukosa usus halus. Enzim tersebut bekerja memecah laktosa menjadi monosakarida yang siap untuk diserap oleh tubuh yaitu glukosa dan galaktosa. Apabila ketersediaan β -D-galaktosidase tidak mencukupi, laktosa yang terkandung dalam susu tidak akan mengalami proses pencernaan dan akan dipecah oleh bakteri di dalam usus halus. Proses fermentasi yang terjadi dapat menimbulkan gas yang menyebabkan kembung dan rasa sakit di perut. Sedangkan sebagian laktosa yang tidak dicerna akan tetap berada dalam saluran cerna dan tidak terjadi penyerapan air dari feses sehingga penderita akan mengalami diare. Gejala ini dinamakan laktosa intoleran, dimana suatu kondisi ketidakmampuan mencerna laktosa menjadi glukosa dan galaktosa karena enzim β -D-galaktosidase yang rendah pada mukosa usus halus. Penderita laktosa intoleran di Amerika sekitar 95%, Eropa 50%, Asia 80%, dan Afrika 80% (Rusynyk & Still 2001).
Enzim β-galaktosidase banyak digunakan untuk biosintesis galaktooligosakarida dan laktulosa yang merupakan senyawa prebiotik, pemacu pertumbuhan mikrob probiotik, dan yang terpenting dalam keseimbangan mikroflora dalam usus pencernaan manusia. Manfaat lain dari β-galaktosidase adalah untuk mengkonversikan limbah industri susu hewani menjadi substrat untuk bioindustri (Gonzalec Siso et al.1996).
Enzim β-galaktosidase dapat dihasilkan dari tanaman, hewan, dan mikroorganisme. Salah satunya adalah Enterobacter cloacae.
Enterobacter cloacae menghasilkan β -galaktosidase dengan aktivitas transglikosilasi sebesar 55% (Liu et al. 2009). Bidang Mikrobiologi LIPI Cibinong telah mengidentifikasi kemampuan E. cloacae
dalam memproduksi enzim ini. Namun demikian, karakterisasi dan penentuan parameter kinetik enzim β-galaktosidase dari bakteri Enterobacter cloacae belum diteliti. Penelitian ini bertujuan mengkarakterisasi (aktivitas, pH optimum, suhu optimum, aktivator, inhibitor dan tingkat pemurnian) serta menentukan parameter kinetik (Vmaks dan KM)
enzim β-galaktosidase dari Enterobacter cloacae. Hipotesis penelitian ini adalah bakteri Enterobacter cloacae menghasilkan
β-galaktosidase yang terkarakterisasi. Selain itu, dihasilkan β-galaktosidase dari
Enterobacter cloacae yang terukur parameter kinetik (Vmaks dan KM) dan tingkat
pemurniannya. Penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai berbagai bakteri Enterobacter cloacae yang menghasilkan β-galaktosidase yang terkarakterisasi. Selain itu, diharapkan juga dapat memberikan informasi ilmiah mengenai parameter kinetik (Vmaks dan KM) dan tingkat
pemurnian enzim β-galaktosidase dari bakteri
Enterobacter cloacae.
TINJAUAN PUSTAKA
β-Galaktosidase
β-galaktosidase (EC 3.2.1.23) termasuk enzim hidrolase yang dapat menghidrolisis ikatan β-D-galaktosida pada ujung nonreduksi residu β-D-galaktosa (Gambar 1). Nama sistematiknya adalah β-D-galaktosida galaktohidrolase. Enzim ini mempunyai nama lain yaitu laktase. Enzim β-galaktosidase bersifat intraseluler pada bakteri dan khamir, tetapi bersifat ekstraseluler pada fungi. Enzim
β-galaktosidase juga bersifat induktif, karena akan diproduksi jika terdapat induser berupa laktosa (Mahoney 2004).
Enzim β-galaktosidase dari bakteri seperti
Lactobacillus bulgaricus bersifat aktif pada pH rendah (dibawah pH 5.5) dengan suhu berkisar 30-60ºC. Enzim β-galaktosidase dari yeast
seperti Kluyveromyces lactis dan
Kluyveromyces fragilis bersifat aktif pada pH netral sekitar 6-8 dengan suhu berkisar 25-40ºC. Enzim yang sama hasil produksi dari fungi seperti Aspergillus niger dan Aspergillus oryzae aktif pada pH rendah berkisar 2.5-6.0 serta bersifat termostabil (Mahoney 2004). β -galaktosidase terdapat pada usus halus manusia yang dapat menghidrolisis laktosa menjadi glukosa dan galaktosa serta mempunyai pH optimum 6 (Campbell et al. 2000)
polipeptida (monomer) serta berbobot molekul sekitar 464 kDa. Setiap monomer terdiri dari 1023 asam amino. Enzim ini berperan sebagai katalisator pada reaksi hidrolisis dan transglikosilasi (Liu et al. 2009).
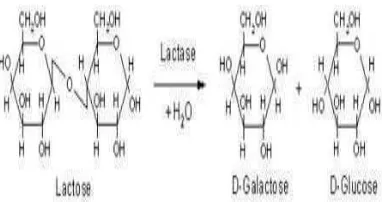
Gambar 1 Reaksi hidrolisis laktosa oleh β- galaktosidase (Chaplin 2004).
Enterobacter cloacae
Bakteri ini memiliki klasifikasi sebagai berikut: kingdom Bacteria, filum Proteobacteria kelas Gamma Proteobacteria, ordo Enterobacteriales, famili Enterobacteriaceae, genus Enterobacter, dan spesies Enterobacter cloacae. Enterobacter cloacae merupakan bakteri Gram negatif, tidak membentuk spora, anaerob fakultatif, dan motil dengan flagela peritrikus (Buchanan 2006). Enterobacter cloacae mempunyai bentuk seperti batang dengan ukuran 0.3-0.6 x 0.8-2.0 m, sehingga kecil dibandingkan dengan bakteri lainnya (Gambar 2). Enterobacter cloacae dapat diisolasi dari buah-buahan, usus hewan, tanah, dan perairan (Pelczar & Chan 1999).
Liu et al (2009) menyatakan bahwa bakteri ini mampu menghasilkan β-galaktosidase dengan suhu optimum 35°C dan aktif pada kisaran pH 6.5-10.5. Enzim β-galaktosidase yang dihasilkan dari bakteri ini mampu mengkatalisis reaksi hidrolisis dan transglikosilasi.
Gambar 2 Enterobacter cloacae (Pelczar &
Chan 1999).
Isolasi dan Pemekatan Enzim
Pemekatan enzim merupakan langkah awal dari proses pemurnian selanjutnya dan dapat
digunakan untuk keperluan analisis enzim. Pemekatan enzim dapat dilakukan dengan dua metode yaitu analitik dan preparatif (penyiapan). Metode analitik menggunakan pengendapan asam (contohnya asam trikloroasetat) dan imunopresipitasi yang dapat menyebabkan denaturasi protein. Berbeda dengan metode analitik, metode preparatif tetap mempertahankan aktivitas protein. Pemekatan protein dengan metode preparatif misalnya dengan pengendapan garam, pengendapan dengan senyawa organik, ultrafiltrasi, liofiliasi, dan dialisis. Metode pemekatan β-galaktosidase yang dilakukan pada penelitian ini adalah menggunakan pengendapan dengan garam.
Pengendapan protein pada awal pemurnian berfungsi untuk memekatkan konsentrasi protein enzim, mereduksi volume larutan enzim, dan memisahkan enzim yang diinginkan dari sebagian enzim yang tidak dikehendaki. Prinsip pengendapan dengan garam berdasarkan pada kelarutan protein yang berinteraksi polar dengan molekul air, interaksi ionik protein dengan garam, dan daya tolak menolak protein yang bermuatan sama. Pengendapan dengan garam biasanya menggunakan garam divalen seperti MgCl2,
MgSO4, dan amonium sulfat biasanya lebih
efektif daripada garam monovalen seperti NaCl, NH4Cl, dan KCl (Boyer 2000). Efek salting-in tidak dipengaruhi oleh sifat garam netral tetapi dipengaruhi oleh konsentrasi dan jumlah muatan pada tiap ion dalam larutan. Kelarutan protein meningkat pada kenaikan konsentrasi garam, kenaikan kelarutan protein akan meningkatkan kekuatan ion larutan. Pada penambahan garam dengan konsentrasi tertentu kelarutan protein akan menurun (salting-out). Konsentrasi garam yang optimum ini sekaligus menurunkan aktivitas enzim. Hal ini dikarenakan sebagian protein mengalami denaturasi dan rusak oleh pengaruh perlakuan selama pengendapan. Semakin banyak molekul air yang berikatan dengan ion-ion garam akan menyebabkan penarikan molekul air yang mengelilingi permukaan protein. Peristiwa ini mengakibatkan protein saling berinteraksi, teragregasi, dan mengendap (Scopes 1987).
Karakterisasi Enzim
Bakteri mengandung enzim konstitutif dan induktif. Enzim konstitutif merupakan enzim yang terdapat dalam sel bakteri dalam jumlah tetap dan tidak bergantung pada keadaan metabolisme organisme tersebut seperti enzim yang terlibat di dalam lintasan glikolisis. Enzim induktif dalam sel bakteri terdapat dalam berbagai konsentrasi. Dalam keadaan normal terdapat dalam jumlah kecil, tetapi konsentrasinya akan meningkat dengan cepat bila substrat tersebut merupakan sumber karbon satu-satunya bagi sel (Lehninger 2004). Aktivitas enzim terhadap substrat dipengaruhi oleh beberapa faktor yaitu, pH, suhu, konsentrasi substrat, aktivator (koenzim dan kofaktor), dan inhibitor.
pH
Efek pH pada enzim berkaitan dengan keadaan ionisasi dari sistem yang dikatalisis, termasuk substrat, dan enzim itu sendiri. Perubahan pH dapat mempengaruhi keadaan ionisasi dari asam-asam amino pada sisi aktif enzim sehingga akan mempengaruhi interaksinya dengan molekul substrat. Kadar pH yang terlalu tinggi atau terlalu rendah akan menyebabkan ketidakstabilan pada konformasi enzim sehingga menyebabkan struktur pada enzim rusak. Enzim mempunyai pH optimum yang khas yang akan menyebabkan aktivitas maksimal. Keadaan optimum ini dihubungkan dengan saat gugus pemberi proton atau penerima proton yang aktif pada sisi enzim berada pada kondisi ionisasi yang tepat. Keadaan optimum tidak harus sama dengan pH lingkungannya.
Aktivitas enzim dalam sel sebagian diatur oleh pH media kulturnya (Lehninger 2004). Enzim β-galaktosidase yang berasal dari fungi mempunyai pH optimum sekitar 2.5-4.5, sedangkan yang berasal dari yeast berkisar 6.0-7.0 (Huang et al. 1995). Enzim β-galaktosidase dari bakteri mempunyai pH optimum 5.0-7.0 (Winarno 1999).
Suhu
Suhu mempengaruhi laju reaksi katalisis enzim dengan dua cara. Pertama, kenaikan suhu akan meningkatkan energi molekul substrat dan pada akhirnya meningkatkan laju reaksi enzim. Peningkatan suhu juga berpengaruh terhadap perubahan konformasi substrat sehingga sisi aktif substrat mengalami hambatan untuk memasuki sisi aktif enzim dan menyebabkan turunnya aktivitas enzim. Kedua, peningkatan energi termal molekul yang membentuk struktur protein enzim itu sendiri akan
menyebabkan rusaknya interaksi-interaksi non kovalen yang menjaga struktur 3D enzim secara bersama-sama sehingga enzim mengalami denaturasi. Denaturasi menyebabkan struktur lipatan enzim membuka pada bagian permukaannya sehingga sisi aktif enzim berubah dan terjadi penurunan aktivitas enzim (Hames dan Hooper 2000).
Peningkatan suhu sebelum tercapai suhu optimum akan meningkatkan kecepatan reaksi katalitik enzim karena energi kinetik molekul-molekul yang bereaksi, yaitu pada saat kompleks enzim-substrat melampaui energi aktivasi terlalu besar, sehingga memecah ikatan sekunder pada konformasi enzim dan sisi aktifnya. Hal ini mengakibatkan enzim terdenaturasi dan kehilangan sifat katalitiknya (Matin 1981). β-galaktosidase yang dihasilkan oleh fungi mempunyai suhu optimum 55°C, sedangkan yeast mempunyai suhu optimum 35°C (Crueger & Crueger 1982).
Aktivator dan Inhibitor
Beberapa enzim membutuhkan komponen tambahan bagi aktivitasnya. Bila komponen tambahan tersebut berupa senyawa anorganik disebut kofaktor, sedangkan jika senyawa organik disebut koenzim. Pada beberapa enzim, kofaktor dan koenzim terlibat langsung pada proses katalitik, tetapi ada juga yang berfungsi sebagai pembawa gugus fungsional tertentu. Hampir semua enzim dapat dihambat oleh senyawa kimia tertentu misalnya ion logam, senyawa pengkelat, senyawa organik, bahkan substrat enzim itu sendiri (Lehninger 2004).
Parameter Kinetik
Michaelis-Menten mendefinisikan suatu tetapan yang dinyatakan sebagai tetapan Michaelis-Menten (KM) adalah konsentrasi
substrat tertentu pada saat enzim mencapai setengah kecepatan maksimumnya. Kecepatan maksimum (Vmaks) adalah kecepatan yang
berangsur-angsur dicapai pada konsentrasi substrat tinggi. Persamaan Michaelis-Menten adalah pernyataan aljabar bagi bentuk hiperbolik kurva tersebut dengan parameter pentingnya adalah konsentrasi substrat ([S]), kecepatan awal (V0), Vmaks, dan KM. Persamaan
Terlihat bahwa KM tidak dipengaruhi oleh
konsentrasi substrat maupun konsentrasi enzim. KM hanya dapat diubah oleh faktor lingkungan.
Kecepatan maksimum (Vmaks) dapat
ditingkatkan dengan meningkatkan konsentrasi enzim dan mengubah faktor lingkungan. Persamaan Michaelis-Menten dapat ditransformasikan ke suatu persamaan lain yang disebut persamaan Lineweaver-Burk. Persamaan ini akan menghasilkan nilai Vmaks
dan KM yang lebih tepat karena pemetaan 1/V0
terhadap 1/[S] menghasilkan garis lurus. Garis ini akan memiliki sudut KM/Vmaks, perpotongan
garis pada sumbu y sebesar 1/Vmaks dan
perpotongan pada sumbu x sebesar -1/KM
(Lehninger 2004). Persamaan Lineweaver-Burk adalah sebagai berikut.
maks maks M
V
S
V
K
V
1
]
[
1
.
1
0+
=
Keterangan:Vo = kecepatan awal Vmaks = kecepatan maksimum
[S] = konsentrasi substrat
KM = konstanta Michaelis-Menten Analisis Aktivitas β-Galaktosidase
Aktivitas β-galaktosidase dapat diketahui dengan menggunakan substrat laktosa untuk menentukan jumlah glukosa dan galaktosa yang terbentuk. Oleh karena itu, penentuan aktivitas
β-galaktosidase sering dilakukan dengan mengukur jumlah glukosa dan galaktosa. Umumnya digunakan o-nitrofenil-β-galaktosida (ONPG) sebagai pengganti substrat laktosa. Laju dari reaksi tersebut dapat diikuti dengan memperkirakan jumlah kromogen o-nitrofenol yang terbentuk (Winarno 1999).
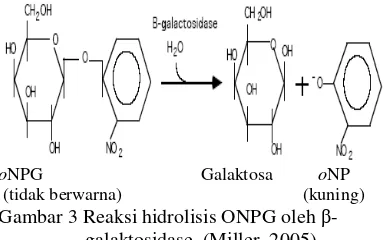
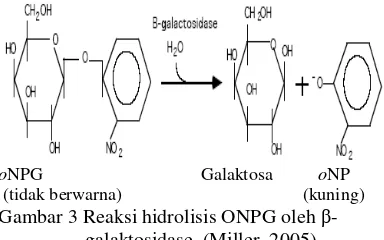
Metode analisis aktivitas β-galaktosidase pada penelitian ini menggunakan substrat o -nitrofenil-β-galaktosida (oNPG). Dalam keadaan normal, oNPG tidak berwarna. Ketika
β-galaktosidase menghidrolisis oNPG maka akan menghasilkan galaktosa dan o-nitrofenol (oNP). Reaksi ini dihentikan dengan penambahan Na2CO3 sehingga pH di dalam
larutan menjadi basa sekitar pH 10-11. Pada pH tersebut oNP akan berubah menjadi bentuk anionik yang berwarna kuning dan β -galaktosidase menjadi inaktif. Jumlah oNP sebanding dengan jumlah β-galaktosidase yang bereaksi sehingga intensitas warna kuning yang dihasilkan dari oNP dapat digunakan untuk menentukan konsentrasi enzim. Jumlah oNP yang terbentuk dapat dideteksi dengan spektrofotometer pada λ = 420 nm (Miller 2005) (Gambar 3).
oNPG Galaktosa oNP (tidak berwarna) (kuning) Gambar 3 Reaksi hidrolisis ONPG oleh β-
galaktosidase (Miller 2005).
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan antara lain biakan berupa Enterobacter cloacae yang merupakan koleksi Bidang Mikrobiologi LIPI Cibinong. Media kultur dan media produksi terdiri atas 10 g laktosa, 5 g pepton, 10 g ekstrak khamir, dan 5 g NaCl yang dilarutkan dalam 1000 mL akuades (pH 7). Bufer yang digunakan adalah bufer fosfat 0.1 M, 0.05 M, dan 0.01 M, bufer asetat 0.1 M, bufer Tris-HCl 0.1 M. Bahan untuk penentuan aktivitas enzim β -galaktosidase, pembuatan kurva standar dan kadar protein adalah enzim β-galaktosidase,
commasie briliant blue 0.1%, o-nitrofenil-β -D-galaktopiranosida (oNPGal), Na2CO3 1 M, dan o-nitrofenol (oNP), bovine serum albumin
(BSA). Bahan untuk pengaruh ion logam terhadap aktivitas enzim digunakan berbagai ion logam (Hg+, Cu2+, Ca2+, Co2+, Mg2+, Mn2+, Zn2+). Bahan untuk pemurnian enzim digunakan garam amonium sulfat dan membran selofan.
Alat-alat yang digunakan untuk penentuan waktu produksi optimum, uji aktivitas enzim β -galaktosidase dan karakterisasinya serta produksi β-galaktosidase adalah mikropipet, jarum ose, tip, laminar air flow cabinet, tabung reaksi, tabung Eppendorf, labu Erlenmeyer, labu ukur, termometer, neraca analitik, vorteks, penangas air Memmert, penangas bergoyang,
stopwatch, pH meter HM-25G TOADKK, kuvet, spektrofotometer UV-Vis 1700 Shimadzu, inkubator Isuzu, botol sentrifus, sonikator Eyela. Alat-alat yang digunakan untuk dialisis adalah gelas piala 1 liter, membran selofan, kantung dialisis, dan
magnetic stirrer.
Metode Penelitian
Penentuan Waktu Produksi Optimum (Liu
et.al 2009)
Sebanyak 2% inokulum bakteri
Terlihat bahwa KM tidak dipengaruhi oleh
konsentrasi substrat maupun konsentrasi enzim. KM hanya dapat diubah oleh faktor lingkungan.
Kecepatan maksimum (Vmaks) dapat
ditingkatkan dengan meningkatkan konsentrasi enzim dan mengubah faktor lingkungan. Persamaan Michaelis-Menten dapat ditransformasikan ke suatu persamaan lain yang disebut persamaan Lineweaver-Burk. Persamaan ini akan menghasilkan nilai Vmaks
dan KM yang lebih tepat karena pemetaan 1/V0
terhadap 1/[S] menghasilkan garis lurus. Garis ini akan memiliki sudut KM/Vmaks, perpotongan
garis pada sumbu y sebesar 1/Vmaks dan
perpotongan pada sumbu x sebesar -1/KM
(Lehninger 2004). Persamaan Lineweaver-Burk adalah sebagai berikut.
maks maks M
V
S
V
K
V
1
]
[
1
.
1
0+
=
Keterangan:Vo = kecepatan awal Vmaks = kecepatan maksimum
[S] = konsentrasi substrat
KM = konstanta Michaelis-Menten Analisis Aktivitas β-Galaktosidase
Aktivitas β-galaktosidase dapat diketahui dengan menggunakan substrat laktosa untuk menentukan jumlah glukosa dan galaktosa yang terbentuk. Oleh karena itu, penentuan aktivitas
β-galaktosidase sering dilakukan dengan mengukur jumlah glukosa dan galaktosa. Umumnya digunakan o-nitrofenil-β-galaktosida (ONPG) sebagai pengganti substrat laktosa. Laju dari reaksi tersebut dapat diikuti dengan memperkirakan jumlah kromogen o-nitrofenol yang terbentuk (Winarno 1999).
Metode analisis aktivitas β-galaktosidase pada penelitian ini menggunakan substrat o -nitrofenil-β-galaktosida (oNPG). Dalam keadaan normal, oNPG tidak berwarna. Ketika
β-galaktosidase menghidrolisis oNPG maka akan menghasilkan galaktosa dan o-nitrofenol (oNP). Reaksi ini dihentikan dengan penambahan Na2CO3 sehingga pH di dalam
larutan menjadi basa sekitar pH 10-11. Pada pH tersebut oNP akan berubah menjadi bentuk anionik yang berwarna kuning dan β -galaktosidase menjadi inaktif. Jumlah oNP sebanding dengan jumlah β-galaktosidase yang bereaksi sehingga intensitas warna kuning yang dihasilkan dari oNP dapat digunakan untuk menentukan konsentrasi enzim. Jumlah oNP yang terbentuk dapat dideteksi dengan spektrofotometer pada λ = 420 nm (Miller 2005) (Gambar 3).
oNPG Galaktosa oNP (tidak berwarna) (kuning) Gambar 3 Reaksi hidrolisis ONPG oleh β-
galaktosidase (Miller 2005).
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan antara lain biakan berupa Enterobacter cloacae yang merupakan koleksi Bidang Mikrobiologi LIPI Cibinong. Media kultur dan media produksi terdiri atas 10 g laktosa, 5 g pepton, 10 g ekstrak khamir, dan 5 g NaCl yang dilarutkan dalam 1000 mL akuades (pH 7). Bufer yang digunakan adalah bufer fosfat 0.1 M, 0.05 M, dan 0.01 M, bufer asetat 0.1 M, bufer Tris-HCl 0.1 M. Bahan untuk penentuan aktivitas enzim β -galaktosidase, pembuatan kurva standar dan kadar protein adalah enzim β-galaktosidase,
commasie briliant blue 0.1%, o-nitrofenil-β -D-galaktopiranosida (oNPGal), Na2CO3 1 M, dan o-nitrofenol (oNP), bovine serum albumin
(BSA). Bahan untuk pengaruh ion logam terhadap aktivitas enzim digunakan berbagai ion logam (Hg+, Cu2+, Ca2+, Co2+, Mg2+, Mn2+, Zn2+). Bahan untuk pemurnian enzim digunakan garam amonium sulfat dan membran selofan.
Alat-alat yang digunakan untuk penentuan waktu produksi optimum, uji aktivitas enzim β -galaktosidase dan karakterisasinya serta produksi β-galaktosidase adalah mikropipet, jarum ose, tip, laminar air flow cabinet, tabung reaksi, tabung Eppendorf, labu Erlenmeyer, labu ukur, termometer, neraca analitik, vorteks, penangas air Memmert, penangas bergoyang,
stopwatch, pH meter HM-25G TOADKK, kuvet, spektrofotometer UV-Vis 1700 Shimadzu, inkubator Isuzu, botol sentrifus, sonikator Eyela. Alat-alat yang digunakan untuk dialisis adalah gelas piala 1 liter, membran selofan, kantung dialisis, dan
magnetic stirrer.
Metode Penelitian
Penentuan Waktu Produksi Optimum (Liu
et.al 2009)
Sebanyak 2% inokulum bakteri
0.7 setara dengan 1010 jumlah koloni/sel, diinokulasi ke dalam 300 mL media kultur, lalu diinkubasi dan diagitasi pada suhu 37ºC. Sel dipanen dua kali dalam sehari (setiap 6 jam) pada hari ke-0 hingga hari ke-2 sebanyak 15 mL. Setelah itu, jumlah bakteri diukur pada OD600, dan sampel disentrifugasi dengan
kecepatan 10000 rpm selama 15 menit pada suhu 4ºC. Kemudian, pelet dilarutkan dalam 1 mL bufer fosfat 0.05 M pH 6.5. Pemecahan sel dilakukan dengan menggunakan glass bead dan divorteks selama 5 menit. Selanjutnya, suspensi sel disentrifus dengan kecepatan 10000 rpm selama 15 menit pada suhu 4ºC. Supernatannya kemudian digunakan untuk uji aktivitas β -galaktosidase.
Uji Aktivitas Enzim β-Galaktosidase (Liu et
al. 2009)
Sebanyak 1000 µl buffer fosfat 0.1 M pH 7 dan 100 µl enzim dimasukkan ke dalam tabung reaksi, kemudian diinkubasi pada suhu 37°C selama 5 menit. Larutan ditambahkan 200 µl
o-nitrofenil-β-D-galaktopiranosida (oNPGal) 4 mg/ml dan diinkubasi pada suhu 37 °C selama 15 menit. Menit ke-15 larutan ditambahkan 1000 µl Na2CO3 1 M. Setelah itu, larutan
dianalisis dengan menggunakan spektrofotometer UV-VIS pada panjang gelombang 420 nm. Aktivitas enzim (U/ml) didefinisikan sebagai jumlah µ mol o -nitrofenol (oNP) yang dibentuk per menit per mililiter enzim pada kondisi percobaan. Pembuatan kurva standar dilakukan dengan cara membuat stok oNP berbagai konsentrasi dari 0.05-3 mg/ml (0.25-15 µ mol) yang dilarutkan dalam 20 mL bufer fosfat 0.01 M pH 7, kemudian larutan diaduk rata. Sebanyak 1000 µl buffer fosfat 0.1 M pH 7 dan 100 µl aquades dimasukkan ke dalam tabung reaksi. Larutan tersebut ditambahkan 200 µl oNP, dan 1000 µl Na2CO3 1 M. Setelah itu, larutan
dianalisis dengan menggunakan spektrofotometer UV-VIS pada panjang gelombang 420 nm. Rumus perhitungannya sebagai berikut:
Aktivitas (U/ml) =
t
V
NP
mikromol
×
o
Keterangan:V = Volume enzim yang diuji (0.1 ml) t = Waktu inkubasi ( 15 menit)
Karakterisasi β-Galaktosidase (Liu et al. 2009)
Karakterisasi enzim meliputi suhu optimum, pH optimum, efek ion logam, pengaruh pemanasan dan parameter kinetik. Enzim diujikan pada suhu inkubasi (25-45°C) dengan
selang 5ºC, dan bufer pada kisaran pH 5.5-8.5 selang 0.5 diinkubasi selama 5 menit sebelum ditambahkan oNPGal 4 mg/ml. Pada pengaruh pemanasan selama 1 jam, enzim diujikan pada berbagai suhu dan pH, diinkubasi selama 1 jam, kemudian ditambahkan oNPGal 4 mg/ml dan diinkubasi selama 15 pada suhu 37 ºC . Ion-ion logam yang digunakan (Hg+, Cu2+, Ca2+, Co2+, Mg2+, Mn2+, Zn2+) pada konsentrasi 0.01 M. Penentuan parameter kinetiknya dilakukan pada enzim kasar dan enzim hasil pemurnian (dialisis) yang diujikan pada konsentrasi 0.1, 1, 2, 4, 5 mg/ml dan waktu inkubasi 5-20 menit selang 5.
Produksi β-Galaktosidase (Wang &
Sakakibara 1997)
Sebanyak 2% inokulum E. cloacae
diinokulasikan ke dalam 900 ml media produksi yang telah steril, diinkubasi pada suhu 37 °C. Kemudian, sel dipanen setelah inkubasi selama 18 jam (waktu produksi β-galaktosidase optimum). Setelah itu, cairan disentrifus dengan kecepatan 10000 rpm (15.880 g) selama 15 menit pada suhu 4°C. Peletnya dilakukan pencucian sebanyak dua kali dengan buffer fosfat 0.05 M pH 6.5. Setelah itu, sebanyak pelet yang diperoleh dilarutkan dalam 30 ml buffer fosfat 0.05 M pH 6.5, dan dilakukan pemecahan sel dengan sonikator 50 kHz selama 5 menit pada suhu 4°C. Suspensi sel disentrifus dengan kecepatan 10000 rpm selama 15 menit pada suhu 4°C. Supernatan yang diperoleh merupakan cairan enzim β -galaktosidase.
Penentuan Kadar Protein (Bradford 1976)
Enzim β-galaktosidase sebanyak 100 l ditambahkan 5 ml larutan coomassie briliant blue 0.1%. Larutan divorteks dan didiamkan selama 5 menit lalu diukur absorbansinya pada panjang gelombang 595 nm. Pembuatan kurva standar protein yang digunakan adalah bovine serum albumin (BSA) dengan berbagai konsentrasi dari 0.005-1.25 mg/ml serta perlakuan yang sama dengan penentuan kadar protein.
Pengendapaan dengan Amonium Sulfat (Scopes 1987)
Sebanyak 20 mL ekstrak kasar β -galaktosidase diendapkan dengan amonium sulfat. Amonium sulfat yang ditambahkan secara bertahap dengan konsentrasi yaitu 10, 20, 30, 40, 50, 60, dan 70%, lalu diaduk dengan
dilarutkan dalam 1 mL bufer fosfat 0.05 M pH 6.5. Aktivitas yang tinggi menunjukan persentase kejenuhan amonium sulfat yang optimum. Jumlah amonium sulfat (gram) yang digunakan untuk melarutkan 1 liter larutan enzim menggunakan rumus dibawah ini dengan S1 merupakan konsentrasi awal amonium sulfat sedangkan S2 merupakan konsentrasi akhir amonium sulfat. Angka 533 menunjukan bahwa untuk membuat larutan jenuh 100% dibutuhkan 533 gram amonium sulfat per liter.
Jumlah amonium sulfat (gram/liter) =
0.3S2
-100
S1)
-(S2
533
Aktivitas spesifik yang tinggi menunjukan persentase kejenuhan amonium sulfat yang optimum dan selanjutnya digunakan dalam tahap pemurnian. Sebelum tahap pemurnian selanjutnya dilakukan dialisis dengan membran selofan. Enzim dimasukkan ke dalam membran selofan dan didialisis menggunakan bufer fosfat 0.01 pH 7 selama 24 jam.
HASIL DAN PEMBAHASAN
Hasil Produksi Enzim β-Galaktosidase dari
Enterobacter cloacae
Produksi enzim β-galaktosidase dilakukan dengan menumbuhkan bakteri Enterobacter cloacae pada media laktosa, pepton, yeast
(LPY) cair setelah sebelumnya dikulturkan dalam medium yang sama hingga mencapai OD=0.7 setara dengan 1010 jumlah koloni/sel (Liu et al. 2009). Pemanenan sel dilakukan dengan cara sentrifugasi dengan kecepatan 10000 rpm ( 15880 g) selama 15 menit pada suhu 4°C, untuk mencegah kerusakan enzim. Prinsip metode sentrifugasi ini, yaitu proses pemisahan ekstrak enzim yang didasarkan pada berat molekul dengan menggunakan gaya sentrifugal. Sentrifugasi dilakukan pada suhu rendah untuk mencegah terjadinya kerusakan enzim. Berdasarkan hal tersebut berat molekul yang ringan akan berada diatas dan yang berat berada dibawah (Koolman 2000). Sel kemudian dicuci sebanyak dua kali dengan menggunakan bufer fosfat 0.05 pH 6.5 agar terbebas dari pengotor yang berasal dari media. Selanjutnya, pemecahan sel dilakukan dengan metode sonikasi 50 kHz selama 5 menit. Metode ini bertujuan untuk memecah dinding sel dengan frekuensi gelombang suara yang lebih besar. Sel dipecah didalam bufer fosfat 0.05 pH 6.5 pada suhu 4°C agar enzim tidak mengalami kerusakan. Menurut Liu et al (2009), enzim β -galaktosidase pada bakteri Enterobacter
cloacae merupakan enzim intraseluler, sehingga memerlukan pemecahan dinding sel. Pemanenan sel dilakukan pada fase eksponensial, karena pembentukan enzim terdapat pada fase tersebut. Oleh karena itu, perlu dilakukan pengukuran pertumbuhan bakteri Enterobacter cloacae selama 30 jam melalui pengukuran optical density (OD) pada panjang gelombang 600 nm.
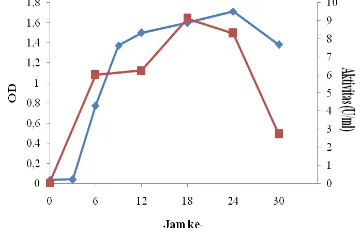
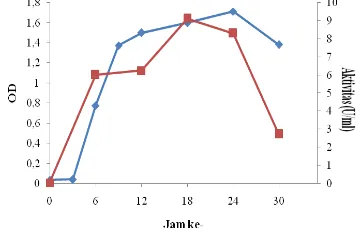
Kurva pertumbuhan diawali dengan fase awal (lag) yang merupakan masa penyesuaian mikroba. Pada fase tersebut terjadi sintesis enzim oleh sel yang dipergunakan untuk metabolisme metabolit. Setelah fase awal itu selesai, baru mulai terjadi reproduksi selular. Konsentrasi selular meningkat perlahan-lahan hingga makin lama makin meningkat sampai pada suatu saat laju pertumbuhan atau reproduksi seluler mencapai titik maksimal dan terjadi pertumbuhan secara logaritmik atau eksponesial. Berdasarkan kurva pertumbuhan tersebut diperoleh bahwa Enterobacter cloacae
menunjukan fase eksponensial setelah diinkubasi selama 12-24 jam (Gambar 4). Selanjutnya, setelah substrat tertentu yang diperlukan untuk pertumbuhan bakteri dalam media biakan mendekati habis dan terjadi penumpukan produk-produk penghambat, maka terjadi penurunan laju pertumbuhan bakteri tersebut. Fase penurunan ditandai oleh berkurangnya jumlah sel hidup (viable) dalam media akibat terjadinya kematian (mortalitas) (Mangunwidjaja et al.1994). Berdasarkan aktivitas β-galaktosidase yang diperoleh, dibuatkan kurva aktivitas β-galaktosidase. Kurva aktivitas menunjukkan bahwa aktivitas
β-galaktosidase tertinggi diperoleh pada jam ke-18 sebesar 9.117 U/mL enzim (Gambar 4). Adapun kadar protein β-galaktosidase tertinggi juga diperoleh pada jam ke-18 sebesar 0.211 mg/ml (Gambar 5). Hasil ini relatif lebih besar dibandingkan dengan aktivitas enzim β -galaktosidase dari Lactobacillus bulgaricus
sebesar 0.088U/ml, sehingga prosfektif untuk produksi (Yuningtias 2008).
dilarutkan dalam 1 mL bufer fosfat 0.05 M pH 6.5. Aktivitas yang tinggi menunjukan persentase kejenuhan amonium sulfat yang optimum. Jumlah amonium sulfat (gram) yang digunakan untuk melarutkan 1 liter larutan enzim menggunakan rumus dibawah ini dengan S1 merupakan konsentrasi awal amonium sulfat sedangkan S2 merupakan konsentrasi akhir amonium sulfat. Angka 533 menunjukan bahwa untuk membuat larutan jenuh 100% dibutuhkan 533 gram amonium sulfat per liter.
Jumlah amonium sulfat (gram/liter) =
0.3S2
-100
S1)
-(S2
533
Aktivitas spesifik yang tinggi menunjukan persentase kejenuhan amonium sulfat yang optimum dan selanjutnya digunakan dalam tahap pemurnian. Sebelum tahap pemurnian selanjutnya dilakukan dialisis dengan membran selofan. Enzim dimasukkan ke dalam membran selofan dan didialisis menggunakan bufer fosfat 0.01 pH 7 selama 24 jam.
HASIL DAN PEMBAHASAN
Hasil Produksi Enzim β-Galaktosidase dari
Enterobacter cloacae
Produksi enzim β-galaktosidase dilakukan dengan menumbuhkan bakteri Enterobacter cloacae pada media laktosa, pepton, yeast
(LPY) cair setelah sebelumnya dikulturkan dalam medium yang sama hingga mencapai OD=0.7 setara dengan 1010 jumlah koloni/sel (Liu et al. 2009). Pemanenan sel dilakukan dengan cara sentrifugasi dengan kecepatan 10000 rpm ( 15880 g) selama 15 menit pada suhu 4°C, untuk mencegah kerusakan enzim. Prinsip metode sentrifugasi ini, yaitu proses pemisahan ekstrak enzim yang didasarkan pada berat molekul dengan menggunakan gaya sentrifugal. Sentrifugasi dilakukan pada suhu rendah untuk mencegah terjadinya kerusakan enzim. Berdasarkan hal tersebut berat molekul yang ringan akan berada diatas dan yang berat berada dibawah (Koolman 2000). Sel kemudian dicuci sebanyak dua kali dengan menggunakan bufer fosfat 0.05 pH 6.5 agar terbebas dari pengotor yang berasal dari media. Selanjutnya, pemecahan sel dilakukan dengan metode sonikasi 50 kHz selama 5 menit. Metode ini bertujuan untuk memecah dinding sel dengan frekuensi gelombang suara yang lebih besar. Sel dipecah didalam bufer fosfat 0.05 pH 6.5 pada suhu 4°C agar enzim tidak mengalami kerusakan. Menurut Liu et al (2009), enzim β -galaktosidase pada bakteri Enterobacter
cloacae merupakan enzim intraseluler, sehingga memerlukan pemecahan dinding sel. Pemanenan sel dilakukan pada fase eksponensial, karena pembentukan enzim terdapat pada fase tersebut. Oleh karena itu, perlu dilakukan pengukuran pertumbuhan bakteri Enterobacter cloacae selama 30 jam melalui pengukuran optical density (OD) pada panjang gelombang 600 nm.
Kurva pertumbuhan diawali dengan fase awal (lag) yang merupakan masa penyesuaian mikroba. Pada fase tersebut terjadi sintesis enzim oleh sel yang dipergunakan untuk metabolisme metabolit. Setelah fase awal itu selesai, baru mulai terjadi reproduksi selular. Konsentrasi selular meningkat perlahan-lahan hingga makin lama makin meningkat sampai pada suatu saat laju pertumbuhan atau reproduksi seluler mencapai titik maksimal dan terjadi pertumbuhan secara logaritmik atau eksponesial. Berdasarkan kurva pertumbuhan tersebut diperoleh bahwa Enterobacter cloacae
menunjukan fase eksponensial setelah diinkubasi selama 12-24 jam (Gambar 4). Selanjutnya, setelah substrat tertentu yang diperlukan untuk pertumbuhan bakteri dalam media biakan mendekati habis dan terjadi penumpukan produk-produk penghambat, maka terjadi penurunan laju pertumbuhan bakteri tersebut. Fase penurunan ditandai oleh berkurangnya jumlah sel hidup (viable) dalam media akibat terjadinya kematian (mortalitas) (Mangunwidjaja et al.1994). Berdasarkan aktivitas β-galaktosidase yang diperoleh, dibuatkan kurva aktivitas β-galaktosidase. Kurva aktivitas menunjukkan bahwa aktivitas
β-galaktosidase tertinggi diperoleh pada jam ke-18 sebesar 9.117 U/mL enzim (Gambar 4). Adapun kadar protein β-galaktosidase tertinggi juga diperoleh pada jam ke-18 sebesar 0.211 mg/ml (Gambar 5). Hasil ini relatif lebih besar dibandingkan dengan aktivitas enzim β -galaktosidase dari Lactobacillus bulgaricus
sebesar 0.088U/ml, sehingga prosfektif untuk produksi (Yuningtias 2008).
Gambar 5 Kadar protein β-galaktosidase Enterobacter cloacae.
Hasil Optimasi Suhu β-galaktosidase dari
Enterobacter cloacae
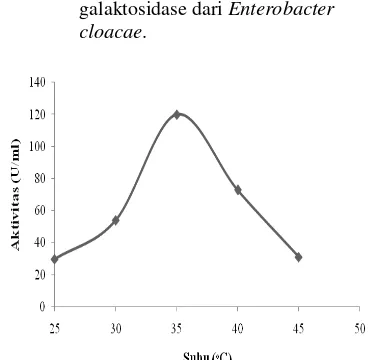
Aktivitas enzim akan semakin meningkat sejalan dengan kenaikan suhu sampai tingkat optimum, sesudahnya aktivitas enzim akan menurun, sehingga kehilangan sebagian aktivitasnya. Penentuan suhu terhadap aktivitas enzim β-galaktosidase diperlihatkan pada Gambar 6. Aktivitas enzim β-galaktosidase pada suhu 25-35°C menunjukkan kenaikan secara bertahap. Suhu optimum β-galaktosidase dari Enterobacter cloacae dicapai pada suhu 35°C dengan aktivitas enzimnya sebesar 71.171 U/ml. Menurut Liu et al (2009), β -galaktosidase dari Enterobacter cloacae
mencapai aktivitas tertinggi pada suhu 35°C. Peningkatan suhu pada batas optimum menyebabkan naiknya energi kinetik yang mempercepat gerak vibrasi, translasi, serta rotasi enzim dan substrat. Kondisi ini memperbesar peluang enzim dan substrat untuk bertumbukan. Semakin sering bertumbukan, maka reaksi pengikatan kompleks enzim substrat akan meningkat. Pada suhu setelah suhu optimum, akivitas enzim menurun. Hal ini dikarenakan enzim adalah molekul protein yang dapat terdenaturasi pada suhu tinggi. Peningkatan suhu hingga batas tertentu dapat menyebabkan semakin bertambahnya kerusakan enzim (Palmer 1991). Pada suhu yang lebih rendah dari suhu optimum, aktivitas enzim juga rendah, hal ini disebabkan karena rendahnya energi aktivasi yang tersedia. Energi tersebut dibutuhkan untuk menciptakan kondisi tingkat kompleks aktif, baik dari molekul enzim atau molekul substrat (Hames dan Hooper 2000).
Pengaruh pemanasan juga dapat mempengaruhi aktivitas β-galaktosidase, seperti diperlihatkan oleh Gambar 7.
Pemanasan selama 1 jam pada berbagai suhu ditunjukkan oleh suhu 35°C, dimana pada suhu tersebut aktivitas enzim mengalami peningkatan secara signifikan sebesar 120.045 U/ml.
Hasil penelitian Rhimi et al (2010) menyebutkan bahwa suhu optimum β -galaktosidase dari bakteri Streptococcus thermophillus sekitar 57°C. Hasil penelitian Chen et al (2008) memperlihatkan bahwa suhu optimum β-galaktosidase dari Basillus stearothermophilus sekitar 70°C dan Bacillus licheniformis sekitar 45°C (Phan Tran et al
1998). Yuningtias (2008) menyebutkan bahwa suhu optimum β-galaktosidase dari bakteri
Lactobacillus bulgaricus aktif pada suhu 43°C dengan aktivitas enzim 0.124 U/ml. Hal ini menunjukkan bahwa enzim β-galaktosidase dari Enterobacter cloacae aktif pada suhu yang lebih rendah jika dibandingkan dengan bakteri lain penghasil enzim ini. Oleh karena itu, komsumsi energi yang diperlukan lebih rendah, sehingga menguntungkan untuk digunakan pada bioindustri.
Gambar 6 Pengaruh suhu terhadap aktivitas β- galaktosidase dari Enterobacter cloacae.
Hasil Optimasi pH β-galaktosidase dari
Enterobacter cloacae
Enzim mempunyai gugus yang dapat terionisasi. Dengan demikian, perubahan pH dapat menyebabkan perubahan gugus tersebut yang dapat mengakibatkan perubahan struktur, komformasi, dan sisi aktif enzim (Chakraborti et al. 2000).
Keasaman (pH) dapat mempengaruhi aktivitas enzim. Daya katalisis enzim menjadi rendah pada pH rendah maupun tinggi, karena terjadinya denaturasi protein enzim. Enzim mempunyai gugus aktif yang bermuatan positif (+) dan negatif (-). Aktivitas enzim akan optimum kalau terdapat keseimbangan antara kedua muatannya. Pada keadaan asam muatannya cenderung positif, dan pada keadaan basa muatannya cenderung negatif sehingga aktivitas enzimnya menjadi berkurang atau bahkan menjadi tidak aktif (Koolman 2000). Peningkatan pH sebelum titik optimum menyebabkan terus meningkatnya aktivitas enzim, sampai seluruh enzim berikatan dengan membentuk kompleks enzim-substrat. pH optimum untuk masing-masing enzim tidak selalu sama.
Pengaruh pH terhadap aktivitas enzim β -galaktosidase diperlihatkan pada Gambar 8. Penggunaan tiga macam bufer (bufer asetat, bufer fosfat, dan bufer Tris-HCl) bertujuan untuk menyediakan lingkungan dengan kisaran pH cukup luas (5.0-8.5), sehingga tidak perlu menggunakan pereaksi yang bersifat asam atau basa kuat untuk membuat kondisi reaksi pada kisaran pH tersebut. Pemilihan buffer yang sesuai sangat penting untuk menjaga protein pada pH yang diinginkan dan untuk memastikan hasil penelitian yang konstan.
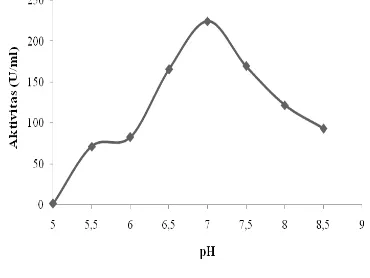
Hasil penelitian menunjukkan bahwa mulai dari pH 5.5-8.0 aktivitas enzim β-galaktosidase pada bakteri Enterobacter cloacae mengalami peningkatan. pH optimum β-galaktosidase dari
Enterobacter cloacae dicapai pada pH 7 dengan nilai aktivitas enzim sebesar 224.504 U/ml. Pada kondisi pH tersebut sisi aktif enzim sudah seluruhnya berikatan dengan substrat membentuk kompleks enzim-substrat. Menurut Lehninger (2004), pada pH optimum, gugus penerima proton yang penting pada sisi aktif berada dalam tingkat ionisasi yang diinginkan. Peningkatan pH diatas batas optimum kerja enzim menyebabkan kerja enzim menurun, karena terjadi denaturasi enzim atau perubahan struktur tiga dimensi molekul enzim. Berdasarkan Gambar 9, memperlihatkan pengaruh pemanasan terhadap aktivitas β -galaktosidase dimana pada pH 7 aktivitas enzim mengalami peningkatan sebesar 170.180 U/ml.
Sebagai perbandingan, pH optimum aktivitas enzim β-galaktosidase dari
Leuconostoc sekitar pH 7.2 (Huang et al 1993). Hasil penelitian Rhimi et al (2009) menyebutkan bahwa β-galaktosidase yang diisolasi dari Lactobacillus bulgaricus memiliki kisaran pH optimum 6.5-7.0. pH optimum enzim β-galaktosidase yang diisolasi dari
Streptococcus thermophilus sekitar pH 6.5-75 (Rhimi et al 2010).
Gambar 8 Pengaruh pH terhadap aktivitas β- galaktosidase dari Enterobacter cloacae.
Gambar 9 Pengaruh pemanasan selama 1 jam pada berbagai pH terhadap aktivitas β-galaktosidase dari Enterobacter cloacae.
Aktivitas Enzim β-galaktosidase Terhadap Penambahan Ion Logam
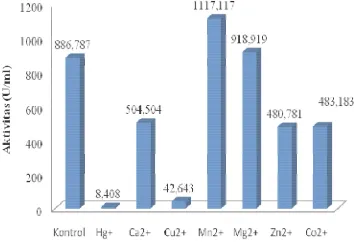
Mg2+ dapat meningkatkan aktivitas enzim (U/ml) pada ion Mn2+ dan Mg2+ masing-masing sebesar 1117.117 U/ml dan 918.919 U/ml dibandingkan dengan aktivitas enzim kontrol. Hal tersebut menunjukkan bahwa ion Mn2+ dan ion Mg2+ dapat meningkatkan aktivitas enzim
β-galaktosidase dari bakteri Enterobacter cloacae (aktivator enzim). Ion Hg2+ dan Cu2+ memiliki kemampuan tertinggi sebagai inhibitor, dimana aktivitas enzim pada ion Hg+ dan Cu2+ mengalami penurunan masing-masing sebesar 8.408 U/ml dan 42.643 U/ml dibandingkan aktivitas enzim kontrol. Hal tersebut menunjukkan bahwa ion Hg+ dan Cu2+ dapat menurunkan aktivitas enzim β -galaktosidase secara drastis. Ion-ion Ca2+, Zn2+, dan Co2+ juga mengalami penurunan aktivitas enzim masing-masing sebesar 504.504 U/ml, 480.781 U/ml, dan 483.183 U/ml. Hal tersebut menunjukkan bahwa ion Ca2+, Zn2+, dan Co2+ hanya menghambat sebagian aktivitas enzim β-galaktosidase (inhibitor parsial).
Hasil penelitian Liu et al (2009) menyebutkan bahwa β-galaktosidase dari
Enterobacter cloacae dihambat secara signifikan oleh ion Hg+ dan ion Cu2+ pada konsentrasi 0.01 mM. Ion-ion logam yang dapat meningkatkan aktivitas enzim β -galaktosidase dari Enterobacter cloacae
(aktivator) adalah ion Mg2+ dan Mn2+. Hasil penelitian Chen et al (2008) menyebutkan bahwa β-galaktosidase dari Bacillus stearothermophilus dihambat secara signifikan oleh ion Fe2+, Zn2+, Cu2+, Pb2+, dan Sn2+.
Gambar 8 Aktivitas enzim β-galaktosidase pada penambahan ion logam.
Aktivitas Spesifik β-galaktosidase Hasil Pengendapan Amonium Sulfat
Pengendapan protein dengan amonium sulfat adalah metode yang sering digunakan karena memiliki daya larut tinggi di dalam air, dan relatif murah. Pemilihan amonium sulfat didasarkan pada kelarutan protein yang berinteraksi polar dengan molekul air, interaksi ionik protein dengan garam dan daya tolak
menolak protein yang bermuatan sama. Kelarutan protein (pH dan temperatur tertentu) meningkat pada kenaikan konsentrasi garam (salting in). Kenaikan kelarutan protein akan meningkatkan kekuatan ion larutan. Pada penambahan garam dengan konsentrasi tertentu kelarutan protein menurun (salting out). Molekul air yang berikatan dengan ion-ion garam semakin banyak yang menyebabkan penarikan selubung air yang mengelilingi permukaan protein sehingga mengakibatkan protein saling berinteraksi, beragregasi, dan kemudian mengendap (Harris 1989). Aktivitas spesifik adalah satu unit enzim permiligram protein (Wirahadikusumah 1989). Adapun nilai aktivitas spesifik tersebut dapat digunakan sebagai ukuran besarnya kemurnian enzim hasil isolasi (Lehninger 2004).
Hasil pengendapan amonium sulfat terhadap aktivitas spesifik β-galaktosidase dari
Enterobacter cloacae ditunjukkan pada Gambar 9, pengendapan dengan amonium sulfat fraksi 50% mampu meningkatkan aktivitas spesifik enzim β-galaktosidase sebesar 101.768 U/mg, jika dibandingkan dengan pengendapan ammonium sulfat pada fraksi lainnya. Pada prinsipnya, penambahan amonium sulfat sampai jenuh bertujuan untuk mengendapkan protein yang terdapat dalam larutan ekstrak kasar enzim. Enzim adalah protein, maka setelah pengendapan, konsentrasi β -galaktosidase dalam campuran akan meningkat. Dengan konsentrasi yang lebih besar, aktivitas enzim terhadap substrat yang sama juga akan meningkat.
Hasil penelitian Chen et al (2008) menyebutkan bahwa pengendapan dengan amonium sulfat pada fraksi 65% mampu meningkatkan aktivitas spesifik β-galaktosidase dari Bacillus stearothermophilus sebesar 80.3 U/mg. Hasil penelitian Shaikh et al (1999) menyebutkan bahwa terjadi peningkatan aktivitas spesifik β-galaktosidase dari
Rhizomucor sp pada pengendapan amonium sufat 90% sebesar 10.5 U/mg.
Hasil Tahapan Pemurnian Enzim
β-Galaktosidase
Fraksi-fraksi hasil pemekatan garam ammonium sulfat, kemudian didialisis untuk menghilangkan garam ammonium sulfat dan molekul kecil berberat molekul rendah. Pada tahap dialisis, garam yang berlebih di dalam sampel dapat dihilangkan dengan cara menempatkan sampel di dalam kantung (membran) dialisis semipermeabel yang direndam di dalam larutan buffer. Molekul yang berukuran kecil akan keluar melalui membran, sedangkan molekul yang besar akan tertahan di dalam membran dialisis (Harris 1989). Keberhasilan suatu tahap pemurnian, ditandai dengan semakin meningkatnya aktivitas spesifik enzim setelah mengalami pemurnian.
Hasil tahapan pemurnian diperlihatkan pada Tabel 1, dimana aktivitas spesifik dan tingkat kemurnian pada pengendapan amonium
sulfat 50% dan dialisis menunjukkan peningkatan sebesar 6.842 U/mg dan 7.397 U/mg dibandingkan ekstrak kasar. Hal ini menunjukkan bahwa semakin murni suatu enzim, sehingga dapat dijadikan ukuran besarnya kemurnian enzim hasil isolasi (Lehninger 2004). Hasil tersebut relatif besar dibandingkan tingkat kemurnian enzim β -galaktosidase dari Rhizomucor sp sebesar 3.18 kali (Shaikh et al.1999).
Rendemen (%) merupakan hasil pembagian total aktivitas tahapan purifikasi dengan total aktivitas ekstrak kasar dikalikan 100%, pada pengendapan amonium sulfat 50% dan dialisis menunjukkan penurunan sebesar 87.21% dan 68.42% dibandingkan ekstrak kasar. Hal ini dikarenakan adanya protein yang hilang pada tiap tahapan pemurnian, dimana senyawa-senyawa pengotor dan protein-protein lain sudah terpisahkan (Harris 1989).
Tabel 1 Tahapan pemurnian enzim β-galaktosidase.
Tahap Volume enzim (ml) total protein (mg) Total Aktivitas (U) Aktivitas spesifik
(U/mg) Kemurnian
Rendemen (%) Ekstrak kasar 30 374.329 789.189 2.108 1.000 100.00 ammonium sulfat 50% 1 100.592 688.288 6.842 3.246 87.21
Dialisis 1.8 73.000 540.000 7.397 3.509 68.42
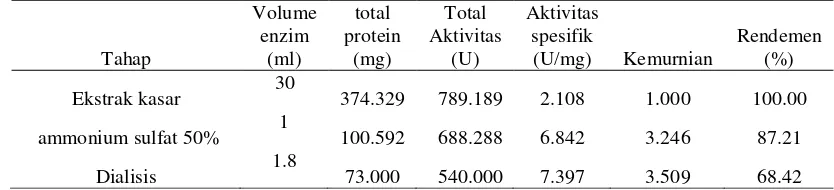
Nilai KM dan Vmaks Enzim β-galaktosidase
Penentuan nilai KM dan Vmaks berguna untuk
menganalisis afinitas enzim dengan substrat spesifiknya, menentukan kecepatan reaksi enzim pada suatu tertentu. Persamaan garis pada kurva Lineweaver-Burk ekstrak kasar dan dialisis dibuat dengan menurunkan persamaan Michealis-Menten yang diperoleh dari hasil penentuan kinetika enzim (Gambar 10). Data pada Lampiran 17 dan 18.
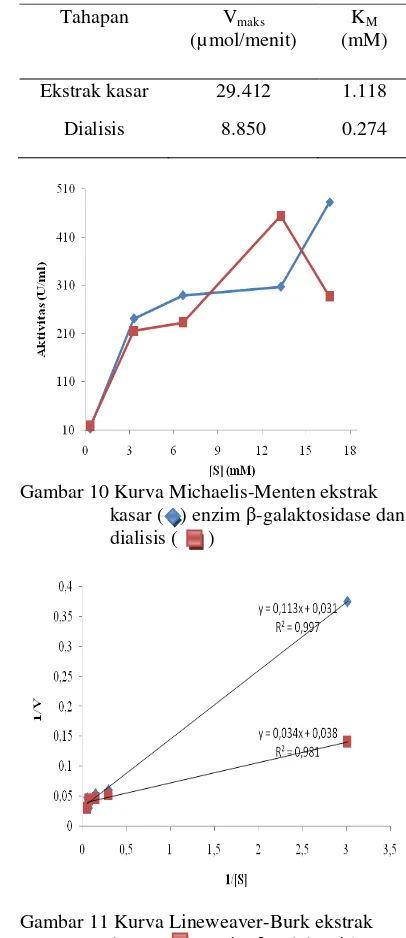
Penentuan KM dan Vmaks secara lebih tepat
dan mudah dilakukan pemetaan data dengan memanfaatkan transformasi aljabar persamaan Lineweaver-Burk (Gambar 11). Persamaan Lineweaver-Burk untuk ekstrak kasar enzim β -galaktosidase adalah y = 0.034x + 0.038 dengan nilai r2 sebesar 0.981 sehingga Vmaks aktivitas β
-galaktosidase sebesar 29.412 mol/menit, dan nilai KM sebesar 1.118 mM (Tabel 2). Pada
dialisis, peningkatan konsentrasi substrat juga meningkatkan kecepatan reaksi. Persamaan Lineweaver-Burk untuk dialisis adalah y = 0.113x + 0.031 dengan nilai r2 sebesar 0.997 sehingga kecepatan maksimum aktivitas β
-galaktosidase sebesar 8.850 µ mol/menit dan nilai KM sebesar 0.274 mM. Semakin rendah
nilai KM maka semakin kuat ikatan antara
enzim dan substrat. Dengan mengetahui nilai KM dan Vmaks maka kecepatan reaksi suatu
enzim pada setiap konsentrasi dapat dihitung. Selain itu, dengan mengetahui nilai KM dapat
mengetahui enzim tersebut berikatan kuat dengan substrat atau ikatannya lemah, yang berarti dapat diketahui kesesuaian enzim dengan substrat yang diberikan (Winarno 1999). Berdasarkan nilai diatas KM enzim β
-galaktosidase pada dialisis lebih kecil dibandingkan KM pada ektrak kasar, sehingga β-galaktosidase dialisis lebih kuat berikatan dengan substrat membentuk kompleks enzim-substra jika dibandingkan pada ekstrak kasar.
Hasil penelitian Yuningtias (2008) menyebutkan bahwa nilai Vmaks dan KM β
-galaktosidase dari isolat bakteri asam laktat masing-masing adalah 0.212 µ mol/menit dan 0.326 mM. Hasil penelitian Chen et al (2008) menyebutkan bahwa nilai Vmaks dan KM β
-galaktosidase dari Bacillus stearothermophilus
menyatakan bahwa β-galaktosidase dari Lactobacillus bulgaricus mempunyai parameter kinetik Vmaks 0.385 µmol/menit dan KM 1.075
mM.
Tabel 2 Nilai Vmaks dan KM β-galaktosidase
pada ekstrak kasar dan dialisis. Tahapan Vmaks
(µ mol/menit)
KM
(mM) Ekstrak kasar 29.412 1.118 Dialisis 8.850 0.274
Gambar 10 Kurva Michaelis-Menten ekstrak kasar ( ) enzim β-galaktosidase dan dialisis ( )
Gambar 11 Kurva Lineweaver-Burk ekstrak kasar ( ) enzim β-galaktosidase dan dialisis ( ).
SIMPULAN DAN SARAN
Simpulan
Enzim β-galaktosidase dari bakteri
Enterobacter cloacae mempunyai waktu produksi optimum pada 18 jam. Kondisi optimum enzim β-galaktosidase dari bakteri
Enterobacter cloacae pada suhu 35°C, pH 7. Aktivitas spesifik enzim β-galaktosidase pada ekstrak kasar, presipitasi 50%, dan dialisis masing-masing sebesar 2.108 U/mg, 6.842 U/mg, dan 7.397 U/mg. Kation divalen Mn2+ dan Mg2+ berperan sebagai aktivator enzim β -galaktosidase. Ion Hg+ dan Cu2+ berperan sebagai inhibitor enzim β-galaktosidase. Enzim
β-galaktosidase dari Enterobacter cloace pada ekstrak kasar mempunyai parameter kinetik Vmaks sebesar 29.412 µmol/menit dan KM
sebesar 1.118 mM. Enzim β-galaktosidase dari
Enterobacter cloacae pada dialisis pada parameter kinetik Vmaks sebesar 8.850
µ mol/menit dan KM sebesar 0.274 mM.
Saran
Bakteri Enterobacter cloacae perlu dilakukan pemurnian enzim selanjutnya misalnya dengan kromatografi filtrasi gel dan elektroforesis. Selain itu, perlu dilakukan amobilisasi enzim β-galaktosidase dari
Enterobacter cloacae agar enzim dapat digunakan berulang-ulang dan mereduksi biaya. Perlu juga dilakukan penelitian lanjut mengenai aplikasi β-galaktosidase terhadap berbagai produk pangan yang mengandung laktosa, misalnya produk susu.
DAFTAR PUSTAKA
Belitz HD, Grosch W. 2009. Food Chemistry. Germany: Springer Verlag.
Bergmaier D, Champagne CP, Lacroix C. 2005. Growth and Exopolysaccharide Production During Free and Immobilized Cell Chemostat Culture of Lactobacillus rhamnosus RW-9595M. J Appl Microbiol
98:272-284.
Boyer R. 2000. Modern Experimental Biochemistry. San Fransisco: Adison Wesley Longman Inc.
Boyer R. 2002. Concepts in Biochemistry. United States: Brook Cole.
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 72:248-254.
Buchanan RE, Gibbons. 2006. Bergey’s Manual of Determinative Bacteriology. Baltimore: Woverly.
menyatakan bahwa β-galaktosidase dari Lactobacillus bulgaricus mempunyai parameter kinetik Vmaks 0.385 µmol/menit dan KM 1.075
mM.
Tabel 2 Nilai Vmaks dan KM β-galaktosidase
pada ekstrak kasar dan dialisis. Tahapan Vmaks
(µ mol/menit)
KM
(mM) Ekstrak kasar 29.412 1.118 Dialisis 8.850 0.274
Gambar 10 Kurva Michaelis-Menten ekstrak kasar ( ) enzim β-galaktosidase dan dialisis ( )
Gambar 11 Kurva Lineweaver-Burk ekstrak kasar ( ) enzim β-galaktosidase dan dialisis ( ).
SIMPULAN DAN SARAN
Simpulan
Enzim β-galaktosidase dari bakteri
Enterobacter cloacae mempunyai waktu produksi optimum pada 18 jam. Kondisi optimum enzim β-galaktosidase dari bakteri
Enterobacter cloacae pada suhu 35°C, pH 7. Aktivitas spesifik enzim β-galaktosidase pada ekstrak kasar, presipitasi 50%, dan dialisis masing-masing sebesar 2.108 U/mg, 6.842 U/mg, dan 7.397 U/mg. Kation divalen Mn2+ dan Mg2+ berperan sebagai aktivator enzim β -galaktosidase. Ion Hg+ dan Cu2+ berperan sebagai inhibitor enzim β-galaktosidase. Enzim
β-galaktosidase dari Enterobacter cloace pada ekstrak kasar mempunyai parameter kinetik Vmaks sebesar 29.412 µmol/menit dan KM
sebesar 1.118 mM. Enzim β-galaktosidase dari
Enterobacter cloacae pada dialisis pada parameter kinetik Vmaks sebesar 8.850
µ mol/menit dan KM sebesar 0.274 mM.
Saran
Bakteri Enterobacter cloacae perlu dilakukan pemurnian enzim selanjutnya misalnya dengan kromatografi filtrasi gel dan elektroforesis. Selain itu, perlu dilakukan amobilisasi enzim β-galaktosidase dari
Enterobacter cloacae agar enzim dapat digunakan berulang-ulang dan mereduksi biaya. Perlu juga dilakukan penelitian lanjut mengenai aplikasi β-galaktosidase terhadap berbagai produk pangan yang mengandung laktosa, misalnya produk susu.
DAFTAR PUSTAKA
Belitz HD, Grosch W. 2009. Food Chemistry. Germany: Springer Verlag.
Bergmaier D, Champagne CP, Lacroix C. 2005. Growth and Exopolysaccharide Production During Free and Immobilized Cell Chemostat Culture of Lactobacillus rhamnosus RW-9595M. J Appl Microbiol
98:272-284.
Boyer R. 2000. Modern Experimental Biochemistry. San Fransisco: Adison Wesley Longman Inc.
Boyer R. 2002. Concepts in Biochemistry. United States: Brook Cole.
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 72:248-254.
Buchanan RE, Gibbons. 2006. Bergey’s Manual of Determinative Bacteriology. Baltimore: Woverly.
KARAKTERISASI DAN PENENTUAN PARAMETER
KINETIK ENZIM
β
-GALAKTOSIDASE DARI
Enterobacter cloacae
RESTI SITI MUTHMAINAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
menyatakan bahwa β-galaktosidase dari Lactobacillus bulgaricus mempunyai parameter kinetik Vmaks 0.385 µmol/menit dan KM 1.075
mM.
Tabel 2 Nilai Vmaks dan KM β-galaktosidase
pada ekstrak kasar dan dialisis. Tahapan Vmaks
(µ mol/menit)
KM
(mM) Ekstrak kasar 29.412 1.118 Dialisis 8.850 0.274
Gambar 10 Kurva Michaelis-Menten ekstrak kasar ( ) enzim β-galaktosidase dan dialisis ( )
Gambar 11 Kurva Lineweaver-Burk ekstrak kasar ( ) enzim β-galaktosidase dan dialisis ( ).
SIMPULAN DAN SARAN
Simpulan
Enzim β-galaktosidase dari bakteri
Enterobacter cloacae mempunyai waktu produksi optimum pada 18 jam. Kondisi optimum enzim β-galaktosidase dari bakteri
Enterobacter cloacae pada suhu 35°C, pH 7. Aktivitas spesifik enzim β-galaktosidase pada ekstrak kasar, presipitasi 50%, dan dialisis masing-masing sebesar 2.108 U/mg, 6.842 U/mg, dan 7.397 U/mg. Kation divalen Mn2+ dan Mg2+ berperan sebagai aktivator enzim β -galaktosidase. Ion Hg+ dan Cu2+ berperan sebagai inhibitor enzim β-galaktosidase. Enzim
β-galaktosidase dari Enterobacter cloace pada ekstrak kasar mempunyai parameter kinetik Vmaks sebesar 29.412 µmol/menit dan KM
sebesar 1.118 mM. Enzim β-galaktosidase dari
Enterobacter cloacae pada dialisis pada parameter kinetik Vmaks sebesar 8.850
µ mol/menit dan KM sebesar 0.274 mM.
Saran
Bakteri Enterobacter cloacae perlu dilakukan pemurnian enzim selanjutnya misalnya dengan kromatografi filtrasi gel dan elektroforesis. Selain itu, perlu dilakukan amobilisasi enzim β-galaktosidase dari
Enterobacter cloacae agar enzim dapat digunakan berulang-ulang dan mereduksi biaya. Perlu juga dilakukan penelitian lanjut mengenai aplikasi β-galaktosidase terhadap berbagai produk pangan yang mengandung laktosa, misalnya produk susu.
DAFTAR PUSTAKA
Belitz HD, Grosch W. 2009. Food Chemistry. Germany: Springer Verlag.
Bergmaier D, Champagne CP, Lacroix C. 2005. Growth and Exopolysaccharide Production During Free and Immobilized Cell Chemostat Culture of Lactobacillus rhamnosus RW-9595M. J Appl Microbiol
98:272-284.
Boyer R. 2000. Modern Experimental Biochemistry. San Fransisco: Adison Wesley Longman Inc.
Boyer R. 2002. Concepts in Biochemistry. United States: Brook Cole.
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 72:248-254.
Buchanan RE, Gibbons. 2006. Bergey’s Manual of Determinative Bacteriology. Baltimore: Woverly.
Adiono, penerjemah. Jakarta : UI Press. Terjemahan dari: Food Science.
Campbell et al. 2005. The molecular basis of lactose intolerance. Science Progress Vol. 88: 157-202.
Chakraborti S, Sani RK, Banerjee UC, Sobti RC. 2000. Purification and characterization of a novel β-galactosidase from Bacillus sp. MTCC-3088. J Industrial Microbiol and Biotecnol 24:58-63.
Chandra A.B. 2010. Karakterisasi dan Kinetka Enzimatik β-galaktosidase Isolat Bakteri AV-1 pada Susu Pasteurisasi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam.
Chaplin M. 2004. The use of lactases in dairy industry. [terhubung berkala].http://www. lsbu.ac.uk/biology/enztech/lactase.html. [1 Maret 2008].
Chen W, H. Zhang, J. Ge, X. Ding. 2002a. High-level expression of thermostable galactosidase gene in Escherichia coli.
Biotechnol 12:8–11.
Chen W, H. Zhang, X. Ding. 2002b. Study on properties of thermostable β-galactosidase and hydrolysis of lactose in milk. China Dairy Ind 30:15–18.
Chen W, Chen H, Xia Y, Zhao J, Tian F, Zhang H. 2008. Production, purification, and characterization of a potential thermostable
β-galactosidase for milk lactose hydrolysis from Basillus stearothermophilus. J Dairy Sci 91:1751-1758.
Crueger W, Crueger A. 1982. Biotechnology: A Textbook Of Industrial Microbiology. Wiesbaden: Science Tech Inc.
Dixon M, Webb EC. 1978. Enzymes. New Yok: Academica Press.
Euber JR, Brunner JR. 1979. Determination of lactose in milk products by high performance liquid chromatography. J Dairy Sci 62: 685-690.
Gekas V, Lonez-Leiva M. 1985. Hydrolysis of lactose. Literature review Process Biochem 20:12
Gonzales Siso M.I. 1996. The biotechnological utilization of cheese whey. A review Bioros Technol 57: 1-11.
Hames B.D, Hooper N.M. 2000.
Biochemistry. The Instant Notes. Ed.ke-2. Hongkong:Springer-Verlag.
Harris E.L.V. dan Angal, S. 1989. Protein Purification Methods. New York: Oxford University Pr.
Hsu C.A, Yu R.C, Chou C.C. 2005. Purifiaction and characterization of a sodium –stimulated β-galactosidase from
Bifidobacterium longum CCRC 15708.
World J Microb Biotechnol 22:355-361. Huang DQ, Prevost H, Divies C. 1993.
Principal characteristics of β-galactosidase from Leuconostoc spp. J Int Dairy 5:29-43.
Huber R.E et al. 1984. Binding and reactivity at the glucose site of galactosyl-β -galactosidase. Arch Biochemistry and Biophysics 234: 151-160.
Hung M.N, Lee B.H. 2002. Purification and characterization of a recombinant β -galaktosidase with transgalactosylation activity from Bifidobacterium infantis
HL96. J Appl Microbiol Biotechnol
58:439-445.
Jacobson R.H et al. 1994. There dimensional structure of β-galactosidase from
Escherichia coli. Nature 369: 761-766. Jay JM. 2000. Modern Food Microbiology.
Maryland: Aspen Publishers Inc.
Koolman J, Rohm K. (2000). Atlas Berwarna & Teks Biokimia. Terjemahan Septelia. Jakarta: Hipokrates.
Kwak SH, Jeon IJ. 1985. Effect of various conditions on the formation of oligosaccharides in milk treated with β -galactosidase. J Dairy Sci 69: 2785-2790. Liu LL, Xiao M, Li ZY, Li YM, Wang FS.
2009. A novel transglycosylating β -galactosidase from Enterobacter cloacae
B5. Process Biochemistry 44: 232-236. Lehninger AL. 2004. Principles of
Biochemistry 4rd Edition. Amhrest: Elsevier Science.
Mahoney R.R. 2004.Galactosyl-oligosaccharide formation during lactose hydrolysis: a review. Food Chem 63:147-154.
Mangunwidjaja D, Suryani A.1994.Teknologi Bioproses. Jakarta: Penebar Swadaya. Marsh MN, Riley SA. 1998. Digestion and
absorption of nutrients and vitamins.
Marshall VME, Tamime AY. 1997. Physiology and biochemistry of fermented milks. Di dalam: Microbiology and Biochemistry of Cheese and Fermented Milk. New York: Chapman & Hall.
Marteau et al. 1990. Effect of the microbial lactase (EC 3.2.1.23) activity in yoghurt on the intestinal absorption of lactose: an in vivo study in lactase-deficient humans.
British Journal of Nutrition 64: 71-79.