KAJIAN PENGHAMBATAN EFEK TOKSIK KARMOISIN DAN
RHODAMIN TERHADAP PROLIFERASI SEL LIMFOSIT TIKUS OLEH
EKSTRAK DAUN JELATANG (
Urtica dioica
L
.
)
SKRIPSI
RIJALI ARONI
F24063451
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
INHIBITION OF CARMOISINE AND RHODAMINE TOXIC EFFECTS ON
RAT’S SPLEEN LYMPHOCYTES PROLIFERATION ACTIVITY BY
Urtica
dioica
L. LEAF EXTRACT
Rijali Aroni1, Fransisca R. Zakaria1 1
Department of Food Science and Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Campus, PO BOX 220, Bogor, West Java, Indonesia
ABSTRACT
Urtica dioica L. has long been known as a herbal remedy and nutritious addition to the diet. It has been consumed for a long time as medicinal plants in many parts of the world. This study aimed to observe the effect of U. dioica L. leaf extracts in enhancing proliferation of rat’s spleen lymphocytes. Furthermore, this study also aimed to observe the capability of U. dioica L. leaf extracts in defending lymphocyte against toxic effects of carmoisine and rhodamine B . 30 Sprague Dawley rats were split into three groups, which are control, 0.1 g/kg BW/day dose, 1 g/kg BW/day dose group. The control group was given drinking water while the others were given U. dioica L. leaf crude extracts at their dose respectively. After 90 days of treatment, lymphocyte cells from the rat’s spleen then isolated and tested using MTT proliferation assay with addition of mitogen, and various concentration of carmoisine and rhodamine B. Stimulation index of spontaneous proliferation in 0.1 g/kg BW/day dose group was higher than the other groups. Mitogen-induced proliferation shows an increased proliferation activity in control and 1 g/kg BW/day dose group, while in 0.1 g/kg BW/day dose group a decreased proliferation activity was observed. U. dioica L. leaf crude extracts given at 1 g/kg BW/day shows that the rat’s lymphocyte proliferation activity at the presence of carmoisine was higher than control and 0.1 g/kg BW/day dose group. Likewise, at the presence of rhodamine B, the rat’s lymphocyte proliferation activity of 1 g/kg BW/day dose group was higher than control and 0.1 g/kg BW/day dose group. It is concluded that U. dioica L. leaf crude extract given at 1 g/kg BW/day could inhibit carmoisine and rhodamine B toxic effect on rat’s spleen lymphocytes proliferation activity.
RIJALI ARONI. F24063451. Kajian penghambatan efek toksik karmoisin dan rhodamin terhadap proliferasi sel limfosit tikus oleh ekstrak daun jelatang (Urtica dioica L.). Di bawah bimbingan Prof. Dr. Ir. Fransisca R. Zakaria, MSc. 2011
RINGKASAN
Urtica dioica L. memiliki sejarah panjang sebagai obat herbal dan bahan pangan yang bergizi di berbagai belahan dunia. Penelitian-penelitian terdahulu menyebutkan bahwa tanaman jelatang mengandung beberapa komponen bioaktif yang berfungsi positif terhadap kesehatan, diantaranya adalah komponen-komponen yang memiliki sifat imunomodulator. Namun demikian, pengaruh konsumsi daun tanaman jelatang terhadap sistem imun tubuh belum diketahui secara pasti. Oleh karena itu, perlu dilakukan suatu kajian tentang pengaruh konsumsi tanaman jelatang terhadap respon imun tubuh. Dan lebih jauh lagi, perlu dilakukan pula kajian tentang pengaruh konsumsi tanaman jelatang dalam menangkal efek-efek negatif dari paparan senyawa-senyawa kimia berbahaya.
Penelitian ini dilakukan untuk mempelajari pengaruh pemberian ekstrak daun jelatang (Urtica dioica L.) sebanyak 0.1 g/kg BB/hari dan 1 g/kg BB/hari dalam menstimulasi proliferasi limfosit dan menghambat efek toksik yang ditimbulkan oleh senyawa karmoisin dan rhodamin B terhadap aktivitas proliferasi sel limfosit limfa tikus. Penelitian diawali dengan pembuatan ekstrak jelatang dari bubuk daun jelatang kering dengan dosis 0.1 g/kg BB/hari dan 1 g/kg BB/hari. Pengujian dilakukan dengan menggunakan tikus percobaan jenis Sprague Dawley yang berumur ±2 bulan selama 90 hari dengan 3 hari masa adaptasi. Tikus percobaan dibagi menjadi tiga kelompok. Kelompok pertama merupakan kontrol negatif, kelompok kedua diberikan ekstrak daun jelatang sebanyak 0.1 g/kg BB/hari, dan kelompok ketiga diberikan ekstrak daun jelatang sebanyak 1 g/kg BB/hari. Ekstrak daun jelatang diberikan melalui proses pencekokan. Tikus kelompok kontrol negatif juga dicekok, namun dengan air minum dalam kemasan (AMDK), sehingga mengalami stress yang sama.
Penimbangan berat badan untuk memantau pertumbuhan tikus percobaan dilakukan dua hari sekali. Kenaikan berat badan tertinggi terjadi pada kelompok kontrol sebesar 136.60±40.20 g. Hal ini sesuai dengan konsumsi pakan/hari kelompok kontrol yang lebih tinggi dibanding kelompok lain. Hasil analisis statistik menunjukkan bahwa konsumsi pakan/hari kelompok tikus kontrol berbeda nyata pada taraf kepercayaan 95% dengan dua kelompok lain. Namun kenaikan berat badan tidak berbeda nyata pada taraf kepercayaan 95% pada masing-masing kelompok tikus. Grafik pertumbuhan masing-masing kelompok tikus juga cenderung meningkat. Hal ini mengindikasikan bahwa selama masa perlakuan, semua kelompok tikus berada dalam keadaan pertumbuhan yang baik. Selama periode pemeliharaan tikus percobaan ditemukan dua kasus kematian (mortalitas). Kedua kasus ini terjadi pada kelompok tikus dosis 0.1 g/kg BB/hari dan dosis 1 g/kg BB/hari. Kedua kasus kematian ini diperkirakan terjadi karena penyimpangan irama jantung (arrythmia) Mengingat hasil pemeriksaan fisik menunjukkan lebih banyak tikus yang tidak menunjukkan gejala toksisitas, maka diperkirakan tikus yang mati selama pengujian lebih sensitif dibandingkan tikus-tikus lainnya.
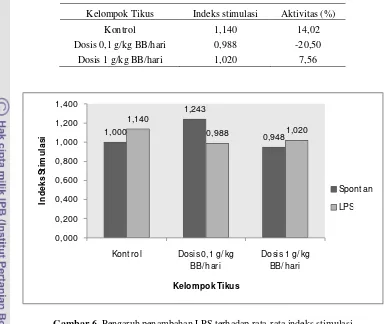
disesuaikan dengan perlakuan yang akan diberikan. Kemudian absorbansi masing-masing sumur diukur dengan menggunakan microplate reader (ELISA Reader) pada panjang gelombang 570 nm. Hasil pengujian proliferasi limfosit spontan menunjukkan bahwa indeks stimulasi limfosit kelompok tikus dosis 0.1 g/kg BB/hari memiliki nilai yang paling tinggi yaitu 1.243. Adapun kelompok tikus dengan pemberian daun jelatang dosis 1 g/kg BB/hari memiliki nilai IS yang lebih rendah dari kontrol yaitu sebesar 0.948.
Konsentrasi karmoisin yang diujikan adalah 48 µg/ml, 96 µg/ml dan 144 µg/ml kultur. Secara umum terlihat bahwa adanya paparan karmoisin menyebabkan penurunan aktivitas proliferasi secara signifikan pada kelompok tikus kontrol. Sementara itu, pada kelompok tikus dosis 0.1 g/kg BB/hari, secara umum terjadi penurunan aktivitas proliferasi limfosit yang signifikan akibat adanya paparan karmoisin. Dengan demikian, pemberian ekstrak daun jelatang pada dosis 0.1 g/kg BB/hari tidak dapat menghambat efek toksik yang ditimbulkan karmoisin terhadap proliferasi limfosit tikus. Adapun pada kelompok tikus dosis 1 g/kg BB/hari, aktivitas proliferasi meningkat secara signifikan pada ketiga konsentrasi paparan karmoisin yang diujikan. Pemberian ekstrak daun jelatang pada dosis ini tidak hanya mampu menghambat efek toksik dari paparan karmoisin namun juga masih mampu menstimulasi proliferasi limfosit.
ii
KAJIAN PENGHAMBATAN EFEK TOKSIK KARMOISIN DAN RHODAMIN
TERHADAP PROLIFERASI SEL LIMFOSIT TIKUS OLEH EKSTRAK DAUN
JELATANG (Urtica dioica L.)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan,
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
RIJALI ARONI
F24063451
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
iii
Judul Skripsi : Kajian penghambatan efek toksik karmoisin dan rhodamin terhadap proliferasi
sel limfosit tikus oleh ekstrak daun jelatang (Urtica dioica L.)
Nama : Rijali Aroni
NIM : F24063451
Menyetujui,
Pembimbing
(Prof. Dr. Ir. Fransisca R. Zakaria, MSc) NIP 19490614.198503.2.001
Mengetahui,
Plt. Ketua Departemen Ilmu dan Teknologi Pangan
(Dr. Ir. Nurheni Sri Palupi, MSi) NIP 19610802.198703.2.002
iv PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Saya menyatakan dengan sebenar – benarnya bahwa skripsi dengan judul Kajian penghambatan efek toksik karmoisin dan rhodamin terhadap proliferasi sel limfosit tikus oleh ekstrak daun jelatang (Urtica dioica L.) adalah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi
manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang
tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar
Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2011
Yang membuat pernyataan
v © Hak cipta milik Rijali Aroni, tahun 2011
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari
vi
BIODATA PENULIS
vii
KATA PENGANTAR
Penulis mengucapkan syukur kehadirat Allah SWT atas rahmat dan karunia-Nya
sehingga penulis dapat menyelesaikan penelitian yang berjudul “Kajian Penghambatan Efek Toksik Karmoisin dan Rhodamin terhadap Proliferasi Sel Limfosit Tikus Oleh Ekstrak Daun Jelatang (Urtica dioica L.)”.
Pada kesempatan ini penulis ingin menyampaikan rasa terima kasih dan penghargaan
yang sebesar-besarnya kepada:
1. Prof. Dr. Ir. Fransisca R. Zakaria, MSc selaku dosen pembimbing atas segala bimbingan,
kesabaran dan nasihat yang diberikan kepada penulis selama menjadi mahasiswa Departemen
Ilmu dan Teknologi Pangan
2. Fytagoras BV Plant Science, Belanda yang membiayai sebagian dana penelitian
3. Seluruh dosen Departemen Ilmu dan Teknologi Pangan atas segala ilmu yang sangat
bermanfaat
4. Keluarga tercinta, Ibu, Bapak, Kak Insa, Kak Yoesron, Oyik, dan Rizqy atas kesabaran dan
kasih sayangnya
5. Teman-teman satu bimbingan, Anto, Husna, dan Erin atas bantuan dan semangatnya.
6. Teman-teman dan kakak-kakak yang tergabung dalam tim toksisitas, Mas Anas, Mas Gito,
Anissa, Keni, Dinda, dan Zatil, atas arahan dan kerjasamanya
7. Teman-teman seperjuangan di Friends 24 café, Tito, Kak Fahmi, Kak Riza, Zul, Rina, Widi,
Widya, Risma, Kak Dila, dan Kak Tiwi atas pengalaman yang sangat berharga.
8. Wahyu Anggarini atas waktu, kesabaran, semangat dan keceriaan yang dibagi bersama
penulis.
9. Seluruh teman-teman seperjuangan di ITP 43, terutama Roni, Lingga, Deni, Ade, Dewi,
Hasti, Abe, dan Bintang atas keceriaan mengisi hari-hari penulis.
10. Teman-teman satu kontrakan, Rendi, Ahmad, Izhul, Akbar, Andi, Adun, Awet, Budi, dan
Arif atas kerjasama dan bantuannya.
11. Para laboran dan staf, terutama Pak Adi, Pak Wahid, Mas Aldi, dan Bu Sri
12. Seluruh staf UPT
Akhirnya penulis berharap semoga tulisan ini bermanfaat dan memberikan kontribusi yang nyata terhadap perkembangan ilmu pengetahuan di bidang teknologi pangan.
Bogor, Juli 2011
viii
DAFTAR ISI
Halaman
KATA PENGANTAR ………..……….... vii
DAFTAR TABEL ……….………... ix
DAFTAR GAMBAR ……… x
DAFTAR LAMPIRAN ……… xi
I. PENDAHULUAN ……… 1
1.1. Latar Belakang ………...………. 1
1.2. Tujuan ……… 2
II. TINJAUAN PUSTAKA ………...………. 3
2.1. Toksisitas Pewarna Sintetis………...……….………….……... 3
2.1.1. Karmoisin ………….………….………….………….………….………... 3
2.1.2. Rhodamin B …………...……….………….………….………….…… 4
2.2. Jelatang (Urtica dioica L.)………... 6
2.3. Limfosit ………..………. 7
2.4. Proliferasi Sel Limfosit ………... 8
2.5. Uji Proliferasi Sel Limfosit ……...………... 9
2.5.1. 2.5.2. Kultur Sel ………...………. Uji MTT ………...……… 9 10 III. BAHAN DAN METODE ……….………. 12
3.1. Bahan dan Alat ………..……….………. 12
3.2. Metode Penelitian ………...………. 13
IV. HASIL DAN PEMBAHASAN ………....………. 17
4.1. Pemeliharaan dan Pertumbuhan Tikus ... 17
4.2. Proliferasi Sel Limfosit Limfa Tikus ……… 19
4.2.1. Proliferasi Limfosit Spontan ………... 21
4.2.2. Proliferasi Limfosit dengan Penambahan LPS ...……… 22
4.2.3. Proliferasi Limfosit dengan Penambahan Senyawa Toksik……… 24
V. SIMPULAN DAN SARAN ………...………. 31
5.1. Simpulan ………...………. 31
5.2. Saran ………..………. 31
DAFTAR PUSTAKA ………...………...
ix
DAFTAR TABEL
Halaman
Tabel 1. Bahan pewarna sintetis yang dilarang penggunaannya pada makanan di
Indonesia………...………....………....………....……… 5
Tabel 2. Komposisi ransum standar AIN 1976...……… ……… 12
Tabel 3. Komposisi campuran vitamin... ……….. 12
Tabel 4. Komposisi campuran mineral...………. 13
Tabel 5.
Tabel 6.
Tabel 7.
Tabel 8.
Tabel 9.
Tabel 10.
Bahan- bahan yang ditanam ke dalam kultur sel...………
Rata-rata dan standar deviasi berat badan, kenaikan berat badan, dan konsumsi
pakan padasetiap kelompok tikus………...……
Rata-rata indeks stimulasi pada setiap perlakuan………..
Rata-rata indeks stimulasi dan aktivitas proliferasi limfosit dengan penambahan
LPS………..
Nilai aktivitas proliferasi limfosit dengan perlakuan karmoisin (%)………….……
Nilai aktivitas proliferasi limfosit dengan perlakuan rhodamin B (%)………..…… 15
18
20
23
25
x
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur kimia karmoisin...…………... 3
Gambar 2. Struktur kimia rhodamin B... 4
Gambar 3. Jelatang (Urtica dioica L.)... 6 Gambar 4. Pertumbuhan tikus kontrol dan tikus yang diberi ekstrak daun jelatang dosis
0,1 g/kg BB/hari dan dosis 1 g/kg BB/hari ... 18 Gambar 5. Rata-rata indeks stimulasi proliferasi spontan pada setiap kelompok tikus 21
Gambar 6. Pengaruh penambahan LPS terhadap rata-rata indeks stimulasi ... 23
Gambar 7. Pengaruh penambahan karmoisin 48 μg/ml terhadap aktivitas proliferasi limfosit... 25 Gambar 8. Pengaruh penambahan karmoisin 96 μg/ml terhadap aktivitas proliferasi
limfosit ... 26 Gambar 9. Pengaruh penambahan karmoisin 144 μg/ml terhadap aktivitas proliferasi
limfosit... 26 Gambar 10. Pengaruh penambahan rhodamin B 12 μg/ml terhadap aktivitas proliferasi
limfosit... 28 Gambar 11. Pengaruh penambahan rhodamin B 24 μg/ml terhadap aktivitas proliferasi
limfosit... 29 Gambar 12. Pengaruh penambahan rhodamin 36 μg/ml terhadap aktivitas proliferasi
xi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Perhitungan konversi dosis manusia ke tikus... 38
Lampiran 2. Contoh perhitungan volume cekok per tikus... 38
Lampiran 3. Hasil penimbangan berat badan pada setiap kelompok tikus... 39
Lampiran 4. Konsumsi pakan per hari... 44
Lampiran 5. Hasil uji homogenitas keragaman beserta uji sidik ragam terhadap berat badan tikus pada awal perlakuan... 52
Lampiran 6. Hasil uji homogenitas keragaman beserta uji sidik ragam terhadap berat badan tikus pada akhir perlakuan... 52
Lampiran 7. Hasil uji homogenitas keragaman beserta uji sidik ragam terhadap kenaikan/selisih berat badan tikus………... 53
Lampiran 8. Lampiran 9. Rata-rata absorbansi kultur sel pada tiap perlakuan... Hasil uji sidik ragam terhadap nilai indeks stimulasi spontan……..….. 53 53 Lampiran 10. Hasil uji T berpasangan terhadap nilai IS spontan dan IS dengan penambahan LPS... 54
Lampiran 11. Hasil uji T berpasangan terhadap nilai IS spontan dan IS dengan penambahan karmoisin 48 μg/ml... 54
Lampiran 12. Hasil uji T berpasangan terhadap nilai IS spontan dan IS dengan penambahan karmoisin 96 μg/ml... 55
Lampiran 13. Hasil uji T berpasangan terhadap nilai IS spontan dan IS dengan penambahan karmoisin 144 μg/ml... 55
Lampiran 14. Hasil uji T berpasangan nilai IS spontan dan IS dengan penambahan rhodamin B 12 μg/ml... 56
Lampiran 15. Hasil uji T berpasangan nilai IS spontan dan IS dengan penambahan rhodamin B 24 μg/ml... 56
I.
PENDAHULUAN
1.1.
Latar Belakang
Dewasa ini, bahan pewarna sintetis telah digunakan secara luas pada pengolahan pangan. Bahan pewarna sintetis ini diketahui memiliki efek negatif bagi tubuh, seperti efek toksik, karsinogenik, ataupun genotoksik. Oleh karena itu, penggunaan bahan-bahan pewarna sintetis ini diatur dengan ketat di seluruh dunia. Namun, penggunaan bahan pewarna yang dilarang juga masih sering ditemukan. Padahal efek negatif dari bahan pewarna yang dilarang sudah jelas dan jauh lebih berbahaya dibandingkan dengan pewarna yang telah diregulasi. Hal ini membuat kita sebagai konsumen pangan akan semakin rentan terhadap paparan senyawa-senyawa kimia berbahaya.
Seiring dengan kemajuan teknologi, ajakan-ajakan ataupun regulasi untuk mengurangi penggunaan bahan-bahan tambahan sintetis pada makanan dan obat-obatan semakin meningkat. Penemuan-penemuan terbaru menunjukkan bahwa semakin banyak bahan-bahan asing (sintetis/xenobiotik) yang masuk ke dalam tubuh, maka semakin tinggi pula resiko kesehatan yang akan muncul. Oleh karena itu, banyak orang beralih menggunakan bahan-bahan alami seperti tanaman-tanaman obat (herbal) sebagai obat ataupun bahan makanan untuk menjaga status kesehatannya.
Penggunaan berbagai jenis herbal sebagai makanan ataupun obat-obatan untuk meningkatkan status kesehatan sebagian besar merupakan warisan dari tradisi leluhur. Penggunaan tanaman-tanaman ini umumnya hanya didasarkan pada pengalaman tanpa adanya dukungan data-data ilmiah. Sehingga, informasi yang jelas dan akurat mengenai khasiat dan keamanan suatu herbal pun sulit ditemukan. Oleh karena itu, penelitian-penelitian mengenai khasiat dan keamanan herbal semakin berkembang, baik melalui tinjauan terhadap kandungan senyawa di dalamnya ataupun tinjauan penggunaan secara keseluruhan.
Urtica dioica L. atau di Indonesia dikenal dengan nama Jelatang merupakan tanaman yang banyak terdapat di sebagian besar daerah Asia dan Eropa Utara, terutama di daerah pedalaman. Di Indonesia, tanaman ini belum banyak digunakan sebagai bahan pangan dan umumnya dikenal sebagai tanaman liar yang tumbuh di daerah persawahan. Walaupun demikian, tanaman ini memiliki sejarah panjang sebagai obat herbal dan bahan pangan yang bergizi di berbagai belahan dunia. Di beberapa negara daun jelatang diolah menjadi semacam sup serta umum diolah menjadi minuman sejenis teh. Daun jelatang juga digunakan secara tradisional sebagai obat herbal untuk perawatan radang sendi (arthritis). Ekstrak tanaman jelatang juga digunakan untuk mengobati penyakit anemia, infeksi saluran urin, hay fever (allergic rhinitis), dan beberapa masalah ginjal.
2
Pada penelitian ini, studi difokuskan pada uji proliferasi sel limfosit karena sel limfosit merupakan salah satu komponen yang memiliki peranan penting dalam respon imun tubuh. Sel limfosit bertanggung jawab dalam proses identifikasi dan eliminasi mikroorganisme patogen dan zat-zat berbahaya lainnya yang masuk ke dalam tubuh. Adapun proliferasi sel limfosit merupakan proses pembelahan secara mitosis dan diferensiasi sel sebagai respon terhadap antigen atau mitogen. Proliferasi limfosit dapat mengindikasikan aktivitas respon imun spesifik yang berkaitan dengan suatu sistem imun. Parameter yang digunakan dalam pengujian aktivitas proliferasi sel limfosit adalah pengamatan indeks stimulasi (IS) dari sel limfosit yang diisolasi dari limfa tikus dan di kultur dalam media dan lingkungan steril.
1.2.
Tujuan
Penelitian ini dilakukan untuk mempelajari pengaruh pemberian ekstrak daun jelatang (Urtica dioica L.) sebanyak 0,1 g/kg BB/hari dan 1 g/kg BB/hari dalam menstimulasi proliferasi limfosit dan menghambat efek toksik yang ditimbulkan oleh senyawa karmoisin dan rhodamin B terhadap aktivitas proliferasi sel limfosit tikus Sprague Dawley.
II.
TINJAUAN PUSTAKA
2.1.
Toksisitas Pewarna Sintetis
Pewarna tambahan alami ataupun sintetis telah digunakan secara luas pada makanan, kosmetik dan obat-obatan (Hallagan et al. 1995). Walaupun demikian, menurut Thorngate III (2002) industri makanan lebih memilih pewarna sintetis dibandingkan pewarna asal hewan, tanaman ataupun mineral karena warnanya yang konsisten, kuat, dan stabil. Frazier (2009) menyebutkan bahwa pewarna sintetis umumnya berupa pewarna azo (seperti karmoisin, amaranth), yang warnanya berasal dari grup azo (R1-N=N-R2). Grup R pada pewarna azo secara normal merupakan sistem aromatik, memberikan sistem ikatan ganda terkonjugasi yang dapat menampilkan berbagai jenis warna (kuning, oranye, merah, coklat).
Toksikologi pewarna makanan sintetis kurang mendapat perhatian hingga awal dekade 1930, ketika 4-dimethylaminoazobenzene ditemukan bersifat karsinogen. Setelah itu, pewarna-pewarna lain dibuktikan bersifat toksik dan dilarang untuk ditambahkan pada makanan (Janssen 1997). Walaupun demikian, pewarna sintetis yang dilarang masih sering digunakan dan ditemukan keberadaannya dalam makanan. Menurut EFSA (2005), banyak negara Uni Eropa memberikan notifikasi tentang keberadaan pewarna-pewarna illegal yang diketahui memiliki sifat karsinogenik dan genotoksik seperti Sudan I, Sudan II, Sudan III, Sudan IV, Para Red, Rhodamin B, and Orange II pada beberapa bahan makanan.
2.1.1.
Karmoisin
Karmoisin atau dikenal juga dengan azorubine merupakan pewarna azo dengan rumus kimia C20H12N2Na2O7S2 (Gambar 1). Senyawa ini memiliki berat molekul 502.44 g/mol dengan nama kimia disodium 4-hydroxy-3- (4-sulphonato-1-naphthylazo) naphthalene-1-sulphonate (EFSA 2009). Karmoisin bersifat larut air dan sedikit larut pada etanol. Senyawa ini biasanya berbentuk bubuk garam disodium dengan warna merah hingga maroon. Karmoisin umum digunakan pada makanan yang mengalami proses pemanasan setelah difermentasi (Amin et al. 2010).
Gambar 1. Struktur kimia Karmoisine (EFSA 2009)
4
bahan pangan dengan nilai Acceptable Daily Intake (ADI) sebesar 0-4 mg/kg BB/hari. Sebagian dari karmoisin yang dicerna mengalami reduksi azo dalam usus. Selain itu, karmoisin yang tidak termodifikasi dan 5 metabolit tidak dikenal juga ditemukan pada feses (EFSA 2009). Menurut Amin et al. (2010), karmoisin dapat tereduksi dalam organisme menjadi sebuah amine aromatik yang sangat sensitif.
Beberapa penelitian yang telah dilakukan menunjukkan efek negatif dari karmoisin. Studi yang dilakukan oleh Amin et al. (2010) menyimpulkan bahwa pewarna makanan seperti tartrazin dan karmoisin dapat memberikan pengaruh negatif dan mengubah beberapa penanda biokimia pada organ-organ penting seperti hati dan ginjal, baik pada dosis tinggi ataupun rendah. Lebih jauh lagi, tartrazin dan karmoisin juga memberikan efek yang lebih beresiko pada dosis yang lebih tinggi karena dapat menginduksi stress oksidatif melalui pembentukan radikal bebas. Sharma et al. (2006) menemukan bahwa dua dosis Tomato Red (campuran karmoisin dan ponceau 4R) menunjukkan peningkatan yang signifikan pada aktivitas alkaline phospatase (ALP). Pada keadaan normal, ALP yang berada di dalam hati akan diekskresikan ke dalam empedu. Jika terjadi kerusakan atau obstruksi pada hati dan saluran empedu, seperti kolestasis, maka kadar ALP darah akan meningkat. Selain itu, Sharma et al. (2005) juga mengamati adanya peningkatan yang signifikan pada serum transaminase, total protein serum dan globulin tikus yang dietnya ditambahkan pewarna cokelat A dan B (Sunset Yellow, tartrazin, karmoisin dan Brilliant Blue pada berbagai konsentrasi). Peningkatan spesifik pada fraksi globulin akan menuju kepada peningkatan sintesis immunoglobulin, mekanisme pertahanan yang bertujuan untuk melindungi tubuh dari efek toksik pewarna sintesis tersebut.
2.1.2.
Rhodamin B
Rhodamin B (C28H31ClN2O3) adalah zat warna sintetis berbentuk serbuk kristal, berwarna hijau atau ungu kemerahan, tidak berbau dan berwarna merah terang berfluorensi dalam larutan. Rhodamin B memiliki nama kimia [9-(2-carboxyphenyl)-6-diethylamino-3-xanthenylidene]-diethylammoniumchloride dengan berat molekul 479.02 g/mol. Rhodamin B semula digunakan untuk kegiatan histologi dan sekarang berkembang untuk berbagai keperluan seperti sebagai pewarna kertas dan tekstil. Rhodamin B juga digunakan secara luas pada aplikasi bioteknologi seperti fluorescence microscopy, flow cytometry, fluorescence correlation spectroscopy dan ELISA. Menurut Inchem (2006) nilai LD50 rhodamin B adalah 89.5 mg/kg berat badan.
5
Rhodamin B seringkali disalahgunakan untuk pewarna pangan dan kosmetik. Sebagai contoh, rhodamin B ditemukan pada makanan dan minuman seperti kerupuk, sambal botol dan sirup di Makassar pada saat BPOM Makassar melakukan pemeriksaan sejumlah sampel makanan dan minuman ringan (Anonimus 2006). Menurut Peraturan Menteri Perdagangan RI No.4 tahun 2006, rhodamin B termasuk dalam bahan pewarna sintetis yang dilarang penggunaannya (Tabel 1).
Tabel 1. Bahan pewarna sintetis yang dilarang penggunaannya pada makanan di Indonesia
No Nama Warna
1 Merah Citrus Red
2 Merah Ponceau 3R
3 Merah Ponceau SX
4 Merah Sudan I
5 Merah Rhodamin B
6 Merah Amaran
7 Merah Ponceau 6R
8 Oranye Auramine
9 Oranye Chrycidine
10 Oranye Oil Orange SS
11 Oranye Oil Orange XO
12 Oranye Orange G
13 Oranye Orange GGN
14 Kuning Oil Yellow AB
15 Kuning Oil Yellow OB
16 Kuning Methanil Yellow
17 Kuning Butter Yellow
18 Kuning Aniline Yellow
19 Hijau Guinea Green
20 Biru Indantren Blue R
21 Violet Magenta I
22 Violet Magenta II
23 Violet Magenta III
24 Violet Violet 6B
25 Coklat Coklat FB
6
pada mencit menunjukkan terjadinya perubahan bentuk dan organisasi sel dalam jaringan hati dari normal ke patologis, yaitu perubahan sel hati menjadi nekrosis dan jaringan di sekitarnya mengalami desintegrasi atau disorganisasi. Kerusakan pada jaringan hati ditandai dengan terjadinya piknotik dan hiperkromatik dari nukleus, degenerasi lemak dan sitolisis dari sitoplasma.
2.2.
Jelatang (
Urtica dioica
L.)
Jelatang (Urtica dioica L.) merupakan spesies yang paling banyak dikenal dari 30-45 tanaman dalam genus Urtica. Tanaman yang umum disebut common nettle atau stinging nettle ini merupakan tanaman asli Eropa, Asia, bagian utara Afrika, dan Amerika Utara. Tanaman ini sering dihindari karena adanya bulu atau duri-duri halus pada daun dan batangnya. Jika menyentuh kulit, duri-duri halus ini akan mengeluarkan beberapa komponen kimia seperti acetylcholine, histamin, serotonin dan asam format yang kemungkinan menimbulkan rasa gatal.
Berikut adalah klasifikasi Urtica dioica L. Kingdom : Plantae
Subkingdom : Tracheobionta
Superdivisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Subkelas : Hamamelididae
Ordo : Urticales
Famili : Urticaceae
Genus : Urtica L.
Spesies : Urtica dioica L.
(European Medicines Agency 2007)
Jelatang berkembang biak dengan menyebarkan rhizome dan stolon hingga membentuk rumpun. Tanaman perennial (tahunan) ini mampu tumbuh hingga mencapai tinggi 1-2 meter. Daun, batang dan kelopak tanaman jelatang dipenuhi duri atau bulu-bulu halus yang dapat menimbulkan rasa gatal dan menyengat jika menyentuh kulit. Daun tanaman jelatang berbentuk lancip dan bergerigi. Tanaman ini memiliki bunga yang berwarna putih kekuningan. Tanaman jelatang mampu menghasilkan 10.000 hingga 20.000 biji pada cuaca cerah. Penampakan tanaman jelatang dapat dilihat pada Gambar 3.
7
Secara tradisional, tanaman jelatang banyak digunakan sebagai obat dan bahan makanan. Daun jelatang memiliki rasa seperti bayam dan umum dimasak menjadi sup walaupun pengolahan menjadi minuman sejenis teh juga kerap ditemui. Perendaman dalam air atau pemasakan, secara tradisional diyakini dapat menghilangkan efek gatal atau menyengat dari tanaman ini sehingga aman dikonsumsi. Menurut Allardice (1993), jelatang merupakan pangan yang sangat bergizi yang mudah dicerna dan kaya akan mineral (terutama zat besi), vitamin C dan provitamin A. Daun jelatang mengandung sekitar 14.4 mg/100 g α-tocopherol, 0.23 mg/100 g riboflavin, 13 mg/100 g Fe, 0.95 mg/100 g Zn, 873 mg/100 g Ca, dan 532 mg/100 g K (Aksu dan Kaya 2004). Guil-Guerrero et al. (2003) juga mengidentifikasi adanya kandungan karotenoid pada daun jelatang, diantaranya lutein dan isomernya serta β-karoten dan isomernya dengan kandungan vitamin A untuk setiap 100 g daun jelatang muda dan tua masing-masing 16.2 dan 36,2 µg RE. Tanaman jelatang juga dikembangbiakkan secara komersial untuk ekstraksi klorofil yang digunakan sebagai pewarna makanan dan obat-obatan. Beberapa komponen aktif telah berhasil diisolasi dari beberapa bagian tanaman jelatang; steroid, phenylpropanoid, coumarin (Chaurasia dan Wichtl 1987), terpenoid (Ganser dan Spiteller 1995), polisakarida (Wagner et al. 1989) dan lektin (Galelli and Truffa-Bachi 1993) dari akar. Karakaya dan EL (1999) mendeteksi kandungan flavonoid pada jelatang dengan apigenin sebagai komponen flavonoid utama.
Daun jelatang digunakan secara tradisional sebagai obat herbal untuk perawatan radang sendi (arthritis). Ekstrak dari tanaman ini juga sering digunakan sebagai obat alami untuk hipertensi dan diabetes (Ziyyat et al. 1997). Fragoso et al. (2008) menyebutkan penggunaan jelatang sebagai obat tradisional pada beberapa penyakit seperti penyakit kelamin dan saluran kencing yang ringan (nocturia, dysuria, penghambatan saluran ginjal, iritasi kantung kemih, dan infeksi), gangguan ginjal, alergi, diabetes, pendarahan internal (mencakup pendarahan uterine, epistaxis, dan melena), anemia, penyakit saluran pencernaan yang ringan (diare, disentri, dan keasaman lambung yang meningkat), sakit muskoluskeletal, osteoarthritis, dan alopecia.
Beberapa temuan menunjukkan bahwa tanaman jelatang memberikan efek positif terhadap sistem imun tubuh. Komponen flavonoid glikosida utama yang diisolasi dari tanaman jelatang diketahui memiliki aktivitas immunomodulator dan anti-inflamasi (Akbay et al. 2003). Ekstrak biji tanaman jelatang memiliki efek hepatoprotective pada tikus yang menderita aflatoxicosis, yang kemungkinan bekerja dengan meningkatkan sistem pertahanan antioksidatif (Yener et al. 2009). Polisakarida yang diisolasi dari ekstrak air akar tanaman jelatang mampu menstimulasi baik sel T limfosit ataupun sistem pelengkapnya secara in vitro (Wagner et al. 1989). Gulcin et al. (2004) menunjukkan bahwa tanaman jelatang memiliki aktivitas antioksidan yang sangat kuat.
2.3.
Limfosit
Limfosit merupakan bagian dari sel darah putih (leucocytes) yang tidak memiliki granula dalam sitoplasma (Kuby et al. 2007). Limfosit terdapat sebanyak 20-80% dari sel bernukleasi dalam darah dan lebih dari 99% dalam cairan limfatik (limfa). Limfosit juga terdapat dalam organ limfoid misalnya limfa, kelenjar limfa dan timus. Limfosit merupakan bagian dari sel darah putih yang bersifat agranulosit, berukuran kecil, berbentuk bulat dengan diameter 7-12 µm. Limfosit merupakan sel kunci dalam proses imun spesifik (meliputi respon imun seluler dan humoral) untuk mengenali antigen melalui reseptor antigen.
8
tiga kelompok yaitu limfosit sel B, sel T, dan sel NK (Natural Killer). Sel B dan T memiliki reseptor pada permukaan yang mampu mengenali antigen tertentu dan termasuk dalam sistem pertahanan spesifik sedangkan sel NK tidak mempunyai reseptor untuk mengenal antigen termasuk sistem pertahanan non spesifik (Kuby et al. 2007). Pada manusia normal, sel limfosit B berjumlah 5-15% dan sel limfosit T berjumlah sekitar 65-80% dari jumlah limfosit dalam tubuh. Sel B berperran dalam respon imun humoral dan sel T berperan dalam sistem imun seluler, sedangkan sel Natural Killer berperan dalam respon imun non spesifik (Harris 1991).
Sel limfosit B merupakan sel yang berasal dari sel stem dalam sumsum tulang belakang, tumbuh menjadi sel plasma yang menghasilkan antibodi dan sel memori. Reseptor sel B merupakan molekul antibodi terikat membran. Menurut Sheeler dan Bianchi (1982) limfosit B termasuk sistem pertahanan humoral yaitu tidak menggunakan sel dalam melawan antigen melainkan menghasilkan berbagai jenis antibodi. Sel B memori memiliki waktu hidup lebih lama dan terus mengekspresikan antiibodi terikat membrannya. Meskipun sel plasma hanya hidup beberapa hari, namun sel-sel ini dapat mensekreesikan antibodi dalam jumlah besar selama hidup. Diperkirakan bahwa satu sel plasma dapat mensekresikan lebih dari 2000 molekul antibodi per detik. Antibodi yang disekresi merupakan molekul efektor yang penting dalam imunitas humoral.
Sel limfosit T merupakan sistem pertahanan seluler yang berasal dari sel stem (sumsum tulang belakang) dan bermigrasi ke organ timus untuk menjadi dewasa. Sel T dewasa meninggalkan kelenjar timus dan masuk ke dalam pembuluh getah bening dan berfungsi sebagai bagian dari sistem pengawasan kekebalan. Dalam proses pendewasaan, sel T membelah diri menjadi tiga bentuk yang memiliki peran masing-masing yaitu sel Thelper (Th), Tsuppresor (Ts) dan Tcytotoxic (Tc). Sel Thelper dapat dibedakan dari sel Tcytotoxic pada adanya glikoprotein yang berbeda pada permukaan membran mereka. Sel Thelper merupakan sel T yang berperan dalam stimulasi sistesis antibodi dan aktivasi makrofag dengan cara mengeluarkan molekul yang disebut sitokinin. Sel ini bekerja bersama dengan aktivitas antibodi sel B. Sel Tsuppresor berperan menekan aktivitas sel T yang lain. Sel ini mempunyai kemampuan menurunkan produksi antibodi. Sel Tcytotoxic memiliki kemampuan untuk menghancurkan sel alogenik dan sel sasaran yang terinfeksi patogen intraseluler (Baratawidjaja 2006). Adapun sel NK menurut Kresno (1996) termasuk sel nul karena tidak memiliki reseptor antigen pada permukaan tetapi memiliki reseptor untuk komplemen (C) dan fragmen molekul antibodi. Sel ini memiliki ukuran yang lebih besar daripada limfosit T dan B. Sel limfosit ini juga dikenal sebagai Large Granular Lymphocyte (LGL) karena merupakan sel dengan sejumlah besar sitoplasma dengan granula azurofilik (Kuby et al. 2007). Sel NK berfungsi sebagai sel efektor sitolitik yang dapat menyerang dan melisis sel target yaitu sel abnormal seperti sel neoplastik, sel terinfeksi virus /patogen seluler, dan sel normal yang tidak dewasa (Roitt dan Delves 2001).
2.4.
Proliferasi Sel Limfosit
9
Respon proliferasi sel limfosit yang di uji pada sistem in vitro dapat digunakan untuk menggambarkan fungsi limfosit dan status imun individu. Proliferasi merupakan fungsi biologis mendasar pada sel limfosit, yaitu meliputi proses diferensiasi dan pembelahan sel. Aktivitas proliferasi limfosit merupakan salah satu parameter yang dapat digunakan untuk mengukur status imunitas karena proses proliferasi menunjukkan kemampuan dasar dari sistem imun (Roitt dan Delves 2001).
Proliferasi sel limfosit dapat diinduksi oleh suatu senyawa yang disebut mitogen. Mitogen pada umumnya berasal dari tumbuhan (lektin) atau merupakan gula terikat seperti concanavalin A (con-A), pokeweed (PWM) dan fitohemaglutinin (PHA) serta senyawa non lektin seperti lipopolisakarida (LPS). Menurut Lao et al. (2001) aktivitas mitogen bersifat spesifik seperti con-A umumnya menginduksi proliferasi sel limfosit T, LPS menginduksi sel B, sedangkan PWM menginduksi sel limfosit T dan B. Kresno (1996) menyatakan bahwa respon terhadap mitogen dianggap menyerupai respon limfosit terhadap antigen, sehingga uji proliferasi limfosit dengan rangsangan mitogen banyak dipakai untuk menguji fungsi limfosit.
2.5.
Uji Proliferasi Sel Limfosit
Pengujian aktivitas proliferasi sel limfosit dapat dilakukan secara in vivo pada tikus percobaan dengan tujuh minggu masa perlakuan. Pengujian ini meliputi proses isolasi sel limfosit, perhitungan dan pengkulturan suspensi sel limfosit limfa. Sel limfosit yang umum digunakan adalah sel limfosit dari organ limfa. Organ limfa merupakan organ limfoid sekunder yang berfungsi menangkap dan mempresentasikan antigen dengan efektif. Selain itu, sel B dan sel T dalam organ limfa sudah dalam keadaan matang dan siap untuk berproliferasi dan berdiferensiasi. Organ limfa juga merupakan tempat untuk saringan darah atau pembersihan mikroba darah dan tempat respon imun utama terhadap antigen asal darah (Baratawidjaja 2006).
Perhitungan jumlah sel hidup dilakukan dengan metode pewarnaan biru trifan. Biru trifan merupakan larutan buffer isotonik. Prinsip metode ini adalah penyerapan zat warna melalui membran sel. Biru trifan hanya dapat mewarnai sel jika sel itu rusak sehingga dapat digunakan untuk membedakan sel mati/rusak dengan sel hidup. Sel hidup memiliki bentuk bulat dan tidak berwarna/terang, sedangkan sel mati/rusak memiliki bentuk mengkerut dan berwarna biru (Shaper 1998).
2.5.1.
Kultur Sel
Kultur sel merupakan teknik yang biasa digunakan untuk mengembangbiakkan sel di luar tubuh (in vitro). Kultur sel dapat digunakan untuk mengevaluasi dampak yang ditimbulkan dari kondisi abnormal atau keberadaan senyawa berbahaya pada sel. Untuk melakukan kultur sel secara in vitro dibutuhkan kondisi pertumbuhan yang mirip dengan kondisi in vivo seperti pengaturan temperature, konsentrasi O2 dan CO2, pH, tekanan osmosis, dan kandungan nutrisi. Dalam bidang ilmu pangan, kultur sel seringkali digunakan untuk evaluasi fungsi dan keamanan bahan pangan secara in vitro (Freshney 1994).
10
digunakan harus disesuaikan dengan jenis sel yang akan dikultur. Media yang sering digunakan untuk kultur sel limfosit adalah Roswell Park Memorial Institute (RPMI)-1640 yang merupakan media sintetis yang kaya nutrisi.
Serum yang biasa digunakan untuk kultur sel limfosit adalah Fetal Bovine Serum (FBS). Serum ini berfungsi sebagai protein pembawa hormon untuk menstimulasi pertumbuhan sel. Komponen serum sebagian besar adalah protein dan komponen lainnya seperti polipeptida, hormon-hormon, mineral dan bahan makanan seperti asam amino, glukosa, lemak, asam keto, etoalamin, fosfoetanol amin dan hasil-hasil metabolit lainnya.
Media kultur sel juga ditambahkan buffer dan antibiotik. Penambahan buffer bertujuan untuk menjaga keseimbangan nilai pH yaitu pH 7.4. Menurut Freshney (1994) pertumbuhan sel akan terhambat jika pH sedikit lebih rendah dari pH 7. Buffer yang umum digunakan adalah NaHCO3. Penambahan antibiotik bertujuan untuk mencegah kontaminasi media. Antibiotik yang berbeda memiliki spektrum antimikroba yang berbeda. Penisilin merupakan antimikroba untuk bakteri gram positif, streptomisin untuk bakteri gram positif dan negatif, sedangkan gentamisin untuk bakeri gram positif, gram negatif, dan mikroplasma (Freshney 1994). Menurut Cartwright dan Shah (1994) faktor utama dalam memilih jenis antibiotik untuk kultur sel adalah tidak bersifat toksik, memiliki spektrum antimikroba yang luas, ekonomis, dan memiliki kecenderungan minimum untuk menginduksi pembentukan mikroba yang kebal. Antibiotik yang sering digunakan adalah campuran penisilin dan streptomisin.
Menurut Freshney (1994) penggunaan kultur sel lebih menguntungkan karena lingkungan tempat hidup sel dapat dikontrol dan diatur sehingga kondisi fisiologis dari kultur relatif konstan. Namun teknik ini juga memiliki beberapa kelemahan seperti rawan kontaminasi karena sel hewan tumbuh lebih lambat daripada kontaminan, membutuhkan lingkungan yang kompleks seperti di dalam tubuh, serta sel yang tumbuh mengalami perubahan sifat dan kehilangan spesifitas sel karena sel tidak lagi terintegrasi dalam jaringan.
2.5.2.
Uji MTT
Pengujian proliferasi sel dapat dilakukan menggunakan metode pewarnaan MTT ( 3-[4,5-Dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide). MTT merupakan suatu garam tetrazolium yang direduksi pada sel metabolik hidup. Prinsip metode ini adalah pengukuran absorbansi senyawa formazan yang berwarna ungu yang merupakan hasil konversi MTT oleh aktivitas enzim suksinat dehidrogenase dari mitokondria sel hidup. Kandungan suksinat dehidrogenase relatif konstan diantara berbagai sel dengan tipe spesifik, sehingga jumlah formazan yang terbentuk proporsional terhadap jumlah sel limfosit yang hidup. Bagaimanapun, telah diketahui juga bahwa reliabilitas dan sensitivitas metode ini dipengaruhi oleh berbagai faktor diantaranya volume sel, antioksidan dan senyawa berwarna lainnya (Wang et al. 2006).
Enzim suksinat dehidrogenase adalah salah satu enzim yang berperan aktif selama proses respirasi seluler secara aerobik. Enzim suksinat dehidrogenase merupakan flavoprotein yang mengandung protein dengan ikatan Fe (besi) dan S (belerang). Enzim ini terikat pada bagian membrane mitokondria yang berfungsi sebagai reduktor selama tahapan siklus Krebs dan transport electron. Pada siklus Krebs, enzim ini menerima hidrogen dari suksinat dan bertugas menghidrogenasi suksinat menjadi fumarat serta menghasilkan FADH2 (Lehninger 1982).
11
III.
BAHAN DAN METODE
3.1.
Bahan dan Alat
3.1.1.
Bahan
Bahan dasar yang digunakan adalah daun jelatang (Urtica dioica L.) kering yang disuplai oleh Fytagoras BV Plant Science, Belanda. Hewan percobaan yaitu tikus jenis Sprague Dawley diperoleh dari SEAFAST Center, IPB. Bahan untuk pemeliharaan tikus, meliputi air minum dalam kemasan dan ransum yang mengikuti standar American Institute of Nutrition (AIN) 1976. Komposisi ransum standar AIN 1976 tertera pada Tabel 2.
Tabel 2. Komposisi ransum standar AIN 1976
Bahan Penyusun
Jumlah (%)
Proteina 20
Lemakb 5
Selulosac 5
Campuran vitamin 1
Campuran mineral 3,5
Patid Untuk membuat 100%
a
Sebagai sumber protein digunakan tepung kasein
b
sebagai sumber lemak digunakan minyak jagung
c
sebagai sumber selulosa digunakan carboxymethylcellulose
d
sebagai sumber pati digunakan tepung maizena
Ransum standar AIN 1976 menggunakan campuran vitamin dan mineral. Komposisi campuran vitamin dapat dilihat pada Tabel 3 sedangkan komposisi campuran mineralnya pada Tabel 4.
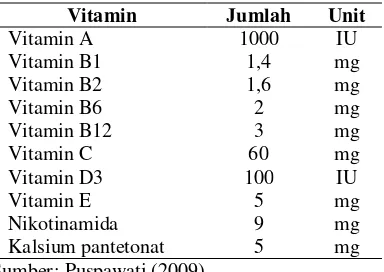
Tabel 3. Komposisi campuran vitamin
Vitamin Jumlah Unit
Vitamin A 1000 IU
Vitamin B1 1,4 mg
Vitamin B2 1,6 mg
Vitamin B6 2 mg
Vitamin B12 3 mg
Vitamin C 60 mg
Vitamin D3 100 IU
Vitamin E 5 mg
Nikotinamida 9 mg
Kalsium pantetonat 5 mg
13
Tabel 4. Komposisi campuran mineral
Nama senyawa Jumlah (g/kg campuran)
NaCl (39,3% Na, 60,7% Cl) 74,0
KI (40,7% K, 59,3% I) 0,790
KH2PO4 (22,8% P, 28,7% K ) 389,000
MgSO4. 7H2O 57,300
CaCO3 (40% Ca) 381,400
FeSO4. 7H2O (20,1% Fe) 27,000
MnSO4. 7H2O 4,010
ZnSO4. 7H2O 0,548
CuSO4. 5H2O 0,477
CoCl2. 6H2O 0,023
Sumber: Puspawati (2009)
Bahan untuk euthanasia tikus, yaitu eter. Bahan-bahan kimia yang digunakan pada pengujian proliferasi sel limfosit meliputi bubuk Rosewell Park Memorial Institute (RPMI)-1640 sebagai medium pertumbuhan sel limfosit, antibiotik penicilin-streptomisin, mitogen lipopolisakarida (LPS) Salmonella typhii, larutan rhodamin B (0.04 mg/ml, 0.08 mg/ml, dan 0.12 mg/ml), larutan karmoisin (0.16 mg/ml, 0.32 mg/ml, 0.48 mg/ml), NH4Cl, tryphan blue, NaHCO3, aquabides, phosfat buffer saline (PBS), fetal bovine serum (FBS), MTT (3-[4,5-Dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide), HCl, isopropanol.
3.1.2.
Alat
Peralatan yang digunakan selama perlakuan dan penanganan tikus percobaan antara lain kandang plastik, botol minum, wadah ransum, timbangan, dan peralatan cekok. Peralatan untuk pembuatan larutan cekok meliputi blender, kain kasa, botol, gelas piala dan tabung reaksi. Peralatan untuk anastesi tikus serta pengambilan organ, yaitu syringe, tabung sentrifuse, gunting, dan pinset.
Adapun peralatan yang digunakan untuk pengujian proliferasi sel limfosit antara lain sentrifuse, lemari steril, inkubator, mikroskop, mikroskop inversi, hemasitometer, membran steril 0.2 µm, tabung sentrifuse steril, botol steril, cawan petri steril, tabung reaksi steril, multiplate microwell 96, pipet pasteur, mikropipet, mikrotip, ELISA Reader.
3.2.
Metode Penelitian
3.2.1.
Pembuatan ekstrak daun jelatang (mengacu Afrah 2010)
Daun jelatang kering dihaluskan dengan blender kering untuk memperoleh bubuk daun jelatang. Untuk pembuatan ekstrak dengan dosis 0.1 g/kg BB/hari, tiap 1 g bubuk daun ditambahkan 50 ml aquades kemudian diblender. Sementara untuk dosis 1 g/kg BB/hari, tiap 1 g bubuk daun ditambahkan 5 ml aquades dan diblender. Selanjutnya, campuran tersebut disaring dengan kain kasa untuk mendapatkan ekstrak daun jelatang.
3.2.2.
Pemeliharaan tikus (mengacu Afrah 2010)
14
2 diberikan ekstrak daun jelatang sebanyak 0,1 g/kg BB/hari; sedangkan kelompok 3 diberikan ekstrak daun jelatang sebanyak 1 g/kg BB/hari.Ekstrak daun jelatang diberikan melalui proses pencekokan. Tikus kelompok kontrol juga dicekok, namun dengan air minum dalam kemasan (AMDK), sehingga mengalami stress yang serupa dengan tikus yang dicekok ekstrak daun jelatang. Ransum yang digunakan sesuai dengan standar AIN 1976 dan diberikan secara ad libitum. Air juga diberikan dengan cara yang sama. Tikus diadaptasi selama 3 hari. Setelah masa adaptasi selesai, tiap harinya tikus dicekok sesuai perlakuan dan dosis masing-masing. Perlakuan tersebut berlangsung hingga 90 hari. Untuk memantau pertumbuhan tikus, selama masa percobaan dilakukan penimbangan berat badan dua hari sekali.
3.2.3.
Pengujian Proliferasi Sel Limfosit
3.2.3.1.
Persiapan pereaksi dan media kultur (Puspawati 2009)
Untuk pembuatan larutan media RPMI sebagai medium kultur sel limfosit, RPMI bubuk dalam sachet (16.2 g) dilarutkan dengan air bebas pirogen (aquabides) sehingga diperoleh 1 L larutan medium RPMI 1640. Kemudian ditambahkan 2 g NaHCO3 dan 1% penisilin-streptomisin. Untuk pembuatan larutan NH4Cl, sebanyak 0.85 mg bubuk NH4Cl dilarutkan dalam 100 ml aquabides dan diaduk hingga homogen. Pembuatan phosphate buffer saline (PBS) dilakukan dengan melarutkan satu tablet PBS dalam 200 ml aquabidest. Indikator tryphane blue 0.20% dibuat dengan melarutkan bubuk tryphane blue sebanyak 0.02 mg dalam 10 ml PBS dan diaduk hingga homogen.
Persiapan fetal bovine serum (FBS) dilakukan dengan memanaskan 15 ml FBS pada suhu 560C selama 45 menit. Setelah dingin, larutan disterilisasi dingin dengan membran filter steril 0.20 µm. Pembuatan larutan LPS, sebanyak 0.417 mg bubuk LPS dimasukkan ke dalam labu takar 10 ml dan ditambahkan PBS sampai tanda tera. Pembuatan MTT 0.5% dilakukan dengan melarutkan 0.25 mg bubuk MTT dalam 50 ml PBS dan diaduk hingga homogen. Untuk pembuatan HCl-isopropanol, HCl 37% (pekat) dipipet sebanyak 33.1 µl dan ditambahkan 9.669 ml isopropanol dan diaduk hingga homogen sehingga didapat larutan HCl-isopropanol 0.04 N. Larutan ini harus dibuat segar tiap akan digunakan. Larutan-larutan (pereaksi dan media) yang telah dibuat kemudian disterilisasi dingin dengan membran filter steril 0.20 µm.
3.2.3.2.
Pengambilan organ
Pengambilan organ tikus dilakukan dalam keadaan steril. Tikus dimasukkan dalam wadah kaca bertutup yang sebelumnya telah diisi dengan kapas dan eter. Saat tikus terlihat tidak mampu lagi bergerak dan matanya mulai tertutup, tikus diangkat, disemprot dengan alkohol dan diletakkan di alas bedah. Kulit perut digunting (mengikuti pola seperti huruf V) hingga mendekati rongga dada. Limfa tikus diambil menggunakan gunting dan pinset steril dan segera dicuci dengan larutan PBS steril di dalam botol steril.
3.2.3.3.
Isolasi sel limfosit limfa (Prangdimurti 1999)
15
telah lisis dibuang. Pelet dijentik-jentikkan dan ditambahkan 5 ml RPMI kemudian disentrifuse dengan kecepatan 2500 rpm selama 5 menit. Endapan disuspensikan dengan 3 ml RPMI.3.2.3.4.
Penghitungan sel limfosit limfa
Sebanyak 50 µl suspensi sel limfosit ditempatkan dalam sumur microplate dan ditambahkan dengan 50 µl tryphan blue (1:1). Sebanyak 50 µl campuran kemudian ditempatkan pada hemasitometer. Penghitungan dilakukan di bawah mikroskop dengan perbesaran 400 kali. Sel yang hidup tampak terang, jernih dan berbentuk bulat sedangkan sel yang mati akan berwarna biru dan mengkerut.
Berdasarkan hasil perhitungan pada area 2 kotak besar hemasitometer (@ 16 kotak kecil) dapat ditentukan jumlah sel yang hidup per mililiter suspensi dengan rumus :
N = V
2 x F x 10 sel/ ml Keterangan :
N = jumlah sel/ml
V/2 = rata-rata jumlah sel terhitung dari dua bidang pandang F = faktor pengenceran (2)
104 = jumlah sel per luas bidang pandang (1.0 mm x 1.0 mm x 0.1 mm) Suspensi sel limfosit kemudian ditepatkan 2x106 sel/ml melalui pengenceran dengan RPMI-1640.
3.2.3.5.
Pengujian proliferasi sel limfosit limfa (Puspaningrum 2003; Keller
et
al
. 2005)
Suspensi sel dikultur dalam microplate 96 sumur dengan volume total masing-masing sumur adalah 100 µl. Bahan-bahan yang ditambahkan pada setiap sumur disesuaikan dengan perlakuan yang akan diberikan seperti ditunjukkan Tabel 5.
Tabel 5. Bahan-bahan yang ditanam ke dalam kultur sel
Perlakuan RPMI (µl)
Suspensi sel (µl)
Mitogen (µl)
Senyawa toksik (µl)
FBS (µl)
Kontrol 30 60 - - 10
Perlakuan mitogen
(LPS)
- 60 30 - 10
Perlakuan senyawa
toksik*
- 60 - 30 10
*
senyawa toksik yang digunakan adalah rhodamin B dan karmoisin16
Kultur sel diinkubasi pada suhu 370C dengan atmosfer 5% CO2, 95% udara dan RH 96% selama 72 jam. Empat jam sebelum masa inkubasi berakhir, ditambahkan 10 µl larutan MTT 0.5% ke dalam masing-masing sumur. Dan setelah masa inkubasi berakhir, ke dalam tiap sumur ditambahkan 80 µl HCl-isopropanol 0.04 N. Kemudian absorbansi masing-masing sumur diukur dengan menggunakan microplate reader (ELISA reader) pada panjang gelombang 570 nm. Nilai Optical Density (OD) hasil pembacaan ELISA reader bersifat proporsional terhadap jumlah sel hidup. Indeks stimulasi (IS) sebagai dasar penentuan aktivitas proliferasi dihitung dengan menggunakan persamaan sebagai berikut.IS = OD sel per lakuan ( dengan mitogen atau senyaw a toksik) OD sel kontr ol ( tanpa mitogen atau senyaw a toksik)
Nilai rata-rata indeks stimulasi dengan perlakuan mitogen atau senyawa toksik kemudian
dibandingkan dengan nilai rata-rata indeks stimulasi spontan dan secara statistic dianalisis
menggunakan uji T berpasangan (paired-sample T-test) pada taraf kepercayaan 95%. Besar peningkatan atau penurunan aktivitas proliferasi limfosit akibat penambahan mitogen atau senyawa
toksik ditentukan dengan perhitungan % aktivitas sebagai berikut.
% Aktivitas= (IS perlakuan (dengan mitogen atau senyawa toksik)-IS spontan)
IV.
HASIL DAN PEMBAHASAN
4.1.
Pemeliharaan dan Pertumbuhan Tikus
Penelitian ini menggunakan tikus putih (Rattus norvegicus) galur Sprague Dawley berumur sekitar delapan minggu sebagai hewan uji. Menurut Puspawati (2009) tikus galur ini merupakan tikus yang mudah didapat dan sering digunakan dalam pengujian imunitas. Tikus percobaan dipelihara dan diberikan perlakuan pencekokan selama 90 hari ditambah 3 hari masa adaptasi. Larutan cekok yang diberikan adalah ekstrak daun jelatang dengan menggunakan air sebagai pelarut. Berdasarkan dosis larutan cekok yang diberikan, tikus percobaan dibagi menjadi tiga kelompok yaitu kelompok dosis 0,1 g/kg BB/hari, kelompok dosis 1 g/kg BB/ hari, dan kelompok kontrol yang diberikan air minum. Hal ini dilakukan agar tikus kontrol juga menerima stress perlakuan yang sama dengan tikus kelompok lainnya. Penentuan dosis 0.1 g/kg BB/hari didasarkan pada hasil konversi dosis pemberian pada manusia (Lampiran 1). Volume larutan cekok yang diberikan berbeda-beda karena masing-masing tikus memiliki berat yang tidak sama. Contoh perhitungan volume larutan cekok dapat dilihat pada Lampiran 2. Tikus kontrol dicekok dengan air minum sebanyak 1 ml.
Ekstrak daun jelatang yang diberikan merupakan ekstrak kasar yang masih berupa suspensi karena adanya partikel-partikel yang tidak terlarut. Penggunaan ekstrak kasar sebagai larutan cekok diharapkan dapat memberikan hasil yang mendekati hasil pengujian jika daun jelatang diberikan secara langsung bersama pakan. Pemberian daun jelatang langsung bersama pakan sulit dilakukan mengingat konsumsi pakan dari masing-masing tikus berbeda-beda dan kemungkinan adanya karakteristik daun jelatang yang tidak disukai oleh tikus.
Pemberian substansi uji tertentu dengan cara tertentu pada hewan percobaan dapat mempengaruhi pola makan, tingkah laku dan pertumbuhan hewan tersebut. Selama periode pemeliharaan tikus percobaan ditemukan dua kasus kematian (mortalitas). Kasus pertama ditemukan pada kelompok tikus dosis 1 g/kg BB/hari setelah 42 hari masa perlakuan dan kasus kedua ditemukan pada kelompok tikus dosis 0.1 g/kg BB/hari setelah 73 hari masa perlakuan. Adanya gejala morbiditas (sakit/menderita) terlihat pada kedua tikus dalam waktu kurang dari 24 jam sebelum kematian. Selain itu, ditemukan juga banyak darah di sekitar hidung dan mata kedua tikus yang telah mati. Kedua kasus kematian ini diperkirakan terjadi karena penyimpangan irama jantung (arrythmia).
Menurut Peterson dan Talcott (2006), tanaman Urtica spp dapat memicu gejala-gejala klinis seperti salivasi, muntah, arrythmia, dyspnea, kelemahan, dan collapse. Mekanisme terjadinya arrhytmia diduga terkait dengan sifat diuretik dari daun Urtica dioica L. Beberapa laporan menunjukkan bahwa diuretik, terutama yang tidak memiliki aktivitas menghemat kehilangan kalium dari tubuh (non potassium sparing diuretic), dapat meningkatkan risiko kematian arrhytmic (kematian akibat penyimpangan denyut jantung) pada pasien-pasien hipertensif, yang diduga terjadi karena diuretik mengubah keseimbangan elektrolit (Cooper et al. 1999). Ditemukannya sedikit darah di sekitar mulut dan hidung tikus pada saat pemeriksaan diasumsikan akibat tikus menggosok-gosokkan hidung ke tutup kandang yang terbuat dari logam. Tingkah laku tersebut diperkirakan karena pemberian jelatang dapat memicu gatal, seperti yang disebutkan oleh Fragoso et al. (2008).
18
Penimbangan berat badan untuk memantau pertumbuhan tikus percobaan dilakukan dua hari sekali. Data berat badan tikus selama masa perlakuan tertera pada Lampiran 3. Tabel 6 menunjukkan data berat badan awal, berat badan akhir, kenaikan berat badan, serta rata-rata konsumsi pakan per hari setiap kelompok tikus. Setelah 90 hari masa percobaan, semua kelompok tikus mengalami kenaikan berat badan. Kenaikan berat badan tertinggi terjadi pada kelompok kontrol sebesar 136.60±40.20 g. Hal ini sesuai dengan rata-rata konsumsi pakan/hari kelompok kontrol yang lebih tinggi dibanding kelompok lain. Pemberian ekstrak daun jelatang pada dosis 0.1 g/kg BB/hari dan 1 g/kg BB/hari mempengaruhi konsumsi pakan/hari kelompok tikus tersebut menjadi lebih rendah. Walaupun demikian, hal tersebut tidak memberikan pengaruh negatif pada pertumbuhan tikus secara keseluruhan.
Hasil analisis uji sidik ragam terhadap berat badan awal tikus tertera pada Lampiran 5; berat akhir tikus pada Lampiran 6 dan kenaikan berat badan pada Lampiran 7. Berat badan kelompok tikus yang mendapat ekstrak daun jelatang, baik dosis 0.1 g/kg BB/hari maupun 1 g/kg BB/hari, tidak berbeda nyata dengan kontrol pada taraf kepercayaan 95%. Hasil analisis statistik menunjukkan bahwa kenaikan berat badan tidak berbeda nyata pada taraf kepercayaan 95% pada masing-masing kelompok tikus. Grafik pertumbuhan masing-masing kelompok tikus juga cenderung meningkat (Gambar 4). Hal ini mengindikasikan bahwa selama masa perlakuan, semua kelompok tikus berada dalam keadaan pertumbuhan yang baik. Menurut National Research Council (1978), pertumbuhan dan perkembangan yang baik dari mahkluk hidup ditandai dengan terjadinya kenaikan berat badan yang mengikuti bentuk kurva pertumbuhan yang sigmoid. Dalam kondisi diet seimbang (protein, energi, serta komponen-komponen lainnya), kenaikan berat badan akan terjadi sesuai dengan pola pertumbuhan yang seharusnya, dan akan menjadi lebih buruk bila hewan mendapatkan ransum yang tidak bergizi seimbang.
Tabel 6. Rata-rata dan standar deviasi berat badan, kenaikan berat badan, dan konsumsi pakan pada setiap kelompok tikus
Perlakuan
Berat badan (g) Konsumsi
pakan/hari (g)
Awal Akhir Kenaikan
Kontrol 194.20±22.78a 330.80±43.79a 136.60±40.20a 18.54±1.77a
Dosis 0.1 g/kg BB/hari 183.60±14.28a 287.33±47.02a 104.11±39.40a 16.80±1.84b Dosis 1 g/kg BB/hari 188.90±14.19a 293.89±70.20a 104.44±61.16a 17.24±1.94b
Notasi huruf yang sama dalam kolom yang sama menunjukkan perbedaan yang tidak signifikan pada taraf kepercayaan 95%. Begitu pula sebaliknya (uji lanjut Tukey)
Gambar 4. Pertumbuhan tikus kontrol dan tikus yang diberi ekstrak daun jelatang dosis 0.1 g/kg BB/hari dan dosis 1 g/kg BB/hari
0,00 100,00 200,00 300,00 400,00
0 50 100
B e ra t b a d a n ( g ) Hari ke-kont rol
19
4.2.
Proliferasi Sel Limfosit Limfa Tikus
Proliferasi limfosit merupakan suatu proses yang dapat mengindikasikan aktivitas respon imun spesifik yang berkaitan dengan suatu system imun. Menurut Kuby et al. (2007), sel limfosit yang dapat berproliferasi adalah sel B dan sel T yang merupakan bagian dari sistem imun spesifik. Sel B bertambah banyak dan berdiferensiasi menjadi sel plasma (efektor) dan sel memori pada awal proses proliferasi, sedangkan sel T berdiferensiasi menjadi sel Thelper (Th), Tsuppresor (Ts) dan Tcytotoxic (Tc). Sel B akan menghasilkan antibodi dari sel plasmanya unruk melawan benda asing (antigen) yang dapat merugikan bagi kesehatan. Sel T akan menghasilkan sitokinin yang menginduksi sistem imun lain.
Pengujian aktivitas proliferasi sel limfosit limfa tikus setelah 90 hari masa perlakuan dilakukan melalui proses isolasi sel limfosit limfa, perhitungan dan pengkulturan suspensi sel limfosit limfa, serta penentuan indeks stimulasi sel limfosit limfa berdasarkan hasil pengujian dengan metode MTT. Sel limfosit yang diuji berasal dari organ limfa. Organ ini merupakan organ limfoid sekunder yang dirancang untuk menginisiasi respon imun terhadap antigen asal darah. Janeway et al. (2001) menyebutkan bahwa limfa merupakan organ yang mengumpulkan antigen dari darah serta mengumpulkan dan membuang sel darah merah (eritrosit) yang telah tua. Organ limfa mengandung kompartemen-kompartemen khusus yang merupakan tempat sel-sel imun berkumpul dan bekerja, dan berfungsi sebagai tempat pertemuan (konfrontasi) sistem imun dengan antigen (National Institute of Health 2003).
Sebelum dikultur, jumlah sel dalam suspensi sel limfosit dihitung menggunakan metode biru trifan. Hal ini dilakukan untuk mengetahui konsentrasi sel hidup dalam suspensi sel limfosit. Sel hidup memiliki membran sel yang masih utuh sehingga pewarna biru trifan yang diberikan tidak akan masuk ke dalam sel. Sel hidup tampak berbentuk bulat utuh dan bening pada pengamatan dengan mikroskop perbesaran 400x. Adapun sel yang telah mati tampak mengkerut dan berwarna kebiruan karena membran selnya telah rusak dan pewarna biru trifan dapat masuk ke dalam sel. Jumlah sel hidup dalam suspensi sel yang akan dikultur minimal sebesar 95% (Tejasari 2000).
Pengkulturan sel limfosit limfa dilakukan secara in vitro dengan media RPMI 1640 yang mengandung nutrisi yang diperlukan untuk pertumbuhan sel. Dalam media kultur juga ditambahkan fetal bovine serum (FBS) sebesar 10%. Penambahan serum ini bertujuan untuk memberikan hormon-hormon penting pertumbuhan, protein, lipid, dan mineral-mineral yang penting untuk prtumbuhan, serta sebagai faktor penempel sel pada matrik tempat sel tumbuh (Freshney 1994). Antibiotik juga ditambahkan untuk mengatasi kontaminasi mikroorganisme. Selain itu ditambahkan juga NaHCO3 yang berfungsi sebagai buffer untuk mempertahankan pH yang diperlukan dalam pengkulturan sel limfosit (Freshney 1994).
20
Dalam proses pengkulturan sel sangat dibutuhkan kondisi yang steril untuk menghindari kontaminasi mikroorganisme. Tahapan-tahapan dalam pengkulturan sel limfosit dikerjakan secara aseptis dan sebagian besar dilakukan di dalam lemari steril. Inkubasi kultur sel limfosit dilakukan selama 72 jam dalam inkubator CO2 dengan pengaturan suhu 370C, kadar CO2 5%, udara 95%, dan RH 97%. Kondisi ini diupayakan untuk mendekati kondisi yang sama dengan kondisi tubuh. Menurut Freshney (1994), untuk melakukan kultur sel secara in vitro dibutuhkan kondisi pertumbuhan yang mirip dengan kondisi in vivo seperti pengaturan temperatur, konsentrasi O2 dan CO2, pH, tekanan osmosis, dan kandungan nutrisi.
Di akhir masa inkubasi dilakukan pengujian proliferasi sel limfosit dengan metode MTT (3-(4.5- dimethilthyazol-2-yl)-2.5 diphenyl-tetrazolium bromide). Empat jam sebelum berakhirnya masa inkubasi, senyawa MTT yang berwarna kuning ditambahkan ke dalam kultur sel. Senyawa MTT akan bereaksi dengan enzim suksinat dehidrogenase yang ada dalam mitokondria sel hidup. Enzim ini dapat mengubah senyawa tetrazolium dari MTT untuk menghasilkan kristal formazan yang berwarna biru. Nilai absorbansi dari warna biru kristal formazan ini kemudian dijadikan indikator jumlah sel limfosit hidup. Penambahan HCl-isopropanol dilakukan pada akhir masa inkubasi atau sebelum dilakukan pengukuran nilai absorbansi. Hal ini dilakukan untuk menghentikan aktivitas proliferasi sel limfosit sehingga stabil selama pengukuran nilai absorbansi dan untuk melarutkan kristal formazan yang terbentuk (Puspawati 2009).
Pengukuran nilai absorbansi kultur sel limfosit dilakukan dengan ELISA reader. Kesalahan dapat terjadi pada proses pengukuran ini karena adanya kontaminasi bakteri maupun khamir. Mitokondria sel bakteri dan khamir juga mengandung enzim suksinat dehidrogenase yang dapat bereaksi dengan garam tetrazolium. Oleh karena itu, pelaksanaan analisis yang aseptis sangat diperlukan untuk menghindari adanya kontaminasi.
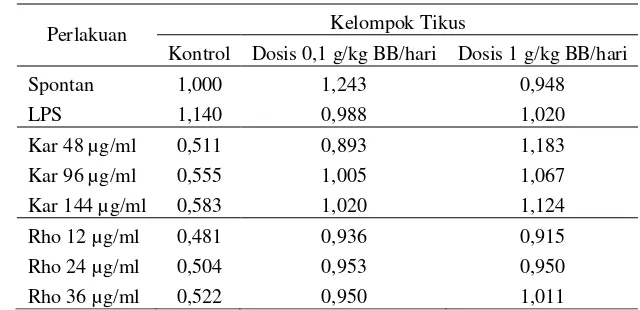
[image:34.595.155.475.551.706.2]Aktivitas proliferasi sel limfosit limfa tikus ditentukan melalui perhitungan nilai indeks stimulasi (IS). Nilai ini merupakan perbandingan antara rata-rata absorbansi kultur yang diberi perlakuan (konsumsi daun jelatang, penambahan mitogen atau senyawa toksik) dengan rata-rata absorbansi kultur yang tidak diberi perlakuan (kontrol). Semakin tinggi nilai IS menandakan proliferasi limfosit semakin banyak atau aktivitas proliferasi limfosit semakin tinggi (Cambier 2000). Data rata-rata absorbansi kultur sel pada masing-masing perlakuan tertera pada Lampiran 8. Adapun rata-rata indeks stimulasi pada masing-masing perlakuan tertera pada Tabel 7.
Tabel 7. Rata-rata indeks stimulasi pada setiap perlakuan
Perlakuan Kelompok Tikus
Kontrol Dosis 0,1 g/kg BB/hari Dosis 1 g/kg BB/hari
Spontan 1,000 1,243 0,948
LPS 1,140 0,988 1,020
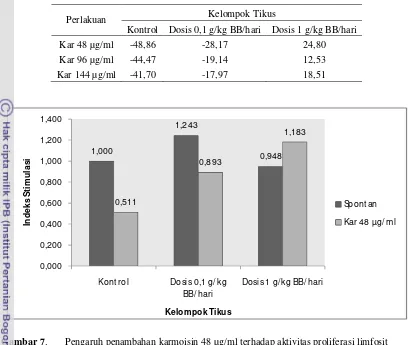
Kar 48 µg/ml 0,511 0,893 1,183
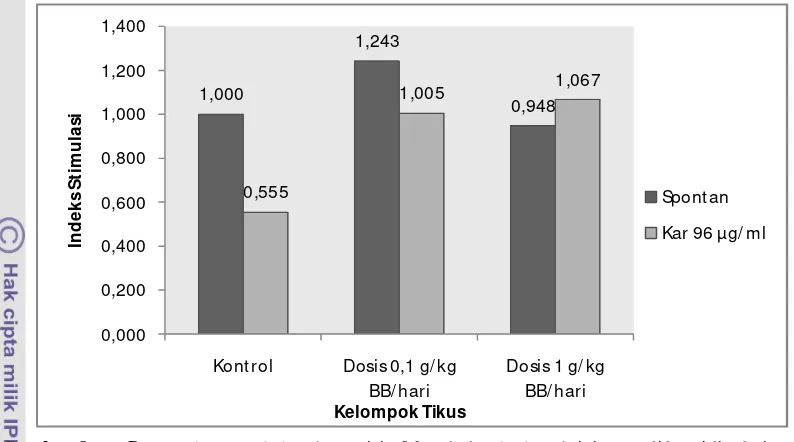
Kar 96 µg/ml 0,555 1,005 1,067
Kar 144 µg/ml 0,583 1,020 1,124
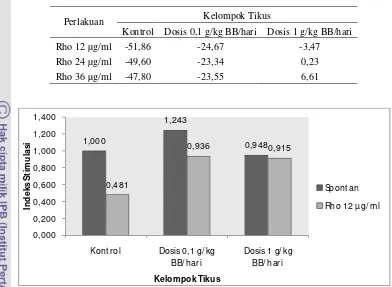
Rho 12 µg/ml 0,481 0,936 0,915
Rho 24 µg/ml 0,504 0,953 0,950
21
4.2.1.
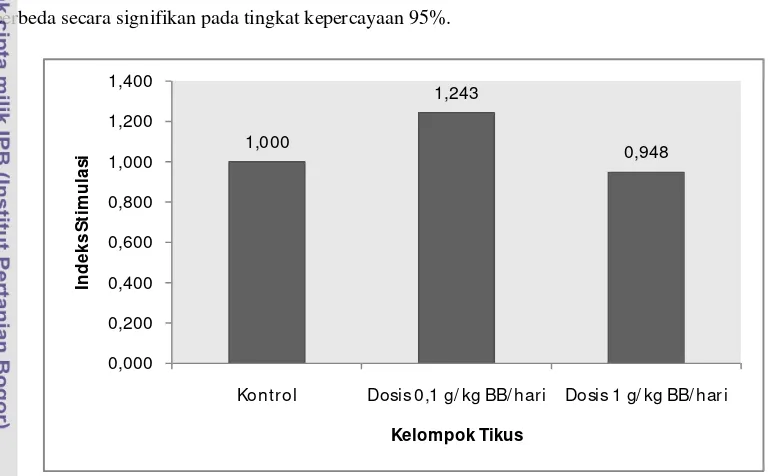
Proliferasi Limfosit Spontan
[image:35.595.117.503.239.477.2]Gambar 5 menunjukkan rata-rata indeks stimulasi sel limfosit limfa tikus tanpa penambahan mitogen atau senyawa toksik (proliferasi limfosit spontan). Nilai indeks stimulasi ini merupakan hasil bagi antara nilai absorbansi kelompok tikus dosis 0.1 g/kg BB/hari atau dosis 1 g/kg BB/hari dengan nilai absorbansi kelompok tikus kontrol. Dengan demikian, kelompok tikus kontrol memiliki nilai indeks stimulasi 1. Terlihat bahwa kelompok tikus dengan pemberian daun jelatang dosis 0.1 g/kg BB/hari memiliki nilai IS yang paling tinggi yaitu 1.243. Adapun kelompok tikus dengan pemberian daun jelatang dosis 1 g/kg BB/hari memiliki nilai IS yang lebih rendah dari kontrol yaitu sebesar 0.948. Hasil analisis statistik dengan uji sidik ragam (Lampiran 9) menunjukkan bahwa rata-rata nilai indeks stimulasi kelompok tikus kontrol, dosis 0.1 g/kg BB/hari, dan dosis 1 g/kg BB/hari tidak berbeda secara signifikan pada tingkat kepercayaan 95%.
Gambar 5. Rata-rata indeks stimulasi proliferasi spontan pada setiap kelompok tikus
Hasil penelitian menunjukkan bahwa indeks stimulasi limfosit kelompok tikus dosis 0.1 g/kg BB/hari memiliki nilai yang paling tinggi. Hal ini dapat terjadi mengingat adanya kandungan komponen-komponen bioaktif pada daun jelatang seperti komponen fenolik yang memiliki sifat antioksidan. Gulcin et al. (2004) menyatakan bahwa komponen fenolik pada ekstrak air dari tanaman jelatang bertanggung jawab terhadap aktivitas antioksidan yang kuat dan mendeteksi kandungan fenol sebesar 25,3 µg pyrocatechol equivalent pada 1 mg ekstrak. Lebih jauh lagi, Gulcin et al. (2004) menunjukkan aktivitas antioksidan dari ekstrak air daun jelatang sebesar 39, 66, dan 98% inhibisi peroksidasi dalam emulsi asam linoleat masing-masing pada konsentrasi 50, 100, dan 250 µg. Adanya sifat antioksidan dari komponen fenolik dapat melindungi sel limfosit dari stress oksidatif yang dapat merusak sel limfosit sehingga proliferasi terhambat. Penelitian tentang sifat antioksidan senyawa fenolik yang menunjukkan peranan sebagai antiradikal atau antioksidan secara in vivo pada manusia juga telah dilakukan oleh Erniwati (2007) yang menyebutkan komponen bioaktif seperti polifenol pada bubuk kakao bebas lemak dapat meningkatkan sifat antiradikal bebas pada sel limfosit manusia.
Puspawati (2009) yang melakukan kajian aktivitas proliferasi limfosit dan kapasitas antioksidan sorgum dan jewawut pada tikus Sprague Dawley menyebutkan bahwa terjadinya aktivitas antioksidan senyawa fenolik sorgum dan jewawut diduga karena senyawa fenolik tersebut setelah mengalami metabolisme dalam tubuh dapat diserap oleh jaringan seperti organ limfa. Mekanisme
1,000
1,243
0,948
0,000 0,200 0,400 0,600 0,800 1,000 1,200 1,400
Kont rol Dosis 0,1 g/ kg BB/ hari Dosis 1 g/ kg BB/ hari
In
d
e
k
s
S
ti
m
u
la
si
22
aktivitas antioksidan dari senyawa fenolik ini adalah kemampuan senyawa fenolik mendonorkan elektron atau mekanisme menangkap (scavenger) radikal bebas atau ROS menjadi produk yang non reaktif. Adapun menurut Damiani et al. (2008), penghambatan transfer hidrogen merupakan mekanisme yang umum terjadi pada antioksidan fenolik. Sebagian besar antioksidan sintetis ataupun alami merupakan senyawa fenolik (ArOH) yang paling sedikit memiliki satu grup hidroksil yang terikat pada cincin benzene. Efek antioksidan dari senyawa fenolik ini terjadi karena donasi atom hidrogen fenolik pada rantai yang mengandung radikal peroksil (1) merupakan reaksi yang terjadi lebih cepat dibandingkan penyerangan radikal peroksil terhadap substrat organik (2) yang merupakan tahap propagasi dari proses peroksidatif.
Selain itu, dugaan adanya komponen fenolik dari ekstrak daun jelatang yang berikatan dengan reseptor pada permukaan sel limfosit yang tersusun atas protein juga menjadi alasan tingginya proliferasi limfosit pada kelompok tikus dosis 0.1 g/kg BB/hari. Menurut Tejasari (2007) komponen fenolik dapat berikatan dengan reseptor sel limfosit karena komponen fenolik dapat berikatan dengan protein melalui ikatan hidrogen. Adanya ikatan ini secara tidak langsung mengaktivasi sel B untuk berproliferasi (Tejasari dan Zakaria 2002).
Namun demikian, pada dosis yang lebih tinggi (1 g/kg BB/hari), pemberian ekstrak daun jelatang menunjukkan efek menurunkan proliferasi limfosit. Hal ini diduga akibat banyaknya komponen fenolik yang terakumulasi dalam sel. Fardiaz (1996) men