Lampiran 2. Gambar tumbuhan cincau hijau (Cycle barbata Miers)
Lampiran 3. Gambar simplisia dan serbuk daun cincau hijau (Cyclea barbata L.Miers)
Gambar simplisia daun cincau hijau
Lampiran 5. Bagan kerja penelitian 1. Pembuatan ekstrak daun cincau hijau
simplisia
ditiriskan
dipotong kecil-kecil
dikeringkan dalam lemari pengering
ditimbang (8 kg) Daun cincau hijau (10 kg)
dibersihkan dan dicuci
hari terlindung dari cahaya
Lampiran 5. (Lanjutan)
2. Pengujian karakterisasi, skrining dan antidiare
Ekstrak kering 112 -Saat mulai terjadi
diare
Lampiran 6. Perhitungan hasil karakterisasi serbuk simplisia dan ekstrak etanol daun cincau hijau
1. Penetapan kadar air
a. Berat sampel = 5,0780 g
2. Penetapan kadar sari yang larut dalam air
a. Berat sampel = 5,0780 g Kadar air
=
volume II-volume IKadar sari = 0,1980 Kadar sari rata-rata = (19,49+20,01+22,38) %
3 = 20,63 %
3. Penetapan kadar sari yang larut dalam etanol
a. Berat sampel = 5,0510 g
Kadar sari = Berat sari Berat Sampel x
100
Kadar sari rata-rata = (18,31+17,24+16,17) %
3 = 17,24 %
4. Penetapan kadar abu total
a. Berat sampel = 2,0280 g
5. Penetapan kadar abu yang tidak larut dalam asam Kadar abu yang tidak larut dalam asam = Berat Abu
Berat Sampel x 100 %
Kadar abu total = Berat Abu
Kadar abu = 0,0090
2,0220 x 100 % = 0,44 % Sampel III Berat sampel = 2,0200 g
Beratabu = 0,0110 g Kadar abu = 0,0110
2,0200� 100 % = 0,54 %
Kadar abu yang tidak larut dalam asam rata-rata= (0,64+0,44+0,54) %
Lampiran 8. Gambar alat yang digunakan
Spuit dan oral sonde
Lampiran 9. Gambar konsistensi feses tikus
Feses tikus
Feses tikus lembek
Lampiran 10. Volume maksimum larutan sediaan uji yang dapat diberikan pada hewan
uji (Mulyono, 1984)
Jenis hewan uji Volume maksimum (ml) sesuai jalur pemberian
i.v. i.m. i.p. s.c. p.o.
Mencit (20-30 g) 0,5 0,05 1,0 0,5-1,0 1,0
Tikus (200 g) 1,0 0,1 2-5 2-5 5,0
Hamster (50 g) - 0,1 1-2 2,5 2,5
Marmot (300 g) - 0,25 2-5 5,0 10,0
Kelinci (2,5 kg) 5-10 0,5 10-20 5-10 20,0
Kucing (3 kg) 5-10 1,0 10-20 5-10 50,0
Anjing (5 kg) 10-20 5,0 20-50 10,0 100,0
Lampiran 12. Perhitungan konversi dosis
1. Perhitungan konversi dosis loperamid HCl (tablet Imodium®) dari manusia ke tikus :
Dosis manusia (berat 70 kg) = 2-8 mg dan tidak melebihi 16 mg/hari Dosis tikus (berat 200 g) = 0,018 x (16 mg) = 0,2 mg
Lampiran 13. Perhitungan pembuatan suspensi loperamid HCl (table imodium®) Dosis manusia (70 kg) = 2-8 mg dan tidak melebihi 16 mg/hari
Dosis tikus (200 g) setelah dikonversikan = 1 mg/kg bb
Tablet Imodium ditimbang sebanyak 20 tablet (berat = 1126 mg) 20 tablet Imodium mengandung Loperamid HCl sebanyak 40 mg Loperamid HCl yang digunakan = 1 mg
Serbuk Imodium yang diambil = 1 mg 40 mg
x 1126 mg = 28,15 mg
Jadi serbuk Imodium sebanyak 56,3 mg mengandung Loperamid HCl sebanyak 1 mg.
Lampiran 14. Perhitungan dosis pemberian ekstrak etanol daun cincau hijau (EEDCH) dan loperamid HCl (tablet Imodium®)
Konsentrasi EEDCH = 4 % = 4 g/100 ml = 40 mg/ml a. EEDCH yang diberikan untuk dosis 50 mg/kg bb
Berat badan tikus = 200 g
b. EEDCH yang diberikan untuk dosis 100 mg/kg bb Berat badan tikus = 200 g
c. EEDCH yang diberikan untuk dosis 150 mg/kg bb Berat badan tikus = 200 g
d. Konsentrasi Loperamid = 1,13mg/ml ml
25 mg 28,15
=
Lampiran 15. Hasil pengamatan saat mulai terjadinya diare setelah pemberian oleum ricini
Keterangan:
OR : Oleum ricini
EEDCH : Ekstrak etanol daun cincau hijau
Perlakuan
Hewan
Jumlah Rata-rata (menit)
1 2 3 4 5
OR + CMC
1% bb 56 55 60 58 56 285 57
OR + Loperamid
HCl 1 mg/kg bb 114 114 85 92 90 495 99
OR + EEDCH
50 mg/kg bb 60 59 60 88 57 324 64,8
OR + EEDCH
100 mg/kg bb 87 90 119 114 90 500 100
OR + EEDCH
Lampiran 16. Hasil pengamatan konsistensi feses setelah pemberian oleum ricini Berlendir
Perlakuan Diameter serapan
air (cm)
Perlakuan Diameter serapan
air (cm)
EEDCH : Ekstrak etanol daun cincau hijau
Lampiran 17. Hasil pengamatan frekuensi diare setelah pemberian oleum ricini
Perlakuan Diameter serapan
Perlakuan Hewan Jumlah Rata-rata
EEDCH : Ekstrak etanol daun cincau hijau
Lampiran 18. Hasil pengamatan lama terjadinya diare setelah pemberian oleum ricinis
Keterangan:
OR : Oleum ricini
EEDCH :Ekstrak Etanol Daun Cincau Hijau
Lampiran 25. Hasil Analisis Statistik Duncan
Saat mulai terjadinya diare
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
Konsistensi feses (diameter serapan air) berlendir
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 5,000.
diameter
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
normal
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 5,000.
Berlendir
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
lembek
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
berat
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 5,000.
Frekuensi diare
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
Lamaterjadidiare
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
Waktu diare
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
waktu
Duncana
kelompok N
Subset for alpha = 0.05
1 2 3
dosis150 5 164.500
dosis100 5 175.400
loperamid 5 177.700
dosis50 5 213.240
CMC 5 249.040
Sig. .405 1.000 1.000
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
normal
waktu
Duncana
kelompok N
Subset for alpha = 0.05
1 2 3
dosis150 5 214.400
loperamid 5 270.000
dosis100 5 282.000
dosis50 5 334.800
CMC 5 349.400
Sig. 1.000 .234 .151
DAFTAR PUSTAKA
Ahmadu, A.A. (2007). Anti-Diarrheal Activity of the Leaf Extracts of Daniella oliveri. Afcrican Journal of Traditional, Complementary and Alternative Medicines. 4(4): 524.
Anief, M. (1999). Ilmu Meracik Obat, Teori Dan Praktik. Yogyakarta: Gadjah Mada University Press. Halaman 107,169.
Budi, N., Nugroho., dan Sundari, Dian. (2006). Efek Antidiare Jus Temu Putih (Curcuma zedoaria Rosc.) dan Temu Mangga (Curcuma mangga Val. Et. Zipp.) pada Tikus Putih. Media Litbang Kesehatan. 1(16): 29-34.
Budiarti, S. (1997). Attachment to the Hep-2 cells and diversity of Escherichia coli serotype O isolates enterophatogenic Indonesia. Jurnal Berkala Ilmu Kedokteran. 4(29): 106.
Clinton, C.N.D. (2009). Plant tannins: A novel approach to the treatment of ulcerative colitis. Natural Medicine Journal. 2(13): 1-3.
Depkes RI. (1979). Materia Medika Indonesia. Jilid III. Jakarta: Departemen Kesehatan RI. Halaman 155-171.
Depkes RI. (1995). Materia Medika Indonesia. Edisi Keenam. Jakarta: Departemen Kesehatan RI. Halaman 300-306, 323-325.
Depkes RI. (1995). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan RI. Halaman 9,33,649,696.
Di Carlo, G., Autore, G., Izzo, A.A., Maiolino, P., Mascolo, N., Viola, P., Diurno, M.V., dan Capasso, F. (1993). Inhibition of Intestinal Motility and Secretory by Flavonoids in Mice and Rats: Structure Activity Relationships. Journal of Pharmacy and Pharmacology. 45(12): 1054-1059.
Farnsworth, N.R. (1966). Biologycal and Phytochemical Screening of Plants. Journal of Pharmaceutical Science. 55(3): 262-264.
Fauci, A.S. (2008). Harrison’s principle of internal medicine. Edisi XVII. USA: Mc Graw Hill. Halaman 249-250.
Goodman, S.L., dan Gilman, A. (1996). The Pharmacological Basis of Therapeutics. Edisi kesembilan. USA: Mc Graw-Hill. Halaman 927.
Harbone, J.B. (1987). Metode Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan. Penerjemah Kosasih Padmawinata. Edisi Kedua. Bandung: ITB Press. Halaman 147-148, 281.
Harmida, Vivin, F.Y., dan Sarno. (2011). Studi Etnofitomedika di Desa Lawang Agung Kecamatan Mulak Ulu Kabupaten Lahat Sumatera Selatan. Jurnal Penelitian Sains. 14(1): 14, 110.
Ikawati, Z. (2008). Pengantar Farmakologi Molekuler. Yogyakarta: Gadjah Mada University Press. Halaman 50, 78-81.
Jeejeebhoy, K. N. (1977). Symposium on Diarrhea Definition and Mechanisms of diarrhea. Scientific Section. CMA Journal. 24(116): 737-739.
Kumar, R. (1983) Chemical and Biochemical Nature of Fodder Tree Tannins. Journal of Agricultural and Food Chemistry. 31(17): 1364-1366.
Lutterodt, G.D. (1989). Inhibition of Gastrointestinal Release of Acetylcholine by Quercetin as a Possible Mode of Action of Psidium guajava leaf Extracts in the Treatment of Acute Diarrhea Disease. Journal Ethnopharmacology. 8(23): 235-247.
McPhee, S.J., Papadakis, M.A. (2007). Current Medical Diagnosis & Treatment. Edisi XLVI. USA: Mc Graw Hill. Halaman 559-560.
Nurdjanah, N. dan Christina, W. (2005). Peluang Tanaman Rempah dan Obat Sebagai Sumber Pangan Fungsional. Jurnal Litbang Pertanian. 24(2): 47-55.
Otshudi, L.A., Vercruysse, A., dan Foriers A. (2000). Contribution to the Ethnobotanical, Phytochemical and Pharmacological Studies of Traditionally Used Medicinal Plant in the Treatment of Dysentery and Diarrhea in Lomela Area, Democratic Republik of Congo (DRC), Journal of Ethnopharmacology. 71(3): 411-23.
Prasetyo, D., dan Fadlyana, E. (2004). Hubungan Antara Pemberian Air Susu Ibu dan Kejadian Diare pada Masa Bayi. Majalah Kedokteran Bandung. 2(36): 3.
Robert, M.K., dan Nelson, W.E. (2007). Nelson textbook of pediatrics.Edisi XVIII. Philadelphia: Sauders. Halaman 1613-1616.
Sari., L.O.R.K. (2006). Pemanfaatan Obat Tradisional Dengan Pertimbangan Manfaat dan Keamanan. Majalah Ilmu Kefarmasian. 3(1): 1-7.
Tjay, H.T., dan Rahardja, K. (2007) Obat-Obat Penting, Khasiat, Penggunaan dan Efek Sampingnya, Edisi Keempat. Jakarta: PT. Elex Media Computindo. Halaman 288-289, 296-297.
WHO. (1992). Quality Control Methods For Medical Plant Materials. Geneva: World Health Organization. Halaman 31-33.
BAB III
METODE PENELITIAN
Penelitian ini dilakukan secara eksperimental berdasarkan Rancangan Acak Lengkap (RAL). Penelitian meliputi pengumpulan sampel, identifikasi sampel, pengolahan sampel, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak, penyiapan hewan percobaan, dan pengujian efek antidiare secara oral pada tikus. Data hasil penelitian dianalisis secara ANAVA (analisis variansi) dan dilanjutkan dengan uji beda rata-rata Duncan menggunakan program SPSS versi 17.
3.1 Alat dan Bahan 3.1.1 Alat
Alat-alat gelas, pisau, lemari pengering, seperangkat alat maserasi, seperangkat alat destilasi, oven listrik (Fischer scientific), neraca hewan (Presica Geniweigher GW-1500), neraca listrik (Vibra AJ), ayakan, pipet tetes, desikator (Fischer Scientific), mortir dan stamper, krus porselin, kaca objek (object glass), kaca penutup (deck glass), rotary evaporator, blender (National), cawan porselen, cawan porselen berdasar rata, alumunium foil, kertas saring, spatula, stopwatch, kandang hewan, oral sonde, pot plastik, wadah pengamatan.
3.1.2 Bahan
asetat anhidrat, asam asetat pekat, natrium klorida, kalium iodida, iodium, α -naftol, asam nitrat, bismuth nitrat, etil asetat, isopropanol, natrium sulfat anhidrat, serbuk seng, serbuk magnesium, metanol, eter, etanol 96 %, air suling.
3.2 Pembuatan Pereaksi 3.2.1 Pereaksi mayer
Dilarutkan 1,36 g raksa (II) klorida P dalam 60 ml air, tambahkan pada larutan 5 g larutan kalium iodida P dalam 10 ml air, dilarutkan dalam air suling hingga 100 ml (Depkes RI, 1995).
3.2.2 Pereaksi dragendroff
Dilarutkan 8 g bismuth nitrat P dilarutkan asam nitrat 20 ml kemudian dicampur dengan larutan kalium iodida 27,2 g dalam 50 ml air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih diambil dan diencerkan dengan air secukupnya hingga 100 ml (Depkes RI, 1995).
3.2.3 Pereaksi bouchardat
Dilarutkan 2 g iodium P dan 4 g kalium iodida P dalam air secukupnya hingga diperoleh 100 ml larutan (Depkes RI, 1995).
3.2.4 Pereaksi molish
Dilarutkan 3 g α-naftol dalam asam nitrat 0,5 N secukupnya hingga
diperoleh 100 ml larutan (Depkes RI, 1995). 3.2.5 Larutan pereaksi besi (III) klorida 1%
Dilarutkan 1 g besi (III) klorida dalam air suling hingga diperoleh 100 ml larutan kemudian disaring (Depkes RI, 1995).
Dilarutkan 15,17 g timbal (II) asetat dengan air suling bebas CO2 hingga diperoleh 100 ml larutan (Depkes RI, 1995).
3.2.7 Larutan pereaksi natrium hidroksida 2 N
Dilarutkan 8,001 g natrium hidroksida dalam air suling hingga diperoleh 100 ml larutan (Depkes RI, 1995).
3.2.8 Larutan pereaksi kloralhidrat
Dilarutkan 50 g kloralhidrat P dalam 20 ml air (Depkes RI, 1995). 3.2.9 Larutan pereaksi asam sulfat 2 N
Sebanyak 10 ml asam sulfat pekat diencerkan dengan air suling hingga diperoleh 100 ml larutan (Depkes RI, 1979).
3.2.10 Larutan pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling hingga diperoleh 100 ml larutan (Depkes RI, 1979).
3.3 Pengumpulan dan Pengolahan Sampel 3.3.1 Pengumpulan sampel
3.3.2 Identifikasi sampel
Determinasi sampel dilakukan di Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
3.3.3 Pengolahan tumbuhan
Sampel yang digunakan pada penelitian ini adalah daun cincau hijau yang masih segar. Daun dicuci sampai bersih dan ditiriskan, kemudian ditimbang sebagai berat basah. Daun kemudian dikeringkan pada lemari pengering pada temperatur ± 40oC hingga kering. Setelah kering, simplisia diserbuk hingga halus menggunakan blender. Disimpan dalam wadah plastik yang tertutup rapat.
3.4 Pemeriksaan Karakteristik
Dilakukan pemeriksaan karakteristik simplisiadaun cincau hijau yang meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu yang tidak larut dalam asam (Depkes RI, 1995; WHO, 1992).
3.4.1 Makroskopik
Pemeriksaan makroskopik dilakukan terhadap simplisia daun cincau hijau meliputi bentuk, bau, warna dan rasa.
3.4.2 Mikroskopik
3.4.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alat terdiri dari alas bulat 500 ml, alat penampung, pendingin, tabung penyambung, dan tabung penerima 10 ml.
a. Penjenuhan toluen
Sebanyak 200 ml toluena dan 2 ml air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air
Ke dalam labu tersebut dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
3.4.4 Penetapan kadar sari larut air
kemudian disaring. Diuapkan 20 ml filtrat sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.4.5 Penetapan kadar sari larut etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring, 20 ml filtrat diuapkan sampai kering dalam cawan berdasar rata yang telah ditara dan sisanya dipanaskan pada suhu 105oC sampai bobot tetap. Kadar sari larut dalam etanol dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.6 Penetapan kadar abu total
Sebanyak 2 g serbuk simplisia ditimbang seksama dimasukkan dalam krus platina atau krus silikat yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 600oC selama 3 jam. Kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.4.7 Penetapan kadar abu tidak larut asam
ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bobot yang dikeringkan di udara (Depkes RI, 1995).
3.5 Skrining Fitokimia
Skrining fitokimia serbuk simplisia daun cincau hijau meliputi: pemeriksaan senyawa golongan alkaloid, flavonoid, glikosida, tanin, saponin dan steroid/triterpenoid (Depkes RI, 1995).
3.5.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloida: diambil 3 tabung reaksi, lalu kedalamnya dimasukkan 0,5 ml filtrat.
Pada masing-masing tabung reaksi; 1. ditambahkan 2 tetes pereaksi Mayer 2. ditambahkan 2 tetes pereaksi Bouchardat 3. ditambahkan 2 tetes pereaksi Dragendorff
Alkaloida positif jika terjadi endapan atau kekeruhkan pada paling sedikit dua dari tiga percobaan diatas (Depkes RI, 1995).
3.5.2 Pemeriksaan flavonoid
3.5.3 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g, lalu disari dengan 30 ml campuran etanol 95% dengan air (7:3) dan 10 ml asam klorida 2 N, direfluks selama 2 jam, didinginkan dan disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Sari air dikumpulkan dan diuapkan pada temperatur tidak lebih dari 50٥C. Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut: 0,1 ml larutan percobaan dimasukan dalam tabung reaksi dan diuapkan diatas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish. Kemudian secara perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung, terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan ikatan gula (Depkes RI, 1995).
3.5.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau hijau kehitaman menunjukkan adanya tanin (Harbone, 1987). 3.5.5 Pemeriksaan saponin
3.5.6 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama 2 jam, disaring, filtrat diuapkan dalam cawan penguap dan pada sisanya ditambahkan 2 tetes pereaksi Lieberman-Bourchard. Apabila terbentuk warna ungu atau merah yang berubah menjadi biru atau biru hijau menunjukkan adanya steroid/triterpenoid (Depkes RI, 1995).
3.6 Pembuatan Ekstrak Etanol Daun Cincau Hijau
Pembuatan ekstrak daun cincau hijau dilakukan secara maserasi menggunakan etanol 96% (Depkes RI, 1979).
Cara kerja:
Sebanyak 500 g serbuk simplisia daun cincau hijau dimasukkan ke dalam wadah kaca berwarna gelap, kemudian dituangi dengan 1500 ml etanol 96%. Ditutup dan dibiarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, diserkai dan diperas. Ampas dicuci dengan 1500 ml etanol 96%, dipindahkan ke dalam bejana tertutup, dibiarkan di tempat sejuk, terlindung dari cahaya selama 2 hari, selanjutnya disaring. Maserat etanol yang diperoleh diuapkan dengan menggunakan rotary evaporator pada temperatur ± 40oC sampai diperoleh ekstrak kental (Depkes RI, 1979).
3.7 Percobaan Efek Antidiare
3.7.1 Penyiapan hewan coba
Hewan percobaan yang digunakan adalah tikus jantan putih dengan berat badan 160-200 g sebanyak 25 ekor, dibagi dalam 5 kelompok dimana setiap kelompok terdiri dari 5 ekor tikus.
Dua minggu sebelum pengujian dilakukan hewan percobaan harus dipelihara dan dirawat dengan sebaik-baiknya pada kandang yang mempunyai ventilasi baik dan selalu dijaga kebersihannya. Hewan yang sehat ditandai dengan pertumbuhan normal dan suhu badan normal (Depkes RI, 1979).
3.7.2 Penyiapan bahan
Bahan yang digunakan meliputi suspensi CMC Na sebagai kontrol, suspensi Loperamid HCl (Imodium®) sebagai pembanding, suspensi ekstrak etanol daun cincau hijau sebagai bahan uji dan oleum ricini sebagai induktor diare.
3.7.2.1 Pembuatan suspensi CMC Na 1% (b/v)
Sebanyak 1 g CMC Na ditaburkan kedalam lumpang yang berisi air suling panas sebanyak 20 ml, ditutup dan dibiarkan selama 30 menit hingga diperoleh massa yang transparan, digerus lalu diencerkan dengan air suling hingga 100 ml (Anief M, 1999).
3.7.2.2 Pembuatan suspensi Loperamid HCl dari tablet Imodium®
Tablet Imodium mengandung 2 mg Loperamid HCl, ditimbang sebanyak 20
tablet. Tablet digerus dan diambil serbuk sebanyak 28,15 mg. Serbuk dimasukkan
kedalam lumpang, kemudian ditambahkan suspensi CMC 1% sedikit demi sedikit
sambil digerus homogen lalu diencerkan dengan suspensi CMC 1% hingga 25 ml
3.7.2.3 Pembuatan suspensi Ekstrak Etanol Daun Cincau Hijau konsentrasi 4% (b/v)
Ekstrak etanol daun cincau ditimbang sebanyak 1 g, kemudian digerus di dalam lumpang, lalu ditambahkan CMC Na 1% sedikit demi sedikit lalu diencerkan dengan CMC Na1% sampai 25 ml.
3.7.3 Pengujian efek antidiare
Dosis ekstrak etanol daun cincau hijau ditentukan berdasarkan orientasi pada hewan percobaan terhadap parameternya. Dosis yang digunakan yaitu dosis, 25, 50, 75, 100, 125, 150 mg/kg bb. Hasil orientasi dipilih variasi dosis sebanyak tiga dosis. Dosis I 50 mg/kg bb, dosis II 100 mg/kg bb dan dosis III 150 mg/kg bb. Sebagai pembanding suspensi Loperamid HCl dosis 1 mg/kg bb dan kontrol suspensi CMC Na1%.
Tikus yang telah dipuasakan 18 jam sebelum penelitian, dikelompokkan menjadi 5 kelompok dan kemudian diberikan oleum ricini sebanyak 2 ml setiap ekornya (Budi, et.al., 2006). Satu jam setelah pemberian oleum ricini masing-masing kelompok diberi perlakuan yaitu kelompok kontrol diberikan suspensi CMC dosis 1% bb, kelompok pembanding diberikan suspensi Loperamid HCl dosis 1 mg/kg bb dan kelompok bahan uji diberikan suspensi EEDCH yang terdiri dari tiga dosis yaitu 50, 100 dan 150 mg/kg bb,lalu tikus ditempatkan dalam wadah pengamatan. Pengamatan dimulai 30 menit setelah pemberian oleum ricini dilakukan selama 6 jam. Parameter yang diamati meliputi saat mulai terjadi defekasi, lama terjadinya defekasi, konsistensi feses dan frekuensi defekasi.
tikus mulai diare dengan konsistensi berlendir sampai konsitensi kembali normal. Konsistensi feses dibagi tiga kelompok yaitu : berlendir, lembek dan normal. Ketiga kelompok tersebut ditentukan dengan melihat diameter dan berat feses. Frekuensi feses ditentukan dengan menghitung jumlah total diare selama waktu pengamatan (Winda, 2010).
3.8 Pengumpulan Data
Data yang diperoleh kemudian dirata-ratakan untuk masing-masing kelompok dan nilai dari masing-masing kelompok tersebut dibandingkan.
3.9 Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Sampel
Identifikasi sampel yang dilakukan di Herbarium Bogoriense, Bidang Botani Pusat, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor menunjukkan bahwa sampel adalah benar daun cincau hijau (Cyclea barbata L.Mier). Hasil identifikasi sampel dapat dilihat pada Lampiran 1 halaman
37.
4.2 Hasil Karakterisasi Simplisia 4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik simplisia daun cincau hijau adalah daun berwarna hijau kecoklatan berbentuk jantung, panjang daun 5,5 cm sampai 9 cm,lebar daun 5,5 cm sampai 9,5 cm. Ujung daun runcing, tepi daun tidak rata, berambut halus, pangkal daun tumpul, tangkai daun panjang nya 2,5 cm sampai 4,5 cm.
4.2.2 Pemeriksaan mikroskopik
banyak rongga udara. Berkas pembuluh tipe korateral. Pada epidermis bawah terdapat stomata tipe anomositik.
4.2.3 Pemeriksaan karakteristik
Karakteristik serbuk simplisia daun cincau hijau yang diperoleh dapat dilihat pada Tabel 4.1, dan hasil perhitungan karakterisasi dapat dilihat pada Lampiran 5 halaman .
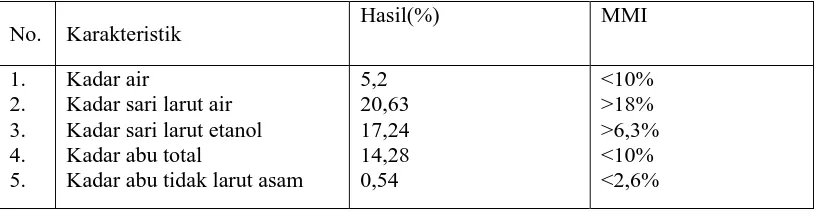
Tabel 4.1 Hasil karakterisasi serbuk simplisia dan ekstrak etanol daun cincau hijau
Berdasarkan hasil pada tabel di atas, karakteristik simplisia daun cincau hijau memenuhi persyaratan umum pada Materia Medika Indonesia (MMI).
Tujuan dari penetapan kadar air adalah untuk mengetahui besarnya kandungan air dalam simplisia. Hal ini terkait dengan kemurnian dan adanya kontaminan dalam simplisia tersebut. Penghilangan kadar air hingga jumlah tertentu berguna untuk memperpanjang daya tahan selama penyimpanan. Penetapan kadar sari larut air dilakukan untuk mengetahui banyaknya sari larut dalam pelarut air. Senyawa-senyawa yang dapat larut dalam air adalah glikosida, gula, gom, protein, enzim, zat warna, dan asam organik. Penetapan kadar sari larut etanol digunakan untuk mengetahui banyaknya sari terlarut dalam pelarut polar. Senyawa-senyawa yang dapat larut dalam etanol adalah glikosida, steroida, flavonoida, klorofil, dan dalam jumlah sedikit yang larut yaitu lemak. Penetapan
No. Karakteristik Hasil(%) MMI
Kadar sari larut air Kadar sari larut etanol Kadar abu total
Kadar abu tidak larut asam
kadar abu merupakan cara untuk mengetahui sisa yang tidak menguap dari suatu simplisia pada pembakaran. Pada penetapan kadar abu total, abu dapat berasal dari bagian jaringan tanaman sendiri atau pengotor lain misalnya pasir atau tanah. (Depkes RI, 1979).
4.3 Hasil Skrining Fitokimia
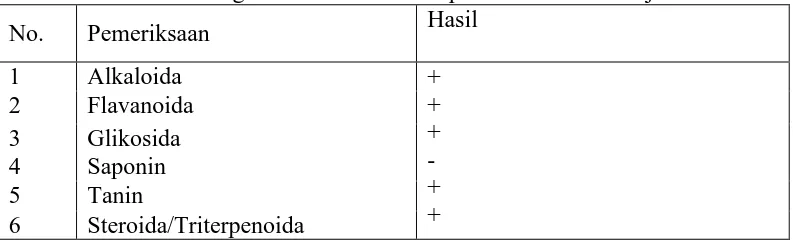
Skrining fitokimia dilakukan terhadap serbuk simplisia daun cincau hijau yang hasilnya menunjukkan bahwa daun cincau hijau mengandung senyawa kimia golongan flavanoida, glikosida, tanin dan triterpenoid.
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia daun cincau hijau
No. Pemeriksaan Hasil
1 Alkaloida +
(+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
4.4 Hasil Pengujian Efek Antidiare
tidak digunakan dalam penelitian karena tidak memberikan efek yang signifikan terhadap penurunan diare.
Tikus yang telah dipuasakan 18 jam sebelum penelitian, dikelompokkan menjadi 5 kelompok dan kemudian diberikan oleum ricini sebanyak 2 ml setiap ekornya. Satu jam setelah pemberian oleum ricini masing-masing kelompok diberi perlakuan yaitu kelompok kontrol diberikan suspensi CMC dosis 1% bb, kelompok pembanding diberikan suspensi Loperamid HCl dosis 1 mg/kg bb dan kelompok bahan uji diberikan suspensi EEDCH yang terdiri dari tiga dosis yaitu 50, 100 dan 150 mg/kg bb. Penentuan efek antidiare dari ekstrak etanol daun cincau hijau dilakukan dengan cara mengamati saat mulai terjadinya diare, konsistensi feses, frekuensi diare dan lama terjadinya diare.
4.4.1 Penentuan saat mulai terjadinya diare
Saat mulai terjadi diare diamati setelah pemberian EEDCH dan feses keluar dengan konsistensi berlendir. Hubungan antara dosis dan rata-rata waktu mulai terjadinya diare pada hewan uji setelah pemberian EEDCH sebagai antidiare dapat dilihat pada Tabel 4.3.
Tabel 4.3 Hasil data saat mulai terjadinya diare
Keterangan:
OR : Oleum Ricini
EEDCH : Ekstrak Etanol Daun Cincau Hijau
Kel Perlakuan Saat mulai terjadinya diare (menit ke-)±SD
1 OR + CMC 1% bb 57 ± 2,0
2 OR + Loperamid. 1 mg/kg bb 99 ± 13,93
3 OR + EEDCH50 mg/kg bb 64,8 ± 13,03
4 OR + EEDCH 100 mg/kg bb 99,8 ± 15,39
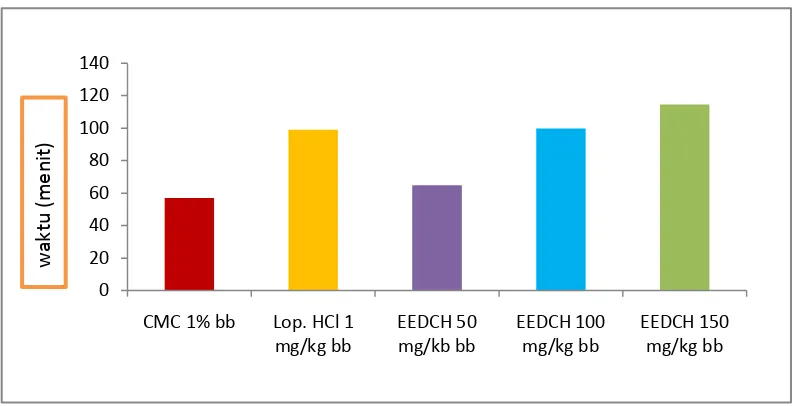
Pada pemberian CMC diperoleh waktu saat mulai diare pada menit 57±2,0, namun setelah pemberian EEDCH dengan dosis yang bervariasi terlihat adanya perubahan waktu mulai terjadinya diare. Hal ini memperlihatkan bahwa EEDCH dosis 150 mg/kg bb (114,6 ± 4,83) memiliki waktu mulai terjadi diare paling la1ma dibandingkan dengan EEDCH dosis 100 mg/kg bb (99,8 ± 15,39) dan dosis 50 mg/kg bb (64,8 ± 13,03). Grafik saat mulai terjadi diare dapat dilihat pada gambar 4.1 di bawah ini:
Gambar 4.1 Grafik saat mulai terjadi diare
Dari Gambar 4.1 dapat dilihat perbedaan grafik dari masing-masing kelompok perlakuan. Pemberian loperamid HCl dosis 1 mg/kg bb menyebabkan perubahan waktu yang sangat berarti yaitu pada menit 99 ± 13,93, sehingga waktu mulai terjadinya diare lebih lama dibanding dengan EEDCH dosis 50 dan 100 mg/kg bb. Berdasarkan uji statistik ANAVA (P < 0,05) dilanjutkan uji beda rata-rata Duncan, EEDCH dosis 100 mg/kg bb tidak berbeda signifikan dengan loperamid HCl dosis 1 mg/kg bb, tetapi berbeda signifikan terhadap kelompok dosis 150 mg/kg bb. Sedangkan jika dibandingkan dengan kelompok kontrol, semua kelompok EEDCH memberikan perbedaan yang signifikan (P > 0,05).
Sampel uji dinyatakan memiliki efek antidiare, jika waktu mulai terjadi diare yang diperoleh lebih lama daripada kontrol dan semakin cepat terjadinya diare maka efek antidiare akan semakin lemah. Hasil penentuan saat mulai terjadinya diare dapat dilihat pada analisis Duncan Lampiran 24 halaman .
4.4.2 Penentuan konsistensi feses
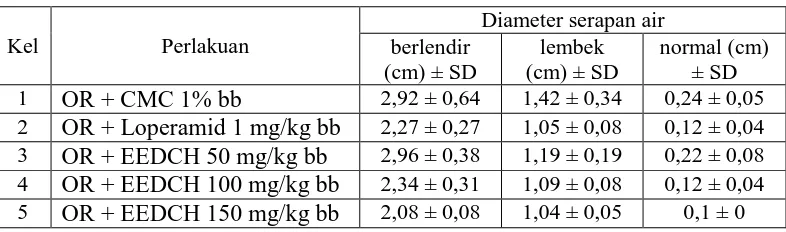
Penentuan konsistensi feses dilakukan dengan cara melihat bentuk feses yang terjadi, dapat dikategorikan ke dalam tiga kelompok yaitu konsistensi berlendir (BL) dengan diameter serapan air lebih besar dari 2 cm, konsistensi lembek (L) dengan diameter serapan air antara 1-2 cm dan konsistensi normal (N) dengan diameter serapan air lebih kecil dari 1 cm (Winda, 2010).
Tabel 4.4 Hasil data diameter serapan air
Tabel 4.5 Hasil data berat feses
Keterangan:
OR : Oleum Ricini
EEDCH : Ekstrak Etanol Daun Cincau Hijau
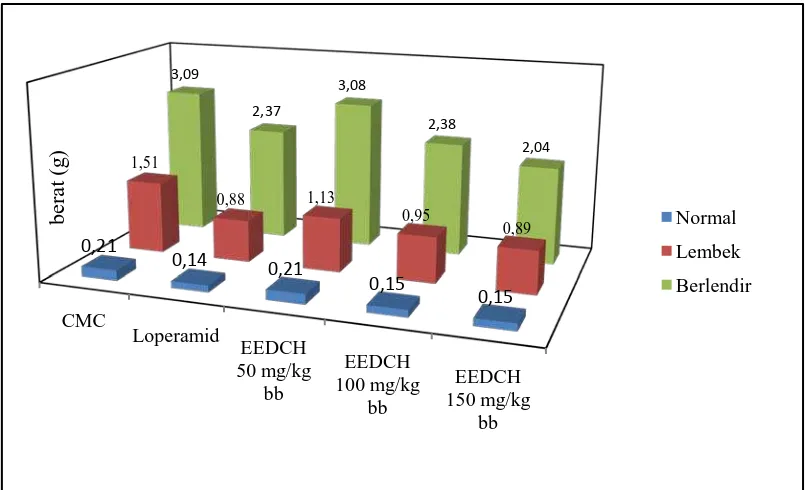
Gambar 4.2 Grafik konsistensi feses
Pada Tabel 4.4, 4.5 dan Gambar 4.2 diatas dapat dilihat hubungan antara dosis, diameter serapan air dan berat feses hewan uji setelah pemberian EEDCH seperti yang terlihat pada Lampiran 15 halaman .
Berdasarkan hasil analisis statistik ANAVA (P < 0,05) dilanjutkan uji beda rata-rata Duncan konsistensi feses berlendir, diameter serapan air yang dihasilkan dosis 150 mg/kg bb, 100 mg/kg bb serta kelompok pembanding memiliki efek berbeda signifikan (P > 0,05) terhadap kelompok dosis 50 mg/kg bb dan kelompok kontrol. Tidak ada perbedaan yang signifikan antara kelompok kontrol dan dosis 50 mg/kg bb. Sedangkan pada berat feses yang dihasilkan kelompok dosis 150 mg/kg bb berbeda signifikan (P > 0,05) dengan masing-masing kelompok.
Pada uji beda rata-rata Duncan feses lembek, diameter serapan air dan berat feses yang dihasilkan kelompok kontrol berbeda signifikan terhadap semua kelompok EEDCH dan pembanding. Sedangkan diameter serapan air dan berat
feses kelompok dosis150 mg/kg bb, dosis 100 mg/kg bb dan kelompok pembanding tidak berbeda signifikan.
Hasil uji Duncan feses normal, diameter serapan air yang dihasilkan kelompok kontrol dan dosis 50 mg/kg bb berbeda signifikan terhadap kelompok pembanding, dosis 100 mg/kg bb dan 150 mg/kg bb. Dilihat dari berat feses yang dihasilkan, antara kelompok pembanding, dosis 100 dan 150 mg/kg bb tidak berbeda signifikan, demikian juga antara kelompok dosis 50 dengan kelompok kontrol.
Dari uraian di atas, semakin besar diameter serapan air maka feses yang terbentuk semakin berat maka diare semakin parah dan efek antidiare EEDCH semakin lemah. Hasil penentuan saat mulai terjadinya diare dapat dilihat pada analisis Duncan Lampiran 24 halaman .
EEDCH dosis 150 mg/kg bb dapat membentuk konsistensi feses normal yang berbeda signifikan (P > 0,05) dengan masing-masing kelompok. Dari hasil tersebut dapat disimpulkan bahwa semakin cepat terbentuk konsistensi feses normal, maka semakin kuat efek anti diare yang dimilikinya.
4.4.3 Penentuan frekuensi diare
Frekuensi diare ditentukan dengan menghitung jumlah total diare tikus selama waktu pengamatan.
Tabel 4.6 Hasil data frekuensi diare
Keterangan:
OR : Oleum Ricini
EEDCH : Ekstrak Daun cincau hijau
Hasil pengujian EEDCH menunjukkan adanya perbedaan yang nyata (P > 0,05) terhadap frekuensi diare bila dibandingkan dengan frekuensi yang dihasilkan oleh kelompok kontrol (7,0 ± 0,00 kali). Pemberian dosis 100 mg/kg bb menyebabkan penurunan frekuensi diare (3,20 ± 0,45 kali) yang sebanding dengan kelompok pembanding (3,40 ± 0,55 kali) lebih sedikit daripada kelompok dosis 50 mg/kg bb (5,60 ± 0,89 kali) dan dengan pemberian dosis 150 mg/kg bb frekuensi diare yang ditimbulkan lebih sedikit daripada kelompok pembanding yaitu 2,40 ± 0,55. Grafik frekuensi diare dapat dilihat pada Gambar 4.3 di bawah ini:
Gambar 4.3 Grafik frekuensi diare
Berdasarkan hasil analisis statistik ANAVA (P < 0,05) dilanjutkan uji beda rata-rata Duncan frekuensi diare menunjukkan bahwa kelompok kontrol berbeda signifikan dengan masing-masing kelompok, sedangkan antara kelompok pembanding dan dosis 100 mg/kg bb tidak berbeda secara signifikan Hasil penentuan saat mulai terjadinya diare dapat dilihat pada analisis Duncan Lampiran 24 halaman .
7
CMC Loperamid Dosis 50 Dosis 100 Dosis 150
4.4.4 Penentuan lama terjadinya diare
Lama terjadinya diare ditentukan dari saat tikus mulai diare dengan konsistensi berlendir sampai kembali membentuk feses dengan konsistensi normal.
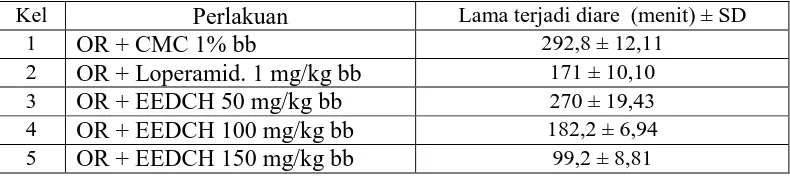
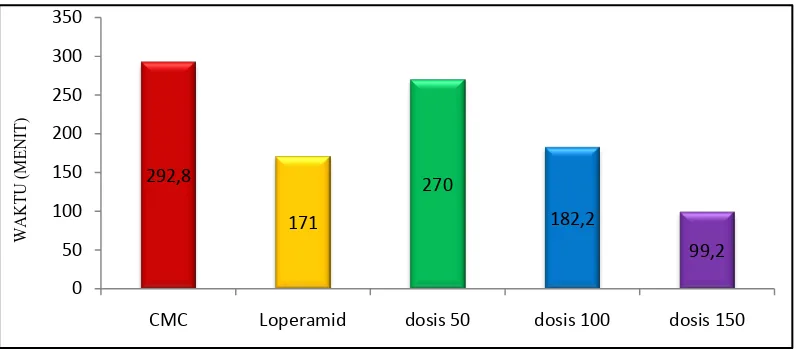
Tabel 4.7 Hasil data lama terjadinya diare
Keterangan:
OR : Oleum Ricini
EEDCH : Ekstrak Etanol Daun Cincau Hijau
Pada Tabel 4.7 dan Gambar 4.4, terlihat hubungan antara dosis dengan lama terjadinya diare pada hewan uji setelah pemberian EEDCH seperti yang terlihat pada Lampiran .
Pemberian oleum ricini dan CMC menghasilkan lama terjadi diare 292,8 ± 12,11 menit, namun setelah pemberian EEDCH dengan dosis yang bervariasi mengakibatkan waktu lama terjadinya diare menjadi berkurang. EEDCH dosis 150 mg/kg bb (99,2 ± 8,81 menit) memiliki waktu lama terjadi diare tersingkat jika dibandingkan kelompok dosis 50 mg/kg bb (270 ± 19,43 menit), dosis 100 mg/kg bb (182,2 ± 6,94 menit) dan kelompok pembanding (292,8 ± 12,11 menit). Grafik waktu lama terjadinya diare dapat dilihat pada Gambar 4.4 di bawah ini:
Kel Perlakuan Lama terjadi diare (menit) ± SD
1 OR + CMC 1% bb 292,8 ± 12,11
2 OR + Loperamid. 1 mg/kg bb 171 ± 10,10
3 OR + EEDCH 50 mg/kg bb 270 ± 19,43
4 OR + EEDCH 100 mg/kg bb 182,2 ± 6,94
Gambar 4.4 Grafik lama terjadi diare
Dari hasil analisis statistik ANAVA (P < 0,05) dilanjutkan uji beda rata-rata Duncan lama terjadinya diare menunjukkan bahwa kelompokdosis 150 mg/kg bb berbeda signifikan (P > 0,05) terhadap masing-masing kelompok sedangkan kelompok kontrol dan dosis 50 mg/kg tidak berbeda secara signifikan. Efek yang ditimbulkan kelompok dosis 100 mg/kg bb dengan pembanding juga tidak berbeda signifikan. Semakin singkat waktu terjadinya diare maka semakin kuat efek antidiare yang dimiliki. Hasil penentuan saat mulai terjadinya diare dapat dilihat pada analisis Duncan Lampiran 24 halaman .
Dari parameter yang telah diamati, efek antidiare dosis 50mg/kg bb mempunyai efektivitas yang lebih lemah dibanding kelompok kontrol lemah (Gambar 4.4); dosis 100 mg/kg bb mempunyai efektifitas yang sebanding atau sama dengan pembanding (Gambar 4.3); dosis 150mg/kg bb (Gambar 4.1) mempunyai efek yang lebih kuat daripada pembanding.
Hasil penelitian terdahulu melaporkan bahwa kandungan senyawa aktif dari beberapa tanaman obat seperti golongan tanin, flavonoid, alkaloid, saponin dan steroid/triterpenoid memiliki khasiat antidiare. Beberapa senyawa turunan
292,8
CMC Loperamid dosis 50 dosis 100 dosis 150
tanin dan flavonoid memiliki aktivitas sebagai antimotilitas, antisekretori dan antibakteri (Otshudi, et.al., 2000). Berdasarkan skrining fitokimia yang dilakukan menunjukkan bahwa daun cincau hijau mengandung tanin. Diduga tanin di dalam sampel inilah yang memberikan aktivitas antidiare. Tanin dapat mengurangi intensitas diare dengan cara menciutkan selaput lendir usus dan mengecilkan pori sehingga akan menghambat sekresi cairan dan elektrolit (Tjay dan Rahardja, 2002). Selain itu, sifat adstringen tanin akan membuat usus halus lebih tahan (resisten) terhadap rangsangan senyawa kimia (toksin bakteri dan castor oil ) yang mengakibatkan diare (Kumar, 1983).
Beberapa penelitian juga telah melaporkan mengenai flavonoid sebagai antidiare. Mekanisme flavonoid dalam menghentikan diare yang diinduksi oleh castor oil adalah dengan menghambat motilitas usus sehingga mengurangi sekresi
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa:
1. Hasil pemeriksaan karakteristik serbuk simplisia daun cincau hijau memenuhi syarat MMI dimana kadar air 5,2%, kadar sari larut air 20,63%, kadar sari larut etanol 17,24%, kadar abu total 14,28% dan kadar abu tidak larut asam 0,54%. Hasil skrining fitokimia menunjukkan serbuk simplisia daun cincau hijau mengandung senyawa kimia golongan alkaloida, flavanoida, glikosida, tanin, steroida/triterpenoida.
2. Ekstrak etanol daun cincau hijau dosis 50, 100, dan 150 mg/kg bb mempunyai efek sebagai antidiare yang diberikan pada tikus yang diinduksi dengan oleum ricini menggunakan metode defekasi. Pemberian dosis 100 mg/kg bb menunjukkan efek yang setara dengan obat pembanding loperamid HCl dosis 1 mg/kg bb.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Di IndonesiacincauhijauyangbernamalatinCycleabarbataMiers banyak ditemui di berbagai tempat, mulai dari pasar tradisional sampaisupermarket.Di beberapadaerah,tanamaninidikenaldengan
namacamcao(Jawa),camcauh(Sunda),juju, kepleng,krotok,tahulu, tarawalu,telor,terungkemau(Melayu).Bagi masyarakatIndonesia cincau hijau dikonsumsi sebagai campuran minuman yang menyegarkan.Ada empatjeniscincauyangdikenalmasyarakat,yaitu cincau hijau, cincau hitam dan cincau minyak serta cincau perdu. Bentukfisikkeempattanamanini sangatberbedasatusamalainnya.
NamunmasyarakatIndonesiaamatmenggemarijeniscincauhijau,hal ini karenafisikdauncincauhijautipisdanlemassehinggalebihmudah diremas untukdijadikan gelatinatauagar-agar. Aromacincauhijau tidak langu. Cincau hijau yang berbentuk agar-agar berasal dari daunnyayangdiremas-remasdandicampurairmatang.Aircampuran
ituakanberwarnahijau.Setelahdisaringdandibiarkanmengendap, akan menghasilkan lapisan agar-agar berwarna hijau (Heny dan Dian, 2004).
2.1.1 Sistematika tumbuhan
Kingdom
Kelas : Dicotyledoneae
Ordo : Ranales
Famili : Menispermae Genus : Cyclea
Spesies :Cyclea barbata L. Miers (Heyne,1987).
2.1.2 Morfologi tumbuhan
Batang tanaman ini bulat, berdiameter ± 1 cm dan merambatkearahkananpadapohoninangsertatinggi/panjang ± 5-16 m. Bentuk daunnya seperti perisai atau jantung, berwarnahijau,bagianpangkalnyaberlekukdan bagiantengah melebar sertaujungnya meruncing. Tepidaunberombak dan permukaan bawahnya berbulu halus,sedang permukaan atasnyaberbulukasardanjarang.Panjangdaunbervariasi±5-16 cmdan bertulangdaunmenjari (Heny dan Dian, 2004)
kelopak yang berbulu. Benangsari mempunyaisatutangkaidengankepalasari bergeromboldiujungnya.Setiapkepalasarimempunyaiempat sel yangakanpecahdengansendirinyajika sudahmasak.Buah tanamancincauhijaukecil-kecil,berbentukbulat dan agak berbulu.Setiapbuahmengandung1-2 bijiyangkerasberbentuk bulattelur.Akarcincauhijau dapattumbuhmembesarseperti umbidenganbentuktidakteratur.Dalamkeadaansegar,akar ini berdagingdanmengandungbanyakcairan.Padaakaryang
sudahkering,warnakulitluarnya berubah menjadi coklatke abu-abuan,mempunyaisisir-sisiryang membujur dan terlihatmenonjol (Taryono, 2003).
2.1.3 Kandungan Kimia Tumbuhan
Secaraumumkandungandauncincauhijau adalah karbohidrat, lemak, protein dan senyawa-senyawa lainnya sepertiPolifenol,Flavonoidsertamineral-mineral danvitamin- vitamin,diantaranyaKalsium, Fosfor dan Vitamin A serta Vitamin B (Hatta, 1995)
2.1.4 Kegunaan Kandungan Tumbuhan 2.1.4.1. Polifenol
vitaminCdanvitaminE.Kelompok-kelompoksenyawafenolikterdiridariasam-asam fenolat dan flavonoid.Fenolmerupakanzat antioksidandarigolongan antioksidasipemutusrantaiyang akan memotong perbanyakanreaksi berantaisehinggaakan mengendalikan dan mengurangi peroksidasi lipid manusiadimanaperoksidasilipid merupakanreaksi rantaidenganberbagaiefek
yangberpotensialmerusak danjugamerupakan
sumberradikalbebas.Efekdariradikalbebas adalah perusakanjaringanin vivosehinggamenimbulkan penyakitkanker,proses penuaan,peradangan, aterosklerosisdan lain sebagainya (Raharjo, 2004).
2.1.4.2. Flavanoid
Senyawaflavonoidmempunyaiikatangula yang disebut aglikon yang berikatan dengan berbagai gula dansangatmudahterhidrolisis ataumudahlepasdari gugus gulanya.Flavonoidmerupakanantioksidanyang potensialuntuk mencegahpembentukanradikalbebas. Senyawatersebut mempunyai sifat anti bakteri dananti viral (Raharjo, 2004)
2.1.4.3 Glikosida
2007).
2.1.4.4 Tanin
Tanin terdapat luas dalam tumbuhan berpembuluh, dalam angiospermae terdapat khusus dalam jaringan kayu. Menurut batasannya, tanin dapat bereaksi dengan protein membentuk kopolimer mantap yang tak larut dalam air. Sebagian besar tumbuhan yang banyak bertanin dihindari oleh hewan pemakan tumbuhan karena rasanya yang sepat. Kita menganggap salah satu fungsi utama tanin dalam tumbuhan ialah sebagai penolak hewan pemakan tumbuhan (Robinson, 1995). 2.1.4.5 Steroida/Triterpenoid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isopren dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik, yaitu skualen. Senyawa tersebut mempunyai struktur siklik yang relatif kompleks, kebanyakan merupakan suatu alkohol, aldehid atau asam karboksilat (Harbone, 1987).
2.2 Simplisia dan Ekstrak 2.2.1 Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang belum mengalami pengolahan apapun juga dan kecuali dikatakan lain, berupa bahan yang telah dikeringkan. Simplisia dibedakan simplisia nabati, simplisia hewani dan simplisia pelikan (mineral). Simplisia nabati adalah simplisia yang berupa tumbuhan utuh, bagian tumbuhan atau eksudat tumbuhan (DepKes, 2000). 2.2.2 Ekstrak
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian sehingga memenuhi baku yang telah ditetapkan (DepKes, 2000).
Pembuatan sediaan ekstrak dimaksudkan agar zat berkhasiat yang terdapat di simplisia terdapat dalam bentuk yang mempunyai kadar yang tinggi dan hal ini memudahkan zat berkhasiat dapat diatur dosisnya (Anief, 1999).
Ekstraksi adalah kegiatan penarikan zat aktif dengan menggunakan pelarut yang sesuai. Metode ekstraksi dengan menggunakan pelarut dapat dibagi kedalam dua cara yaitu:
a. Cara dingin, yaitu:
kinetik berarti dilakukan pengadukan yang kontinu (terus-menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
2. Perkolasi, adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction) yang umunya dilakukan pada temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan.
b. Cara Panas
1. Refluks adalah ektraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umunya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
2. Soxhlet, adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik. 3. Digesti, adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40-50oC.
5. Dekok, adalah infus pada waktu yang lebih lama (≥30 oC) dan temperatur sampai titik didih air (DepKes, 2000).
2.3 Uraian Usus Halus
Bagian saluran cerna tempat berlangsungnya pencernaan dan penyerapan makanan adalah usus halus. Usus halus mulai dari pylorus dan berlingkar-lingkar dalam rongga perut sampai ke usus besar. Garis tengah usus halus kira-kira 2,5 cm dan panjangnya sekitar 6,35 m. Secara anatomi usus halus dibagi dalam tiga bagian, yaitu duodenum (kira-kira 25cm), yeyenum (kira-kira 2,5 cm), dan ileum (kira-kira 3,6 m) (Anwar, 2000).
2.3.1 Histologi
Secara histologik, usus halus terdiri atas beberapa lapisan melingkar, berupa lapisan otot (musculus) dan lampisan lender (mukosa). Lapisan yang paling dalam (lapisan mukosa) sangat berperan pada proses penyerapan obat (Aiache, dkk., 1993)
Gambar 2.1 Irisan melintang saluran cerna
kelenjar penghasil alkali. Dua lapis otot polos, yaitu otot sirkular (bentuk spiral yang rapat) berperan dalam mengkontraksi usus dan otot longitudinal (spiral panjang) berperan dalam memendekkan usus. Di dalam lapisan otot ini terdapat jaringan saraf (pleksus Mienterikus). Lapisan serosa merupakan lapisan terluar yang melapisi usus dan juga dinding rongga abdomen dimana usus terletak (Asih, 1996).
2.3.2 Gerakan Usus
Agar proses yang terjadi di dalam usus halus berjalan baik dan lancar, dinding usus harus mencampuradukkan bubur makanan yang diterima dari lambung dengan cairan usus, dan memaparkan bubur ini kepada permukaan mukosa usus dan menggerakkan bubur isi usus ke bawah sepanjang usus ke arah kolon (Anwar, 2000).
Saraf parasimpatik yang intrinsik membebaskan asetilkolin yang memulai kontraksi usus. Sedangkan saraf-saraf simpatik akan membebaskan noradrenalin yang akan merelaksasi dinding usus. Saraf parasimpatik yang ekstrinsik merupakan cabang-cabang dari saraf vagus. Zat-zat kimia endogen yang dapat menambah gerakan usus adalah gastrin, cholecystokinin, dan angiotensin II. Adrenalin, noradrenalin dan secretin akan merelaksasi dinding usus. Zat-zat kimia yang dibebaskan setempat yang dapat menambah gerakan usus adalah histamin, prostaglandin dan serotonin, namun peran zat-zat kimia ini dalam pengendalian gerakan usus yang normal tidak jelas (Anwar, 2000).
2.4 Uraian Diare
pencernaan yang normal. Frekuensi dan konsistensi berbeda-beda pada tiap individu. Sebagai contoh, beberapa individu defekasi tiga kali sehari, sedangkan yang lainnya hanya dua atau tiga kali seminggu (Wells, dkk, 2006).
Secara normal makanan yang terdapat di dalam lambung dicerna menjadi bubur (chymus), kemudian diteruskan ke usus halus untuk diuraikan lebih lanjut oleh enzim-enzim. Setelah terjadi resorpsi, sisa chymus tersebut yang terdiri dari 90% air dan sisa-sisa makanan yang sukar dicernakan, diteruskan ke usus besar (colon). Bakteri-bakteri yang biasanya selalu berada di colon mencerna lagi sisa-sisa (serat-serat) tersebut, sehingga sebagian besar dari sisa-sisa-sisa-sisa tersebut dapat diserap pula selama perjalanan melalui usus besar. Airnya juga direabsorpsi kembali sehingga akhirnya isi usus menjadi lebih padat. Tetapi kadang terjadi peristaltik usus yang meningkat sehingga pelintasan chymus sangat dipercepat dan masih mengandung banyak air pada saat meninggalkan tubuh sebagai tinja. Penyebab utamanya adalah bertumpuknya cairan di usus akibat terganggunya resorpsi air dan atau terjadinya hipersekresi. Pada keadaan normal, proses reabsorpsi dan sekresi dari air dan elektrolit-elektrolit berlangsung pada waktu yang sama di sel-sel epitel mukosa. Proses ini diatur oleh beberapa hormon, yaitu resorpsi oleh enkefalin, sekresi diatur oleh prostaglandin dan neurohormon V.I.P. (Vasoactive Intestinal Peptide). Biasanya reabsorpsi melebihi sekresi, tetapi karena suatu sebab sekresi menjadi lebih besar daripada reabsorpsi, oleh karena itulah diare terjadi (Tan dan Rahardja, 2002).
2.4.1. Klasifikasi diare
a. Diare akibat virus, misalnya influenza perut dan travelers diarrhea yang disebabkan antara lain oleh rotavirus dan adenovirus.
b. Diare akibat bakteri (invasif), dapat disebabkan oleh Salmonella, Shigella, Campylobacter, dan jenis Coli tertentu.
c. Diare parasiter, dapat disebabkan oleh Entamooeba Hystolitica, Giardia Lambia, Cryptosporidium dan Cyclospora yang terutama terjadi didaerah
tropis.
d. Diare akibat enterotoksin, penyebabnya adalah kuman-kuman yang membentuk enterotoksin, yang terpenting adalah E.Coli dan Vibrio Cholerae dan yang jarang adalah Shigella, Salmonella, Campylobacter dan
Entamoeba Hystolitica (Tjay dan Rahardja, 2002).
2. Klasifikasi berdasarkan organ yang terkena infeksi:
a. Diare infeksi enternal atau diare karena infeksi di usus (bakteri, virus, parasit).
b. Diare infeksi parenteral atau diare karena infeksi di luar usus (otitis, media, infeksi saluran pernafasan, infeksi saluran urin, dan lainnya).
3. Klasifikasi diare berdasarkan lamanya diare:
a. Diare akut atau diare karena infeksi usus yang bersifat mendadak, dan bisa berlangsung terus selama beberapa hari. Diare ini disebabkan oleh karena infeksi usus sehingga dapat terjadi pada setiap umur dan bila menyerang umumnya disebut gastroenteritis infantile.
2.4.2 Obat-obat diare
Obat-obat yang digunakan dalam pengobatan diare dikelompokkan menjadi beberapa kategori, yaitu:
1. Kemoterapeutik, untuk terapi kausal yakni memberantas bakteri penyebab diare, seperti antibiotik, sulfonamid, kinolon dan furazolidon.
2. Obstipansia, yang dibagi menjadi:
a. zat-zat penekan peristaltik, candu dan alkaloidanya, derivat petidin (difenoksilat dan loperamid), dan antikolinergik (atropine dan ekstrak belladonna).
b. adstringen, yang menciutkan selaput lendir usus, misalnya asam samak (tanin) dan tanalbumin, garam-garam bismuth dan aluminium.
c. adsorbensia, misalnya carbo adsorbens yang pada permukaannya dapat menyerap zat-zat beracun yang dihasilkan oleh bakteri. Yang termasuk juga dalam golongan ini, antara lain adalah pektin, garam-garam bismuth dan aluminium.
3. Spasmolitik, yakni zat-zat yang dapat melepaskan kejang-kejang otot yang sering kali menyebabkan nyeri perut pada diare (Tjay dan Rahardja, 2002).
Obat antimotilitas (penekan peristaltik) secara luas digunakan sebagai terapi simtomatis pada diare akut ringan sampai sedang. Opioid seperti morfin. difenoksilat dan kodein menstimulasi aktivitas reseptor μ pada neuron mienterikus
loperamid tidak dapat menyebabkan ketergantungan. Antibiotik, berguna hanya pada infeksi spesifik tertentu, misalnya pada penyakit kolera dan disentri basiler yang dapat diterapi dengan tetrasiklin. Kuinolon adalah obat yang lebih baru yang tampaknya efektif melawan patogen diare yang paling penting (Neal, 2006). 2.5 Loperamid Hidrokloridum
Loperamid merupakan derivat difenoksilat dengan khasiat obstipasi yang dua sampai tiga kali lebih kuat tetapi tanpa khasiat terhadap susunan saraf pusat sehingga tidak menimbulkan ketergantungan. Zat ini mampu menormalkan keseimbangan resorpsi-sekresi dari sel-sel mukosa, yaitu memulihkan sel-sel yang berada dalam keadaan hipersekresi ke keadaan resorpsi normal kembali (Tjay dan Rahardja, 2002).
Loperamid tidak diserap dengan baik melalui pemberian oral dan penetrasinya ke dalam otak tidak baik, sifat-sifat ini menunjang selektifitas kerjanya. Kadar puncak dalam plasma dicapai dalam waktu 4 jam sesudah minum obat. Masa laten yang lama ini disebabkan oleh penghambatan motilitas saluran cerna dan karena obat mengalami sirkulasi enterohepatik (Sardjonodkk., 2004). Loperamid memperlambat motilitas saluran cerna dengan mempengaruhi otot sirkuler dan longitudinalis usus. Obat ini berikatan dengan reseptor opioid sehingga diduga efek konstipasinya diakibatkan oleh ikatan loperamid dengan reseptor tersebut. Waktu paruh 7-14 jam (Marcellus, 2001). Kurang dari 2% dieliminasi renal tanpa diubah, 30% dieliminasi fekal tanpa
diubah dan sisanya dieliminasi setelah mengalami metabolisme dalam hati sebagai glukoroid ke dalam empedu (Bircher dan Lotterer, 1993).
Oleum ricini atau castor oil atau minyak jarak berasar dari biji Ricinus communis suatu trigliserida risinoleat dan asam lemak tidak jenuh. Di dalam usus
halus minyak jarak dihidrolisis oleh enzim lipase menjadi gliserol dan asam risinoleat. Asam risinoleat inilah yang merupakan bahan aktif sebagai pencahar. Minyak jarak juga bersifat emolien. Sebagai pencahar obat ini tidak banyak digunakan lagi karena banyak obat yang lebih aman. Minyak jarak menyebabkan kolik, dehidrasi yang disertai gangguan elektrolit. Obat ini merupakan bahan induksi diare pada penelitian diare secara eksperimental pada hewan percobaan (Teke, et al., 2007).
Menurut Katzung (2001), asam risinoleat hasil hidrolisis castor oil, merupakan iritan lokal yang dapat meningkatkan motilitas usus. Mula kerjanya cepat dan berlangsung terus sampai senyawa ini diekskresi melalui kolon. Dosis oleum ricini adalah 2 sampai 3 sendok makan (15 sampai 30 ml), diberikan sewaktu perut kosong. Efeknya timbul 1 sampai 6 jam setelah pemberian, berupa pengeluaran buang air besar berbentuk encer (Anwar, 2000).
2.7 Metode-metode Pengujian Antidiare
Ada 3 metode yang biasa digunakan untuk pengujian antidiare, yaitu (Vogel, 2002) :
1. Metode margens (pengamatan lintas norit)
kecil dari kontrol bahwa dapat disimpulkan bahwa sampel uji memiliki efek antidiare.
2. Metode pola defekasi
Pada metode ini diamati frekuensi buang air besar, konsistensi feses, massa feses dan waktu terjadinya diare. Semuanya diamati dalam jangka waktu tertentu. Jika frekuensi buang air besar lebih kecil, konsistensi feses lebih padat, massa feses lebih banyak dan waktu diare lebih lama dibandingkan kontrol, maka dapat disimpulkan bahwa yang diuji memiliki efek sebaga anti diare.
3. Secara in vitro
BAB I PENDAHULUAN 1.1 Latar Belakang
Gangguan terhadap saluran pencernaan (gastroenteritis) bervariasi dari yang ringan hingga yang berat, serta dapat pula menyebabkan kematian bila tidak ditangani dengan benar. Salah satu contoh gangguan terhadap saluran pencernaan adalah diare (Prasetyo dan Fadlyana, 2004).
Diare merupakan suatu gejala penyakit yang terjadi akibat adanya penyimpangan atau gangguan terhadap sistem pencernaan makanan. Diare merupakan salah satu masalah kesehatan masyarakat yang cukup kompleks. Jika tidak ditangani dengan baik, diare dapat mempengaruhi pertahanan tubuh penderita hingga menimbulkan kematian. Diare merupakan penyebab utama kesakitan dan kematian pada anak-anak di negara yang sedang berkembang dengan perkiraan 1.3 milyar kejadian dan 3.2 juta kematian setiap tahun pada balita. Menurut laporan Departemen Kesehatan Republik Indonesia, setiap anak mengalami diare 1.6-2 kali dalam setahun (Prasetyo dan Fadlyana, 2004).
55% dari anak-anak penderita diare. Oleh karena itulah, upaya pencegahan dan pengendalian diare ini menjadi sangat penting (Budiarti, 1997).
Pemanfaatan tanaman telah dilakukan manusia sejak berabad-abad lalu sebagai pengobatan. Badan Kesehatan Dunia memperkirakan sekitar 80% penduduk dunia mengandalkan obat tradisional untuk pertolongan pertama dengan pengobatan menggunakan ekstrak tanaman atau komponen aktifnya. Meningkatnya minat masyarakat untuk menggunakan obat alam dikarenakan obat sintetik memiliki beberapa kelemahan antara lain belum banyak ragamnya, harganya sangat mahal dan efek sampingnya yang tidak dikehendaki. Selain itu ada kecenderungan masyarakat untuk kembali menggunakan bahan-bahan alami baik sebagai obat maupun untuk konsumsi sehari-hari yang disebut back to nature (Rachmini, 2001).
Indonesia merupakan penghasil komoditas tanaman obat yang potensial, sebanyak 940 jenis tanaman obat yang sudah ditemukan tetapi baru 80 jenis yang sudah diproduksi untuk pembuatan obat. Selain itu tanaman obat dapat digunakan untuk bahan makanan sehingga berfungsi sebagai pangan fungsional. Cincau hijau (Cyclea barbata L.Miers) merupakan tanaman yang dapat dijadikan pangan fungsional dalam bentuk healthy dessert (Rachmini, 2001).
bekerja sebagai pembeku protein/astrigen yaitu zat yang berikatan pada mukosa, kulit atau jaringan yang berfungsi membekukan protein, sehingga membran mukosa menjadi kering dan membentuk pembatas (thight junction) yang bersifat resisten terhadap inflamasi dari mikroorganisme (Clinton, 2009). Flavanoid dapat menghambat proses inisiasi dari inflamasi, seperti menghambat pelepasan histamin dan mediator inflamasi yang dapat menghambat peristaltik usus (Ahmadu,2007). Pada saat diare, kontraksi otot polos dan motilitas usus meningkat sehingga dengan diberikan cincau hijau diharapkan dapat menurunkan kondisi tersebut dari zat yang dikandungnya. Akan tetapi, data ilmiah mengenai khasiat cincau hijau belum banyak diketahui sehingga perlu dilakukan suatu penelitian untuk mendapatkan data ilmiah mengenai khasiat cincau hijau (Rachmini, 2001).
1.2 Perumusan Masalah
Berdasarkan latar belakang diatas, maka perumusan masalah pada penelitian ini adalah:
a. Apakah karakteristik dan skrining fitokimia simplisia daun cincau hijau memenuhi syarat MMI ?
b. Apakah ekstrak etanol daun cincau hijau mempunyai efek antidiare yang diuji menggunakan metode defekasi dan berapa dosis optimal yang sesuai bila dibandingkan dengan Loperamid HCl?
1.3 Hipotesis
Berdasarkan perumusan masalah diatas maka hipotesis pada penelitian ini adalah:
a. Karakterisasi simplisia daun cincau hijau memenuhi syarat MMI dan skrining fitokimia, simplisia daun cincau hijau mengandung senyawa alkaloid, flavanoid, glikosida, tanin dan steroid.
1.4 Tujuan
Adapun tujuan dari penelitian ini adalah untuk mengetahui: a. Karakterisasi dan skrining simplisiadaun cincau hijau.
b. Efek antidiare ekstrak etanol daun cincau hijau menggunakan metode defekasi dan dosis optimal bila dibandingkan dengan Loperamid HCl.
1.5 Manfaat
1.6 Kerangka Pikir Penilitian
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Kerangka pikir penelitian Daun cincau hijau
UJI EFEK ANTIDIARE EKSTRAK ETANOL DAUN CINCAU HIJAU (Cyclea barbata) PADA TIKUS DENGAN METODE DEFEKASI
ABSTRAK
Secara umum tanaman cincau hijau sudah dikenal dan telah dimanfaatkan oleh masyarakat Indonesia sebagai makanan dan obat tradisional, tanaman ini juga banyak tersebar di pulau Jawa. Daun cincau sering digunakan dalam pengobatan panas dalam, obat sakit perut, antidiare, juga sebagai antikanker karena cincau diduga mengandung senyawa yang mempunyai aktivitas antioksidan yang mampu mematikan sel kanker. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia dan efek antidiare ekstrak etanol daun cincau hijau pada tikus yang diinduksi dengan oleum ricini.
Serbuk simplisia daun cincau hijau dikarakterisasi dan dilakukan skrining fitokimia, kemudian serbuk dibuat menjadi ekstrak dengan etanol 96% dengan metode maserasi. Selanjutnya ekstrak etanol daun cincau hijau diuji aktivitas antidiare pada tikus yang diinduksi dengan oleum ricini 2 ml menggunakan metode defekasi. Ekstrak etanol daun cincau hijau diberikan secara oral dosis 50, 100, dan 150 mg/kg bb, sebagai pembanding diberi loperamid HCl dosis 1 mg/kg bb. Pengamatan dilakukan terhadap terjadinya diare setiap 30 menit selama 6 jam, meliputi: saat mulai terjadi diare, konsistensi feses, frekuensi diare dan lama terjadinya diare.
Hasil pemeriksaan karakteristik serbuk simplisia daun cincau hijau diperoleh kadar air 5,2%, kadar sari larut air 20,63%, kadar sari larut etanol 17,24%, kadar abu total 14,28% dan kadar abu tidak larut asam 0,54%. Hasil skrining fitokimia serbuk simplisia diperoleh senyawa alkaloida, flavanoida, glikosida, tanin, steroida/triterpenoida. Uji efek antidiare ekstrak etanol daun cincau hijau pada tikus menunjukkan bahwa semua dosis memberikan efek antidiare. Dosis 50 mg/kg bb memiliki efek antidiare yang lebih kecil dibanding loperamid HCl dosis 1 mg/kg bb (p < 0,05), sedangkan dosis 100 mg/kg bb memberikan efek antidiare yang sama dengan loperamid HCl dosis 1 mg/kg bb dan dosis 150 mg/kg bb memperlama saat mulai terjadi diare dan mempersingkat lama terjadinya diare dibandingkan dengan loperamid HCl dosis 1 mg/kg bb. Hasil uji statistik menunjukkan bahwa EEDCH dosis 150 mg/kg bb berbeda signifikan dengan loperamid 1 mg/kg bb (p > 0,05) dan EEDCH dosis 50, 100 dan 150 mg/kg bb mempunyai efek antidiare pada tikus yang diinduksi dengan oleum ricini.
STUDY ON ANTIDIARHEAL ACTIVITY OF ETHANOL EXTRACT OF GREEN CINCAU (Cyclea barbata) IN RATS WITH DEFECATION
METHOD
ABSTRACT
Generally green cincau has been known and has been used among Indonesian people. This plant is many found in Java island and often used as treatment for , stomachache, diarrhea and anticancer as green cincau contains high amount of antioxidant. The aim of this study was to determine characteristics simplicia, content of chemical substance and antidiarrheal effects of ethanol extract of green cincau in rats that induced by oleum ricini.
Simplicia green cincau powder characterization and phytochemical screening done, then powder macerated with ethanol 96%. Furthermore, the ethanol extract of the green cincau antidiarrheal activity was tested in rat induced with 2 ml of oleum ricini using defecation method. Ethanol extract of green cincau was given orally a dose of 50, 100, and 150 mg/kg bw, as a comparison of loperamide HCl was given a dose of 1 mg/kg bw. Observation were done to diarrhea occurre every 30 minutes for 6 hours, includes: current start happening diarrhea, stool consistency, frequency and duration occurrence of diarrhea.
Results observation of simplicia green cincau powder characteristics obtained 5.2% water content, 20.63% of water-soluble extract, 17,24% ethanol-soluble extract, 14.28% total ash content and 0,54% of acid inethanol-soluble ash content. Results of phytochemical screening of green cincau powder are: alcaloides, flavanoida, glycosides, tannins, steroid/triterpenoida. Test antidiarrheal effects of the ethanol extract of the green cincau leaves in rats showed that all doses of antidiarrheal effect. Doses of 50 mg / kg bw has antidiarrheal effects that are smaller than the dose of loperamide HCl 1 mg/kg bw (P < 0,05), while a dose of 100 mg / kg bw given the same antidiarrheal effect of loperamide HCl with dose 1 mg / kg bw and a dose of 150 mg / kg bw delay current start happening and shorthen duration occurrence of diarrhea compared with loperamide HCl with dose 1 mg / kg bw. Statistic analysis showed significant difference between dose 150 mg/kg bw and loperamide HCl 1 mg/kg bw (P > 0,05).
UJI EFEK ANTIDIARE EKSTRAK ETANOL
DAUN CINCAU HIJAU (Cyclea barbata)PADA TIKUS DENGAN
METODE DEFEKASI
SKRIPSI
OLEH:
GRACE NATASHA
NIM 091501129
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
UJI EFEK ANTIDIARE EKSTRAK ETANOL
DAUN CINCAU HIJAU (Cyclea barbata) PADA TIKUS
DENGAN METODE DEFEKASI
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
GRACE NATASHA
NIM 091501129
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
LEMBAR PENGESAHAN SKRIPSI
UJI EFEK ANTIDIARE EKSTRAK ETANOL DAUN CINCAU
HIJAU (Cyclea barbata) PADA TIKUS DENGAN METODE
DEFEKASI
OLEH: GRACE NATASHA
NIM 091501129
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 15 Agustus 2015
Pembimbing I,
Drs. Saiful Bahri, M.S., Apt. NIP 195208241983031001
Pembimbing II,
Hari Ronaldo Tanjung, S.Si., M.Sc., Apt. NIP 197803142005011002
Dr. Edy Suwarso,S.U, Apt. NIP 130935857
Drs. Saiful Bahri, M.S., Apt. NIP 195208241983031001
Dr. Poppy Anjelisa Z. Hsb, M.Si., Apt. NIP 197506102005012003