Lampiran 2. Gambar tumbuhan sikkam (Bischofia javanica Blume)
pohon sikkam
Lampiran 3. Gambar simplisia dan serbuk kulit batang sikkam (Bischofia
javanica Blume)
Simplisia batang sikkam
Lampiran 4. Bagan kerja penelitian
1. Pembuatan ekstrak kulit batang sikkam
serbuk simplisia 1,2 kg
dimaserasi dengan etanol 80% hingga serbuk terendam
maserat ampas
maserat
diuapkan dengan rotary evaporator
dikeringkan dengan freeze dryer
ekstrak kering 112 g
dibiarkan selama 5 hari terlindung dari cahaya
dicuci dengan etanol 80% dan dibiarkan selama 2 hari
disaring
ampas
Lampiran 4. (Lanjutan)
2. Pengujian karakterisasi, skrining dan antidiare
Ekstrak kering 112 g
Karakterisasi simplisia dan ekstrak, meliputi penetapan:
Skrining fitokimia simplisia dan ekstrak meliputi:
Hasil Hasil Hasil
Uji antidiare, meliputi parameter:
-Saat mulai terjadi diare
-Konsistensis feses -Frekuensi diare -Lama terjadi diare -Kadar air
-Kadar abu total -Kadar sari larut air -Kadar sari larut
etanol
-Kadar abu tidak larut asam
- alkaloida -flavanoida
-glikosida -tanin -saponin
Lampiran 5. Perhitungan hasil karakterisasi serbuk simplisia dan ekstrak etanol
kulit batang sikkam
1.Penetapan kadar air
% Kadar air =volume air (ml) simplisia ekstrak Simplisia ekstrak simplisia ekstrak
Lampiran 5. (Lanjutan)
2. Penetapan kadar sari larut air
% Kadar sari yang larut dalam air =berat sari (g) berat (g) x
100
20 x 100 %
Kadar sari larut air simplisia:
1. % Kadar sari yang larut dalam air = 0,1863 g 5,0047 g x
Kadar sari larut air ekstrak:
1. % Kadar sari yang larut dalam air = 0,3358 g simplisia ekstrak simplisia ekstrak simplisia Ekstrak 1. 5,0047 5,0047 49,5950 51,9458 49,7813 52,2816 2. 5,0042 5,0042 48,0379 49,9262 48,2047 50,2347 3. 5,0022 5,0039 49,6782 46,2146 49,8504 46,5461
% Kadar sari yang larut dalam air = = 17,49%
Lampiran 5. (Lanjutan)
3. Penetapan kadar sari larut etanol
% Kadar sari yang larut dalam etanol =berat sari (g) berat (g) x
100
20 x 100 %
Kadar sari larut etanol simplisia:
1. % Kadar sari yang larut dalam etanol = 0,1161 g
3. % Kadar sari yang larut dalam etanol = 0,1230 g 5,0069 g x
Kadar sari larut etanol ekstrak:
1. % Kadar sari yang larut dalam etanol = 0,2330 g simplisia ekstrak Simplisia ekstrak simplisia ekstrak 1. 5,0052 5,0055 49.5842 49,5937 49,7003 49,8267 2. 5,0053 5,0049 48,0292 48,0401 49,1459 48,2802 3. 5.0069 5,039 49,6795 46,3641 49,8025 46,5895
= 11,84% % Kadar sari yang larut
dalam etanol rata-rata
% Kadar sari yang larut dalam etanol rata-rata
Lampiran 5. (Lanjutan)
4. Penetapan kadar abu total
% Kadar abu total = berat abu (g)
berat (g) x 100%
Kadar abu total simplisia:
1. % Kadar abu total =0,0961 g
Kadar abu total ekstrak:
1. % Kadar abu total = 0,0095 g
simplisia Ekstrak simplisia ekstrak
1. 2,0235 2,0812 0,0961 0,0095
2. 2,0128 2,0352 0,0776 0,0118
3. 2,0132 2,0458 0,0731 0,0083
= 4,07% % Kadar abu total rata-rata
Lampiran 5. (Lanjutan)
5. Penetapan kadar abu tidak larut asam
% Kadar abu tidak larut asam =berat abu (g)
berat (g) x 100 %
Kadar abu tidak larut asam simplisia:
1. % Kadar abu tidak larut asam =0,0645 g
Kadar abu tidak larut asam ekstrak:
1. % Kadar abu tidak larut asam =0,0001 g
simplisia Ekstrak Simplisia ekstrak
1. 2,0235 2,0812 0,1306 0,0001
2. 2,0128 2,0352 0,1226 0,0002
3. 2,0132 2,0476 0,1140 0,0003
= 6,06%
Lampiran 6. Gambar konsistensi feses tikus
Feses tikus normal
Feses tikus lembek
Lampiran 7. Volume maksimum larutan sediaan uji yang dapat diberikan pada hewan uji (Mulyono, 1984)
Jenis hewan uji Volume maksimum (ml) sesuai jalur pemberian
i.v. i.m. i.p. s.c. p.o.
Lampiran 10. Gambar alat yang digunakan
Spuit dan oral sonde
Lampiran 11. Perhitungan konversi dosis
1. Perhitungan konversi dosis loperamid HCl (tablet Imodium®
Dosis manusia (berat 70 kg) = 2-8 mg dan tidak melebihi 16 mg/hari Dosis tikus (berat 200 g) = 0,018 x (16 mg) = 0,2 mg
Maka dosis loperamid HCl untuk tikus = 1 mg/kg bb
) dari manusia ke tikus :
2. Perhitungan konversi dosis EEKBS dari tikus ke manusia : Dosis yang digunakan dalam penelitian adalah :
- 75 mg/kg bb atau sama dengan 15 mg/200 g bb - 100 mg/kg bb atau sama dengan 20 mg/200 g bb - 125 mg/kg bb atau sama dengan 25 mg/200 g bb - 150 mg/kg bb atau sama dengan 30 mg/200 g bb Dosis optimal EEKBS pada tikus adalah 25 mg/200 g bb. Faktor konversi dosis tikus = 56,0
Dosis manusia = dosis pada tikus x faktor konversi = 25 mg x 56,0
Lampiran 12. Perhitungan Kadar Loperamid HCl dari Tablet Imodium®
Dosis manusia (70 kg) = 2-8 mg dan tidak melebihi 16 mg/hari Dosis tikus (200 g) setelah dikonversikan = 1 mg/kg bb
Tablet Imodium ditimbang sebanyak 20 tablet (berat = 2400 mg) 20 tablet Imodium mengandung Loperamid HCl sebanyak 40 mg Loperamid HCl yang digunakan = 15 mg
Lampiran 13. Perhitungan dosis pemberian ekstrak etanol kulit batang sikkam
(EEKBS) dan loperamid HCl (tablet imodium®
a. Perhitungan EEKBS dosis 75 mg/kg bb )
b. Perhitungan EEKBS dosis 100 mg/kg bb
Konsentrasi EEKBS = 3 % = 3 g/100 ml = 30 mg/ml
c. Perhitungan EEKBS dosis 125 mg/kg bb
d. Perhitungan EEKBS dosis 150 mg/kg bb
Lampiran 14. Hasil orientasi dosis bahan uji terhadap saat mulai terjadinya diare
setelah pemberian oleum ricini.
Keterangan:
OR : oleum ricini
EEKBS : ekstrak etanol kulit batang sikkam
Grafik hasil orientasi dosis
56,8
Perlakuan Saat mulai terjadinya diare
Lampiran 15. Hasil pengamatan saat mulai terjadinya diare setelah pemberian
oleum ricini
Keterangan:
OR : oleum ricini
EEKBS : ekstrak etanol kulit batang sikkam Perlakuan
Hewan
Jumlah
Rata-rata (menit)
1 2 3 4 5 6
OR + CMC
1% bb 56 54 60 58 56 57 341 56,8
OR + loperamid
HCl 1 mg/kg bb 114 114 87 89 90 110 604 100,7 OR + EEKBS
75 mg/kg bb 60 59 60 88 57 85 409 68,2 OR + EEKBS
100 mg/kg bb 86 83 60 87 59 86 461 76,8 OR + EEKBS
125 mg/kg bb 89 90 119 114 89 90 591 98,5 OR + EEKBS
Lampiran 16. Hasil pengamatan konsistensi feses setelah pemberian oleum ricini
EEKBS : ekstrak etanol kulit batang sikkam
Perlakuan Diameter serapan
air (cm)
Perlakuan Diameter serapan
air (cm)
Perlakuan Diameter serapan
Lampiran 17. Hasil pengamatan frekuensi diare setelah pemberian oleum ricini
Perlakuan Hewan Jumlah Rata-rata
1 2 3 4 5 6
OR + CMC 1% bb 7 7 7 7 7 7 42 7,0
OR + loperamid
HCl 1 mg/kg bb 3 3 4 4 3 2 19 3,17
OR + EEKBS 75
mg/kg bb 5 7 5 5 6 5 33 5,5
OR +. EEKBS 100
mg/kg bb 5 4 4 4 4 4 25 4,1
OR + EEKBS 125
mg/kg bb 3 3 3 3 4 3 19 3,17
OR + EEKBS 150
mg/kg bb 2 3 3 2 2 3 15 2,5
Keterangan:
OR : oleum ricini
Lampiran 18. Hasil pengamatan lama terjadinya diare setelah pemberian oleum ricini
Keterangan:
OR : oleum ricini
Lampiran 19. Hasil deskriptif data
Saat mulai terjadi diare
Perlakuan
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
Min Max Lower
Bound
Upper Bound
Susp.CMC 1% bb 6 56.8333 2.04124 .83333 54.6912 58.9755 54.00 60.00
Susp.Lop HCL1mg/kg
bb 6 1.0067E2 13.26147 5.41397 86.7496 114.5837 87.00 114.00
Susp.EEKBS 75
mg/kg bb 6 68.1667 14.27469 5.82762 53.1863 83.1470 57.00 88.00
Susp.EEKBS 100
mg/kg bb 6 76.8333 13.49691 5.51009 62.6692 90.9975 59.00 87.00
Susp.EEKBS 125
mg/kgbb 6 98.5000 14.03923 5.73149 83.7667 113.2333 89.00 119.00
Susp.EEKBS 150
mg/kg bb 6 1.1867E2 1.50555 .61464 117.0867 120.2466 116.00 120.00
Lampiran 19. (Lanjutan)
Konsistensi feses (diameter serapan air)
Lampiran 19. (Lanjutan)
Waktu defekasi
N Mean
Std.
Deviation Std. Error
Lampiran 19. (Lanjutan)
Deviation Std. Error
Lampiran 20. Hasil Analisis Statistik Anava
Saat mulai terjadi diare
Konsistensi feses (diameter serapan air)
Konsistensi feses (berat)
Within Groups 3826.667 30 127.556
Waktu defekasi
Frekuensi diare
Lama terjadi diare
Sum of Squares df
Mean
Square F Sig.
Feses berlendir Between Groups 11896.979 5 2379.396 25.093 .000
Within Groups 2844.708 30 94.824
Total 14741.688 35
Feses lembek Between Groups 31879.239 5 6375.848 16.310 .000
Within Groups 11727.730 30 390.924
Total 43606.969 35
Feses normal Between Groups 87864.250 5 17572.850 210.160 .000
Within Groups 2508.500 30 83.617
Total 90372.750 35
Sum of Squares df Mean Square F Sig.
Between Groups 87.250 5 17.450 55.105 .000
Within Groups 9.500 30 .317
Total 96.750 35
Sum of Squares df Mean Square F Sig.
Between Groups 175335.806 5 35067.161 135.328 .000
Within Groups 7773.833 30 259.128
Lampiran 21. Hasil Analisis Statistik Duncan
Saat mulai terjadinya diare
Konsistensi feses (diameter serapan air)
berlendir
Susp.EEKBS 125 mg/kgbb 6 98.5000
Susp.Lop HCL1mg/kg bb 6 1.0067E2
Susp.EEKBS 150 mg/kg bb 6 1.1867E2
Sig. .092 .194 .742 1.000
Means for groups in homogeneous subsets are displayed.
Kelompok N
Means for groups in homogeneous subsets are displayed.
Kelompok N
normal
Means for groups in homogeneous subsets are displayed.
Konsistensi feses (berat)
Susp.EEKBS 125 mg/kgbb 6 2.3750
Susp.EEKBS 100 mg/kg bb 6 2.7217
Susp.EEKBS 75 mg/kg bb 6 3.0717
Susp.CMC 1% bb 6 3.1733
Sig. .050 .542 1.000 .378
Means for groups in homogeneous subsets are displayed.
Kelompok N
normal
Means for groups in homogeneous subsets are displayed.
Kelompok N
Means for groups in homogeneous subsets are displayed.
Kelompok N
normal
Means for groups in homogeneous subsets are displayed.
Kelompok N
Means for groups in homogeneous subsets are displayed.
Kelompok N
DAFTAR PUSTAKA
Ahmadu, A.A., Zezi, A.A., dan Yano, A.H. (2007) Anti-Diarrheal Activity of the Leaf Extracts of Daniellia Oliveri Hutch and Dalz (Fabaceae) and Ficus Sycomorus Miq (Moraceae). African Journal. 4(4): 524-528.
Ajaib, M. dan Khan, Z.U. (2012). Bischofia javanic : A New Record To The Flora of Pakistan. Biologia (Pakistan). 58(1,2): 179-183.
Anief, M. (1999). Ilmu Meracik Obat, Teori Dan Praktik. Cet. 5. Yogyakarta: Gadjah Mada University Press. Hal. 107,169.
Anwar, H.J. (2000). Farmakologi dan Terapi Obat-obatan Saluran Cerna. Jakarta: Penerbit Hipokrates. Hal. 15-17.
Bachheti, R.K., Indra, R., dan Archana, J. (2013). Chemical Composition, Mineral and Nutritional Value of Wild Bischofia javanica seed. Intenasional Food Research Journal. 20(4): 1747-1751.
Clinton, C.N.D. (2009). Plant tannins: A novel approach to the treatment of ulcerative colitis. Natural Medicine Journal. 2: 1-3.
Depkes. (1979). Materia Medika Indonesia. Jilid III. Jakarta: Depkes RI. Hal. 155-171.
Depkes. (1995). Materia Medika Indonesia. Edisi Keenam. Jakarta: Depkes RI. Hal. 323-325.
Depkes. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Depkes RI. Hal. 1, 9-12, 17.
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Depkes RI. Hal. 9, 33, 649, 696.
Ditjen POM. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Depkes RI. Hal. 300-306, 323-326.
Di Carlo, G., Autore, G., Izzo, A.A., Maiolino, P., Mascolo, N., Viola, P., Diurno, M.V., dan Capasso, F. (1993). Inhibition of Intestinal Motility and Secretory by Flavonoids in Mice and Rats: Structure Activity Relationships. Journal of Pharmacy and Pharmacology. 45(12): 1054-1059.
Fauci, A.S. (2008). Harrison’s principle of internal medicine. Edisi XVII. New York: Mc Graw Hill. Hal. 249-250.
Friedman, S.L., Kenneth, Mc R.Q., Grendell, J.H. (2003). Current Diagnostic & Treatment in Gastroenterology. Edisi II. New York: Mc Graw Hill. Hal. 301-308.
Goodman, S.L., dan Gilman, A. (1996). The Pharmacological Basis of Therapeutics. Edisi kesembilan. New York: Mc Graw-Hill. Hal. 927.
Harbone, J.B. (1987). Metode Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan. Penerjemah Kosasih Padmawinata. Edisi Kedua. Bandung: ITB Press. Hal. 147-148, 281.
Harmida, Vivin, F.Y., dan Sarno. (2011). Studi Etnofitomedika di Desa Lawang Agung Kecamatan Mulak Ulu Kabupaten Lahat Sumatera Selatan. Jurnal Penelitian Sains. 14(1): 14110.
Ikawati, Z. (2008). Pengantar Farmakologi Molekuler. Yogyakarta: Gadjah Mada University Press. Hal. 50, 78-81.
Jeejeebhoy, K.N. (1977). Symposium on Diarrhea Definition and Mechanisms of diarrhea. Scientific Section. CMA Journal. 116: 737-739.
Katzung, B.G. (2001). Farmakologi: Dasar dan Klinik. Edisi Pertama. Jakarta: Salemba Medika. Hal. 984-985.
Kumar, R. (2001) Chemical and Biochemical Nature of Fodder Tree Tannins. Journal of Agricultural and food chemistry. 31: 1364-1366.
Lutterodt, G.D. (1989). Inhibition of Gastrointestinal Release of Acetylcholine by Quercetin as a Possible Mode of Action of Psidium guajara leaf Extracts in the Treatment of Acute Diarrhoea Disease. Journal Ethnopharmacology. 23: 235-247.
Markham, K.R. (1988). Cara Mengidentifikasi Flavonoida. Bandung: ITB-Press. Hal. 1-8.
McPhee, S.J., dan Papadakis, M.A. (2007). Current Medical Diagnosis & Treatment. Edisi XLVI. USA: Mc Graw Hill. Hal. 559-560.
Otshudi, L.A., Vercruysse, A., dan Foriers A. (2000). Contribution to the Ethnobotanical, Phytochemical and Pharmacological Studies of Traditionally Used Medicinal Plant in the Treatment of Dysentery and Diarrhoea in Lomela Area, Democratic Republik of Congo (DRC), Journal of Ethnopharmacol. 71(3): 411-23.
Pradhan K.B. dan Badola K.H. (2008). Ethnomedicinal Plant Use by Lepcha Tribe of Dzongu Valley, Bordering Khangchendzonga Biosphere Reserve, in North Sikkim India. Journal of Ethnobiology and Ethnomedicine.
4(22): 1-18.
Rajbongshi, P.P., Kamaruz, Z., Sangeeta, B., dan Simanti, D. (2014). A Review on Traditional Use and Phytopharmacological Potential of Bischofia javanica Blume. International Journal of Pharmaceutical Sciences Review and Research. 24(2): 24-29.
Robert, M.K. dan Nelson, W.E. (2007). Nelson Textbook of Pediatrics. Edisi XVIII. Philadelphia: Sauders. Hal. 1613-1616.
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Edisi Keenam. Bandung: Penerbit ITB. Hal. 191.
Sardjono, Santoso, dan Dewoto. (1995). Analgesik Opioid dan Antagonis. dalam Farmakologi dan Terapi. Edisi 4. Jakarta. FK-UI. Hal. 200.
Sari., L.O.R.K. (2006). Pemanfaatan Obat Tradisional Dengan Pertimbangan Manfaat Dan Keamanan. Majalah Ilmu Kefarmasian. 3(1): 1-7.
Seed Leaflet. (2012). Bischofia javanica Blume. Copenhagen Forest & Landscape Denmark. 157.
Suharyono. (1991). Diare Akut Klinik dan Laboratorik. Jakarta: PT Rineka Cipta. Hal. 1-2.
Sundari, D., Yun, A.N., dan Budi, N. (2005). Uji Khasiat Antidiare Ekstrak Daun Sendok (Plantago major Linn.) Pada Tikus Putih. Media Litbang Kesehatan. 15(3): 19-23.
Sutharson, L., Nath, L.K., Kar, P.K., Shila E.B., dan Rajan J.V. (2009). Free Radical Scavenging Activity of Leaves of Bischofia javanica Blume and Fraxinus Floribunda Wallich. Pharmacologyonline. 19(7): 5150-5156.
Tan, H.T., dan Rahardja, K. (2007) Obat-Obat Penting, Khasiat, Penggunaan dan Efek Sampingnya, Edisi Keempat. Cet. 1. Jakarta: PT. Elex Media Computindo. Hal. 288-289, 296-297.
Trease, G.E. dan Evans, W.C. (1983). Pharmacognosy. Edisi Keduabelas. London: Bailliere Tindal. Hal. 376-380.
Vogel, H. (2002). Drug Discovery and Evaluation. Frankfurt: Springer. Hal. 875-878.
Wells, B.G. (2006). Pharmacotherapy Handbook. Edisi Keenam. Singapore: The Mc Graw Hill Companies. Hal. 222-227.
WHO. (1992). Quality Control Methods For Medical Plant Materials. Geneva: World Healt Organization. Hal. 31-33.
BAB III
METODE PENELITIAN
Penelitian ini dilakukan secara eksperimental berdasarkan Rancangan Acak Lengkap (RAL), meliputi pengumpulan sampel, identifikasi sampel, pengolahan sampel, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak, penyiapan hewan percobaan, dan pengujian efek antidiare secara oral pada tikus. Data hasil penelitian dianalisis secara ANAVA (analisis variansi) dan dilanjutkan dengan uji beda rata-rata Duncan menggunakan program SPSS versi 17.
3.1 Alat dan Bahan
3.1.1 Alat
Alat-alat gelas, pisau, lemari pengering, seperangkat alat maserasi, alat destilasi, oven listrik (Fischer scientific), neraca hewan (Presica Geniweigher GW-1500), neraca listrik (Vibra AJ), ayakan, pipet tetes, desikator (Fischer Scientific), mortir dan stamper, krus porselin, kaca objek (object glass), kaca penutup (deck glass), rotary evaporator, freeze dryer (Edward), blender (National), cawan porselen, cawan porselen berdasar rata, alumunium foil, kertas saring, spatula, stopwatch, kandang hewan, oral sonde, pot plastik, wadah pengamatan.
3.1.2 Bahan
anhidrat, asam sulfat pekat, natrium klorida, kalium iodida, iodium, α-naftol, asam nitrat, bismuth nitrat, etil asetat, isopropanol, natrium sulfat anhidrat, serbuk seng, serbuk magnesium, metanol, eter, etanol 96 %, air suling.
3.2 Pembuatan Pereaksi
3.2.1 Pereaksi Mayer
Dilarutkan 1,36 g raksa (II) klorida P dalam 60 ml air, tambahkan pada larutan 5 g larutan kalium iodida P dalam 10 ml air, encerkan dengan air seluruhnya hingga 100 ml (Ditjen POM, 1995).
3.2.2 Pereaksi Dragendroff
Dilarutkan 8 g bismuth nitrat P dilarutkan dalam asam nitrat 20 ml kemudian dicampur dengan larutan kalium iodida 27,2 g dalam 50 ml air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih diambil dan diencerkan dengan air secukupnya hingga 100 ml (Ditjen POM, 1995).
3.2.3 Pereaksi Bouchardat
Dilarutkan 2 g iodium P dan 4 g kalium iodida P dalam air secukupnya hingga diperoleh 100 ml larutan (Ditjen POM, 1995).
3.2.4 Pereaksi Molish
Dilarutkan 3 g α-naftol dalam asam nitrat 0,5 N secukupnya hingga
diperoleh 100 ml larutan (Ditjen POM, 1995).
3.2.5 Larutan pereaksi besi (III) klorida 1%
Dilarutkan 1 g besi (III) klorida dalam air suling hingga diperoleh 100 ml larutan kemudian disaring (Ditjen POM, 1995).
Dilarutkan 15,17 g timbal (II) asetat dengan air suling bebas CO2 hingga
diperoleh 100 ml larutan (Ditjen POM, 1995).
3.2.7 Larutan pereaksi natrium hidroksida 2 N
Dilarutkan 8,001 g natrium hidroksida dalam air suling hingga diperoleh 100 ml larutan (Ditjen POM, 1995).
3.2.8 Larutan pereaksi asam sulfat 2 N
Sebanyak 10 ml asam sulfat pekat diencerkan dengan air suling hingga diperoleh 100 ml larutan (Ditjen POM, 1979).
3.2.9 Larutan pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling hingga diperoleh 100 ml larutan (Ditjen POM. (1979).
3.3 Pengumpulan dan Pengolahan Sampel
3.3.1 Pengumpulan sampel
Pengumpulan tumbuhan dilakukan secara purposif, yaitu berdasarkan pertimbangan peneliti dengan memilih batang yang telah dewasa dan tanpa membandingkan dengan daerah lain. Tumbuhan yang digunakan dalam penelitian ini adalah kulit batang sikkam (Bischofia javanica Blume), diambil dari kebun warga di Raya, Kabupaten Simalungun, Provinsi Sumatera Utara.
3.3.2 Identifikasi sampel
Determinasi sampel dilakukan di Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
3.3.3 Pengolahan tumbuhan
lain dengan cara dikerok atau ditoreh, selanjutnya kulit dicungkil dari lingkaran atas ke bawah. Diperoleh irisan kulit kira-kira dengan lebar 5 - 10 cm dan panjang 10 - 20 cm. Kulit batang dicuci sampai bersih dan ditiriskan, kemudian dikeringkan. Untuk mempercepat pengeringan, kulit batang dipotong kecil-kecil dengan ukuran kurang lebih 2,5 x 3,5 cm. Kulit batang sikkam yang sudah bersih ditimbang berat seluruhnya sebagai berat basah, kemudian dikeringkan di lemari pengering pada temperatur ± 40oC. Setelah kering, simplisia diserbuk hingga halus menggunakan blender dan diayak. Disimpan dalam wadah plastik yang tertutup rapat.
3.4 Pemeriksaan Karakteristik
Dilakukan pemeriksaan karakteristik simplisia dan ekstrak etanol kulit batang sikkam yang meliputi pemeriksaan makroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu yang tidak larut dalam asam (Ditjen POM, 1995; WHO, 1992).
3.4.1 Makroskopik
Pemeriksaan makroskopik dilakukan terhadap simplisia kulit batang sikkam meliputi bentuk, bau, warna dan rasa.
3.4.2 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alat terdiri dari alas bulat 500 ml, alat penampung, pendingin, tabung penyambung dan tabung penerima 10 ml.
Sebanyak 200 ml toluena dan 2 ml air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air
Kemudian kedalam labu tersebut dimasukkan 5 g serbuk simplisia dan ekstrak etanol kulit batang sikkam yang telah ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
3.4.3 Penetapan kadar sari larut air
3.4.4 Penetapan kadar sari larut etanol
Sebanyak 5 g serbuk simplisia dan ekstrak etanol kulit batang sikkam yang telah dikeringkan dimaserasi selama 24 jam dalam 100 ml etanol 96 % dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring, 20 ml filtrat diuapkan sampai kering dalam cawan berdasar rata yang telah ditara dan sisanya dipanaskan pada suhu 105oC sampai bobot tetap. Kadar sari larut dalam etanol dihitung terhadap bahan yang telah dikeringkan (Depkes, 1995).
3.4.5 Penetapan kadar abu total
Sebanyak 2 g serbuk simplisia dan ekstrak etanol kulit batang sikkam yang telah digerus dan ditimbang seksama dimasukkan dalam krus platina atau krus silikat yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 600oC selama 3 jam. Kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Depkes, 1995).
3.4.6 Penetapan kadar abu tidak larut asam
3.5 Skrining Fitokimia
Skrining fitokimia serbuk simplisia dan ekstrak etanol kulit batang sikkam meliputi: pemeriksaan senyawa golongan alkaloid, flavonoid, glikosida, tanin, saponin dan steroid/triterpenoid (Depkes, 1995).
3.5.1 Pemeriksaan alkaloida
Serbuk simplisia dan ekstrak etanol kulit batang sikkam ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloida: diambil 3 tabung reaksi, lalu kedalamnya dimasukkan 0,5 ml filtrat.
Pada masing-masing tabung reaksi; 1. ditambahkan 2 tetes pereaksi Mayer 2. ditambahkan 2 tetes pereaksi Bouchardat 3. ditambahkan 2 tetes pereaksi Dragendorff
Alkaloida positif jika terjadi endapan atau kekeruhkan pada paling sedikit dua dari tiga percobaan diatas (Depkes, 1995).
3.5.2 Pemeriksaan flavonoid
3.5.3 Pemeriksaan glikosida
Serbuk simplisia dan ekstrak etanol kulit batang sikkam ditimbang sebanyak 3 g, lalu disari dengan 30 ml campuran etanol 95 % dengan air (7:3) dan 10 ml asam klorida 2 N, direfluks selama 2 jam, didinginkan dan disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Sari air dikumpulkan dan diuapkan pada temperatur tidak lebih dari 50o
Sebanyak 0,5 g serbuk simplisia dan ekstrak etanol kulit batang sikkam dimasukkan kedalam tabung reaksi ditambahkan 10 ml air panas, didinginkan kemudian dikocok selama 10 detik. Jika terbentuk buih yang mantap setinggi
C. Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut: 0,1 ml larutan percobaan dimasukan dalam tabung reaksi dan diuapkan di atas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish. Kemudian secara perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung, terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan ikatan gula (Depkes, 1995).
3.5.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia dan ekstrak etanol kulit batang sikkam disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1 - 2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau hijau kehitaman menunjukkan adanya tanin (Harbone, 1987).
1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan satu tetes asam klorida 2 N menunjukkan adanya saponin (Ditjen POM, 1995).
3.5.6 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dan ekstrak etanol kulit batang sikkam dimaserasi dengan 20 ml eter selama 2 jam, disaring, filtrat diuapkan dalam cawan penguap dan pada sisanya ditambahkan 2 tetes pereaksi Lieberman-Bourchard. Apabila terbentuk warna ungu atau merah yang berubah menjadi biru atau biru hijau menunjukkan adanya steroid/triterpenoid (Ditjen POM, 1995).
3.6 Pembuatan Ekstrak Etanol Kulit Batang Sikkam (EKKBS)
Pembuatan ekstrak sikkam dilakukan secara maserasi menggunakan etanol 80% (Depkes, 1979).
Cara kerja:
3.7 Percobaan Efek Antidiare
Percobaan efek antidiare meliputi penyiapan hewan percobaan, penyiapan
bahan uji, kontrol, loperamid HCl sebagai obat pembanding, oleum ricini sebagai induktor diare dan pengujian efek antidiare.
3.7.1 Penyiapan hewan percobaan
Hewan percobaan yang digunakan adalah tikus jantan putih dengan berat badan 160-210 g sebanyak 36 ekor, dibagi dalam 6 kelompok dimana setiap kelompok terdiri dari 6 ekor tikus. Dua minggu sebelum pengujian dilakukan hewan percobaan harus dipelihara dan dirawat dengan sebaik-baiknya pada kandang yang mempunyai ventilasi baik dan selalu dijaga kebersihannya. Hewan yang sehat ditandai dengan pertumbuhan dan suhu badan yang normal (Depkes, 1979).
3.7.2 Penyiapan bahan
Bahan yang digunakan meliputi suspensi CMC sebagai kontrol, suspensi loperamid HCl (imodium®) sebagai pembanding, suspensi ekstrak kulit batang sikkam sebagai bahan uji dan oleum ricini sebagai induktor diare. Pembuatan sediaan dalam bentuk suspensi bertujuan untuk mendispersikan zat-zat yang tidak larut dalam air seperti bahan tambahan pada tablet imodium® dan golongan senyawa non polar yang terkandung di dalam ekstrak.
3.7.2.1 Pembuatan suspensi CMC 1% (b/v)
3.7.2.2 Pembuatan suspensi loperamid HCl dosis 1 mg/kg bb
Tablet imodium mengandung 2 mg loperamid HCl, ditimbang sebanyak 20
tablet kemudian digerus dan diambil sebanyak 900 mg dimasukkan ke dalam
lumpang. Selanjutnya ditambahkan suspensi CMC 1% sedikit demi sedikit sambil
digerus sampai homogen lalu dicukupkan dengan suspensi CMC 1% hingga 50 ml.
3.7.2.3 Pembuatan suspensi EEKBS konsentrasi 2,25; 3; 3,75; 4,5% (b/v)
Sebanyak 2250 mg dimasukkan ke dalam lumpang, lalu ditambahkan sedikit suspensi CMC 1% digerus samapi homogen, selanjutnya dicukupkan dengan CMC 1% sampai 50 ml (4,5%). Pembuatan EEKBS dengan variasi konsentrasi (2,25; 3; 3,75)% dilakukan dengan mengambil (5; 6,7; 8,3) ml larutan suspensi EEKBS 4,5% masing-masing dimasukkan ke dalam labu tentukur 10 ml dan dicukupkan hingga garis tanda dengan suspensi CMC 1%.
3.7.3 Pengujian efek antidiare
Dosis EEKBS ditentukan berdasarkan orientasi pada hewan percobaan terhadap parameternya, yaitu 25, 50, 75, 100, 125, 150 mg/kg bb. Hasil orientasi menunjukkan bahwa dosis yang memberikan efek antidiare paling baik adalah dosis 75 mg/kg bb (2,25%), 100 mg/kg bb (3%), 125 mg/kg bb (3,75%) dan 150 mg/kg bb (4,5%) sedangkan dosis 25 dan 50 mg/kg bb tidak memiliki efek yang signifikan. Larutan suspensi dibuat bervariasi agar pemberian dosis ekstrak terhadap setiap tikus pada masing-masing kelompok seragam yaitu sebesar 0,667 ml/tikus, sebagai pembanding suspensi loperamid HCl dosis 1 mg/kg bb konsentrasi 0,03% dengan pemberian 0,667ml/tikus dan kontrol suspensi CMC 1%.
ekornya. Satu jam setelah pemberian oleum ricini masing-masing kelompok diberi perlakuan yaitu kelompok kontrol diberikan suspensi CMC 1% bb, kelompok pembanding diberikan suspensi loperamid HCl 1 mg/kg bb dan kelompok bahan uji diberikan suspensi EEKBS yang terdiri dari empat dosis yaitu 75, 100, 125 dan 150 mg/kg bb, lalu tikus ditempatkan dalam wadah pengamatan. Pengamatan dimulai 30 menit setelah pemberian oleum ricini dilakukan selama 6 jam. Parameter yang diamati meliputi saat mulai terjadinya diare, konsistensi feses, frekuensi diare dan frekuensi defekasi (Sundari, dkk., 2005).
3.8 Analisis Data
Data hasil pengamatan terhadap saat mulai terjadinya diare, konsistensi feses, frekuensi diare dan lama terjadinya diare dianalisis secara statistik berdasarkan rata-rata masing-masing kelompok dengan metode analisis variansi (ANAVA) pada tingkat kepercayaan 95%, dilanjutkan dengan uji beda rata-rata Duncan untuk melihat perbedaan nyata antar kelompok perlakuan. Analisis
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Sampel
Identifikasi sampel dilakukan di Herbarium Bogoriense, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor. Hasilnya menunjukkan sampel yang digunakan adalah benar kulit batang sikkam (Bischofia javanica Blume). Terlihat Lampiran 1, halaman 49.
4.2Hasil Karakterisasi
4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik simplisia kulit batang sikkam merupakan potongan-potongan kulit yang lebar dengan permukaan luar berwarna coklat tua sedang bagian dalam berserat berwarna coklat kemerahan dengan rasa kelat. Gambar simplisia sikkam dapat dilihat pada Lampiran 2, halaman 50.
4.2.2 Pemeriksaan karakteristik
Karakteristik serbuk simplisia dan ekstrak etanol kulit batang sikkam (EEKBS) yang diperoleh dapat dilihat pada Tabel 4.1.
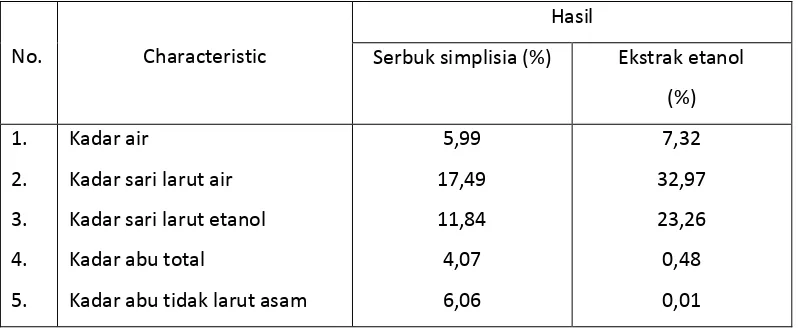
Tabel 4.1 Hasil karakterisasi serbuk simplisia dan EEKBS
No. Characteristic
Hasil
Serbuk simplisia (%) Ekstrak etanol
(%)
Kadar sari larut air
Kadar sari larut etanol
Kadar abu total
Kadar abu tidak larut asam
Karakteristik serbuk simplisia kulit batang sikkam tidak tercantum di buku Materia Medika Indonesia. Berdasarkan persyaratan umum, kadar air simplisia memenuhi syarat di mana tidak lebih dari 10%, karena jika melebihi persyaratan, memungkinkan terjadinya pertumbuhan jamur.
Penetapan kadar sari larut air dilakukan untuk mengetahui banyaknya senyawa yang ikut tersari dengan air seperti glikosida, gula, protein, enzim, zat warna, dan asam organik. Penetapan kadar sari larut etanol digunakan untuk mengetahui banyaknya senyawa kimia yang terlarut dalam pelarut etanol seperti glikosida, steroida, flavonoida, klorofil, dan dalam jumlah sedikit yang larut yaitu lemak. Tujuan penetapan kadar abu adalah untuk memberikan gambaran kandungan mineral internal dan eksternal yang berasal dari proses awal sampai terbentuknya ekstrak (Depkes, 2000).
4.3Hasil Skrining Fitokimia
Skrining fitokimia dilakukan terhadap serbuk simplisia dan EEKBS di mana hasilnya menunjukkan bahwa kulit batang sikkam mengandung senyawa kimia golongan flavanoida, glikosida, tanin dan triterpenoid.
Flavanoida diskrining dengan penambahan sebuk Mg, asam klorida pekat akan memberikan warna merah. Skrining glikosida ditunjukkan dengan terbentuknya cincin ungu dengan penambahan Molish dan asam sulfat pekat. Penambahan FeCl3 1% memberikan warna biru kehitaman yang menunjukkan
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol kulit batang
sikkam
Keterangan:
(+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
4.4 Pengujian Efek Antidiare
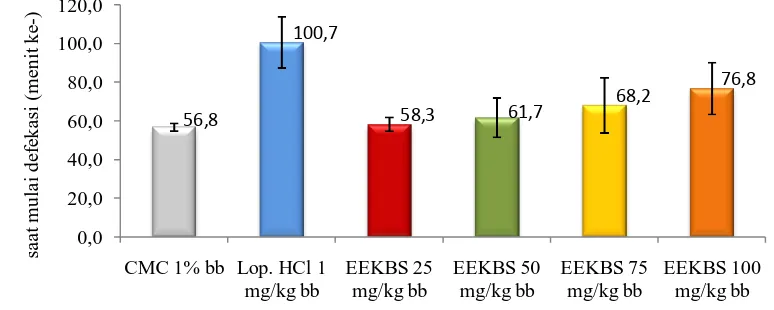
Pengujian efek antidiare dari suspensi EEKBS diawali dengan melakukan orientasi dengan menggunakan dosis 25, 50, 75, 100, 125 dan 150 mg/kg bb. Hasil orientasi menunjukkan bahwa dosis 75, 100, 125, 150 mg/kg bb memberikan efek terhadap penurunan diare sedangkan dosis 25 dan 50 mg/kg bb tidak memberikan efek yang signifikan terhadap penurunan diare.
Tikus yang telah diaklitimasi 18 jam sebelum penelitian, dikelompokkan menjadi 6 kelompok dan kemudian diberikan oleum ricini sebanyak 2 ml setiap ekornya. Satu jam kemudian masing-masing kelompok diberi perlakuan yaitu kelompok kontrol diberikan suspensi CMC 1% bb, kelompok pembanding diberikan suspensi loperamid HCl 1 mg/kg bb dan kelompok bahan uji diberikan suspensi EEKBS yang terdiri dari empat dosis yaitu 75, 100, 125 dan 150 mg/kg bb. Penentuan efek antidiare dari ekstrak etanol kulit batang sikkam dilakukan
No Pemeriksaan Hasil
Serbuk simplisia Ekstrak etanol
1 Alkaloida - -
2 Flavanoida + +
3 Glikosida + +
4 Saponin - -
5 Tanin + +
dengan cara mengamati saat mulai terjadinya diare, konsistensi feses, frekuensi diare dan lama terjadinya diare.
4.4.1 Penentuan saat mulai terjadinya diare
Hasil penentuan saat mulai terjadinya diare dapat dilihat pada Tabel 4.3.
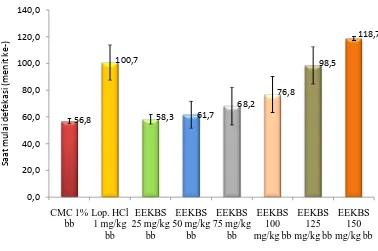
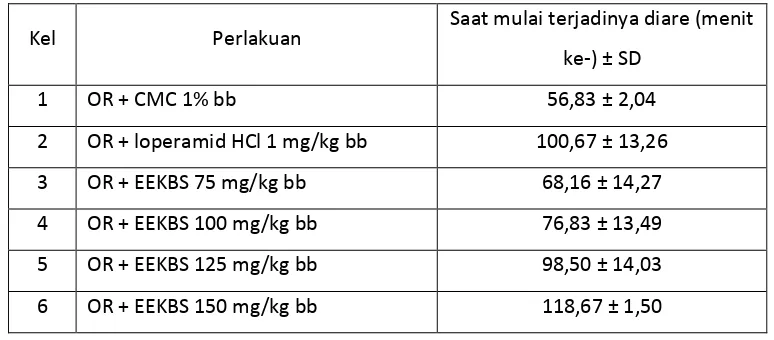
Tabel 4.3 Hasil analisis data saat mulai terjadinya diare
Keterangan:
OR : oleum ricini
EEKBS : ekstrak etanol kulit batang sikkam
Pada Tabel 4.3 dapat dilihat adanya perubahan yang nyata (p < 0,05) antara dosis dan rata-rata waktu mulai terjadinya diare pada hewan uji setelah pemberian EEKBS sebagai antidiare. Pada pemberian CMC diperoleh waktu saat mulai diare pada menit 56,83 ± 2,04 yang menggambarkan ada tidaknya pengaruh pembawa terhadap penginduksi, namun setelah pemberian EEKBS dengan dosis yang bervariasi terlihat adanya perubahan waktu mulai terjadinya diare. Hal ini memperlihatkan bahwa EEKBS dosis 150 mg/kg bb (118,67 ± 1,50) memiliki waktu mulai terjadi diare paling lama dibandingkan dengan EEKBS dosis 100 mg/kg bb (76,83 ± 13,49), dosis 75 mg/kg bb (68,18 ± 14,27) dan dosis 125 mg/kg bb (98,50 ± 14,03).
Kel Perlakuan Saat mulai terjadinya diare (menit
ke-) ± SD
1 OR + CMC 1% bb 56,83 ± 2,04
2 OR + loperamid HCl 1 mg/kg bb 100,67 ± 13,26
3 OR + EEKBS 75 mg/kg bb 68,16 ± 14,27
4 OR + EEKBS 100 mg/kg bb 76,83 ± 13,49
5 OR + EEKBS 125 mg/kg bb 98,50 ± 14,03
Gambar 4.1 Grafik saat mulai terjadi diare
Pada Gambar 4.1 dapat dilihat perbedaan grafik dari masing-masing kelompok perlakuan. Pemberian loperamid HCl 1 mg/kg bb menyebabkan perubahan waktu yang sangat berarti yaitu pada menit 100,67 ± 13,26, dimana waktu mulai terjadinya diare lebih lama dibanding dengan EEKBS dosis 75 dan 100 mg/kg bb. Berdasarkan uji statistik, EEKBS dosis 125 mg/kg bb tidak berbeda signifikan dengan loperamid HCl 1 mg/kg bb, tetapi berbeda signifikan terhadap kelompok dosis 150 mg/kg bb. Sampel uji dinyatakan memiliki efek antidiare, jika waktu mulai terjadi diare yang diperoleh lebih lama daripada kontrol dan semakin cepat terjadinya diare, maka efek antidiare akan semakin lemah. Hasil penentuan saat mulai terjadinya diare dapat dilihat pada analisis Duncan Lampiran 21, halaman 79.
Pengujian efek antidiare pada penelitian ini menggunakan metode yang sama dengan penelitian yang telah dilakukan Winda (2010), yaitu metode defekasi dengan menggunakan oleum ricini sebagai penginduksi. Perbedaanya terletak pada banyaknya oleum ricini yang diberikan pada hewan uji.
Waktu mulai terjadinya diare pada penelitian Winda yang diberi oleum ricini 0,5 ml/ekor adalah menit ke-129,2. Hasil tersebut berbeda dengan penelitian ini, yaitu pada menit ke-100,7 dengan pemberian oleum ricini 2 ml/ekor. Perbedaan waktu mulai terjadinya diare tersebut disebabkan pengaruh jumlah oleum ricini yang diberikan pada hewan uji. Semakin banyak penginduksi yang diberikan, maka semakin cepat diare yang ditimbulkan (Tan dan Rahardja, 2002).
4.4.2 Penentuan konsistensi feses
Penentuan konsistensi feses dapat dilakukan dengan cara melihat bentuk feses yang terjadi. Hasil penentuan konsiatensi feses dapat dilihat pada Tabel 4.4 berikut ini:
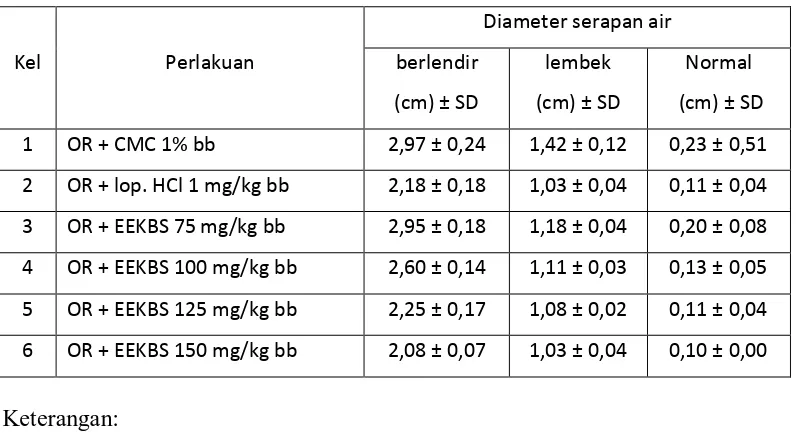
Tabel 4.4 Hasil analisis data diameter serapan air
Keterangan:
OR : oleum ricini
EEKBS : ekstrak etanol kulit batang sikkam
Konsistensi feses dapat dikategorikan ke dalam tiga kelompok yaitu berlendir (BL) dengan diameter serapan air lebih besar dari 2 cm, lembek (L) dengan diameter serapan air antara 1-2 cm dan normal (N) dengan diameter serapan air lebih kecil dari 1 cm.
Tabel 4.5 Hasil analisis data berat feses
Keterangan:
OR : oleum ricini
EEKBS : ekstrak kulit batang sikkam
Gambar 4.2 Grafik konsistensi feses
Pada Tabel 4.4; 4.5 dan Gambar 4.2 di atas dapat dilihat hubungan antara dosis, diameter serapan air dan berat feses hewan uji setelah pemberian EEKBS seperti yang terlihat pada Lampiran 16, halaman 69.
Berdasarkan hasil analisis statistik ANAVA (p < 0,05) dilanjutkan uji beda rata-rata Duncan konsistensi feses berlendir, menunjukkan bahwa diameter serapan air yang dihasilkan kelompok dosis 100 mg/kg bb berbeda signifikan
dengan masing-masing kelompok. Perbedaan yang tidak signifikan dihasilkan oleh kelompok pembanding, dosis 125 dan 150 mg/kg bb, begitu juga antara kelompok dosis 75 mg/kg bb dengan kelompok kontrol. Apabila dilihat dari berat feses yang dihasilkan, maka dosis 100 dan 150 mg/kg bb memiliki efek yang berbeda secara signifikan terhadap kelompok lainnya sedangkan antara kelompok dosis 125 mg/kg bb dengan pembanding dan antara kelompok dosis 75 mg/kg bb dengan kelompok kontrol tidak berbeda secara signifikan.
Pada uji beda rata-rata Duncan feses lembek, menunjukkan bahwa diameter serapan air dan berat feses yang dihasilkan kelompok kontrol, berbeda secara signifikan terhadap masing-masing kelompok. Efek yang tidak berbeda secara signifikan dihasilkan oleh kelompok dosis 125, 150 mg/kg bb dan kelompok pembanding, demikian juga antara kelompok dosis 75 mg/kg bb dengan dosis 100 mg/kg bb.
Hasil uji Duncan feses normal, menunjukkan bahwa diameter serapan air yang dihasilkan kelompok kontrol dan dosis 75 mg/kg bb berbeda secara signifikan terhadap kelompok pembanding, dosis 100, 125 dan 150 mg/kg bb. Dilihat dari berat feses yang dihasilkan, antara kelompok pembanding, dosis 125 dan 150 mg/kg bb tidak berbeda signifikan, demikian juga antara kelompok dosis 75 dengan 100 mg/kg bb sedangkan kelompok kontrol, efek yang dihasilkan berbeda signifikan terhadap masing-masing kelompok.
Tabel 4.6 Waktu defekasi setiap 30 menit selama 6 jam pengamatan setelah
diberi oleum ricini
Keterangan:
Pada kelompok kontrol, konsistensi feses berlendir terjadi pada menit 54 -177, lembek 184 - 321 dan feses normal terbentuk pada menit 326 - 359. Kelompok pembanding, feses berlendir terjadi pada menit 87 - 117, lembek 143 - 235 dan normal terbentuk pada menit 234 - 250. Pada kelompok dosis 75 mg/kg
bb, feses berlendir mulai terbentuk pada menit ke-57 - 125, lembek 148 - 291dan terbentuknya feses normal dimulai pada menit 321 - 331. Konsistensi feses yang terjadi pada pemberian EEKBS 100 mg/kg bb, berlendir pada menit 59 - 138, lembek 156 - 234 dan normal terjadi pada menit 248 - 274. Pada kelompok dosis 125, feses berlendir mulai terbentuk di menit 89 - 119, lembek 122 - 233, dan feses normal menit 235 - 253 sedangkan pada kelompok dosis 150 mg/kg bb, terbentuknya feses berlendir terjadi pada menit 89 - 119, lembek 144 - 198 dan normal 204 - 230.
EEKBS dosis 125 mg/kg bb dapat membentuk konsistensi feses normal yang tidak berbeda signifikan (p < 0,05) dengan kelompok pembanding. Dari hasil tersebut dapat disimpulkan bahwa semakin cepat terbentuk konsistensi feses normal, maka semakin kuat efek anti diare yang dimilikinya.
4.4.3 Penentuan frekuensi diare
Pada Tabel 4.7 dan Gambar 4.3, terlihat hubungan antara dosis dengan frekuensi diare pada hewan uji setelah pemberian EEKBS seperti yang terlihat pada Lampiran 17, halaman 70.
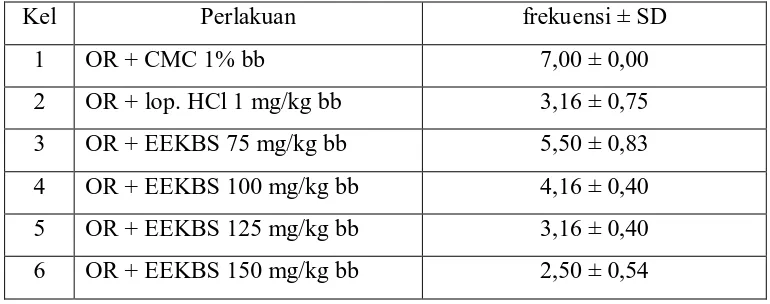
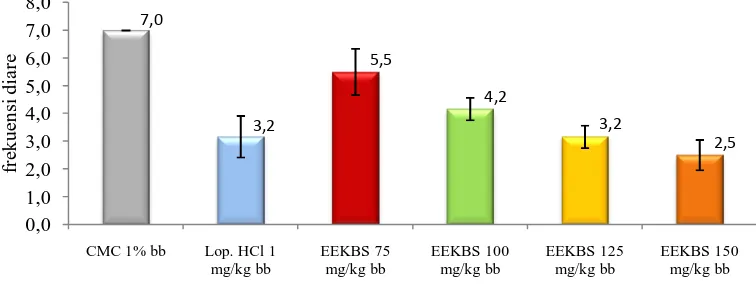
Tabel 4.7 Hasil analisis data frekuensi diare
Keterangan:
OR : oleum ricini
EEKBS : ekstrak etanol kulit batang sikkam
Kel Perlakuan frekuensi ± SD
1 OR + CMC 1% bb 7,00 ± 0,00
Hasil pengujian EEKBS terhadap antidiare terlihat adanya perubahan yang nyata (p<0,05) terhadap frekuensi diare bila dibandingkan dengan frekuensi yang dihasilkan oleh kelompok kontrol (7,0 ± 0,00 kali). Pemberian dosis 125 mg/kg bb menyebabkan penurunan frekuensi diare (3,16 ± 0,40 kali) yang sebanding dengan kelompok pembanding (3,16 ± 0,75 kali) lebih kecil daripada kelompok dosis 75 mg/kg bb (5,5 ± 0,83 kali) dan 100 mg/kg bb (4,16 ± 0,40 kali), tetapi dengan pemberian dosis 150 mg/kg bb frekuensi diare yang ditimbulkan lebih sedikit daripada kelompok pembanding yaitu 2,50 ± 0,54.
Gambar 4.3 Grafik frekuensi diare
Berdasarkan hasil analisis statistik ANAVA (p<0,05) dilanjutkan uji beda rata-rata Duncan frekuensi diare menunjukkan bahwa kelompok kontrol, dosis 75 dan 100 mg/kg bb berbeda signifikan terhadap masing-masing kelompok saedangkan antara kelompok pembanding, dosis 125 dan 150 mg/kg bb tidak berbeda secara signifikan.
4.4.4 Penentuan lama terjadinya diare
Pada Tabel 4.8 dan Gambar 4.4, terlihat hubungan antara dosis dengan lama terjadinya diare pada hewan uji setelah pemberian EEKBS seperti yang terlihat pada Lampiran 18, halaman 71.
Tabel 4.8 Hasil analisis lama terjadinya diare
Keterangan:
OR : oleum ricini
EEKBS : ekstrak etanol kulit batang sikkam
Pemberian oleum ricini dan CMC menghasilkan lama terjadi diare 291 ± 14,26 menit, namun setelah pemberian EEKBS dengan dosis yang bervariasi mengakibatkan waktu lama terjadinya diare menjadi berkurang. EEKBS dosis 150 mg/kg bb (97 ± 9,94 menit) memiliki waktu lama terjadi diare tersingkat jika dibandingkan kelompok dosis 75 mg/kg bb (263 ± 19,92 menit), dosis 100 mg/kg bb (185 ± 14,22 menit), dosis 125 mg/kg bb (141 ± 18,59 menit) dan kelompok pembanding (138 ±17,52 menit).
Gambar 4.4 Grafik lama terjadi diare
Dari hasil analisis statistik ANAVA (p<0,05) dilanjutkan uji beda rata-rata Duncan lama terjadinya diare menunjukkan bahwa kelompok kontrol, dosis 75,
100 dan 150 mg/kg bb berbeda secara signifikan terhadap masing-masing kelompok sedangkan efek yang tidak berbeda secara signifikan (P<0,05) dihasilkan oleh kelompok dosis 125 mg/kg bb dengan pembanding. Hasil penentuan saat mulai terjadinya diare dapat dilihat pada analisis Duncan Lampiran 21, halaman 79.
Dari parameter yang telah diamati, efek antidiare dapat dikategorikan berdasarkan tingkat efektivitasnya dalam menekan diare sebagai berikut:
1. lemah, bila efek antidiare diatas efek kelompok kontrol dan dibawah efek kelompok pembanding.
2. sebanding/ sama, bila efek antidiare sama dengan efek kelompok pembanding.
3. kuat, bila efek antidiare diatas efek kelompok pembanding.
Berdasarkan kategori diatas, efek antidiare dari masing-masing kelompok bahan uji dapat dikategorikan sebagai berikut: dosis 75 dan 100 mg/kg bb mempunyai efektivitas yang lemah; dosis 125 mg/kg bb mempunyai efektivitas yang sebanding atau sama dan dosis 150 mg/kg bb mempunyai efektivitas yang kuat.
menunjukkan bahwa kulit batang sikkam mengandung tanin. Diduga tanin di dalam sampel inilah yang memberikan aktivitas antidiare. Tanin dapat mengurangi intensitas diare dengan cara menciutkan selaput lendir usus dan mengecilkan pori sehingga akan menghambat sekresi cairan dan elektrolit (Tan dan Rahardja, 2002). Selain itu, sifat adstringen tanin akan membuat usus halus lebih tahan (resisten) terhadap rangsangan senyawa kimia (toksin bakteri dan castor oil ) yang mengakibatkan diare (Kumar, 2001).
Beberapa penelitian juga telah melaporkan mengenai flavonoid sebagai antidiare. Mekanisme flavonoid dalam menghentikan diare yang diinduksi oleh castor oil adalah dengan menghambat motilitas usus sehingga mengurangi sekresi
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa:
1. Hasil pemeriksaan karakteristik serbuk simplisia kulit batang sikkam meliput i kadar air 5,99%, kadar sari larut air 17,49%, kadar sari larut etanol 11,84%, kadar abu total 4,07% dan kadar abu tidak larut asam 6,06% sedangkan hasil pemeriksaan karakterisasi ekstrak etanol kulit batang sikkam adalah kadar air 7,32%, kadar sari larut air 32,97%, kadar sari larut etanol 23,26%, kadar abu total 0,48%, kadar abu tidak larut asam 0,01%.
2. Hasil skrining fitokimia menunjukkan serbuk simplisia dan ekstrak etanol kulit batang sikkam mengandung senyawa kimia golongan flavanoida, glikosida, tanin, steroida/triterpenoida.
3. Ekstrak etanol kulit batang sikkam dosis 75, 100, 125 dan 150 mg/kg bb mempunyai efek sebagai antidiare yang diberikan pada tikus yang diinduksi dengan oleum ricini menggunakan metode defekasi. Pemberian dosis 125 mg/kg bb menunjukkan efek yang tidak berbeda secara signifikan (p < 0,05) dengan obat pembanding loperamid HCl 1 mg/kg bb.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Sikka m termasuk jenis daerah: singkam, cingkam (Jawa), di negara-negara lain disebut sebagai jitang (Malasia), tuai Kayunya dalam perdagangan dikenal dengan Bishop wood atau Java cedar (Rajbongshi, et al., 2014).
Tumbuhan ini tumbuh di dataran rendah sampai ketinggian ± 1500 m dari permukaan laut, berasal dari Asia selatan, Asia tenggara, Australia dan China. Pohon ini menyebar luas mulai dari barat
2.1.1 Sistematika tumbuhan
Sistematika tumbuhan sikkam adalah sebagai berikut (Seed Leaflet, 2012):
Kingdom
Divisi : Spermatophyta Kelas : Dicotyledoneae Ordo : Euphorbiales Famili : Euphorbiaceae Genus : Bischofia
2.1.2 Morfologi tumbuhan
Pohon sikkam (Bischofia javanica Blume) merupakan pohon besar yang tingginya dapat mencapai 40 m, diameter batang 95 - 150 cm, bercabang-cabang, arah tumbuh tegak lurus, berkayu, biasanya keras dan kuat, bentuk batang bulat, tanpa mata kayu, termasuk dalam tumbuhan menahun (Seed Leaflet, 2012).
Kulit batang luar memecah dan bersisik berwarna coklat kemerahan hingga keunguan, di sebelah dalam berwarna merah jambu, menyerat dan mengeluarkan getah merah bening, encer atau agak kental seperti jeli (Rajbongshi, et al., 2014). Daun berwarna hijau dengan panjang 4 - 8 inci dengan ketebalan 7 - 22 mm, bentuk daun lonjong berlekuk tiga serta meruncing ke ujung daun. Letak daun spiral/melingkar, mempunyai tangkai daun panjang (3 - 8 inci), tepinya beringgit hingga bergerigi halus, bertulang daun menyirip, sisi atas mengkilap. kebiruan jika masak, dengan 1 - 2 biji di setiap ruang, lonjong, panjang 5 mm (Bachheti, et al., 2013).
2.1.3 Kandungan kimia tumbuhan
Kandungan sikkam adalah protein (18,69%), karbohidrat (18,91%), tanin (16%) (Ajaib dan Khan, 2012), flavonoid, kuersetin, sitosterol, asam stearat (3,89%), asam linolenat (56,76%), asam palmitat (12,28%), serat (5,32%), kalsium, kalium, natrium, magnesium (Bachheti, et al., 2013), vitamin C, asam elagit (8 - 10% ) (Rajbongshi, et al., 2014).
2.1.4 Kegunaan tumbuhan
untuk mewarnai pakaian, jala dan anyaman dari bambu (Bachheti, et al., 2013). Berbagai penelitian telah dilakukan untuk menguji manfaat sikkam (bischofia javanica Blume), seperti antileukimia, antiinflamasi (Sutharson, et al., 2009),
antimikroba, antialergi (Rajbongshi, et al., 2014), mengobati luka bakar, antihelmintik (Seed Leaflet, 2012), antidiare dan merangsang pertumbuhan rambut (Pradhan dan Badola, 2008).
2.2 Simplisia dan Ekstrak
2.2.1 Simplisia
Simplisia adalah bahan alamiah yang digunakan sebagai obat dan belum mengalami pengolahan apapun, kecuali dikatakan lain, berupa bahan yang telah dikeringkan. Simplisia dibedakan atas simplisia nabati, simplisia hewani dan simplisia pelikan (Depkes, 2000).
2.2.2 Ekstrak
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian rupa sehingga memenuhi syarat baku yang telah ditetapkan (Depkes, 2000).
Ekstraksi adalah kegiatan penarikan zat aktif dengan menggunakan pelarut yang sesuai. Metode ekstraksi dengan menggunakan pelarut dapat dibagi kedalam dua cara yaitu:
a. Cara dingin
(kamar). Secara teknologi termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi yang seimbang antara bahan dan pelarut.
2. Perkolasi, adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction), umunya dilakukan pada temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi dan tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus-menerus sampai diperoleh ekstrak (perkolat).
b. Cara panas
1. Refluks adalah ektraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
2. Soxhlet, adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik. 3. Digesti, adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40 - 50o
4. Infus, adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96 - 98
C.
o
5. Dekok, adalah infus pada waktu yang lebih lama (≥ 30 C) selama waktu tertentu (15 - 20 menit).
o
2.3Uraian Golongan Senyawa Kimia Sikkam
Senyawa kimia yang terdapat pada sikkam meliputi flavonoida, glikosida, tanin dan steroida/triterpenoida.
2.3.1 Flavonoida
Flavonoid mengandung 15 atom karbon dalam inti dasarnya mempunyai struktur C6-C3-C6 yaitu dua cincin aromatik yang dihubungkan oleh tiga atom karbon yang merupakan rantai alifatik. Menurut perkiraan, kira-kira 2% dari seluruh karbon yang difotosintesis oleh tumbuhan diubah menjadi flavonoid atau senyawa yang berkaitan erat dengannya. Sebagian besar tanin berasal dari flavonoid sehingga merupakan salah satu golongan fenol alam yang terbesar (Markham, 1988).
Flavonoid mencakup banyak pigmen dan terdapat pada seluruh dunia tumbuhan mulai dari fungus sampai angiospermae. Beberapa fungsi flavonoid untuk tumbuhan yaitu pengaturan tumbuh, pengaturan fotosintesis, kerja antimikroba dan antivirus dan anti serangga (Robinson, 1995).
2.3.2 Glikosida
Glikosida adalah suatu senyawa, bila dihidrolisis akan terurai menjadi gula (glikon) dan senyawa lain (aglikon atau genin). Pembagian glikosida paling banyak berdasarkan aglikonnya, umumnya mudah terhidrolisis oleh asam mineral atau enzim. Hidrolisis oleh asam memerlukan panas sedangkan oleh enzim tidak memerlukan panas (Farnsworth, 1966).
2.3.3 Tanin
Tanin terdapat luas pada tumbuhan berpembuluh. Tanin dapat bereaksi dengan protein membentuk kopolimer yang tak larut dalam air. Sebagian besar tumbuhan banyak mengandung tanin rasanya sepat. Salah satu fungsi tanin dalam tumbuhan ialah sebagai penolak hewan pemakan tumbuhan (Robinson, 1995).
Berdasarkan identitas inti fenolit dan cara pembentukannya, tanin dibagi menjadi tiga yaitu tanin yang terhidrolisis, tanin yang terkondensasi dan tanin kompleks (Trease dan Evans, 1983).
a. Tanin terhidrolisis (Hydrosable Tannin)
Tanin jenis ini biasanya berikatan pada karbohidrat dengan membentuk jembatan oksigen dan dapat dihidrolisis menggunakan asam sulfat atau asam klorida ataupun dengan enzim. Prekursor pembentukan tanin ini adalah asam fenolit (asam galat, asam elagit), residu glukosa, serta antara asam fenolit dan glukosa ada ikatan ester.
b. Tanin terkondensasi (Condesed Tannins)
Proanthocyanidin yang merupakan polimer dari flavanoida yang dihubungkan
melalui C8 dengan C4. Prekursor pembentukan tanin ini adalah flavanoida, catechin, flavonol -3-4-diol.
c. Tanin kompleks (Complex Tannin)
Tanin kompleks merupakan campuran antara tanin terhidrolisis dan tanin terkondensasi. Contoh tumbuhan yang mengandung tanin kompleks adalah teh, kuercus, dan castanea. Ada dua tipe dari tanin kompleks, yaitu true tannin (berat molekul 1000-5000) dan pseudo tannin (berat molekul kurang dari 1000).
Tanin dapat mengurangi intensitas diare dengan cara menciutkan selaput lendir usus dan mengecilkan pori sehingga akan menghambat sekresi cairan dan elektrolit (Tan dan Rahardja, 2002). Sifat adstringen tanin akan membuat usus halus lebih tahan (resisten) terhadap rangsangan bakteri Escherichia coli, Shigella sp, Salmonella sp, virus, amuba, dan toksin bakteri seperti Staphylococcus aureus,
Clostridium welchii yang mengakibatkan diare (Kumar, 2001).
2.3.4 Steroid/triterpenoid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isopren dan secara biosintesis diturunkan dari hidrokarbon C30
berkhasiat sebagai anti diabetes, gangguan menstruasi, gangguan kulit kerusakan hati dan malaria (Robinson, 1995).
Steroida adalah triterpen yang kerangka dasarnya sistem cincin siklopentana perhidrofenantren. Dahulu steroid dianggap sebagai senyawa satwa (digunakan sebagai hormon kelamin, asam empedu), tetapi pada tahun-tahun terakhir ini makin banyak senyawa steroid yang ditemukan dalam jaringan tumbuhan (Harborne, 1987).
Gambar 2.1. Struktur dasar steroida dan sistem penomorannya
Menurut asalnya senyawa steroid dibagi atas:
a. Zoosterol, yaitu steroid yang berasal dari hewan, misalnya kolesterol.
b. Fitosterol, yaitu steroid yang berasal dari tumbuhan, misalnya sitosterol dan stigmasterol.
c. Mycosterol, yaitu steroid yang berasal dari fungi, misalnya ergosterol.
d. Marinesterol, yaitu steroid yang berasal dari organisme laut, misalnya spongesterol.
2.4 Uraian Diare
Diare adalah buang air besar (defekasi) dengan tinja berbentuk cair atau setengah cair (setengah padat), kandungan air tinja lebih banyak dari biasanya lebih dari 200 g/24 jam. Definisi lain memakai kriteria frekuensi, yaitu buang air besar encer lebih dari 3 kali per hari. Buang air besar encer tersebut dapat/tanpa disertai lendir dan darah (Wells, 2006).
Secara normal makanan yang terdapat di dalam lambung dicerna menjadi bubur (chymus), kemudian diteruskan ke usus halus untuk diuraikan lebih lanjut oleh enzim-enzim. Setelah terjadi resorpsi, sisa chymus tersebut yang terdiri dari 90% air dan sisa-sisa makanan yang sukar dicernakan, diteruskan ke usus besar (colon). Bakteri-bakteri yang biasanya selalu berada di kolon mencerna lagi sisa-sisa (serat-serat) tersebut, sehingga sebagian besar dari sisa-sisa-sisa-sisa tersebut dapat diserap selama perjalanan melalui usus besar. Airnya juga direabsorpsi kembali sehingga akhirnya isi usus menjadi lebih padat (Jeejeebhoy, 1977). Tetapi kadang terjadi peristaltik usus yang meningkat sehingga pelintasan chymus sangat dipercepat dan masih mengandung banyak air pada saat meninggalkan tubuh sebagai tinja. Penyebab utamanya adalah bertumpuknya cairan di usus akibat terganggunya resorpsi air dan atau terjadinya hipersekresi. Pada keadaan normal, proses reabsorpsi dan sekresi dari air dan elektrolit-elektrolit berlangsung pada waktu yang sama di sel-sel epitel mukosa. Biasanya reabsorpsi melebihi sekresi, tetapi karena suatu sebab sekresi menjadi lebih besar daripada reabsorpsi, sehingga terjadi diare (Tan dan Rahardja, 2007).
2.4.1 Klasifikasi diare
1. Diare karena infeksi, meliputi:
a. Diare akibat virus, misalnya influenza perut dan travelers diarrhea yang dapat disebabkan oleh rotavirus dan adenovirus.
b. Diare akibat bakteri (invasif), disebabkan oleh Salmonella, Shigella, Campylobacter, dan jenis Coli tertentu.
c. Diare parasiter, disebabkan oleh Entamooeba Hystolitica, Giardia Lambia, Cryptosporidium dan Cyclospora yang terutama terjadi didaerah tropis.
d. Diare akibat enterotoksin, penyebabnya adalah E.Coli dan Vibrio Cholerae dan yang jarang adalah Shigella, Salmonella, Campylobacter dan Entamoeba Hystolitica (Tan dan Rahardja, 2002).
2. Klasifikasi berdasarkan organ yang terkena infeksi:
a. Diare infeksi enteral atau diare karena infeksi di usus (bakteri, virus, parasit).
b. Diare infeksi parenteral atau diare karena infeksi di luar usus (otitis, media, infeksi saluran pernafasan, infeksi saluran urin, dan lainnya).
3. Klasifikasi diare berdasarkan lamanya diare:
a. Diare akut merupakan diare yang bersifat mendadak dan bisa berlangsung terus selama beberapa hari disebabkan oleh infeksi usus sehingga dapat terjadi pada setiap umur.
b. Diare kronik merupakan diare yang berlangsung lebih dari dua minggu (Suharyono, 1991).
2.4.2 Obat-obat diare
1. Kemoterapeutik, untuk terapi kausal yakni memberantas bakteri penyebab diare, seperti antibiotik, sulfonamid, kinolon dan furazolidon.
2. Obstipansia, yang dibagi menjadi:
a. zat-zat penekan peristaltik, candu dan alkaloidanya, derivat petidin (difenoksilat dan loperamid), dan antikolinergik (atropine dan ekstrak belladonna).
b. adstringen, menciutkan selaput lendir usus, misalnya asam samak (tanin) dan tanalbumin, pektin; adsorbensia, misalnya carbo adsorbens yang pada permukaannya dapat menyerap zat-zat beracun yang dihasilkan oleh bakteri, antara lain kaolin, garam-garam bismuth dan aluminium.
3. Spasmolitik, yakni zat-zat yang dapat melepaskan kejang-kejang otot penyebab nyeri perut pada diare (Tan dan Rahardja, 2007).
2.5 Loperamid Hidrokloridum
Loperamid merupakan derivat difenoksilat dengan khasiat obstipasi dua sampai tiga kali lebih kuat, tetapi tanpa khasiat terhadap susunan saraf pusat sehingga tidak menimbulkan ketergantungan. Zat ini mampu menormalkan keseimbangan resorpsi-sekresi dari sel-sel mukosa dengan memulihkan sel-sel yang berada dalam keadaan hipersekresi ke keadaan resorpsi normal kembali (Tan dan Rahardja, 2007).
sehingga diduga efek konstipasinya diakibatkan oleh ikatan loperamid dengan reseptor tersebut.
2.6 Minyak Jarak
Oleum ricini atau castor oil atau minyak jarak berasar dari biji Ricinus communis suatu trigliserida risinoleat dan asam lemak tidak jenuh. Di dalam usus
halus minyak jarak dihidrolisis oleh enzim lipase menjadi gliserol dan asam risinoleat. Asam risinoleat inilah yang merupakan bahan aktif sebagai pencahar. Obat ini merupakan bahan induksi diare pada penelitian diare secara eksperimental pada hewan percobaan (Teke, et al., 2007).
Menurut Katzung (2001), asam risinoleat hasil hidrolisis castor oil, merupakan iritan lokal yang dapat meningkatkan motilitas usus. Mula kerjanya cepat dan berlangsung terus sampai senyawa ini diekskresi melalui kolon. Dosis oleum ricini adalah 2 - 3 sendok makan (15 - 30 ml), diberikan sewaktu perut kosong. Efeknya timbul 1 sampai 6 jam setelah pemberian, berupa pengeluaran buang air besar berbentuk encer (Anwar, 2000).
2.7Metode-metode Pengujian Antidiare
Ada 3 metode yang biasa digunakan untuk pengujian antidiare, yaitu: 1. metode margens (pengamatan lintas norit)
kecil dari kontrol bahwa dapat disimpulkan bahwa sampel uji memiliki efek antidiare.
2. metode pola defekasi
Pada metode ini diamati frekuensi buang air besar, konsistensi feses, massa feses dan waktu terjadinya diare. Semuanya diamati dalam jangka waktu tertentu. Jika frekuensi buang air besar lebih kecil, konsistensi feses lebih padat, massa feses lebih banyak dan waktu diare lebih lama dibandingkan kontrol, maka dapat disimpulkan bahwa yang diuji memiliki efek sebagai antidiare.
3. secara in vitro
BAB I PENDAHULUAN
1.1 Latar Belakang
Obat tradisional telah lama digunakan baik di negara berkembang maupun negara maju. Menurut WHO (1992), sekitar 65% dari penduduk negara maju dan 80% dari penduduk negara berkembang telah menggunakan obat herbal maupun obat tradisional. Dukungan WHO terhadap konsep back to nature dibuktikan dengan adanya rekomendasi untuk menggunakan obat tradisional atau herbal dalam pemeliharaan kesehatan masyarakat dan pencegahan penyakit, terutama untuk penyakit kronis, penyakit degeneratif dan kanker.
Bangsa Indonesia telah lama mengenal dan menggunakan tumbuhan berkhasiat obat sebagai salah satu upaya dalam menanggulangi masalah kesehatan. Pengetahuan tumbuhan berkhasiat obat hanya berdasarkan pengalaman dan keterampilan yang secara turun-temurun telah diwariskan dari satu generasi ke generasi berikut dan penggunaannya telah dilakukan nenek moyang kita sejak berabad-abad yang lalu (Sari, 2006).
2000). Tanin bersifat sebagai antibakteri dan menciutkan dinding usus (Nurdjanah dan Christina, 2005; Ajaib dan Khan, 2012). Senyawa flavanoid dan terpenoid juga dapat berkhasiat sebagai antidiare (Otshudi, et al., 2000) selain itu, tumbuhan ini dapat juga berkhasiat sebagai antileukimia dan antiinflamasi (Sutharson, et al., 2009).
Diare didefenisikan sebagai suatu keadaan peningkatan kecepatan pengosongan usus besar dan peningkatan kandungan air pada feses. Ciri-ciri diare umumnya ditandai dengan frekuensi defekasi yang melebihi frekuensi normal, konsistensi encer, bersifat akut dan kronis (Suharyono, 1991). Diare akut ditandai dengan adanya infeksi yang disebabkan oleh bakteri Escherichia coli, Shigella sp, Salmonella sp, virus, amuba dan oleh toksin bakteri antara lain Staphylococcus
aureus, Clostridium welchii yang mencemari makanan, sedangkan diare kronis
terkait dengan gangguan gastrointestinal (Jeejeebhoy, 1977).
Berdasarkan uraian di atas maka pada penelitian dilakukan pengujian efek antidiare ekstrak etanol kulit batang sikkam terhadap tikus yang diiduksi oleum ricini menggunakan metode defekasi.
1.2 Perumusan Masalah
Perumusan masalah pada penelitian ini adalah:
a. apakah simplisia dan ekstrak etanol kulit batang sikkam dapat ditentukan karakteristiknya?
b. apakah serbuk simplisia dan ekstrak etanol kulit batang sikkam dapat ditentukan golongan senyawa kimianya?
1.3 Hipotesis
Hipotesis pada penelitian ini adalah:
a. karakteristik simplisia dan ekstrak etanol kulit batang sikkam dapat ditentukan dengan melakukan karakterisasi.
b. serbuk simplisia dan ekstrak etanol kulit batang sikkam dapat ditentukan golongan seyawa kimianya dengan melakukan skrining fitokimia.
c. ekstrak etanol kulit batang sikkam mempunyai efek antidiare dan dosis optimal yang diperoleh sebanding dengan loperamid HCl.
1.4 Tujuan
Adapun tujuan dari penelitian ini adalah untuk mengetahui: a. karakterisasi simplisia dan ekstrak etanol kulit batang sikkam.
b. skrining fitokimia serbuk simplisia dan ekstrak etanol kulit batang sikkam. c. efek antidiare ekstrak etanol kulit batang sikkam dan dosis optimal bila
dibandingkan dengan loperamid HCl.
1.5 Manfaat
1.6 Kerangka Pikir Penilitian
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Kerangka pikir penelitian
Simplisia kulit batang sikkam
Karakteristik simplisia