PANJANG
MOHAMMAD KHOTIB
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Density Functional Theory dalam
Sintesis, Karakterisasi, dan Prediksi Aplikasi. Kasus: Senyawa Zn-Dialkilditiokarbamat Rantai Panjang adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2010
MOHAMMAD KHOTIB. Density Functional Theory dalam Sintesis, Karakterisasi, dan Prediksi Aplikasi. Kasus: Zn-Dialkilditiokarbamat Rantai Panjang. Dibimbing oleh ZAINAL ALIM MAS’UD dan H.M. ANWAR NUR.
Senyawa alkilditiokarbamat merupakan senyawa organosulfur, yang dalam bentuk terkoordinasi dengan logam memililki aplikasi luas, misalnya dibidang otomotif sebagai zat tambahan pelumas. Sintesis kompleks logam alkilditiokarbamat rantai panjang belum mendapatkan perhatian sehingga diperlukan suatu kajian metode sintesis dan karakterisasi sifat-sifatnya. Sumber alkil rantai panjang dapat berasal dari minyak sawit atau minyak nabati lainnya. Sumber alkil rantai panjang akan terjamin keberlangsungannya karena Indonesia merupakan negara penghasil minyak sawit terbesar kedua setelah malaysia. Selain itu, pemanfaatan ini juga menjadi khasanah pengembangan produk turunan dari minyak sawit, selain sebagai minyak goreng, bahan baku sabun, surfaktan, dan biodiesel.
Penggunaan instrumentasi dalam identifikasi mekanisme reaksi dan optimalisasi geometri struktur akan membutuhkan waktu lama dan biaya yang besar. Penggunaan kimia komputasi (kimia kunatum) menjadi bagian terintegrasi dalam mengidentifikasi mekanisme reaksi, optimimisasi geometri struktur dan sifat senyawa kimia dengan cepat dan hasil yang mendekati percobaan sehingga mengefisienkan waktu penelitian dan mendapatkan terobosan yang efektif dalam penjelasan mekanisme, molekul, sifat, fungsi, dan target-target yang lain. Langkah dalam mengintegrasikan kimia komputasi/kimia kuantum, dalam hal ini Density Functioal Theory (DFT), merupakan aplikasi dari manajemen sains seperti diilustrasikan dalam Gambar 1.
Gambar 1 Ilustrasi penggunaan DFT untuk mendapatkan senyawa dengan fungsi yang ditargetkan
Pola sintesis dibutilditiokarbamat digunakan untuk mensintesis Zn-dialkilditikarbamat rantai panjang, dalam hal ini Zn-dipalmitilditiokarbamat. Sintesis Zn-dipalmitilditiokarbamat diawali dengan sintesis amida sekunder dari palmitilamina dan palmitoilklorida. Rendemen yang diperoleh dalam sintesis amida sekunder ini sebesar 90.91%. Hasil perhitungan DFT metode B3LYP dengan basis set 6-31G* menunjukkan bahwa reaksi pembentukan amida melalui asilklorida dan amina primer bersifat eksoterm (energi reaktan lebih tinggi dari pada energi produk). Berdasarkan perhitungan DFT, pembentukan amida sekunder ini terjadi melalui serangan nukleofilik dari amina primer ke atom karbon karbonil dari asil klorida, karena adanya kesesusaian secara simetri antara orbital HOMO dari amina primer (sumber elektron) dan orbital LUMO dari asil klorida. Amida sekunder yang diperoleh direduksi menjadi amina sekunder menggunakan LiAlH4. Rendemen yang diperoleh dari reduksi amida sekunder (dipalmitilamida) menjadi dipalmitilamina sebesar 47.5%. Dipalmitilamina
RENCANA
M ANAJEM EN KLASIK M ANAJEM EN SAINS
PERCOBAAN I
SESUAI TIDAK
PERCOBAAN II
SESUAI TIDAK
PERCOBAAN III
KIM IA KUANTUM (DFT)
PREDIKSI LANGKAH & TARGET
PEM BUKTIAN LANGKAH
HPLC. Pengukuran FTIR yang diperoleh dibandingkan dengan hasil perhitungan dan menunjukkan bahwa hasil pengukuran dan perhitungan DFT terhadap rasio intensitas dan bilangan gelombang dari senyawa Zn-dibutilditiokarbamat tidak berbeda nyata pada tingkat kepercayaan 95%. Hasil optimasi geometri DFT metode B3LYP basis set 6-31G* menunjukkan Zn-dibutilditiokarbamat berbentuk tetrahedral seperti yang diperoleh dari hasil pengukkuran XRD dengan sudut ikatan S-C-S 116.85O dan hasil kristalografi sebesar 117.8(5)O. Panjang ikatan hasil analisis kristalografi sinar X antara atom S-C dalam struktur Zn-dibutilditiokarbamat sebesar 0.1704-0.1725 nm. Hasil perhitungan dengan DFT sebasar 1.691-1.692 nm (senyawa mono inti) dan 1.683-1.743 nm (senyawa dua inti).
Perkiraan sifat dan aplikasi dari produk yang diperoleh (Zn-dialkilditiokarbamat) sebagai aditif pelumas (antiwear dan antifriksi) didasarkan pada nilai chemical hardness dan elektronegativitas absolut. Pembanding yang digunakan adalah Mo-dialkilditiokarbamat (antifriksi yang sangat baik, antiwear yang kurang baik dibandingkan Zn-DTP) dan Zn-dialkilditiofosfat (antiwear yang sangat baik, antifriksi yang kurang baik dibandingkan Mo-DTC). Hasil perhitungan DFT metode B3LYP dengan basis set 6-31G* terhadap Zn-dialkilditiokarbamat (C4-C18) diperoleh nilai elektronegativitas absolute yang lebih rendah dari pada Mo-Dialkilditiokarbamat, yang berarti memiliki kemampuan antifriksi Zn-dialkilditiokarbamat. Nilai hardness yang diperoleh dari perhitungan DFT lebih besar dari pada senyawa Zn-ditiofosfat, yang berarti memiliki kemampuan antiwear yang lebih rendah. Berdasarkan nilai elektronegativitas absolute dari perhitungan DFT, senyawa Zn-dialkilditiokarbamat termasuk kategori superlubricity yang dapat bekerja dalam sistem boundary lubricant.
MOHAMMAD KHOTIB. Density Functional Theory in Synthesis, Characterization, and Application Application Prediction. Case : Long Chain Zn-Dialkyldithiocarbamate. Under direction of ZAINAL ALIM MAS’UD and H.M. ANWAR NUR.
Coordination compounds of dialkyldithiocarbamate have broad applications, e.g. automotive lubricant additives. Coordinated long chain dialkyldithiocarbamate was studied to obtain the better anti-friction and anti-wear. Integration of computation chemistry e.g. density functional theory used to identify reaction mechanisms, to optimize geometry of structure, and to estimate properties of compounds. The aim of this study was to obtain long chain complexes Zn-dialkyldithiocarbamate, to examine their structures, and to estimate their applications using Density Functional Theory methods (DFT). Long chain Zn-dialkyldithiocarbamate was synthesized through reaction between ZnCl2, NaOH, CS2 and secondary amine during 24 hours in room condition. Secondary amine was obtained from LiAlH4 reduction of amide 2o during 24 hours in nitrogen atmospheric. Reaction of long chain amine 1o and long chain acylchloride was used to obtain amide 2o. DFT and instrumentation (FTIR and HPLC) was used to study of mechanism, structure elucidation and its application. The results showed the synthesis of Zn-dibutyldithiocarbamate, dipalmitilamide, dipalmitilamine, Zn-dipalmitildithiocarbamate yields are 90.02%, 90.91%, 47.5%, and 66.49% respectively. The ratio of intensity and wave number for Zn-dibutyldithiocarbamate from FTIR spectra and DFT calculations wasn’t significantly different at 95% confidence level. According to DFT calculation (B3LYP/ 6-31G*), the carbon-sulfur bonds in Zn-dibutyldithiocarbamate have an average length of 0.1683-0.1743 nm and the ligand “bite” angle S-C-S has a mean value of 116.85o. This result indicates a tetrahedral-shaped Zn-dibutyldithiocarbamate. Lubricant additives (anti-wear and anti-friction) properties of Zn-dialkyldithiocarbamates was estimated by chemical hardness and absolute electronegativity. Lower electronegativity value is better anti-friction, and lower chemical hardness is better anti-wear. Anti-friction ability of Zn-dialkyldithiocarbamate is better than Mo-Zn-dialkyldithiocarbamate, while anti-wear ability is lower than Zn-dialkiydithiophosphates. Based on electronegativity absolute value of DFT calculations, the Zn-dialkyldithiocarbamate is categorized as superlubricity that can perform in the boundary lubricant system.
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
MOHAMMAD KHOTIB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Mohammad Khotib
NIM : G452050011
Disetujui
Komisi Pembimbing
Dr. Zainal Alim Mas’ud, DEA Prof. (Emeritus). Dr. Ir. M. Anwar Nur, M.Sc
Ketua Anggota
Diketahui
Ketua Program Studi Kimia Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Latifah K. Darusman, MS Prof. Dr. Ir. Khairil A. Notodiputro, M.S
Nama : Mohammad Khotib
NIM : G452050011
Disetujui
Komisi Pembimbing
Dr. Zainal Alim Mas’ud, DEA Prof. (Emeritus). Dr. Ir. M. Anwar Nur, M.Sc
Ketua Anggota
Diketahui
Ketua Program Studi Kimia Dekan Sekolah Pascasarjana
Prof. Dr. Dra. Purwatiningsih, MS Prof. Dr. Ir. Khairil A. Notodiputro, M.S
Puji dan Syukur penulis panjatkan kepada Allah SWT atas segala Rahmat dan Karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian dengan judul Density Functional Theory dalam Sintesis, Karakterisasi, dan Prediksi Aplikasi. Kasus: Zn-Dialkilditiokarbamat Rantai Panjang dapat selama 12 bulan mulai Maret 2009 sampai maret 2010 bertempat di Laboratorium Terpadu IPB.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu dalam penyelesaian karya ilmiah ini, antara lain Dr. Zainal Alim Mas’ud, DEA dan Prof. (emeritus) Dr. Ir. H. M. Anwar Nur, M.Sc selaku komisi pembimbing, kepada Prof. Dr. Ir. Latifah K Darusman, MS selaku Ketua Program Studi Kimia Sekolah Pascasarjana IPB, kepada Prof. Dr. Ir. Tun Tedja Irawadi, MS selaku Ketua Departemen Kimia IPB, dan kepada Dr. Dyah Iswantini, M.Agr selaku Kepala Bagian Kimia Fisik Departemen Kimia IPB. Terima kasih kepada segenap staf dan pegawai di Laboratorium Terpadu IPB dan Departemen kimia yang telah memberikan dukungannya sehingga penulis dapat menyelesaikan studi di Sekolah Pascasarjana IPB.
Terima kasih juga diungkapkan khusus kepada istri tercinta Gina Libria Nadjamoeddin, S.Si, kedua ananda Shafa Raissa Salma dan Marwah ‘Ilmi Ihsani, keluarga besar Mi’ad Ihsan dan keluarga besar Drs. Hamid Nadjamoeddin (alm.) yang selalu mendo’akan dan memberikan semangat serta dorongan dalam penyelesaian karya ilmiah ini. Ucapan terima kasih juga disampaikan kepada teman-teman Pascasarjan Kimia 2005 khususnya Tedi Kurniadi beserta istri dan Asep Syafurrohman atas dukungannya. Semoga karya ilmiah ini dapat bermanfaat, Amiin.
Penguji Luar Komisi pada Ujian Tesis:
Halaman Kompleks Alkil Ditiokarbamat ... 5
Kajian Struktur dan Sifat Kompleks Alkil ditiokarbamat ... 7
Density Functional Theory(DFT) ... 8
AplikasiDFT dalam sintesis ... 13
AplikasiDFT dalam penentuan struktur... 15
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 20
Bahan dan Alat Penelitian ... 20
Sintesis N-palmitilpalmitoilamida (reaksi Schotten-Baumann) ... 20
Sintesis dipalmitilamina... 21
Sintesis Kompleks Zn-Dialkilditiokarbamat Rantai Panjang ... 21
Identifikasi Keberhasilan Sintesis ... 21
Metode komputasi kimia ... 22
HASIL DAN PEMBAHASAN Sintesis Senyawa Zn-Dibutilditiokarbamat ... 23
Sintesis Senyawa Zn-Diakilditiokarbamat Rantai Panjang ... 30
Penentuan Struktur ... 36
Perkiraan Aplikasi Senyawa Kompleks ... 40
SIMPULAN DAN SARAN Simpulan ... 45
Saran ... 46
DAFTAR PUSTKA ... 47
DAFTAR TABEL
Halaman
1 puncak serapan penting dari spektrum IR pada senyawa alkildithiokarbamat 7
2 Metode/fungsional yang digunakan dalam DFT ... 13
3 Nilai geseran kimia hasil analisis NMR dan perhitungan DFT... 17
4 Parameter struktur yang terpilih dengan XRD dan
perhitungan teori (panjang ikatan) ... 18
5 Perbandingan hasil pengamatan dan perhitungan vibrasi molekul
dari senyawa pirazolin ... 19
6 Nilai Energi hasil perhitungan DFT metode BLYP dengan basis set 6-31G* 25
7 Perubahan entalpi dan energi bebas Gibbs reaksi pembentukan
ditiokarbamat dan Zn-dibutilditiokarbamat ... 26
8 Muatan parsial dari dibutilamina hasil perhitungan DFT menggunakan
metode B3LYP dengan basis set 6-31G* ... 30
9 Nilai EHOMO, ELUMO, Gap energi, dan Hardness Hasil perhitungan DFT
metode BLYP dengan basis set 6-31G* ... 36
10 Ringkasan peak IR dari reaktan sampai produk dalam
sintesis Zn-dialkilditiokarbamat ... 39
11 Nilai Chemical hardness, elektronegativitas absolute, dan softness dari Zn-DTC, Zn-DTP dan Mo-DTC yang dihitung
DAFTAR GAMBAR
Halaman
1 Ilustrasi penggunaan DFT untuk mendapatkan senyawa dengan
fungsi yang ditargetkan ... 3
2 Struktur senyawa kompleks dari logam dengan bilangan oksidasi 2 (MCl2) ... 6
3 Struktur senyawa kompleks dari logam dengan bilangan oksidasi 3 (MCl3) ... 6
4 Alur sintesis kompleks logam timah dialkilditiokarnbamat ... 6
5 Penjelasan LDA (Koch W & Holthausen Max C. 2001) ... 12
6 Bentuk anion 4-Methyl-1-thioxo-1,2,4,5-tetrahydro [1,2,4] triazolo[4,3-a] quinazolin-5-one dan kontur HOMO-nya ... 15
7 Struktur kimia Spartein N-oksida (1-3) dan Isospartein N-oksida (4) ... 17
8 Stuktur pirazolin teroptimalisasi secara geometri menggunakan DFT ... 18
9 Optimalisasi geometri dari 2,4-dimethylphenyl ... 19
10 Struktur Zn-dibutildithiokarbamat binuclear ... 23
11 Struktur Zn-dibutilditiokarbamat dengan single nuclear yang lain ... 23
12 Reaksi pembentukan senyawa Zn-dibutilditiokarbamat ... 24
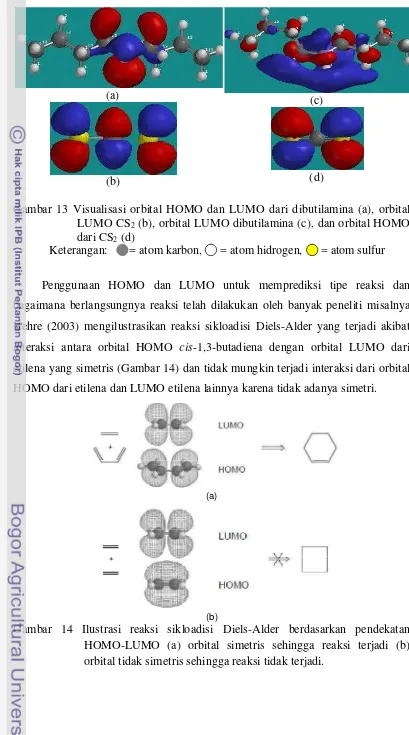
13 Visualisasi orbital HOMO dan LUMO dari dibutilamina (a), orbital LUMO CS2 (b), orbital LUMO dibutilamina (c), dan orbital HOMO dari CS2 (d) ... 27
14 Ilustrasi reaksi sikloadisi Diels-Alder berdasarkan pendekatan HOMO-LUMO (a) orbital simetris sehingga reaksi terjadi (b) orbital tidak simetris sehingga reaksi tidak terjadi... 28
Halaman
16 Potensial elektrostatik dibutilamina hasil perhitungan DFT menggunakan B3LYP dengan basis set 6-31G* ... 29
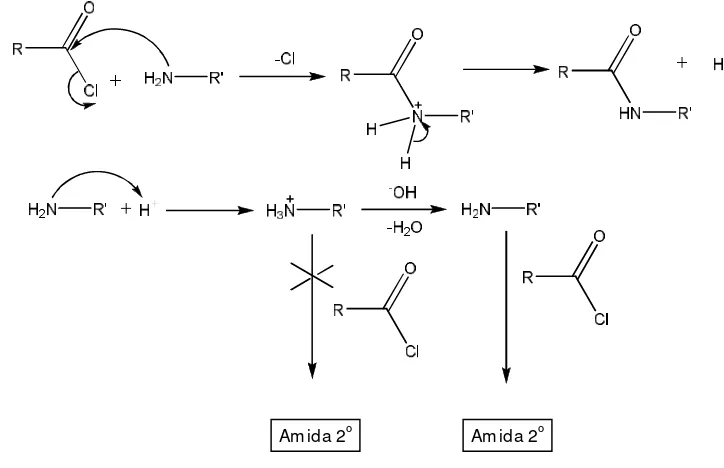
17 Skema reaksi pembentukan amida mengikuti
reaksi Schotten-Baumann ... 31
18 Orbital molekul HOMO-LUMO dari amina primer dan asilklorida
hasil perhiungan DFT metode B3LYP dengan basis set 6-31G* ... 32
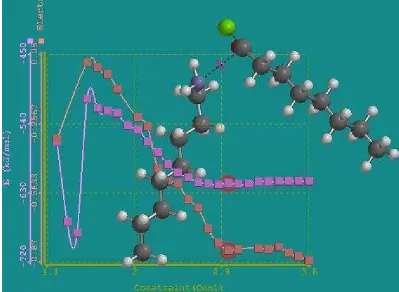
19 Profil energi pembentukan amida sekunder dari amina primer
dan asilklorida ... 33
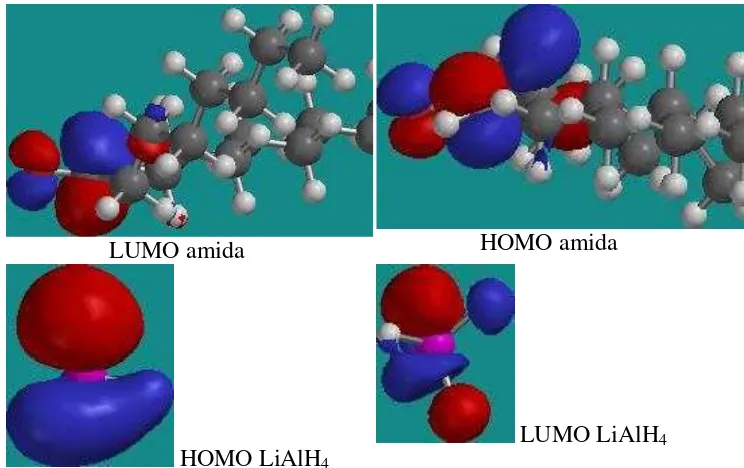
20 Orbital HOM dan LUMO dari LiAlH4 dan amida ... 34
21 Skema reduksi amida sekunder menjadi amina sekunder ... 34
22 Profil energi HOMO-LUMO dari ZnCl2 dan Na-dialkilditiokarbamat
(alkil = C4, C6, C8, C12, dan C16)... 35
23 Sebaran data rasio intensitas terhadap bilangan gelombang hasil pengukuran FTIR spectrometer dan perhitungan DFT
metode B3LYP dengan basis set 6-31G* ... 37
24 Kromatogram HPLC senyawa dibutilamina dan Zn-dibutilditiokarbamat 38
25 Kromatogram HPLC fraksi metanol hasil purifikasi
senyawa Zn-dibutilditiokarbamat ... 38
26 Kromatogram dipalmitilamina dan Zn-dipalmitilditiokarbamat ... 40
27 Reaksi asam-basa tribokimia Zn-Ditiofosfat, proses pembentukan Fe/Zn fosfat yang lambat (reaksi asam basa keras), dan
proses pembentukan FeSx yang cepat (reaksi asam basa lunak) ... 41
28 Pengaruh panjang rantai dalam kation imidazolium terhadap friksi... 43
29 Pengaruh panjang rantai alkil dari kation imidazolium terhadap nilai hardness & elektronegativitas hasil perhitungan DFT
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian sintesis senyawa kompleks alkilditiokarbamat ... 51
2 Data Rendemen Zn-dibutilditiokarbamat, Palmitilpalmitoilamida,
Dipalmitilamina, dan Zn-Dipalmitilditiokarbamat ... 52
3 Spektrum FTIR dibutilamina, ditiokarbamat dan Zn-dibutilditiokarbamat 53
4 Spektrum FTIR heksadesilamina dan dipalmitilamida ... 53
5 Spketrum FTIR dipalmitilamina dan Zn-dipalmitilditiokarbamat ... 54
6 Spektra IR dibutilamina hasil perhitungan DFT metode B3LYP
dengan basis set 6-31G* ... 55
7 Spektra IR dibutilditiokarbamat hasil perhitungan DFT
metode B3LYP dengan basis set 6-31G* ... 56
8 Spektra IR Zn-dibutilditiokarbamat hasil perhitungan DFT
Latar Belakang
Senyawa ditiokarbamat merupakan senyawa organosulfur, yang dalam bentuk terkoordinasi dengan logam memiliki aplikasi luas. Aplikasi senyawa ini dibidang otomotif sebagai zat tambahan pelumas, bidang pertanian digunakan sebagai pestisida (insektida dan fungisida), bidang geologi sebagai akselarasi dalam vulkanisasi, dan bidang farmasi sebagai antioksidan (Kaludjerovic et. al
2002) dan contrast agent dalam meningkatkan resolusi MRI (Hermann et al
2008). Logam ditiokarbamat heterosiklik berpotensi sebagai pestisida dan antioksidan misalnya potassium (1,1-dioxothiolan-3-yl)-dithiocarbamate efektif sebagai fungisida selektif (Vasiliev & Polackov 2000). Dalam bidang biologis, kompleks Zn dengan ligan NCS2 dijadikan model secara struktur dan spektroskopi dalam sisi pengikatan logam dalam sejumlah protein metallotreonina dan metalloregulatori.
Grossiord et al (1998) dalam Asthana P (2006) menyatakan bahwa m etilen-bis-(di-n-butilditiokarbamat) merupakan aditif antiwear yang sangat baik dan memiliki sifat antioksidan yang baik. Senyawa ini digunakan pada gear oils dan pelumas gemuk. Molibdenum ditiokarbamat sangat baik sebagai antiwear dan memiliki sifat mengurangi friksi sehingga disebut friction modifier. Gao, Jason (2003) menambahkan Zn-diamilditiokarbamat dan Sb-diamilditiokarbamat dalam pelumas mesin diesel memiliki sifat antioksidan. Griffo & Keshavan 2007 menggunakan zat tambahan yang berfungsi sebagai antifriksi dan antiwear dalam “high performance rock bit grease” berupa Pb-diamilditiokarbamat, Mo-di-n-butilditiokarbamat, Zn-ditiokarbamat, dan Sb-ditiokarbamat. R.T. Vanderbilt Company, Inc merupakan salah satu perusahaan yang telah memproduksi Extreme
Pressure dan anti wear agent dengan bahan utamanya senyawa ditiokarbamat (Zn-diamilditiokarbamat dan Sb-dialkilditiokarbamat).
Demikian juga telah dilakukan kajian sintesis dan karakterisasi sifat senyawa kompleks logam ditiokarbamat alkil rantai pendek, aromatik, dan siklik. Dalam kaitannya pengaruh panjang rantai terhadap kemampuan anti friksi, Minami (2009) menyatakan bahwa rantai alkil (C4-C12) dalam kation imidazolium yang semakin panjang memiliki kemampuan antifriksi yang lebih baik.
Alkil rantai panjang dari senyawa kompleks dialkilditiokarbamat diperkirakan memiliki kemampuan antifriksi yang baik berdasarkan analogi terhadap kation imidazolium. Selama ini, sintesis kompleks logam alkilditiokarbamat rantai panjang belum mendapatkan perhatian sehingga diperlukan suatu kajian metode sintesis dan karakterisasi sifat-sifatnya. Sumber alkil rantai panjang dapat berasal dari minyak sawit atau minyak nabati lainnya. Sumber alkil rantai panjang akan terjamin keberlangsungannya karena Indonesia merupakan negara penghasil minyak sawit terbesar kedua setelah Malaysia. Selain itu, pemanfaatan ini juga menjadi khasanah pengembangan produk turunan dari minyak sawit, selain sebagai minyak goreng, bahan baku sabun, surfaktan, dan biodiesel.
Penggunaan instrumentasi dalam identifikasi mekanisme reaksi dan opmalisasi geometri struktur akan membutuhkan waktu lama dan biaya besar. Penggunaan kimia komputasi menjadi bagian terintegrasi dalam mengidentifikasi mekanisme reaksi, optimalisasi geometri struktur dan sifat senyawa kimia dengan cepat dan hasil yang mendekati percobaan sehingga mengefisienkan waktu penelitian dan mendapatkan terobosan yang efektif dalam penjelasan mekanisme, molekul, sifat, fungsi, dan target-target yang lain. Langkah dalam mengintegrasikan kimia komputasi, dalam hal ini DFT, merupakan aplikasi dari manajemen sains seperti ilustrasikan dalam Gambar 1. Kanakaraju & Kolandaivel (2002) menggunakan ab initio dan DFT untuk mempelajari ikatan hidrogen dan van der Waals dari isomer of pirol-nitrogen dan pirol-karbon monoksida. Broclawik
et al (2002) mempelajari sifat geometri dan elektronik (berkenaan dengan tapak aktif)
Gambar 1 Ilustrasi penggunaan DFT untuk mendapatkan senyawa dengan fungsi yang ditargetkan
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan senyawa kompleks logam alkilditiokarbamat rantai panjang, mengkaji strukturnya serta perkiraan aplikasinya menggunakan metode DFT.
Manfaat Penelitian
Penelitian ini bermanfaat sebagai modal awal dalam optimalisasi sintesis dan aplikasi dari senyawa kompleks logam dialkilditiokarbamat rantai panjang,
RENCANA
MANAJEMEN KLASIK MANAJEMEN SAINS
PERCOBAAN I
SESUAI TIDAK
PERCOBAAN II
SESUAI TIDAK
PERCOBAAN III
KIMIA KUANTUM (DFT)
PREDIKSI LANGKAH & TARGET
PEMBUKTIAN LANGKAH
sehingga diperoleh produk yang bernilai ekonomis tinggi, efisien dalam sintesis dan aplikasinya, dan aman terhadap lingkungan.
Hipotesis
TINJAUAN PUSTAKA
Kompleks Alkil Ditiokarbamat
Senyawa ditiokarbamat merupakan senyawa organosulfur yang memililki aplikasi luas. Senyawa turunan ditiokarbamat telah disintesis lebih dari 30 tahun yang lalu dan telah banyak laporan tentang aktivitas farmakologinya misalnya sebagai antimikroba, antivirus, tuberkulostatik, dan anticholinergik. Senyawa ditiokarbamat juga digunakan sebagai akselarasi dalam vulkanisasi, zat tambahan pelumas (lubricant additive) tekanan ekstrim, pestisida, dan antioksidan (Kaludjerovic eT al. 2002).
Senyawa kompleks Cu(II)ditiokarbamat telah berhasil digunakan sebagai prekursor sumber tunggal untuk pembentukan film CuS semikonduktor. Besi (II) dan besi (III) ditiokarbamat telah dikaji untuk menjelaskan fenomena
spin-crossover, penangkap radikal NO dan sebagai antioksidan dan pro-oksidan dalam sistem biologis. Sifat optik dan elektrotermal dari ditiokarbamat dapat secara efektif digunakan untuk mengkonstruksi sensor molekul dan makromolekul.
Peranan kompleks Zn tiolat dalam sistem biologis menstimulasi beberapa kajian tentang senyawa koordinasi Zn dengan ligan sulfur. Kompleks Zn dengan ligan NCS2 merupakan suatu hal yang menarik untuk dijadikan model secara struktur dan spektroskopi dalam sisi pengikatan logam dalam sejumlah protein metalloteonein dan metalloregulatori. Vasiliev & Polackov (2000) telah melakukan kajian sintesis dan struktur dari zinc(II)-bis(dibutilditiokarbamat).
Ditiokarbamat telah ditemukan bereaksi sebagai ligan bidentat dan melakukan koordinasi dengan logam melalui kedua atom sulfurnya dan kedua kompleks logam transisi yang terkoordinasi tetra dan heksa. Sejumlah besar senyawa ditiokarbamat diketahui terikat dengan CS2 dalam pola koordinasi 1-end on, 2-side or in 3
N
Gambar 2 Struktur senyawa kompleks dari logam dengan bilangan oksidasi 2 (MCl2)
Gambar 3 Struktur senyawa kompleks dari logam dengan bilangan oksidasi 3 (MCl3)
Shahzadi et al. (2006) telah melakukan sintesis, karakterisasi spektrum, dan sifat biosida dari senyawa kompleks kloro-diorganotimah(II)piperidil ditiokarbamat. Sintesis dilakukan melalui reaksi antara piperidina dengan CS2 pada suhu ruang selama 2 jam untuk menghasilkan ditiokarbamat, kemudian ditiokarbamat direaksikan dengan diorganotimah(II)klorida sehingga diperoleh senyawa kompleks logam timah ditiokarbamat (alur sintesis seperti pada Gambar 4).
Kajian Struktur dan Sifat Kompleks Alkil ditiokarbamat
Identifikasi keberhasilan sintesis senyawa kompleks alkilditiokarbamat dapat dilakukan dengan beberapa teknik/metode. Teknik identifikasi keberhasilan dan sekaligus karakterisasi sifat fisiknya dapat diringkas sebagai berikut:
1. Analisis elementer (unsur)
Analisis elementer merupakan analisis unsur-unsur penyusun dari suatu material. Analisis elementer dapat menunjukkan komposisi unsur penyusun dari material sehingga dapat diprediksi rumus empirisnya. Analisis elementer yang biasa yang dilakukan untuk senyawa kompleks adalah analisis karbon, nitrogen, sulfur dan logam penyusunnya. Analisis elementer untuk C, H, N, S dapat dilakukan dengan instrumen ”elementer
analyzer” atau dengan teknik konvensional seperti analisis karbon dengan titrimetri kromat sulfat, analisis nitrogen dengan Kjedahl atau spektrofometer sinar tampak, analisis sulfur dengan pengendapan atau spektrofometer visibel. Analisis logam dilakukan dengan AAS, ICP atau ICP-MS.
2. Analisis secara spektroskopi
Analisis secara spekroskopi yang biasa digunakan dalam mengidentifikasi keberhasilan sintesis adalah spektroskopi infra merah, spektroskopi UV, NMR, XRD, EPR, ESI-MS, dan teknik spektroskopi lainnya. Informasi yang diperoleh dari spektrum IR adalah adanya serapan spesifik dari gugus penyusun senyawa kompleks yang disajikan pada Tabel 1.
Tabel 1 Pita serapan penting dari spektrum IR pada senyawa alkildithiokarbamat*
No Bilangan gelombang Gugus Keterangan
1 1680– 1640 (cm-1) CN
2 1530–1430 (cm-1) C N S2C–NR2& tipe pita serapan medium-kuat
3 1001 (cm-1) C-S Bebas
4 Sekitar 1000 (cm-1) C-S Jika 1 pita serapan kuat bidentat, jika 2 pita serapan monodentat
5 Sekitar 2400- 2650 (cm-1) S-H Pita serapan kuat
6 Daerah finger print M-C, M-S Tipe pita serapan dari lemah sampai kuat
Demikian juga dengan spektroskopi UV yang akan mengindikasikan adanya transisi elektronik yang spesifik dari senyawa kompleks dialkilditiokabamat. Transisi yang biasa terjadi pada senyawa kompleks dialkilditiokarbamat adalah (Zhang et al. 2003):
a. Transisi * disekitar 236 nm berasal dari gugus S···C··· S. Transisi ini tidak terjadi pembelahan pita serapan sehingga dapat dinyatakan sebagai indikasi terjadi kompleks pada ikatan C···S. b. Transisi n * pada panjang gelombang 267 nm berasal dari
pasangan elektron bebas pada atom sulfur. 3. Analisis sifat fisik dan kimia senyawa kompleks
Sifat fisik dan kimia merupakan dasar untuk mengidentifikasi aplikasi yang sesuai dari senyawa tersebut. Beberapa sifat fisik yang diidentifikasi adalah sifat termal, tegangan permukaan, konduktivitas, dan sifat fisik lainnya. Instrumentasi yang digunakan untuk analisis sifat fisik, yaitu untuk analisis termal adalah adalah DSC, TGA dan DTA. Sifat kimia yang dipelajari sangat bergantung pada aplikasi yang diharapkan misalnya biosida, antioksidan, aditif pelumas, dan lain- lain.
Density Funtional Theory (DFT)
Pemanfaatan komputer dalam mengaplikasikan teori di bidang kimia telah berkembang dengan pesat, dan lazim diistilahkan kimia komputasi. Komputasi kimia digunakan pada saat model matematik dapat dikembangkan dengan baik dan secara otamatis dapat diaplikasikan pada komputer.
adanya hubungan one-to-one antara densitas elektron molekul dan fungsi gelombang dengan elektron banyak (Anonim 2007).
Seminario & Politzer (1995) dirumuskan bagaimana DFT dapat memberikan penyelesaian persamaan Schrödinger yang lebih sederhana dibandingkan dengan ab initio karena didasarkan pada densitas elektron yang tergantung pada arah bidang Cartesius. Penyelesaian persamaan Schrödinger yang berdasarkan pada DFT sudah tidak menampakkan lagi fungsi gelombang dan dijabarkan sebagai berikut;
= ……. per samaan Schr ödinger untuk sistem N−elektr on dan M inti
= + + ……oper ator Hamiltonian
= ( ̂1, ̂2, ̂3, ̂4 …. . ̂ ) ……. fungsi gelombang yang juga merupakan
fungsi dari koordinat spin dari semua N elektron (s1, s2, s3,…sN).
= − ∑ …. Oper ator ener gi kinetik
= 1 ……. . Oper ator tolakan elektr on−elektr on
….. Operator potensial eksternal
Operator energi kinetik dan tolakan elektron-elektron merupakan operator universal karena tidak tergantung pada potensial eksternal (misalnya konfigurasi inti). Kesulitan untuk membuat penyelesaian persamaan Schrödinger adalah adanya Vee untuk sistem dua atau lebih elektron. Penyelesaian persamaan Schrödinger untuk sistem hydrogen-like adalah
dan fungsi gelombang radial ternormalisasi adalah
Sistem dua atau lebih elektron selalu memperoleh nilai energi perhitungan
adalah tidak melakukan perhitungan dengan fungsi gelombang N-elektron tapi menggunakan perhitungan densitas elektron. Densitas elektron didefinisikan dengan persamaan;
dimana δ adalah fungsi delta Dirac dan ri adalah N variable spasial dari fungsi gelombang. Definisi ini ekivalen dengan persamaan berikut
Perssamaan Schrödinger dapat ditulis kembali seperti berikut
Dari persamaan diatas tergambar adanya hubungan antara potensial eksternal (ext) dan densitas elektronik (ρ) dari suatu sistem dan berimplikasi bahwa energi merupakan fungsional dari densitas elektronik pada kedaan dasar (E = Eext [ρ]). Persamaan diatas masih mengandung pendekatan fungsi gelombang
dan pada saat dicoba untuk menghitung energi, maka diperoleh energi perhitungan lebih besar dari yang sebenarnya. Kohn-Sham mengembangkan penyelesaian persamaan Schrödinger khususnya dalam menyelesaikan fungsi universal dari persamaan Schrödinger yang didasarkan pada densitas elektron. Hasil penyelesaian Kohn-Sham terhadap perhitungan energi didefinisikan dengan persamaan:
,
Dalam persamaan ini tidak terlihat lagi fungsi gelombang seperti yang digunakan dalam teknik ab initio dalam kimia kuantum. Prosedur ini menggunakan suatu orbital molekul yang mempresentasikan densitas elektron seperti densitas elektron sebenarnya.
teori ini dikembangkan oleh Kohn dan Sham dengan stuktur formula seperti pada metode Hartree-Fock.
Dalam formulasi ini, densitas elektron dinyatakan sebagai kombinasi linier dari fungsi dasar. Suatu determinan terbentuk dari fungsi ini yang disebut orbital Kohn-Sham, dan densitas elektron dari determinan orbital ini yang digunakan untuk menghitung energi. Hal yang mendasar secara matematik dari metode ini adalah definisi “functional”. Fungsional berbeda dengan fungsi, fungsional merupakan fungsi dari fungsi dan secara matematik dieksperisikan sebagai:
function elektron dan densitas elektron merupakan fungsi dari 3 variabel yaitu posisi x, y, z dari elektron. Dengan mengabaikan jumlah elektron, fungsi densitas elektron selalu hanya tergantung pada ketiga nilai tersebut. Functional (F) memberikan informasi energi molekul dan secara matematik hubungan energi dengan densitas elektron dinyatakan sebagai:
Dalam DFT, pembagian metode yang digunakan terlalu rumit dan berbeda-beda. Secara umum, metode dalam DFT terbagi menjadi 3 kelompok/kelas yaitu: 1. Metode yang menggunakan “Local density approximation (LDA)”. Asumsi
Gambar 5 Penjelasan LDA (Koch & Holthausen 2001)
2. Metode yang mengkombinasikan perhitungan densitas elektron dengan faktor koreksi gradien. Gradien dalam matematik merupakan fungsi yang mengukur kecepatan perubahan beberapa sifat. Dalam hal ini, gradient terlihat menjelaskan ketakseragaman densitas elektron, dan biasa dikenal sebagai gradient terkoreksi atau bentuk lain non-lokal.
3. Metode mengkombinasikan perkiraan Hartree-Fock dengan pertukaran energi dan perkiraan DFT dengan pertukaran energi, semuanya dikombinasikan dalam fungsional yang meliputi korelasi elektron. Metode ini diketahui sebagai metode hybrid dan merupakan metode DFT yang sering dipakai dan popular dalam praktik/aplikasi.
Pada umumnya, perhitungan gradien terkoreksi atau hibrid memberikan hasil yang lebih akurat dibandingkan LDA. Tetapi, dalam beberapa kasus metode LDA memberikan hasil yang sangat baik, misalnya LDA diketahui memberikan hasil yang kurang akurat dalam geometri dan memprediksi energi ikatan yang besar. Generasi terbaru dari fungsional hybrid memberikan hasil yang lebih akurat dibandingkan teknik gradient terkoreksi.
Beberapa metode/fungsional DFT yang umum digunakan disajikan pada Tabel 2. Pedoman umum untuk memilih metode DFT sebagai berikut:
2. BLYP dengan sebagian besar basis set digunakan dengan hasil akurat untuk senyawa yang mengandung logam dan kurang akurat untuk senyawa organik.
3. BLYP dan B3LYP fokus pada penetuan densitas muatan pada atom atau molekul
4. metode gradien terkoreksi dan hibrid memberikan tingkat akurasi yang tinggi dalam penentuan optimisasi geometri
5. metode B3YLP memberikan hasil yang lebih baik dalam perhitungan rekasi kimia
6. metode menjadi pertimbangan dalam mendapatkan hasil untuk interaksi ikatan hidrogen lemah
Tabel 2 Metode/fungsional yang digunakan dalam DFT
Nama metode Akronim Tipe metode
X alpha X Pertukaran
Hartree-Fock Slater functional HFS HF dengan pertukaran LDA
Vosko, Wilks, Nusair VWN LDA Lee, Yang, and Parr exchange functional
B3LYP, Becke3LYP
DFT Hybrid
Perdue and Wang 1991 PW91 Gradient-corrected
Gill 1996 G96 Pertukaran (Exchange)
Perdew 1986 P86 Gradient-corrected
Becke 1996 B96 Gradient-corrected
Becke exchange, Perdew Correlation B3P86 Hybrid Becke exchange, Perdew & Wang
Correlation
penyusunnya sehingga terbentuk ikatan kimia baru. Ikatan kimia yang terbentuk dapat berupa ikatan kovalen, kovalen koordinat, atau ikatan ionik tegantung pada interaksi yang terjadi. Terjadinya reaksi kimia sangat tergantung pada kondisi elektron dari gugus-gugus senyawa penyusun, yang berarti sangat berhubungan dengan densitas elektron. Adanya kaitan yang erat antara reaksi kimia dan kondisi ekektron dari suatu senyawa, memungkinkan DFT dapat digunakan dalam mempelajari bagaimana reaksi kimia tersebut berlangsung.
Contoh aplikasi DFT dalam mempelajari reaksi kimia adalah:
1. Aplikasi DFT dalam mempelajari regioselektivitas serangan elektrofilik pada
4-Methyl-1-thioxo-1,2,4,5-tetrahydro[1,2,4]triazolo[4,3-a] quinazolin-5-one
(Fathalla et al 2001). Serangan elektrofilik secara regioselektif didasarkan pada nilai HOMO-LUMO tiap atom dari bentuk anion senyawa
4-Methyl-1-thioxo-1,2,4,5-tetrahydro[1,2,4]triazolo[4,3-a] quinazolin-5-one pada level DFT B3LYP/6-31G**. Gambar 6 memperlihatkan kontur HOMO dari anion senyawa tersebut.
Gambar 6 Bentuk anion 4-Methyl-1-thioxo-1,2,4,5-tetrahydro[1,2,4] triazolo[4,3-a] quinazolin-5-one dan kontur HOMO-nya.
yang terlokasi dan hambatan aktivasi diperkirakan dengan metode yang
berbeda yaitu Hartree-Fock, post-Hartree-Fock, dan DFT. Selektivitas exo- -facial tinggi yang terlihat dalam sikloadisi dapat diprediksi dengan baik menggunakan RHF/3-21G atau level ab initio yang lebih tinggi.
3. Rivera & Rios-Motta (2007) menggunakan DFT (dengan metode B3LYP dan basis set 6-31G) dalam rangka menjelaskan mekanisme reduksi N,N,N´,N´ -Tetramethylethylenediamine (TMEDA) dari 1,3,6,8-tetraazatricyclo-[4.4.1.1]dodecane (TATD) dengan asam format.
4. Pérez-Mayoral et al. (2006) melakukan penelitian hubungan antara teori dan percobaan tentang stabilitas kinetik dan termodinamika dari senyawa kompleks lantanida asam poliaminopolikarboksilat linier dan makrosiklik. Deskriptor yang digunakan dalam mengamati stabilitas kinetic adalah energi aktivasi pada tahap pertama proses dissosiasi yang dihitung dengan metode DFT menggunakan basis set 6-31+G** untuk ligan dan model CPCM untuk menghitung efek solvasi. Stabilitas kompleks secara termodinamik didasarkan pada perbedaan energi total dari energi kompleks yang terbentuk, ligan dan logam (Etotal Ekompleks -Eligan -Elogam). Nilai perbedaan
energi yang lebih kecil menunjukkan lebih stabil secara termodinamik.
Aplikasi DFT dalam Penentuan Struktur
Untuk sistem kulit tertutup yang jenuh secara koordinasi memiliki deviasi
melebihi 0.1 Å untuk jarak ikatan yang meliputi pusat logam dapat dilakukan dengan pendekatan fungsi gelombang (HF dan MP). Tetapi, untuk mengkaji sistem kulit-terbuka tak jenuh secara koordinasi, metode UHF dan MP tidak dapat memberikan informasi yang memuaskan, seperti yang dikatan oleh Taylor 1992: “kimia logam transisi merupakan sebuah kuburan untuk metode MP berbasis UHF”.
Hubungan teknik penentuan struktur dengan instrumentasi dan DFT adalah adanya kaitan yang erat antara densitas elektron molekul dengan prinsip dasar intrumen dalam menentukan struktur. Dalam spektroskopi IR dan UV-Visible, molekul akan mengalami gangguan elektrik sehingga mengubah kerapatan elektron (Koch & Holthausen 2001). Perubahan kerapatan elektron diubah dalam bentuk distribusi energi potensial sehingga mampu menampilkan spektrum.
Spektroskopi NMR yang digunakan dalam penentuan struktur didasarkan pada geseran kimia setiap atom dalam molekul. Faktor penting yang mempengaruhi geseran kimia adalah densitas elektron, elektronegativitas gugus sekitarnya dan efek medan magnet yang diinduksi. Densitas elekron melindungi inti, elektronegativitas gugus sekitar akan mengurangi densitas elektron inti, dan efek induksi menyebabkan perubahan sirkulasi elektron. Oleh karena itu, dengan melakukan identifikasi densitas elektron akan memberikan informasi geseran kimia dari atom dalam molekul.Contoh aplikasi DFT dalam penentuan struktur :
a. Penentuan perubahan konformasi ligan senyawa alkaloid Sparteine
Gambar 7 Struktur kimia Spartein N-oksida (1-3) dan Isospartein N-oksida (4).
Tabel 3 Nilai geseran kimia hasil analisis NMR dan perhitungan DFT
Atom
b. Guo et al (2008) melakukan perbandingan hasil penentuan struktur kristal
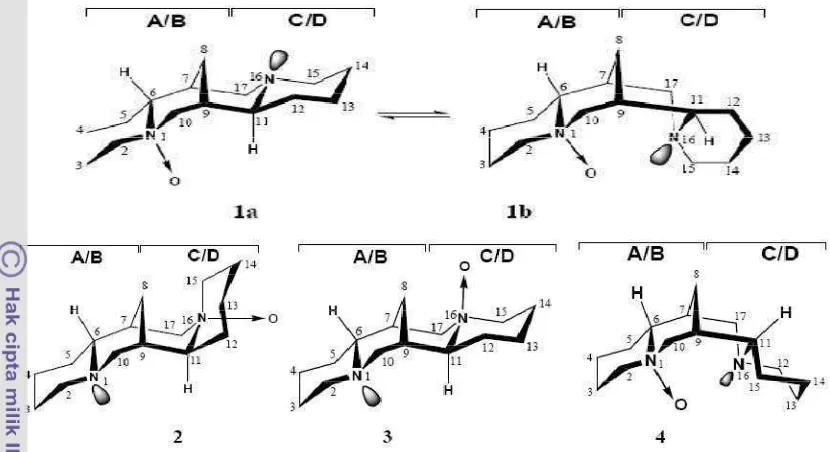
Gambar 8 Stuktur pirazolin teroptimalisasi secara geometri menggunakan DFT.
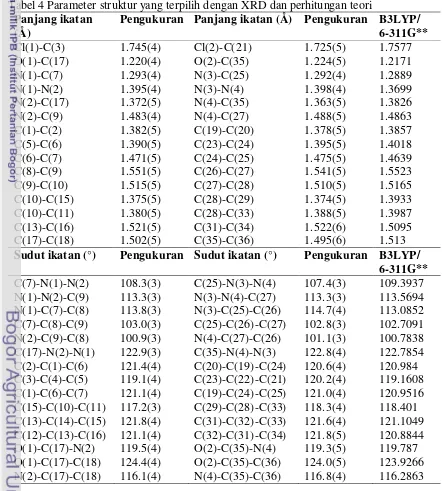
Tabel 4 Parameter struktur yang terpilih dengan XRD dan perhitungan teori
Panjang ikatan (Å)
Tabel 5 Hasil pengamatan dan perhitungan vibrasi molekul dari senyawa pirazolin
Gugus fungsi Percobaan Perhitungan
DFT
phenyl ring C-H bend + pyrazolinyl ring C-H bend 1319 1328 pyrazolinyl ring C-H bend + N-N str. 1248 1248 pyrazolinyl ring C-H bend + N-N str. 1144 1138
pyrazolinyl ring C-H bend 1089 1088
methyl group C-H bend 1014 1019-1011
phenyl ring C-H bend 953 950
phenyl ring C-H twist. 819 815
skeleton deformation + C-Cl str. 726 715
skeleton deformation 627 630
c. Beata Jasiewicz (2008) menggunakan DFT (B3YLP) dengan metode
continuous set of gauge transformations (CSGT) dalam menghitung nilai konstanta perlindungan mutlak (absolute shielding-) 13C-NMR untuk membedakan N1-oxide and α-Isosparteine N-oxide. Nilai dikonversi menjadi nilai pergeseran kimia (δ) dalam NMR.
d. Claramunt et al. (2007) melakukan kajian struktur senyawa analog Tinuvin®P yaitu 2-(2,4-Dimethylphenyl)-2H-benzotriazole and 2-Phenyl-2H-benzotriazole. Metode DFT yang dgunakan adalah Hartree-Fock HF/6-31G** dan B3LYP/6-HF/6-31G**. Hasil perhitungan dengan HF/6-HF/6-31G** terhadap sudut tekuk dari struktur 2,4-dimethylphenyl group (N1-N2-C7-C8) yang telah dioptimisasi lebih mendekati hasil XRD (Gambar 9).
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Terpadu IPB mulai bulan Agustus 2009 sampai Maret 2010.
Bahan dan Alat
Alat-alat yang digunakan dalam pelaksanaan penelitian ini adalah perangkat lunak Hyperchem, Gaussian dan Spartan, Komputer core2duo, RAM 4 Gb, dan Hard disk 500 Gb, seperangkat alat gelas sisntesis (labu bulat dan kondensor), pengaduk magnet dan batang magnetnya, FTIR, rotary evaporator, timbangan analitik, dan alat gelas lainnya
Bahan-bahan yang digunakan dalam penelitian ini adalah dietileter, ZnCl2, THF kering, CS2, NaOH 40%, HCl 3%, aseton, LiAlH4, palmitatoil amina, heksadesilamina, NaOH pelet, dan akuades.
Diagram alir penelitian ditunjukkan pada Lampiran 1.
Sintesis N-palmitilpalmitoilamida (reaksi Schotten-Baumann)
Sintesis dipalmitilamina (Affani R & Dugat D 2007)
Dipalmitilamina disintesis dengan menyiapkan LiAlH4 (0.021 mol, 0.79 g) dalam THF kering di labu leher tiga yang dilengkapi dengan kondensor dan pemanas listrik. Campuran dipanaskan, diaduk, dan dialirkan gas nitrogen. Kemudian N-palmitilpalmitoilamida (0.0042 mol, 2.00 g) dalam THF kering ditambahkan secara perlahan. Pemanasan, pengadukan, dan aliran gas nitrogen terhadap campuran dilakukan selama 24 jam. Setelah dingin, campuran didekantasi untuk mendapatkan amina sekunder. Padatan yang diperoleh dicuci dengan air untuk menghilangkan kelebihan LiAlH4. Padatan disaring dan ditambahkan HCl 3%, dipanaskan selama 2 jam untuk menghilangkan sisa amida yang tidak bereaksi. Padatan dipisahkan dan dicuci dengan NaOH sampai netral untuk memisahkan sabun dari amida yang tidak bereaksi, kemudian padatan dikeringkan dan ditimbang.
Sintesis Kompleks Zn-Dialkilditiokarbamat
Amina sekunder ditimbang untuk mendapatkan 1 mmol bahan dan dilarutkan dalam 20 mL dietileter. Larutan ditambah dengan 1 mmol ( 0.2 mL) CS2 dan diaduk selama 4 jam. Larutan ditambah dengan 1 mmol NaOH pelet dan 20 mL air, kemudian diaduk selama 6 jam. Larutan ditambah dengan ZnCl2 sejumlah ekivalen reaksinya (Zn = 0.5 mmol) dan diaduk selama 8 jam. Fase eter dipisahkan dan dicuci dengan air kemudian pelarut eter diuapkan secara perlahan sehingga diperoleh padatan dan ditimbang untuk dihitung persen rendemennya.
Identifikasi Keberhasilan Sintesis
Keberhasilan sintesis dalam penelitian ini dipantau menggunakan FTIR dan HPLC. Spektrum FTIR diperoleh menggunakan alat FTIR merk Shimadzu tipe IRPrestige-21. Analisis HPLC menggunakan alat HPLC merk Shimadzu tipe LC-10A dengan kondisi analisis :
- Kolom : Waters-Bondapack C18 10µm, dan dimensi kolom 300x4.0 mm
- Fase gerak : (a) Metanol:air (95:5) untuk Zn-dibutilditiokarbamat dan dibutilamina.
- Detektor : UV (254 nm) - Laju alir : 0.8 L/menit
Metode Komputasi Kimia
HASIL DAN PEMBAHASAN
Sintesis Senyawa Zn-Dibutilditiokarbamat
Senyawa kompleks ditiokarbamat diperoleh dari reaksi antara ion logam Zn dengan senyawa ditiokarbamat. Komponen reaktan senyawa kompleks Zn-dialkilditokarbamat berdasarkan kajian retro-sintesis terdiri dari senyawa amina sekunder, karbon disulfida, dan ion logam Zn. Komponen reaktan senyawa Zn-dibutilditiokarbamat adalah dibutilamina dan karbon disulfida untuk membentuk dibutilditiokarbamat dan selanjutnya direaksikan dengan ZnCl2 untuk membentuk senyawa kompleks Zn-dibutilditiokarbamat dengan struktur seperti Gambar 10 dan Gambar 11.
Gambar 10 Struktur Zn-dibutildithiokarbamat inti ganda (Zhang et al. 2003)
Gambar 11 Struktur Zn-dibutilditiokarbamat dengan inti tunggal (Karlin 2005) At om karbon At om Hidrogen At om Sulfur At om Zn
At om Nit rogen
At om karbon At om Hidrogen At om Sulfur At om Zn
Senyawa kompleks terbentuk dari interaksi atom pusat sebagai asam Lewis dan ligan sebagai basa Lewis atau interaksi yang didasarkan pada teori HSAB (Hard and soft acid and bases) (Huheey 1978). Logam Zn sebagai atom pusat dan berdasarkan teori HSAB termasuk dalam kelompok “border line”, dan senyawa kompleks yang terbentuk memiliki tingkat stabilitas yang paling besar dibandingkan dengan logam lain dengan bilangan oksidasi 2+ berdasarkan “Irving-Williams Series”. Ligan dari senyawa kompleks Zn-dibutilditiokarbamat adalah dibutilditiokarbamat dengan atom sulfur (S) sebagai sumber basa lunaknya. Atom sulfur dibandingkan dengan atom oksigen memiliki kecenderungan yang lebih tinggi membentuk senyawa kompleks dengan logam transisi termasuk didalamnya Zn (Huheey 1978, dan Messiler & Tarr 1998).
Dalam pembentukan senyawa Zn-dibutilditiokarbamat (Gambar 12), dibutilditiokarbamat direaksikan dengan NaOH untuk meningkatkan reaktivitas atom sulfurnya dan mengikat klorida dari ZnCl2. Selain itu, penggunaan suasana basa (NaOH) meningkatkan reaktivitas atom nitrogen dibutilamina. Atom nitrogen dari dibutilamina dalam kondisi basa memiliki elektron bebas yang siap bereaksi, tetapi jika dalam kondisi asam atom nitrogen akan membentuk garam amina sehingga tidak reaktif. Ion logam Na termasuk jenis asam keras dan klorida termasuk jenis basa keras sehingga pembentukan NaCl lebih disukai dari pada pengikatan logam Na oleh atom sulfur. Atom sulfur dalam bentuk ditiokarbamat termasuk jenis basa lunak sehingga akan lebih cenderung melepaskan ion logam Na untuk membentuk senyawa kompleks dengan ion logam Zn.
Gambar 12 Reaksi pembentukan senyawa Zn-dibutilditiokarbamat.
asam basa keras (Tabel 6). Sedangkan ion Zn dan ditiokarbamat (DTC) memiliki nilai hardness dan gap energi yang rendah sehingga diketogorikan sebagai
borderline-soft. Oleh karena itu, pembentukan senyawa Zn-dialkilditiokarbamat cenderung terjadi dengan baik. Produk reaksi antara ZnCl2 (borderline-hard) dan NaDTC (hard-soft) yaitu NaCl (hard-hard) dan Zn-DTC (borderline-soft) memiliki gap energi HOMO asam (Na-LUMO yang lebih rendah dari pada ion-ion reaktanya). Gap energi antara HOMO anion-ion DTC dan LUMO ion-ion Zn2+ sebesar 23.63 ev, HOMO ion Cl- dan LUMO ion Na+ sebesar 8.7 ev, serta HOMO ion Cl- dan LUMO ion Zn2+ sebesar 24.13 ev sehingga NaCl lebih cenderung terbentuk dalam reaksi tersebut.
Tabel 6 Nilai Energi hasil perhitungan DFT metode BLYP dengan basis set 6-31G*
Ion/senyawa
Energi (ev)
HOMO LUMO Hardness Elektronegativitas Gap HOMO-LUMO
ZnCl2 -11.85 -7.63 2.11 9.74 4.22
dibutiltiokarbamat ke Zn-dibutilditiokarbamat, entalpi dan energi bebas GIbss bernilai negatif yang menigindikasikan reaksi pembentukan bersifat eksoterm dan berjalan spontan.
Tabel 7 Perubahan entalpi dan energi bebas Gibbs reaksi pembentukan ditiokarbamat dan Zn-dibutilditiokarbamat
SENYAWA Eo (Kj/mol) H o (Kj/mol) G o (Kj/mol)
Dibutilamina -974185 -973465 -973582
CS2 -2176505 -2176474 -2176545
Ditiokarbamata -3240406 -3239518 -3239688
Perubahan energy -89578.2 -89561.6
Zn-dibutilditiokarbamat -10997018.06 -10997247.54
Perubahan energy -10907439.85 -10907685.94
Pembentukan senyawa kompleks dapat dijelaskan melalui teori ikatan valensi, orbital molekul dan teori medan ligan. Berdasarkan teori ikatan valensi, dijabarkan sebagai berikut:
Konfigurasi elekt ron logam Zn :
Konfigurasi elect ron ion Zn2+ :
Konfigurasi Zn-dit iokarbamat :
Orbital ikatan yang terbentuk berupa sp3 sehingga berdasarkan teori ikatan valensi bentuk geometri senyawa kompleks Zn-dibutilditiokarbamat adalah tetrahedral. Berdasarkan Zhang et al (2003) dari hasil analisis kristalografi sinar X menunjukkan bahwa senyawa kompleks Zn-dibutilditiokarbamat memilki struktur tetrahedral. Panjang ikatan hasil analisis kristalografi sinar X antara atom S-C dalam struktur Zn-dibutilditiokarbamat sebesar 0.1704-0.1725 nm. Hasil perhitungan dengan DFT sebasar 1.691-1.692 nm (senyawa mono inti) dan 1.683-1.743 nm (senyawa dua inti). Sudut ikatan antara S-C-S sebesar 117.8(5)o berdasarkan hasil kristolografi (Zhang et al 2003) dan hasil perhitungan DFT metode B3LYP dengan basis set 6-31G* sebesar 116.85o. Parameter struktur lain yang mengidentifikasi ligan ditiokarbamat adalah panjang ikatan C-N(R1,R2) berkisar 0.124-0.152 nm (Karlin 2005) dan hasil perhitungan DFT metode BLYP dan B3LYP basis set 6-31G* sebesar 0.1348 nm. Hal ini menunjukkan optimasi
geometri dari perhitungan DFT metode B3LYP dengan basis set 6-31G* mendekati hasil percobaan dan struktur yang diusulkan memiliki kesamaan.
Sintesis senyawa Zn-dibutilditiokarbamat menghasilkan suatu kristal transparan dengan rendemen 90.01% (perhitungan lengkapnya ada di Lampiran 3). Rendemen yang diperoleh cukup besar dan selama proses sintesis dilakukan pada suhu kamar dibantu dengan pengadukan. Hal ini menunjukkan reaksi secara termodinamika dapat berlangsung secara spontan, walaupun berlangsung selama 8 jam dan untuk membentuk kristal dibutuhkan waktu yang lama sekitar 24 jam (menguapkan pelarutnya secara perlahan sehingga pembentukan kristalnya berjalan dengan baik). Suatu reaksi dinyatakan berlangsung secara spontan jika memiliki energi bebas Gibbs lebih kecil dari nol (G < 0). Hasil perhitungan termodinamika berdasarkan DFT metode B3LYP dengan basis set 6-31G* diperoleh nilai G reaksi pembentukan senyawa Zn-dibutilditiokarbamat lebih kecil dari nol yaitu sebesar -10907685.94 Kj/mol (Table 6).
(a)
(b)
(c)
(d)
Gambar 13 Visualisasi orbital HOMO dan LUMO dari dibutilamina (a), orbital LUMO CS2 (b), orbital LUMO dibutilamina (c), dan orbital HOMO dari CS2 (d)
Keterangan: = atom karbon, = atom hidrogen, = atom sulfur
Penggunaan HOMO dan LUMO untuk memprediksi tipe reaksi dan bagaimana berlangsungnya reaksi telah dilakukan oleh banyak peneliti misalnya Hehre (2003) mengilustrasikan reaksi sikloadisi Diels-Alder yang terjadi akibat interaksi antara orbital HOMO cis-1,3-butadiena dengan orbital LUMO dari etilena yang simetris (Gambar 14) dan tidak mungkin terjadi interaksi dari orbital HOMO dari etilena dan LUMO etilena lainnya karena tidak adanya simetri.
(a)
(b)
Henre (2003) mengemukakan bahwa permukaan densitas elektron dapat dijadikan sebagai gambaran dari ukuran dan bentuk keseleruhan molekul. Nilai potensial elektrostatik, merupakan contoh yang dapat menunjukkan densitas elektron, dapat membedakan daerah yang kaya elektron (mengalami serangan elektrofilik) dan yang miskin elektron (mengalami serangan nukleofilik). Visualisasi potensial elektrostatik dari struktur dapat membedakan senyawa yang mudah mengalami serangan elektrolifik atau bereaksi dengan hidrogen, seperti yang diilustrasikan pada Gambar 15 untuk senyawa trimetilamina, dimetileter, dan metilfluorida. Potensial elektrostatik dibutilamina hasil perhitungan DFT menggunakan metode B3LYP dengan basis set 6-31G* sebesar -83,68 kJ/mol dan divisualisakan pada Gambar 16. Potensial elektrostatik dibutilamina terpusat pada atom nitrogen yang menunjukkan adanya kumpulan elektron (adanya pasangan elektron bebas) dan menjadi pusat serangan elektrofilik dari karbon disulfida.
(a) (b) (c)
Gambar 15 Perbedaan potensial elektrostatik (a) dimetilamina, (b) dimetileter (c) metilfluorida
Gambar 16 Potensial elektrostatik dibutilamina hasil perhitungan DFT menggunakan B3LYP dengan basis set 6-31G*
Reaktivitas senyawa dapat juga dilihat dari nilai muatan parsialnya seperti dalam Fathalla et al 2001 yang mempelajari muatan parsial Mulliken dari
4-Methyl-1-thioxo-1,2,4,5-tetrahydro[1,2,4]triazolo[4,3-a]quinazolin-5-one untuk mengidentifikasi regioselektivitas serangan elektrofilik. Muatan parsial Mulliken
terbesar pada senyawa dibutilamina terdapat pada atom nitrogen (Tabel 8). Oleh karena itu, serangan elektrofilik sangat mungkin terjadi pada atom nitrogen. Table 8 Muatan parsial dari dibutilamina hasil perhitungan DFT menggunakan
metode B3LYP dengan basis set 6-31G*
Atom Muatan parsial
Mulliken Elektrostatik alamiah
N -0.561 -0.718 -0.690
Sintesis Senyawa Zn-Diakilditiokarbamat Rantai Panjang
Pola sintesis senyawa kompleks Zn-dibutilditiokarbamat digunakan untuk mensintesis senyawa kompleks Zn-dialkilditiokarbamat dengan alkil rantai panjang. Jenis alkil yang digunakan adalah rantai karbon 16 dan sumber alkil yang digunakan merupakan turunan dari asam lemak palmitat. Pada penelitian ini, bahan baku alkil yang digunakan adalah amina primer dari asam palmitat (heksadesilamina) dan asil klorida dari asam palmitat (palmitoil klorida). Tahapan yang dilakukan untuk membentuk dialkil dalam senyawa kompleks adalah:
a. Pembentukan amida sekunder
Gambar 17 Skema pembentukan amida berdasarkan reaksi Schotten-Baumann
Dalam pembentukan amida pada Gambar 17 menghasilkan ekivalen asam yang dapat bereaksi dengan amina primer yang dapat bereaksi membentuk garam ammonium, yang menyebabkan amina tersebut tidak bereaksi dengan asil kloridanya dan rendemennya akan berkurang. Garam ammonium dapat dikonversi ke dalam bentuk amina bebasnya kembali dengan penambahan basa sehingga dapat bereaksi dengan asil kloridanya. Dalam penelitian ini, NaOH digunakan sebagai sumber basa dan kelebihan NaOH dapat dengan mudah dihilangkan dengan air. Rendemen hasil sintesis amida sekunder dari palmitoilklorida dan palmitat sebesar 97.76%. Sintesis amide menggunakan asilklorida dan amina primer menghasilkan rendemen yang besar karena reaktivitas dari atom karbonil dan gugus pergi yang baik dari klorida.
Reaktivitas atom karbon karbonil pada asil klorida lebih besar dibandingkan dalam bentuk anhidridanya. Kondisi ini disebabkan oleh sifat elektronegativitas dari klorida yang besar dan menyebabkan atom karbon memilki kutub positif yang memudahkan serangan nukleofilik dari atom nitrogen amina. Selain itu, klorida merupakan gugus pergi yang baik
sehingga pada saat ada serangan nukleofilik terhadap atom karbon, klorida dengan mudah akan lepas dari ikatan karbonil. Kemudahan serangan nukleofilik diharapkan dapat meningkatkan rendemen amida yang disintesis melalui jalur asil klorida. Serangan nukleofilik ini digambarkan dengan hasil perhitungan DFT yang menunjukkan adanya kecocokan simetri orbital HOMO dari atom nitrogen senyawa amina primer dan LUMO dari atom karbon karbonil dari asilklorida (Gambar 18). Serangan nukleofilik dari atom nitrogen juga dapat dilihat dari hasil perhitungan DFT (Gambar 19) yang menunjukkan perubahan posisi dari dua atom hidrogen dari amina dan atom oksigen dan klorida dari senyawa asil pada saat keadaan transisi. Posisi atom-atom tersebut membentuk pola tetrahedral.
(a) LUMO asilklorida
(b) HOMO amina primer
(c) HOMO asilklorida
(d) LUMO amina primer
Gambar 18 Orbital molekul HOMO-LUMO dari amina primer dan asilklorida hasil perhiungan DFT metode B3LYP dengan basis set 6-31G*
Gambar 19 Profil energi pembentukan amida sekunder dari amina primer dan asilklorida ( muatan, energi)
b. Pembentukan dipalmitilamina
Amina sekunder diperoleh melalui reduksi amida menggunakan reduktor LiAlH4 karena LiAlH4 merupakan reduktor yang kuat dibandingkan dengan reduktor lainnya seperti NaBH4. Pemilihan reduktor sangat penting, karena gugus alkil yang panjang dari amida dapat mengurangi kemampuan reduksi dari reduktor. Rendemen hasil sintesis yang diperoleh sebesar 46.66% dan rendemen yang diperoleh kecil karena adanya pengaruh rantai yang terhadap reaktivitas LiAlH4 dalam mentransfer elektron. Kemampuan reduksi LiAlH4 dijelaskan melalui pendekatan EHOMO dan ELUMO dari amida dan LiAlH4.
sekunder. Serangan nukleofilik dari atom hidrogen LiAlH4 pada atom karbonil terbukti dengan kesesuaian orbital HOMO dari LiAlH4 dengan orbital LUMO dari amida (Gambar 20). Mekanisme pembentukan amina melalui reduksi amida (Brukner 2002) diperlihatkan pada Gambar 21.
LUMO amida HOMO amida
HOMO LiAlH4
LUMO LiAlH4
Gambar 20 Orbital HOMO dan LUMO dari LiAlH4 dan amida
c. Pembentukan senyawa Zn-dialkilditiokarbamat
Sintesis senyawa Zn-dipalmitilditiokarbamat dilakukan seperti sintesis Zn-dibutilditiokarbamat, dan rendemen yang diperoleh sebesar 66.49%. suatu reaksi terjadi jika memiliki simetri orbital yang sesuai dan tingkat energi HOMO-LUMO yang mirip (Miessler & Tarr 1998). Hasil perhitungan DFT dengan metode BLYP basis set 6-31*G menunjukkan jarak EHOMO ZnCl2 dan EHOMO Na-dialkilditiokarbamat semakin pendek dengan semakin pendeknya rantai alkil dari Na-dialkilditiokarbamat (Gambar 22). Senyawa/ion/unsur yang memiliki tingkat energi HOMO yang lebih besar akan berfungsi sebagai donor elektron, dan sebaliknya. Oleh karena itu, Na-Dialkilditiokarbamat berfungsi sebagai donor elektron (basa Lewis) dan ZnCl2 sebagai penerima elektron (asam Lewis).
Gambar 22 Profil energi HOMO-LUMO dari ZnCl2 dan Na-dialkilditiokarbamat (alkil = C4, C6, C8, C12, dan C16)
hardness dari Zn dan dialkilditokarbamat memiliki nilai yang mirip serta lebih kecil dari ion Na dan Cl. Hasil perhitungan tersebut memberikan gambaran bahwa ion Na dan klorida bersifat asam basa keras karena memilki nilai hardness dan gap EHOMO-ELUMO yang besar (Miessler & Tarr 1998). Dan ion Zn2+ dan dialkilditiokarbamat akan cenderung mudah bereaksi membentuk senyawa baru, sedangkan ion Na akan lebih cenderung bereaksi dengan ion klorida karena memiliki karakter asam-basa keras.
Tabel 9 Nilai EHOMO, ELUMO, Gap energi, dan Hardness Hasil perhitungan DFT metode BLYP dengan basis set 6-31G*
Komponen Ion E (ev) EHOMO
Dibutilditiokarbamat -32796.2 -4.44 -1.37 3.07 1.535
Penentuan Struktur
a. Senyawa Zn-dibutilditiokarbamat
Identifikasi keberhasilan sintesis senyawa Zn-dibutilditiokarbamat dipantau menggunakan FTIR dan HPLC. Hasil pengukuran FTIR menunjukkan adanya perubahan puncak dari spektrum dibutilamina, dibutilditiokarbamat, dan Zn-dibutilditiokarbamat. Puncak penting yang menunjukkan adanya perubahan struktur (Zhang et al. 2003 dan ) adalah puncak serapan 3300 cm-1 (ulur N-H), 1100 cm-1 adanya S-H, 1640-1550 cm -1 (tekuk N-H), 1000 cm-1 adanya kompleks S-M. Spektrum hasil pengukuran
dengan FTIR (Lampiran 4) menunjukkan perbedaan antara dibutilamina, dibutiltiokarbamat dan Zn-dibutilditiokarbamat. Hilangnya puncak serapan pada bilangan gelombang 331.78 cm-1 (vibrasi N-H) dan munculnya puncak serapan pada bilangan gelombang 929.69, 956.69 dan 1010.70 cm-1 (vibrasi C-S,S).
Dibutilditiokarbamat adalah puncak yang tajam di bilangan gelombang 1100 cm-1. Puncak serapan tunggal dan kuat pada bilangan gelombang ini menunjukkan vibrasi dari C-S,S yang bebas (tidak terkompleks). Spektrum IR beberapa senyawa yang berkaitan dengan pembentukan Zn-dialkilditiokarbamat berdasarkan hasil perhitungan DFT dan pengukuran dengan alat FTIR terlampir (Lampiran 4 dan 7).
Intensitas pada bilangan gelombang tiap gugus fungsi dari vibrasi molekul merupakan hal yang karakteristik pada suatu molekul. Uji statistik (uji t) terhadap rasio intensitas dan bilangan gelombang dari senyawa Zn-dibutilditiokarbamat antara hasil pengukuran dan perhitungan tidak berbeda nyata pada selang kepercayaan 95%. Selain itu, data rasio intensitas terhadap bilangan gelombang menunjukkan sebaran (pola sebaran) yang tidak berbeda (Gambar 23). Pola rasio intensitas dan bilangan gelombang yang memiliki puncak-puncak spesifik antara hasil pemgukuran dan perhitungan memiliki kemiripan sehingga hasil perhitungan dapat digunakan sebagai identifikasi.
Gambar 24 Sebaran data rasio intensitas terhadap bilangan gelombang hasil pengukuran FTIR spectrometer dan perhitungan DFT metode B3LYP dengan basis set 6-31G*
sama. Hasil analisis HPLC dengan kolom C18, detektor UV (254 nm) dan eluen metanol:air (95:5) menunjukkan adanya perbedaan waktu retensi antara dibutilamine (tR=4.092 menit) dan Zn-dibutilditiokarbamat hasil pemurnian dengan melarutkannya dalam metanol (tR=6.942 menit) (Gambar 24). Dalam proses pemurnian tersebut, senyawa Zn-dibutilditiokarbamat terlarut dalam pelarut metanol yaitu adanya peak pada tR=6.917 menit (Gambar 25) yang menunjukkan adanya senyawa Zn-dibutilditiokarbamat.
Gambar 24 Kromatogram HPLC senyawa dibutilamina dan Zn-dibutilditiokarbamat
b. Senyawa Zn-dipalmitilditiokarbamat
Identifikasi keberhasilan sintesis dilakukan dengan FTIR & HPLC. Nilai puncak serapan pada spektrum FTIR menunjukkan adanya perbedaan dari setiap tahapan reaksi mulai dari amina primer, amida sekunder, amina sekunder dan Zn-dialkilditiokarbamat (Lampiran 5 dan 6). Perbedaan spektrum FTIR dari heksadesilamina, N-heksaldesilpalmitoilamida, dipalmitilamina, dan Zn-dipalmitilditiokarbamat diringkas pada Tabel 10. Hasil analisis dengan HPLC menggunakan kolom C18 eluen methanol:propanol (95:5) dengan detektor UV (254 nm) diperoleh pemisahan yang baik antara dipalmitilamina dan Zn-dipalmitilditiokarbamat. Waktu retensi (tR) 0.500 menit menunjukkan senyawa dipalmitilamina dan tR=0.750 menit menunjukkan senyawa Zn-dipalmitilditiokarbamat (Gambar 26).
Table 10 Ringkasan puncak serapan IR dari reaktan sampai produk dalam sintesis Zn-dialkilditiokarbamat
Bilangan geombang (cm-1)
C16H35N C15H31CONH34C16 (amida 2o)
C16H33N C16 H34 (amina 2o)
Zn- dialkil DTC
Tipe vibrasi
3301 Ada Ada Ada Tidak ada N-H
1639-1645 ada Ada Tidak ada Tidak ada N-H & C=O
1544-1555 ada Ada Ada Tidak ada C-H & N-H
Gambar 26 Kromatogram dipalmitilamina dan Zn-dipalmitilditiokarbamat
Perkiraan Aplikasi Senyawa Kompleks
Aktivitas lubricant boundary additive berfungsi mengurangi friksi dan wear dengan menjaga adanya boundary antara dua permukaan yang saling kontak dan membentuk sabun atau kompleks antara senyawa aditif dengan oksida logam. Proses pembentukan lapisan senyawa Zn-dialkilditiokarbamat pada permukaan logam dapat dilihat pada Gambar 26. Proses ini dianalogikan dengan model yang pertama kali diusulkan oleh Marina et al (1998) dan Ohmae N (2005) dalam proses pembentukan lapisan Zn-DialkilDitiofosafat (ZDDP) di permukaan logam (Gambar 27).
Mekanisme yang terjadi dalam proses tribokimia merupakan reaksi kimia sehingga dapat dijelaskan melalui pendekatan teori HSAB. System tribokimia yang baik diperoleh pada saat kestabilan reaksi dalam proses dicapai melalui penggunaan additive yang mampu bereaksi dengan asam lunak dan asam keras. Martin et al. (2000) menggunakan pendekatan chemical hardness untuk menjelaskan efek sinergis dari system Mo-ditiokarbamat (antifriksi yang sangat baik, µ=0.05, antiwear yang kurang baik) dan Zn-ditiofosfat (antiwear yang sangat baik, antifriksi kurang baik µ=0.15). Dalam system biner tersebut, Zn-DTP akan bereaksi dengan oksida besi (reaksi asam-basa keras) dalam status sebagai
Minutes
Amine 2 Palm Palm+Zn Palm (070110)
antiwear dan Mo-DTC membentuk MoS2, MoO3, dan karbamat akibat friksi. MoS2 berfungsi sebagai antifriksi melalui pembetukan tribofilm single sheet. Penjelasan kuantitatif terjadinya reaksi kimia dapat diukur menggunakan chemical
hardness, elektronegativitas absolute, dan softness (Miessler & Tarr 1998). Ukuran kuantitatif diatas digunakan untuk memprediksi reaktivitas aditif pelumas sebagai antifriksi dan antiwear.
Gambar 27 Reaksi asam-basa tribokimia Zn-Ditiofosfat, proses pembentukan Fe/Zn fosfat yang lambat (reaksi asam basa keras), dan proses pembentukan FeSx yang cepat (reaksi asam basa lunak) (Ohmae N et al 2005)
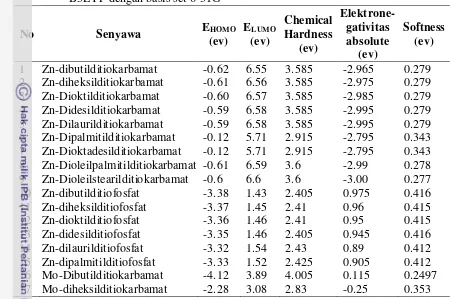
Tabel 11 Nilai Chemical hardness, elektronegativitas absolute, dan softness dari Zn-DTC, Zn-DTP dan Mo-DTC yang dihitung berdasarkan DFT B3LYP dengan basis set 6-31G*
No Senyawa EHOMO 2 Zn-diheksilditiokarbamat -0.61 6.56 3.585 -2.975 0.279 3 Zn-Dioktilditiokarbamat -0.60 6.57 3.585 -2.985 0.279 4 Zn-Didesilditiokarbamat -0.59 6.58 3.585 -2.995 0.279 5 Zn-Dilaurilditiokarbamat -0.59 6.58 3.585 -2.995 0.279 6 Zn-Dipalmitilditiokarbamat -0.12 5.71 2.915 -2.795 0.343 7 Zn-Dioktadesilditiokarbamat -0.12 5.71 2.915 -2.795 0.343 8 Zn-Dioleilpalmitilditiokarbamat -0.61 6.59 3.6 -2.99 0.278 9 Zn-Dioleilstearilditiokarbamat -0.6 6.6 3.6 -3.00 0.277 10 Zn-dibutilditiofosfat -3.38 1.43 2.405 0.975 0.416 11 Zn-diheksilditiofosfat -3.37 1.45 2.41 0.96 0.415 12 Zn-dioktilditiofosfat -3.36 1.46 2.41 0.95 0.415 13 Zn-didesilditiofosfat -3.35 1.46 2.405 0.945 0.416 14 Zn-dilaurilditiofosfat -3.32 1.54 2.43 0.89 0.412 15 Zn-dipalmitilditiofosfat -3.33 1.52 2.425 0.905 0.412 16 Mo-Dibutilditiokarbamat -4.12 3.89 4.005 0.115 0.2497 17 Mo-diheksilditiokarbamat -2.28 3.08 2.83 -0.25 0.353
Senyawa Zn-DTP dan Mo-DTC sudah dikenal sebagai aditif pelumas (antiwear dan antifriksi) yang baik. Mo-DTC merupakan antifriksi yang sangat baik dan lebih baik dibandingkan Zn-DTP. Mo-DTC yang termasuk salah satu
superlubricity (Erdemir & Martin 2007) karena memiliki kemampuan menurunkan koefisien friksi sampai lebih kecil dari 0.05. Dan dari segi parameter kuantitatif, Mo-DTC dengan panjang rantai yang sama memiliki nilai elektronegativitas yang lebih rendah dibandingkan dengan Zn-DTP. Hal ini menunjukkan nilai elektronegativitas yang semakin rendah akan meningkatkan antivitas anti friksi yang lebih baik (Erdemir et al. 2005) dan berdasarkan Martin
yang lebih baik dari lainnya. Selain itu, nilai elektronegativitas Zn-DTC rantai C16 dan C18:1 turun tetapi nilai hardness meningkat lagi. Demikian juga pada Zn-DTC rantai C18 dan C18:1, sehingga adanya rantai tak jenuh menyebabkan peningkatan kemampuan antifriksi tetapi mengurangi kemampuan antiwear-nya.
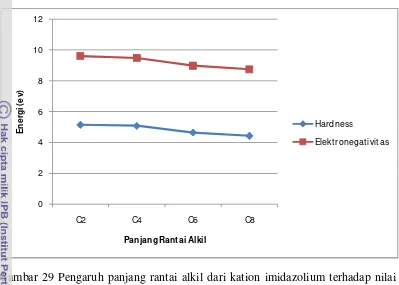
Kemampuan antiwear dari Zn-DTP lebih baik dibandingkan Mo-DTC, hal ini disebabkan gugus fosfat dari Zn-DTP bersifat basa keras dan wear yang terjadi akibat friksi seperti Fe2O3 bersifat asam keras sehingga Zn-DTP dapat menjaga kesetimbangan dari proses tribokimia. Ukuran kuantitatif (dalam hal ini nilai hardness) dari Zn-DTP lebih rendah dibandingkan Mo-DTP dengan panjang rantai alkil yang sama. Oleh karena itu, senyawa dengan nilai hardness yang lebih rendah memiliki kemampuan antiwear yang lebih baik. Nilai hardness Zn-DTC berada diantara Zn-DTP dan Mo-DTC, sehingga senyawa Zn-DTC memiliki kemampuan antifriksi dari Mo-DTC dan kemampuan antiwear dari Zn-DTP. Pengaruh panjang rantai terhadap kemampuan antifriksi juga dilakukan oleh Minami (2009), dan memperlihatkan bahwa panjang rantai dalam kation imidazolium menurunkan koefisien friksi yang berarti senyawa tersebut memiliki kemampuan antifriksi yang lebih baik (Gambar 28). Hasil perhitungan DFT menunjukkan semakin panjang rantai alkil semakin turun nilai hardness dan elektronegativitasnya (Gambar 29).
Gambar 29 Pengaruh panjang rantai alkil dari kation imidazolium terhadap nilai hardness & elektronegativitas hasil perhitungan DFT metode B3LYP dengan basis set 6-31G*
0 2 4 6 8 10 12
C2 C4 C6 C8
E
n
e
rg
i
(e
v
)
Panjang Rantai Alkil
Hardness