PROFIL PROTEIN SUSU KUDA DAN SUSU KAMBING
PADA BERBAGAI KONDISI SDS PAGE
DWI AGUSTYANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Profil Protein Susu Kuda dan Susu Kambing pada Berbagai Kondisi SDS PAGE benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
DWI AGUSTYANTI. Profil Protein Susu Kuda dan Susu Kambing pada Berbagai Kondisi SDS PAGE. Dibimbing oleh MAGGY THENAWIDJAJA SUHARTONO dan HARSI DEWANTARI KUSUMANINGRUM.
SDS PAGE (Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis) merupakan metode yang banyak digunakan untuk menganalisis protein mikroorganisme, tumbuhan, hewan, manusia, termasuk susu. Susu merupakan salah satu bahan pangan hewani kaya protein yang dihasilkan oleh mamalia: sapi, kambing, domba, kerbau, kuda, dan sebagainya. Selain susu sapi, susu kuda dan susu kambing telah banyak diminati oleh masyarakat karena memiliki nilai gizi yang tinggi, serta diyakini dapat memberikan berbagai manfaat kesehatan. Protein susu dapat terpisah ke dalam bagian kasein dan whey. Fragmen protein dapat diketahui dengan analisis SDS PAGE yang memberikan gambaran profil protein. Profil protein dapat dimanfaatkan dalam pengembangan produk pangan sesuai dengan karakteristik protein yang diinginkan. Tujuan penelitian ini adalah menganalisis keseluruhan profil protein susu, kasein, dan whey dari susu kuda dan susu kambing pada kondisi SDS PAGE yang bervariasi, serta memperoleh kondisi SDS PAGE yang optimum untuk dapat menghasilkan visualisasi profil protein yang informatif.
Penelitian dilakukan dalam dua tahap, yaitu preparasi sampel dan analisis SDS PAGE. Pada tahap preparasi sampel dilakukan pemisahan lemak dengan cara sentrifugasi, dan pemisahan kasein dan whey susu kuda dan susu kambing dengan menggunakan asam klorida. Selanjutnya, dilakukan tahap analisis profil protein susu, kasein dan whey dari susu kuda dan susu kambing pada berbagai kondisi SDS PAGE (konsentrasi gel pemisah 12%, 15%, 18% dan voltase running SDS PAGE 70 Volt, 200 Volt, 70-200 Volt).
Hasil analisis SDS PAGE protein susu kuda memperlihatkan pemisahan fragmen protein yang mencirikan laktoferin, serum albumin, imunoglobulin,
kasein, -laktoglobulin, lisozim, dan α-laktalbumin. Hasil SDS PAGE protein susu kambing memperlihatkan pemisahan fragmen protein yang mencirikan laktoferin, serum albumin, imunoglobulin, α-kasein, -kasein, κ-kasein, -laktoglobulin, dan α-laktalbumin. Jumlah pita protein pada hasil SDS PAGE protein susu kuda dan susu kambing berkisar antara 9 sampai 12 pita protein.
Hasil SDS PAGE protein kasein susu kuda dan susu kambing menunjukkan terdapatnya pemisahan fragmen kasein yang mencirikan α-kasein, -kasein, dan
κ-kasein, dengan jumlah pita protein berkisar antara 7 sampai 10 pita protein. Fragmen yang dominan pada profil protein kasein susu kuda adalah α-kasein, sedangkan pada profil protein kasein susu kambing yang dominan adalah κ -kasein. Hasil SDS PAGE protein whey susu kuda dan susu kambing menunjukkan pemisahan fragmen whey yang mencirikan laktoferin, serum albumin,
Pada konsentrasi gel pemisah 12%, hasil SDS PAGE menunjukkan pemisahan pita protein cenderung menyebar pada bagian bawah gel dibandingkan konsentrasi gel pemisah 15% dan 18%, sedangkan pada konsentrasi gel pemisah 18% terlihat cenderung menyebar pada bagian atas gel. Konsentrasi gel pemisah 15% memberikan visualisasi profil protein yang terbaik. Running SDS PAGE dengan voltase sebesar 70 Volt memberikan hasil visualisasi profil protein yang lebih baik dibandingkan dengan 200 Volt dan 70-200 Volt, baik pada protein susu, kasein, dan whey susu kuda maupun susu kambing.
Visualisasi profil protein terbaik diperoleh pada kondisi SDS PAGE menggunakan konsentrasi gel pemisah 15% dan voltase 70 Volt, baik pada protein susu, kasein, dan whey susu kuda maupun susu kambing. Pada kondisi tersebut, profil protein yang dihasilkan memperlihatkan pemisahan fragmen laktoferin, serum albumin, imunoglobulin, α-kasein, -kasein, κ-kasein, -laktoglobulin, lisozim, dan α-laktalbumin dengan jelas. Kondisi SDS PAGE yang optimum (15%, 70 Volt) dapat dimanfaatkan untuk memperoleh informasi yang komprehensif terkait fragmen protein pada susu kuda dan susu kambing yang dapat digunakan sebagai ingredien dalam pengembangan pangan fungsional dan kebutuhan medis, serta untuk pengawasan mutu protein susu selama proses produksi, transportasi dan pengolahan.
SUMMARY
DWI AGUSTYANTI. Protein Profiles of Mare’s and Goat’s Milk at Various SDS PAGE Conditions. Supervised by MAGGY THENAWIDJAJA SUHARTONO and HARSI DEWANTARI KUSUMANINGRUM.
SDS PAGE (Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis) has been used to analyze proteins from microorganisms, plants, animals, and humans, including milk. Milk is one of animal foods that rich in protein produced by mammals: cow, goat, sheep, buffalo, mare, etc. In addition to cow’s milk,
mare’s and goat’s milk are consumed because of their high nutritional value
which could provide various health benefits. Milk protein can be separated into casein and whey. Protein fragments can be analyzed by SDS PAGE, which can illustrate the protein profiles. Protein profiles can be utilized in development of food products in accordance with characteristics of the desired protein. The aim of this study was to analyze overall protein profile of defatted milk, casein and whey
from mare’s and goat’s milk using varying SDS PAGE conditions, and to obtain the optimum SDS PAGE conditions that provide informative protein profile.
The study was conducted in two stages, namely the sample preparation and SDS PAGE analysis. Mare's and goat's milk was defatted by centrifuge and separated into casein and whey by hydrochloric acid. SDS PAGE was performed by using separating gel at concentration of 12%, 15%, 18%, and voltage of 70 Volt, 200 Volt, and 70 to 200 Volt. Mare’s and goat’s milk were analyzed in the form of their defatted milk, casein and whey.
SDS PAGE results for mare’s defatted milk protein shows separation of
fragments: lactoferrin, serum albumin, immunoglobulin, casein, -lactoglobulin, lysozyme, and α-lactalbumin. SDS PAGE results for goat’s defatted milk protein shows separation of fragments: lactoferrin, serum albumin, immunoglobulin, α
-casein, -casein, κ-casein, -lactoglobulin, and α-lactalbumin. The amount of protein bands on SDS PAGE results for mare's and goat's defatted milk protein ranged from 9 to 12.
SDS PAGE results for mare’s and goat’s casein shows separation of
fragments: α-casein, -casein, and κ-casein, with the amount of protein bands ranged from 7 to 10. Dominant fragments of mare's casein protein profile were α -casein, while on goat’s casein protein profile was κ-casein. SDS PAGE results for
mare’sand goat’s whey protein shows separation of fragments: lactoferrin, serum
albumin, immunoglobulin, -lactoglobulin, lysozyme (mare’s milk), and α -lactalbumin, with the amount of protein bands ranged from 6 to 10 (mare’s milk) and 8 (goat’s milk). Dominant fragment of mare's and goat’s whey protein profile was -lactoglobulin.
Protein bands in separating gel concentration of 12% appeared at the bottom of the gel compared with 15% and 18% gel, whereas in 18% gel the protein bands appeared at the top of the gel. Overall, 15% gel provides the best visualization of
defatted milk, casein and whey protein profiles from mare’s and goat’s milk.
The best and clean protein profile was obtained using a separating gel at concentration of 15% and voltage of 70 Volt for mare’s and goat’s milk. The
protein profiles indicated clear lactoferrin, serum albumin, immunoglobulin, α
-casein, -casein, κ-casein, -lactoglobulin, lysozyme, and α-lactalbumin protein bands. The optimum conditions (SDS PAGE 15%, 70 Volt) could be used to
obtained comprehensive information regarding the protein fragments of mare’s
and goat's milk. Its protein fragments could be used as ingredient for the development of functional food and medical uses, and for quality control of the milk protein from mare and goat during harvest, transport and processing.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
PROFIL PROTEIN SUSU KUDA DAN SUSU KAMBING
PADA BERBAGAI KONDISI SDS PAGE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT karena atas rahmat dan karunia-Nya penulis dapat menyelesaikan tesis yang berjudul Profil Protein Susu Kuda dan Susu Kambing pada Berbagai Kondisi SDS PAGE.
Penulis menyampaikan penghargaan dan ucapan terima kasih yang tidak terhingga kepada:
1. Ibu Prof Dr Ir Maggy Thenawidjaja Suhartono dan Ibu Dr Ir Harsi Dewantari Kusumaningrum selaku komisi pembimbing yang telah memberikan curahan ilmu, bimbingan, waktu, dan perhatian selama penelitian dan penulisan tesis ini. Penulis juga menyampaikan ucapan terima kasih secara khusus kepada Ibu Prof Dr Ir Maggy Thenawidjaja Suhartono yang telah memberikan dukungan dana penelitian.
2. Bapak Prof Dr Ir Dedi Fardiaz, MSc selaku Penguji Luar Komisi dan Ibu Dr Endang Prangdimurti selaku perwakilan dari Program Studi Ilmu Pangan yang telah banyak memberikan saran guna menyempurnakan penulisan tesis ini. 3. Seluruh pengajar di Program Studi Ilmu Pangan yang telah memberikan ilmu
bagi penulis.
4. Badan Pengawas Obat dan Makanan yang telah memberikan kesempatan, dukungan, dan dana selama menempuh studi di Program Studi Ilmu Pangan, Sekolah Pascasarjana, Institut Pertanian Bogor.
5. Ibu Ir Tetty Helfery Sihombing, MP beserta jajaran di Direktorat Standardisasi Produk Pangan yang telah memberikan kesempatan, dukungan, dan semangat selama menempuh studi di Program Studi Ilmu Pangan, Sekolah Pascasarjana, Institut Pertanian Bogor.
6. Bapak, Ibu, Kakak, Adik, Keponakan, serta seluruh keluarga dan sahabat atas segala doa, dukungan, semangat, dan kasih sayangnya kepada penulis.
7. Keluarga besar Pondok Putri Rahmah atas doa, dukungan, semangat, dan bantuannya kepada penulis.
8. Para teknisi dan rekan-rekan di Laboratorium Mikrobiologi dan Biokimia Gedung PAU, Laboratorium SEAFAST Center, dan Laboratorium ITP yang telah memberikan ilmu dan bantuan selama penulis melakukan penelitian. 9. Rekan-rekan mahasiswa IPN atas bantuan dan kerjasamanya selama
menempuh studi di Program Studi Ilmu Pangan.
Semoga tesis ini dapat bermanfaat. Saran dan kritik yang membangun sangat penulis harapkan.
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesis Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Protein Susu 3
Kasein 3
Whey 4
SDS PAGE (Sodium Dodecyl Sulfate Polyacrylamide GelElectrophoresis) 5
3 METODE PENELITIAN 6
Lokasi dan Waktu Penelitian 6
Bahan dan Peralatan Penelitian 6
Metodologi 7
4 HASIL DAN PEMBAHASAN 8
Profil Protein Susu 8
Profil Protein Kasein 14
Profil Protein Whey 16
Pengaruh Konsentrasi Gel Pemisah 19
Pengaruh Tegangan Listrik (Voltase) 20
5 SIMPULAN DAN SARAN 21
Simpulan 21
Saran 21
DAFTAR PUSTAKA 22
LAMPIRAN 25
DAFTAR TABEL
1 Komposisi susu kuda, susu kambing, susu sapi, susu domba, dan ASI 3 2 Fragmen kasein susu kuda, susu kambing, susu sapi, susu domba, dan
ASI 4
3 Fragmen whey susu kuda, susu kambing, susu sapi, susu domba, dan
ASI 5
4 Analisis SDS PAGE pada susu kuda dan susu kambing 6
5 Komposisi gel penahan dan gel pemisah 7
6 Profil protein susu kuda dan protein susu kambing 10 7 Ukuran (berat molekul) fragmen protein susu kuda, susu kambing, susu
sapi, dan ASI 14
8 Profil protein kasein susu kuda dan kasein susu kambing 15 9 Profil protein whey susu kuda dan whey susu kambing 17 10 Konsentrasi gel pemisah, voltase, lama protein bermigrasi, dan profil
protein 19
DAFTAR GAMBAR
1 Hasil SDS PAGE susu kuda 9
2 Hasil SDS PAGE susu kambing 12
3 Hasil SDS PAGE protein susu kuda, susu kambing, susu sapi, dan ASI 13
DAFTAR LAMPIRAN
1 Penentuan pita protein menggunakan program Gel Analyzer versi 2010a 27 2 Penentuan fragmen protein dominan (SDS PAGE 15%, 70 Volt)
1
1
PENDAHULUAN
Latar Belakang
Elektroforesis merupakan teknik pemisahan fragmen berdasarkan migrasi molekul bermuatan pada suatu medan listrik. Salah satu teknik elektroforesis yang sering digunakan adalah SDS PAGE (Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis), yang merupakan metode cepat dan reproducible dalam mengkuantifikasi dan mengkarakterisasi protein. SDS PAGE dapat menganalisis kemurnian protein, mengestimasi berat molekul protein, memverifikasi konsentrasi protein, serta mendeteksi proteolisis dan modifikasi protein (Bollag dan Edelstein 1991, Walker 2002). Migrasi protein pada SDS PAGE dapat dipengaruhi oleh parameter, seperti medan listrik, matriks gel, serta ukuran, bentuk, muatan, dan komposisi kimia protein.
SDS (sodium dodecyl sulfate) bersama dengan -merkaptoetanol digunakan pada analisis SDS PAGE untuk melepaskan struktur sekunder, tertier, dan kuartener, serta ikatan disulfida pada protein sehingga menghasilkan rantai polipeptida linier yang membentuk kompleks SDS-protein bermuatan negatif. Medan listrik akan membawa kompleks SDS-protein tersebut ke arah muatan yang berlawanan. SDS PAGE menggunakan gel poliakrilamid yang berperan sebagai media migrasi dalam pemisahan protein. Gel poliakrilamid dibentuk melalui polimerisasi akrilamid dengan bisakrilamid (senyawa pengikatan silang), dengan inisiator amonium persulfat (APS) dan katalis tetrametiletilendiamin (TEMED). Ruang antar ikatan silang pada polimer membentuk pori yang ukurannya dapat dibuat beragam berdasarkan banyaknya akrilamid yang digunakan (konsentrasi gel). Pori-pori tersebut yang memungkinkan terjadinya migrasi molekul protein pada gel poliakrilamid (Shi dan Jackowski 1998, Walker 2002, Roy et al. 2012).
SDS PAGE telah digunakan untuk menganalisis protein pada mikroorganisme, tumbuhan, hewan, manusia, termasuk susu. Susu merupakan salah satu bahan pangan hewani kaya protein yang dihasilkan oleh mamalia : sapi, kambing, domba, kerbau, kuda, dan sebagainya. Tingkat konsumsi susu pada masyarakat terus mengalami peningkatan dari tahun ke tahun. Selain susu sapi, susu kuda dan susu kambing telah banyak diminati oleh masyarakat karena memiliki nilai gizi yang tinggi, serta diyakini dapat memberikan berbagai manfaat kesehatan. Keunggulan susu kuda dibandingkan susu sapi diantaranya yaitu kandungan lemak yang lebih rendah, sedangkan keunggulan susu kambing diantaranya adalah kandungan protein yang lebih tinggi dibandingkan susu sapi.
2
Perumusan Masalah
Profil protein susu dari sapi, kambing, domba, kuda, keledai, unta, dan manusia telah diteliti melalui analisis SDS PAGE. Namun dalam hal ini, analisis komprehensif menggunakan parameter konsentrasi gel pemisah dan voltase yang bervariasi belum dilaporkan. Penelitian sebelumnya, masing-masing dilakukan dengan kondisi SDS PAGE yang berbeda menggunakan konsentrasi gel pemisah pada kisaran 12% hingga 20% dan voltase 75 Volt hingga 200 Volt. Penelitian mengenai pengaruh variasi matriks gel elektroforesis (dalam hal ini, konsentrasi gel pemisah) dan tegangan listrik (voltase) running SDS PAGE terhadap profil protein susu kuda dan susu kambing belum pernah dilaporkan.
Informasi mengenai profil protein dapat dimanfaatkan dalam pengembangan ingredien protein pangan sesuai dengan karakteristik yang diinginkan. Selain itu, profil protein yang informatif juga dapat digunakan dalam pengawasan mutu protein susu selama proses produksi, transportasi dan pengolahan. Oleh karena itu, kondisi optimum dalam melakukan analisis SDS PAGE perlu diperhatikan agar diperoleh informasi profil protein yang lebih akurat.
Tujuan Penelitian
Tujuan penelitian ini adalah menganalisis keseluruhan profil protein susu, kasein, dan whey dari susu kuda dan susu kambing menggunakan SDS PAGE pada kondisi yang bervariasi (konsentrasi gel pemisah 12%, 15%, 18% dan voltase running SDS PAGE 70 Volt, 200 Volt, 70-200 Volt). Penelitian ini juga bertujuan untuk memperoleh kondisi SDS PAGE yang optimum untuk dapat menghasilkan visualisasi profil protein yang informatif.
Hipotesis Penelitian
Hipotesis penelitian ini yaitu:
1. Profil protein susu kuda berbeda dengan profil protein susu kambing.
2. Variasi konsentrasi gel pemisah dan voltase pada SDS PAGE dapat menghasilkan profil protein yang berbeda.
3. Konsentrasi gel pemisah dan voltase SDS PAGE yang optimum dapat menghasilkan visualisasi profil protein yang menyeluruh dan informatif.
Manfaat Penelitian
3 nilai gizi tinggi dan memberikan berbagai manfaat kesehatan. Protein susu dapat terpisah menjadi bagian kasein dan whey. Susu kuda memiliki kandungan protein (21,4 g/kg) yang lebih tinggi dibandingkan dengan air susu ibu (ASI) (14,2 g/kg), namun lebih rendah dibanding susu sapi, susu kambing dan susu domba (32,5 bervariasi tergantung pada faktor genetik, fisiologis, nutrisi serta kondisi lingkungan (Malacarne et al. 2002, Naert et al. 2013). Komposisi susu kuda dan susu kambing, dibandingkan susu sapi, susu domba, dan ASI sebagaimana tercantum pada Tabel 1.
Tabel 1 Komposisi susu kuda, susu kambing, susu sapi, susu domba, dan ASI
Komposisi Susu kuda Susu
kambing Susu sapi
Sumber: Potočnik et al. (2011)
Kasein
4
dihasilkan, kemudian diproses lebih lanjut (drain, wash, press, mill, dry) sehingga diperoleh kasein-asam dan kasein-rennet (Wang et al. 2013).
Kasein meliputi 4 komponen yang terdiri dari αs1-, αsβ-, - dan κ-kasein, (BM 23,9 kDa). Fragmen kasein susu kuda dan susu kambing, dibandingkan susu sapi, susu domba, dan ASI sebagaimana tercantum pada Tabel 2.
Tabel 2 Fragmen kasein susu kuda, susu kambing, susu sapi, susu domba, dan ASI
Fragmen kasein Susu kuda Susu
kambing Susu sapi
Sumber: Potočnik et al. (2011)
Whey
Whey merupakan protein yang terkandung dalam cairan sisa pengendapan susu (produksi kasein). Protein whey terdiri dari -laktoglobulin ( -Lg), α -laktalbumin (α-La), laktoferin (Lf), serum albumin (SA), imunoglobulin (Ig) (Eriksen et al. 2010), dan lisozim (Lis) (Uniacke-Lowe et al. 2010). Dalam industri pangan, whey digunakan sebagai sumber asam amino dan peptida bioaktif. Whey digunakan sebagai antimikroba yang dapat menghambat pertumbuhan mikroba dan menstimulasi sistem imun dalam tubuh, diantaranya yaitu laktoferin, lisozim, dan imunoglobulin (Claeys et al. 2014).
Berat molekul whey susu kuda yaitu laktoferin (BM 75,4 kDa) (Uniacke-Lowe et al. 2010), serum albumin (BM 60 kDa) (Guo et al. 2007), -laktoglobulin (BM 18,5 kDa) (Uniacke-Lowe et al. 2010), lisozim (BM 14,4 kDa) (Yuniati dan
5
Tabel 3 Fragmen whey susu kuda, susu kambing, susu sapi, susu domba, dan ASI
Fragmen whey Susu kuda Susu
Sumber: Potočnik et al. (2011)
SDS PAGE (Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis)
Elektroforesis merupakan teknik pemisahan fragmen berdasarkan migrasi molekul bermuatan pada suatu medan listrik. Salah satu teknik elektroforesis yang sering digunakan adalah SDS PAGE (Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis), yang merupakan metode cepat dan reproducible dalam mengkuantifikasi dan mengkarakterisasi protein. SDS PAGE dapat menganalisis kemurnian protein, mengestimasi berat molekul protein, memverifikasi konsentrasi protein, mendeteksi proteolisis dan mendeteksi modifikasi protein (Bollag dan Edelstein 1991, Walker 2002). Menurut Roy et al. (2012), migrasi protein pada SDS PAGE dipengaruhi oleh beberapa parameter, seperti medan listrik, matriks gel, serta ukuran, bentuk, muatan, dan komposisi kimia protein.
SDS (sodium dodecyl sulfate) merupakan deterjen anionik yang digunakan
bersama dengan -merkaptoetanol untuk melepaskan struktur sekunder, tertier, dan kuartener, serta ikatan disulfida pada protein sehingga menghasilkan rantai polipeptida linier yang membentuk kompleks SDS-protein bermuatan negatif. Medan listrik akan membawa kompleks SDS-protein tersebut ke arah muatan yang berlawanan. SDS PAGE menggunakan gel poliakrilamid yang berperan sebagai media migrasi dalam pemisahan protein. Gel poliakrilamid dibentuk melalui polimerisasi akrilamid dengan bisakrilamid (senyawa pengikatan silang), dengan inisiator amonium persulfat (APS) dan katalis tetrametiletilendiamin (TEMED). Ruang antar ikatan silang pada polimer membentuk pori yang ukurannya dapat dibuat beragam berdasarkan banyaknya akrilamid yang digunakan (konsentrasi gel). Pori-pori tersebut yang memungkinkan terjadinya migrasi molekul protein pada gel poliakrilamid (Shi dan Jackowski 1998, Walker 2002, Roy et al. 2012).
6
Nurliyani 2003, Miranda et al. 2004, Guo et al. 2007, Maheswari et al. 2007, Almaas et al. 2008, Salem et al. 2009, Eriksen et al. 2010, Inglingstad et al. 2010, Ahmed et al. 2011, Uniacke-Lowe 2011, Kumar et al. 2013, El-Hatmi et al. 2015). Analisis SDS PAGE terhadap susu kuda dan susu kambing telah dilakukan pada beberapa penelitian dengan kondisi konsentrasi gel pemisah dan voltase SDS PAGE sebagaimana tertera pada Tabel 4.
Tabel 4 Analisis SDS PAGE pada susu kuda dan susu kambing Referensi Sampel Konsentrasi
Penelitian dilaksanakan di Laboratorium Mikrobiologi dan Biokimia PAU (Pusat Antar Universitas) IPB dan Laboratorium Mikrobiologi Pangan SEAFAST Center IPB. Penelitian dilaksanakan pada bulan Maret 2015 sampai Juni 2015.
Bahan dan Peralatan Penelitian
7
tris (2-hidroksimetil-2-metil-1,3-propanediol), TEMED, 2-merkaptoetanol, gliserol, metanol, asam asetat (Merck KGaA, Darmstadt, Germany), SDS, Coomassie Brilliant Blue R-250 (Sigma Chemical Co, USA), APS, glisin (AppliChem GmbH, Dramstadt, Germany), dan bromophenol blue (Biorad Laboratories, CA). Alat yang digunakan antara lain: sentrifugasi dingin (Tomy MRX-125), peralatan elektroforesis SDS PAGE (Bio-rad, Mini Protean 3), inkubator shaker (Rosi 1000), dan berbagai jenis alat-alat gelas.
Metodologi
Preparasi Susu Kuda dan Susu Kambing
Susu kuda segar dan susu kambing segar disentrifugasi 1200 x g, 4ºC selama 30 menit untuk memisahkan komponen lemak. Isolasi kasein dilakukan dengan cara menambahkan HCl 2N pada susu yang telah dihilangkan lemaknya, hingga mencapai titik isoelektrik yaitu pH 4,2 untuk susu kuda dan pH 4,6 untuk susu kambing, kemudian disentrifugasi 5000 x g, 40C selama 30 menit. Endapan (kasein) yang diperoleh dibilas dengan akuabides, selanjutnya disentrifugasi 5000 x g, 40C selama 30 menit. Supernatan (whey) ditambahkan NaOH 2N, kemudian disentrifugasi 5000 x g, 40C selama 30 menit, sehingga diperoleh whey dengan pH netral (Maheswari et al. 2007, Salem et al. 2009, Detha et al. 2013).
Analisis Profil Protein dengan SDS PAGE
Analisis profil protein dilakukan menggunakan Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS PAGE) (Bollag dan Edelstein 1991, dengan modifikasi), dengan variasi konsentrasi gel pemisah dan tegangan listrik (voltase) running SDS PAGE. Sampel yang dianalisis terdiri dari susu yang telah dihilangkan lemaknya (susu tanpa lemak), kasein dan whey dari susu kuda dan mengandung 75 ml Tris-HCl 2M (pH 8,8), 4 ml SDS 10%, dan 21 ml akuabides. Larutan C mengandung 50 ml Tris-HCl 1M (pH 6,8), 4 ml SDS 10%, dan 46 ml akuabides. Komposisi gel penahan dan gel pemisah sebagaimana tertera pada Tabel 5. Buffer elektroforesis mengandung 3 g tris-base, 14,4 g glisin, dan 1 g SDS dalam 1 L akuades (pH 8,3). Buffer sampel mengandung 0,5 ml 2-merkaptoetanol, 2 ml SDS 10%, 5 ml gliserol 50%, 1 ml bromophenol blue 1%, 0,6 ml Tris-HCl 1M (pH 6,8), dan 0,9 ml akuabides.
Tabel 5 Komposisi gel penahan dan gel pemisah
8
Sebanyak 60 μl sampel dilarutkan dengan 15 μl buffer sampel. Larutan tersebut kemudian dipanaskan dalam air mendidih selama 5 menit, selanjutnya disentrifugasi 500 x g, 40C selama 10 menit untuk memisahkan komponen yang tidak larut. Sebanyak 15 µl larutan dimasukkan ke dalam sumur gel SDS PAGE (gel penahan 4%, dengan variasi gel pemisah 12%, 15%, 18%). Elektroforesis dilakukan pada variasi tegangan listrik 70 Volt, 200 Volt, dan voltase bertahap (70-200 Volt), yaitu semula 70 Volt selama 2 jam, kemudian dinaikkan menjadi 200 Volt hingga akhir elektroforesis, dengan arus 50 miliampere. Gel diwarnai dengan larutan staining (1 g Coomassie Brilliant Blue R-250, 450 ml metanol, 100 ml asam asetat, 450 ml akuades) dilanjutkan dengan pembilasan dengan larutan destaining (100 ml asam asetat, 100 ml metanol, 800 ml akuades). Penentuan pita protein dan fragmen protein yang dominan dilakukan menggunakan program Gel Analyzer versi 2010a yang diunduh dari situs www.gelanalyzer.com.
4
HASIL DAN PEMBAHASAN
Analisis SDS PAGE dapat memberikan gambaran berbagai jenis protein yang terdapat pada susu. Penelitian ini memberikan informasi profil protein susu, kasein, serta whey dari susu kuda dan susu kambing, berdasarkan hasil SDS PAGE dengan variasi konsentrasi gel pemisah (12%, 15%, 18%) dan voltase (70 Volt, 200 Volt, 70-200 Volt) (Gambar 1 dan Gambar 2). Jumlah pita protein dan fragmen protein yang dominan ditentukan dengan menggunakan program Gel Analyzer versi 2010a (Lampiran 1 dan Lampiran 2).
Profil Protein Susu
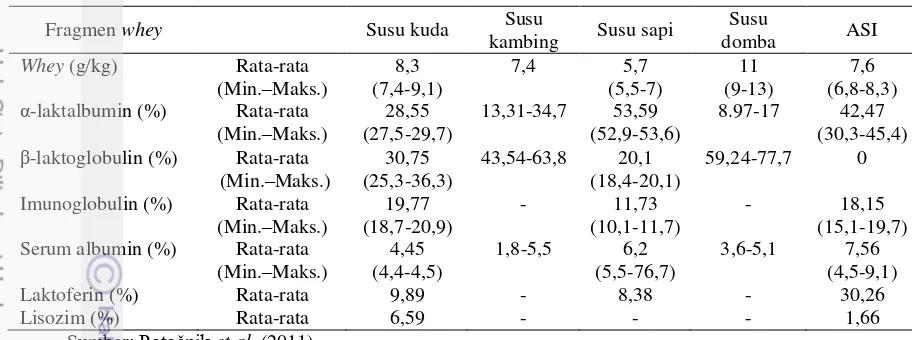
Pada penelitian ini, hasil SDS PAGE protein susu yang diperoleh berdasarkan variasi penggunaan konsentrasi gel pemisah dan voltase running SDS PAGE menunjukkan visualisasi pemisahan fragmen protein dan jumlah pita protein yang beragam. Hasil SDS PAGE protein susu kuda memperlihatkan pemisahan fragmen protein yang mencirikan laktoferin, serum albumin,
imunoglobulin, kasein, -laktoglobulin, lisozim, dan α-laktalbumin, dengan jumlah pita protein berkisar antara 9 sampai 12 pita protein (Gambar 1.A dan Tabel 6). Fragmen-fragmen protein tersebut dapat terlihat pada hasil SDS PAGE protein susu kuda penelitian ini, kecuali dengan penggunaan konsentrasi gel pemisah 12% pada voltase 70 Volt dan 200 Volt. Hasil SDS PAGE 12%, 70 Volt (Gambar 1.A.I.1) tidak memperlihatkan adanya fragmen α-laktalbumin, sedangkan hasil SDS PAGE 12%, 200 Volt (Gambar 1.A.I.2) tidak
9
Gambar 1 Hasil SDS PAGE susu kuda
(A) Susu tanpa lemak, (B) Kasein, (C) Whey;
Konsentrasi gel pemisah: 12% (I), 15% (II), 18% (III); Voltase: 70 Volt (1), 200 Volt (2), 70-200 Volt (3);
Fragmen: (a) Laktoferin, (b) Serum albumin, (c) Imunoglobulin, (d) α-kasein, (e) -kasein, (f) κ-kasein, (g) -laktoglobulin, (h) Lisozim, (i) α-laktalbumin; Referensi: (aa) Miranda et al. 2004, (bb) Uniacke-Lowe 2011,
(cc) Inglingstad et al. 2010, (dd) Ochirkhuyag et al. 2000, (ee) Egito et al. 2002.
A
B
10
10
Tabel 6 Profil protein susu kuda dan protein susu kambing
Profil protein susu 12% 15% 18%
70 Volt 200 Volt 70-200 Volt 70 Volt 200 Volt 70-200 Volt 70 Volt 200 Volt 70-200 Volt Susu kuda
Pita protein* 10 pita 10 pita 11 pita 11 pita 12 pita 9 pita 9 pita 10 pita 10 pita
Fragmen protein
Laktoferin √ √ √ √ √ √ √ √ √
Serum albumin √ √ √ √ √ √ √ √ √
Imunoglobulin √ √ √ √ √ √ √ √ √
Kasein √ √ √ √ √ √ √ √ √
-laktoglobulin √ √ √ √ √ √ √ √ √
Lisozim √ ** √ √ √ √ √ √ √
α-laktalbumin ** ** √ √ √ √ √ √ √
Susu kambing
Pita protein* 10 pita 12 pita 10 pita 10 pita 11 pita 11 pita 9 pita 10 pita 11 pita
Fragmen protein
Laktoferin √ √ √ √ √ √ √ √ √
Serum albumin √ √ √ √ √ √ √ √ √
Imunoglobulin √ √ √ √ √ √ √ √ √
α-kasein √ √ √ √ √ √ √ √ √
-kasein √ √ √ √ √ √ √ √ √
κ-kasein √ √ √ √ √ √ √ √ √
-laktoglobulin √ √ √ √ √ √ √ √ √
Lisozim - - - -
α-laktalbumin ** ** ** √ √ √ √ √ √
11
Penelitian sebelumnya dengan kondisi SDS PAGE yang berbeda dilakukan oleh Miranda et al. (2004) (12%, 180 Volt), Inglingstad et al. (2010) (15%), dan Uniacke-Lowe (2011) (12%, 200 Volt). Pada penelitian ini, visualisasi fragmen laktoferin, serum albumin, dan imunoglobulin terlihat lebih jelas dengan menggunakan konsentrasi gel pemisah 15% pada voltase 70 Volt dibandingkan hasil penelitian Miranda et al. (2004) dan Uniacke-Lowe (2011).
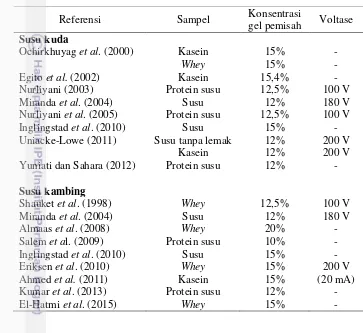
Hasil SDS PAGE protein susu kambing memperlihatkan pemisahan fragmen protein yang mencirikan laktoferin, serum albumin, imunoglobulin, α
-kasein, -kasein, κ-kasein, -laktoglobulin, dan α-laktalbumin, dengan jumlah pita protein berkisar antara 9 sampai 12 pita protein (Gambar 2.A dan Tabel 6). Fragmen-fragmen protein tersebut dapat terlihat pada hasil SDS PAGE protein susu kambing penelitian ini, kecuali dengan penggunaan konsentrasi gel pemisah
1β% (Gambar β.A.I), tidak memperlihatkan adanya fragmen α-laktalbumin. Penelitian sebelumnya dilakukan pada berbagai kondisi SDS PAGE yaitu 12%, 180 Volt (Miranda et al. 2004), 15% (Inglingstad et al. 2010) dan 12% (Kumar et al. 2013).
Pada penelitian ini (dengan kondisi SDS PAGE 15%, 70 Volt), visualisasi fragmen laktoferin, serum albumin, dan imunoglobulin dari susu kambing terlihat lebih jelas dibandingkan dengan hasil penelitian Miranda et al. (2004). Berdasarkan hal tersebut, dapat diamati bahwa penambahan konsentrasi gel pemisah menjadi 15% menggunakan voltase yang lebih rendah (70 Volt) dibandingkan penelitian sebelumnya memberikan visualisasi profil protein yang lebih baik.
Gambar 1.A dan Gambar 2.A menunjukkan bahwa pemisahan fragmen kasein pada hasil SDS PAGE protein susu kuda kurang terlihat dibandingkan pada protein susu kambing. Pada hasil SDS PAGE protein susu kambing jelas terlihat
terdapat pemisahan fragmen kasein yang terdiri dari α-kasein, -kasein, dan κ -kasein. Menurut Potočnik et al. 2011, susu kuda mengandung kasein (10,7 g/kg) lebih rendah dibandingkan susu kambing (24 g/kg). Gambar 1.A dan Gambar 2.A juga menunjukkan bahwa fragmen lisozim dapat terlihat pada hasil SDS PAGE protein susu kuda namun tidak demikian pada protein susu kambing. Hal ini dapat dimungkinkan karena kadar lisozim pada susu kambing yang sangat kecil (250x10-6 g/L) dibandingkan pada susu kuda (0,5-1,33 g/L) (Claeys et al. 2014), sehingga lisozim pada susu kambing dapat tidak terdeteksi.
12
Gambar 2 Hasil SDS PAGE susu kambing
(A) Susu tanpa lemak, (B) Kasein, (C) Whey;
Konsentrasi gel pemisah: 12% (I), 15% (II), 18% (III); Voltase: 70 Volt (1), 200 Volt (2), 70-200 Volt (3);
Fragmen: (a) Laktoferin, (b) Serum albumin, (c) Imunoglobulin, (d) α-kasein, (e) -kasein, (f) κ-kasein, (g) -laktoglobulin, (h) Lisozim, (i) α-laktalbumin; Referensi: (aa) Miranda et al. 2004, (cc) Inglingstad et al. 2010,
(ff) Kumar et al. 2013, (gg) Ahmed et al. 2011, (hh) Eriksen et al. 2010, (jj) El-Hatmi et al. 2015.
A
B
13
Gambar 3 menunjukkan bahwa pada profil protein susu kuda dapat terdeteksi adanya fragmen lisozim, namun tidak demikian pada protein susu kambing, susu sapi dan ASI. Menurut Claeys et al. (2014), kandungan lisozim pada susu kambing dan susu sapi sangat kecil dibandingkan susu kuda (0,5-1,33 g/L), yaitu 250x10-6 g/L dan (70-600)x10-6 g/L, namun memiliki kadar pada kisaran yang hampir sama dengan ASI (0,1-0,89 g/L). Penelitian Inglingstad et al. (2010) tidak mengidentifikasi adanya fragmen imunoglobulin, -laktoglobulin dan lisozim pada profil protein ASI. Berdasarkan penelitian Potočnik et al. (2011) dan Claeys et al. (β014), -laktoglobulin tidak dapat terdeteksi pada ASI, namun terdapat sejumlah kandungan imunoglobulin dan lisozim pada ASI.
Gambar 3 Hasil SDS PAGE protein susu kuda, susu kambing, susu sapi, dan ASI Fragmen: (a) Laktoferin, (b) Serum albumin, (c) Imunoglobulin, (d) α-kasein, (e) -kasein, (f) κ-kasein, (g) -laktoglobulin, (h) Lisozim, (i) α-laktalbumin; Keterangan: Hasil SDS PAGE protein susu kuda dan susu kambing merupakan hasil dari penelitian ini (SDS PAGE 15%, 70 Volt), sedangkan hasil SDS PAGE protein susu sapi dan ASI merupakan hasil dari penelitian Inglingstad et al. (2010) (SDS PAGE 15%).
14
Tabel 7 Ukuran (berat molekul) fragmen protein susu kuda, susu kambing, susu sapi, dan ASI
a) Uniacke-Lowe et al. (2010); b) Guo et al. (2007); c) Miranda et al. (2004); d) Egito et al. (2002); e) Yuniati dan Sahara (2012); f) Shauket et al. (1998); g) da Costa et al. (2014); h) Salem et al. (2009); i) Basch et al. (1985)
Profil Protein Kasein
Kasein memiliki peranan dalam kesehatan diantaranya sebagai sumber asam amino, kalsium, fosfat dan peptida bioaktif (antioksidan, imunomodulator, antimikroba) (Phelan et al. 2009, Uniacke-Lowe et al. 2010). Menurut Salem et al. (2009), asam amino yang dominan pada kasein susu kambing yaitu glutamat (20,3 g/100 g protein), leusin (13,6 g/100 g protein), dan prolin 9,3 g/100 g protein). α-kasein dan -kasein memiliki peranan sebagai antioksidan dan imunomodulator, sedangkan κ-kasein berperan sebagai antimikroba (menghambat infeksi bakteri) dan dalam penggumpalan susu (Phelan et al. 2009, Uniacke-Lowe et al. 2010).
Hasil SDS PAGE kasein susu kuda pada penelitian ini menunjukkan terdapatnya pemisahan fragmen kasein yang mencirikan α-kasein, -kasein, dan
κ-kasein (Gambar 1.B), dengan jumlah pita protein berkisar antara 7 sampai 10 pita protein (Tabel 8). Profil protein kasein susu kuda yang dihasilkan pada penelitian sebelumnya dengan berbagai kondisi SDS PAGE dilakukan oleh Ochirkhuyag et al. (2000) (15%), Egito et al. (2002) (15,4%) dan Uniacke-Lowe (2011) (12%, 200 Volt). Pada penelitian sebelumnya (Egito et al. 2002; Ochirkhuyag et al. 2000), hasil SDS PAGE kasein susu kuda tidak memperlihatkan adanya fragmen κ-kasein, sedangkan pada penelitian ini (kondisi SDS PAGE 15%, 70 Volt) fragmen κ-kasein terlihat dengan jelas. Visualisasi profil protein kasein susu kuda (Gambar 1.B) memperlihatkan pemisahan fragmen kasein yang lebih jelas dibandingkan pada profil protein susu kuda (Gambar 1.A).
Hasil SDS PAGE protein kasein susu kambing juga menunjukkan terdapatnya pemisahan fragmen kasein yang mencirikan α-kasein, -kasein, dan
κ-kasein (Gambar 2.B), dengan jumlah pita protein berkisar antara 7 sampai 10 pita protein (Tabel 8). Penelitian sebelumnya telah dilakukan oleh Ahmed et al. (2011) dengan kondisi SDS PAGE 15%, 20 mA. Dibandingkan dengan penelitian ini, visualisasi profil protein kasein susu kambing pada penelitian Ahmed et al. (2011) memperlihatkan lebih banyak pita protein selain fragmen utama kasein.
No Fragmen protein Berat molekul (kDa)
15
15
Tabel 8 Profil protein kasein susu kuda dan kasein susu kambing
Profil protein kasein 12% 15% 18%
70 Volt 200 Volt 70-200 Volt 70 Volt 200 Volt 70-200 Volt 70 Volt 200 Volt 70-200 Volt Susu kuda
Pita protein* 10 pita 10 pita 9 pita 10 pita 10 pita 9 pita 7 pita 10 pita 8 pita
Fragmen protein
α-kasein √ √ √ √ √ √ √ √ √
-kasein √ √ √ √ √ √ √ √ √
κ-kasein √ √ √ √ √ √ √ √ √
Susu kambing
Pita protein* 8 pita 7 pita 7 pita 7 pita 8 pita 7 pita 10 pita 10 pita 10 pita
Fragmen protein
α-kasein √ √ √ √ √ √ √ √ √
-kasein √ √ √ √ √ √ √ √ √
κ-kasein √ √ √ √ √ √ √ √ √
16
Penggunaan voltase 70 Volt dan 70-200 Volt dengan konsentrasi gel pemisah 15% pada analisis SDS PAGE protein kasein susu kuda dan protein kasein susu kambing dapat menghasilkan visualisasi profil protein yang hampir serupa, hal ini dapat dimungkinkan karena fragmen kasein telah terpisah pada bagian tengah gel. Migrasi protein yang terjadi pada 2 jam pertama (voltase awal 70 Volt) telah mencapai 3/4 bagian dari keseluruhan gel, sehingga ketika perpindahan voltase menjadi 200 Volt, pemisahan fragmen kasein telah selesai terlebih dahulu.
Analisis Gel Analyzer profil protein kasein susu kuda (Lampiran 1.1.B dan Lampiran 2.1.B) memperlihatkan bahwa fragmen protein α-kasein (63,2% kasein) memiliki nilai intensitas dan persentase lebih tinggi dibandingkan -kasein (21% kasein) dan κ-kasein (15,8% kasein). Hal ini menunjukkan bahwa fragmen α -kasein lebih dominan dibandingkan --kasein dan κ-kasein. Menurut Potočnik et al. (2011), kadar α-kasein (46,65%) pada protein kasein susu kuda lebih tinggi sebesar 2,3-24,6 g/L untuk α-kasein, 0-29,6 g/L untuk -kasein, dan 2,8-13,4 g/L untuk κ-kasein.
Profil Protein Whey
Protein whey merupakan sumber asam amino (glutamat, leusin, lisin), protein dan peptida bioaktif (antimikroba) (Uniacke-Lowe et al. 2010, Claeys et al. 2014). Protein whey mengandung laktoferin, serum albumin, imunoglobulin, -laktoglobulin, α-laktalbumin, dan lisozim. Laktoferin merupakan glikoprotein yang dapat mengikat zat besi, dan berperan dalam penghambatan pertumbuhan bakteri dan infeksi virus, menstimulasi pertumbuhan mikroflora menguntungkan pada saluran pencernaan, dan sebagai faktor pertumbuhan tubuh. Imunoglobulin berperan sebagai pertahanan alami tubuh terhadap infeksi. -laktoglobulin dapat berfungsi sebagai fasilitator dalam penyerapan vitamin, penghambat, pemodifikasi dan promoter aktivitas enzim, serta pengikat retinol dan asam lemak di dalam tubuh. α-laktalbumin merupakan protein yang dapat mengikat kalsium, dan berperan dalam sintesa laktosa. Lisozim berperan dalam melawan infeksi pada tubuh, serta mengikat kalsium yang dapat meningkatkan stabilitas dan aktivitas enzim (Uniacke-Lowe et al. 2010).
Profil protein whey susu kuda menunjukkan pemisahan fragmen whey yang mencirikan laktoferin, serum albumin, imunoglobulin, -laktoglobulin, lisozim,
17
17
Tabel 9 Profil protein whey susu kuda dan whey susu kambing
Profil protein whey 12% 15% 18%
70 Volt 200 Volt 70-200 Volt 70 Volt 200 Volt 70-200 Volt 70 Volt 200 Volt 70-200 Volt Susu kuda
Pita protein* 9 pita 9 pita 10 pita 10 pita 10 pita 10 pita 6 pita 8 pita 6 pita
Fragmen protein
Laktoferin √ √ √ √ √ √ √ √ √
Serum albumin √ √ √ √ √ √ √ √ √
Imunoglobulin √ √ √ √ √ √ √ √ √
-laktoglobulin √ √ √ √ √ √ √ √ √
Lisozim √ ** √ √ √ √ √ √ √
α-laktalbumin ** ** √ √ √ √ √ √ √
Susu kambing
Pita protein* 6 pita 6 pita 8 pita 6 pita 6 pita 8 pita 6 pita 6 pita 7 pita
Fragmen protein
Laktoferin √ √ √ √ √ √ √ √ √
Serum albumin √ √ √ √ √ √ √ √ √
Imunoglobulin √ √ √ √ √ √ √ √ √
-laktoglobulin √ √ √ √ √ √ √ √ √
Lisozim - - - -
α-laktalbumin ** ** √ √ √ √ √ √ √
18
Hasil SDS PAGE 12%, 70 Volt (Gambar 1.C.I.1) tidak memperlihatkan
adanya fragmen α-laktalbumin, sedangkan hasil SDS PAGE 12%, 200 Volt
(Gambar 1.C.I.β) tidak memperlihatkan adanya fragmen lisozim dan α -laktalbumin. Dibandingkan dengan penelitian sebelumnya oleh Ochirkhuyag et al. (2000) yang menggunakan konsentrasi gel pemisah 15%, visualisasi profil protein whey susu kuda pada penelitian ini memperlihatkan fragmen laktoferin, serum albumin dan imunoglobulin yang lebih jelas. Selain itu, penelitian ini (kondisi SDS PAGE 15%, 70 Volt) juga menunjukkan pemisahan fragmen lisozim dan α -laktalbumin yang lebih baik.
Profil protein whey susu kambing menunjukkan pemisahan fragmen whey yang mencirikan laktoferin, serum albumin, imunoglobulin, -laktoglobulin, dan
α-laktalbumin (Gambar 2.C), dengan jumlah pita protein berkisar antara 6 sampai 8 pita protein (Tabel 9). Fragmen-fragmen protein tersebut dapat terlihat pada hasil SDS PAGE protein whey susu kambing penelitian ini, kecuali dengan penggunaan konsentrasi gel pemisah 12% pada voltase 70 Volt dan 200 Volt (Gambar 2.C.I.1 dan Gambar 2.C.I.2), tidak terlihat adanya fragmen α -laktalbumin. Penelitian sebelumnya dengan kondisi SDS PAGE yang berbeda dilakukan oleh Eriksen et al. (2010) (15%, 200 Volt) dan El-Hatmi et al. (2015) (15%). Dibandingkan dengan penelitian El-Hatmi et al. (2015), posisi pita protein dengan kondisi SDS PAGE 15%, 70 Volt pada penelitian ini menyebar lebih proporsional pada gel.
Pada profil protein whey susu kambing, baik profil protein whey hasil penelitian ini maupun penelitian sebelumnya (Eriksen et al. 2010, El-Hatmi et al. 2015), tidak terlihat adanya fragmen lisozim sebagaimana terdapat pada profil protein whey susu kuda. Seperti yang telah dijelaskan sebelumnya, hal ini dapat dimungkinkan karena kadar lisozim pada susu kambing yang sangat kecil dibandingkan pada susu kuda (Claeys et al. 2014).
Analisis Gel Analyzer profil protein whey susu kuda (Lampiran 1.1.C dan Lampiran 2.1.C) memperlihatkan bahwa fragmen protein yang dominan adalah -laktoglobulin (30,8% protein whey), yang memiliki nilai intensitas dan persentase lebih tinggi dibandingkan dengan fragmen protein whey lainnya. Menurut
Potočnik et al. (2011), kadar -laktoglobulin (30,75%) pada protein whey susu kuda lebih tinggi dibandingkan kadar fragmen protein lainnnya yaitu α -laktalbumin (28,55%), imunoglobulin (19,77%), laktoferin (9,89%), lisozim (6,59%), dan serum albumin (4,45%). Pada analisis Gel Analyzer profil protein whey susu kambing (Lampiran 1.2.C dan Lampiran 2.2.C) juga menunjukkan hal yang serupa dengan profil protein whey susu kuda, yaitu fragmen protein yang dominan adalah -laktoglobulin (40,6% protein whey). Berdasarkan Claeys et al. (2014), kisaran kadar -laktoglobulin (1,5-5 g/L) pada susu kambing lebih tinggi dibandingkan kadar α-laktalbumin (0,7-2,3 g/L), imunoglobulin (0,1-0,4 g/L), laktoferin (0,02-0,2 g/L), dan lisozim (250x10-6 g/L).
19
tambahan pita protein tipis yang tidak terdapat pada profil protein susu. Hal ini dapat dimungkinkan karena proses pemisahan kasein dan whey menggunakan asam kuat HCl yang dapat menyebabkan terhidrolisisnya protein (Walker 2002). Dengan demikian, protein lain atau peptida hasil hidrolisis asam masih terdapat dan terlihat pada profil protein.
Tabel 10 menyajikan informasi terkait konsentrasi gel pemisah, voltase, lama protein bermigrasi, dan profil protein pada penelitian ini. Kondisi SDS penelitian sebelumnya dengan profil protein penelitian ini menggunakan kondisi SDS PAGE yang sama (dalam hal ini, konsentrasi gel pemisah dan voltase) dapat menghasilkan posisi pita protein yang tidak persis sama (Gambar 1.A dan Gambar 1.B pada kondisi SDS PAGE 12%, 200 Volt, serta Gambar 2.C pada kondisi SDS PAGE 15%, 200 Volt). Menurut Kavoosi dan Ardestani (2012), variasi terhadap profil protein yang dihasilkan dapat dimungkinkan karena terdapatnya keragaman pada sampel protein yang dianalisis (dalam hal ini, komponen dan komposisi protein susu) serta variasi dalam melakukan preparasi sampel.
Pengaruh Konsentrasi Gel Pemisah
20
Pada profil protein susu dan profil protein whey dengan konsentrasi gel pemisah 12%, terdapat fragmen whey yang tidak terlihat (lisozim dan/atau α -laktalbumin) (Gambar 1.A.I.1, Gambar 1.A.I.2, Gambar 1.C.I.1, Gambar 1.C.I.2, Gambar 2.A.I, Gambar 2.C.I.1, Gambar 2.C.I.2). Hal ini disebabkan oleh ukuran pori yang lebih besar pada konsentrasi gel pemisah 12% menyebabkan molekul protein lebih mudah melewati gel, sehingga fragmen tersebut belum sempat terpisah ketika sudah mencapai akhir elektroforesis. Pada konsentrasi gel pemisah 18%, terlihat pemisahan pita protein yang belum sempurna, ditunjukkan dengan fragmen whey (lisozim dan/atau -laktoglobulin dan α-laktalbumin) yang saling menumpuk. Dengan konsentrasi gel pemisah 15%, pemisahan protein menjadi optimum. Menurut Walker (2002), konsentrasi gel pemisah 15% banyak digunakan dalam analisis protein dengan SDS PAGE.
Gel poliakrilamid terbentuk karena adanya ikatan silang kovalen antara monomer akrilamid dengan bis-akrilamid dengan radikal bebas persulfat. Ikatan silang polimer akrilamid membentuk pori dengan beragam ukuran. Menurut Roy et al. (2012), semakin tinggi konsentrasi gel akan menghasilkan ukuran pori yang semakin kecil, sehingga molekul protein terutama yang berukuran besar semakin sulit untuk melewati gel, dan sebaliknya. Secara keseluruhan, konsentrasi gel pemisah 15% memberikan visualisasi profil protein yang terbaik, baik profil protein susu, kasein maupun whey dari susu kuda dan susu kambing.
Pengaruh Tegangan Listrik (Voltase)
Penelitian ini menunjukkan bahwa waktu yang diperlukan protein untuk bermigrasi (lama running SDS PAGE) lebih cepat dengan menggunakan voltase 200 Volt, yaitu 1,5 jam, dibandingkan voltase 70 Volt (4 jam) dan 70-200 Volt (2,5 jam). Gambar 1 dan Gambar 2 menunjukkan bahwa running SDS PAGE dengan voltase sebesar 70 Volt memberikan hasil visualisasi profil protein yang lebih baik dibandingkan dengan 200 Volt dan 70-200 Volt, baik protein susu, kasein, dan whey dari susu kuda maupun susu kambing. Pada voltase 200 Volt, pemisahan protein lebih cenderung terjadi pada bagian bawah gel, sehingga menyebabkan terdapatnya protein yang belum terpisah secara sempurna (saling menumpuk) atau bahkan tidak terpisah, seperti fragmen lisozim dan/atau α -laktalbumin (Gambar 1.A.I.2, Gambar 1.C.I.2, Gambar 2.A.1.2, Gambar 2.C.1.2).
21
5
SIMPULAN DAN SARAN
Simpulan
Penelitian ini menyajikan informasi yang menyeluruh mengenai profil protein susu, kasein dan whey dari susu kuda dan susu kambing. Analisis SDS PAGE menggunakan konsentrasi gel pemisah 15% memberikan hasil visualisasi profil protein yang lebih baik dibandingkan dengan konsentrasi gel pemisah 12% dan 18%. Demikian juga halnya, penggunaan voltase 70 Volt lebih baik dibandingkan voltase 200 Volt dan 70-200 Volt. Jumlah pita protein pada profil protein bervariasi berdasarkan konsentrasi gel pemisah dan voltase running SDS PAGE, yaitu berkisar antara 6 sampai 12 pita protein. Fragmen yang dominan
pada profil protein kasein susu kuda adalah α-kasein, sedangkan pada profil protein kasein susu kambing adalah κ-kasein. Fragmen yang dominan pada profil protein whey susu kuda dan susu kambing adalah -laktoglobulin.
Pada penggunaan konsentrasi gel pemisah 15% dan voltase 70 Volt, profil protein yang dihasilkan memperlihatkan pemisahan fragmen laktoferin, serum albumin, imunoglobulin, α-kasein, -kasein, κ-kasein, -laktoglobulin, lisozim dan α-laktalbumin dengan jelas. Kondisi SDS PAGE yang optimum (15%, 70 Volt) dapat dimanfaatkan untuk memperoleh informasi yang komprehensif terkait fragmen protein pada susu kuda dan susu kambing yang dapat digunakan sebagai ingredien dalam pengembangan pangan fungsional dan kebutuhan medis, serta untuk pengawasan mutu protein susu selama proses produksi, transportasi dan pengolahan.
Saran
Penelitian lebih lanjut perlu dilakukan terkait uji bioaktifitas (seperti antimikroba, stimulasi imunitas, antihipertensi) dari fragmen protein susu kuda dan susu kambing, khususnya fragmen protein yang dominan. Pengaplikasian SDS PAGE pada kondisi konsentrasi gel pemisah 15% dan voltase 70 Volt dapat dilakukan untuk analisis profil protein susu kuda dan susu kambing dari daerah lain, serta susu dari mamalia lain yang potensial untuk dikembangkan menjadi ingredien pangan fungsional dan kebutuhan medis, seperti domba, kerbau, dan rusa.
22
DAFTAR PUSTAKA
Ahmed ABF, Babiker EE, Mori N, Ahmed IAM. 2011. Hydrolysis of ovine and caprine caseins by enzymatic extract from Solanum dubium seeds. Aust J Basic Appl Sci. 5(3):331-336.
Almaas H, Berner V, Holm H, Langsrud T, Vegarud GE. 2008. Degradation of whey from caprine milk by human proteolytic enzymes, and the resulting antibacterial effect against Listeria monocytogenes. Small Rum Res. 79:11-15. doi:10.1016/j.smallrumres.2008.07.013.
Basch JJ, Douglas FWJ, Procino LG, Holsinger VH, Farrell HMJ. 1985. Quantitation of caseins and whey proteins of processed milks and whey protein concentrates, application of gel electrophoresis, and comparison with Harland-Ashworth procedure. J Dairy Sci. 68(1):23-31. doi:10.3168/jds.S0022-0302(85)80792-X.
Bollag DM, Edelstein SJ. 1991. Protein Methods. New York (AS): Willey-Liss. Claeys WL, Verraes C, Cardoen S, Block JD, Huyghebaert A, Raes K,
Dewettinck K, Herman L. 2014. Consumption of raw or heated milk from different species: an evaluation of the nutritional and potential health benefits. Food Cont. 42:188-201. doi:10.1016/j.foodcont.2014.01.045. Da Costa WKA, de Souza EL, Beltrão-Filho EM, Vasconcelos GKV,
Santi-Gadelha T, Santi-Gadelha CAA, Franco OL, Queiroga RCR, Magnani M. 2014. Comparative protein composition analysis of goat milk produced by the Alpine and Saanen breeds in Northeastern Brazil and related antibacterial activities. Plos One 9(3):1-8.doi:10.1371/journal.pone.0093361.
Detha A, Sudarwanto M, Latif H, Datta FU, Rahayu P. 2013. Fractionation and identification antimicrobial activity of Sumba mare milk protein against causative agent of subclinical mastitis. Glob Vet. 11(5):674-680. doi: 10.5829/idosi.gv.2013.11.5.76210.
Egito AS, Miclo L, Lόpez C, Adam A, Girardet JM, Gaillard JL. β00β. Separation and characterization of mares’ milk αS1-, -, κ-caseins, -casein-like, and protease pepton component 5-like peptides. J Dairy Sci. 85(4): 697-706. El-Hatmi H, Jrad Z, Salhi I, Aguibi A, Nadri A, Khorchani T. 2015. Comparison
of composition and whey protein fractions of human, camel, donkey, goat
and cow milk. Mljekarstvo. 65(3):159-167.
doi:10.15567/mljekarstvo.2015.0302.
Eriksen EK, Holm H, Jensen E, Aaboe R, Devold TG, Jacobsen M, Vegarud GE. 2010. Different digestion of caprine whey proteins by human and porcine gastrointestinal enzymes. Br J Nutr. 104:374-381. doi:10.1017/S0007114510000577.
23
Inglingstad RA, Devold TG, Eriksen EK, Holm H, Jacobsen M, Liland KH, Rukke EO, Vegarud GE. 2010. Comparison of the digestion of caseins and whey proteins in equine, bovine, caprine and human milks by human gastrointestinal enzymes. Dairy Sci Technol. 90:549-563. doi:10.1051/dst/2010018.
Kavoosi G, Ardestani SK. 2012. Gel Electrophoresis – Principles and Basics. Magdeldin S, editor. Rijeka (Kroasia): InTech.
Kumar A, Rout PK, Mohanty BP. 2013. Identification of milk protein polymorphism in Indian goats by 2D gel electrophoresis. J Proteomics Bioinform. 6(1):1-4. doi:10.4172/jpb.1000252.
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227:680-685.
Maheswari RRA, Setiawan J, Mulyanto S, Batubara I, Sumantri C, Farajallah A. 2007. Identifikasi laktoferin pada susu kambing kacang dengan metode imunodifusi radial tunggal dan natrium dodesil sulfat poliakrilamida elektroforesis gel. J Ilmu Pert Indones. 12(3): 163-172.
Malacarne M, Martuzzi F, Summer A, Mariani P. 2002. Protein and fat
composition of mare’s milk: some nutritional remarks with reference to human and cow’s milk. Int Dairy J. 12:869–877.
Miranda G, Mahé M, Leroux C, Martin P. 2004. Proteomic tools to characterize the protein fraction of Equidae milk. Proteomics 4:2496-2509. doi:10.1002/pmic.200300765.
Naert L, Vande-Vyvere B, Verhoeven G, Duchateau L, De-Smet S, Coopman F.
β01γ. Assessing heterogeneity of the composition of mare’s milk in
Flanders. Vlaams Diergeneeskundig Tijdschrift 82:23-30.
Nurliyani. 2003. Komposisi kimia dan profil protein susu kuda pada SDS PAGE (sodium dodecyl sulfate polyacrylamide gel electrophoresis). Bul Peternak. 27(2):86-93.
Nurliyani, Artama WT, Noor Z. 2005. Respon antibodi dan aktivitas fagositosis makrofag peritoneal mencit yang diberi protein susu kuda pasteurisasi dan fermentasi. Med Kedokter Hewan 21(2):51-57.
Ochirkhuyag B, Chobert J, Dalgalarrondo M, Haertlé T. 2000. Characterization of mare caseins: identification of aS1- and aS2- caseins. Lait 80:223-235.
Phelan M, Aherne A, FitzGerald RJ, O’Brien NM. β009. Casein-derived bioactive peptides: Biological effects, industrial uses, safety aspects and regulatory status. Int Dairy J. 19:643-654. doi:10.1016/j.idairyj.2009.06.001.
Potočnik K, Gantner V, Kuterovac K, Cividini A. β011. Mare’s milk: composition and protein fraction in comparison with different milk species. Mljekarstvo 61(2):107-113.
24
Saini D, Sarin R. 2012. SDS-PAGE analysis of leaf galls of Alstonia scholaris (L.) R. Br. J Plant Pathol Microb. 3:1-3. doi:10.4172/2157-7471.1000121. Salem SA, El-Agamy EI, Salama FA, Abo-Soliman NH. 2009. Isolation,
molecular and biochemical characterization of goat milk casein and its fractions. Tropic Subtropic Agroecosyst. 11:29-35.
Shauket M, Ashfaque M, Hussain I, Chaudhry TM. 1998. SDS PAGE with discontinuous buffer system of goat milk whey. Pakistan Vet J. 18(4):173-176.
Shi Q, Jackowski G. 1998. Gel Electrophoresis of Proteins: A Practical Approach. Hames BD, editor. New York (US): Oxford University Press. Ed ke-3.
Tay EP, Gam LH. 2011. Proteomics of human and the domestic bovine and caprine milk. AsPac J Mol Biol Biotechnol. 19(1):45-53.
Uniacke-Lowe T. 2011. Studies on equine milk and comparative studies on equine and bovine milk systems [disertasi]. Cork (IE): University College Cork.
Uniacke-Lowe T, Huppertz T, Fox PF. 2010. Equine milk proteins: chemistry, structure and nutritional significance. Int Dairy J. 20:609-629. doi: 10.1016/j.idairyj.2010.02.007.
Walker JM. 2002. The Protein Protocols Handbook. Walker JM, editor. New Jersey (US): Humana Press. Ed ke-2.
Wang J, Su Y, Jia F, Jin H. 2013. Characterization of casein hydrolysates derived from enzymatic hydrolysis. Chem Cent J. 7(62):1-8. doi:10.1186/1752-153X-7-62.
Wibowo AD, Suhartono MT, Siagian PLP. 2012. Fraksionasi dan penentuan profil protein bungkil kelapa dengan SDS PAGE. J Teknol dan Industri Pangan 23(1):69-74.
25
27
27
Lampiran 1 Penentuan pita protein menggunakan program Gel Analyzer versi 2010a
1 Susu Kuda
1. A Protein Susu
70 Volt 200 Volt 70-200 Volt
12%
15%
18%
Keterangan:
Konsentrasi gel pemisah: 12% , 15%, 18%; Voltase: 70 Volt, 200 Volt, 70-200 Volt.
12%
15%
28
28
1. B Kasein
70 Volt 200 Volt 70-200 Volt
12%
15%
Keterangan:
Konsentrasi gel pemisah: 12% , 15%, 18%; Voltase: 70 Volt, 200 Volt, 70-200 Volt.
12%
15%
29
29
1. C Whey
70 Volt 200 Volt 70-200 Volt
12%
Keterangan:
Konsentrasi gel pemisah: 12% , 15%, 18%; Voltase: 70 Volt, 200 Volt, 70-200 Volt.
12%
15%
30
30
2 Susu Kambing
2. A Protein Susu
70 Volt 200 Volt 70-200 Volt
12%
15%
18%
Keterangan:
Konsentrasi gel pemisah: 12% , 15%, 18%; Voltase: 70 Volt, 200 Volt, 70-200 Volt.
12%
15%
31
31
2. B Kasein
70 Volt 200 Volt 70-200 Volt
12%
15%
18%
Keterangan:
Konsentrasi gel pemisah: 12% , 15%, 18%; Voltase: 70 Volt, 200 Volt, 70-200 Volt.
12%
15%
32
32
2. C Whey
70 Volt 200 Volt 70-200 Volt
12%
15%
18%
Keterangan:
Konsentrasi gel pemisah: 12% , 15%, 18%; Voltase: 70 Volt, 200 Volt, 70-200 Volt.
12%
15%
33
Lampiran 2 Penentuan fragmen protein dominan (SDS PAGE 15%, 70 Volt) menggunakan program Gel Analyzer versi 2010a
1 Susu Kuda 1.A Protein Susu
Nomor
pita protein Fragmen protein Raw volume Persentase (%)
1 Laktoferin 2371 13,6
2 Serum albumin 1674 9,6
3 Imunoglobulin 1607 9,2
4 α-kasein 1303 7,5
5 -kasein 747 4,3
6 κ-kasein 1041 6
7 -laktoglobulin 4906 28,2
8 Lisozim 2007 11,5
9 α-laktalbumin 1758 10,1
34
1.B Kasein
Nomor
pita protein Fragmen protein Raw volume Persentase (%)
1 α-kasein 7509 63,2
2 -kasein 2500 21
3 κ-kasein 1880 15,8
Total 11889 100
1.C Whey
Nomor
pita protein Fragmen protein Raw volume Persentase (%)
1 Laktoferin 6131 15,8
2 Serum albumin 4159 10,7
3 Imunoglobulin 4724 12,2
4 -laktoglobulin 11948 30,8
5 Lisozim 6013 15,5
6 α-laktalbumin 5839 15
35
2 Susu Kambing 2.A Protein Susu
Nomor
pita protein Fragmen protein Raw volume Persentase (%)
1 Laktoferin 1131 5,1
2 Serum albumin 1496 6,8
3 Imunoglobulin 1475 6,7
4 α-kasein 3546 16,2
5 -kasein 4698 21,4
6 κ-kasein 7342 33,5
7 -laktoglobulin 1840 8,4
8 α-laktalbumin 410 1,9
Total 21938 100
2.B Kasein
Nomor
pita protein Fragmen protein Raw volume Persentase (%)
1 α-kasein 1441 18,9
2 -kasein 2192 28,8
3 κ-kasein 3980 52,3
36
2.C Whey
Nomor
pita protein Fragmen protein Raw volume Persentase (%)
1 Laktoferin 3545 16,1
2 Serum albumin 3892 17,6
3 Imunoglobulin 4692 21,3
4 -laktoglobulin 8944 40,6
5 α-laktalbumin 965 4,4
37
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 7 Agustus 1980 sebagai putri kedua dari tiga bersaudara dari Bapak Soeparno Djaya dan Ibu Lisaparsih. Pada tahun 1999, penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui Undangan Seleksi Masuk IPB (USMI) untuk menempuh pendidikan sarjana di Departemen Gizi Masyarakat dan Sumberdaya Keluarga, Fakultas Pertanian, IPB. Penulis lulus sarjana pada tahun 2004 dengan predikat Cum Laude, dan pada tahun yang sama penulis diterima bekerja sebagai Pegawai Honorer di Direktorat Standardisasi Produk Pangan, Badan Pengawas Obat dan Makanan (Badan POM). Pada tahun 2005, penulis lulus tes Calon Pegawai Negeri Sipil dan bekerja di Badan POM sampai dengan sekarang. Kesempatan untuk melanjutkan studi ke jenjang Magister pada Program Studi Ilmu Pangan Sekolah Pascasarjana IPB diperoleh pada tahun 2012 dengan beasiswa dari Badan POM.