PROFIL PROTEIN SEROPOSITIF DAN SERONEGATIF BOVINE VIRAL DIARRHEA VIRUS (BVDV) PADA
SAPI-SAPI IMPOR
ANA ROUDLOTUL JANNAH
PROGRAM STUDI BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2019 M/ 1440 H
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
ANA ROUDLOTUL JANNAH 1113095000030
PROGRAM STUDI BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2019 M/ 1440 H
i
ANA ROUDLOTUL JANNAH. Profil Protein Seropositif dan Seronegatif Bovine Viral Diarrhea Virus (BVDV) Pada Sapi-Sapi Impor. Skripsi. Program Studi Biologi, Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah Jakarta. Dibimbing oleh Dr. Muharam Saepulloh, S.Si., M.Sc.
dan drh. RR. Bhintarti Suryohastari, M. Biomed. 2018.
Seiring impor sapi yang dilakukan pemerintah untuk memenuhi kebutuhan pangan masyarakat, mengakibatkan salah satu penyakit menular yaitu Bovine Viral Diarrhea Virus (BVDV) dapat masuk ke Indonesia. Bovine Viral Diarrhea (BVD) diprioritaskan pemberantasannya karena dapat menyebabkan kematian pada sapi dan menimbulkan kerugian ekonomi. Penelitian ini bertujuan untuk mengetahui profil protein berdasarkan berat molekul (BM) pada hasil ELISA antibodi terhadap BVDV. Sapi yang diperiksa menggunkan ELISA adalah sapi Peranakan Ongole, Limosin, Simental, Angus, Brangus, Brahman, Wagyu, dan Frisien Holstein di Balai Embrio Ternak (BET), Bogor, Indonesia. Penelitian ini dilakukan dengan analisis SDS-PAGE terhadap seropositif dan seronegatif BVDV pada serum sapi. Sebanyak 43 serum sapi yang diujikan, 21 sampel seropositif BVDV (49%) dan 22 sampel seronegatif BVDV (51%). Hasil SDS-PAGE menunjukkan pita protein dengan BM 151, 397 kDa yang diduga IgG seropositif BVDV pada sapi Friesian Holstein dan pita dengan BM 55, 350 kDa yang diduga antigen seropositif BVDV pada sapi Frisien Holstein dan Wagyu. Sementara itu, pita protein IgG dan antigen virus BVDV tidak terdapat pada seluruh sapi yang memiliki seronegatif antibodi BVDV. Pada seropositif BVDV ditemukan pita protein Ig dan pita protein yang diduga sebagai antigen BVDV, sedangkan pada seronegatif BVDV tidak terdapat pita protein Ig dan antigen BVDV. Hasil penelitian diharapkan dapat sebagai data yang membantu tindakan pencegahan dan pemberantasan BVDV di Indonesia.
Kata kunci: BVDV, Immunoglobulin, Profil protein, SDS-PAGE, ELISA
ii ABSTRACT
ANA ROUDLOTUL JANNAH. Porifl Protein of Bovine Viral Diarrhea Virus (BVDV) Seropositive and Seronegative on an Imported Cattles. Essay.
Biology Studies Program, Faculty of Science and Technology, Syarif Hidayatullah State Islamic University Jakarta. Under Guidance of Dr.
Muharam Saepulloh, S.Si., M.Sc. and drh. RR. Bhintarti Suryohastari, M.
Biomed. 2018.
Along with the import of cattle by the government to meet the food needs of the people, one of the infectious diseases, BVDV (Bovine Viral Diarrhea Virus), can enter Indonesia. Bovine Viral Diarrhea got eradication prioritizes because it can cause death in cattle and cause economic losses. This study aims to determine the protein profile based on molecular weight (BM) on the ELISA antibody results on BVDV. The Cattles that examined using ELISA were Ongole, Limosin, Simental, Angus, Brangus, Brahman, Wagyu, Frisien Holstein at the Livestock Embryo Center (LEC), Bogor, Indonesia. This study was carried out by detecting the profile of the ELISA seropositive and seronegative immunoglobulin protein results using SDS-PAGE. Serum is taken from Holstein Friesian, Ongole, Limousine, Simental, Angus, Brangus, Brahman, and Wagyu cattle breeds. The ELISA results showed that from 43 bovine serums tested, 21 samples were BVDV seropositive (49%) and 22 samples were seronegative BVDV (51%). The SDS- PAGE results showed that protein bands with BM 151, 397 kDa suspected as BVDV seropositive IgG from Holstein Friesian cattle and protein bands with BM 55, 350 kDa suspected as BVDV seropositive antigens from Frisien Holstein and Wagyu cattle. Mean while, All antibody seronegative BVDV cattle did not show IgG protein bands and BVDV antigens. The results of the study are expected to be used as data for the prevention and eradication of BVDV in Indonesia.
Keywords: BVDV, Immunoglobulin, Protein profile, SDS-PAGE, ELISA
iii
semesta alam, atas nikmat ilmu pengetahuan yang diberikan sehingga penulis dapat menyelesaikan skripi. Penelitian ini merupakan salah satu syarat dalam memperoleh gelar Sarjana Sains pada Program Studi Biologi Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Skripsi ini berjudul Profil Protein Seropositif dan Seronegatif Bovine Viral Diarrhea Virus (BVDV) Pada Sapi-Sapi Impor. Penelitian ini dilaksanakan di Balai Besar Penelitian Veteriner, Bogor. Penulis mengucapkan terima kasih kepada semua pihak yang telah banyak membantu dan memberikan dukungan baik dalam bentuk moril maupun materil, yaitu kepada:
1. Kedua orang tua, kaka dan adik, terima kasih atas doa dan dukungan yang tak henti-hentinya.
2. Dr. Agus Salim, M.Si, selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
3. Dr. Dasumiati M.Si., selaku Ketua Program Studi Biologi Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta, serta selaku penguji I pada sidang munaqosah penelitian yang telah memberikan masukannya kepada penulis.
4. Dr. Muharam Saepulloh, S.Si., M.Sc. selaku pembimbing I atas kesediaan dalam membimbing dan memberikan ilmu, arahan, saran, dan nasihat yang bermanfaat kepada penulis.
5. drh. R.R. Bhintarti Suryohastari M. Biomed., selaku pembimbing II atas kesediaan dalam membimbing dan memberikan pengarahan, sehingga penulis dapat menyelesaikan skripsi ini
iv
6. Dr. Megga Ratnasari Pikoli dan Dr. Nani Radiastuti selaku dosen penguji I dan penguji II pada seminar proposal dan seminar hasil penelitian yang telah memberikan masukan kepada penulis
7. Etyn Yunita, M.Si, selaku penguji I dan penguji II pada sidang munaqosah penelitian yang telah memberikan masukannya kepada penulis.
8. Seluruh dosen yang telah mendidik penulis selama menuntut ilmu di Program Studi Biologi, FST UIN Syarif Hidayatullah Jakarta.
9. Pak Puji, selaku pembimbing di laboratorium BBLITVET yang selalu sabar mendampingi saya dan atas ilmu yang diberikan, serta para bapak yang membantu dalam pengambilan sampel serum.
10. Festy Auliyaur Rahmah, S. Si, serta laboran lainnya yang membantu penelitian di laboratorium UIN Jakarta.
11. Rekan mahasiswa Jurusan Biologi 2013 yang bersama-sama dengan penulis menghadapi suka duka selama menempuh pendidikan. Teman SMA yang selalu memberikan membantu dan memberikan motivasi kepada penulis
12. Semua pihak yang telah membantu penulis dalam menyelesaikan penelitian.
Penulis menyadari penyusunan skripsi ini masih jauh dari sempurna.
Penulis berharap semoga skripsi ini dapat bermanfaat bagi pembaca.
Jakarta, 24 Januari 2019
Penulis
v
Halaman
PERNYATAAN ... 3
ABSTRAK ... i
ABSTRACT ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR GAMBAR ... vii
DAFTAR TABEL ... viii
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 1
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
1.6 Kerangka Berpikir ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Protein ... 5
2.1.1 Penggolongan protein... 6
2.2 Serum ... 7
2.3 Imunoglobulin ... 8
2.3.1 Imunoglobulin alpha (IgA) ... 10
2.3.2 Imunoglobulin Delta (IgD) ... 11
2.3.3 Imunoglobulin epsilon (IgE) ... 11
2.3.4 Imunoglobulin Gamma (IgG) ... 12
2.3.5 Imunoglobulin M (IgM) ... 12
2.4 Bovine Viral Diarrhea Virus (BVDV) ... 13
2.4.1 Biotipe BVDV ... 14
2.4.2 Patogenesis BVD ... 17
2.4.3 BVD di Indonesia ... 19
2.5 Enzyme-Linked Immunsorbent Assay (ELISA) ... 20
2.5.1 ELISA secara langsung ... 20
vi
2.5.2 ELISA secara tidak langsung ... 21
2.5.3 Uji ELISA terhadap BVDV ... 23
2.6 SODIUM DODECYL SULPHATES-POLY ACRYLAMID GEL ELECTROPHORESIS (SDS-PAGE) ... 24
2.7 Sapi ... 26
BAB III METODE PENELITIAN ... 29
3.1 Waktu dan Tempat ... 29
3.2 Alat dan Bahan ... 29
3.3 Metode Penelitian... 30
3.3.1 Pengumpulan sampel ... 30
3.3.2 Preparasi Sampel ... 31
3.3.3 Prosedur ELISA Secara Tidak Langsung ... 31
3.3.4 Prosedur SDS-PAGE ... 32
3.4 Analisis Hasil ... 33
BAB IV HASIL DAN PEMBAHASAN ... 35
4.1 Deteksi Imunoglobulin Menggunakan ELISA... 35
4.2 Profil Protein SDS-PAGE ... 37
BAB V PENUTUP ... 47
5.1 Kesimpulan ... 47
5.2 Saran ... 47
DAFTAR PUSTAKA ... 48
LAMPIRAN ... 53
vii
Halaman
Gambar 1. Kerangka Berpikir ... 4
Gambar 2. Reaksi dehidrasi dalam sintesis polimer ... 6
Gambar 3. Struktur umum molekul imunoglobulin ... 10
Gambar 4. Struktur 5 macam imunoglobulin: IgG, IgA, IgD, IgE, IgM ... 10
Gambar 5. Struktur BVDV ... 14
Gambar 6. Metode penentuan kadar antigen atau antibodi dengan cara ELISA ... 22
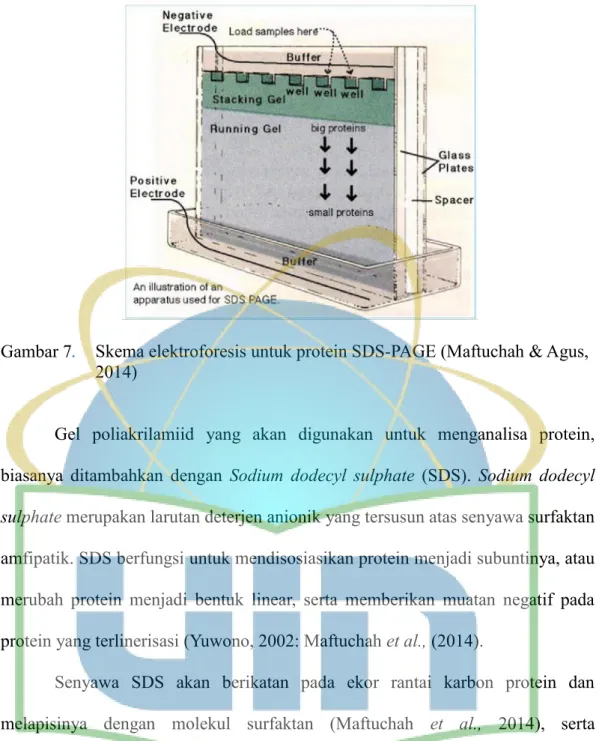
Gambar 7. Skema elektroforesis untuk protein SDS-PAGE ... 25
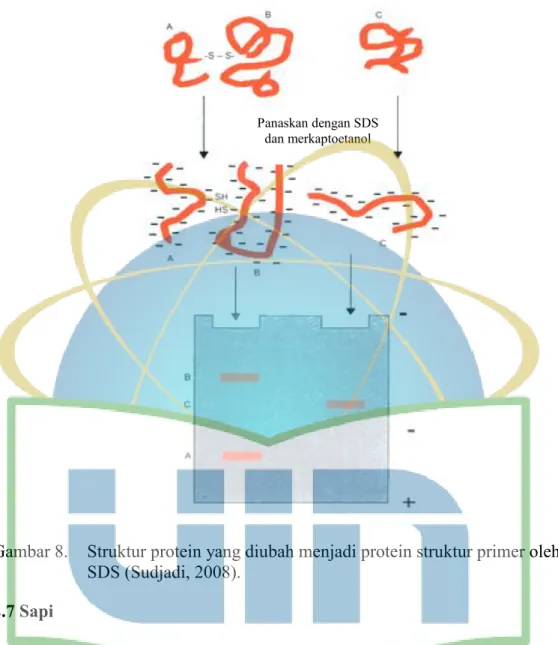
Gambar 8. Struktur protein yang diubah menjadi protein struktur primer oleh SDS . 26 Gambar 9. Nilai Log BM pita marker broad range prestained SDS-PAGE standar ... 38
Gambar 10. Hasil SDS-PAGE seropositif dan seronegatif BVDV ... 40
viii
DAFTAR TABEL
Halaman Tabel 1. Persentase hasil uji ELISA terhadap antibodi BVDV ... 35 Tabel 2. Berat molekul sampel seropositif dan seronegatif BVDV ... 39 Tabel 3. Nilai Optical Density BVDV+ ... 42
ix
Halaman Lampiran 1. Nilai S/P pada serum sapi yang dideteksi menggunakan ELISA ... 53 Lampiran 2. Perhitungan persamaan regresi linear protein marker dengan
menggunkan kurva standar ... 54
1
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia memiliki kewajiban untuk mewujudkan ketersediaan, keterjangkauan, dan pemenuhan konsumsi pangan yang cukup dan aman. Hal tersebut tertera dalam UU Nomor 18 Tahun 2012 tentang pangan (UU RI, 2012).
Usaha pemerintah dalam pelaksanaan undang-undang tersebut yaitu dengan pengadaan impor. Salah satu hewan yang diimpor oleh pemerintah adalah sapi.
Sapi merupakan komoditas kedua setelah unggas yang kuota produksinya lebih rendah dibandingkan dengan permintaan masyarakat (Kementerian Pertanian, 2016).
Impor sapi terbukti meningkatkan populasi sapi di Indonesia dan mampu memenuhi kebutuhuhan masyarakat (Kementerian Pertanian, 2016), hanya saja terdapat risiko masuknya penyakit sapi yang dibawa oleh sapi impor ke Indonesia. Bovine Viral Diarrhea Virus (BVDV) atau diare ganas merupakan salah satu penyakit yang dibawa oleh sapi impor. Dampak yang timbul akibat BVDV yaitu, sapi mengalami diare, demam, lesi pada selaput lendir lidah, penurunan nafsu makan, penurunan berat badan, hingga menyebabkan kematian.
Sebanyak 60 % dari 5325 sapi yang diperiksa pada 21 peternakan di Jerman mengalami kematian akibat BVDV dan 400 ekor sapi yang persisten BVDV dimusnahkan (Gethmann, 2015). Dampak ekonomi akibat penyakit BVD dapat mengakibatkan kerugian moneter di 15 negara yaitu sebesar 0,50 hingga 687,80 dolar Amerika per sapi (Richter et al., 2017). Kerugian ekonomi akibat BVDV menjadi salah satu alasan pentingnya pencegahan dan pemberantasan BVDV.
Upaya pencegahan dan pemberantasan BVDV penting untuk dilakukan, agar sapi yang terkena BVDV tidak melahirkan anakan yang persisten. Infeksi pesristen pada sapi sangat berbahaya, karena sapi persisten dapat menjadi sumber penyebar virus sepanjang hidupnya (Prastyowati, 2015). Sapi yang terinfeksi BVDV akan membentuk respon imun. Respon imun tubuh sapi akibat terinfeksi BVDV yaitu terbentuknya imuniglobulin (Ig). Infeksi BVDV pada sapi dapat diketahui dengan mendeteksi Ig pada serum. Deteksi Ig pada sapi impor yang tidak memiliki data bebas vaksin telah dilakukan oleh Primawidyawan (2015).
Hasil penelitian tersebut memberikan informasi bahwa 63% sapi positif Ig terhadap BVDV, namun belum diketahui karakter profil protein Ig terhadap BVDV dan antigen BVDV pada sapi tersebut.
Mengetahui profi protein berdasar berat molekul (BM) pada Ig seropositif dan seronegatif terhadap BVDV, serta mengetahui profil protein antigen BVDV pada seropositif sangat dibutuhkan. Profil protein imunoglobulin yang terbentuk dapat memberikan informasi tentang karakter Ig terhadap BVDV pada sapi yang tidak divaksin, serta informasi tentang virus BVD yang menginfeksi, karena perbedaan strain virus mengakibatkan perbedaan imunoglobulin yang terbentuk (Reddy et al., 1995). Profil protein antigen yang ditemukan dapat digunakan sebagai pengetahuan dan dapat dikembangkan untuk pembuatan vaksin sub-unit, karena dalam pencegahan virus harus terdapat kespesifikan antara vaksin dan virus yang mewabah di lokasi hewan dipelihara (Poettri et al., 2014).
Informasi tentang profil protein Ig terhadap BVDV dan antigen BVDV pada serum sapi dapat dijadikan salah satu upaya dalam pencegahan dan pemberantasan BVDV. Oleh karena itu, dilakukan penelitian untuk mengetahui
3
protein Ig terhadap BVDV dan antigen BVDV pada sapi yang belum divaksin agar dapat diketahui profil protein Ig sapi yang terbentuk akibat terinfeksi BVDV secar alami dan profil antigen BVDV yang menginfeksi sapi.
1.2 Rumusan Masalah
1. Bagaimanakah profil protein imunoglobulin pada seropositif dan seronegatif BVDV hasil uji ELISA?
2. Bagaimanakah profil protein antigen BVDV pada sampel seropositif?
1.3 Hipotesis
1. Profil protein pada seropositif dan seronegatif BVDV menunjukkan karakter pita imunoglobulin berdasarkan Berat Molekul (BM)
2. Profil protein antigen BVDV pada seropositif dan seronegatif menunjukkan karakter pita berdasarkan berat molekul (BM).
1.4 Tujuan Penelitian
1. Mengetahui perbedaan profil protein imunoglobulin pada seropositif dan seronegatif BVDV yang diuji ELISA;
2. Mendeteksi keberadaan protein antigen BVDV pada sampel seropositif.
1.5 Manfaat Penelitian
Penelitian ini dilakukan dengan harapan dapat memberikan informasi mengenai perbedaan profil imunoglobulin pada seropositif dan seronegatif BVDV pada sapi di BET, sehingga lebih lanjut dapat digunakan sebagai data pendukung untuk tindakan pencegahan dan pemberantasan BVDV yaitu dengan cara pengembangan vaksin sub-unit.
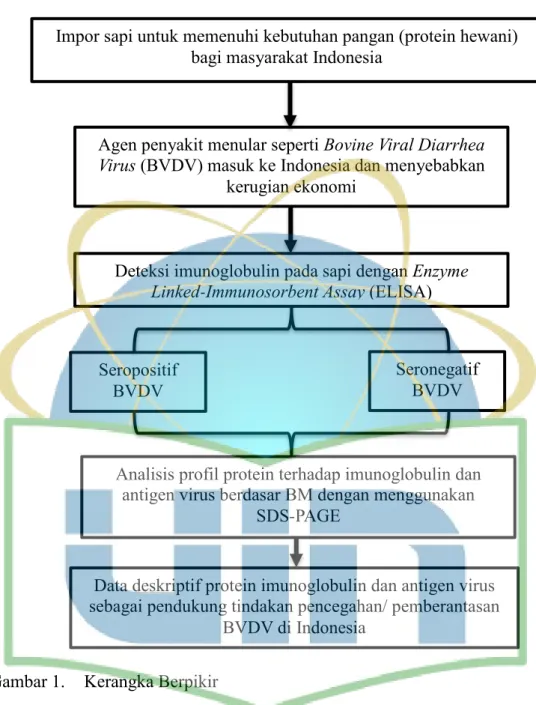
1.6 Kerangka Berpikir
Gambar 1. Kerangka Berpikir
Impor sapi untuk memenuhi kebutuhan pangan (protein hewani) bagi masyarakat Indonesia
Agen penyakit menular seperti Bovine Viral Diarrhea Virus (BVDV) masuk ke Indonesia dan menyebabkan
kerugian ekonomi
Deteksi imunoglobulin pada sapi dengan Enzyme Linked-Immunosorbent Assay (ELISA)
Analisis profil protein terhadap imunoglobulin dan antigen virus berdasar BM dengan menggunakan
SDS-PAGE
Data deskriptif protein imunoglobulin dan antigen virus sebagai pendukung tindakan pencegahan/ pemberantasan
BVDV di Indonesia Seropositif
BVDV
Seronegatif BVDV
5
BAB II
TINJAUAN PUSTAKA
2.1 Protein
Protein berasal dari kata proteois yang berartarti tempat pertama. Protein menyusun lebih dari 50% massa kering sebagian besar sel. Protein merupakan polimer yang tersusun atas asam amino. Asam amino terdiri dari gugus amino, gugus karboksil, atom hidrogen dan rantai samping yang terikat pada atom karbon. Jumlah asam amino yang umum pada jasad hidup yaitu 20 macam, dengan perbedaan masing-masing asam amino pada bagian gugus samping.
Rantai samping asam amino dibedakan atas: (1) polar, bermuatan negatif (aspartat, asam glutamat), (2) polar, bermuatan positif (arginin, histidin, lisin), (3) polar, tidak bermuatan (asparagin, glutamin, serin, treonin), (4) nonpolar/hidrofobik (alanin, sistein, isoleusin, leusin, metionin, fenilalanin, prolin, triptofan, tirosin, valin) (Yuwono, 2002).
Susunan asam amino dalam protein diikat oleh ikatan peptida. Ikatan peptida terbentuk antara gugus karboksil dan gugus amin yang mengalami reaksi sintesis dehidrasi, yaitu dibebaskannya satu molekul air (Maggy et al., 2017).
Protein memiliki empat tingkat struktur yaitu struktur primer, sekunder, tersier, kuartener. Struktur primer merupakan sekuen asam amino. Struktur sekunder merupakan kumparan dan lipatan polipeptida. Struktur tersier adalah pelipatan bagian antara heliks−α dan lembaran−β serta interaksi non kovalen yang menyebabkan pelipatan pada suatu rantai polipeptida. Struktur kuartener merupakan gabungan beberapa rantai polipeptida akibat adanya interaksi
nonkovalen, sehingga membentuk satu molekul tunggal protein (Yuwono, 2002;
Campbell & Jane, 2008).
Gambar 2. Reaksi dehidrasi dalam sintesis polimer (Campbell & Jane, 2008)
2.1.1 Penggolongan protein
Protein berdasar bentuk molekul dibagi menjadi dua golongan: (1) protein globular, (2) protein fibrosa. Protein globular merupakan protein dengan struktur tersier globular yang menunjukkan pola pelipatan rumit (Fried & George, 2005).
Protein globular memiliki bentuk yang bulat atau hampir bulat dengan sedikit sekali atau tidak ada rongga interior untuk molekul air. Protein globular larut dalam air dan larutan garam. Protein globulin yang ada di dalam tubuh yaitu albumin plasma, globulin plasma, beberapa hormoon, entibodi, dan hamper semua enzim (Sumardjo, 2008).
7
Protein fibrosa merupakan material struktural, terdiri atas rantai polimer yang dihubungkan dalam lembaran-lembaran atau memilin dalam bentuk serat memanjang. Rantai polipeptida pada protein fibrosa ditaut-silang oleh ikatan hidrogen, sehingga membentuk struktur seoerti lembaran (Oxtoby et al., 2003).
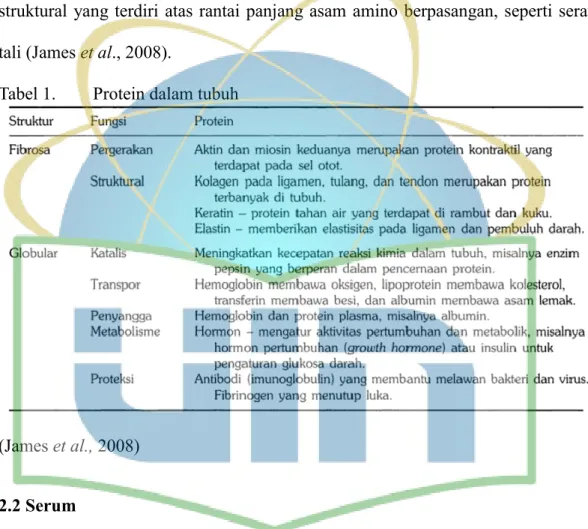
Miosin otot, keratin rambut, fibrio sutera, dan kolagen tulang termasuk ke dalam golongan protein fibrosa (Sumardjo, 2008). Protein fibrosa mempunyai peran struktural yang terdiri atas rantai panjang asam amino berpasangan, seperti serat tali (James et al., 2008).
Tabel 1. Protein dalam tubuh
(James et al., 2008)
2.2 Serum
Serum merupakan plasma darah tanpa faktor penggumpal. Darah merupakan jaringan ikat yang terdiri atas beberapa jenis sel beserta dengan plasma. Sel darah dan plasma darah dapat dipisahkan dari jaringan darah.
Pemisahan kedua komponen darah tersebut dapat dilakukan dengan cara memasukkan jaringan darah ke alat sentrifugasi. Sel darah akan mengendap di
dasar tabung sentrifuge, sedangngkan plasma darah berada di bagian atas tabung sentrifuge. Plasma darah berwarna kuning transparan (Campbell et al., 2004).
Plasma darah terdiri dari 91,0% air, 8,0% protein, dan 0,9% mineral.
Protein dalam plasma tersusun atas albumin, globulin, protrombin, dan fibrinogen.
Mineral dalam plasma terdiri dari natrium klorida, natrium bkarbonat, garam dari kalsium, fosfor, magnesium, dan besi. Bahan bahan organik seperti glukosa, lemak, urea, asam urat, keratinin, kolestrol, dan asam amino merupakan bahan oraganik yang ada di dalam plasma dengan total sebesar 0,01% (Pearce, 2009).
2.3 Imunoglobulin
Imunoglobulin atau merupakan efektor yang tersusun atas 82-96 polipeptida dan 4-8% karbohidrat. Imunoglobulin (Ig), yaitu molekul glikoprotein golongan protein globulin. Sebagai efektor, imunoglobulin memiliki kemampuan biologik yang penting yaitu menetralisasi toksin, menetralisasi aktivitas virus, aglutinas mikroorganisme atau partikel antigenik (Subowo, 2009).
Imunoglobin berasal dari proforilasi sel B limfosit yang terjadi kontak dengan antigen. Imunoglobulin terbentuk secara spesifik tergantung dengan antigen yang merangsang pembentukannya. Imunitas spesifik memiliki respon yang intens dan perlindungan yang lebih baik pada paparan penyakit. Dua hal yang penting dalam imunoglobulin yaitu spesifitas dan efektivitas biologik (Bratawidjaja & Iris, 2012).
Immunoglobulin di serum baru akan muncul setelah beberapa hari inang terinfeksi antigen. IgM merupakan immunoglobulin primer yang pertama kali muncul dan menyerang BVDV, yaitu setelah inang terinfeksi BVDV selama 2 minggu. Setelah terbentuknya IgM maka terbentuklah IgG pada minggu ketiga
9
paska inang terinfeksi BVDV (Brown et al., 1979). Tingginya produski IgM dapat menekan produksi IgG, begitu pula ketika produksi IgG meningkat maka produksi IgM akan menurun (Purwaningrum, 2010).
Imunoglobin memiliki 4 rantai polipeptida, yaitu 2 rantai ringan (light chain
=L) (berwarna hijau tua dan hijau muda: gambar 3) dan 2 rantai berat (heavy chain= H) (berwarna merah tua dan merah muda: gambar 3) yang dihubungkan oleh ikatan disulfida (garis berwarna hitam yang menghubungkan tiap polipeptida) (Radji, 2015). Rantai H dan L pada imunoglobulin, masing-masing memiliki 2 regio yaitu regio variabel dan regio konstan (masing-masing ditunjukan dengan huruf V dan C pada gambar 3). Regio variabel yaitu penggal ujung pada rantai H dan L yang tersusun atas urutan asam amino yang selalu berubah, sedangkan regi C merupkan penggal pada ujung H dan L yang tersusun atas urutan asam amino yang sama pada tiap jenis imunoglobulin (Subowo, 2009).
Perbedaan antara rantai ringan dan rantai berat didasari atas perbedaan BM (Berat Molekul). BM rantai H memiliki berat 2 kali dari berat rantai L (Subowo, 2009). Rantai ringan imunoglobulin terdiri atas 2 jenis yaitu kappa dan lambda yang terdiri atas 230 asam amino, sedangkan rantai berat terdiri atas memiliki 5 jenis yaitu IgM, IgG, IgE, IgA, dan IgD yang terdiri atas 450-600 asam amino.
(Bratawidjaja & Iris, 2012).
Gambar 3. Struktur umum molekul imunoglobulin (Radji, 2015)
2.3.1 Imunoglobulin alpha (IgA)
Imunoglobulin alpha (IgA) merupakan imunoglobulin yang dapat ditemukan di dalam berbagai cairan, namun paling banyak ditemukan pada cairan sekresi saluran pernapasan, saluran pencernaan, dan kemih, serta air mata, keringat, ludah dan air susu. Jumlah IgA dalam serum hanya sebesar 15% dari total seluruh imunoglobulin Berat molekul IgA yaitu sebesar 160.000−380.000 dalton (Sofro, 1994).
Gambar 4. Struktur 5 macam imunoglobulin: IgG, IgA, IgD, IgE, IgM (www.britannica.com)
Imunoglobulin Alfa IgA banyak ditemukan pada permukaan jaringan mukosa
11
dalam bentuk dimer, tersusun atas 2 molekul imunoglobulin (rantai ringan berwarna merah muda dan rantai berat berwarna hijau, gambar 4) yang dihubungkan dengan joining chain (bentuknya menyerupai huruf U dengan warna ungu, Gambar 4) sedangkan dalam serum bentuk IgA adalah monomer (Subowo, 2009).
Fungsi IgA di dalam tubuh yaitu melindugi tubuh dari patogen, Mencegah masuknya patogen ke dalam sel penjamu, dapat bekerja sebagai opsonin yaitu bersifat bekteriolitik komplemen dan menetralisasi toksin dan virus, mencegah terjadinya kontak antara virus atau toksin dengan sel sasaran, menganglutinasikan kuman dan memudahkan fagositosis (Bratawidjaja & Iris, 2012).
2.3.2 Imunoglobulin Delta (IgD)
Imunoglobulin delta (IgD) merupakan imunoglobulin yang jumlahnya sedikit di dalam serum, karena Ig rentan terhadap proses proteolitik. Bentuk IgD dalam serum berupa monomer (gambar 4). Jumlah IgD hanyalah 0,2% dari total imunoglobulin dalam serum yaitu tepatnya di membran sel B. Imunoglobulin Delta tidak dapat mengikat komplemen, namun tetap berfungsi sebagai reseptor antigen pertama pada permukaan sel B (Radji, 2015). Imunoglobulin Delta memiliki berat molekul sebesar 180 kDa (Choico & Geoffery, 2009)
2.3.3 Imunoglobulin epsilon (IgE)
Imunoglobulin epsilon (IgE) merupakan imunoglobulin yang peka terhadap alergen. IgE mudah melekat pada permukaan mastosit dan basofil melalui reseptor Fragmen crystallizable (FcR). Struktur IgE berupa monomer (gambar 4).
Imunoglobulin ini diproduksi dalam selaput lendir saluran napas dan cerna oleh
organ limfoid. Berat molekul IgE sebesar 200.000 dalton. Fungsi IgE dalam tubuh belum diketahui dengan jelas, namun diduga bahwa IgE melindungi tubuh dari parasit karena diketahui bahwa imunoglobulin ini banyak ditemukan pada penderita infeksi cacing (Bratawidjaja & Iris, 2012; Radji, 2015).
2.3.4 Imunoglobulin Gamma (IgG)
Imunoglobulin gamma (IgG) merupakan imunoglobulin yang banyak ditemukan di dalam serum. IgG terdiri dari satu molekul imunoglobulin saja (rantai ringan berwarna merah muada dan rantai berat berwarna hijau yang, gambar 4). Komponen utama imunoglobulin serum adalah IgG dengan jumlah sebesar 80% dari total imunoglobulin (Subowo, 2009), yang memiliki berat molekul sebesar 150.000−170.000 dalton (Sofro, 1998).
Imunoglobulin Gama dapat ditemukan dalam berbagai cairan seperti darah, cairan serebo spinal (CSS) dan juga urin. IgG memiliki sifat opsonin yang dapat memusnahkan antigen. Kemampuan opsonin ini efektif akibat adanya sel fagosit, monosit, dan makarofag yang memiliki reseptor Fase Crystallizable (FcR) antigen, sehingga dapat mempererat antara fagosit dengan sel sasaran (Bratawidjaja & Iris, 2012). IgG diproduksi oleh sapi setelah 3 minggu sapi terinfeksi BVDV (Brown et al., 1979).
2.3.5 Imunoglobulin M (IgM)
Imunoglobulin M (IgM) merupakan makro-globulin yaitu imunnoglobulin terbesar karena strukturnya berupa pentamer (tersusun atas 5 molekul imunoglobulin yang dihubungkan dengan joining chain, gambar 4). Berat molekul IgM yaitu sebesar 900.000 dalton, diproduksi oleh sel B sebagai reseptor antigen.
13
Jumlah IgM dalam serum hanya sebesar 5-10% dari total imunoglobulin, namun kemampuan untuk mengaglutinasi berbagai partikel dan fiksasi komplemen 20 kali lebih efektif dalam aglutinasi dan 1000 kali lebih efektif dalam menghancurkan bakteri dibandingkan dengan IgG (Radji, 2015).
Imunoglobulin M merupakan respon imun primer terhadap antigen dalam sistem imun yang hanya ditemukan di dalam serum saja, karena ukurannya yang besar menghambat pergerakan imunoglobulin tersebut untuk berdifusi ke jaringan tubuh (Radji, 2015). Dua minggu setelah sapi terinfeksi BVDV, IgM ditemukan dalam serum (Brown et al., 1979).
2.4 Bovine Viral Diarrhea Virus (BVDV)
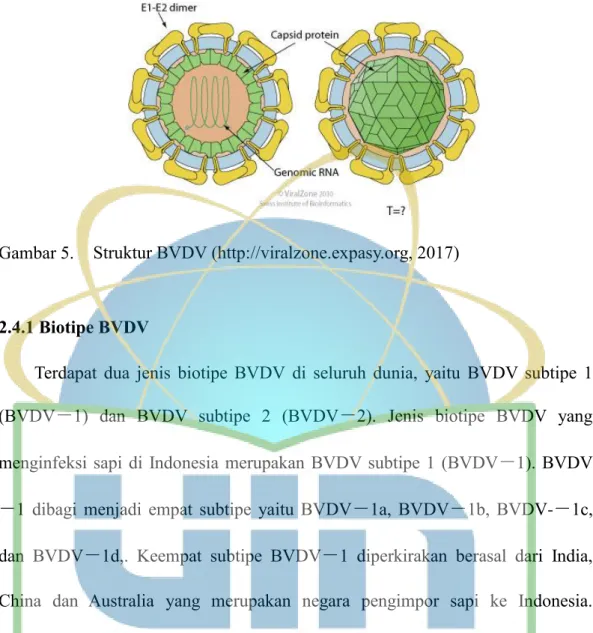
Bovine Viral Diarrhea Virus merupakan virus diare ganas yang infeksius terhadap sapi yang disebabkan oleh virus RNA untai tunggal . Virus tersebut masuk ke dalam anggota genus Pestivirus, famili Flaviridae (Radji, 2015).
Struktur Virus BVD terdiri atas asam nukleat (warna hijau pada tengah partikel virus, gambar 5), kapsid (warna hijau yang mengelilingi RNA, gambar 5), dan selubung (warna biru dan kuning, E1-E2 dimer, gambar 5). BVDV memiliki bentuk yang bulat dengan berbagai macam ukuran. BVDV dengan ukuran 80-
100 nm merupakan virion matang dengan selubung. BVDV dengan ukuran 30-
50 nm, dan BVDV dengan ukuran 15-20 nm, merupakan virion yang mengalami pecah, sehingga ukurannya menjadi kecil, namun tetap inveksius. Peritek- partikel kecil virion tetap dianggap mengandung antigen larut. BVDV dapat hidup bertahun-tahun dan stabil jika kondisi lingkungannya berada pada suhu yang rendah yaitu -70 °C (minus 70 derajat celcius) dan inaktif jika berada pada
kondisi lingkungan dengan suhu 56 °C (Ditjennak, 2014).
Gambar 5. Struktur BVDV (http://viralzone.expasy.org, 2017)
2.4.1 Biotipe BVDV
Terdapat dua jenis biotipe BVDV di seluruh dunia, yaitu BVDV subtipe 1 (BVDV-1) dan BVDV subtipe 2 (BVDV-2). Jenis biotipe BVDV yang menginfeksi sapi di Indonesia merupakan BVDV subtipe 1 (BVDV-1). BVDV
-1 dibagi menjadi empat subtipe yaitu BVDV-1a, BVDV-1b, BVDV--1c, dan BVDV-1d,. Keempat subtipe BVDV-1 diperkirakan berasal dari India, China dan Australia yang merupakan negara pengimpor sapi ke Indonesia.
Kehadiran BVDV-1 bersama dengan sapi impor, kemungkinan disebabkan oleh strain vaksin yang digunakan oleh negara tersebut adalah BVDV-1 (Saepulloh &
Sendow, 2015).
Berdasarkan karakteristik kultur sel in-vitro, virus BVDV digolongkan ke dalam 2 biotipe yaitu cp (sitopatik) yang mampu mengahancurkan sel-sel yang terinfeksi dengan beberapa mekanisme yang dilakukan virus tersebut dan ncp (non-sitopatik) yaitu kemampuan virus untuk mereplikasi pada bagian sel yang
15
terinfeksi sebagai sel jinak, agar virus tetap dapat hidup dalam sel tersebut.
Biotipe ini diklasifikasikan atas dasar kemampuan virus untuk mengubah sel yang diinfeksi. Biotipe sitopatik terbentuk akibat adanya delesi internal atau rekombinasi RNA biotipe non-sitopatik. Kedua biotipe tersebut menyebabkan adanya perubahan ekspresi protein pada monosit.
Sitopatik dan non sitopatik BVDV memiliki target protein mitokondria dan enzim antioksidan yang berbeda pada sel yang terinfeksi virus tersebut, hal inilah yang membedakan dampak kedua biotipe tersebut terhadap sel yang terinfeksi, yaitu sel bisa mengalami efek sitopatik (kematian sel) atau efek non sitopatik yang menyebabkan timbulnya infeksi persisten (IP) (Pinchuk et al., 2015). Infeksi persisten disebabkan oleh induk yang terinfeksi BVD non sitopatik ketika bunting dalam trisemester pertama, sehingga pedet yang lahir bertindak sebagai sumber penyebar virus sepanjang hidupnya (Prastyowati, 2015).
Perbedaan efek yang ditimbulkan dari kedua biotipe tersebut disebabkan perbedaan regulasinya terhadap monosit. Kedua biotipe tersebut mengatur ekspresi gen Tumor Necrosis Factor-α (TNF-α), Interleukin (IL)-1β, IL-6, T helper (Th1) tipe sitokinin IL-15, Th2 tipe sitokinin IL-10, gen co-stimulator Cluster of Differentiation-80 (CD80) & CD86, serta Toll Like Receptor (TLR) 7 pada waktu 24 jam pasca infeksi, namun pada 1 jam pasca infeksi nonsitopatik yang mengatur ekspresi TLR, yaitu TLR3. Reseptor TLR menstimulasi terbentuknya sitokinin (Interferon tipe1) (Lee et al., 2008).
Menurut Pinchuk et al., (2008) penurunan protein kinase merupakan efek dari sitopatik BVDV berdasarkan penelitiannya pada patogenesis BVDV melalui proteomika menyebabkan perubahan ekspresi protein yang lebih tinggi oleh
biotipe cp dibandingkan dengan biotipe ncp pada BVDV. Perubahan ekspresi ini menyebabkan adanya penurunan jumlah protein kinase pada monosit sapi.
Ammari et al., (2010) menjelaskan bahwa ncp BVDV menyebabkan terjadinya infeksi persisten, sedangkan cp BVDV menyebabkan adanya efek sitopatik.
Berdasarkan karakteristik protein BVDV, maka BVDV memiliki 2 protein yang spesifik, yaitu protein virus yang utama (Major) memiliki berat molekul protein 115 kDa, 80 kDa, dan 55 kDa; sedangkan protein virus yang minor memiliki berat molekul protein 38 kDa dan 45 kDa (Purchio et al. 1984).
Sementara itu, Loy et al., (2013) melaporkan bahwa virus BVD memiliki glikoprotein yang disebut sebagai glikoprotein E2 yang berfungsi mengikat virus BVD yang masuk ke dalam sel inang. Selain itu, glikoprotein E2 dapat mengkode struktur protein 55 kDa. Monoklonal antibodi spesifik terhadap E2 memiliki kemampuan dalm menetralisasi virus terhadap virus BVD yang bersifat sitopatik maupun virus BVD yang non sitopatik (Donis et al., 1988).
Berdasarkan karakteristik virus BVD tersebut, maka glikoprotein E2 sering kali digunakan sebagai acuan untuk pengembangan vaksin sub-unit BVD (Loy et al., 2013). Vaksin sub-unit BVD yang menggunakan glikoprotein E2 dapat digunakan untuk pengendalian dan pencegahan penyakit BVD terutama untuk mengetahui status infeksi ternak yaitu keberadaan virus pada individu ternak itu berasal dari vaksin atau infeksi alami dalam program DIVA (Differentiating Infected from Vaccinated individuals).
Penggunaan vaksin konvensional tidak akan bisa digunakan untuk membedakan status penyakit berasal dari vaksin atau infeksi alami. Oleh karena itu, dengan terdeteksinya protein dengan berat molekul 55 kDa (glikoprotein E2)
17
dalam sampel, maka dapat diketahui bahwa ternak sapi yang ada di daerah tersebut telah terpapar oleh galur virus BVD yang mengandung glikoprotein E2 (55 kDa). Sehingga data tersebut lebih lanjut dapat dijadikan sebagai acuan dalam pembuatan vaksin sub Unit E2.
2.4.2 Patogenesis BVD
Penyakit BVD bersifat infeksius pada sapi, dengan laju infeksi yang sangat tinggi karena bersifat sporadik, namun kejadian klinisnya rendah. Virus BVD banyak didapatkan dalam bentuk penyakit kronis karena bersifat immunosupresif (menekan atau menurunkan aktivitas imun) dan teratogenik (perkembangan sel yang tidak normal selama kehamilan) (Ditjennak, 2014).
Sifat virus yang immunosupresif dapat mengakibatkan penurunan fungsi limfosit-T. Kejadian klinis pada hewan yang terinfeksi BVDV yaitu ditandai dengan stomatitis erosif akut, gastroenteritis dan diare. Penyakit BVD merupakan penyakit yang mengakibatkan gangguan pada pencernaan dan pernapasan dengan morbiditas (kasus penyakit) pada suatu populasi mencapai 25 % dan memiliki dampak kematian (mortalitas) hingga mencapai 90-100%. Virus BVD dapat ditemukan di dalam darah ketika 15-60 hari virus menginfeksi hewan ternak (Ditjennak, 2014; Subronto, 1989).
Ada beberapa bentuk penyakit yang disebabkan oleh BVDV yaitu diare (39%), radang paru (35%), lesi pada mulut (11%), lesi mata (10%), hingga keguguran (5%). Gejala klinis yang diderita oleh sapi apabila terserang virus BVD dalam bentuk klinisnya atau gejala, akan mengangibatkan demam, diare ringan, lekopenia dan secara serologis akan ditemukan imunoglobulin dengan titer yang tinggi (Ditjennak, 2014).
Gejala klinis akibat BVDV adalah bentuk subklinis, akut, dan kronis.
(1)Bentuk subklinis: yaitu ditandai dengan gejala demam, diare ringan, leukopenia, dan juga terdapat banyak jumlah titer imunoglobulin apabila diujikan secara serologis. (2) Bentuk akut: yaitu gejala yang ditimbulkan dengan waktu yang cepat. Gejala ini mengakibatkan naiknya suhu tubuh hewan hingga mencapai 41°C, menurunnya jumlah leukosit sebanyak 50%, nafsu makan berkurang, kelesuan, serta turunya produksi susu. Selain itu, gejala klinis pada bentuk akut ini juga ditunjukkan dengan diare yang berisikan mukus dan darah serta berbau busuk, erosi pada bibir, gusi, dan lidah. Sapi dapat mengalami kematian setelah terjadinya gejala klinis setelah 5-7 hari (Ditjennak, 2014).
Bentuk gejala klinis selanjutnya yaitu, (3) Bentuk sub akut atau kronis: yaitu keadaan dimana sapi dapat bertahan hidup setelah mengalami gejala klinis, walaupun keadaannya tidak sembuh benar. Sapi masih mengalami diare, rambut terlihat kering dan kasar, erosi kronis pada rongga mulut dan kulit, serta terjadinya kekurusan yang berlangsung secara cepat. (4) Bentuk neonatal: yaitu keadaan dimana sapi mengalami diare, gangguan pernapasan, dan suhu tubuh yang meningkat. Bentuk ini terjadi pada sapi yang berumur kurang dari 1 bulan akibat dari induk yang mengalami penyakit BVD (Ditjennak, 2014). Infeksi BVDV dapat dilihat dengan cara diagnosis serologik, virologik, dan munculnya tanda klinis, serta ditemukannya lesi pada sapi meskipun pada umumnya infeksi paska kelahiran bersifat non klinis (Sudarisman, 2011),
Penyakit BVDV menyebar dengan baik dan meningkat persebarannya ketika musim dingin dan terajdi secara kontak langsung antara sapi yang terinfeksi dengan sapi sehat, ataupun tidak langsung yaitu melalui makanan yang
19
terkontaminasi feses dan virus yang terbang akibat terbawa angin (aerosol) (Primawidyawan, 2015). Kambing, domba, kerbau, dan rusa, merupakan hewan berkuku genap yang cukup rentan terhadap virus BVD, namun sapi merupakan spesies yang paling peka terhadap virus tersebut. Virus BVDV biasanya menyerang sapi yang masih muda, umur 6-24 bulan (Subronto, 1989).
Faktor yang mempengaruhi terhadap tingginya nilai titer imunoglobulin BVD pada sapi adalah program biosekuriti yang kurang baik dalam peternakan, yaitu meliputi kurangnya pengawasan terhadap lalu lintas sapi yang baru saja diimpor dari negara lain dan kurangnya kesadaran akan pentingnya sanitasi peralatan dan kandang sapi. Pengolahan limbah yang buruk akan memberikan peluang sebesar 2.667 kali menimbulkan hasil ELISA imunoglobulin positif terhadap BVD. Biosekuriti merupakan tindakan perlindungan manusia, hewan, tanaman, dan lingkungannya terhadap organisme yang membahayakan bagi manusia, seperti agen penyakit dan hama (Primawidyawan, 2015).
2.4.3 BVD di Indonesia
Indonesia merupakan salah satu negara yang terserang BVDV. Virus ini banyak ditemukan pada sapi perah dengan perentase mencapai 75%, sedangkan pada sapi potong persentase sapi yang terinfeksi BVDV yaitu sebesar 28%
(Sudarisman, 2010). Infeksi akut mengakibatkan diare profuse, erosi pada saluran gastrointestinal dan demam. Virus BVD dapat menganggu reproduksi sehingga menyebabkan rendahnya efisiensi reproduksi ternak (Adjid, 2004).
Penelitian yang dilakukan oleh Supriyadi et al., (2006) menunjukan bahwa terdapat 34 sampel positif BVD dari jumlah sampel yang diujikan sebanyak 62 pada sapi yang terdapat di Kalimantan Timur. Sapi yang berasal dari Jawa Timur,
Jawa Tengah, dan Daerah Istimewa Yogyakarta, diketahui bahwa terdapat 170 (71,73%) sampel yang terdeteksi memiliki imunoglobulin BVD dari 237 sampel yang dideteksi (Swasthikawati, 2015).
2.5 Enzyme-Linked Immunsorbent Assay (ELISA)
Enzyme-Linked Immunsorbent Assay (ELISA) merupakan teknik yang digunakan untuk mendeteksi imunoglobulin dan antigen pada serum. ELISA dibagi menjadi dua cara yaitu secara langsung (direct) dan tidak langsung (indirect). ELISA secara langsung digunakan untuk mendeteksi antigen, sedangkan secara tidak langsung digunakan untuk mendeteksi imunoglobulin.
Teknik ELISA cukup sederhana sehingga interpretasi terhadap hasil pemeriksaan sangat jelas untuk menentukan hasil positif maupun negative (Radji, 2015)
Teknik ELISA digunakan untuk mendiagnosis infeksi yang disebabkan oleh bakteri, virus, parasit atau serodiagnosis lainnya. Teknik ELISA telah dikembangkan dalam bentuk kit diagnostik, yaitu prosedur penentuannya dapat dilakukan secara otomatis dengan menggunakan spektrofotometer atau ELISA reader (Radji, 2015). Teknik ELISA memiliki tingkat sensitivitas dan spesifisitas yang tinggi pada pendeteksian imunoglobulin terhadap virus Infectious Laryngotrachitis dalam serum ayam, yaitu dengan tingkat sensitivitas sebesar 98%
dan spesifisitas sebesar 97,14% (Indriani et al., 2002)
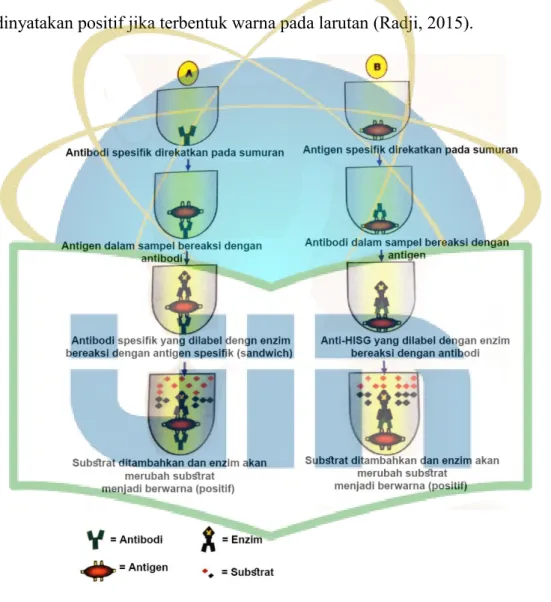
2.5.1 ELISA secara langsung
Enzyme-Linked Immunsorbent Assay secara langsung dilakukan dengan beberapa tahap, tahap pertama yaitu melekatkan imunoglobulin spesifik (berwarna hijau seperti huruf Y, gambar 6) yang telah diketahui pada permukaan sumuran
21
mikroplat. Sampel yang mengandung antigen (berwarna merah di atas imunoglobulin spesifik, gambar 6) yang akan ditentukan, dimasukkan ke masing- masing sumuran. Reaksi imunoglobulin akan terjadi apabila sampel memiliki antigen yang cocok dengan imunoglobulin. Kompleks antigen imunoglobulin akan tetap menempel erat pada dasar sumuran meskipun dilakukan pencucian untuk menghilangkan antigen yang tidak terkait dengan imunoglobulin.
Imunoglobulin kedua yang spesifik terhadap antigen ditambahkan (berwarna hitam kuning, gambar 6), maka jika terdapat kecocokan akan terbentuk tumpukan komplek antigen immunoglobulin dan immunoglobulin kedua (sandwich).
Langkah berikutnya yaitu penambahan substrat (berbentuk belah ketupat berwarna merah dan hijau dengan bentuk belah ketupat, gambar 6) pada mikroplat. Substrat tersebut akan dihidrolisis oleh enzim horseradish peroxidase atau alkalin fosfat, sehingga terbentuklah warna. Terbentuknya warna menunjukkan adanya positif antigen di dalam sampel (Radji, 2015).
2.5.2 ELISA secara tidak langsung
Elisa secara tidak langsung dilakukan dengan beberapa tahap, langkah pertama yang dilakukan adalah merekatkan antigen (berwarna merah di atas imunoglobulin spesifik, gambar 6) yang telah diketahui pada dasar sumuran mikroplat. Imunoglobulin dalam serum dimasukan ke dalam sumuran yang telah mengandung antigen, sehingga apabila terdapat imunoglobulin yang spesifik terhadap antigen akan terjadi reaksi antigen imunoglobulin (berwarna hijau seperti huruf Y terbalik, Gambar 6).
Kompleks antigen imunoglobulin dicuci sehingga kelebihan antiserum yang tidak terikat dengan antigen akan hilang pada saat pencucian. Langkah selanjutnya
yaitu penambahan anti HISG (antihuman immune serum globulin). Anti-HISG (berwarna hitam kuning, gambar 6) yang telah dilabel dengan enzim akan bereaksi dengan komplek antigen imunoglobulin. Sumuran kemudian dicuci, setelah itu ditambahkan substrat (berbentuk belah ketupat berwarna merah dan hijau dengan bentuk belah ketupat, gambar 6) yang sesuai dengan enzim. Substrat yang ditambahkan merupakan substrat yang dapat dihidrolisis oleh enzim. Hasil dinyatakan positif jika terbentuk warna pada larutan (Radji, 2015).
Gambar 6. Penentuan kadar antigen atau antibodi dengan metode ELISA. (A) Metode ELISA secara langsung untuk mendeteksi antigen, (B) Metode ELISA secara tidak langsung untuk mendeteksi antibodi (Radji, 2015)
23
2.5.3 Uji ELISA terhadap BVDV
Uji serologis BVDV dapat digunakan untuk mengetahui apakah hewan yang diujikan sebelumnya pernah terinfeksi oleh virus, hewan uji telah divaksinasi sebelumnya, atau hewan telah terinfeksi virus secara akut, dan mengetahui apakah pedet (anak sapi) telah terinfeksi ketika dalam masa kandungan serta memiliki antigen kolostrum atau tidak. Uji serlogis ini menggunakan metode ELISA (Enzyme-Linked Immunosorbent Assay) yang memiliki banyak keuntugan, salah satunya yaitu waktu yang dibutuhkan dalam pengujian yang cukup singkat, serta biaya yang dibutuhkan tidak terlalu mahal (Dubovi, 2013).
Imunoglobulin (Ab) sebagai antibodi, antigen (Ag) atau virus BVDV yang diujikan pada tes serologi menggunakan ELISA akan menunjukan hasil yang negatif, namun ketika hewan terinfeksi virus secara lambat, maka hasil tes menunjukan adanya positif imunoglobulin (Ab) dan biasanya negatif antigen (Ag) atau virus BVDV. Sedangkan, jika hewan uji mengalami kondisi IP (Infeksi Persisten) terhadap virus BVDV, maka serum darah yang diujikan menunjukan hasil imunoglobulin (Ab) yang negatif, dan antigen (Ag) atau virus yang positif (Lanyon et al., 2014).
Pengujian terhadap serum darah pada sapi dalam mendeteksi antobodi terhadap BVD, sering dilakukan dengan ELISA. Metode ini sudah digunakan lebih dari 40 tahun yang lalu. Tidak hanya mendeteksi imunoglobulin saja, ELISA juga digunakan untuk mendeteksi antigen spesiemen. Elisa memberikan dampak yang besar dalam bidang kedokteran hewan. Metode ini biasa digunakan untuk mendiagnosa penyakit yang disebabkan oleh virus seperti deteksi Feline Leukimia Virus, Canin Parvovirus, Influenza Viruses dan Rota Virus.
Hasil yang baik pada uji tes ELISA akan diperoleh bila beberapa unsur terpenuhi. Unsur pertama yaitu konsentrasi antigen yang konsisten. Konsistensi antigen akan memicu hasil yang positif. Unsur kedua yaitu reagen imunoglobulin cukup untuk menganalisis sesnsitifitas dan spesifisitas hasil tes yang terpercaya.
Unsur yang ketiga adalah pengujian pada sapi yang memiliki umur kurang dari 3 bulan (Dubovi, 2013).
2.6 SODIUM DODECYL SULPHATES-POLY ACRYLAMID GEL ELECTROPHORESIS (SDS-PAGE)
Elektroforesis merupakan teknik pemisahan molekul berdasarkan ukurannya. Pemisahan molekul tersebut terjadi akibat dimasukannya aliran listrik pada suatu medium yang mengandung sampel. Teknik ini memanfaatkan muatan listrik yang ada pada makromolekul. Listrik yang dialirkan ke medium memiliki muatan listrik positif yang berlawanan dengan muatan listrik makromolekul yaitu memiliki muatan listrik negatif (Sudjadi, 2008), sehingga makromolekul akan bergerak dari kutub negatif ke kutub positif. Kecepatan gerak makromolekul ditentukan oleh rasio muatan terhadap massanya dan bentuk makromolekul tersebut (Yuwono, 2002).
Teknik elektroforesis yang dilakukan pada protein menggunkan gel poliakrilamid. Poliakrilamid merupakan gel yang tersusun atas monomer akrilamid. Terdapat beberapa keunggulan yang dimiliki gel poiakrilamid sebagai medium elektroforesis yaitu, memiliki kekuatan pemisah yang sangat besar sehingga dapat memisahkan satu pasang basa dalam 500 pasang basa, serta dapat menampung jumlah sampel yang lebih besar dibandingkan dengan agarose (Sudjadi, 2008).
25
Gambar 7. Skema elektroforesis untuk protein SDS-PAGE (Maftuchah & Agus, 2014)
Gel poliakrilamiid yang akan digunakan untuk menganalisa protein, biasanya ditambahkan dengan Sodium dodecyl sulphate (SDS). Sodium dodecyl sulphate merupakan larutan deterjen anionik yang tersusun atas senyawa surfaktan amfipatik. SDS berfungsi untuk mendisosiasikan protein menjadi subuntinya, atau merubah protein menjadi bentuk linear, serta memberikan muatan negatif pada protein yang terlinerisasi (Yuwono, 2002: Maftuchah et al., (2014).
Senyawa SDS akan berikatan pada ekor rantai karbon protein dan melapisinya dengan molekul surfaktan (Maftuchah et al., 2014), serta memberikan mutan listrik negatif pada protein sampel, sehingga protein sampel yang telah berubah menjadi protein struktur linear terselubung dengan muatan negatif (Saputra, 2014).
Protein yang telah dielektroforesis kemudian diwarnai dengan Coomassie Blue dengan kemampuan mendeteksi band 50 protein ng dan perak nitrat dengan kemampuan mendeteksi band 50 kali lebih sensitif dibandingkan menggunakan
coomassie blue (Maftuchah et al., 2014). Pewarna tersebut dimasukan bersamaan dengan dimasukannya sampel ke dalam medium (Yuwono, 2008).
Gambar 8. Struktur protein yang diubah menjadi protein struktur primer oleh SDS (Sudjadi, 2008).
2.7 Sapi
Sapi merupakan hewan peliharaan yang dimanfaatkan sebagai sapi pekerja, sapi perah, serta sapi potong. Sistematika sapi adalah sebagai berikut, Kingdom:
Animalia, Filum: Chordata, Kelas: Mammalia, Ordo: Artiodactyla, Famili:
Bovidae, Genus: Bos. Sapi yang dikenal oleh masyarakat luas merupakan sapi hasil domestikasi dari spesies hewan liar. Domestikasi merupakan penjinakan spesies liar yang populasinya dikontrol oleh manusia agar spesies tersebut dapat berfungsi sesuai kebutuhan manusia. Domestikasi hewan ternak timbul pada akhir
Panaskan dengan SDS dan merkaptoetanol
27
jaman Paleolithicum (jaman batu lama) dan awal jaman neolithicum (jaman batu baru). Sapi mulai didomestikasi sekitar 8.000-9.000 tahun yang lalu, yaitu di India, Timur Tengah, dan Sahara-Afrika (Maylinda, 2010; Panjono, 2012).
Sapi domestik merupakan keturunan dari Bos primigenius (aurochs) dan Bos sundaicus/ Bos javanicus (banteng). Bos primigenius memiliki 3 subspesies yaitu Bos primigenius primigenius menurunkan sapi Taurus (Bos primigenius taurus), Bos primigenius namadicus menurukan sapi Zebu (Bos primigenius indicus), Bos primigenius mauretenicus menurunkan sapi Afrika. Bos javanicus memiliki beberapa subspesies yang salah satunya adalah Bos javanicus javanicus yang menurunkan sapi Bali (Panjono, 2012).
Sapi Taurus merupakan sapi Eropa dengan ciri-ciri fisik sebagai berikut, moncong, kuku dan tanduk yang berwarna putih (kecuali sapi dengan rambut yang berwarna hitam), profil muka datar dengan ukuran daun telinga yang kecil dibandingkan dengan sapi Zebu dan tanduk yang panjang (meskipun ada sapi yang tidak bertanduk). Sapi taurus tidak memiliki punuk dan memiliki gelambir yang cenderung kecil dibandingkan dengan sapi Zebu (Panjono, 2012).
Sapi Zebu adalah kelompok sapi India dengan ciri khasnya yaitu adanya punuk atau kelasa. Memiliki tanduk, kuku, dan moncong yang berwarna hitam.
Tanduk sapi Zebu betina lebih anjang dari sapi jantan, meskipun tidak sepanjang sapi Taurus. Sapi Zebu memiliki profil muka yang cembung dengan daun telinga yang lebar. Gelambir pada sapi zebu lebar dan kelenjar keringatnya banyak sehingga sapi ini lebih tahan terhadap lingkungan yang panas dan lembap (Panjono, 2012).
Jenis sapi yang ada di dunia sekitar 815 bangsa. Terbentuknya bangsa sapi ini
disebabkan adanya perkawinan silang antara sapi Taurus, Zebu, Afrika dan Bali (Banteng) . Terdapat lima jenis sapi utama di Indonesia yaitu, sapi Bali, sapi Ongole, sapi Madura, sapi Grati dan sapi Kelantan (Smith & Soesanto, 1988;
Maylinda, 2010; Panjono, 2012).
29
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Oktober 2017 sampai dengan Maret 2018. Lokasi pengambilan sampel dilakukan di Balai Embrio Ternak (BET), Bogor dan pemeriksaan sampel dilakukan di Balai Besar Penelitian Veteriner, Ciwaringin, Bogor Tengah, Jawa Barat serta di Pusat Laboratorium Terpadu UIN Syarif Hidayatullah Jakarta.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian untuk ELISA yaitu syringe, cooling box, tabung, mikrotube, label, freezer, kit BVD, mikroplat, mikropipet, ELISA reader, masker dan sarung tangan. Bahan yang diperlukan dalam penelitian yaitu serum sapi, kit ELISA BVD imunoglobulin (IDEXX) yaitu washing solution, conjugate solution, stoping solution dan larutan tetrametyl benzine (TMB) substrat, aluminium foil, larutan kontrol positif dan negatif BVD.
Alat yang digunakan untuk SDS-PAGE yaitu centrifuge, refrigerator, timbangan digital, alat pencetak gel, mikropipet, sisir (comb), tabung eppendorf, , rak tabung, mistar plastik, penjepit dan tempat untuk pewarnaan/pencucian yang berupa baki-baki plastic, shaker.
Bahan yan digunakan untuk SDS-PAGE yaitu 7,5% resolving gel terdiri dari: (7,28 mL dH2O ditambahkan 3,75 mL larutan 1,5 M Tris-HCl pH 8,8; 150 µL larutan SDS 10%; 3,75 mL larutan akrilamid 30%; 75 µL larutan APS 10%;
7,5 µL TEMED), dan 4% stacking gel terdiri dari: (9 mL dH2O ditambahkan 3,78 mL larutan 0,5 M Tris-HCL pH 6,8; 150 µL larutan SDS 10%; 1,98 mL larutan akrilamid 30%; 75 µL larutan APS 10%; 15 µL TEMED), buffer pemisah (Electrode Running Buffer/ ERB) yang terdiri dari: (Tris HCl 9 gram; glisin 43,2 gram; SDS 10% dan dH2O sebanyak 600 mL), larutan pewarna (0,05%
Coomassie blue, 45% metanol, 10% asam asetat, 45% dH2O dan destain (50%
dH2O, 10% asam asetat, 40% metanol).
3.3 Metode Penelitian
3.3.1 Pengumpulan sampel
Sampel darah diambil dari sapi Friesian Holstein, Peranakan Ongole, Limosin, Simental, Angus, Brangus, Brahman, dan Wagyu yang belum divaksin.
Pemilihan hewan dilakukan secara purposif yaitu dengan memilih sapi yang terduga terinfeksi BVDV dengan memiliki seluruh atau sebagian kriteria berikut yaitu kondisi badan kurus, menderita diare, leleran hidung, memiliki riwayat pernah positif antibodi terhadap BVDV.
Pengambilan sampel dilakukan berdasarkan metode Cameron and Baldock (1998), yaitu metode untuk menentukan besaran sampel dalam rangka mendeteksi penyakit di daerah bebas. Metode “detect disease” tersebut dengan mengasumsikan besaran prevalensi penyakit sebesar 5%, dengan tingkat kepercayaan uji sebesar 95%. Sehingga dari total populasi sapi yang ada di BET sebanyak 600 ekor, maka yang dapat diambil sebagai sampel untuk dilakukan pengujian sebanyak 43 ekor.
31
3.3.2 Preparasi Sampel
Darah sapi diambil sebanyak 5 ml dari vena jugularis menggunakan syringe.
Darah tersebut kemudian dimasukan ke dalam tabung dan disimpan di cooling box untuk menjaga kesegaran sampel selama transportasi menuju laboratorium.
Kemudian, darah tersebut disentrifugasi dengan kecepatan 1500 rpm selama 5 menit hingga terpisahnya antara natan dengan supernatan (serum). Supernatan tersebut kemudian di isolasi ke mikrotube yang telah diberi label sesuai dengan kode hewan uji dan ditulis tanggal pengambilannya, kemudian sampel dianalisis.
3.3.3 Prosedur ELISA Secara Tidak Langsung
Serum sapi yang telah didapatkan dari hasil preparasi sampel, kemudian diperiksa dengan ELISA. Langkah awal yang dilakukan yaitu Alat dan bahan yang akan digunakan dipersiapkan terlebih dahulu. Kit BVD yang telah tersedia kemudian diinkubasi selama 1 jam pada suhu 18-26 °C. Sample diluent tang sebelumnya telah disiapkan, dimasukan ke dalam sumur mikroplat sebanyak 100µl pada tiap sumuran. Sumur A1 dan B1 kemudian dimasukan 25 µl larutan kontrol positif, dan pada sumur C1 dan D1 dimasukan 25 µl larutan kontrol negatif, serta pada sumur E1 hingga seterusnya (sesuai pola yang dibuat) dimasukkan serum sebanyak 25 µl. Kontrol positif dan negatif sudah tersedia di dalam kit BVDV.
Larutan yang terdapat di mikroplat kemudian dihomogenkan dan dilanjutkan dengan menginkubasi larutan pada suhu 18-26°C, yaitu selama 90 menit.
Setalah itu, cairan di dalam sumuran dibuang kemudian mikroplat dicuci dengan menambahkan washing solution sebanyak 300 µl pada tiap sumuran. Pencucian
ini dilakukan sebanyak 5 kali. Mikroplat kemudian dikeringkan yaitu dengan cara membuang larutan yang ada di dalam mikroplat tersebut dan menelungkupkan serta menghentakan mikroplat di atas kain atau tisu yang berdaya serap tinggi hingga sumur benar-benar kosong.
Sebanyak 100 µl conjugat solution kemudian dimasukan ke dalam tiap sumur yang sebelumnya sudah dikosongkan, setelah itu diinkubasi pada suhu 18-26 °C selama 30 menit. Selanjutnya, dilakukan pencucian sesuai dengan prosedur yang sudah dijelaskan. Setelah dilakukan pencucian, dimasukan Tetramethyl Benzidine ke dalam tiap sumur pada mikroplat yaitu sebanyak 100 µl. Kemudian mikroplat ditutup dengan alumunium foil dan diinkubasi pada suhu ruang 18-26°C selama 10 menit di ruang gelap. Selanjutnya, ditambahkan 100 µl stop solution pada tiap sumuran dan setelah itu dilakukan pembacaan larutan sampel menggunakan ELISA reader dengan panjang gelombang 450 nm. Hasil dari pemeriksaan menggunakan ELISA adalah seropositif dan seronegatif BVDV
3.3.4 Prosedur SDS-PAGE
Seropositif dan seronegatif hasil ELISA diperiksa menggunakan SDS-PAGE.
Ada beberapa tahap untuk melakukan prosedur ini. Tahap pertama yang dilakukan adalah pembuatan resolving gel yaitu dengan mencampurkan acrylamid 30%
sebanyak 3,75 mL, Tris HCl pH 8,8 sebanyak 3,75 mL, SDS 10% sebanyak 150 µL, Akuades 7,28 mL, TEMED 7,5 µL, APS 10% sebanyak 75 µL. Bahan tersebut kemudian dihomogenkan dan dimasukan ke dalam glass plate. Bagian lapisan atas running gel ditambahkan dengan akuades hingga batas glass plate.
Akuades tersebut kemudian dibuang dengan cara diserap menggunakan kertas saring ketika resolving gel telah mengeras.
33
Langkah selanjutnya yaitu penambahan stacking gel yang terdiri atas 9 mL aquadest, Tris HCL pH 6,8 sebanyak 3,78 mL, Acrylamid 30% sebanyak 1,98 mL, SDS 0,5% sebanyak 150 µL, TEMED sebanyak 15 µL, APS 10% sebanyak 75 µL. Stacking gel dimasukan ke dalam glass plate, kemudian dimasukkan sisir ke dalam agar tersebut, dan didiamkan hingga agar mengeras.
Setelah dilakukan tahapan-tahapn tersebut, maka selanjutnya adalah mempersiapkan sampel yang akan dimasukan ke dalam sumuran gel. Sebelum sampel dimasukkan ke dalam akrilamid, serum diencerkan 100x menggunkan aquades. Serum yang sudah diencerkan kemudian dicampurkan dengan laemmli buffer yitu masing-masing sebanyak 15 µl (dengan perbandingan 1:1). Larutan sampel tersebut kemudian dipanaskan selama 5 menit ada suhu 95℃.
Tahap selanjunya adalah proses elektroforesis, yaitu dengan cara memasukan glass plate ke dalam chamber model biometra. Selanjutnya elektroforesis buffer dimasukkan ke dalam chamber hingga gel terendam. Sampel dan marker kemudian dimasukan ke dalam sumuran gel. Setelah sampel dan marker dimasukan ke dalam gel, maka power supply dinyalakan selama lebih kurang 1 jam dengan tegangan 155 Volt. Tahap terakhir yaitu melepasan gel dari glass plate dan memasukannya ke dalam cawan petri yang telah berisi zat pewarna coomassi blue.
3.4 Analisis Hasil
Hasil pemeriksaan serum sapi menggunakan ELISA akan dianalisis secara deskriptif dengan cara membaca hasil sampel value relates to positive value (S/P) dari ELISA reader yang menunjukkan serpositif dan seronegatif. Rumus perhitungan s/p sebagai berikut:
(S/P) = Nilai sampel yang diuji optical density (OD) – nilai rataan control negatif Nilai rataan kontrol positif – nilai rataan kontrol negatif Berikut ini merupakan keterangan hasil interpretasi (s/p) untuk sampel serum, plasma dan individual milk:
S/P < 0.20 = negatif 0.20 ≤ S/P < 0.30 = terindikasi S/P ≥ 0.30 = positif
Seropositif dan seronegatif BVDV yang diketahui dari pemeriksaan serum menggunakan ELISA, kemudian diperiksa menggunkan SDS-PAGE. Data hasil pemeriksaan SDS-PAGE akan dianalisis secara deskriptif dan dibandingkan masing-masing seropositif dan seronegatif BVDV. Penentuan berat molekul protein imunoglobulin dilakukan dengan cara mengukur pita-pita protein yang terlihat pada gel poliakrilamid menggunakan penggaris, kemudian dilakukan penghitungan nilai regresi dan berat molekul protein dengan bantuan software excel 2013.
35
BAB IV
HASIL DAN PEMBAHASAN
4.1 Deteksi Imunoglobulin Menggunakan ELISA
Penelitian ini dilakukan dengan menggunakan sampel darah sapi yang berasal dari Balai Embrio Ternak (BET), Bogor. Uji Enzyme Linked- Immubosorbent Assay (ELISA) terhadap Bovine Viral Diarrhea Virus (BVDV) dapat diketahui dengan menganalisis imunoglobulin dalam darah hewan.
Penelitian ini dilakukan dengan memeriksa sampel serum sapi sebanyak 25 µl untuk dianalisis menggunakan kit ELISA dari IDEXX BVDV Total Antibodi (Ab). Sensitivitas ELISA yang tinggi dan waktu mendeteksi yang cepat dari uji netralisasi (gold standard) pada uji serologis, menjadi alasan digunakannya teknik ELISA.
Tabel 1. Persentase hasil uji ELISA terhadap antibodi BVDV
No Jenis Sapi Positif Negatif Jumlah Sapi
1 FriesianHolstein 6 0 6
2 Peranakan Ongol 4 17 21
3 Limosin 4 0 4
4 Simental 4 0 4
5 Angus 2 2 4
6 Brangus 0 2 2
7 Brahman 0 1 1
8 Wagyu 1 0 1
Total Sapi 21 22 43
Persentase Sapi 49% 51% 100%
Sebanyak 43 sampel serum yang diuji menggunakan ELISA, 21 sampel menunjukkan seropositif BVDV dan 22 sampel menunjukkan seronegatif BVDV
(Tabel 1). Serum seropositif BVDV memiliki nilai sampel value relates to positive value (S/P) ≥ 0.30, sedangkan seronegatif BVDV memiliki nilai S/P < 0.20 yang ditunjukkan pada lampiran 1. Nilai S/P dapat diketahui dengan membaca hasil yang ditampilakn oleh ELISA reader. Konsentrasi imunoglobulin terhadap BVDV atau nilai optical density (OD) menentukan tinggi rendahnya nilai S/P. Semakin tingginya nilai OD pada sampel serum, maka nilai S/P akan semakin tinggi.
Kasus BVD pertama kali dilaporkan pada tahun 1985 di Sulawesi dan Kalimantan, kemudian penyakit ini menyebar ke pulau Sulawesi dan pulau lainnya di Indonesia (Ditjennak, 2014). Setiap daerah memiliki strain virus yang berbeda (Poettri et al., 2014) dan virus dengan subtipe berbeda akan menghasilkan respon imunoglobulin yang berbeda (Handayani, 2008), dengan demikian pengamatan karakterisasi imunoglobulin dapat memberikan informasi mengenai virus BVD yang menginfeksi sapi.
Seiring berjalannya waktu, virus yang masuk ke Indonesia dapat mengalami perubahan karakteristik protein serta kemampuan dalam menginfeksi inang (Suwarno, 2014 & Reddy et al., 1995). Keadaan tersebut mengakibatkan imunoglobulin spesifik yang menetralisasi virus juga akan berubah, sehingga pemeriksaan karakterisasi imunoglobulin sangat penting dilakukan. Menurut Saepulloh (2015), BVDV diperkirakan berasal dari strain vaksin yang diberikan pada sapi yang diimpor ke Indonesia. Sebelum masuk ke Indonesia, sapi mengalami vaksinasi.
Pemeriksaan awal terhadap sapi impor yang masuk ke Indonesia dilakukan secara visual, palpasi, auskultasi, dan belum diuji secara laboratorik. Pengujian secara laboratorik dilakukan ketika sapi menunjukkan gejala klinis, sedangkan
37
sapi yang terinfeksi virus BVD nonsitopatik tidak memperlihatkan gejala klinis (Prastyowati, 2015). Dengan demikian sapi yang terinfeksi virus BVD nonsitopatik ditempatkan bersamaan dengan sapi sehat, sehingga menjadi sumber penular virus bagi sapi sehat lainnya. Hal tersebut menjadi penyebab virus BVD masuk dan menyebar di peternakan sapi atau di pusat perbibitan di Indonesia.
Oleh karena itu, pemeriksaan serologik secara rutin terhadap ternak sapi tersebut mutlak diperlukan untuk mencegah terjadinya penyebaran penyakit BVDV.
4.2 Profil Protein SDS-PAGE
Terdapat beberapa protein yang ada di dalam serum yaitu protein albumin, globulin dan protrombin (Pearce, 2009) dan imunoglobulin merupakan bagian dari protein globulin yang terdapat di dalam tubuh akibat respon terhadap antigen yang menyerang tubuh. Penelitian yang dilakukan Suryohastari (2016) memberikan informasi bahwa analisis protein SDS-PAGE dari sampel darah dapat dikerjakan melalui serum. Dengan demikian serum dijadikan sebagai bahan pemeriksaan terhadap sapi yang terinfeksi BVDV agar dapat diketahui perbedaan profil protein imnuglobulin pada seropositif dan seronegatif BVDV.
Serum yang dianalisis dengan SDS-PAGE mewakili seropositif dan seronegatif BVDV pada masing-masing jenis sapi. Apabila serum sapi hanya terdapat seropostif atau seronegatif BVDV saja pada satu jenis sapi, maka serum yang dianalisis menggunakan SDS-PAGE hanya seropositif BVDV atau hanya seronegatif BVDV pada satu jenis sapi.
Analisis SDS-PAGE dilakukan menggunakan alat dan formula poliakrilamid serta marker dari BIO-RAD. Berat molekul protein serum dalam penelitian ini diketahui dengan menghitung persamaan regresi linier yang
berdasarkan nilai mobilitas relatif marker. Persamaan regresi linier yang diperoleh yaitu y = -1,4688x + 2,3622 dengan R² = 0,9649 yang menunjukkan bahwa tingkat perkiraan ketelitian berat molekulnya tinggi. Nilai R² yang mendekati 1,0 maka persamaan regresi nilai yang diperoleh semakin bagus. Hal tersebut menunjukkan bahwa persamaan tersebut mendekati kepastian nilai berat molekul dari protein yang dianalisis. Nilai Regresi linear yang diperoleh, kemudian digunakan untuk menghitung berat molekul sampel seropositif dan seronegatif BVDV.
Gambar 9. Nilai Log BM pita marker broad range prestained SDS-PAGE standar
Serum sapi seropositif dan seronegatif BVDV dianalisis menggunakan SDS-PAGE untuk mengetahui berat molekul protein imunoglobulin dan berat molekul protein antigen virus BVD. Marker yang digunakan terdiri dari delapan pita penunjuk berat molekul protein, yaitu 6,9 kDa, 21 kDa, 29 kDa, 35,8 kDa, 56,2 kDa, 101 kDa, 125 kDa, dan 210 kDa (Gambar 10).
y = -1.4688x + 2.3622 R² = 0.9649
0 0.5 1 1.5 2 2.5
0 0.2 0.4 0.6 0.8 1 1.2
Log BM
Mobilitas Relatif (Rf)
39
Tabel 2. Berat molekul sampel seropositif dan seronegatif BVDV
Lane Sampel Jarak Pergerakan
(cm) BM (kDa)
1 Sapi Wagyu BVDV+
1,7 70,1939
2,04 55,3502
2,1 53,0775
4,23 11,9817
2 Brangus BVDV- 1,7 70,1939
3 Simental BVDV+ 1,7 70,1939
4 Limosin BVDV+ 1,7 70,1939
5 Friesian Holstein BVDV+
0,6 151,397
1,4 86,5646
2,04 55,3502
2,33 45,1973
4,18 12,4077
6 Angus BVDV- 1,7 70,1939
2,1 53,0775
7 Angus BVDV+ 1,71 69,7051
2,1 53,0775
8 Peranakan Ongol BVDV- 1,78 66,3776
2,1 53,0775
9 Peranakan Ongol BVDV+ 1,71 69,7051
Hasil SDS-PAGE pada seropositif dan seronegatif pada beberapa jenis sapi yang berbeda, menunjukkan pada Wagyu BVDV+ terdapat 4 pita protein (BM 70,193 kDa, 55,350 kDa 53,077 kDa, dan 11,981 kDa), Brangus BVDV- , Simental BVDV+, Limosin BVDV+ terdapat 1 pita protein (BM 70,1939 kDa), Peranakan Ongol BVDV+ terdapat 1 pita protein (BM 69,7051 kDa), Frisian Holstein BVDV+ terdapat 5 pita protein (BM 151,397 kDa, 86,564 kDa, 55,350 kDa, 45,197 kDa, 12,407 kDa), Angus BVDV- menunjukkan 2 pita protein (BM 70,193 kDa, 53,077 kDa), Angus BVDV+ menunjukkan 2 pita protein (BM 69,705 kDa, 53,077 kDa), dan Peranakan Ongol BVDV- menunjukkan 2 pita