ISOLASI DAN PENAPISAN KAPANG PENGHASIL
β
-GLUKOSIDASE DAN KARAKTERISASI
ENZIM YANG DIHASILKAN
OLEH :
TRIRAKHMA SOFIHIDAYATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
RINGKASAN
TRIRAKHMA SOFIHIDAYATI. Isolasi dan Penapisan Kapang Penghasil
β-Glukosidase dan Karakterisasi Enzim yang Dihasilkan. Dibimbing oleh: I MADE ARTIKA dan TRESNAWATI S. PURWADARIA.
Tumbuh-tumbuhan menghasilkan karbohidrat dalam bentuk pati dan lignoselulosa. Selulosa tidak bisa dimanfaatkan sebagai sumber energi oleh ternak unggas karena hewan tersebut tidak memiliki mikroorganisme rumen yang mampu mencerna selulosa. Beberapa cara pengolahan limbah dilakukan dengan menggunakan bantuan mikrob yang dapat menghasilkan enzim selulolitik. Selain kapang, enzim selulase juga dihasilkan oleh siput dan rayap. Penelitian ini bertujuan untuk mengisolasi kapang yang dapat menghasilkan enzim β-glukosidase, memproduksi dan
mengkarakterisasi enzim. Sebanyak 22 isolat yang menunjukkan aktivitas β-glukosidase dengan menghasilkan daerah hitam pada medium yang mengandung
eskulin, berhasil diisolasi. Kapang yang menghasilkan aktivitas β-glukosidase tertinggi (RM 3D) diidentifikasi sebagai Aspergillus foetidus (Naka.) Thom dan Raper.
ABSTRACT
TRIRAKHMA SOFIHIDAYATI. Isolation and Screening β-glucosidase-producing fungi and Characterization the enzyme. Under the direction of: I MADE ARTIKA and TRESNAWATI S. PURWADARIA.
Plants are producing carbohydrate in the form of polysacharide and lignocellulose. Cellulose can not be used as a energy sources by poultry, because they do not have rumen microorganism having capability to digest cellulose. Several methods employed in waste management are using cellulolytic-producing microbacteria. Cellulolytic enzyme is produced by fungi, snails and termites. The purpose of this research is to isolate β-glucosidase- producing fungi and characterize the enzyme. Beta-glucosidase activity is indicated by the presence of black zone on medium containing esculin. The fungi having high level β-glucosidase (RM 3D) activity identified as Aspergillus foetidus (Naka.) Thom and Raper.
Beta-glucosidase enzyme production from Aspergillus foetidus (Naka.) (RM 3D) on the medium containing 3% wheat pollard, at room temperature and with incubation periode of 6 days showed activity at 3.56 U/ml. The optimum activity level of β-glucosidase was reached at pH 5.0 and temperature 60 ºC. The stable condition for
the β-glucosidaseis was observed in pH 4.2 – 5.0. The enzyme was relatively stable at 28 and 40 ºC, but very unstable at 80 ºC. The activity of β-glucosidase increased by addition of cations Mg2+, Ba2+, Ca2+, Mn2+, Co2+ and EDTA at concentration of 1 mM, and by EDTA and Fe3+ at concentration of 5 mM. On the other hand, the activity
decreased when 1 mM and 5 mM cations of Cu2+ and Zn2+ were added. The activity of
β-glucosidase increased two fold after precipitated by organic solvent acetone at 80%, but the protein level decreased 64%. Analysis on SDS-PAGE of the enzyme generated 4 protein band appeared at molecular weight of 134.9, 104.7, 87.1 and 41.7 kDa respectively. Zymografi analysis confirmed that the β-glucosidase Aspergillus foetidus
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul:
ISOLASI DAN PENAPISAN KAPANG PENGHASIL β-GLUKOSIDASE DAN KARAKTERISASI ENZIM YANG DIHASILKAN
Adalah benar merupakan hasil penelitian saya sendiri dan belum pernah dipublikasikan. Semua sumber data dan informasi yang digunakan jelas dan dapat diperiksa kebenarannya
Bogor, Maret 2007
ISOLASI DAN PENAPISAN KAPANG PENGHASIL
β
-GLUKOSIDASE DAN KARAKTERISASI
ENZIM YANG DIHASILKAN
TRIRAKHMA SOFIHIDAYATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biokimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Isolasi dan Penapisan Kapang Penghasil β-Glukosidase dan Karakterisasi Enzim yang dihasilkan
Nama : Trirakhma Sofihidayati
NRP : G451030031
Program Studi : Biokimia
Menyetujui,
1. Komisi Pembimbing
Dr. Ir. I Made Artika, M. App. Sc Dr. Ir. Tresnawati S. Purwadaria
Ketua Anggota
Mengetahui,
2. Ketua Program Studi Biokimia Dekan Sekolah Pascasarjana
Prof. Dr. drh. Maria Bintang, MS Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
RIWAYAT HIDUP
Penulis dilahirkan di Semarang pada tanggal 4 September 1963 sebagai anak ketiga dari empat bersaudara dari Bapak H. Sundjoto Ariyosuhendro dan Ibu almarhumah Hj. Siti Arifah. Tahun 1990 penulis menikah dengan Erwanto dan mempunyai seorang anak, Anisa Fatiha Qodriyani (1999)
PRAKATA
Segala puji dan syukur penulis panjatkan bagi Allah yang Maha Pengasih dan Penyayang atas segala rahmat dan karunia-Nya sehingga tesis ini dapat terselesaikan.
Tesis yang berjudul “Isolasi dan Penapisan Kapang Penghasil β-Glukosidase dan Karakterisasi Enzim yang Dihasilkan” disusun berdasarkan hasil penelitian yang dilaksanakan dari bulan Juli 2005 sampai dengan Agustus 2006 di Laboratorium Pakan, Balai Penelitian Ternak, Ciawi, Bogor.
Penulis mengucapkan terima kasih yang tak terhingga dan penghargaan yang
setinggi-tingginya kepada Bapak Dr. Ir. I Made Artika, M. App. Sc. dan Ibu Dr. Ir. Tresnawati S. Purwadaria selaku pembimbing atas arahan, bimbingan,
perhatian dan kesabarannya yang telah diberikan dalam penelitian dan penulisan tesis. Terima kasih penulis sampaikan kepada Bapak Kepala Balai Penelitian Ternak Ciawi Bogor atas izin dan segala fasilitas yang diberikan kepada penulis selama melakukan penelitian. Tak lupa penulis sampaikan terima kasih kepada Pak Helmi, Ibu Emi, Pak Tyas, Ibu Ema, Ibu Tuti, Ibu Susan, Nila, Eka, dan semua pegawai Laboratorium Pakan dan Analitik Balitnak Ciawi Bogor atas bantuan dan pengorbanan waktunya. Demikian
pula kepada Pak Arya di Biokimia, Ibu Emmi di Mikologi dan Anggia di Bioteknologi yang rela dan siap membantu untuk menyelesaikan penelitian.
Semoga Allah SWT yang Maha Pemurah membalas semua kebaikan yang diberikan dengan balasan yang lebih sempurna.
Penulis menyadari bahwa penulisan ini masih banyak kekurangannya, namun demikian semoga hasil penelitian ini bermanfaat bagi penelitian selanjutnya.
Bogor, Maret 2007
Halaman
DAFTAR TABEL ... .... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 3
Manfaat Penelitian... 4
Hipotesis ... 4
TINJAUAN PUSTAKA Selulosa dan Enzim Selulase ... 5
Mekanisme Penguraian Selulosa ... 9
Enzim β-glukosidase ... 10
Pemekatan dan Pemisahan Enzim... 12
Pemanfaatan Kapang ... 16
BAHAN DAN METODE Tempat dan Waktu Penelitian... 18
Bahan dan Alat ... 18
Metode Penelitian ... 18
Isolasi Kapang Selulolitik ... 18
Penapisan Kapang Penghasil β-glukosidase... 19
Pembuatan Polard NaOH ... 19
Produksi Enzim ... 19
Penentuan Aktivitas Enzim ... 20
Penentuan Aktivitas Total Selulase ... 20
Penentuan Aktivitas β-glukosidase ... 20
Penentuan Kadar Protein dan Aktivitas Spesifik.... 21
Karakterisasi Enzim β-glukosidase ... 22
Penentuan pH dan Suhu Optimum Enzim ... 22
Penentuan pH dan Suhu Stabilitas enzim ... 22
Pengendapan Protein dengan Aseton ... 22
Pengaruh EDTA dan Ion logam terhadap Aktivitas Enzim... ... 22
Penentuan Berat Molekul Enzim dengan Teknik Zimografi... 23
Pembuatan Gel Poliakrilamida SDS-PAGE ….…. 23 Preparasi Sampel Protein ….……….……. 23
x
Pewarnaan Protein ……… 24
Analisis Zimografi SDS-PAGE ... 25
Identifikasi Isolat Kapang ……….………… 25
HASIL DAN PEMBAHASAN Penapisan Kapang Secara Semi Kuantitatif ... 26
Identifikasi Isolat Kapang RM 3D... 30
Karakterisasi Enzim β-glukosidase ... 31
Pengaruh pH Dan Suhu Terhadap Aktivitas ... 31
Pengaruh pH Dan Suhu Terhadap Stabilitas …………... 34
Pengaruh Penambahan Aseton Terhadap Perolehan Kembali Protein dan Aktivitas Spesifik... 37
Pengaruh EDTA dan Kation... 38
Penentuan Bobot Molekul ... 40
SIMPULAN DAN SARAN ... 42
DAFTAR PUSTAKA ... 44
xi
Halaman
1 Hidrolisis berbagai substrat oleh enzim selulolitik……… 8
2 Metode pemurnian untuk mengisolasi β-glukosidase dari komponen
selulase... 14
3 Produk metabolit yang dihasilkan kapang... 17
xii
DAFTAR GAMBAR
Halaman
1 Struktur selulosa. ... 5
2 Struktur molekul selulosa ... 6
3 Mekanisme hidrolisis selulosa oleh kompleks selulase... 9
4 Model regulasi biosintesis selulase ... 11
5 Pemotongan eskulin oleh adanya aktivitas enzim β-glukosidase... 15
6 Beberapa isolat hasil isolasi. ... 28
7 Kurva produksi enzim Fpase isolat kapang... 29
8 Kurva produksi enzim β-glukosidase isolat kapang... 30
9 Isolat kapang Aspergillus foetidus (Naka.) (RM 3D)... 31
10 Aktivitas β-glukosidase terhadap variasi pH... 32
11 Aktivitas β-glukosidase terhadap variasi suhu... 33
12 Stabilitas β-glukosidase terhadap variasi pH... 35
13 Stabilitas β-glukosidase pada suhu 28 ºC ... 36
14 Stabilitas β-glukosidase pada suhu 40 ºC ……….. 36
15 Stabilitas β-glukosidase pada suhu 80 ºC ... 37
16 Pengaruh Aseton Terhadap β-glukosidase... 38
17 Pengaruh EDTA dan Kation terhadap aktivitas β-glukosidase... 39
xiii
Halaman
1 Diagram alir Penelitian……….. 51
2 Pembentukan daerah hitam Aspergillus foetidus (Naka.) (RM 3D) pada media agar Dubos... 52
3 Komposisi penambahan pelarut organik………... 53
4 Komposisi media dan pereaksi dalam 1 L larutan ……… 54
5 Standar Bobot molekul. ……….. 56
6 Kurva standar nitrofenol dalam bufer asetat pada T 50º C ……... 57
7 Kurva standar nitrofenol dalam bufer asetat pada pH 5.0………. 58
8 Kurva standard glukosa untuk penentuan aktivitas FPase pada T 50º C……… 59
9 Kurva standar protein ………... 60
PENDAHULUAN
Latar Belakang
Karbohidrat merupakan sumber energi utama bagi mahluk hidup. Karbohidrat
terdiri dari kelompok monosakarida, disakarida dan polisakarida. Tumbuh-tumbuhan
adalah penghasil karbohidrat terbesar, yaitu polisakarida dalam bentuk pati dan
lignoselulosa (selulosa, hemiselulosa dan lignin). Komponen-komponen tersebut
dihasilkan dari proses fotosintesis (Lea dan Leegood 1994). Selulosa belum banyak
dimanfaatkan sebagai sumber energi untuk ternak unggas karena sulit dicerna. Untuk
ternak ruminansia seperti sapi, kerbau, domba dan yang lainnya, selulosa dapat dicerna
karena kelompok hewan tersebut memiliki mikroorganisme rumen yang mampu
mencerna selulosa.
Hewan nonruminansia seperti unggas merupakan komoditi yang paling banyak
diproduksi dan dimanfaatkan oleh masyarakat. Karena itu ketersediaan pakan untuk
unggas harus dapat dipenuhi dengan baik (Butarbutar 2001). Pakan unggas yang umum
digunakan adalah jagung yang bertindak sebagai sumber energi, sedangkan bungkil
kedelai dan tepung ikan sebagai sumber protein (Anonimus 1995).
Perkembangan peternakan di Indonesia menuntut adanya pakan yang murah,
berkualitas, tersedia dalam jumlah yang cukup serta tidak bersaing dengan manusia.
Murtidjo (1992) melaporkan bahwa biaya ransum dalam usaha peternakan ayam
mencapai 60-70% dari total biaya produksi. Berbagai limbah pertanian dan industri
seperti polard (dedak gandum) dan dedak padi, berpotensi sebagai pakan ternak
alternatif untuk menggantikan pakan yang masih diimport. Limbah pertanian ini
meskipun tersedia dalam jumlah yang cukup memadai dengan harga yang lebih murah,
tetapi masih sangat terbatas dimanfaatkan sebagai pakan ternak. Selain mengandung
protein, limbah tersebut mengandung kadar serat yang cukup tinggi sehingga sulit
dicerna. Polard mengandung kadar serat sekitar 30-35%, dedak padi 62% (Juliono
1996) dan serat sabut sawit 40% (Aritonang 1986). Tingginya kadar serat ini
disebabkan oleh tingginya kadar selulosa, yang merupakan komponen utama penyusun
mendegradasi selulosa dengan cara atau teknologi yang dapat meningkatkan nilai
nutrisi dan kecernaan limbah tersebut.
Beberapa cara pengolahan limbah yang sudah dikenal antara lain pengolahan
fisik, kimia, dan biologi (Judoamidjojo et al. 1989). Cara-cara pengolahan ini
diharapkan dapat memecah ikatan selulosa menjadi gula sederhana yang akhirnya dapat
dengan mudah dimanfaatkan oleh ternak sebagai sumber energi. Pengolahan secara
biologi (biofermentasi) dapat dilakukan dengan menggunakan bantuan mikrob yang
dapat menghasilkan enzim selulolitik, misalnya kapang. Kapang Aspergillus niger dan
Rhizopus oligosporus misalnya, diketahui mampu menghasilkan beberapa jenis enzim,
antara lain enzim selulase, amilase, laktase dan protease (Landecker 1996). Bahkan
R. oligosporus juga dapat menghasilkan vitamin B12 dan mineral yang diperlukan oleh
ternak. Dalam lingkungan yang banyak mengandung selulosa, kapang mampu
menghasilkan enzim selulase yang dapat memecah ikatan β-1,4 glikosida pada selulosa
menjadi monomer-monomer yang lebih sederhana, seperti glukosa. Enzim selulase juga
dihasilkan oleh mikroorganisme lain seperti siput dan rayap. Ekstrak rayap
mengandung selulase (endoglukanase dan β-glukosidase) (Purwadaria et al. 2003c) dari
epitel usus dan kelenjar ludahnya (Brune 1998). Aktivitas endoglukanase endogen pada
Reticulitermes spp. diketahui banyak terdapat di kelenjar ludahnya, sedangkan aktivitas
eksoglukanase dan β-glukosidase pada Coptotermes formosanus, masing-masing
ditemukan 75% di usus tengah dan 24% di usus belakangnya (Itakura et al. 1997;
Asada et al. 1998). Aktivitas enzim selulase juga ditemukan pada sarang rayap yang
dihasilkan oleh aktivitas jamur termasuk kapang (Sand 1970). Nurbayti (2002) telah
berhasil memproduksi enzim selulase dari kapang Penicillium nalgiovense Laxa yang
diisolasi dari sarang rayap.
Sebagai negara tropis, Indonesia mempunyai keragaman hayati berupa
mikroorganisme yang tersebar dalam berbagai media, baik tanah, air, ataupun dalam
bahan pangan. Berbagai jenis kapang dapat diperoleh melalui cara isolasi. Teknik
isolasi dilakukan untuk mendapatkan biakan murni yang terdiri dari satu jenis
mikroorganisme. Jenis kapang yang dapat digunakan sebagai mikrob penghasil enzim
selulolitik pada dasarnya harus sama dengan mikrob yang terdapat dalam bahan pangan
manusia, sehingga tidak membahayakan jika dikonsumsi oleh ternak. Jenis enzim yang
3
Hidayat (2002) memanfaatkan enzim selulase untuk mendegradasi selulosa yang
terdapat pada jerami padi. Bungkil kelapa yang mengandung manan merupakan
substrat yang baik untuk memproduksi enzim mananase (Yunaeni 1998; Purwadaria
et al. 2003b). Kemampuan dan kecepatan mikrob tersebut dalam menghidrolisis
senyawa polimer menjadi senyawa monomer dipengaruhi beberapa faktor, diantaranya
kadar substrat, pH, suhu dan waktu inkubasi.
Beberapa enzim yang terlibat dalam proses degradasi selulosa adalah
endoglukanase, eksoglukanase, dan β-glukosidase. Dalam mendegradasi selulosa,
enzim endoglukanase dan eksoglukanase menghasilkan selobiosa yang akhirnya dapat
menghambat aktivitas kerja enzim itu sendiri. Beta-glukosidase berperan sebagai
penghidrolisis selobiosa menjadi senyawa yang lebih sederhana, yaitu glukosa, yang
dapat segera dimanfaatkan oleh makhluk hidup, dalam hal ini ternak unggas.
Proses biofermentasi mempunyai banyak keuntungan dibandingkan pengolahan
cara fisik dan kimia. Selain aman dan sederhana, biofermentasi juga memungkinkan
terjadinya peningkatan nilai nutrisi pada limbah pertanian dan industri. Namun
penggunaan enzim komersial untuk proses enzimatik pada limbah pertanian dan
industri tidak ekonomis, karena harganya yang mahal. Karena itu, perlu adanya
teknologi yang dapat meningkatkan daya cerna limbah pertanian tersebut dengan biaya
yang lebih murah. Produksi suatu enzim dapat ditingkatkan dengan penemuan strain
baru yang lebih berpotensi atau dapat juga melalui induksi strain mutan agar dapat
menghasilkan enzim yang diharapkan dengan jumlah yang lebih besar. Besarnya
manfaat kapang dan pentingnya peran enzim dalam mengkatalisis suatu reaksi,
memberi pemikiran bagi penulis untuk melakukan penelitian tentang enzim
β-glukosidase yang dihasilkan oleh kapang dari lingkungan rayap.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengisolasi kapang dari lingkungan rayap yang mampu menghasilkan
enzim β-glukosidase
2. Memproduksi enzim β-glukosidase
Manfaat Penelitian
Penelitian ini diharapkan dapat memberi informasi tentang karakter enzim
β-glukosidase agar mampu menghasilkan aktivitas yang optimal apabila digunakan
dalam campuran pakan.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah bahwa dalam lingkungan
sarang rayap terdapat kapang yang mampu menghasilkan enzim β-glukosidase dengan
TINJAUAN PUSTAKA
Selulosa dan Enzim Selulase
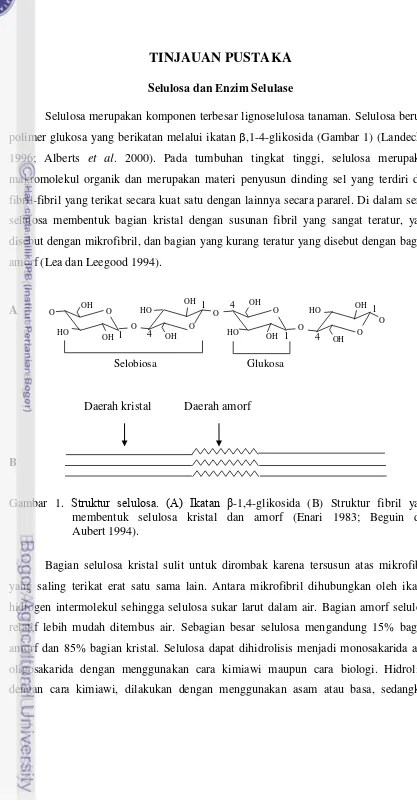
Selulosa merupakan komponen terbesar lignoselulosa tanaman. Selulosa berupa
polimer glukosa yang berikatan melalui ikatan β,1-4-glikosida (Gambar 1) (Landecker
1996; Alberts et al. 2000). Pada tumbuhan tingkat tinggi, selulosa merupakan
makromolekul organik dan merupakan materi penyusun dinding sel yang terdiri dari
fibril-fibril yang terikat secara kuat satu dengan lainnya secara pararel. Di dalam serat,
selulosa membentuk bagian kristal dengan susunan fibril yang sangat teratur, yang
disebut dengan mikrofibril, dan bagian yang kurang teratur yang disebut dengan bagian
amorf (Lea dan Leegood 1994).
A
Daerah kristal Daerah amorf
B
Gambar 1. Struktur selulosa. (A) Ikatan β-1,4-glikosida (B) Struktur fibril yang
membentuk selulosa kristal dan amorf (Enari 1983; Beguin dan Aubert 1994).
Bagian selulosa kristal sulit untuk dirombak karena tersusun atas mikrofibril
yang saling terikat erat satu sama lain. Antara mikrofibril dihubungkan oleh ikatan
hidrogen intermolekul sehingga selulosa sukar larut dalam air. Bagian amorf selulosa
relatif lebih mudah ditembus air. Sebagian besar selulosa mengandung 15% bagian
amorf dan 85% bagian kristal. Selulosa dapat dihidrolisis menjadi monosakarida atau
oligosakarida dengan menggunakan cara kimiawi maupun cara biologi. Hidrolisis
dengan cara kimiawi, dilakukan dengan menggunakan asam atau basa, sedangkan
hidrolisis secara biologi, disebut juga dengan cara enzimatik, dapat dilakukan dengan
menggunakan enzim selulase murni atau dengan mikroorganisme penghasil enzim
selulase (Hardjo et al. 1989).
Selulosa merupakan polimer yang terdiri dari 100-14.000 unit glukosa yang
berikatan melalui ikatan β,1-4-glikosida. Ikatan β ini menimbulkan rantai lurus
panjang yang membentuk serat dengan daya rentang tinggi (Alberts etal. 2000; Stryer
2000). Serat-serat selulosa pada tanaman terikat pada matrik protein dan senyawa
polisakarida lainnya. Matrik ini disusun oleh dua molekul polisakarida, yaitu
hemiselulosa dan pektin, yang komposisi keduanya berbeda antara spesies satu dengan
spesies lainnya. Serat dan molekul matriks tersebut dihubungkan oleh ikatan hidrogen
yang membentuk ikatan intermolekul dan intramolekul. Ikatan intermolekul terjadi
antara gugus OH dari atom C nomor enam dengan atom O pada ikatan β,1-4-glikosida.
Ikatan intramolekul terjadi antara gugus OH pada atom C nomor tiga dengan atom O
pada cincin piranosa (Lea dan Leegood 1994) (Gambar 2).
Gambar 2. Struktur molekul selulosa (Alberts et al. 2000)
Enzim selulase adalah kelompok enzim hidrolitik yang mempunyai kemampuan
menghidrolisis selulosa menjadi glukosa. Glukosa yang dihasilkan selanjutnya dapat
dimanfaatkan sebagai bahan makanan oleh manusia atau hewan, atau dapat juga
digunakan untuk memproduksi bahan-bahan kimiawi. Simanjuntak (1998) telah
membuktikan bahwa penggunaan kapang A. niger untuk memfermentasi bungkil inti
7
sawit dapat meningkatkan energi metabolisme. Suatu enzim bekerja secara spesifik,
dan dapat mempercepat reaksi dengan menurunkan energi aktivasi suatu reaksi kimia
(Lehninger 2000; Stryer 2000).
Enzim selulase adalah enzim yang dapat memutuskan ikatan glikosida β-1,4 di
dalam selulosa, selodekstrin, selobiosa dan turunan selulosa lainnya, dan
menguraikannya menjadi glukosa (Fogarty dan Kelly 1982; Landecker 1996). Enzim
selulase merupakan enzim induksi yang dihasilkan sebagai tanggapan terhadap selulosa
yang ada di lingkungan pertumbuhan organisme penghasilnya. Aktivitas enzim selulase
merupakan hasil kerja tiga tipe enzim yang saling berkaitan dari kompleks enzim
selulase, yaitu (i) endoglukanase, (ii) eksoglukanase, (iii) dan β-glukosidase (Whitaker
1994).
Endoglukanase [1,4 (1,3;1,4)-β-D-glukan 4-glukanohidrolase; EC 3.2.1.4]
menghidrolisis ikatan β-glikosida pada selulosa secara acak menghasilkan glukosa,
selobiosa, selodekstrin dan oligomer lainnya (Hoshino et al. 1994). Pada umumnya
enzim ini bekerja pada selulosa amorf dan selulosa tersubstitusi yang mudah larut
seperti carboxy methyl cellulose (CMC) (Tabel 1) dan hidroksietil selulosa, dan tidak
aktif pada selulosa kristal seperti katun dan avisel (suatu selulosa mikrokristalin)
(Whitaker 1994). Karena endoglukanase memiliki aktivitas yang sangat tinggi pada
substrat CMC (Hoshino et al. 1994) enzim ini disebut sebagai CMCase (Gong dan Tsao
1979). Tetapi Cai et al. (1999) menemukan aktivitas endoglukanase pada Volvariella
volvacea yang tinggi justru pada avisel, bukan pada CMC.
Eksoglukanase (sellobiohidrolase atau 1,4-β-D-glukan sellobiohidrolase; EC
3.2.1.91) merupakan komponen selulase yang memecah selulosa kristal dengan
menghilangkan gugus selobiosa pada ujung akhir nonreduksi rantai selulosa (Hoshino
et al. 1994). Endoglukanase dan selobiohidrolase dapat bekerja secara sinergis
menghidrolisis selulosa dengan optimum (Purwadaria 1997). Selobiohidrolase
menunjukkan aktivitas yang tinggi pada avisel, yang dapat mencapai 40%, tetapi
menunjukkan aktivitas yang rendah pada selulosa amorf seperti CMC. Karena
aktivitasnya yang tinggi pada avisel, eksoglukanase dikenal juga sebagai aviselase
Tabel 1. Hidrolisis berbagai substrat oleh enzim selulolitik (Enari 1983)
Beta-glukosidase (sellobiase atau β-D-glukosida glukohidrolase, EC 3.2.1.21)
merupakan enzim yang menghidrolisis selobiosa dan selooligomer menjadi glukosa,
dan menghilangkan glukosa dari ujung akhir nonreduksi rantai selodekstrin yang
pendek (Whitaker 1994). Eksoglukohidrolase dan β-glukosidase umumnya terdapat
pada substrat yang mengandung selobiosa (dua unit glukosa), hingga seloheksaosa
(enam unit glukosa). Kedua enzim tersebut dapat dibedakan berdasarkan aktivitasnya
terhadap selobiosa dan seloheksaosa. β-glukosidase lebih cepat menghidrolisis
selobiosa daripada seloheksaosa, sementara eksoglukohidrolase bertindak sebaliknya.
Enzim β-glukosidase sangat berperan sebagai penghidrolisis selobiosa, yang menjadi
penghambat aktivitas eksoglukanase dan endoglukanase (Takano 1992; Whitaker
1994).
Enzim selulase dan hemiselulase merupakan dua jenis enzim yang dihasilkan
oleh sebagian besar kapang. Enzim selulase yang dihasilkan oleh kapang genus
Trichoderma sebagian besar merupakan enzim selobiohidrolase (Kim et al. 1994;
Jorgensen et al. 2003), sedangkan enzim selulase yang berasal dari genus Aspergillus,
komponen terbesarnya adalah enzim β-glukosidase (Kader dan Omar 1998; Juhăsz
et al. 2003; Purwadaria et al. 2003a). Aktivitas sinergis dari beberapa spesies dapat
menghasilkan degradasi selulosa dan hemiselulosa secara optimum. Campuran 20%
volume enzim yang berasal dari Eupinicillium javanicum (tinggi aktivitas CMCase,
β-D-mannanase dan α-D-galaktosidase) dan 80% volume enzim A. niger (tinggi
aktivitas β-glukosidase, β-D-mannosidase) dapat meningkatkan gula pereduksi pada
POME (Palm Oil Mill Effluent) sampai 55% (Purwadaria et al. 2003a). Limbah kertas
9
menghasilkan aktivitas β-glukosidase tertinggi (3.07 IU/ml) setelah 7 hari inkubasi
(Juhăsz et al. 2003).
Mekanisme Penguraian Selulosa
Dalam hidrolisis selulosa terdapat tiga komponen enzim yang terlibat, yaitu
endoglukanase, selobiohidrolase, dan β-glukosidase (Gambar 3). Penguraian selulosa
dimulai pada daerah amorf oleh endoglukanase secara acak sehingga membentuk rantai
yang terbuka bagi aktivitas selobiohidrolase. Aktivitas selibiohidrolase membebaskan
unit selobiosa dan selodektrin dari ujung rantai selulosa. Endoglukanase selanjutnya
menyerang pada lapisan kedua dari serat selulosa dan diikuti oleh aktivitas
selobiohidrolase. Akhirnya selobiosa dan selooligosakarida yang terbentuk dihidrolisis
oleh enzim β-glukosidase membentuk glukosa.
•
•
nSelobiosa dan glukosa
selooligosakarida
Gambar 3. Mekanisme hidrolisis selulosa oleh kompleks selulase (Enari 1983)
EG atau CBH
Selobiohidrolase (CBH) Endoglukanase (EG)
β-Glukosidase
Regulasi biosintesis selulase terjadi karena selobiosa dalam jumlah kecil pada
substrat selulosa dan merupakan hasil hidrolisis dari selulase masuk ke dalam sel
melalui sistem transport aktif (Gambar 4). Sebagian selobiosa yang masuk ini akan
dihidrolisis menjadi glukosa oleh enzim β-glukosidase konstitutif. Selobiosa
intraseluler kemudian menjadi induser aktif yang bereaksi dengan protein represor,
sehingga mengakibatkan protein represor menjadi tidak aktif. Akibatnya terjadi induksi,
yang kemudian diikuti dengan proses transkripsi dan translasi enzim selulase. Selulase
yang disintesis didalam sel kemudian dikeluarkan melintasi membran melalui
mekanisme pelepasan yang spesifik. Selulase ekstraseluler ini menghidrolisis selulosa
menjadi selobiosa dan glukosa ekstraseluler. Selobiosa dan glukosa masuk kedalam sel
dan terlibat dalam proses induksi dan represi. Selobiosa yang tinggi memicu aktivitas
dan sintesis enzim β-glukosidase, tetapi kadar glukosa intraseluler yang tinggi dapat
mempengaruhi sintesis selulase melalui mekanisme represi katabolit dan juga
menghambat aktivitas β-glukosidase intraseluler. Akumulasi glukosa di dalam sel
memicu aktivitas enzim glukosa oksidase, yang akan mengoksidasi glukosa menjadi
asam glukonat dan glukonolakton. Glukonolakton dapat menghambat aktivitas
β-glukosidase (Gong dan Tsao 1979; Landecker 1996).
Enzim β-glukosidase
Enzim β-glukosidase menghidrolisis dengan cepat substrat dengan bobot
molekul (BM) yang kecil. Berdasarkan substrat yang dihidrolisis, enzim β-glukosidase
dikelompokkan menjadi tiga jenis, yaitu selobiase, aril-β-glukosidase, dan ekso-β−1,4
-glukan glukohidrolase. Selobiase menghidrolisis selobiosa. Aril-β-glukosidase
menghidrolisis p-nitrophenilglukosida (pNPG), dan ekso-β−1,4-glukan glukohidrolase
menghidrolisis selooligomer (Gong dan Tsao 1979). Selain aktif pada substrat yang
mengandung berbagai p-nitrofenilglukosida, enzim β-glukosidase diketahui juga
menghidrolisis ikatan β-D-galaktosida, β-D-fukosida dan α-L-arabinosida pada
Rhodoturulaminuta(Onishi dan Tanaka 1996; Li et al. 2001).
Enzim β-glukosidase pada Aspergillus merupakan enzim konstitutif intraseluler.
Enzim konstitutif yaitu enzim yang dapat diproduksi tanpa adanya suatu induser.
11
Transkripsi dan Translasi
(Gong dan Tsao 1979; Stryer 2000). Aktivitas enzim β-glukosidase dapat diinduksi
secara optimum oleh substrat yang mengandung campuran filter paper dan pati
(Landecker 1996), tetapi dihambat oleh glukosa, secara kuat oleh D-δ-glukonolakton
(Chen et al. 1998; Svasti et al, 1999; Stryer 2000, Parry et al. 2001) dan oleh adanya
Gambar 4. Model regulasi biosintesis selulase (Gong & Tsao 1979) +
Sebaliknya aktivitas enzim β-glukosidase pada daun cassava ternyata tidak nampak
dihambat oleh gula ataupun monosakarida lain seperti galaktosa dan fruktosa (Yeoh
dan Woo 1992). Bahkan Kumalasari (2003) mendapatkan aktivitas enzim
β-glukosidase yang meningkat 2 kali lipat dengan adanya penambahan glukosa 250
ppm. Sementara aktivitas β-glukosidase yang meningkat pada buah tomat diperkirakan
sebagai respon adanya infeksi jamur patogen (Georgieva et al. 2004).
Seperti halnya enzim yang lain, aktivitas enzim β-glukosidase diantaranya
dipengaruhi oleh pH, suhu, konsentrasi substrat, konsentrasi enzim dan waktu inkubasi.
Suhu dapat meningkatkan aktivitas enzim hingga dua kali lipat setiap kenaikan suhu
10 ºC sampai mencapai suhu optimum, setelah itu pada suhu ekstrim protein enzim
akan mengalami denaturasi hingga enzim menjadi tidak aktif lagi. Begitu pula halnya
dengan pH, pada pH optimum aktivitas enzim mencapai maksimum, tetapi di luar pH
optimum aktivitasnya akan menurun. Suhu optimum suatu enzim berbeda antara
spesies satu dengan spesies lainnya. Sebagian besar enzim mempunyai pH optimum
4 - 8. Untuk kapang pH optimum pada umumnya berada dibawah 7 (Landecker 1996).
Konsentrasi substrat dan banyaknya enzim serta waktu inkubasi yang semakin
bertambah akan meningkatkan aktivitas enzim sampai tingkat tertentu, kemudian
setelah itu aktivitasnya akan tetap (Murray et al. 2000). Enzim β-glukosidase
mempunyai suhu optimum 50 ºC (Asada 1999; Purwadaria et al. 2003a) dan pH
optimum 5.0 (Asada 1999), sedangkan suhu optimum untuk mikroorganisme termofilik
antara 45 – 65 ºC (Lin et al.1999). Desrochers et al.(1981) menyatakan bahwa pH
optimum untuk β-glukosidase dari S. commune adalah 5.3 dan suhu optimum pada
30 ºC. Enzim β-glukosidase yang diekstraksi dari rayap (Glyptotermes montanus)
mempunyai pH optimum 5.8, dan suhu optimum 42 – 45 ºC (Purwadaria et al. 2003c).
Pada daun cassava β-glukosidase mempunyai pH optimum 4.7 - 4.9 (Yeoh dan Woo
1992). Aktivitas enzim β-glukosidase dari A. niger dan R. minuta IFO879
masing-masing stabil selama 230 hari pada suhu 4 ºC (Yan dan Liau 1998).
Pemekatan dan Pemisahan Enzim
Pemekatan protein merupakan tahap awal dari prosedur pemurnian enzim.
13
pelarut organik seperti alkohol atau aseton. Pengendapan protein dengan menggunakan
pelarut organik berdasarkan pada pengurangan kelarutan protein dan konstanta
dielektrika pelarut. Semakin banyak pelarut organik yang ditambahkan, semakin
berkurang daya solvasi air dan muatan pada permukaan molekul protein yang hidrofilik
dan molekul-molekul pelarut organik akan mendekati daerah hidrofobik disekitar
permukaan protein. Hal ini akan menurunkan kelarutan dan menyebabkan
molekul-molekul protein berinteraksi satu dengan lainnya, dan akhirnya akan terjadi
pengendapan. Prosedur pengendapan dengan menggunakan pelarut organik dilakukan
pada suhu rendah. Pada suhu diatas 10 ºC, konformasi protein akan mengalami
perubahan sehingga molekul-molekul pelarut organik dapat masuk ke bagian dalam
struktur protein dan merusak interaksi hidrofobik, akibatnya protein akan mengalami
denaturasi (Scopes 1987, Harris 1989).
Teknik pemisahan β-glukosidase dari kompleks selulase dilakukan sama seperti
pemurnian protein yang lainnya. Beberapa contoh metode pemurnian yang digunakan
untuk mengisolasi β-glukosidase terdapat pada Tabel 2. Berat molekul (BM) enzim
β-glukosidase dapat ditentukan dengan menggunakan metode pemisahan elektroforesis.
Elektroforesis menggunakan gel poliakrilamid ditambah dengan adanya deterjen
anionik, SDS, digunakan untuk memisahkan protein menjadi subunit-subunit protein
dan menentukan masing-masing berat molekulnya. SDS-PAGE dengan sistim
diskontinu dari Laemmli (1970) digunakan untuk menentukan homogenitas dan BM
selulase. Larutan contoh yang mempunyai aktivitas enzim β-glukosidase selanjutnya
dapat dideteksi dengan menggunakan analisis zimografi. Analisis zimografi yang
digunakan untuk mengidentifikasi pita-pita protein pada gel poliakrilamid dapat
dilakukan melalui tiga cara (Purwadaria 1988), yaitu :
1. Analisis Zimografi dengan metode elusi
Metode ini digunakan bila substrat tidak larut. Pita-pita protein dipisahkan
dengan memotong gel menjadi strip-strip. Penentuan aktivitas enzim dilakukan
dengan mengelusi enzim dari pita.
2. Analisis Zimografi dengan aktivitas pewarnaan
Metode aktivitas pewarnaan menunjukkan lokasi pita protein yang mempunyai
Tabel 2. Metode pemurnian untuk mengisolasi β-glukosidase dari komponen selulase
Organisme Metode pemurnian Komponen Enzim
Schizophyllum commune Bio-Gel P200 β-glukosidase
(Desrochers et al. 1981) SDS-PAGE (BM 97 kDa)
Ruminococcus albus DEAE Bio-Gel A β-glukosidase hasil kloning
(Takano et al. 1992)
Pichia etchellsii PAGE β-glukosidase hasil kloning
(Pandey dan Mishra 1995) Analisis Zimogram (BM 200 kDa)
Rhodotorulaminuta IFO879 DEAE-Toyopearl β-glukosidase
(Onishi & Tanaka 1996) Butyl-Toyopearl (BM 144 kDa, dimer)
p-aminobenzyl 1-thio-
β-D-glukopiranosida
Thermoascus aurantiacus (NH4)2SO4 β-glukosidase
(Parry et al. 2001) Sephacryl 300 (BM 120 kDa, BM protein
SDS-PAGE Analisis Zimogram
15
poliakrilamid direaksikan dengan 4-metilumbelliferil β-D-glukosida (MUG)
setelah gel dicuci dengan bufer asetat pH 4 (Parry et al. 2001).
Metilumbelliferon yang dilepaskan akan berpendar oleh adanya sinar UV.
3. Analisis Zimografi dengan mencampurkan substrat dalam gel
Substrat p-NPG yang dicampurkan pada gel elektroforesis akan menghasilkan
pita berwarna kuning.
Identifikasi aktivitas enzim β-glukosidase secara semi kuantitatif dapat
dilakukan dengan menggunakan eskulin (6,7-dihidrocoumaric 6-glikosida) yang
ditambahkan pada medium pertumbuhan. Enzim β-glukosidase akan memotong eskulin
menjadi eskuletin (6,7-dihidroksi coumarin) yang akan membentuk senyawa kompleks
besi fenolat yang berwarna coklat atau hitam bila bereaksi dengan ion feri (Fe3+)
((James et al. 1997; Gratner 2006) (Gambar 5). Selain itu, komponen enzim
β-glukosidase dapat ditentukan aktivitasnya dengan mengukur pelepasan p-nitrofenol
(p-NP) dari hasil hidrolisis p-nitrofenil glukosida (p-NPG) (Lin et al. 1999). Satu unit
aktivitas enzim didefinisikan sebagai jumlah enzim yang dibutuhkan untuk
mengkatalisis pembentukan satu mikromol (10-6 mol) p-nitrofenol per menit pada
kondisi assay.
Gambar 5. Pemotongan eskulin oleh adanya aktivitas enzim β-glukosidase
(James et al. 1997; Gratner 2006)
Sumber Karbon
Eskuletin β-D-Glukosa
yg dikeluarkan
Kompleks Besi Fenolat
Pemanfaatan Kapang
Sel-sel mikrob merupakan pusat penghasil berbagai enzim. Produksi enzim dari
mikroorganisme mempunyai beberapa keuntungan, diantaranya: lebih mudah
ditumbuhkan pada lingkungan yang terkontrol, cepat beregenerasi, mudah dilakukan
rekayasa genetika, dan siklus produksi yang singkat, bila dibandingkan dengan enzim
yang berasal dari tumbuhan maupun hewan (Landecker 1996). Beberapa jenis mikrob
dapat tumbuh pada substrat yang banyak mengandung selulosa dikarenakan
kemampuannya menghasilkan enzim yang dapat mendegradasi derivat selulosa dan
selulosa amorf. Organisme lain penghasil enzim selulase adalah rayap, yang mampu
hidup di lingkungan yang mengandung lignoselulosa seperti kayu lapuk, rumput
ataupun sampah tumbuhan pada berbagai kondisi. Kapang bersimbiosis dengan rayap
dalam mendegradasi selulosa yang terdapat pada kayu. Karena kemampuannya
menguraikan selulosa menjadi molekul glukosa yang relatif mudah memasuki dan
dimanfaatkan oleh sel, rayap berpotensi digunakan sebagai makanan tambahan untuk
ternak (Purwadaria et al. 2003c).
Kapang mempunyai aplikasi yang sangat luas sebagai media penelitian dalam
genetika, biokimia, dan penelitian nutrisi. Beberapa spesies kapang menghasilkan
produk metabolit yang bermanfaat secara komersial, dan menjadi pedoman untuk
mikologi industri, seperti kapang yang digunakan untuk menghasilkan enzim,
antibiotik, dan bermacam-macam asam organik (Tabel 3). Dalam upaya memperbaiki
mutu pakan, bantuan mikrob diperlukan dalam suatu proses fermentasi. Selain proses
fermentasi, keberhasilan teknik ini ditentukan oleh jenis mikrob yang digunakan.
Umumnya jenis mikrob yang digunakan adalah yang mempunyai aktivitas selulolitik
yang tinggi dalam mendegradasi selulosa dan derivatnya, dan mampu meningkatkan
17
Tabel 3. Produk metabolit yang dihasilkan oleh kapang (Landecker, 1996)
Produk metabolit Jenis kapang
Asam organik
Asam sitrat Asam glukonat Asam Itakonat
Enzim
Amilase, amiloglukosidase
Invertase Laktase
Enzim-enzim pektat
Protease Rennet
Antibiotik dan Obat-obatan
Agen antihiperkolesterol
Cephalosporin
A. niger, Botrytis cinerea, Penicillium notatum
Aspergillus spp. Mucor pusillus
Cryphonectria parasitica, Mucor spp.
Cephalosporium caerulens, P. citrinum, Monascus ruber
Acremonium chrisogenum Claviceps paspali
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Teknologi Pakan, Balai Penelitian Ternak,
Departemen Pertanian, Ciawi, Bogor. Waktu yang dibutuhkan 13 bulan, dimulai pada
bulan Juli 2005 sampai Agustus 2006.
Bahan dan Alat
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah polard dari
PT. Indofeed-Bogor, Sigmasel-20, kertas saring Whatman No.1, esculin
(6,7-dihydro-coumeric 6-glycoside), 4-metilumbelliferil β-D-glukosida (MUG), p-nitrofenil-β
-D-glukosida (p-NPG), aseton, coomassie brilliant blue (CBB), dinitrosalicylic acid
(DNS), potato dextrose agar (PDA), ekstrak khamir, bacto pepton, streptomisin,
NaN3
Alat
, D-glukosa, serum bovin albumin, HMW Marker Kit (Amersham Pharmacia
Biotech). Sumber isolat diperoleh dari kayu lapuk yang menjadi sarang rayap.
Alat-alat yang digunakan adalah pipetmikro, sentrifus berpendingin Beckman
GS-15R, sentrifus Clements Model B-Universal, autoklaf (TOMY SEIKO, Jepang),
Spektrofotometer U 2000 (Double wavelength Double Beam, Hitachi 557), pH meter
Horiba, Hoefer Macro Vue UV-20 transiluminator (Hoefer Scientific Inst, USA),
piranti elektroforesis Mini VE Hoefer (Amersham Pharmacia Biotech), kuvet, neraca
analitik Mettler P163 (ketelitian 1.0 mg) dan H 80 (ketelitian 0.1 mg), vorteks, ose,
rotaryshaker, blender, peralatan gelas, dan alat-alat lainnya.
Metode Penelitian Isolasi Kapang Selulolitik
Kapang diisolasi dari kayu lapuk yang menjadi sarang rayap. Mula-mula kapang
yang terdapat pada kayu dilarutkan dengan larutan 0.85% NaCl steril, kemudian
digoreskan pada medium Mandels (Lampiran 1) yang mengandung 1% bacto agar,
19
langsung yaitu menggoreskan kapang pada medium Mandels. Medium terdiri dari dua
lapisan, dimana lapisan atas mengandung Sigmasel-20 0.5% sebagai sumber karbon
dan streptomisin 100 ppm yang digunakan untuk mencegah pertumbuhan bakteri.
Kultur diinkubasi pada suhu ruangan dengan kondisi aerob. Isolat yang
menghasilkan selulase akan membentuk zona bening di sekitar koloni isolat. Isolat
kemudian dipindahkan pada medium PDA (Lampiran 4) untuk mendapatkan satu jenis
koloni yang murni. Tiap-tiap koloni dipisahkan dan disimpan pada medium agar miring
PDA. Tiga isolat pembanding koleksi Balitnak diremajakan pada medium agar miring
dan diinkubasi pada kondisi sama.
Penapisan Kapang Penghasil β-glukosidaseSecara Semi Kuantitatif
Penapisan dilakukan berdasarkan rasio (perbandingan) diameter daerah hitam
terhadap koloni pada medium Dubos (Lampiran 4) yang ditambah 0.02% ekstrak
khamir, 0.1% eskulin, dan 0.05% Fe-NH4
Isolat yang dipilih untuk memproduksi enzim β-glukosidase ditanam pada
media agar miring PDA dan diinkubasi selama 5 hari (Haryati etal. 1997). Kemudian
-sitrat. Kapang yang mempunyai aktivitas
enzim β-glukosidase akan memotong eskulin membentuk eskuletin yang bila bereaksi
dengan ion feri membentuk endapan yang berwarna hitam (Gratner 2006). Setelah
diinkubasi selama 4 hari, ratio antara diameter koloni dengan diameter zona hitam
diukur. Dari hasil pengamatan ini, dipilih beberapa isolat yang mempunyai aktivitas
β-glukosidase terbaik untuk digunakan sebagai penghasil enzim.
Pembuatan Polard NaOH
Kedalam 1 liter larutan NaOH 0.5% (b/v) ditambahkan sebanyak 50 gram
polard kering. Campuran dididihkan selama 60 menit dalam penangas air. Selama
pemanasan dilakukan pengadukan. Setelah didinginkan sampai suhu kamar, campuran
disaring dengan kain tipis dan dicuci dengan air sampai air perasan mempunyai pH
netral. Polard yang telah netral kemudian diletakkan merata dalam wadah dan
dikeringkan dengan blower pada suhu 40 °C selama 2 hari. Polard yang telah kering
digiling dengan blender.
spora disuspensikan dalam 5 ml larutan NaCl 0.85%. Sebanyak 2 ml inokulum
diinokulasikan pada 50 ml media Mandels yang mengandung 3% polard NaOH sebagai
sumber karbon, 0.3% ekstrak khamir, dan 0.075% bactopepton. Selanjutnya diinkubasi
pada suhu 30 °C dalam inkubator bergoyang dengan kecepatan 150 rpm selama 6 hari.
Masa inkubasi dihentikan dengan menambahkan 0.2% NaN3. Filtrat enzim dipisahkan
dengan sentrifugasi pada kecepatan 7000 rpm dengan suhu 4 °C selama 20 menit.
Untuk mengetahui aktivitas enzim, dilakukan pengujian pada hari ke 5, 6 dan 7.
Penentuan Aktivitas Enzim
a. Penentuan Aktivitas Total Selulase (Filter Paper-ase)
Aktivitas Filter Paper-ase (FPase) ditentukan berdasarkan metode Mandels etal.
(1976). Sebanyak 0.4 ml filtrat enzim ditambah larutan bufer asetat pH 5.5 sampai
volumenya 1.5 ml. Selanjutnya ditambahkan kertas saring Whatman No.1 (1 x 6 cm2
Aktivitas FPase (U/ml) = x fp 2 x ml enzim yang dipipet
fp = faktor pengenceran
b. Penentuan Aktivitas β-glukosidase
),
divorteks dan diinkubasi pada suhu 50 °C selama 60 menit. Reaksi dihentikan dengan
penambahan 3 ml pereaksi DNS (Lampiran 4) (Miller 1959), campuran kemudian
divorteks dan dipanaskan dalam air mendidih selama 15 menit, setelah pemanasan
selesai campuran ditambah 5 ml akuades. Filtrat enzim dengan perlakuan yang sama
tanpa inkubasi digunakan sebagai kontrol. Absorbansi diukur pada panjang gelombang
540 nm. Blanko terdiri dari 1.5 larutan buffer asetat, 3 ml larutan DNS dan 5 ml
akuades.
Kadar glukosa yang dihasilkan dihitung berdasarkan kurva standar dengan
konsentrasi glukosa 0.0 - 0.6 mg dari larutan induk 3 mg/ml. Produksi 2 mg/ml glukosa
pada kondisi percobaan setara dengan 0.185 unit FPase/ml (Mandels etal. 1976).
0.185 x (mg glukosa sampel - mg glukosa kontrol)
Aktivitas β-glukosidase ditentukan dengan mengukur pelepasan p-nitrofenol
21
p-NPG 0.3% (b/v) diprainkubasi selama 10 menit pada suhu 50 °C. Sampel terdiri
dari 0.5 ml filtrat enzim, 0.5 ml larutan bufer asetat pH 5.0, dan 0.5 ml p-NPG 0.3%
dimasukkan dalam tabung reaksi. Kontrol terdiri dari 0.5 ml larutan buffer dan 0.5 ml
p-NPG. Sampel dan kontrol divorteks dan diinkubasi pada suhu 50 °C selama 60 menit.
Selanjutnya ditambah 1 ml Na2CO3 1 M. Untuk kontrol penambahan 0.5 ml filtrat
enzim dilakukan setelah penambahan Na2CO3. Sebagai blanko digunakan 1 ml
akuades, 0.5 ml larutan buffer asetat pH 5.0 dan 1 ml Na2CO3. Absorban diukur pada
panjang gelombang 400 nm. Kadar p-nitrofenol yang dihasilkan ditentukan berdasarkan
kurva standar dengan konsentrasi nitrofenol 0 - 24 µg/ml dari larutan induk 30 µg/ml.
Bila filtrat enzim terlalu pekat, dilakukan pengenceran hingga mencapai kadar
nitrofenol standar. Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang
dibutuhkan untuk mengkatalisis pembentukan satu mikromol (10-6
Aktivitas (U/ml) = x fp
ß-glukosidase Waktu inkubasi (menit) x BM nitrofenol (139 µg/µmol)
c. Penentuan Kadar Protein dan Aktivitas Spesifik
Penentuan kadar protein dilakukan berdasarkan metode Bradford (1976).
Sebanyak 0.2 ml filtrat enzim ditambahkan 5 ml pereaksi Bradford (analisis
semimakro) kemudian divortek. Absorbansi diukur pada panjang gelombang 595 nm
setelah 2 menit dan sebelum 1 jam. Blanko menggunakan 0.2 ml akuades yang
direaksikan dengan 5 ml pereaksi Bradford. Kadar protein ditentukan dari kurva standar
larutan BSA pada kisaran 0.1 sampai 1.0 mg protein/ml. Perhitungan aktivitas spesifik
enzim β-glukosidase dapat ditentukan dengan:
1000 (µg/mg)
mol) p-nitrofenol
per-menit pada kondisi yang ditentukan.
[nitrofenol]sampel (µg/ml) - [nitrofenol]kontrol (µg/ml)
Aktivitas Spesifik (U/mg) = x Aktivitas enzim (U/ml)
Karakterisasi Enzim β-glukosidase a. Penentuan pH dan Suhu Optimum Enzim
Penentuan pH optimum dilakukan dengan menguji aktivitas enzim pada kisaran
pH 4.2, 4.6, 5.0, 5.4, 5.8 dan 6.2. Sedangkan penentuan suhu optimum dilakukan
dengan menguji aktivitas enzim pada variasi suhu 40, 50, 55, 60, 65, dan 70 ºC.
b. Penentuan pH dan Suhu Stabilitas enzim
Penentuan pH stabilitas dilakukan dengan menginkubasi enzim dalam bufer
asetat (pH 4.2, 4.6, 5.0, 5.4, 5.8, dan 6.2) pada suhu optimum selama 30 menit. Setelah
inkubasi berakhir, aktivitas enzim ditentukan pada kondisi pH optimum dan suhu
optimum.
Penentuan suhu stabilitas dilakukan dengan menginkubasi enzim dalam bufer
optimum pada variasi suhu 28, 40 dan 80 ºC. Pengambilan filtrat enzim untuk setiap
suhu masing-masing dilakukan setiap hari selama 4 hari, setiap 30 menit selama 180
menit dan setiap 30 detik selama 270 detik. Aktivitas enzim ditentukan pada kondisi pH
optimum dan suhu optimum.
c. Pengendapan Protein dengan Aseton
Pengendapan protein dengan aseton dilakukan pada kisaran 60 sampai 90%.
Aseton dingin ditambahkan sedikit demi sedikit sambil diaduk dengan stirer dan suhu
campuran dijaga stabil antara -5 dan 0 ºC, lalu campuran dibiarkan selama 30 menit.
Endapan yang terbentuk dipisahkan dengan sentrifus pada kecepatan 7000 rpm (suhu
4 ºC, 15 menit). Larutan didekantasi dan endapannya dilarutkan kembali ke volume
semula dengan bufer asetat pH optimum. Kemudian ditentukan perolehan kembali
kadar protein dan aktivitas β-glukosidase.
d. Pengaruh EDTA dan Ion logam terhadap Aktivitas Enzim
Pengaruh EDTA dan ion logam ditentukan dengan menambahkan
masing-masing EDTA, MgCl2, ZnCl2, CuCl2, MnCl2, FeCl3, CoCl2, CaCl2, dan BaCl2 dengan
23
terdiri dari enzim, substrat p-NPG 0.3%, dan bufer asetat, selanjutnya diinkubasi
selama 1 jam pada kondisi suhu dan pH optimum.
Penentuan Bobot Molekul Enzim dengan Teknik Zimogram
Bobot molekul enzim ditentukan dengan menggunakan SDS-PAGE (Sodium
Dodecyl Sulphate-Polyacrilamida Gel Electrophoresis) (Laemmi 1970). Protein standar
HMW yang digunakan terdiri dari Myosin (BM = 212.000), α-2-makroglobulin (BM =
170.000), β-galaktosidase (BM = 116.000), Transferrin (BM = 76.000), Glutamat dehidrogenase (BM = 53.000).
a. Pembuatan Gel Poliakrilamida SDS-PAGE
Komposisi untuk separating gel (8%) dibuat dengan cara mencampurkan 5.3 ml
larutan akrilamida (30% T), 9.39 ml akuades, 5 ml bufer Tris-HCl 1 M pH 8.8, 0.2 ml
SDS 10% (b/v), 10 μl TEMED, dan 200 μl amonium persulfat 10% (b/v). Larutan
diaduk hingga homogen dan siap diisikan pada plate gel, gel akan terbentuk setelah
30 - 60 menit.
Stacking gel (5%) dibuat dengan komposisi yang terdiri dari 2.5 ml larutan
akrilamida (30% T), 8.5 ml akuades, 3.75 ml bufer Tris-HCl 1 M pH 6.8, 0.12 ml SDS
10% (b/v), 8 μl TEMED, dan 75 μl amonium persulfat 10% (b/v). Larutan diaduk
hingga homogen dan siap diisikan pada plate gel.
b. Preparasi Sampel Protein
Sebanyak 720 μl sampel dimasukkan dalam vial 2 ml dan ditambahkan 30 μl
bromfenolblue 0.05% (b/v), dan 250 μl bufer sampel [(larutan sampel + BPB) : bufer sampel = 3:1 ]. Bufer sampel merupakan campuran 10 ml β-merkaptoetanol, 20 ml bufer stacking gel, 20 ml gliserol, dan 4 g SDS.
Preparasi protein standar dilakukan dengan melarutkan 175 ml μg HMW marker
dalam 1000 μl akuades, dan ditambahkan Bufer sampel. Untuk mengetahui batas
pergerakan protein ditambahkan pewarna bromfenolblue dengan perbandingan sama
dengan larutan sampel. Larutan selanjutnya dipanaskan dalam penangas 100 ºC selama
dan protein standar siap diinjeksikan ke dalam sumur-sumur elektroforesis. Pengisian
larutan sampel dan protein standar ke dalam sumur pada gel akrilamida masing- masing
sebanyak 5 μl dengan menggunakan syringe.
c. Elektroforesis
Gel yang telah ditempatkan pada modul elektroforesis diatur sehingga
permukaan gel terendam dalam bufer elektroda. Elektroforesis dilakukan dengan
mengalirkan arus listrik mula-mula 15 mA untuk tiap gel. Voltase maksimum 120 volt
dan daya maksimum 30 Watt. Setelah pergerakan sampel mencapai separating gel,
aliran arus listrik ditingkatkan 20 mA tiap gel, sedangkan voltase dan daya konstan.
Proses pemisahan dihentikan setelah 1 jam, atau setelah marker warna biru berada
sekitar 0.5 cm dari batas separating gel. Gel hasil elektroforesis dilepas dari cetakan
dengan menggunakan spatula, dan gel siap untuk pewarnaan protein atau analis
zimografi β-glukosidase.
d. Pewarnaan Protein
Sebelum dilakukan pewarnaan, gel terlebih dahulu direndam dalam larutan
TCA 12.5% selama 24 jam dalam lemari pendingin atau direndam dalam larutan
fixative (50% v/v methanol dalam air) selama 1 jam. Gel kemudian dikeluarkan dari
larutan fixative dan dicuci dengan air, selanjutnya direndam dalam larutan pewarna
Coomassie blue R-250 selama 4 jam. Larutan pewarna dibuat dengan melarutkan
Coomassie nlue R-250 dalam metanol : asam asetat : air = 4 : 1 : 4. Kelebihan warna
dihilangkan dengan larutan destaining (10% v/v metanol, 7.5% v/v asam asetat dalam
air) dengan 2 - 3 kali penggantian sampai diperoleh pita-pita protein berwarna biru
dengan latar belakang jernih, kemudian dibilas dengan air. Bobot molekul sampel
ditentukan dengan menghitung nilai Rf dari pita-pita yang nampak, kemudian diplotkan
pada kurva standar log BM terhadap Rf protein standar.
Jarak pergerakan pita dari tempat awal (cm)
25
e. Analisis Zimografi
Pita protein yang mempunyai aktivitas β-glukosidase diidentifikasi dengan
menggunakan metode Parry et al. (2001). Setelah elektroforesis selesai, gel dilepas dari
cetakan dan jarak migrasi bromofenol biru diukur dari batas atas gel pemisah. Gel
untuk analisis zimografi terlebih dahulu dicuci dengan 50 mM bufer natrium asetat pH
4.0 yang mengandung 25% isopropanol selama 15 menit dan 2 kali dalam bufer yang
sama tetapi tanpa mengandung isopropanol, masing-masing selama 30 menit. Gel
kemudian diinkubasi dalam 0.5 mM MUG yang dilarutkan dalam 50 mM bufer natrium
asetat pH 4.0 yang telah diencerkan 10 kali pada suhu 40 - 42 ºC selama 15 menit.
Adanya aktivitas β-glukosidase dapat diketahui dengan melihat metilumbelliferon yang
akan berpendar di bawah sinar UV.
Identifikasi Isolat Kapang
Identifikasi isolat kapang dilakukan oleh IPB Culture Collection di
Laboratorium Mikologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan
Alam IPB Bogor melalui pengamatan makroskopis dan mikroskopis (Lampiran 10).
Media yang digunakan untuk identifikasi adalah Malt Ekstrak Agar (MEA)
Penapisan Kapang Secara Semi Kuantitatif
Dari proses isolasi kapang yang ditumbuhkan pada medium agar Mandels
(Lampiran 4) yang mengandung 0.5% Sigmasel-20 didapat 22 jenis isolat kapang
(Tabel 4). Ke 22 jenis isolat kapang tersebut kemudian diuji kemampuannya untuk
membentuk daerah hitam dalam medium Dubos yang mengandung 0.1% eskulin dan
0.05% Fe-NH4
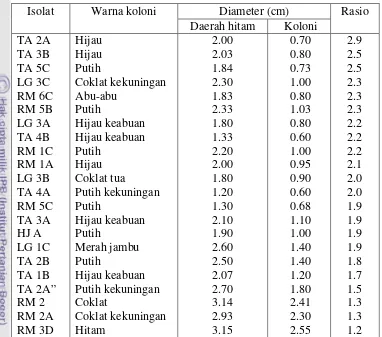
Dari hasil pengamatan yang dilakukan pada hari ke 4, isolat-isolat kapang ini
membentuk kisaran nisbah diameter daerah hitam terhadap diameter koloni antara 1.2
dan 2.9. Nisbah tertinggi dihasilkan oleh isolat TA 2A dan terendah oleh isolat RM 3D.
Kemampuan isolat kapang membentuk daerah hitam disekitar koloni menunjukkan
bahwa kapang tersebut menghasilkan enzim β-glukosidase yang mampu memutuskan
ikatan β-1,4-glikosida pada struktur selulosa. Untuk diameter daerah hitam terbesar dihasilkan oleh isolat RM 3D, yaitu 3.15, dan terkecil oleh isolat TA 4A, yaitu 1.2.
Berdasarkan hasil pengujian nisbah diameter daerah hitam terhadap diameter koloni
dan diameter daerah hitam yang diperoleh, dipilih dua isolat dengan nisbah diameter
daerah hitam terhadap diameter koloni yang tertinggi, yaitu TA 2A dan TA 3B, dan dua
isolat dengan diameter daerah hitam yang terbesar; yaitu RM 2 dan RM 3D. Meskipun
nilai nisbah diameter daerah hitam terhadap diameter koloni tinggi, namun belum tentu
aktivitas enzimnya tinggi, begitu juga sebaliknya (Ardiningsih 2002). Ke 4 isolat hasil
seleksi ini kemudian diuji secara kuantitatif aktivitas enzim β-glukosidasenya. Selain ke
4 isolat hasil isolasi dari kayu yang menjadi sarang rayap tersebut, juga diamati 3 isolat
kapang koleksi unggulan Balitnak, yaitu BS4, S11 dan SS240. Isolat BS4
(Eupenicillium javanicum) merupakan hasil isolasi Haryati (1997), S11 (Penicillium
nalgiovense Laxa) merupakan hasil isolasi Nurbayti (2002) dari sarang rayap,
sedangkan SS240 merupakan isolat mutan Penicillium nalgiovense S11 yang dihasilkan
Sanjaya (2003). Beberapa isolat hasil penapisan disajikan pada Gambar 6.
-sitrat pada suhu ruang dan kondisi aerob. Isolat-isolat kapang yang
mempunyai aktivitas enzim β-glukosidase akan memotong eskulin menjadi eskuletin
yang bila bereaksi dengan ion feri akan membentuk kompleks besi fenolat, yang
27
Tabel 4. Hasil penapisan isolat kapang
Isolat Warna koloni Diameter (cm) Rasio
Daerah hitam Koloni
TA 2A
Sebelum penyeleksian secara kuantitatif, terlebih dahulu dilakukan produksi
enzim. Produksi enzim dilakukan dalam media Mandels yang disuplementasi dengan
3% polard NaOH sebagai sumber karbonnya. Selain harganya yang murah, polard
mengandung serat kasar (selulosa) yang cukup tinggi (30-35%) (Hauser 1995) dan kaya
akan vitamin, mineral, lemak dan protein yang dibutuhkan untuk pertumbuhan mikrob,
khususnya dalam hal ini kapang. Dalam penelitian yang dilakukan Ginoga (2004),
enzim β-glukosidase pada kapang Penicillium nalgiovense Laxa baru terekspresikan
setelah hari ke 4 waktu inkubasi, maka untuk mengetahui waktu inkubasi optimum
yang menghasilkan enzim dengan aktivitas maksimum dari ke 7 isolat kapang
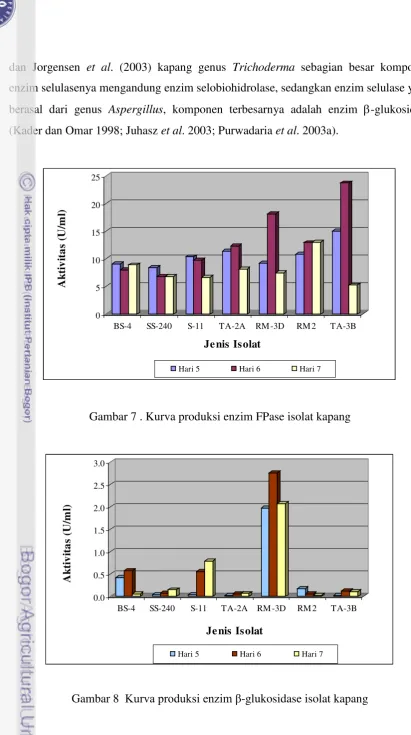
tersebut, dilakukan pengamatan aktivitas FPase dan β-glukosidase pada hari ke 5, 6 dan
7. Pada Gambar 7 disajikan aktivitas FPase yang dihasilkan oleh ke 7 isolat yang
Gambar 6 . Beberapa isolat hasil isolasi.
sampai dengan hari ke 6 waktu inkubasi, namun setelah melewati waktu optimum
mengalami penurunan yang tajam hingga mencapai 77.8% (TA 3B). Aktivitas FPase
tertinggi dicapai oleh isolat TA 3B (23.6 U/ml), kemudian diikuti oleh isolat RM 3D
(18.1 U/ml). Sedangkan aktivitas FPase ke 3 isolat koleksi Balitnak rata-rata
mengalami penurunan setelah hari ke 5 waktu inkubasi. Penurunan yang tajam dialami
oleh isolat S11(35.6%) pada hari ke 7 inkubasi. Isolat SS240 hanya mengalami
penurunan sebesar 18.7%, sedangkan isolat BS4 mengalami penurunan aktivitas pada
hari ke 6 waktu inkubasi tetapi kembali mengalami peningkatan pada hari ke 7
inkubasi. Dari pengamatan aktivitas β-glukosidase ke 7 isolat kapang (Gambar 8),
diperoleh 3 isolat yang memperlihatkan aktivitas yang menonjol yaitu BS4 (0.57 U/ml)
dan RM 3D (2.76 U/ml) pada hari ke 6 waktu inkubasi, dan S11 (0.79 U/ml) pada hari
ke 7 waktu inkubasi, sedangkan 4 isolat yang lainnya menunjukkan aktivitas
β-glukosidase yang rendah, yaitu antara 0.02 dan 0.18 U/ml.
Kapang merupakan mikrob penghasil enzim selulase terbesar dibandingkan
mikrob lainnya. Beragamnya nilai aktivitas enzim yang dihasilkan oleh ke 7 isolat
kapang disebabkan oleh jenis kapang yang berbeda-beda. Menurut Kim et al. (1994)
29
dan Jorgensen et al. (2003) kapang genus Trichoderma sebagian besar komponen
enzim selulasenya mengandung enzim selobiohidrolase, sedangkan enzim selulase yang
berasal dari genus Aspergillus, komponen terbesarnya adalah enzim β-glukosidase
(Kader dan Omar 1998; Juhasz etal. 2003; Purwadaria etal. 2003a).
Gambar 7 . Kurva produksi enzim FPase isolat kapang
Analisis FPase merupakan analisa enzim pada selulosa kristalin. Kristalinitas
selulosa merupakan penghambat utama hidrolisis selulosa secara maksimum dan
menjadi faktor yang menentukan biodegradibilitas selulosa oleh enzim selulolitik. Jadi
mikroorganisme yang menghasilkan FPase yang tinggi lebih berpotensi menghidrolisis
bahan pakan alami seperti dedak dan polard, yang sebagian besar mengandung selulosa
kristalin (Beldman et al. 1987; Judoamidjojo 1989). Karena mekanisme kerja FPase
dapat dihambat oleh adanya selobiosa, maka untuk mendegradasi selulosa secara
menyeluruh diperlukan peranan enzim yang dapat menyempurnakan hidrolisis
selobiosa sehingga menghasilkan monomer-monomer glukosa yang mudah diserap dan
dimanfaatkan oleh sel. Hasil pengukuran aktivitas FPase dan β-glukosidase pada filtrat
enzim isolat-isolat kapang menunjukkan bahwa isolat RM 3D merupakan isolat terbaik
dibandingkan dengan isolat yang lainnya. Selain memiliki aktivitas FPase yang cukup
tinggi pada hari ke 6 waktu inkubasi (18.1 U/ml), isolat RM 3D ternyata menunjukkan
aktivitas β-glukosidase tertinggi sejak awal pengamatan. Aktivitas β-glukosidase
RM 3D pada hari ke 5, 6 dan 7 waktu inkubasi berturut-turut 1.98 U/ml, 2.76 U/ml, dan
2.07 U/ml. Enzim β-glukosidase berperan penting dalam pengaturan seluruh proses
selulolitik dengan menghilangkan penghambat aktivitas FPase maupun CMCase yang
bekerja pada selulosa amorf. Jadi selain mampu menghidrolisis bahan pakan alami,
RM 3D juga mampu menyempurnakan proses hidrolisis selulosa menjadi glukosa.
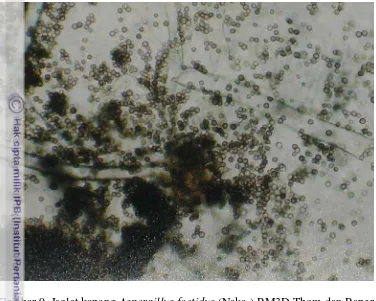
Identifikasi Isolat Kapang RM 3D
Hasil identifikasi isolat kapang RM 3D yang dilakukan di IPB Culture
Collection di laboratorium Mikologi IPB Bogor secara makroskopis dan mikroskopis,
disimpulkan bahwa isolat yang diisolasi dari kayu yang menjadi sarang rayap tersebut
adalah Aspergillus foetidus (Naka.) Thom dan Raper (Raper dan Fennell 1963)
(Lampiran 10). Hal ini sesuai dengan hasil analisis terhadap aktivitas β-glukosidase
pada RM 3D. Pada penelitian sebelumnya, adanya aktivitas β-glukosidase yang tinggi
pada kapang genus Aspergillus juga ditemukan oleh Kader dan Omar (1998) pada
kapang-kapang hasil isolasinya. Enzim-enzim selulolitik juga berhasil diisolasi dari
kapang Penicillium nalgiovense Laxa (Nurbayti 2002), T. viride, T. reesei, T. koningi,
31
Gambar 9. Isolat kapang Aspergillus foetidus (Naka.) RM3D Thom dan Raper
Karakterisasi Enzim
Pengaruh pH Dan Suhu Terhadap Aktivitas β-glukosidase
Enzim mempunyai aktivitas maksimum pada daerah pH yang terbatas.
Pengujian aktivitas enzim β-glukosidase pada berbagai kondisi pH disajikan pada
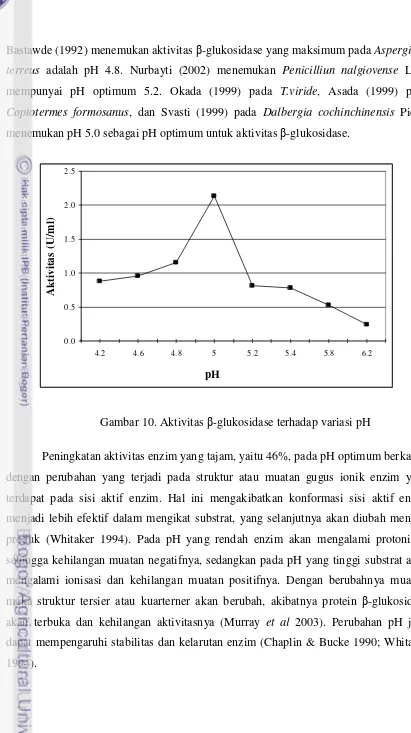
Gambar 10. Pada Gambar 10 terlihat bahwa β-glukosidase mempunyai pH optimum
5.0, dengan aktivitas sebesar 2.13 U/ml. Diatas pH optimum, yaitu 5.2, aktivitasnya
turun sebesar 61% menjadi 0.81 U/ml, sedangkan pada pH dibawah pH optimum, yaitu
4.8, β-glukosidase mempunyai aktivitas sebesar 54% atau 1.15 U/ml, dan pada pH 4.2
aktivitasnya masih 41% atau 0.886 U/ml. Nilai pH optimum ini sesuai dengan yang
diajukan Landecker 1996), bahwa enzim yang berasal dari kapang umumnya
mempunyai pH optimum dibawah 7, dan sebagian besar enzim umumnya mempunyai
pH optimum antara 4 dan 8. Pada penelitian sebelumnya, Purwadaria menyatakan pH
optimum β-glukosidase pada Aspergillus niger NRRL 337 adalah 5.4 (2003a) dan pada
Bastawde (1992) menemukan aktivitas β-glukosidase yang maksimum pada Aspergillus
terreus adalah pH 4.8. Nurbayti (2002) menemukan Penicilliun nalgiovense Laxa
mempunyai pH optimum 5.2. Okada (1999) pada T.viride, Asada (1999) pada
Coptotermes formosanus, dan Svasti (1999) pada Dalbergia cochinchinensis Pierre
menemukan pH 5.0 sebagai pH optimum untuk aktivitas β-glukosidase.
0.0
Gambar 10. Aktivitas β-glukosidase terhadap variasi pH
Peningkatan aktivitas enzim yang tajam, yaitu 46%, pada pH optimum berkaitan
dengan perubahan yang terjadi pada struktur atau muatan gugus ionik enzim yang
terdapat pada sisi aktif enzim. Hal ini mengakibatkan konformasi sisi aktif enzim
menjadi lebih efektif dalam mengikat substrat, yang selanjutnya akan diubah menjadi
produk (Whitaker 1994). Pada pH yang rendah enzim akan mengalami protonisasi
sehingga kehilangan muatan negatifnya, sedangkan pada pH yang tinggi substrat akan
mengalami ionisasi dan kehilangan muatan positifnya. Dengan berubahnya muatan,
maka struktur tersier atau kuarterner akan berubah, akibatnya protein β-glukosidase
akan terbuka dan kehilangan aktivitasnya (Murray et al 2003). Perubahan pH juga
dapat mempengaruhi stabilitas dan kelarutan enzim (Chaplin & Bucke 1990; Whitaker
33
Selain pH, suhu medium juga mempengaruhi aktivitas enzim. Gambar 11
menyajikan pengaruh berbagai suhu terhadap aktivitas enzim β-glukosidase, yang
ditetapkan pada pH optimum enzim. Pada Gambar 11, terlihat bahwa β-glukosidase
mempunyai suhu optimum 60 ºC, dengan aktivitas sebesar 3.56 U/ml. Pada suhu diatas
suhu optimum, aktivitas β-glukosidase menurun tajam sebesar 68%, menjadi 1.12
U/ml, bahkan pada suhu 70 ºC, aktivitasnya tinggal 13% atau 0.45 U/ml. Namun pada
suhu dibawah suhu optimum β-glukosidase relatif stabil. Pada suhu 50 ºC aktivitasnya
turun 51%, menjadi 1.74 U/ml, bahkan pada suhu 40 ºC aktivitasnya masih 27% atau
0.95 U/ml. Nilai suhu optimum pada penelitian ini sesuai dengan hasil penelitian
Bastawde (1992) yang menemukan suhu 60 ºC sebagai suhu maksimum aktivitas
β-glukosidase Aspergillus terreus, sedangkan Nurbayti (2002) menemukan suhu 55 ºC
sebagai suhu optimum Penicilliun nalgiovense Laxa.
0.0
Gambar 11. Aktivitas β-glukosidase terhadap variasi suhu
Peningkatan aktivitas enzim sejalan dengan peningkatan suhu sesuai dengan
yang dikemukan Landecker (1996), bahwa suhu dapat meningkatkan aktivitas enzim
hingga dua kali lipat setiap kenaikan suhu 10 ºC sampai mencapai suhu optimum.
Selain itu menurut Whitaker (1994), enzim umumnya lebih stabil pada suhu yang
jumlah molekul yang bereaksi, baik dengan kenaikan energi kinetiknya, penurunan
rintangan energi, maupun dengan peningkatan frekuensi benturan antar molekul.
Apabila suhu dinaikkan terus, maka akhirnya akan tercapai suatu suhu dimana molekul
yang bereaksi menjadi tidak stabil, bahkan kehilangan aktivitas katalitiknya. Hal ini
disebabkan oleh energi kinetik enzim menjadi besar sehingga melampaui rintangan
energi untuk memutuskan ikatan hidrogen dan hidrofobik pada struktur enzim. Dengan
terputusnya ikatan pada struktur sekunder dan tersier protein β-glukosidase,
mengakibatkan enzim mengalami denaturasi dengan disertai kehilangan aktivitas
katalitiknya (Whitaker 1994 ; Murray et al 2003).
Penetapan pH maupun suhu optimum mutlak dilakukan karena sangat penting
sebagai prasyarat penetapan aktivitas enzim. Hal ini disebabkan karena perubahan suhu
dan ataupun pH, diantaranya dapat mempengaruhi stabilitas enzim, pH buffer, ataupun
afinitas enzim sebagai aktivator dan inhibitor (Whitaker 1994). Selain itu, dengan
diketahuinya pH dan suhu optimum enzim akan bermanfaat dalam aplikasi mikrob
selulolitik untuk mendegradasi selulosa secara maksimal dan aplikasi bioteknologi
enzim.
Pengaruh pH Dan Suhu Terhadap Stabilitas β-glukosidase
Hasil pengujian pengaruh variasi pH terhadap stabilitas enzim (Gambar 12)
pada penyimpanan suhu 60 ºC selama 30 menit, menunjukkan bahwa β-glukosidase
cenderung stabil dan aktif pada pH asam. Enzim relatif stabil pada selang pH 4.2 dan
5.0, dan kenaikan nilai pH menyebabkan menurunnya aktivitas enzim. Aktivitas enzim
pada pH 4.2 adalah 85% dari aktivitas maksimum, sedangkan pada nilai pH mendekati
netral (6.2), aktivitas enzim tinggal 12%. Sebagai perbandingan, Nurbayti (2002)
mendapatkan bahwa β-glukosidase P. nalgiovense Laxa stabil pada pH 4.8 - 5.2.
Kestabilan enzim terhadap perubahan pH dapat dimanfaatkan dalam ransum ternak,
karena pH kestabilan enzim berada pada kisaran pH organ pencernaan ayam dan itik
(pH 4.5–6.9), sedangkan organ ampela dan proventrikulus mempunyai pH 2.3 – 3.4
(Sturkie 1976).
35
β-glukosidase menunjukkan aktivitas yang relatif stabil selama 1 hari penyimpanan.
Pada kondisi ini terjadi peningkatan aktivitas sebesar 210%, bahkan pada hari ke 4
penyimpanan, aktivitas enzim masih lebih dari 50%. Pada penelitian sebelumnya,
Desrochers et al. (1981) menemukan waktu paruh β-glukosidase pada suhu 30 ºC dan
pH 7 adalah 72 jam (3 hari). Mengingat waktu paruh β-glukosidase yang lebih dari 4 hari, hal ini memungkinkan enzim tersebut dapat digunakan sebagai campuran pakan
pada suhu ruang dengan jangka tertentu.
0
Gambar 12. Stabilitas β-glukosidase terhadap variasi pH
Hasil pengamatan pada suhu 40 ºC menunjukkan bahwa aktivitas enzim
β-glukosidase relatif stabil. Aktivitas meningkat 2 kali lipat pada inkubasi 90 menit
(202%) (Gambar 14), dan masih lebih besar dari aktivitas semula (120%) pada
inkubasi 180 menit. Pengujian aktivitas β-glukosidase terdahulu pada suhu ini
dilakukan Desrochers et al. (1981). Pada kondisi tersebut dan pH 7 β-glukosidase
mempunyai waktu paruh 24 jam, tetapi kurang dari 1 jam pada suhu 50 ºC. Kestabilan
enzim β-glukosidase pada suhu 40 ºC, menyebabkan enzim tersebut dapat
dimanfaatkan sebagai campuran dalam pakan unggas, karena unggas memiliki suhu