RANGKUMAN MATERI AJAR
KELAS XI SMA PROGRAM MIA
Materi:
HIDROKARBON DAN MINYAK BUMI
TERMOKIMIA
*KHUSUS UNTUK DIPELAJARI
Oleh:
1
HIDROKARBON
Salah satu rumpun senyawa yang melimpah di alam adalah senyawa karbon. Senyawa ini
tersusun atas atom karbon dan atom-atom lain yang terikat pada atom karbon, seperti hidrogen, oksigen,
nitrogen, dan atom karbon itu sendiri. Salah satu senyawa karbon paling sederhana adalah
hidrokarbon. Hidrokarbon banyak digunakan sebagai komponen utama minyak bumi dan gas alam.
Apakah kekhasan dari atom karbon? Bagaimanakah atom karbon membentuk senyawa
hidrokarbon? Bagaimanakah menggolongkan senyawa hidrokarbon? Mari simak penjelasan berikut
ini ....
A. Kekhasan Atom Karbon
Atom karbon (C) merupakan pemeran utama dalam mempelajari hidrokarbon. Atom C ini
memiliki karakteristik yang khas dibanding atom lainnya. Karakteristik itu adalah kemampuannya
membentuk rantai C yang panjang. Mengapa bisa? Peristiwa ini disebabkan atom C mempunyai empat
elektron valensi yang dapat berikatan kovalen dengan atom sejenis atau atom lain.
Gambar 1. Beberapa jenis ikatan kovalen pada atom C
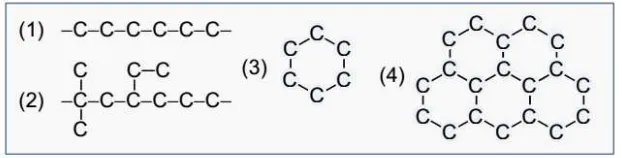
Atom C dapat berikatan dengan atom C lain (sejenis), bahkan dapat membentuk rantai atom
atom C baik alifatik (terbuka: lurus dan bercabang) maupun siklik (tertutup).
Gambar 2. Rantai karbon: (1) rantai lurus; (2) rantai cabang; (3) rantai tertutup; (4) jaring
B. Atom C Primer, Sekunder, Tersier, dan Kuartener
Berdasarkan kemampuan atom karbon yang dapat berikatan denganatom karbon lain, muncullah
istilah atom karbon primer, sekunder, tersier, dan kuartener. Istilah ini didasarkan pada jumlah
atom karbon yang terikat pada atom karbon tertentu.
1. Atom karbon primer (dilambangkan dengan 10) adalah atom-atom karbon yang mengikat
2
Contoh: perhatikan senyawa berikut
dalam senyawa tersebut terdapat
4 atom karbon primer yang
berada pada setiap ujung.
Bisakah kalian melihatnya??
2. Atom karbon sekunder (dilambangkan dengan 20) adalah atom-atom karbon yang mengikat
dua atom karbontetangga.
Contoh: perhatikan atom C yang ditandai pada senyawa berikut.
Atom C yang ditandai pada senyawa di samping
merupakan atom C sekunder. Dia biasanya diapit
oleh dua atom C yang lain.
3. Atom karbon tersier (dilambangkan dengan 30) adalah atom-atom karbon yang mengikat
tiga atom karbontetangga.
Contoh: coba perhatikan senyawa di atas, adakah atom C tersiernya?
Ada ternyata! Jadi, senyawa di samping memiliki 1
atom C tersier. Lihat! Dia diapit oleh tiga atom C
lain.
4. Atom karbon kuartener (dilambangkan dengan 40) adalah atom-atom karbon yang
mengikat empat atom karbontetangga.
Contoh: perhatikan senyawa ini, bisakah kalian menemukan atom C kuartener? Dia diapit
oleh empat atom C lain.
Nah, ternyata senyawa di samping memiliki 1 atom C
kuartener.
C. Penggolongan Senyawa Hidrokarbon
Berdasarkan jumlah ikatan antara atom karbon, senyawa karbon dikelompokkan menjadi
senyawa jenuh dan tidak jenuh. Pada senyawa hidrokarbon jenuh, atom karbon dapat mengikat atom
3
1. Alkana
Senyawa alkana merupakan rantai karbon yang paling sederhana. Alkana merupakan
senyawa hidrokarbon jenuh yang seluruh ikatannya pada atom karbonnya tunggal. Rumus
umum alkana adalah:
Jadi, apabila atom C ada 2, maka atom H pada senyawa alkananya adalah 2(2)+2,
yakni 6 buah. Apabila dituliskan menjadi C2H6, dan jika dijabarkan akan menjadi seperti ini:
etana
Berikut merupakan daftar nama 10 deret pertama dari senyawa alkana:
Nama Senyawa Rumus Molekul
Metana CH4
Etana C2H6
Propana C3H8
Butana C4H10
Pentana C5H12
Heksana C6H14
Heptana C7H16
Oktana C8H18
Nonana C9H20
Dekana C10H22
Tata Nama Senyawa Alkana
Senyawa hidrokarbon dapat diberi nama menggunakan aturan yang sesuai atau yang disetujui
oleh para ilmuwan. Bagaimana cara menamai senyawa alkana? Baiklah, kita akan mencoba
langsung menamai senyawa alkana berikut:
4
ATURAN PERTAMA yang harus kita lakukan adalah menentukan rantai utama
dari senyawa tersebut. Bagaimana caranya? Carilah rantai C yang TERPANJANG,
yakni rantai yang memiliki atom karbon TERBANYAK.
Apakah yang ini???
Ooh, bukan, pemirsa! Ada yang lebih panjang lagi rupanya. Bisakah kalian menemukannya??? Lihatlah, ada dua buah C2H5 dalam rantai tersebut, jadi
senyawa itu apabila dijabarkan lagi akan menjadi seperti ini:
Jadi, manakah rantai terpanjangnya??
Nah, setelah menentukan rantai utama, yang harus dilakukan adalah MENOMORI
RANTAI itu dari ujung satu sampai ujung yang lain. Nah, untuk rantai yang kita
miliki dari ujung mana kita menomorinya??? Baiklah, untuk itu kita memasuki
ATURAN KEDUA!! Penomoran rantai dimulai dari UJUNG RANTAI YANG
TERDEKAT DENGAN CABANG. Jadi, penomoran senyawa yang kita miliki itu
akan menjadi seperti ini:
Ok! Jadi itu RANTAI UTAMAnya
1
5
ATURAN KETIGA, yakni menentukan NAMA ALKIL atau cabang-cabang yang
ada pada rantai utama. Penamaannnya sama dengan alkana, hanya akhirannya diubah
menjadi –il. Berikut tabel deret 5 gugus alkil pertama pada senyawa hidrokarbon:
Jumlah
Karbon Struktur Nama Alkil
1 CH3‒ Metil
2 CH3‒CH2‒ Etil
3 CH3‒CH2‒CH2‒ Propil
4 CH3‒CH2‒CH2‒CH2‒ Butil
5 CH3‒CH2‒CH2‒CH2‒CH2‒ Pentil
Nah, dari struktur yang kita miliki, mana sajakah cabangnya? Jika kalian perhatikan, ada 3
cabang di sana, dan ketiganya merupakan gugus metil.
Apabila dijodohkan dengan rantai utama, gugus-gugus alkil tersebut secara berurutan
MENEMPEL PADA ATOM C ke 3, 4 dan 6. Dengan demikian, kita sudah dapat menamai
struktur yang kita miliki secara lengkap. Urutan penulisan namanya:
1. NOMOR ALKIL/CABANG
2. NAMA ALKIL/CABANG
3. NAMA RANTAI UTAMA
Jadi, saudara-saudara, nama struktur hidrokarbon itu adalah:
3,4,6-trimetil-oktana
6
Kelompok senyawa hidrokarbon yang termasuk senyawa tak jenuh adalah ALKENA dan ALKUNA.
Disebut hidrokarbon tak jenuh karena atom karbon yang dimilikinya tidak mengikat atom hidrogen
secara maksimal. Dengan kata lain mereka memiliki IKATAN RANGKAP. Nah, mari kita bahas
senyawa hidrokarbon tak jenuh ini satu per satu.
2. Alkena
Alkena merupakan senyawa hidrokarbon dengan ikatan rangkap dua (‒C=C‒). Alkena paling sederhana yaitu etena, C2H4. Rumus umum alkena adalah:
Jadi, apabila atom C ada 4, maka atom H pada senyawa alkenanya adalah 2(4), yakni
8 buah. Apabila dituliskan menjadi C4H8, dan jika dijabarkan akan menjadi seperti ini:
H H H
Berikut merupakan daftar nama 10 deret pertama dari senyawa alkena:
Nama Senyawa Rumus Molekul
Atom karbon yang berikatan rangkap (‒C=C‒) diberi nomor yang menunjukkan ikatan rangkap tersebut. Penomoran dimulai dari ujung rantai yang paling dekat dengan ikatan
rangkap.
7
Contoh:
bukan
Jadi, nama senyawa tersebut yang benar adalah 2-pentena.
b)Alkena Rantai Bercabang
Penamaan alkena rantai bercabang hampir sama dengan penamaan alkana. Hanya yang
membedakan adalah ADA NOMOR POSISI UNTUK IKATAN RANGKAP PADA
ALKENA. Aturan yang digunakan tetap sama, yakni:
menentukan RANTAI UTAMA, yaitu rantai terpanjang dan MEMILIKI IKATAN RANGKAP
penomoran rantai utama diawali dari YANG PALING DEKAT DENGAN IKATAN RANGKAP, BUKANdari cabang terdekat
urutan penulisan nama:
1) NOMOR CABANG/ALKIL
2) NAMA CABANG/ALKIL
3) NOMOR IKATAN RANGKAP
4) NAMA ALKENA
Contoh: beri nama untuk senyawa alkena berikut
Seperti biasa, pertama kita TENTUKAN RANTAI UTAMA dari struktur tersebut, yang
MENGANDUNG IKATAN RANGKAP. Dengan demikian, akan menjadi seperti ini:
Selanjutnya kita beri nomor pada rantai tersebut DARI ATOM C YANG TERDEKAT
DENGAN IKATAN RANGKAP. Maka akan menjadi seperti ini:
1
8
Selanjutnya PENAMAAN ALKIL atau CABANG. Jika kalian perhatikan, ada 3
cabang pada struktur itu, dan ketiganya adalah metil.
Nah, secara berurutan metil-metil itu menempel pada atom C nomor 3, 6, dan 9. Nama
rantai utamanya adalah dekena. Karena ikatan rangkapnya ada pada C nomor 3, maka
nama senyawa tersebut adalah:
3,6,9-trimetil-3-dekena
Satu lagi kelompok hidrokarbon tak jenuh adalah alkuna. Mari kita bahas...
3. Alkuna
Alkuna merupakan senyawa hidrokarbon dengan ikatan rangkap tiga (‒C≡C‒). Alkuna
paling sederhana yaitu etuna, C2H2. Rumus umum alkena adalah:
Jadi, apabila atom C ada 3, maka atom H pada senyawa alkenanya adalah 2(3)‒2, yakni 4 buah. Apabila dituliskan menjadi C3H4, dan jika dijabarkan akan menjadi seperti ini:
H
│
H‒C‒C≡C‒H
│
H
1-propuna
Berikut merupakan daftar nama 10 deret pertama dari senyawa alkuna:
Nama Senyawa Rumus Molekul
Etuna C2H2
Propuna C3H4
3
9
Butuna C4H6
Pentuna C5H8
Heksuna C6H10
Heptuna C7H12
Oktuna C8H14
Nonuna C9H16
Dekuna C10H18
Tata Nama Senyawa Alkuna
a) Alkuna Rantai Lurus
Tata nama alkuna rantai lurus BENAR-BENAR SAMA dengan tata nama alkena rantai
lurus. Hanya saja nama rantai utamanya diberi akhiran ‒UNA.
Contoh:
2-butuna
b)Alkuna Rantai Bercabang
Tata nama alkuna rantai bercabang pun SAMA DENGAN tata nama alkena rantai
bercabang. Hanya saja dibedakan penggunaan AKHIRAN pada nama RANTAI UTAMA
menjadi ‒UNA.
Contoh: mari kita memberi nama untuk senyawa alkuna berikut
Baiklah, kita mulai dengan MENENTUKAN RANTAI UTAMA dari struktur tersebut,
yang MENGANDUNG IKATAN RANGKAP. Dengan demikian, akan menjadi seperti
ini:
Selanjutnya kita beri nomor pada rantai tersebut DARI ATOM C YANG TERDEKAT
DENGAN IKATAN RANGKAP. Maka akan menjadi seperti ini:
10
Selanjutnya PENAMAAN ALKIL atau CABANG. Jika kalian perhatikan, hanya ada 1
cabang pada struktur itu, dan alkil tersebut bernama metil.
Nah, metil yang kita miliki menempel pada atom C nomor 3. Nama rantai utamanya
adalah pentuna. Karena ikatan rangkapnya ada pada C nomor 1, maka nama senyawa
tersebut adalah:
3-metil-1-pentuna
Demikianlah urusan tata nama berakhir disini... Bagaimana jika kasusnya kita harus membuat
struktur dari nama yang telah diketahui??? Misalkan 2-metil-butana. Bagaimana strukturnya?
Mari kita bahas...
Pertama, kita harus MELIHAT EKOR dari nama senyawa tersebut, karena itu
merupakan nama RANTAI UTAMA.
2-metil-butana
Apabila digambarkan maka akan menjadi seperti ini:
C‒C‒C‒C
Selanjutnya kita lihat nomor alkil, yakni yang paling depan:
2-metil-butana
Berarti posisi alkil/cabang berada pada C nomor 2, dan cabang tersebut merupakan metil
yang memiliki 1 atom C. Kita tambahkan alkil pada struktur kita:
C
Inilah yang kita sebut sebagai isomer. Dengan demikian, struktur yang telah kita bahas
merupakan ISOMER DARI PENTANA.
11
D. Sifat Fisik Senyawa Hidrokarbon
Sifat fisik suatu zat antara lain titik didih dan titik leleh. Secara umum, SEMAKIN BANYAK
JUMLAH ATOM KARBON dalam senyawa hidrokarbon, baik itu alkana, alkena, maupun alkuna
maka SEMAKIN TINGGI PULA TITIK DIDIH juga TITIK LELEH yang dimiliki senyawa
tersebut.
Selain itu juga, SEMAKIN BANYAK CABANG pada suatu hidrokarbon, maka SEMAKIN
RENDAH TITIK DIDIH maupun TITIK LELEHNYA.
Baiklah selesai sudah pembahasan kita mengenai SENYAWA HIDROKARBON. Pahami ya!
Jika kalian RAJIN MEMBACA, maka jalan keluar menuju SUKSES akan lancar jaya!
12
MINYAK BUMI
Untuk apa kita mempelajari hidrokarbon? Salah satu manfaatnya adalah agar kalian siap menghadapi
bab yang satu ini. Ya, minyak bumi atau petroleum yang merupakan salah satu senyawa hidrokarbon yang sangat penting bagi manusia. Tentunya kalian pernah mendengar bensin bukan? Nah, bensin itu
merupakan salah satu fraksi minyak bumi.
Apa itu fraksi minyak bumi? Bagaimana cara memperoleh minyak bumi? Mengapa jenis bensin
bisa berbeda-beda (seperti solar, premium, pertamax)? Bagaimana bahaya pembakaran tidak sempurna
suatu bahan bakar? Itulah yang akan kita bahas kali ini.
A. Proses Pembentukan Minyak Bumi
Pernahkah kalian melihat anjungan minyak bumi lepas pantai? Minyak bumi diperoleh dari
pengeboran permukaan bumi hingga mencapai sumbernya. Darimana minyak bumi itu terbentuk?
Gambar 3. Minyak bumi terjadi akibat pelapukan atau sisa-sisa hewan dan tumbuhan renik yang terkubur di dasar laut jutaan tahun lampau. Minyak bumi disebut juga petroleum: petra (batuan) dan oleum (minyak). Ini ditujukan kepada fosil hewan dan tumbuhan yang ditemukan dalam kulit bumi sebagai gas, air, dan padatan.
Minyak bumi terbentuk dari FOSIL-FOSIL HEWAN DAN TUMBUHAN KECIL YANG
HIDUP DI LAUT DAN TERTIMBUN SELAMA BERJUTA-JUTA TAHUN LAMPAU. KETIKA
HEWAN DAN TUMBUHAN LAUT MATI, JASAD MEREKA TERTIMBUN OLEH PASIR
DAN LUMPUR DI DASAR LAUT. Setelah ribuan tahun tertimbun, akibat pengaruh tekanan dan suhu
bumi yang tinggi, lapisan-lapisan lumpur dan pasir berubah menjadi batuan. AKIBAT TEKANAN
DAN PANAS BUMI, FOSIL HEWAN DAN TUMBUHAN YANG TERJEBAK DI LAPISAN
13
BATUAN SECARA PERLAHAN BERUBAH MENJADI MINYAK MENTAH. Biasanya dengan
ditemukannya sumber minyak mentah, akan ditemukan pula gas alam (Sunarya, 2009).
B. Komposisi Hidrokarbon pada Minyak Bumi
Hidrokarbon dalam minyak mentah biasanya terdiri atas hidrokarbon jenuh, alifatik, dan
alisiklik. Sebagian besar komponen minyak mentah adalah hidrokarbon jenuh, yakni alkana dan
sikloalkana.
Di Indonesia, minyak bumi terdapat di bagian utara pulau Jawa, bagian timur Kalimantan dan
Sumatra; daerah Papua; dan bagian timur pulau Seram. Minyak bumi juga diperoleh di lepas pantai
utara Jawa dan pantai timur Kalimantan.
Minyak bumi yang ditambang di Indonesia umumnya banyak mengandung senyawa hidrokarbon
siklik, baik sikloalkana maupun aromatik. Berbeda dengan minyak dari Indonesia, minyak bumi dari
negara-negara Arab lebih banyak mengandung alkana dan minyak bumi Rusia lebih banyak
mengandung sikloalkana.
C. Fraksi-fraksi Minyak Bumi
Minyak bumi terdiri atas berbagai campuran (fraksi) yang terdapat dalam minyak mentah yang belum dapat digunakan. Minyak mentah diolah dalam kilang minyak menggunakan proses destilasi
bertingkat menjadi fraksi-fraksinya.
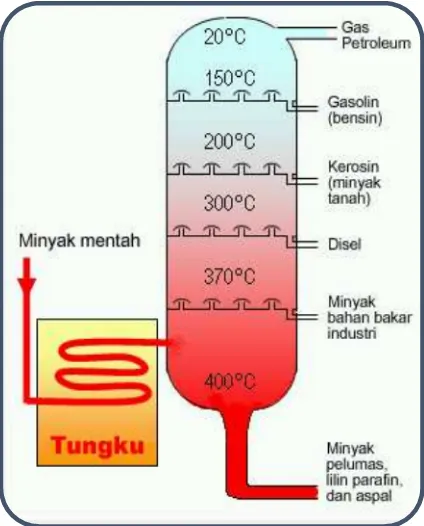
Gambar 4.Tangki penyulingan minyak bumi (tabung fraksionasi)
Prinsip pengolahan minyak mentah menggunakan
destilasi bertingkat adalah pemisahan komponen atau
fraksi-fraksi minyak bumi melalui perbedaan titik
didih. Dimana fraksi yang memiliki titik didih paling
rendah akan keluar terlebih dahulu disusul oleh fraksi
yang memiliki titik didih yang lebih tinggi.
Pada gambar di samping fraksi yang memiliki titik
didih paling rendah adalah gas petroleum, yakni sekitar 20°C, dan fraksi yang memiliki titik didih paling tinggi
adalah ASPAL, sekitar 400°C. Fraksi ini tersisa dalam
tabung fraksionasi dan sering digunakan sebagai
PENGERAS JALAN.
Makin kebawah tabung fraksionasi, makin tinggi
14
D. Bilangan Oktan Bensin
Bensin akhir-akhir ini menjadi perhatian utama karena pemakaiannya untuk bahan bakar
kendaraan bermotor sering menimbulkan masalah. Kualitas bensin ditentukan oleh bilangan oktan,
yaitu bilangan yang menunjukkan jumlah isooktan dalam bensin.
Campuran hidrokarbon yang digunakan sebagai standar untuk membandingkan kualitas bensin
adalah N-HEPTANA dan ISOOKTANA (2,2,4-trimetil-pentana).
Contoh:
Suatu bensin premium diketahui memiliki bilangan oktan sebesar 80. Komposisi hidrokarbon
standar yang dimilikinya adalah
20% n-heptana dan 80% isooktana
Semakin tinggi bilangan oktan, semakin baik kualitas bensin tersebut. Penambahan zat
aditif ke dalam bensin bertujuan untuk mengurangi ketukan dan meningkatkan bilangan oktan.
Zat aditif yang ditambahkan ke dalam bensin biasanya adalah TEL (Tetra Etyl Lead atau tetra etil timbal), rumus molekulnya adalah [(CH3CH2)4Pb], dengan struktur molekul adalah sebagai
berikut:
Tetra etil timbal—TEL
Penggunaan TEL dalam bensin akan segera dihentikan karena menimbulkan pencemaran
udara yang sangat parah, terutama karena pembuangan logam berat timbal (Pb) yang dapat
merusak sistem peredaran darah. Untuk menanggulanginya saat ini telah dikembangkan
penggunaan MTBE (metil tersier butil eter), metanol, dan etanol.
E. Bahaya Pembakaran Bahan Bakar
Penggunaan bensin sebagai bahan bakar menimbulkan dampak berupa pencemaran udara. Hal
ini disebabkan oleh pembakaran tidak sempurna yang akan membentuk gas CO (karbon monoksida).
Gas CO yang dibebaskan dari pembakaran jika terhirup dapat menimbulkan lelah dan pusing, bahkan
pingsan. Hal ini berkaitan dengan reaktivitas sel dara merah terhadap gas CO.
Dalam sel darah manusia terdapat haemoglobin yang bertugas mengangkut O2 ke seluruh
jaringan tubuh. Apabila gas CO di udara terhirup oleh sistem pernapasan, maka HAEMOGLOBIN
LEBIH MUDAH BEREAKSI DENGAN GAS CO dibandingkan gas O2 yang seharusnya kita hirup.
Akibatnya, jaringan tubuh akan kekurangan oksigen. Inilah yang menyebabkan pusing, lelah, dan
15
Termokimia
Setelah mempelajari minyak bumi, kita jadi tahu bahwa minyak bumi ternyata dapat dijadikan bahan
bakar yang digunakan sebagai sumber energi. Tanpa bensin, motor kalian tidak dapat berjalan bukan?
Pembakaran bensin memberikan energi pada mesin motor kalian, sehingga motor tersebut dapat
berjalan mengantarkan kalian ke sekolah.
Nah, energi ternyata dipelajari pula dalam kimia, yang termasuk TERMOKIMIA. Energi
merupakan sumber esensial bagi kehidupan manusia serta makhluk hidup lainnya. Makanan yang kita
makan merupakan sumber energi yang memberikan kekuatan kepada kita untuk dapat bekerja, belajar,
dan beraktivitas lainnya. Setiap materi mengandung energi dalam bentuk energi potensial dan energi
kinetik. Kedua energi ini dinamakan energi internal. Jika energi yang terkandung dalam materi berubah
maka perubahan energi dinamakan kalor. Perubahan energi (kalor) pada tekanan tetap dinamakan
perubahan entalpi atau disimbolkan sebagai ΔH(Sunarya, 2009).
Dalam termokimia kalian akan mempelajariberbagai perubahan energi kalor yang menyertai
suatu reaksi kimia. Sebelum kita mendalami lebih jauh lagi, kalian perlu mengetahui terlebih dahulu
beberapa istilah yang sering dijumpai dalam termokimia. Mari simak penjelasan berikut.
A. Sistem dan Lingkungan
Dalam istilah termokimia dikenal SISTEM yang didefinisikan sebagai bagian dari semesta yang
merupakan fokus kajian. Sedangkan LINGKUNGAN merupakan segala sesuatu di luar sistem yang
bukan kajian.
Misalkan dalam suatu percobaan kalian ingin mengetahui KELARUTAN GULA DALAM
AIR. Dengan demikian yang kalian lakukan adalah memasukkan padatan gula ke dalam air mendidih.
Dalam hal ini yang disebut sebagai SISTEM adalah PADATAN GULA, sedangkan air mendidih dan
SEGALA SESUATU YANG BUKAN PADATAN GULA merupakan LINGKUNGAN.
B. Eksoterm dan Endoterm
Istilah lain yang sering kita jumpai pada termokimia adalah reaksi eksoterm dan endoterm.
Kedua istilah ini berkaitan dengan peristiwa keluar masuknya kalor dari sistem ke lingkungan atau
16
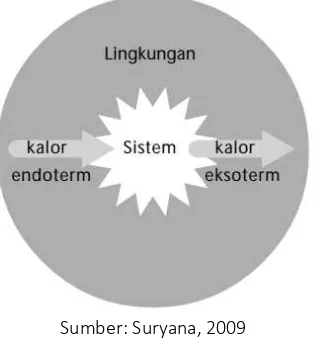
Sumber: Suryana, 2009
Gambar 5. Diagram proses eksoterm dan endoterm antara sistem dan lingkungan
Jika dalam reaksi kimia terjadi perpindahan kalor atau panas dari sistem ke lingkungan maka
suhu lingkungan akan meningkat, inilah yang disebut sebagai reaksi eksoterm (mengeluarkan panas).
Sebaliknya, jika perpindahan kalor terjadi dari lingkungan ke sistem, maka suhu sistem yang akan
meningkat, ini yang disebut sebagai reaksi endoterm (menyerap panas).
Reaksi eksoterm dan endoterm sering kita jumpai di kehidupan sehari-hari.
Contoh proses eksoterm adalah agar-agar memadat, air menjadi es, lelehan besi
memadat menjadi besi. Sedangkan contoh proses endoterm adalah AWAN
MENJADI HUJAN, untuk menjadi tetesan hujan AWAN HARUS MENYERAP
SEJUMLAH BESAR ENERGI MATAHARI.
C. Penentuan Nilai ΔH Reaksi dengan Percobaan
Rumus Umum Penentuan Kalor
Kalian pasti pernah memasak air, bukan? Bagaimana menentukan kalor yang diperlukan
untuk mendidihkan air sebanyak 2 liter? Nah, untuk mengetahui jumlah kalor yang dibutuhkan
itu kita perlu mengukur suhu air sebelum dan sesudah pemanasan. Dari selisih suhu, kita bisa
menghitung kalor yang diserap oleh air. Perhitungan ini didasari pada persamaan:
Keterangan:
Q = kalor yang dibutuhkan suatu sistem (J) m = massa zat (gram)
c = kalor jenis zat (J/g°C)
ΔT = perubahan suhu (°C)
17
Contoh: logam besi dipanaskan dari 30°C hingga 150°C. Jika berat besi 2 kg dan kalor jenis besi 0,5
J/g°C, tentukan kalor yang diperlukan!
Jadi, kalor yang dibutuhkan untuk memanaskan logam besi tersebut adalah 120 kJ.
Kalorimetri
Kalor dapat diukur menggunakan suatu alat bernama kalorimeter, pengukuran kalor
menggunakan kalorimeter dinamakan kalorimetri. Untuk mengukur kalor reaksi dalam
kalorimeter, perlu diketahui terlebih dahulu kalor yang dipertukarkan dengan kalorimeter sebab
pada saat terjadi reaksi, sejumlah kalor dipertukarkan antara sistem reaksi dan lingkungan.
Besarnya kalor yang diserap atau dilepaskan oleh kalorimeter dihitung dengan persamaan:
dengan Ck adalah kapasitas kalor kalorimeter.
Prinsip utama dalam perhitungan entalpi menggunakan azas Black, yang berbunyi:
jumlah kalor yang diserap suatu sistem akan sama dengan jumlah kalor yang diterima oleh lingkungan.
Kalorimeter bekerja pada sistem terisolasi, dimana perpindahan kalor dari sistem ke
lingkungan maupun sebaliknya tidak memungkinkan. Namun, tidak ada sesuatu yang sempurna,
adakalanya kalorimeter sebagai lingkungan malah menyerap kalor yang dikeluarkan oleh sistem.
Dengan demikian, azas Black tidak lagi tepat, sehingga muncullah persamaan sebagai berikut:
Q
kalorimeter= C
kΔT
Q
lepas= Q
terima18
Contoh: Pada kalorimeter, 5 gram logam Na dimasukkan ke dalam 95 gram air. Tercatat cuhu naik
dari 300 K menjadi 350 K. Jika kalor jenis larutan 4 J/g K dan kapasitas kalor kalorimeter 0
J/K, tentukan nilai ΔH reaksi!
D. Penentuan Nilai ΔH Reaksi Menggunakan Data Sekunder
Perhitungan ΔH reaksi melalui percobaan yang telah kita bahas sebelumnya tidak dapat
ditentukan persamaan reaksi yang terjadi antara zatnya. Bagaimana menentukan ΔH reaksi dari persamaan kimia yang diketahui?
Nah, ternyata selain melalui percobaan, ΔH reaksi dapat ditentukan berdasarkan data entalpi yang telah ada. Data inilah yang disebut sebagai data sekunder. Data entalpi tersebut telah disepakati
oleh para ahli kimia, sehingga kita tinggal menggunakannya saja. Dengan demikian, dari persamaan
reaksi yang diketahui kita dapat menghitung berapa kalor reaksi atau ΔH reaksi yang dibutuhkan oleh
suatu reaksi kimia. Ada tiga metode pengukuran ΔH menggunakan data sekunder, yakni:
1. MENGGUNAKAN DATA PEMBENTUKAN STANDAR
2. HUKUM HESS
3. DAN MENGGUNAKAN DATA ENERGI IKATAN
Untuk lebih jelasnya mari kita bahas satu per satu.
1. Perhitungan ΔH Reaksi Berdasarkan Data ΔH Pembentukan Standar
Harga perubahan entalpi ditentukan oleh keadaan awal dan keadaan akhir sutau reaksi.
Zat-zat pereaksi dianggap mengalami reaksi penguraian dan zat-zat hasil reaksi dianggap
19
pembentukannya, namun tandanya berlawanan. Untuk lebih jelasnya mari kita tentukan kalor
pembentukan senyawa CS2, dimana diketahui nilai ΔH reaksi pembentukan sebagai berikut:
(1) CS2 + 3O2→ CO2 + 2SO2 ΔH = –1110 kJ
(2) CO2→ C + O2 ΔH = +394 kJ
(3) SO2→ S + O2 ΔH = +297 kJ
Langkah PERTAMA yang harus kita lakukan adalah melihat tujuan kita terlebih dahulu.
Pada akhir reaksi kita meinginkan TERBENTUKNYA CS2, dari data diatas dapat dilihat
bahwa yang terdapat CS2 hanya pada persamaan reaksi nomor (1). Tapi, nilai ΔH reaksi
yang disediakan adalah untuk penguraian CS2. Untuk itu, persamaan tersebut perlu kita
balik, sehingga nilai ΔH reaksinya pun ikut dibalik, menjadi:
CO2 + 2SO2→ CS2 + 3O2 ΔH = +1110 kJ
Pada reaksi tersebut selain terbentuk CS2 terbentuk pula zat lain, yakni O2 yang tidak kita
inginkan. Sehingga langkah KEDUA yang harus kita lakukan adalah MENGELIMINASI
ZAT LAIN SELAIN YANG KITA INGINKAN. Pada persamaan itu, zat-zat yang tidak
kita inginkan antara lain CO2, 2SO2, dan O2. Bagaimana cara mengeliminasinya? Coba
kita lihat satu persatu.
Untuk mengeliminasi CO2 yang berada pada ruas kiri, tinggal kita tambahkan
persamaan reaksi lain yang memiliki CO2, dan disimpan di ruas sebaliknya yakni ruas
kanan. Pada data yang telah disediakan CO2 ada pada persamaan ke (2). Agar berada pada
ruas kanan, persamaan itu kita balik menjadi:
C + O2→ CO2 ΔH = –394 kJ
Sedangkan untuk mengeliminasi 2SO2, kita gunakan persamaan ke (3). SO2 harus dipindah
ruas, dan nilainya dikali 2. Persamaan reaksinya akan menjadi seperti ini:
2S + 2O2→ 2SO2 ΔH = –594 kJ
Selanjutnya tinggal kita urutkan ketiga persamaan baru yang telah kita miliki, menjadi:
CO2 + 2SO2 → CS2 + 3O2 ΔH = +1110 kJ
C + O2 → CO2 ΔH = –394 kJ
2S + 2O2 → 2SO2 ΔH = –594 kJ
C + 2S → CS2 ΔH = +122 kJ
Jadi, kalor yang dibutuhkan dalam pembentukan senyawa CS2 adalah +122 kJ.
20
2. Perhitungan ΔH Reaksi Menggunakan Hukum Hess
Hukum Hess dikemukakan oleh seorang ahli kimia berkebangsaan Swiss Germain Henry Hess (1802–1850). Hukum ini sangat berguna karena kenyataannya, tidak semua reaksi dapat ditentukan kelor reaksinya secara eksperimen. Menurut Hess:
Contoh 1: perhatikan diagram berikut
Setiap nilai ΔH yang ada pada diagram tersebut menunjukkan bahwa reaksi yang terjadi sesuai dengan arah anak panah memiliki nilai ΔH tertentu. Misalnya, untuk mengubah 2A+B menjadi A2B, kalor yang dibutuhkan adalah sebanyak ΔH1. Hal ini merupakan reaksi yang berjalan satu
tahap. Sesuai perkataan Hess, reaksi ternyata bisa berjalan beberapa tahap, dengan demikian kita
dapat mencari nilai ΔH untuk reaksi yang lain. Dalam diagram di atas, coba tentukan
perubahan entalpi reaksi A2B → CD2.
Yang harus kita lakukan adalah memilih jalan memutar. Apabila jalan yang kita
tempuh berlawanan dengan arah anak panah, berarti nilai ΔH harus dibalik. Reaksi keseluruhan akan menjadi seperti berikut:
A2B → 2A + B –ΔH1
2A + B → C + 2D ΔH2
C + 2D → CD2 ΔH3
A2B → CD2 ΔH = –ΔH1+ ΔH2+ΔH3
Contoh 2: perhatikan diagram berikut
+
―perubahan entalpi suatu reaksi tetap sama, baik
berlangsung dalam satu tahap maupun beberapa
tahap‖
21 Tentukan nilai ΔH3!
Jawab:
ΔH3 berarti menentukan perubahan entalpi reaksi berikut:
N2(g) + 2O2(g) → 2NO(g) + O2(g)
Sehingga,
N2(g) + 2O2(g) → NO2(g) ΔH1 = +66,4 kJ
NO2(g) → 2NO(g) + O2(g) ΔH2 = +114,1 kJ
N2(g) + 2O2(g) → 2NO(g) + O2(g) ΔH3 = +180,5 kJ
3. Perhitungan ΔH Reaksi Menggunakan Data Energi Ikatan
Kalian sudah tahu apa yang dimaksud dengan ikatan? Kekuatan ikatan antara atom-atom
dalam molekul dapat diketahui dari energinya. Semakin besar energi yang diperlukan untuk
memutuskan ikatan, semakin kuat ikatan tersebut. Energi ikatan didefinisikan sebagai jumlah
energi yang diperlukan untuk memutuskan ikatan 1 mol suatu molekul dalam wujud gas.
Dalam reaksi kimia terjadi pemutusan ikatan (pada pereaksi) dan pembentukan kembali
ikatan (pada hasil reaksi). Untuk memutuskan ikatan diperlukan energi. Sebaliknya, untuk
membentuk ikatan dilepaskan energi. Selisih energi pemutusan dan pembentukan ikatan
menyatakan perubahan entalpi reaksi tersebut, yang dirumuskan sebagai berikut:
dengan Σ menyatakan jumlah ikatan yang terlibat dan E merupakan energi ikatan rata-rata per mol ikatan.
Contoh:
Diketahui entalpi pembakaran sempurna 1 mol CH4= ‒18 kkal, energi ikatan:
O=O : 119 kkal mol–1
C=O : 173 kkal mol–1
O—H : 110 kkal mol–1 Tentukan energi ikatan C—H!
Jawab:
Reaksi pembakaran sempurna CH4:
CH4 + 2O2→ CO2 + 2H2O ΔH = ‒18 kkal/mol
Apabila digambarkan struktur molekulnya, maka akan menjadi seperti ini: +
22 H
│
H—C—H + 2 O=O O=C=O + 2 H—O—H
│
H
Ruas Kiri (pemutusan ikatan): Ruas Kanan (pembentukan ikatan):
4 ikatan C—H: ΔH = 4 × (C—H) 2 ikatan C=O : ΔH = 2 × 173 kkal/mol 2 ikatan O=O : ΔH = 2 × 119 kkal/mol 4 ikatan O—H: ΔH = 4 × 110 kkal/mol
ΣE = (4×C–H) + (2×119) = 4(C–H) + 238 kkal/mol ΣE = (2 × 173) + (4 × 110) = +786 kkal/mol
Masukkan ke dalam rumus:
ΔHreaksi = ΣE.pemutusan ikatan–ΣE.pembentukan ikatan
‒18 kkal/mol = (4(C—H) + 238 kkal/mol) – (+786 kkal/mol)
‒18 kkal/mol = 4(C—H) + 238 kkal/mol – 786 kkal/mol
‒18 kkal/mol = 4(C—H) ‒ 548 kkal/mol
‒4(C—H) = ‒548 kkal/mol +18 kkal/mol
‒4(C—H) = ‒530 kkal/mol
(C—H) = = 132,5 kkal/mol
Jadi, energi ikatan C—H pada pembakaran sempurna CH4 adalah 132,5 kkal/mol.
Selesai sudah pembahasan materi sebagai bekal UTS kalian
INGAT!!!