2. TINJAUAN PUSTAKA
2.1 Kandungan Gizi Umbi dan Genetik Ubi jalar
Umbi merupakan produk utama ubi jalar, dimana peran ubi jalar tidak terbatas untuk bahan pangan tetapi berkembang menjadi produk industri yang memiliki nilai tambah yang tinggi. Sebagai bahan pangan ubi jalar memiliki kandungan karbohidrat yang baik, selain itu karbohidrat yang dikandung ubi jalar masuk dalam klasifikasi Low Glycemix Index (LGI, 54), artinya komoditi ini sangat cocok untuk penderita diabetes (Salma, 2005). Ubi jalar juga sebagai sumber serat pangan yang dapat menyerap kolesterol dan sumber β karoten yang baik untuk kesehatan mata. Menurut Sarwono (2005) kelebihan ubi jalar berdaging jingga yaitu merupakan sumber vitamin C dan β karoten (pro vitamin A) yang tinggi, sedangkan ubi jalar berdaging putih mengandung vitamin C danβkaroten sangat rendah.
Ubi jalar (Ipomea batatas (L) Lam) merupakan tanaman polipolid yang mempunyai kromosom 2n = 6X = 90. Menurut Basuki (1986) ubi jalar merupakan amphiploid yang diduga berasal dari kombinasi spesies diploid dengan spesies tetraploid dari genus Ipomea dan kemudian diikuti duplikasi kromosom secara alamiah. Nishiyama (1982) yang meneliti jumlah kromosom dan mengadakan analisis genom Ipomea menentukan satu kelompok yang terdiri dari Ipomea batatas(2n = 6X = 90),Ipomea trifida(2n = 6X = 90),Ipomea littorallis(2n = 4X = 60) dan Ipomea leucantha(2n = 2X = 30), spesies-spesies tersebut nampaknya merupakan seri diploid ke heksaploid. Tetua yang asli adalah I.leucantha dan I.batatasmerupakan duplikasi secara alami dariI.leucantha(2X) menjadiI.trifida (6X) dan kemudian membentuk I.batatas(6X) atau dari I.leucantha(2X) dengan I.littorallis(4X) menjadiI.trifida(6X) dan kemudian menjadiI.batatas(6X).
2.2 Pelestarian Plasma Nutfah secara In Vitro
Pelestarian in vitro menurut Imelda dan Soetisna (1992), terbagi atas dua kelompok, yaitu kelompok yang diperbanyak dengan biji (berbiji rekalsitran) dan kelompok yang diperbanyak secara vegetatif meliputi yang tidak berbiji (steril), hanya berbiji pada saat tertentu, biji heterosigot dan tanaman umbi-umbian seperti
ubi jalar. Ubi jalar diperbanyak secara vegetatif sehingga pengaturan koleksi plasma nutfah lebih sulit dibandingkan dengan tanaman lain yang diperbanyak dengan biji, untuk itu sebagian besar pemulia melestarikan genotipe ubi jalar secarain vitro(Wattimenaet al, 2003).
Pelestarian plasma nutfah melalui penyimpanan in vitro terbagi atas 1) penyimpanan jangka panjang dimana aktivitas metabolisme dihentikan tetapi sel-sel tidak mati dengan menggunakan nitrogen cair (N2) dalam suhu yang sangat rendah, teknik ini dikenal dengan istilah kriopreservasi. 2) Penyimpanan jangka pendek yaitu dengan menekan pertumbuhan untuk sementara atau biasa disebut pertumbuhan minimal menggunakan suhu rendah, penambahan zat penghambat, penambahan gula alkohol dan pemiskinan media (Imelda dan Soetisna, 1992). Pertumbuhan minimal lebih disukai pemulia karena mudah, materi mudah tersedia dan genetik plasma nutfah stabil. Kerugian dari teknik pertumbuhan minimal adalah membutuhkan frekuensi subkultur yang lebih sering (Wattimenaet al, 2003).
Menurut Roostika dan Mariska (2003), plasma nutfah yang disimpan dengan kriopreservasi berstatus sebagai base collection (koleksi dasar) dalam bank gen in vitro, sedangkan yang disimpan dengan teknik pertumbuhan minimal berstatus sebagaiactive collection(koleksi aktif) dan koleksi tanaman di lapangan merupakanworking collection(koleksi kerja) (Gambar 1).
Pelestarian plasma nutfah melalui penyimpanan secarain vitromempunyai beberapa kelebihan antara lain 1) tidak membutuhkan tempat yang luas, 2) dapat menghemat tenaga dan biaya, 3) tidak menghadapi resiko kehilangan genotipe akibat gangguan hama, penyakit dan cekaman lingkungan, 4) memudahkan dalam pertukaran atau pengiriman bahan tanaman kepada pengguna, 5) memudahkan dalam pengambilan tindakan perbaikan apabila terjadi kemunduran pada koleksi, 6) memudahkan perbanyakan (Mariskaet al, 1996).
Gambar 2. Pemanfaatan kultur in vitro dalam koleksi plasma nutfah dan pertukaran plasma nutfah ( Karta, 1985).
2.3 Pelestarian In Vitro Ubi Jalar melalui Pertumbuhan Minimal
Pelestarian ubi jalar secarain vitro jangka pendek sering dilakukan dengan menekan pertumbuhan atau sering disebut pertumbuhan minimal. Pelestarian melalui pertumbuhan minimal salah satunya dengan menambahkan zat penghambat atau senyawa retardan seperti paclobutrazol, cycocel, ancymidol dan asam absisat (Withers, 1985; Tambunan dan Sunarlim, 2001). Penelitian yang dilakukan Munantyorini et al (2000), menyatakan bahwa konsentrasi paclobutrazol yang baik yaitu pada konsentrasi 30 mg/l. Hal in diperkuat oleh penelitian Tambunan dan Sunarlim (2001) yang menyimpulkan penyimpanan in vitro ubi jalar dengan menggunakan zat penghambat paclobutrazol lebih efisien dan efektif memperpanjang masa penyimpanan daripada menggunakan zat penghambatancymidol, dimana konsentrasipaclobutrazol yang dicobakan terbaik adalah 30 mg/l, sedangkan pada penyimpanan tanaman pule (Rauvolvia serpentina), ancymidol1 mg/l lebih baik dari paclobutrazol(Purnamaningsih dan Lestari,1997; Lestari dan Purnamaningsih, 2005). Pada tanaman obat pulasari (Alyxia stelata) paclobutrazol 5 mg/I dapat menghambat pertumbuhan sampai
Koleksi lapang
PUSAT PLASMA NUTFAH
Bank genin vitro
Mikropropagasi iro Koleksi dasar (kriopreservasi) Koleksi aktif (pertumbuhan minimal)
PERTUKARAN PLASMA NUTFAH
minggu ke 12 (Lestari et a1,1994; Lestari dan Purnamaningsih, 2005), konsentrasi paclobutrazol 5 mg/l juga dapat menekan pertumbuhan tanaman obat temu lawak (Curcuma xanthoriza) dalam media pelestarian (Syahid, 2007). Selain paclobutrazol danancymidol dapat juga digunakan ABA (Asam Absisik) sebagai penghambat pertumbuhan. Penggunaan ABA dalam media penyimpanan pada tanaman obat sambang colok (Aerva sanguinolenta) diperoleh media yang terbaik adalah MS + ABA I mg/I (Amalia et al, 2004), sedangkan media penyimpanan terbaik untuk tanaman obat daun dewa (Gynura procumbens) adalah media MS ½ + ABA 5 mg/l (Lestari dan Purnamaningsih, 2005).
Penyimpanan dengan menekan pertumbuhan dapat juga dilakukan dengan menggunakan senyawa stabilisator osmotik yaitu untuk meningkatkan osmolaritas media sehingga penyerapan nutrisi ke dalam jaringan menjadi terhambat (Tambunan dan Sunarlim, 2001). Senyawa yang dapat digunakan sebagai stabilisator osmotik antara lainmanitol (Withers, 1985; Tambunan dan Sunarlim, 2001) atau sukrosa (Bessembinder, 1993; Sunarlimet al, 1999). Dalampenelitian Sunarlim (1999), diperoleh beberapa varietas ubi jalar yang cocok disimpan menggunakan media MS + manitol 40 g/l dan juga diperoleh beberapa varietas tidak cocok menggunakan media ini. Untuk tanaman inggu media penyimpanan menggunakan ABA 4 mg/l dan manitol 500-1500 mg/1 dapat menekan pertumbuhan tunas sampai dengan. 6 bulan (Bermawie dan Kristina, 2003). Pelestarian ubi jalar selain menggunakan senyawa retardan dan osmotikum, dapat juga menggunakan senyawa penghambat lain. Dalam penelitian awal oleh Wattimena (2005), penyimpanan ubi jalar melalui pertumbuhan lambat dicapai melalui kombinasi dari pengaruh air kelapa dan asipirin, dimana air kelapa bersifat sebagai pendorong dari aspirin sebagai penghambat.
Penyimpanan ubi jalar secara in vitro dapat juga melalui pemiskinan media dasar MS. Pemiskinan media dasar MS berarti pengurangan hara dalam media in vitro, hal ini disebabkan media MS, merupakan media yang mengandung hara makro maupun mikro yang dibutuhkan oleh jaringan tanaman. Seperti dalam penyimpanan tanaman obat daun dewa, media ½ MS merupakan media terbaik untuk penyimpananin vitro(Lestari dan Purnamaningsih, 2005), sedangkan pada tanaman panili media penyimpan in vitro terbaik adalah media 3/4 MS
(Seswita et al, 2003). Namun media MS dapat digantikan oleh pupuk damn hyponex 20-20-20 yang dapat menghasilkan unsur hara makro dan mikro, dimana vitamin dalam media MS dapat digantikan oleh vitamin yang berasal dari air kelapa.
Penggunaan sukrosa dalam penyimpanan in vitro yaitu karena sukrosa
merupakan karbohidrat yang dibutuhkan tanaman sebagai sumber energi, selain itu sukrosa juga dapat bersifat sebagai stabilisator osmotik media (Winata, 1992). Penggunaan media dasar lain dalam penyimpanan in vitro ubi jalar dilakukan oleh Tambunan (2001) dengan menggunakan media dasar KH (Knop dan Heller) +
sukrosa 5 g/l dan 10 g/l + poclobutrazol 30 mg/1 menghasilkan masa
penyimpanan yang lebih panjang dan persentasi hidup yang lebih tinggi.
2.3.1 Pupuk Daun Hyponex (20-20-20)
Pupuk daun Hyponex (20-20-20) berbentuk bubuk dibuat dengan formula khas sehingga dapat memupuk semua jenis tanaman. Pupuk daun Hyponex (20-20-20) mengandung 4% nitrogen nitrat, 4% nitrogen ammonium, 12%
nitrogen yang larut dalam air, N 20% P20520%, K2O 20% dilengkapi dengan B,
Ca, Co, Fe, Mg, Mn, Mo, S, dan Zn. Bila dibandingkan dengan media MS,
kandungan nitrogen dalam 1 liter Hyponex (20-20-20) lebih rendah
dari kandungan nitrogen dalam 1 liter MS karena di dalam 1 liter Hyponex (20-20-20) terdapat 200 mg/l N, sedangkan dalam 1 liter MS terdapat 821,5 mg/l N (Muawanah, 2005). Dalam penelitian yang dilakukan Nadapdap (2000), media MS dapat disubsitusi dengan pupuk Hyponex (20-20-20) dengan konsentrasi 1,5
g/l. Pada perbanyakan in vitro kentang, dimana Hyponex (20-20-20) hanya
mensubtitusi unsur hara makro dan mikro, sedangkan vitamin dan zat pengatur tumbuh disubtitusi oleh air kelapa dengan konsentrasi 30%. Dalam penelitian Muawanah (2005), Hyponex (20-20-20) 1 g/l dan ekstrak pisang 100 g/l menghasilkan jumlah daun tertinggi dari tanaman anggrek, sedangkan Hyponex (20-20-20) 1 g/l dan ekstrak tomat 100 g/l menghasilkan panjang akar dan jumlah akar tertinggi dari tanaman anggrek. Penggunaan Hyponex (20-20-20) yang
ditambahkan ekstrak kentang pada perkecambahan in vitro biji anggrek Vanda
parishii dan Vanda denisoniana menghasilkan perkecambahan yang tinggi
2.3.2 Aspirin
Saat ini Salicylic Acid (SA) dikenali sebagai hormon tanaman, dalam
tanaman diinduksi oleh hipersensitif (Wattimena, 2005). SA selama ini dikenal
sebagai molekul signal transduksi dalam pertahanan tanaman terhadap penyakit.
Pengaruh SA dalam senesens daun selama ini tidak diketahui, namun menurut
Gan (2004) terdapat fakta yang membuktikan bahwa SA mengontrol pengaturan
senesens daun, yaitu tingkat endogenus SA dalam daun Arabidopsis meningkat
dengan meningkatnyasenesens.
Pada tahun 1898 perusahaan bayer di Jerman membuat senyawa sintetik
pertama yaitu Acetil Salicylic Acid (ASA) dan nama dagangnya adalah aspirin
yang dikenal sebagai sebagai obat sakit kepala. ASA dalam air akan terhidrolisis
menjadi salicylic acid (SA). SA berbeda dengan retardan, menurut Wattimena et al (2003) retardan adalah senyawa yang secara fisiologis memperpendek ruas eksplan dan menaikkan kandungan klorofil, sedangkan SA secara fisiologis memperpanjang durasi inisiasi daun. SA juga dapat memperpanjang katahanan umur bunga potong karena berfungsi sebagai penghambat biosintesis etilen (Leslie dan Romani, 1988).
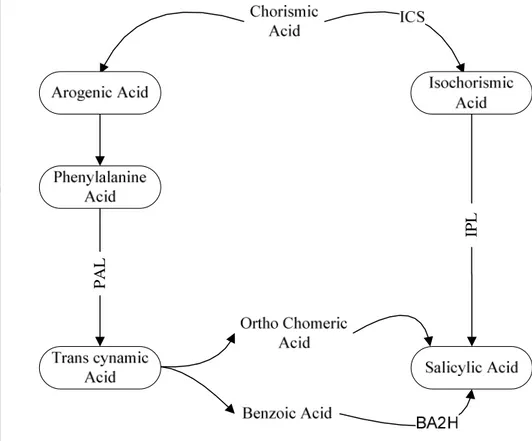
Di dalam tanaman tembakau didapati salicylic acid diproduksi dari
lintasan shikimic acid. Lintasan shikimic acid merupakan awal dari beberapa
lintasan senyawa aromatik termasuk senyawa asam amino aromatik esensial. Satu
cabang dari chorismate menghasilkan phenylalanine yang merupakan substrat
untuk enzim phenylalanine ammonia lyase (PAL) merubah menjadi trans
cinnamic acid yang dapat membentuk dua senyawa yang dilibatkan dalam
sintesis SA, kedua senyawa tersebut adalahortho coumeric aciddanbenzoic acid.
Kemudian senyawa benzoic acid dihidroksilasi menjadi SA oleh enzim benzoic
acid 2 hydroxylase (BA2H), dimana enzim ini diinduksi oleh serangan virus. SA
dari senyawaortho coumeric aciddi dalam tanaman tembakau tidak dihidroksilasi
oleh enzim BA2H. Lintasan lain dari chorismate yang dikatalis oleh enzim
sintase isochorismate(ICS) menghasilkanisochorismic acid, selanjutnya senyawa
ini dikatalis oleh enzim isochorismate pyruvate lyase menjadi SA. Di dalam
mikroorganisme lintasan ini menggambarkan sintesis SA, namun studi genetik dari Arabidopsis menunjukkan lintasan ini juga berfungsi dalam tanaman (Delaney, 2004) (Gambar 2).
IP
L
P
A
L
Gambar 3. Lintasan biosintesissalicylic acid(Delaney, 2004)
2.3.3 Air Kelapa
Selain golongan persenyawaan organik yang konstitusinya jelas,
kadang- kadang dalam media kultur jaringan juga ditambahkan persenyawaan organik kompleks, salah satunya adalah air kelapa. Air kelapa dalam kultur jaringan sebagai pemicu pertumbuhan kalus, pertumbuhan suspensi sel dan morfogenesis (Winata, 1992).
Bahan-bahan yang terkandung dalam air kelapa antara lain asam amino, asam-asam organik, asam nukleat, purin, gula, gula alkohol, vitamin, zat pengatur
tumbuh (Winata,1992). Komposisi air kelapa merupakan sumber alami darizeatin
(Trigiano dan Gray, 2004). Air kelapa mempunyai aktivitas sitokinin yang tinggi
dengan kehadiran dari zeatin, zeatin glukosida, ribosida dan 1,3 difenil urea
(Wattimena et al, 2003). Sitokinin memperlambat proses penghancuran
butir-butir klorofil pada daun-daun yang terlepas pada tanaman dan
memperlambat proses senesens pada daun, buah dan organ-organ lainnya
Selain itu air kelapa juga mengandung IAA (Mandang, 1993) dimana pengaruh fisiologis dari auksin antara lain pembesaran sel, mencegah absisi (pengguguran daun), pertumbuhan akar yaitu mendorong pembesaran sel-sel akar, dimaan selang konsentrasi yang mendorong pembesaran sel-sel akar adalah sangat rendah (Wattimena, 1988).
Dalam penelitian Wattimena (1992), air kelapa digunakan untuk menginduksi umbi kentang secara in vitro dimana air kelapa digunakan sebagai
penghasil sitokinin untuk mensubtitusi sitokinin komersial seperti zeatin, benzyl
adeninedan kinetin. Dalam media in vitro, subtitusi media MS dengan air kelapa dapat menghemat penggunaan media MS sampai 50% dan menghemat sukrosa 10 g/l, selain itu semakin besar konsentrasi air kelapa pengaruh perubahan pH media semakin kecil (Mandang, 1993). Hal ini disebabkan oleh kandungan asam organic yang dijumpai pada air kelapa berfungsi sebagai buffer terhadap perubahan pH (Wattimena, 1990).
Gula dalam air kelapa merupakan sumber karbohidrat yang meliputi sukrosa, glukosa, fruktosa dan manitol (George dan Sherington, 1984). Gula dalam proses respirasi dirombak sehingga menghasilkan suatu ikatan kimia berenergi tinggi yaitu ATP yang digunakan dalam berbagai proses seperti sintesis, transport, penyerapan dan lain-lain. Selain itu gula juga berpengaruh terhadap pertumbuhan kultur melalui pengaruhnya terhadap potensial osmotik media. Potensial osmotik berpengaruh nyata pada sifat-sifat membran, baik terhadap pengaturan keseimbangan ion dalam sel juga pada sifat-sifat protein membran
(Mandang, 1993). Gula alkohol yang terkandung dalam air kelapa (inositol) dalam
jumlah 100 mg/l dapat memperbaiki pertumbuhan tanaman in vitro
(Wattimena, 1990). Manitol merupakan senyawa stabilisator osmotik yang dapat meningkatkan osmolaritas media, sehingga penyerapan nutrisi ke dalam jaringan terhambat (Tambunan, 2001).
Dalam kultur jaringan air kelapa digunakan dalam media perbanyakan
in vitro, yaitu dengan penambahan air kelapa 10%, IBA 0,5 ppm dan 1,5 ppm merupakan konsentrasi terbaik untuk percepatan tunas, jumlah tunas dan jumlah daun tebu (Farid, 2003). Dalam media seleksi aluminium, media induksi kalus
embriogenik yang ditambahkan dengan 150 ml air kelapa, 3% manitol dan Al Cl3
400 M membentuk kalus embrionik dengan presentasi tertinggi (Sutjahjo, 2006). Dalam media induksi embryogenesis somatic dari eksplan embriozigotik buah
2.3.4 Sukrosa
Di dalam kultur jaringan eksplan atau planlet tidak berfotosintesis sehingga bahan fotosintesis diberikan berupa sukrosa. Dengan demikian banyak bahan organik yang perlu ditambahkan ke dalam media untuk mendukung pertumbuhan yang optimal. Karbohidrat terutama gula merupakan komponen yang selalu ada dalam media tumbuh, kecuali dalam media untuk tujuan khusus. Gula merupakan bagian terpenting dari medium. Sebagian besar kultur tanaman tidak dapat berfotosintesis secara efektif karena ketidakmampuan dalam
pengembangan sel dan jaringan, kekurangan klorofil, pertukaran CO2 yang
terbatas dalam jaringan dan cahaya yang lebih rendah dibandingkan dengan keadaan optimum (Robert dan Dennis, 2004), sehingga dalam media perlu ditambahkan gula sebagai penghasil energi. Gula bukan saja sebagai penghasil energi tetapi juga untuk pembentukan metabolit sekunder yang penting dalam pertumbuhan dan perkembangan tanaman. Selain itu menurut George and Sherington (1984) pengaruh nitrat dan ammonium tergantung konsentrasi sukrosa dan pengaruh pengaruh sitokinin dalam pembelahan sel juga tergantung dari ketersediaan gula.
Sukrosa merupakan gula yang sering digunakan sebagai penghasil energi dalam media kultur jaringan. Konsentrasi sukrosa 20-60 g/l (disakarida yang dibuat dari glukosa dan fruktosa) adalah sebagian besar digunakan sebagai penghasil energi karena gula ini ditransport dan disintesis secara alami dalam tanaman (Trigiano dan Gray, 2004). Sukrosa dalam media dihidrolisis menjadi monosakarida selama masa kultur, hidrolisa terjadi karena aktivitas enzim
invertase yang terdapat dalam dinding sel dan paling efektif pada pH rendah (Winata, 1992). Sukrosa adalah yang paling baik lalu glukosa, maltosa dan rafinosa. Fruktosa dan galaktosa kurang efektif, sedangkan laktosa dan manosa adalah karbohidrat yang paling tidak efektif. Konsentrasi gula tergantung tipe dan umur eksplan dalam kultur (Trigiano dan Gray, 2004).
Selain sebagai penghasil energi, gula juga berfungsi sebagai penghasil tekanan osmotik media. Kontribusi nutrisi garam berkisar antara 20-50 % untuk potensi osmotikum media dan sukrosa memberi kontribusi sisanya. Kontribusi sukrosa untuk meningkatkan tekanan osmotik yaitu sukrosa dihidrolisis ke dalam glukosa dan fruktosa selama outoklaf (Trigiano dan Gray, 2004). Menurut George
dan Sherington (1984), sukrosa memberikan pengaruh yang besar terhadap
potensial asmotik media, pada media White 4/5 bagian dari potensial osmotik disebabkan oleh sukrosa sedangkan media MS hanya 2/5 bagian dari potensial osmotik media disebabkan oleh sukrosa.
Dalam penyimpanan in vitro ubi jalar dengan perlakuan retardan, sukrosa yang ditambahkan sebesar 5 atau 10 g/l (Sunarlim, 2001), sedangkan penyimpanan ubi jalar dengan perlakuan kombinasi aspirin dan air kelapa, konsentrasi sukrosa yang digunakan adalah 30 g/l (Wattimena et al, 2003).
Konsentrasi sukrosa 30 g/l juga ditemui pada penyimpanan in vitro panili
(Seswita et al, 2003), penyimpanan in vitro daun dewa (Lestari dan
Purnamaningsih, 2005) dan penyimpananin vitrotemu lawak (Syahid, 2007).
2.3.5 Agar-Agar
Agar-agar adalah pemadat yang paling banyak digunakan. Agar-agar adalah campuran polisakarida yang diperoleh dari beberapa spesies algae. Dalam analisa unsur agar-agar mengandung sedikit Ca, Mg, K dan Na. Keuntungan dari
memakai agar-agar adalah agar-agar membeku pada suhu 45οC dan mencair pada
suhu 100οC sehingga dalam kisaran suhu kultur agar-agar dalam keadaan beku
yang stabil, agar tidak dicerna oleh enzim tanaman dan agar-agar tidak bereaksi dengan persenyawaan-persenyawaan penyusun media (Winata, 1992).
Kekerasan media meningkat secara linier pada pertambahan konsentrasi agar. Konsentrasi agar-agar yang terlalu tinggi dapat mengurangi difusi persenyawaan dari dan ke arah eksplan, sehingga pengambilan hara dan zat tumbuh berkurang sedangkan zat penghambat dari eksplan tetap berkumpul di sekitar eksplan (Winata, 1992). Kekerasan media tergantung jenis agar-agar dan menurut keasaman media, pH rendah umumnya digunakan dalam kultur jaringan tanaman. Pertumbuhan kalus atau organ tanaman pada media agar-agar secara umun kecepatannya lebih berkurang dibandingkan dengan media cair namun
pertumbuhannya akan diperbaiki jika ditambahkan nutrisi (George and
Sherington, 1984).
Potensial air pada media agar-agar lebih rendah dari media cair, hal ini diindikasikan dari meningkatnya kandungan prolin eksplan jika konsentrasi agar-agar ditingkatkan dimana diketahui bahwa kandungan prolin meningkat jika tanaman dalam keadaan stress air (George and Sherington,1984).
Dalam penyimpanan in vitro konsentrasi agar-agar yang sering digunakan adalah sebesar 8 g/l, misalnya pada tanaman ubi jalar (Tambunan dan Sunarlim, 2001), pada tanaman panili (Seswita et al, 2003) dan pada tanaman temu lawak (Syahid, 2007).