15
IV. HASIL DAN PEMBAHASAN
4.1. Analisa Bahan Baku
Media merupakan salah satu faktor yang sangat berpengaruh pada proses fermentasi Bacillus thuringiensis. Di alam banyak tersedia bahan-bahan yang dapat digunakan untuk dijadikan media pertumbuhan Bacillus thuringiensis aizawai diantaranya limbah cair tahu dan air kelapa karena mengandung sumber karbon dan nitrogen. Limbah cair tahu dan air kelapa terlebih dahulu dianalisa komponen karbon, nitrogen, kadar air dan kadar abunya yang tercantum pada Tabel 9.
Tabel 9. Hasil analisis kimia limbah cair tahu dan air kelapa
Komponen Limbah Cair Tahu
(%) Air Kelapa (%) Kadar Air 99.44 95.24 Kadar Abu 0.26 0.51 Kadar Nitrogen 0.09 0.01 Kadar Karbon 0.497 1.018
Pada Tabel 9 dapat dilihat bahwa limbah cair tahu dan air kelapa mengandung air, karbon dan nitrogen yang cukup tinggi sehingga dapat digunakan sebagai media untuk pertumbuhan Bacillus thuringiensis aizawai. Limbah cair tahu merupakan merupakan hasil samping produksi tahu yang dihasilkan pada proses pencucian, perendaman, serta pada proses penggumpalan tahu atau disebut whey.
Pada penelitian ini digunakan limbah cair tahu sisa proses penggumpalan tahu atau whey karena pada umumnya limbah cair tahu ini belum banyak dimanfaatkan, hanya digunakan untuk biang penggumpal tahu berikutnya dan sebagian besar dibuang langsung ke lingkungan yang menyebabkan pencemaran. Penambahan air kelapa digunakan sebagai sumber karbon yang bersifat fermentable sugar sehingga dapat mengoptimalkan proses fermentasi. Namun dalam penerapannya, limbah cair tahu dan air kelapa ini memiliki sifat yang mudah rusak. Kerusakan ini dapat menyebabkan penurunan pH dan nutrien yang terkandungnya akibat aktivitas mikroorganisme yang tidak diharapkan. Sehingga untuk mencegahnya perlunya penanganan bahan baku yang baik berupa pengemasan limbah cair tahu dan air kelapa pada wadah-wadah yang bersih dan steril sehingga dapat mencegah kerusakan sebelum proses fermentasi.
Penelitian peningkatan skala ini mengacu pada hasil penelitian Rachmawati (2011), bahwa formulasi media yang menghasilkan toksisitas tertinggi adalah limbah cair tahu 80% dan air kelapa 20% dengan perbandingan karbon dan nitrogen yaitu 7:1. Pada penelitian ini juga digunakan urea untuk menyesuaikan perbandingan karbon dan nitrogen. Menurut Stanbury dan Whitaker (1984), urea merupakan sumber nitrogen yang sesuai untuk pertumbuhan mikroorganisme karena kemampuannnya untuk mempertahankan pH, namun penggunaanya harus dibatasi karena cenderung tidak stabil.
Mikroorganisme juga memerlukan tambahan mineral untuk pertumbuhan dan pembentukan produknya. Pada penelitian ini, digunakan komposisi mineral yang mengacu pada pernyataan Dulmage dan Rhodes (1971), yaitu 1.0 g/l CaCO3, 0.03 g/l MgSO4.7 H2O, 0.02 g/l MnSO4.7 H2O,
16
4.2. Proses fermentasi Bacillus thuringiensis aizawai
Penelitian peningkatan skala fermentor produksi bioinsektisida dari Bacillus thuringiensis aizawai ini dilakukan pada fermentor tangki berpengaduk skala laboratorium 3 liter dan fermentor skala pilot 40 liter yang didasari pada kesamaan geometri fermentor, kesamaan bahan dan konsentrasi media yang digunakan. Pada penelitian ini diterapkan parameter-parameter yang berpengaruh bagi optimalisasi produksi bioinsektisida mikrobial dari Bacillus thuringiensis aizawa meliputi konsentrasi media, rasio C/N, agitasi, dan aerasi. Agitasi dan aerasi berfungsi untuk mensuplai oksigen secara merata, meratakan seluruh substrat agar dapat tercapai oleh mikroorganisme dan mendispersi gelembung udara dalam medium. Pada fermentor skala laboratorium digunakan fermentor volume 3 liter dengan volume kerja 2 liter, laju aerasi 1 vvm dan kecepatan agitasi 200 rpm. Berdasarkan perhitungan persamaan geometri fermentor digunakan fermentor skala pilot dengan volume 40 liter, laju aerasi 0.9 vvm dan kecepatan agitasi 104 rpm.
4.3. Pertumbuhan Bacillus thuringiensis aizawai
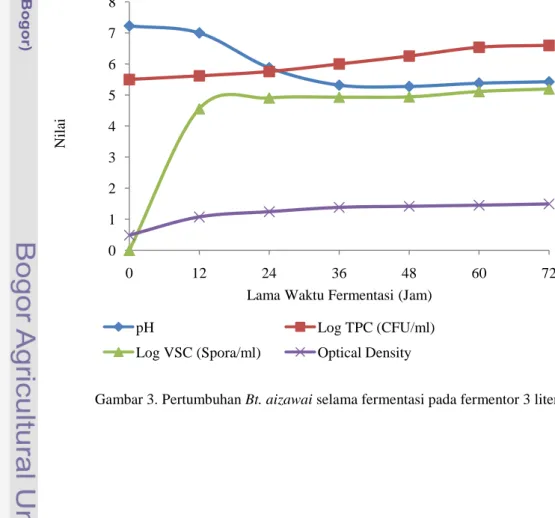
Pertumbuhan Bacillus thuringiensis aizawai selama proses fermentasi pada fermentor 3 liter dapat diamati melalui perubahan pH cairan fermentasi, pengukuran optical density (OD), pengukuran jumlah sel melalui metode cawan sebar atau total plate count (TPC), dan pembentukan spora melalui metode viable spore count (VSC) seperti yang terlihat pada Gambar 3. Sedangkan pada Gambar 4 terlihat hubungan antara jumlah biomassa melalui pengukuran bobot kering biomassa dan gula sisa selama proses fermentasi.
Gambar 3. Pertumbuhan Bt. aizawai selama fermentasi pada fermentor 3 liter 0 1 2 3 4 5 6 7 8 0 12 24 36 48 60 72 pH Log TPC (CFU/ml)
Log VSC (Spora/ml) Optical Density Lama Waktu Fermentasi (Jam)
17 Gambar 4. Produksi biomassa dan gula sisa selama fermentasi pada fermentor 3 liter
4.3.1. Perubahan pH Selama Fermentasi
Pengukuran pH dilakukan untuk mengamati perubahan pH media selama proses fermentasi. Pengukuran pH ini dilakukan setiap 12 jam sekali dari waktu fermentasi jam ke 0 sampai 72 jam. Hasil pengamatan terhadap pH cairan fermentasi menunjukkan bahwa fermentasi berlangsung pada pH 7.00-5.28 pada fermentor 3 liter yang merupakan proses translasi dari skala laboratorium.
Pada tahap awal fermentasi ini terjadi penurunan pH mencapai 5.28 kemudian pada jam ke-48 pH cairan fermentasi pada fermentor 3 liter ini mulai meningkat kembali. Penurunan pH cairan fermentasi ini dapat disebabkan karena adanya proses enzimatis oleh Bacillus thuringiensis aizawai yang mengurai glukosa dari karbon menjadi asam-asam organik. Menurut Benoit et al. (1990), pada perombakan ini dihasilkan ATP dan asam-asam organik seperti asam piruvat, asam asetat, dan asam laktat sehingga dapat menurunkan pH cairan fermentasi. Peningkatan pH cairan fermentasi mulai terjadi pada jam ke 48, hal ini disebabkan oleh penggunaan urea sebagai media sumber nitrogen dan asam yang terakumulasi pada medium dimanfaatkan kembali oleh sel untuk memproduksi poli-β-hidroksibutirat (PHB) yang selanjutnya dapat digunakan sebagai sumber energi selama proses sporulasi. James (1993) menyatakan bahwa urea yang terlarut dalam air akan mengalami perubahan kimia menjadi ammonium bikarbonat sehingga dapat meningkatkan pH larutan. Bacillus thuringiensis dapat menghasilkan enzim urease dengan urea sebagai sumber nitrogen (Sneat 1986). Peningkatan nilai pH yang tidak terlalu tajam ini dapat disebabkan karena adanya ruang antara dasar fermentor dan pengaduk yang menyebabkan meningkatnya daya gunting sehingga sebagian urea mengendap di bagian dasar tangki fermentor dan tidak teraduk sempurna.
Menurut Benhard dan Utz (1993), Bacillus thuringiensis dapat tumbuh pada pH kisaran 5.5 dan 8.5 dan tumbuh optimum pada pH 6.5-7.5. Namun pada grafik terlihat bahwa penurunan pH cairan fermentasi mencapai pH 5.2. Hal ini dapat dipengaruhi karena jumlah karbon pada limbah cair tahu dan air kelapa yang bersifat fermentable sugar lebih tinggi dibandingkan urea, sehingga semakin
0.000 0.005 0.010 0.015 0.020 0.025 0.030 0.035 0.040 0 12 24 36 48 60 72
Biomassa (g/ml) Gula Sisa Fermentasi (g/ml) Lama Waktu Fermentasi (Jam)
Ju m lah B io m ass a d an Gu la Sis a Fer m en tasi ( g /m l)
18 banyak jumlah karbon berupa gula sederhana pada media maka pembentukan asam piruvat akan semakin besar sehingga penurunan pH cairan fermentasi semakin meningkat. Menurut Sjamsuripura et al. (1984), kemampuan tumbuh dan daya toksin Bacillus thuringiensis dapat hancur pada pH di atas 12 dan pH di bawah 3.3. Hal ini membuktikan bahwa Bacillus thuringiensis masih dapat hidup dan memiliki daya toksin pada pH 5.
4.3.2. Optical Density (OD)
Optical density merupakan pengukuran jumlah sel dalam kekeruhan atau turbidity cairan fermentasi, dimana semakin keruh suatu larutan maka menunjukkan jumlah sel semakin meningkat. Menurut Gumbira-Said (1987), kekeruhan suspensi sel diukur pada panjang gelombang 600-700 nm menggunakan spektrofotometer. Pada penelitian ini, pengukuran optical density dilakukan pada panjang gelombang 660 nm menggunakan spektrofotometer.
Pada Gambar 3 terlihat bahwa semakin lama waktu fermentasi maka nilai OD akan semakin meningkat yang menunjukkan bahwa cairan fermentasi semakin berwarna keruh akibat aktivitas sel, sehingga semakin lama waktu fermentasi hingga 72 jam jumlah sel pun semakin meningkat. Menurut Wang et al. (1978), pertumbuhan curah pada media tertentu memiliki empat fase dalam pertumbuhannya yaitu fase awal atau fase lag, fase logaritmik (eksponensial), fase stasioner, dan fase kematian. Pada grafik terlihat bahwa fase lag berlangsung sangat singkat, selanjutnya fase logaritmit terjadi sampai jam ke 24 dan mulai memasuki fase stasioner sampai jam ke 72. Berdasarkan penelitian Salamah (2002) dan Yulianti (2005), fase log Bacillus thuringiensis berlangsung kurang dari 3 jam dan mulai memasuki fase log pada waktu kultivasi 3-24 jam. Semakin tinggi nilai OD maka jumlah sel pada suatu larutan fermentasi semakin besar.
4.3.3. Jumlah Sel Hidup
Pertumbuhan Bacillus thuringiensis aizawai juga dapat diamati melalui pengukuran total plate count (TPC) atau metode cawan sebar. Metode TPC ini digunakan untuk mengukur jumlah sel hidup melalui koloni yang terbentuk dalam 1 ml cairan fermentasi yang dinyatakan dalam colony forming unit (CFU/ml). Pada gambar 3 terlihat bahwa fase lag berlangsung cepat yang menunjukan bahwa inokulum telah beradaptasi dengan medium fermentasi, selain itu banyaknya jumlah sel yang diinokulasikan juga mempengaruhi panjang pendeknya fase lag. Setelah fase lag selesai, mulai terjadi perbanyakan sel atau fase logaritmik yang terjadi sampai jam ke 60. Hasil pengamatan menunjukkan bahwa semakin lama waktu fermentasi jumlah sel semakin meningkat dengan jumlah sel hidup tertinggi adalah pada waktu kultivasi 72 jam yaitu dengan nilai Log TPC sebesar 6.60 atau 3.99 × 106
CFU/ml. Hal ini sesuai dengan grafik optical density dimana semakin lama waktu fermentasi hingga 72 jam cairan fermentasi semakin berwarna keruh akibat aktivitas sel yang menunjukkan jumlah sel dalam cairan fermentasi juga semakin besar. Namun jumlah sel yang dihasilkan pada penelitian ini lebih kecil dibandingkan hasil penelitian Purnawati (2006) menggunakan substrat onggok tapioka pada fermentor tangki berpengaduk volume 3 liter memiliki konsentrasi sel berkisar antara 1.69 × 109
sampai 1.70 × 109 CFU/ml untuk waktu fermentasi 72 jam.
4.3.4. Jumlah Spora Hidup (VSC)
Viable spore count (VSC) merupakan suatu analisa yang digunakan untuk mengukur jumlah spora hidup yang terkandung dalam campuran spora kristal. Pembentukan spora selama fermentasi merupakan hal yang sangat penting karena bahan aktif bioinsektisida berupa kristal protein dibentuk
19 bersamaan dengan pembentukan spora dimana satu buah sel vegetatif. Bacillus thuringiensis dapat membentuk satu buah spora dan satu buah kristal protein. Semakin banyak jumlah spora yang terbentuk maka diharapkan semakin tinggi pula kristal protein yang terbentuk.
Berdasarkan hasil pengamatan pada grafik di atas terlihat bahwa pembentukan spora mulai terjadi pada waktu fermentasi jam ke 12 dan penambahan jumlah spora seiring lamanya waktu fermentasi yang cenderung tetap dan membentuk garis stasioner. Pembentukan spora umumnya mulai terlihat nyata pada saat fase eksponensial akhir atau awal fase stasioner. Hal ini sesuai dengan penelitian Salamah (2002) dan Yulianti (2005), bahwa Bacillus thuringiensis mulai memasuki fase eksponensial pada waktu kultivasi 3-24 jam. Jumlah spora tertinggi pada waktu fermentasi jam 72 yaitu 1.58 × 105 spora/ml. Jumlah spora ini lebih rendah dibandingkan pendapat Luthy et al. (1992), dimana konsentrasi yang ditetapkan untuk produksi skala besar antara 5 × 109 sampai 1 × 1010 spora per ml. Hal ini dapat disebabkan karena adanya daya gunting dan pengadukan yang kurang sempurna karena adanya jarak antara dasar tangki fermentor dan impeller sehingga penyebaran sumber karbon dan nitrogen tidak merata yang menyebabkan nilai pH tidak berada pada kondisi optimum pertumbuhan Bacillus thuringiensis yaitu pada pH 6.5-7.5.
Menurut Sukmadi et al. (1996), cepat lambatnya pembentukan spora tergantung pada lingkungan kultur dan umumnya spora terbentuk pada keadaan lingkungan yang kurang sesuai seperti nilai pH dan suhu yang ekstrim, serta kurangnya suplai makanan bagi Bacillus thuringiensis. Pembentukan spora juga mulai terlihat nyata pada saat fase eksponensial akhir atau awal fase stasioner dimana pada kondisi fermentasi ini mengalami penurunan pH yang ekstrim yaitu dari pH awal 7 turun menjadi 5 sehingga sel mulai membentuk spora. Pada Gambar 3 terlihat bahwa jumlah log spora, log TPC dan nilai OD semakin meningkat seiring lamanya waktu fermentasi sampai 72 jam, hal ini menunjukkan bahwa semakin lama waktu fermentasi pertumbuhan Bt. aizawai semakin baik dan belum memasuki fase kematian.
4.3.5. Jumlah Biomassa
Pengukuran jumlah biomassa dilakukan dengan cara pengukuran bobot kering biomassa dengan metode oven. Bobot kering biomassa merupakan salah satu cara untuk mengukur jumlah sel, namun pengukuran bobot kering biomassa ini adalah pengukuran jumlah sel total sehingga tidak hanya mengukur jumlah sel sel hidup saja, namun sel mati, spora, serta bahan-bahan lain yang tidak larut pun terkadang ikut terhitung, sehingga bobot kering boimassa tertinggi tidak menghasilkan jumlah sel tertinggi. Berdasarkan hasil pengamatan, jumlah sel cenderung semakin meningkat seiring lamanya waktu fermentasi dengan jumlah sel tertinggi adalah pada jam ke 48 yaitu 0.033 g/ml. Namun, pada waktu fermentasi ke 60 dan 72 jam terjadi penurunan bobot kering biomassa sedangkan perhitungan jumlah sel hidup tertinggi berdasarkan metode TPC adalah pada lama waktu fermentasi 72 jam. Hal ini dapat disebabkan karena sel Bacillus thuringiensis aizawai mulai mengalami lisis dan massa sel yang mengalami lisis tersebut sebagian akan dikonversi menjadi energi yang dimanfaatkan oleh sel yang masih hidup sebagai sumber energi untuk pertumbuhannya sehingga dapat mengurangi bobot biomassa yang terukur.
4.3.6. Gula Sisa Fermentasi
Pertumbuhan Bacillus thuringiensis aizawai ini juga berpengaruh dengan konsumsi substrat karena selama prose fermentasi berlangsung sel akan mengkonversi substrat sumber karbon menjadi biomassa dan produk. Gula merupakan sumber karbon utama yang dikonsumsi bakteri sebagai sumber energi untuk metabolismenya. Hal ini ditandai dengan berkurangnya konsentrasi karbon selama proses
20 fermentasi berlangsung. Dalam penelitian ini, limbah cair tahu dan air kelapa sebagai sumber karbon mengalami penurunan kadar glukosa akibat dikonversi menjadi biomassa dan produk. Penggunaan substrat bagi pertumbuhan Bacillus thuringiensis aizawai yang ditunjukan dengan berkurangnya konsentrasi gula dapat dilihat pada Gambar 4.
Pada Gambar 4 di atas terlihat bahwa semakin lama waktu fermentasi, konsentrasi gula pada medium semakin menurun karena gula ini dikonsumsi oleh sel untuk menghasilkan biomassa dan produk. Hasil pengamatan menunjukkan penurunan konsentrasi gula terbesar adalah pada waktu fermentasi 72 jam yaitu 0.38% karena pada waktu kultivasi 72 jam. Pada grafik produksi biomassa dan gula sisa fermentasi selama waktu fermentasi pada fermentor 3 liter terlihat bahwa kadar gula dalam medium semakin menurun dan jumlah biomassa semakin meningkat dengan semakin lamanya waktu fermentasi.
4.4. Uji Toksisitas Bioinsektisida
Pengujian toksisitas bioinsektisida bertujuan untuk menentukan nilai LC50 dan potensi produk
bioinsektisida yang dihasilkan. LC50 merupakan konsentrasi bioinsektisida yang menyebabkan 50 %
serangga uji mati, sehingga semakin kecil nilai LC50 maka semakin besar tingkat toksisitasnya.
Pengujian toksisitas ini dilakukan dengan metode bioassay yaitu dengan cara menentukan mortalitas larva ulat kubis C. pavonana atas perlakuan bioinsektisida yang diberikan. Potensi toksisitas bioinsektisida dapat dilihat pada Tabel 10 di bawah ini dengan perhitungan yang terdapat pada Lampiran 3.
Tabel 10. Potensi toksisitas bioinsektisida
Waktu Fermentasi (Jam) LC50 Potensi produk (IU/mg) Rata-Rata
Fermentor 3 liter Fermentor 40 liter Rata-Rata
48 0.01 0.01 0.01 80,000
60 0.09 0.01 0.05 16,000
72 0.02 0.04 0.03 26,667
Bactospeinea 0.05 16,000
aSyarfat (2010)
Hasil pengujian tingkat toksisitas bioinsektisida pada fermentor skala laboratorium 3 liter dan skala pilot 40 liter menunjukkan hasil yang tidak berbeda jauh. Nilai LC50 memiliki korelasi yang
berlawanan dengan potensi produknya, dimana semakin kecil nilai LC50 yang dihasilkan maka
semakin besar potensinya. Pada penelitiaan ini dihasilkan tingkat toksisitas tertinggi adalah pada waktu fermentasi 48 jam dengan nilai LC50 yaitu 0.01 mg/L dan potensi produk 80,000 IU/mg. Nilai
LC50 ini menunjukkan dengan penggunaan konsentrasi bioinsektisida 0.01 mg/L dapat mematikan
50% serangga target. Pengujian dan perhitungan toksistas bioinsektisida tercantum pada Lampiran 6. Nilai LC50 yang dihasilkan pada penelitian ini lebih kecil dibandingkan dengan nilai LC50 produk
komersial bactospeine yang menunjukkan bahwa potensi produk bioinsektisida yang dihasilkan lebih besar dari potensi produk bactospeine. Nilai LC50 yang dihasilkan pada penelitian ini sama dengan
hasil penelitian skala laboratorium yang dilakukan Rachmawati (2011) dengan media yang sama, dan juga lebih kecil dibandingkan dengan hasil penelitian sebelumnya yang dilakukan Syarfat (2010)
21 dengan menggunakan media 20% ampas tahu dan 80% limbah cair tahu dengan waktu fermentasi selama 30 jam yang menghasilkan nilai LC50 sebesar 1.34 mg/L dengan potensi produk 597.01 IU/mg.
Nilai LC50 dan potensi produk tidak selalu berkorelasi positif dengan nilai TPC dan VSC
produk. Hal ini menunjukkan bahwa tingkat toksisitas produk bioinsektisida tidak selamanya dipengaruhi oleh jumlah sel dan jumlah spora yang terkandung dari produk bioinsektisida tersebut, namun lebih dipengaruhi oleh kualitas strain Bacillus thuringiensi dan kemudahan dicerna dalam usus serangga target karena produk bioinsektisida ini bersifat racun perut. Hal ini sesuai dengan hasil penelitian yang dilakukan oleh Rahayuningsih (2000) pada Bt. israelensis, dan Moris et al. (1996) pada Bt. aizawai.
Produk bioinsektisida yang dihasilkan adalah bioinsektisida yang bersifat racun perut, sehingga untuk mengoptimalkan penggunaan produk ini dibuat dalam bentuk flowable suspension yang mudah diserap oleh daun dan kandungan gula dalam air kelapa ini akan menarik serangga target untuk memakan daun yang telah diberikan bioinsektisida. Menurut Dulmage dan Rhodes (1971), toksisitas spora Bacillus thuringiensis terhadap target dipengaruhi oleh strain bakteri dan keadaan serangga target. Struktur kristal, ukuran molekul protein yang menyusun kristal yang berbeda untuk setiap strain, serta kondisi pH di dalam usus besar serangga target akan berpengaruh pada kelarutan kristal protein. Proses toksisitas kristal protein sebagai bahan aktif bioinsektisida dimulai dengan termakannya kristal protein oleh serangga. Kristal protein ini akan dipecah oleh enzim protease pada kondisi basa dalam usus tengah serangga sehingga melepaskan δ-endotoksin yang bersifat toksin. Toksin ini akan berinteraksi dengan resptor-reseptor pada sel-sel epithelium usus tengah larva serangga yang rentan. Setelah toksin ini bereaksi, maka akan menyebabkan terbentuknya lubang-lubang pada membran sel sehingga dapat mengganggu keseimbangan osmotik sel dan mengakibatkan terjadinya pembengkakan yang menyebabkan larva berhenti makan dan mati. Selain itu, kemampuan enzim protease dalam usus serangga untuk mencerna kristal protein dan adanya reseptor khusus yang mampu mengikat toksin dapat mempercepat aktifitas kerja bioinsektisida. Perbandingan nilai LC50
hasil penelitian ini dan hasil penelitian sebelumnya pada masing-masing perlakukan dapat dilihat pada Tabel 11 berikut.
Tabel 11. Perbandingan nilai LC50 produk bioinsektisida pada masing-masing perlakuan dengan
lama fermentasi 48 jam
Perlakuan Nilai LC50 (mg/L)
Produksi bioinsektisida Bt. aizawai pada fermentor tangki berpengaduk kapasitas 3 liter dengan agitasi 200 rpm dan aerasi 1 vvm pada media limbah cair tahu dan air kelapa
0.01
Produksi bioinsektisida Bt.israelensis pada fermentor tangki berpengaduk kapasitas 3 liter dengan agitasi 200 rpm dan aerasi 1 vvm pada media onggok tapioka
0.002a
Produksi bioinsektisida Bt.israelensis pada fermentor kolom gelembung kapasitas 3 liter dengan aerasi 1 vvm pada media air kelapa
41.086b
Sumber: a Afrianto (2006)
b
Yulianti (2001)
Pada Tabel 11 terlihat bahwa nilai LC50 yang dihasilkan pada produksi bioinsektisida pada
fermentor tangki berpengaduk lebih kecil dibandingkan nilai LC50 yang dihasilkan dari produksi
bioinsektisida pada fermentor kolom gelembung. Hal ini menunjukkan bahwa penggunaan fermentor tangki berpengaduk memberikan kondisi yang lebih optimum karena penyebaran substrat lebih
22 merata. Nilai LC50 yang dihasilkan pada penelitian ini lebih besar dibandingkan dengan penelitian
sebelumnya yang dilakukan Afrianto (2006) menggunakan Bt. israelensis pada media onggok tapioka, namun perbedaan nilai LC50 tidak berbeda jauh yang menunjukkan bahwa limbah cair tahu dan air
kelapa dapat digunakan sebagai media dalam produksi bioinsektisida.
4.2. Peningkatan Skala Fermentor
Kajian peningkatan skala ini dimulai dari percobaan skala laboratorium untuk mengetahui faktor-faktor fisik, kimia dan biologis yang mempengaruhi proses dan hasil fermentasi Bacillus thuringiensis aizawai pada substrat limbah cair tahu dan air kelapa. Berdasarkan data penelitian sebelumnya yaitu menurut Rachmawati (2011), bahwa kondisi optimal untuk pertumbuhan Bacillus thuringiensis aizawai adalah perbandingan konsentrasi C dan N adalah 7:1 dengan formulasi media limbah cair tahu 80% dan air kelapa 20%. Mengacu pada penelitian Afrianto (2006) dan Purnawati (2006), kecepatan agitasi 200 rpm dan kecepatan aerasi 1 vvm selama proses fermentasi pada fermentor 2 liter menghasilkan tingkat toksisitas yang tinggi pada produksi bioinsektisida dari Bacillus thuringiensis. Berdasarkan data-data kondisi optimum pada proses fermentasi Bacillus thuringiensis aizawai ini, lalu dirancang suatu rancangan dan prosedur untuk skala pilot. Rancangan ini bertujuan untuk memberikan kondisi fermentasi yang optimum sehingga dapat dipergunakan untuk rancang bangun alat dan proses produksi pada skala yang lebih besar atau skala industri.
Peningkatan skala fermentor produksi bioinsektisida berbahan aktif Bacillus thuringiensis aizawai ini didasarkan kesamaan geometri fermentor, jenis bahan dan proporsi bahan yang digunakan sama yaitu 80% limbah cair tahu dan 20% air kelapa. Parameter kesamaan geometri fermentor meliputi jenis impeller, jumlah impeller (Ni), serta perbandingan diameter tangki (Dt) dan diameter impeller (Di) yang mengacu pada pendapat Wang (1978) yang terdapat pada Lampiran 4. Geometri fermentor skala laboratorium 3 liter dan skala pilot 40 liter dapat tercantum pada Tabel 12.
Tabel 12. Geometri fermentor 3 dan 40 liter
Parameter Satuan Ukuran Fermentor
3 L 40 L
Tipe impeller - Turbin pipih Turbin pipih
Jumlah impeller (Ni) - 2 2
Jumlah buffle (Nb) - 3 4
Tinggi fermentor m 0.27 0.60
Diameter impeller (Di) m 0.045 0.12
Diameter tangki (Dt) m 0.13 0.297
Volume kerja L 2 22
Metode peningkatan skala yang digunakan adalah metode kaidah ibu jari (rule of thumb) karena telah banyak diterapkan dalam industri fermentasi dengan patokan penggandaan skala yang berhubungan dan mengacu pada perpindahan oksigen (tekanan parsial O2 dan Po2 adalah fungsi dari
KLa yang merupakan fungsi dari Pg/V). Hasil penelitian Purnawati (2006) menyatakan bahwa
efisiensi penggunaan substrat berdasarkan hasil peningkatan skala laboratorium ke skala pilot plant berbasis Pg/V memperoleh hasil yang lebih baik dibandingkan peningkatan skala berbasis KLa yang
menunjukkan bahwa metabolisme Bacillus thuringiensis berlangsung baik. Sehingga pada penelitian ini digunakan kriteria tenaga per unit volume (Pg/V), dimana nilai tenaga per unit volume yang diperoleh dari skala laboratorium akan diterapkan dalam produksi skala pilot.
23 Jenis fermentor yang digunakan pada penelitian ini adalah fermentor tangki berpengaduk yang terdapat sistem agitasi dan aerasi yang digunakan untuk mentransfer kebutuhan oksigen. Peningkatan skala produksi bioinsektisida dari skala fermentor 3 liter menjadi 40 liter menggunakan basis kebutuhan tenaga per volume (Pg/V) tetap membutuhkan kebutuhan agitasi sebesar 104 rpm dengan laju aerasi 0.90 vvm.
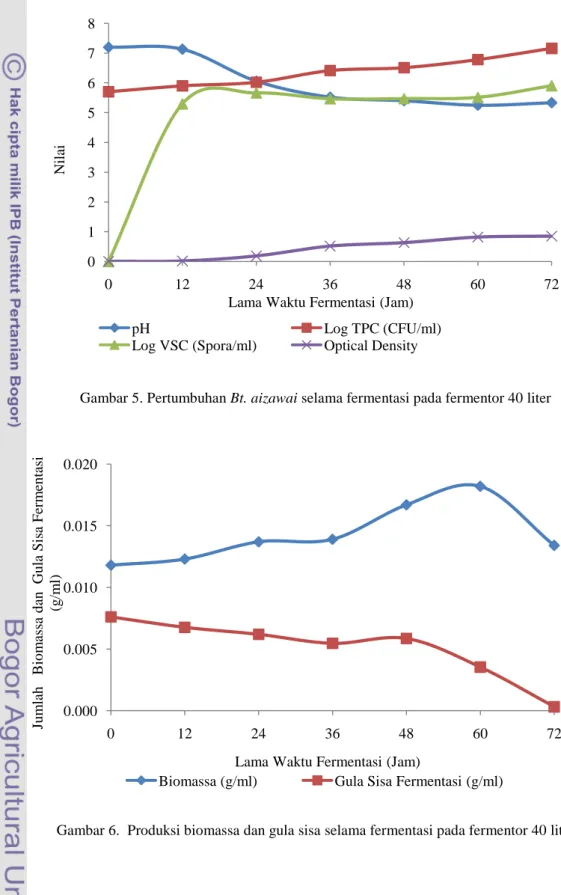
Gambar 5. Pertumbuhan Bt. aizawai selama fermentasi pada fermentor 40 liter
Gambar 6. Produksi biomassa dan gula sisa selama fermentasi pada fermentor 40 liter 0 1 2 3 4 5 6 7 8 0 12 24 36 48 60 72 pH Log TPC (CFU/ml)
Log VSC (Spora/ml) Optical Density Lama Waktu Fermentasi (Jam)
Nilai 0.000 0.005 0.010 0.015 0.020 0 12 24 36 48 60 72
Biomassa (g/ml) Gula Sisa Fermentasi (g/ml) Lama Waktu Fermentasi (Jam)
Ju m lah B io m ass a d an Gu la Sis a Fer m en tasi (g /m l)
24 Pada Gambar 5 terlihat bahwa pertumbuhan Bt. aizawai dan lama waktu fermentasi menunjukkan korelasi yang positif dimana semakin lama waktu fermentasi sampai 72 jam, pertumbuhan Bt. aizawai melalui pengukuran nilai optical density, log TPC dan log VSC yang semakin meningkat. Namun, nilai pH mengalami penurunan dan mulai meningkat kembali pada waktu fermentasi 48 jam.
Produksi bioinsektisida berbahan aktif Bacillus thuringiensis aizawai pada skala pilot yaitu fermentor 40 liter yang memiliki volume kerja 22 liter memperlihatkan pertumbuhan Bacillus thuringiensis aizawai selama proses fermentasi yang tidak berbeda jauh dari produksi bioinsektisida pada fermentor skala laboratorium 3 liter seperti yang terlihat pada Gambar 5. Nilai pH cairan fermentasi pada fermentor 40 liter memilki kisaran antara 7.23-5.25, sedangkan pH cairan fermentasi pada fermentor 3 liter adalah 7.00-5.28.
Jumlah sel yang dihasilkan selama proses fermentasi pada fermentor 40 liter dengan volume kerja 22 liter memiliki nilai yang lebih besar dibandingkan Jumlah sel yang dihasilkan pada fermentasi 3 liter. Hasil pengamatan menunjukkan bahwa semakin lama waktu fermentasi, jumlah sel semakin meningkat dengan jumlah sel hidup tertinggi pada skala pilot adalah pada waktu kultivasi 72 jam yaitu 1.44 × 107 CFU/ml, sedangkan pada skala laboratorium menggunkan fermentor 3 liter dihasilkan jumlah sel tertinggipada waktu kultivasi 72 jam yaitu 3.99 × 106 CFU/ml. Jumlah spora tertinggi pada skala pilot ini adalah pada waktu fermentasi 72 jam sebesar 8.03 × 105 spora/ml,
sedangkan jumlah spora tertinggi pada skala produksi laboratorium menggunakan fermentor 3 liter adalah pada waktu fermentasi jam 72 yaitu 1.58 × 105 spora/ml.
Pada Gambar 6 terlihat bahwa jumlah biomassa berkorelasi negatif dengan total gula sisa terhadap lamanya waktu fermentasi. Nilai biomassa tertinggi yang dihasilkan pada fermentasi skala pilot 40 liter ini adalah pada fermentasi selama 60 jam yaitu 0.018 g/ml, sedangkan pada fermentor skala laboratorium bobot biomasa tertinggi adalah pada waktu fermentasi 48 jam yaitu 0.033 g/ml. Perbedaan ini dapat terjadi karena pengukuran bobot kering biomassa ini tidak hanya mengukur jumlah sel sel hidup saja, tetapi sel mati, spora, serta bahan-bahan lain yang tidak larut pun terkadang ikut terhitung sehingga dapat terjadi perbedaan bobot kering biomassa pada skala produksi yang berbeda dan bobot kering boimassa tertinggi tidak menghasilkan jumlah sel tertinggi. Selain itu, total gula sisa fermentasi pada skala pilot lebih kecil dibandingkan pada skala produksi laboratorium, hal ini menunjukkan bahwa gula yang terdapat pada media yang terdapat pada fermentor 40 liter dikonversi menjadi produk dan biomassa lebih baik dibandingkan pada skala laboratorium.
Secara umum, perubahan yang terjadi pada penggandaan skala berbasiskan kebutuhan daya per volume (Pg/V) pada skala pilot menghasilkan pertumbuhan Bacillus thuringiensis aizawai yang lebih baik dari skala laboratorium. Hal ini sesuai dengan pernyataan Wang et al. (1978) bahwa sifat-sifat biologis yang tercakup dalam pertumbuhan mikroorganisme selama fermentasi tergantung pada peningkatan skala. Selain itu, beberapa parameter kinetika akan berubah walaupun pola metabolisme tidak berubah, parameter kinetika fermentasi pada produksi bioinsektisida pada fermentor 3 dan 40 liter dapat dilihat pada Tabel 13 di bawah ini dengan perhitungan yang tercantum pada Lampiran 5.
25 Tabel 13. Parameter kinetika fermentasi produksi bioinsektisida dari Bacillus thuringiensis aizawai
pada fermentor skala 3 dan 40 liter
Parameter Satuan 3 liter 40 liter
Log N-max CFU/L 9.60 10.16
Log VSC-max Spora/L 8.20 8.91
µN-max (Jam-1) 0.0025 0.0035
YN/S Log TPC/g substrat 0.26 0.196
YP/S Log Spora/g substrat 0.91 0.65
(S0-St)/S0 % 49.76 95.78
Hasil pengamatan peningkatan skala dari skala laboratorium menjadi skala pilot menunjukkan bahwa efisiensi penggunaan substrat dan laju pertumbuhan sel (µN-max) menjadi lebih baik, dimana
pada skala fermentor 40 liter efisiensi penggunaan substrat sebesar 95.78% sedangkan pada fermentor 3 liter sebesar 49.76%. Hal ini menunjukkan bahwa peningkatan skala pada skala pilot menghasilkan metabolisme yang lebih baik. Selain itu, proses pengadukan menggunakan agitator juga mempengaruhi transfer substrat secara merata sehingga dapat meningkatkan efisiensi penggunaan substrat.
Berdasarkan hasil pengamatan pertumbuhan Bacillus thuringiensis aizawai, parameter kinetika fermentasi dan tingkat toksisitas bioinsektisida yang dihasilkan pada skala laboratorium ke skala pilot, maka rancang bangun fermentor produksi bioinsektisida mikrobial menggunakan limbah cair tahu dan air kelapa pada skala industri yaitu fermentor 10,000 liter dilakukan berdasarkan kesamaan geometri fermentor dengan menggunakan nilai Pg/V tetap dengan perhitungan yang terdapat pada Lampiran 6. Hasil perhitungan rancang bangun fermentor 10,000 liter dapat dilihat pada Tabel 14 berikut.
Tabel 14. Rancang bangun fermentor 10,000 liter
Parameter Satuan Ukuran
Tinggi Tangki m 2.91
Diameter impeller (Di) m 0.85
Diameter tangki (Dt) m 2.09 Volume kerja (V) L 7,000 Densitas media (ρ) g/ml 1.0181 Viskositas media (µ) CP 87.34 Kecepatan agitasi rpm 28.29 Laju aerasi vvm 0.27 Kebutuhan Pg/V HP/m3 0.0256
Hasil perhitungan penggandaan skala pada skala industri yaitu fermentor 10,000 L menunjukkan bahwa kebutuhan Pg/V adalah 0.0256 HP/m3 per sekon dengan laju aerasi 0.27 vvm, dan kecepatan agitasi 0.47 rps. Berdasarkan kesamaan geometri, fermentor 10,000 liter memiliki diameter tangki 2.09 m dan diameter impeller 0.85 m dengan volume kerja 7,000 liter. Hasil perhitungan peningkatan skala fermentor berdasarkan Pg/V pada penelitian ini tidak berbeda jauh dengan hasil perhitungan peningkatan skala fermentor produksi bioinsektisida Bt. israelensis menggunakan substrat onggok tapioka yang dilakukan Purnawati (2006) bahwa kebutuhan daya per
26 volume (Pg/V) pada fermentor 10,000 L dengan volume kerja 7,000 L adalah sebesar 0.016 HP/m3 dengan dengan laju aerasi 0.18 vvm, dan kecepatan agitasi 0.53 rps.