UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. SYDNA FARMA
JL. RC. VETERAN NO. 89 BINTARO, JAKARTA SELATAN PERIODE 1 APRIL – 3 JUNI 2013
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
KARTIKA WIDYANTY, S.Farm.
1206313261
ANGKATAN LXXVI
FAKULTAS FARMASI PROGRAM PROFESI APOTEKER
DEPOK
JUNI 2013
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. SYDNA FARMA
JL. RC. VETERAN NO. 89 BINTARO, JAKARTA SELATAN PERIODE 1 APRIL - 3 JUNI 2013
Diajukan sebagai salah satu syarat untuk memperoleh gelar Apoteker
KARTIKA WIDYANTY, S.Farm.
1206313261
ANGKATAN LXXVI
FAKULTAS FARMASI PROGRAM PROFESI APOTEKER
DEPOK
JUNI 2013
HALAMAN PENGESAHAN
Laporan Praktek Kerja Profesi ini diajukan oleh : Nama : Kartika Widyanty, S. Farm.
NPM : 1206313261
Program Studi : Apoteker – Fakultas Farmasi UI
Judul Laporan : Laporan Praktek Kerja Profesi Apoteker di PT. Sydna Farma Jalan RC. Veteran Nomor 89 Bintaro, Jakarta Selatan Periode 1 April – 3 Juni 2013
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Apoteker pada Program Studi Apoteker, Fakultas Farmasi, Universitas Indonesia.
DEWAN PENGUJI
Pembimbing I : Dra. Nony Shilviani, Apt. ( ... )
Pembimbing II : Dr. Iskandarsyah, M.S., Apt. (... )
Penguji I : ... (... )
Penguji II : ... (... )
Penguji III : ... (... )
Ditetapkan di : Depok
Tanggal :
Segala puji dan syukur hanyalah untuk Allah SWT atas limpahan nikmat, rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan Praktek Kerja Profesi Apoteker dan penyusunan laporan ini tepat waktu. Shalawat dan salam senantiasa tercurah kepada Nabi Muhammad SAW beserta keluarga dan sahabatnya. Dalam ruang yang terbatas ini, dengan segala kerendahan hati, penulis ingin menyampaikan terima kasih dan rasa hormat kepada :
1. Ibu Prof. Dr. Yahdiana Harahap, M.S. selaku Dekan Fakultas Farmasi UI.
2. Bapak Dr. Harmita, Apt. selaku Ketua Program Profesi Apoteker Fakultas Farmasi UI.
3. Ibu Dra. Nony Shilviani, Apt. selaku Manajer Pabrik PT. Sydna Farma yang telah memberikan kesempatan untuk melakukan PKPA di PT. Sydna Farma, serta selaku pembimbing yang telah memberikan bimbingan, pengarahan, pelatihan, ilmu dan saran kepada penulis selama peyusunan laporan PKPA.
4. Bapak Dr. Iskandarsyah, M.S., Apt. selaku pembimbing dari Fakultas Farmasi yang telah memberikan ilmu, bimbingan, dan nasehat yang begitu bermanfaat kepada penulis selama peyusunan laporan PKPA.
5. Ibu Arzuliana Zulkati, S.Si., Apt. selaku Manajer Mutu PT. Sydna Farma yang telah memberikan bimbingan, pengarahan, ilmu dan saran kepada penulis selama peyusunan laporan PKPA.
6. Bapak Wisnu Hercahya, S.Si., Apt. selaku Asisten Manajer R & D PT. Sydna Farma yang telah memberikan bimbingan, pengarahan, ilmu dan saran kepada penulis selama peyusunan laporan PKPA
7. Seluruh Manajer, Supervisor, dan staff PT. Sydna Farma yang telah membantu dalam pelaksanaan praktek kerja profesi dan penyusunan laporan ini.
8. Seluruh dosen dan staf tata usaha Fakultas Farmasi UI atas ilmu dan bantuan yang diberikan selama penulis menjalani pendidikan di Program Profesi Apoteker.
9. Keluarga tercinta yang telah memberikan bantuan moril dan materil dan atas
kesabarannya, kasih sayang, dukungan, perhatian dan doa untuk
menyelesaikan pendidikan profesi Apoteker dengan sebaik mungkin.
10. Rekan-rekan PKPA di PT. Sydna Farma yang telah berbagi ilmu, pengalaman dan juga menghibur selama pelaksanaan PKPA.
11. Seluruh sahabat dan teman Program Profesi Apoteker, Fakultas Farmasi UI selaku teman seperjuangan yang telah memberikan dukungan dan semangat.
Penulis menyadari bahwa penyusunan laporan PKPA ini masih jauh dari kesempurnaan. Oleh karena itu, penulis dengan senang hati menerima segala kritik dan saran demi perbaikan di masa yang akan datang. Tak ada yang penulis harapkan selain sebuah keinginan agar laporan PKPA ini dapat bermanfaat bagi pengembangan ilmu pengetahuan pada umumnya dan ilmu farmasi pada khususnya.
Penulis
2013
vi
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
HALAMAN PERSETUJUAN PUBLIKASI... vi
DAFTAR ISI... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
BAB 1. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
BAB 2. TINJAUAN UMUM ... 3
2.1 Industri Farmasi ... 3
2.2 Cara Pembuatan Obat yang Baik (CPOB) ... 6
BAB 3. TINJAUAN KHUSUS ... 24
3.1 Profil PT. Sydna Farma ... 24
3.2 Lokasi dan Sarana Produksi ... 24
3.3 Visi dan Misi ... 26
3.4 Nilai Utama PT. Sydna Fama ... 26
3.5 Organisasi dan Tata Kerja... 27
3.6 Produk PT. Sydna Farma... 46
BAB 4. PEMBAHASAN ... 47
4.1 Penerapan CPOB di Industri ... 47
4.2 Manajemen Mutu... 47
4.3 Personalia ... 48
4.4 Bangunan dan Fasilitas ... 49
4.5 Peralatan ... 56
4.6 Sanitasi dan Higiene ... 57
4.7 Produksi ... 59
4.8 Pengawasan Mutu... 60
4.9 Inspeksi Diri dan Audit Mutu... 61
4.10 Penanganan Keluhan terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian... 62
4.11 Dokumentasi ... 62
4.12 Pembuatan dan Analisis Berdasarkan Kontrak ... 63
4.13 Kualifikasi dan Validasi... 64
BAB 5. KESIMPULAN DAN SARAN ... 65
5.1 Kesimpulan ... 65
5.2 Saran ... 65
DAFTAR ACUAN... 66
vii
Universitas IndonesiaDAFTAR GAMBAR
Gambar 4.1 Sistem Tata Udara ... 68
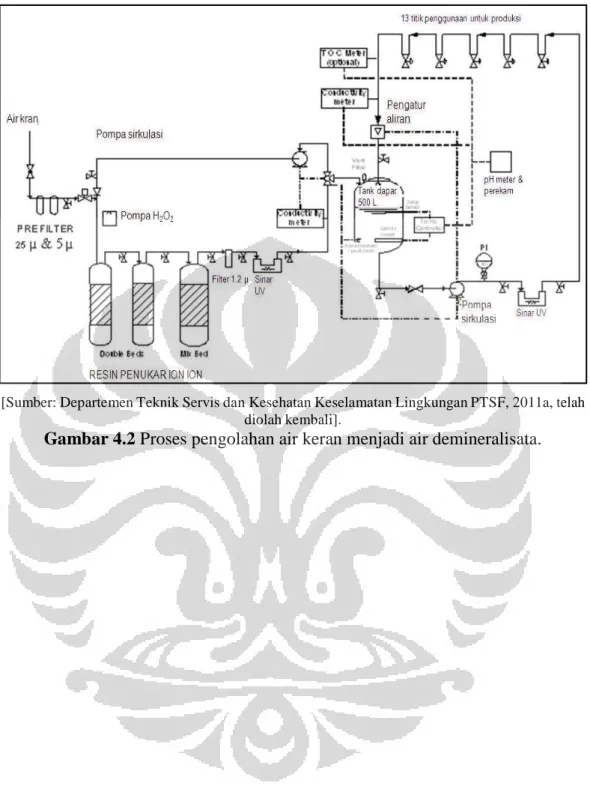
Gambar 4.2 Proses Pengolahan Air Keran Menjadi Air Demineralisata ... 69
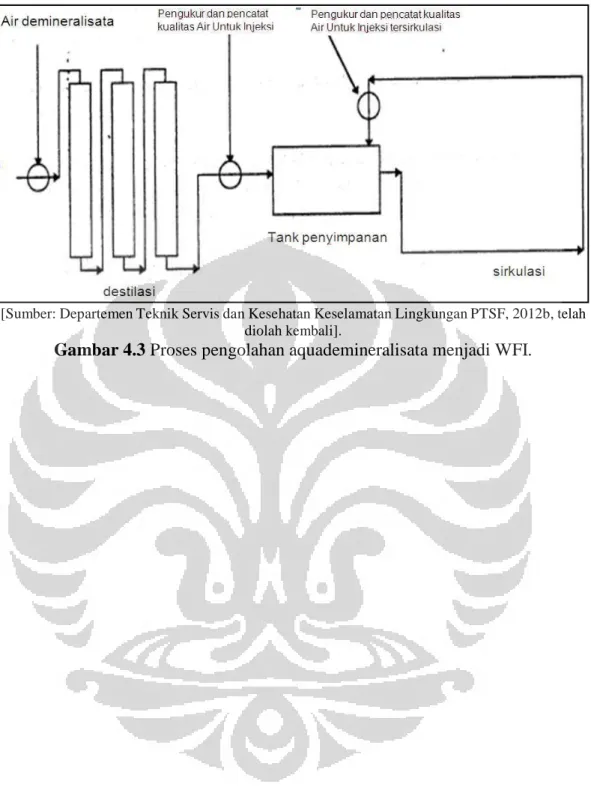
Gambar 4.3 Proses Pengolahan Aquademineralisata Menjadi WFI ... 70
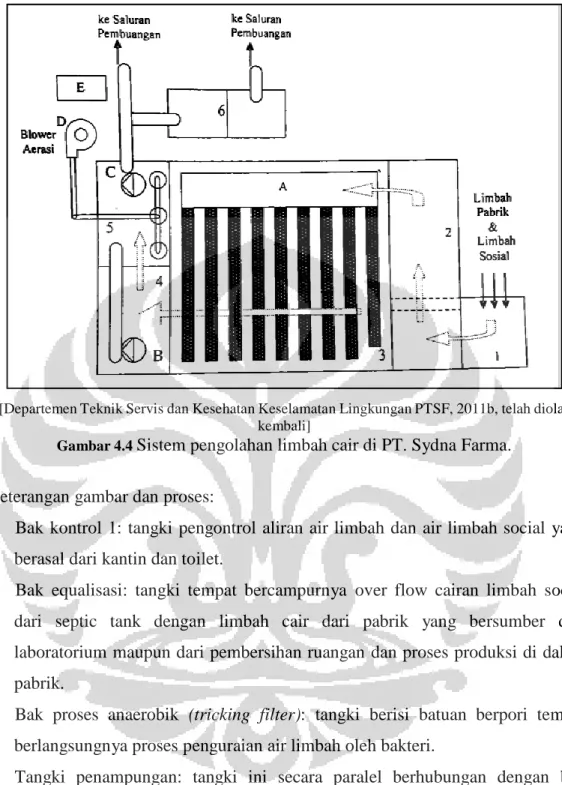
Gambar 4.4 Sistem Pengolahan Limbah Cair di PT. Sydna Farma ... 71
viii
Universitas IndonesiaDAFTAR LAMPIRAN
Lampiran 1. Bagan Struktur Organisasi Pabrik PT. Sydna Farma ... 73 Lampiran 2. Bagan Struktur Organisasi Departemen Pengadaan PT. Sydna
Farma ... 74 Lampiran 3. Bagan Struktur Organisasi Departemen Produksi PT. Sydna
Farma ... 75 Lampiran 4. Bagan Struktur Organisasi Departemen Mutu PT. Sydna
Farma ... 76 Lampiran 5. Bagan Struktur Organisasi Departemen Teknik Servis
dan Kesehatan Keselamatan Lingkungan PT. Sydna Farma ... 77
ix
Universitas IndonesiaBAB 1 PENDAHULUAN
1.1 Latar Belakang
Industri farmasi merupakan salah satu industri yang dikontrol dan diawasi dengan ketat oleh pemerintah dan Badan Pengawas Obat dan Makanan (BPOM).
Pengontrolan tersebut ditinjau dari segi perizinan, produksi, peredaran, maupun kualitas obat yang diedarkan. Hal tersebut dilakukan agar industri farmasi menghasilkan produk yang memenuhi syarat mutu sehingga terwujud kesehatan nasional.
Penerapan CPOB (Cara Pembuatan Obat yang Baik) merupakan salah satu upaya yang dilakukan oleh industri farmasi untuk meningkatkan kualitas obat yang diproduksinya. CPOB adalah pedoman pembuatan obat bagi industri farmasi di Indonesia yang bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan mutu yang ditetapkan dan sesuai dengan tujuan penggunaannya. Melalui pedoman CPOB semua aspek yang berhubungan dengan produksi dan pengendalian mutu obat diperhatikan dan ditentukan sedemikian rupa sehingga tujuannya tercapai. Menurut CPOB, tidaklah cukup bila obat jadi hanya sekedar lulus dari serangkaian pengujian, tetapi yang penting adalah bahwa mutu harus dibentuk ke dalam produk tersebut (BPOM,2012). CPOB menyangkut berbagai aspek mulai dari manajemen mutu, personalia, bangunan dan fasilitas, peralatan, sanitasi dan higienis, produksi, pengawasan mutu, inspeksi diri dan audit mutu dan audit dan persetujuan pemasok, penanganan keluhan terhadap obat dan penarikan kembali obat serta obat kembalian, dokumentasi, pembuatan dan analisis berdasarkan kontrak, serta kualifikasi dan validasi (Badan Pengawas Obat dan Makanan, 2012).
Seorang apoteker di industri farmasi mempunyai peranan dan tanggung jawab penting untuk menerapkan aspek-aspek yang tercantum dalam CPOB tersebut, antara lain sebagai penanggung jawab produksi, penanggung jawab pengawasan dan pemastian mutu. Untuk mencapai peran dan tanggung jawab tersebut, apoteker dituntut memiliki pengetahuan dan keterampilan yang memadai. Namun, pemahaman melalui teori yang didapat dari perkuliahan saja masih kurang mencukupi, maka calon apoteker perlu dibekali dengan
1
Universitas Indonesia2
pengetahuan dan pemahaman yang komprehensif antara teori dengan prakteknya secara langsung.
Program Profesi Apoteker Fakultas Farmasi UI bekerja sama dengan PT.
Sydna Farma dalam menyelenggarakan Praktek Kerja Profesi Apoteker (PKPA) bagi para calon apoteker guna memberikan pembekalan, pengetahuan, pemahaman dan gambaran singkat peran dan tanggung jawab Apoteker di industri farmasi. Pelaksanaan praktek kerja berlangsung dari tanggal 1 April–31 Mei 2013. Dengan adanya praktek kerja ini diharapkan mahasiswa calon Apoteker dapat mengambil manfaat dan ilmu sebanyak mungkin agar nantinya dapat diterapkan secara nyata di dunia kerja.
1.2 Tujuan
Tujuan dari Praktek Kerja Profesi Apoteker Universitas Indonesia di industri farmasi PT. Sydna Farma adalah:
a. Meningkatkan pengetahuan dan wawasan tentang segala aspek industri farmasi yang berhubungan dengan Cara Pembuatan Obat yang Baik (CPOB).
b. Melihat secara langsung proses produksi obat serta penerapan CPOB di PT.
Sydna Farma.
c. Mengetahui dan memahami tugas dan tanggung jawab seorang Apoteker di dalam industri farmasi yang diharapkan dapat menjadi bekal untuk menghadapi dunia kerja yang sesungguhnya
Universitas Indonesia