BAB 2
TINJAUAN PUSTAKA
2.1 Extended-Spectrum-Beta Laktamases-producing Escherichia coli 2.1.1 Karakteristik Escherichia coli
Escherichia coli adalah bakteri yang termasuk ke dalam famili Enterobacteriaceae. Nama Escherichia sendiri diambil dari nama penemu genus
ini, yaitu Theodor Escherich pada tahun 1885, yang diisolasi pertama kali dari feses. Dahulu nama bakteri ini adalah Bacterium coli (de Sousa, 2006) dan disebut juga koliform (Brooks et al, 2007).
Escherichia coli merupakan bakteri gram negatif, berbentuk batang, dan
dapat hidup sendiri maupun berpasangan. Diameternya berkisar 0,5 mikron dan panjangnya berkisar 1-3 mikron. Sebagian spesies Escherichia coli dapat bergerak dengan flagella peritrik. Escherichia coli umumnya memiliki fimbria tapi tidak memiliki spora. Escherichia coli penyebab utama infeksi saluran kemih, disebut juga Uropathogenic Escherichia coli, memiliki faktor adherensi yang disebut P fimbriae atau pili atau fibrillae yang berikatan dengan P antigen darah. Pili ini memerantarai perlekatan bakteri ini dengan sel uroepitel (Basu et al, 2013). Pembentukan pili dikode oleh gen fimH. Bakteri ini juga bersifat anaerob fakultatif, artinya masih dapat bertahan hidup walaupun ada sedikit oksigen.
Di dalam periplasma Escherichia coli, terdapat satu lapis lapisan peptidoglikan. Lapisan peptidoglikan ini memiliki struktur subunit yang tipikal, tersusun dari N-acetyl muramic acid berikatan dengan peptida L-alanine,
D-glutamic acid, mesodiamino pimelic acid, dan D-alanine menggunakan ikatan
amida (de Sousa, 2006).
Escherichia coli merupakan flora normal di saluran pencernaan manusia
tepatnya di lapisan mukosa usus besar. Bakteri ini mulai berkolonisasi beberapa jam setelah bayi lahir. Bakteri ini dapat ditemukan di feses, bisa sampai 1 juta bakteri per gram feses. Jadi, bila dalam air ditemukan Escherichia coli, itu berarti air itu telah terkontaminasi dan tidak layak dikonsumsi lagi.
Bakteri ini dapat memanfaatkan glukonat di dalam usus besar lebih efisien dari spesies usus besar lain sehingga bakteri ini dapat menjadi kompetitor yang baik di dalam usus. Bakteri ini berperan penting dalam sintesis vitamin K, konversi pigmen-pigmen empedu, asam-asam empedu dan penyerapan zat-zat makanan. Escherichia coli termasuk ke dalam bakteri heterotrof yang memperoleh makanan berupa zat organik dari lingkungannya karena tidak dapat menyusun sendiri zat organik yang dibutuhkannya. Zat organik diperoleh dari sisa organisme lain. Bakteri ini menguraikan zat organik dalam makanan menjadi zat anorganik, yaitu CO2, H2O, energi, dan mineral. Di dalam lingkungan, bakteri
pembusuk ini berfungsi sebagai pengurai dan penyedia nutrisi bagi tumbuhan (Dewoto, 2007).
Gambar 2.1. Gambaran mikroskopis Escherichia coli (Brooks et al, 2007)
Escherichia coli memiliki koloni yang sirkular, konveks, halus, dengan tepi
yang tegas, rata, tidak lengket, dan mengubah warna medium menjadi pink karena fermentasi laktosa pada medium agar Mac Conkey. Pada medium agar darah,
Escherichia coli menunjukkan adanya hemolisis sedangkan pada medium
diferensial seperti agar Eosin Methylene Blue (EMB) menunjukkan adanya morfologi koloni yang khas dengan warna pelangi yang berkilau atau yang biasa disebut dengan gambaran metallic sheen (Brooks et al, 2007).
Escherichia coli secara khas menunjukkan hasil yang positif pada tes indol,
lisin dekarboksilase, dan methyl red test (VM). Escherichia coli menghasilkan gas H2 dan CO2 serta asam dari fermentasi glukosa, sorbitol, manitol, larabinosa,
maltosa, dan xylosa dan merupakan bakteri fermenter laktosa yang cepat. Tes nitrat juga menunjukkan Escherichia coli dapat mereduksi nitrat menjadi nitrit.
Sebagian besar strain Escherichia coli menunjukkan hasil yang negatif pada tes oksidase, sitrat, urease, dan gas H2S. Lebih dari 90% isolat bakteri ini positif
terhadap glukoronidase dengan menggunakan substrat 4-metilumbeliferil ß-glukoronida (MUG) (de Sousa, 2006).
Escherichia coli dapat bereaksi silang dengan beberapa spesies Providensia, Klebsiela, dan Salmonella karena memiliki beberapa antigen O. Antigen O adalah
bagian terluar dari lipopolisakarida dinding sel dan terdiri dari unit polisakarida yang berulang. Antigen O resisten terhadap panas dan alkohol dan biasanya terdeteksi dengan aglutinasi bakteri. Antibodi terhadap antigen O terutama adalah IgM. Ada juga antigen K yang merupakan polisakarida yang dapat menyebabkan perlekatan bakteri pada sel epitel sebelum invasi ke saluran kemih (Kayser et al, 2005).
Escherichia coli menghasilkan kolisin atau bakteriolisin yang produksinya
dikendalikan oleh plasmid. Bakteriosin adalah zat bakterisidal yang menyerupai virus yang digunakan untuk melawan bakteri lain. Spesimen yang dapat digunakan untuk pemeriksaan bakteri ini antara lain urin, darah, pus, cairan spinal, dan sputum, tergantung dari manifestasi klinis yang ditimbulkannya (Brooks et al, 2007).
Escherichia coli mampu tumbuh pada suhu berkisar 15-48 0C dengan suhu optimal dimana pertumbuhannya maksimal adalah pada suhu 37-42 0C. Bakteri ini juga mampu tumbuh pada pH berkisar 5,5-8 dengan pH optimal adalah pH netral (de Sousa, 2006).
Gambar 2.3. Pemecahan laktosa oleh Escherichia coli pada Endo Agar (Kayser et al, 2005)
Gambar 2.4. Escherichia coli pada agar Mac Conkey (Brooks et al, 2007)
2.1.2 Patogenisitas Escherichia coli
Escherichia coli dapat menjadi patogen bila ia berada bukan pada habitat
aslinya. Faktor yang mempengaruhi patogenisitas dari bakteri ini di antaranya adalah adanya faktor perlekatan atau adhesi seperti fimbria, fibrillae, protein adhesin intimin, adhesin Afa, dan sebagainya (Basu et al, 2013). Fimbria memiliki struktur seperti batang dengan diameter antara 5-10 nm namun tidak sama dengan flagella. Sedangkan fibrillae memiliki bentuk yang panjang, fleksibel, kasar seperti kawat dan tampak bergelombang, dan memiliki diameter 2-4 nm. Gen pembentuk fimbria adalah papC dan papEF (Pobiega et al, 2013). Selain itu, bakteri ini juga menghasilkan toksin seperti hemolisin yang dikode oleh gen hlyA, faktor nekrosis sitotoksik, dan protease autotransport yang disebut Sat. Ada peran plasmid dalam pembentukan fimbria dan toksin sehingga patogenisitas dari bakteri ini tidak lepas dari keberadaan plasmid. Berbicara mengenai plasmid, walaupun sebagian dapat ditransmisikan sendiri, namun ada beberapa gen yang dalam penyebarannya harus melalui konjugasi plasmid.
Fimbria membantu bakteri melekat pada sel epitel habitat yang baru dan berperan dalam asendens bakteri ke traktus yang lebih jauh seperti pada kasus infeksi saluran kemih. Bakteri yang telah berada di traktus urinarius akan menginfeksi sel urotelium menyebabkan terjadinya reaksi inflamasi epitel yang melapisi saluran kemih. Selain itu, toksin—toksin yang dikeluarkan oleh bakteri ini juga akan menyebabkan kerusakan sel epitel lebih lanjut. Bakteri ini juga dapat berkembang biak menggunakan media urin. Bila daya tahan tubuh host turun, infeksi saluran kemih akan semakin mudah terjadi (Purnomo, 2011)
Escherichia coli yang menginfeksi saluran kemih mampu membentuk
biofilm yang tersusun dari matriks kaya polisakarida yang diselubungi oleh uroplakin sehingga patogenisitasnya semakin meningkat. Bila infeksi saluran kemih berat, dapat timbul bakteremia yang menginduksi penyakit Disseminated
Intravascular Coagulation (DIC) yang merupakan reaksi sistemik tubuh terhadap
endotoksin/sitokin atau lipopolisakarida dari bakteri Escherichia coli.
Penggunaan antimikroba yang tidak rasional dan tidak terarah juga menjadi faktor pendukung patogenisitas bakteri Escherichia coli. Banyak bakteri tersebut
yang telah resisten terhadap beberapa macam obat, salah satunya adalah antimikroba golongan beta laktam seperti penisilin, sefalosporin, dan lain sebagainya. Kelompok bakteri Escherichia coli yang telah resisten terhadap berbagai macam antimikroba golongan beta laktam ini disebut sebagai
Extended-Spectrum-Beta-Laktamases-producing Escherichia coli yang sesuai namanya,
merupakan kelompok bakteri yang mampu menghasilkan enzim beta laktamase untuk menghidrolisis gugus beta laktam dari antimikroba tersebut.
2.2 Resistensi Obat
2.2.1 Mekanisme Resistensi Obat
Populasi kuman dapat menjadi resisten terhadap antibiotik dengan berbagai mekanisme, seperti (Brooks et al, 2007):
a. Produksi enzim yang merusak daya kerja obat tertentu.
Contohnya adalah enzim beta laktamase yang dihasilkan oleh Escherichia
coli yang dapat merusak cincin beta laktam dari antibiotik seperti penisilin.
Dalam hal ini, plasmid memegang peran penting. Plasmid juga berperan dalam pembentukan enzim untuk traspor aktif tetrasiklin melewati membran sel. Enzim lain yang dihasilkan oleh mikroba seperti bakteri gram negatif yang dapat memecah obat aminoglikosida adalah adenilase, fosforilase, dan asetilase.
b. Perubahan permeabilitas kuman terhadap obat tertentu.
Contohnya adalah bakteri Streptokokus yang memiliki barier alami terhadap obat golongan aminoglikosida.
c. Perubahan tempat/lokus tertentu di dalam sel sekelompok mikroorganisme tertentu yang menjadi target dari obat.
Contohnya adalah golongan aminoglikosida yang bekerja merusak sistem ribosom subunit 30s dari bakteri dan oleh karena satu hal lokus ini berubah, maka kuman akan resisten terhadap obat ini. Ada juga metilasi RNA 23s ribosom yang mengubah reseptor eritromisin di subunit 50s ribosom sehingga bakteri resisten terhadap obat. Lain halnya dengan Streptococcus
pneumoniae dan Enterococcus, bakteri ini menyebabkan perubahan pada penicilline binding protein (PBP) sehingga dapat terjadi resistensi.
d. Perubahan pada metabolic pathway yang menjadi target obat.
Contohnya adalah kuman yang resisten terhadap golongan sulfonamida, tidak memerlukan PABA dari luar sel karena bakteri ini masih mampu menggunakan asam folat sehingga metabolisme sel bakteri tidak terganggu walaupun ada sulfonamida.
e. Perubahan enzimatik sehingga kuman meskipun masih hidup dengan baik namun kurang sensitif terhadap antimikroba.
Contohnya pada bakteri yang resisten trimetoprim, asam dihidrofolat reduktase dihambat kurang efisien daripada pada bakteri yang sensitif terhadap trimetoprim.
2.2.2 Etiologi Resistensi Bakteri terhadap Obat a. Non Genetik
Hampir semua obat antibiotik bekerja baik pada masa aktif pembelahan kuman. Oleh karena itu, bila populasi kuman sedang tidak berada pada masa aktif pembelahan sel, maka populasi itu relatif resisten terhadap suatu antibiotik. Untuk beberapa generasi kuman dapat terjadi perubahan pada struktur target obat misalnya kuman yang berbentuk sferoplas kehilangan dinding sel sehingga bila diberikan antibiotik yang merusak dinding sel seperti penisilin dan sefalosporin, maka akan terjadi resistensi. Ada juga mikroorganisme yang menginfeksi pejamu di tempat kerja antimikroba tidak aktif atau ditiadakan seperti gentamisin yang tidak efektif untuk pengobatan demam enterik Salmonella karena bakteri ini terdapat di intraseluler sedangkan gentamisin bekerja di ekstraseluler (Brooks et al, 2007)
b. Genetik
Perubahan genetik dapat menyebabkan resistensi. Perubahan genetik tersebut dapat terjadi secara kromosomal maupun ekstrakromosomal dan perubahan genetik itu dapat dipindahkan dari satu jenis kuman kepada jenis yang lain dengan berbagai cara (Sudarmono, 2011) .
1. Resistensi Kromosomal
Misalnya terjadi mutasi spontan pada lokus ADN yang mengontrol
succeptibility terhadap obat tertentu seperti pada antibiotik
streptomisin dimana reseptornya adalah protein P12 pada ribosom subunit 30s yang bila terjadi mutasi akan menyebabkan kuman menjadi resisten terhadap streptomisin.
2. Resistensi Ekstrakromosomal / Plasmid
Plasmid adalah molekul DNA yang bulat yang berada bebas dalam sitoplasma bakteri. Plasmid adakalanya dapat bersatu ke dalam kromosom bakteri. Plasmid mampu bereplikasi sendiri secara otonom dan dapat dipindahkan dari satu spesies bakteri ke spesies lain. Beberapa contoh plasmid adalah faktor R yang membawa gen-gen untuk resistensi terhadap satu atau lebih antibiotik dan logam berat; toksin yang merupakan produk dari plasmid seperti pada
Enterotoksigenik Escherichia coli; dan faktor F yang memegang
peran penting dalam proses konjugasi bakteri. Plasmid dapat dipindahkan ke bakteri lain dengan berbagai cara, seperti:
- Transduksi
DNA dari plasmid masuk ke bakteriofaga dan kemudian oleh bakteriofaga, gen tersebut ditransfer ke populasi kuman lain. Biasa terjadi pada bakteri Stafilokokus.
- Transformasi
Fragmen DNA yang bebas dapat menembus dinding sel lalu bersatu dengan genom sel sehingga mengubah genotipnya.
- Konjugasi
Faktor F menentukan adanya sex pili. Melalui pili tersebut materi genetik dari sel donor (yang memiliki pili) termasuk plasmid dapat berpindah ke sel resipien. Cara ini yang berperan besar dalam terjadinya multi drug resistance.
- Transposisi
Adalah pemindahan dari rantai DNA pendek antara satu plasmid ke plasmid lain atau dari kromosom ke plasmid dalam sel tersebut. 3. Resistensi Silang
Suatu kuman dapat menjadi resisten terhadap beberapa jenis antibiotik yang memiliki mekanisme kerja yang mirip satu sama lain. Misalnya pada obat-obat yang komposisi kimianya hampir sama seperti pada polimiksin B dengan kolistin, eritromisin dengan oleandomisin, dan neomisin dengan kanamisin. Namun dapat juga terjadi resistensi silang pada dua obat yang berlainan struktur kimianya sama sekali, misalnya pada eritromisin dengan linkomisin (Sudarmono, 2011).
2.2.3 Faktor Resiko Resistensi Obat
Resistensi obat dapat terjadi karena penggunaan antibiotik yang tidak rasional dan tidak tepat. Dari segi tenaga medis, banyak tenaga medis menggunakan dosis yang tidak tepat dan sering menggunakan antibiotik yang amat poten untuk penanganan pertama sehingga perlambatan resistensi terhadap antibiotik tidak terjadi.
Dari segi pasien, banyak pasien yang tidak patuh terhadap cara tepat penggunaan antibiotik, mengkonsumsi sembarang antibiotik yang dijual bebas di apotik tanpa konsultasi terlebih dahulu kepada dokter apakah penggunaan antibiotik tersebut tepat indikasinya (Sudarmono, 2011).
2.2.4 Metode Uji Resistensi Obat
Penentuan kerentanan patogen bakteri terhadap antibiotik dapat dilakukan dengan salah satu dari dua metode yaitu: metode dilusi atau metode difusi. Metode ini dapat dilakukan untuk memperkirakan potensi antibiotik dalam sampel dan kerentanan mikroorganisme dengan menggunakan organisme uji standar yang tepat dan sampel obat tertentu untuk perbandingan (Brooks et al, 2007).
1. Metode Dilusi
Sejumlah zat antimikroba dimasukkan ke dalam medium bakteriologi yang padat ataupun cair. Biasanya dilakukan pengenceran dua kali lipat zat
antibiotik. Medium akhirnya diinokulasikan dengan bakteri yang diuji dan diinkubasi. Metode ini digunakan untuk mengetahui seberapa banyak jumlah zat antimikroba yang diperlukan untuk menghambat pertumbuhan atau membunuh bakteri yang sedang diuji. Salah satu uji dilusi adalah uji dilusi kaldu mikrodilusi yang keuntungannya adalah mampu menunjukkan jumlah obat tertentu yang diperlukan untuk menghambat atau membunuh mikroorganisme yang diuji. Namun, uji dilusi agaknya membutuhkan waktu yang banyak dan kegunaannya terbatas hanya pada keadaan tertentu saja. 2. Metode Difusi
Uji difusi menggunakan cakram kertas filter yang mengandung sejumlah tertentu obat yang ditempatkan di atas permukaan medium padat yang telah diinokulasikan pada permukaan dengan organisme uji. Setelah diinkubasi, diameter zona jernih inhibisi di sekitar cakram diukur sebagai ukuran kekuatan inhibisi obat melawan organisme uji obat tertentu. Metode ini dipengaruhi banyak faktor fisik dan kimia selain interaksi sederhana antara obat dan organisme. Penggunaan cakram tunggal untuk masing-masing antibiotik dengan adanya standarisasi yang tepat memungkinkan pelaporan resistensi mikroorganisme dengan membandingkan ukuran zona inhibisi dengan standar obat yang sama. Inhibisi di sekitar cakram yang mengandung sejumlah antimikroba tertentu tidak menunjukkan kerentanan terhadap konsentrasi obat yang sama per mililiter medium, darah, atau urin. Uji kepekaan dapat dilakukan dengan metode Kirby Bauer disk diffusion menggunakan medium Mueller Hinton Agar (Melaku et al, 2012).
2.2.5 Pembatasan Resistensi Obat
Resistensi obat dapat diminimalisasi dengan mempertahankan kadar obat yang cukup tinggi dalam jaringan untuk menghambat populasi asli maupun mutan yang pertama. Hal ini bisa terjadi bila pasien patuh terhadap aturan pemakaian antibiotik. Kemudian, penggunaan dua obat sekaligus yang tidak menimbulkan resistensi silang, masing-masing saling menghambat timbulnya mutan yang resisten terhadap obat lain, misalnya pada pengobatan tuberkulosis yang menggunakan paduan rifampisin dengan isoniazid. Dan yang terakhir dengan
mencegah pajanan mikroorganisme ke obat tertentu yang sangat berguna dengan membatasi penggunaannya, terutama di rumah sakit. Untuk pemerintah, sebaiknya diberlakukan peraturan tentang penjualan antibiotik sehingga masyarakat tidak dapat membeli antibiotik secara bebas dan sembarangan tanpa ada indikasi yang tepat (Brooks et al, 2007) .
2.3 Resistensi Extended-Spectrum-Beta-Laktamases-producing Escherichia coli
Escherichia coli merupakan strain bakteri patogen yang cerdas. Bakteri ini
memiliki polifosfat kinase yang ada hubungannya dengan patogenisitas, motilitas, dan resistensi obat lewat quorum sensing, regulasi dari replikasi error-prone, dan pembentukan biofilm. Bakteri ini juga mendapat resistensi lewat mutasi langsung dan sistem modulasi dan ini memberi tantangan yang besar dalam pengobatan. Dari tahun 1993, multi drug resistance Escherichia coli memproduksi ESBLs seperti enzim CTX-M (Saha et al, 2013). Seiring berjalannya waktu, prevalensi
ESBLs-producing multi drug resistance Escherichia coli semakin meningkat tidak
hanya di rumah sakit namun juga di populasi umum (van der Donk et al, 2012). Strain ESBLs-producing E.coli banyak didominasi oleh CTX-M tipe 1 dan CTX-M tipe 9 (Livermore, 2012 dalam Soraas, 2014). Selain itu ada juga SHV tipe 5, SHV tipe 12, TEM-63, dan SHV tipe 2a (Mshana et al, 2013). Semua enzim ini merupakan jenis beta laktamase yang dapat menghidrolisis antibiotik golongan beta laktam. Contohnya adalah TEM yang dapat menghidrolisis mecillinam (Soraas, 2014), blaCTX-M yang merupakan gen pengkode cefotaximase yang dapat merusak sefotaksim, antibiotik sefalosporin generasi ketiga (Kirchner, 2013). Escherichia coli yang resisten terhadap antibiotik sefalosporin juga dilaporkan menghasilkan plasmid-mediated AmpC ß lactamase (pAmpC) (Park et al, 2012). Selain itu, Escherichia coli yang resisten terhadap
amoxicillin-clavulanate menghasilkan plasmid-mediated class A ß laktamases, pAmpC, chromosomal-mediated AmpC ß laktamases, inhibitor resistant TEM (IRT) ß laktamase, plasmid-mediated ß laktamase OXA-1, dan enzim complex mutant TEM (CMT) (Ortega et al, 2012). Di Inggris, yang paling banyak
dengan multi-locus sequence type (MLST) ST131 E.coli yang memiliki resistensi terhadap berbagai antibiotik. Gen blaCTX-M berasal dari strain Kluyvera dan disebarkan dengan menggunakan plasmid, dapat secara konjugasi maupun transformasi bila konjugasi tidak berhasil.
E.coli juga dapat mengalami resistensi dengan cara mutasi langsung.
Contohnya adalah mutasi pada gyrase akan menyebabkan resistensi terhadap golongan antibiotik florokuinolon.
Begitu banyak gen penghasil beta laktamase yang telah ditemukan dan begitu mudahnya penyebaran gen resistensi tersebut melalui peran plasmid membuat Escherichia coli dan bakteri Enterobacteriaceae lainnya sulit untuk ditangani.
2.4 Metode Deteksi Extended-Spectrum-Beta-Laktamase-producing Escherichia coli
Berdasarkan Malaysian Society of Infectious Diseases and Chemotherapy, untuk mendeteksi ESBLs-producing E.coli dapat dilakukan dengan dua cara, yaitu uji tapis dan uji konfirmasi. Uji tapis (screening) dapat dilakukan dengan menggunakan standard disc diffusion method dan double disc method, sedangkan untuk uji konfirmasi (phenotypic confirmatory method) dapat dilakukan dengan
disc diffusion method dan MIC method (E-test).
1. Screening ESBLs-producing E.coli a. Standard Disc Diffusion Method
Langkah kerja metode ini adalah sebagai berikut: - Siapkan biakan bakteri berumur 18-24 jam.
- Sediakan plat agar Mueller-Hinton dengan ketebalan antara 3-5 mm.
- Buat suspensi bakteri yang akan diuji, dan disesuaikan kekeruhannya dengan standar 0.5 Mc Farland menggunakan nephelometer.
- Celupkan usap kapas steril ke dalam suspensi bakteri, tekan ke dinding tabung supaya tidak terlalu basah dan oleskan secara merata di seluruh permukaan medium. Diamkan sebentar.
- Letakkan cakram antibiotik: cefotaxime 30 ug, ceftazidime 30 ug,
- Inkubasi lempeng agar dengan suhu 350C selama 16-18 jam.
Hasil: Adanya penurunan diameter zona hambatan menunjukkan kemungkinan
ESBLs positif.
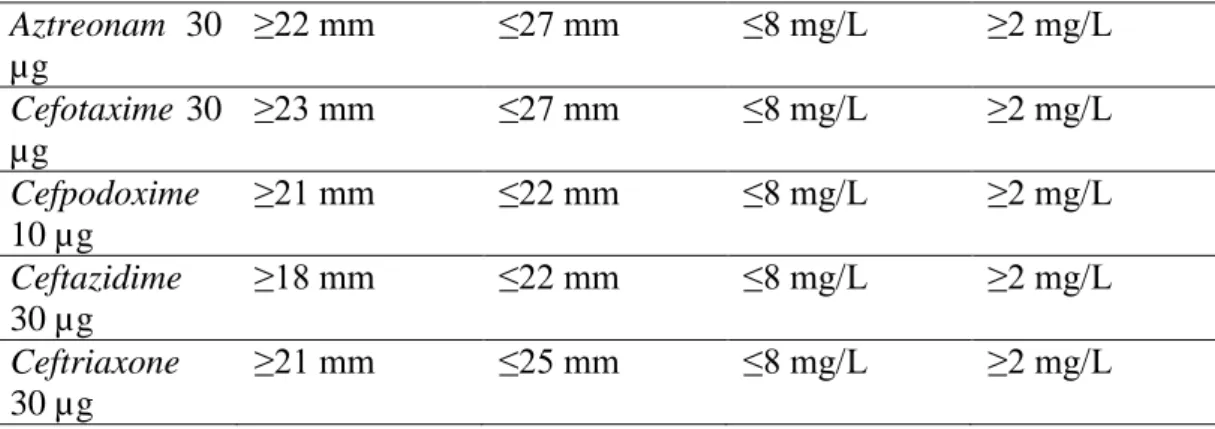
Tabel 2.1. Kriteria Minimum Inhibitory Concentration (MIC) dan Zona Hambatan untuk Deteksi ESBLs pada E. coli
Diameter zona hambat strain yang peka Diameter zona hambat strain yang mungkin memproduksi ESBLs MIC untuk strain yang peka MIC untuk strain yang mungkin memproduksi ESBLs Aztreonam 30 µg ≥22 mm ≤27 mm ≤8 mg/L ≥2 mg/L Cefotaxime 30 µg ≥23 mm ≤27 mm ≤8 mg/L ≥2 mg/L Cefpodoxime 10 µg ≥21 mm ≤22 mm ≤8 mg/L ≥2 mg/L Ceftazidime 30 µg ≥18 mm ≤22 mm ≤8 mg/L ≥2 mg/L Ceftriaxone 30 µg ≥21 mm ≤25 mm ≤8 mg/L ≥2 mg/L
Sumber: Malaysian Society of Infectious Diseases and Chemotherapy, 2001 b. Double Disc Method
Langkah kerja metode ini adalah sebagai berikut: - Siapkan biakan bakteri berumur 18-24 jam.
- Sediakan agar Mueller-Hinton dengan ketebalan antara 3-5 mm.
- Buat suspensi bakteri yang akan diuji dan sesuaikan kekeruhannya dengan standar 0.5 Mc.Farland menggunakan nephelometer.
- Celupkan usap kapas steril ke dalam suspensi bakteri, tekan ke dinding tabung supaya tidak terlalu basah dan oleskan secara merata di seluruh permukaan medium. Diamkan sebentar.
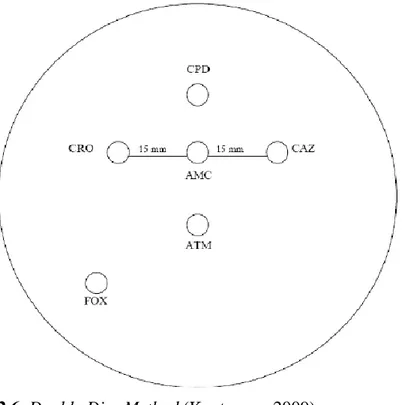
- Berbagai cakram yang terdiri dari antibiotik standar sefalosporin generasi ketiga {ceftazidime 30 ug atau ceftriaxone 30 ug, aztreonam 30 ug atau
cefpodoxime 10 ug diletakkan dengan jarak 15-20 mm (jarak diukur dari
pinggir ke pinggir cakram) dari cakram amoxicillin-clavulanic acid secara aseptik}.
Hasil : Adanya pelebaran zona hambatan antara kedua cakram menunjukkan adanya ESBLs.
Gambar 2.6. Double Disc Method (Kuntaman, 2009) 2. Phenotypic Confirmatory Method
a. Disc Diffusion Method
Prosedur kerja metode ini sama dengan Double Disc Method. Metode ini menggunakan ceftazidime (30ug) vs ceftazidime/clavulanic acid (30/10ug), dan
cefotaxime (30ug) vs cefotaxime/clavulanic acid (30/10ug). Indikasi adanya
antimikroba penghasil ESBLs bila terjadi peningkatan zona hambatan sebesar ≥5mm dari antibiotik yang dikombinasi dengan clavulanic acid yang dibandingkan dengan antibiotik tunggal yang diuji.
b. MIC Method (E-Test)
Metode ini menggunakan kombinasi 2 strip E-test misalnya
ceftazidime/ceftazidime-clavulanic acid dan cefotaxime/cefotaxime-clavulanate.
Kedua strip ini diinokulasikan pada permukaan plat agar dan diinkubasi selama 24 jam. Setiap terjadinya penurunan pengenceran ≥ 3log2 (penggandaannya) dikatakan ESBLs positif.
Catatan: Tidak semua strain yang memproduksi ESBLs spesifik untuk
ceftazidime; strain dengan substrat lain yang spesifik mungkin tidak terdeteksi
dengan hanya menggunakan strip ceftazidime/clavulanic acid; oleh karena itu, strip cefotaxime juga digunakan.