A. BAHAN DAN MEDIA
Bahan mentah yang digunakan adalah ketimun, ikan rucah segar (ikan peperek/ Leigona thidae) , acar (berisi ketimun, bawang merah, dan cabai rawit) yang diperoleh dari penjual sate di sekitar Bogar, garam, dan gula. Bakteri yang digunakan adalah Alcaligenes sp. atau Achromobacter sp. DSM 30002 dan Pseudomo-nas fluorescens DSM 50106 dari Jerman, Escherichia coli dan Staphylococcus aureus dari Laboratorium Mikrobiologi Jurusan Teknologi Pangan, Fateta, IPB, Salmonella typhimuri"um, Vibrio parahaemolyticus, dan Listeria monocytogenes dari Balai Penelitian Veteriner, Bogar.
Isolat bakteri asam laktat dipelihara dalam media agar MRs-CaC0 3 semi padat. Untuk P. fluorescens digu-nakan media agar Pseudomonas, untuk L. monocytogenes media TSA, untuk V. parahaemolyticus media agar Ma-rine, dan untuk bakteri penguji lain digunakan agar Nutrien. Broth yang digunakan untuk menumbuhkan kul-tur kerja bakteri asam laktat adalah MRS broth, untuk L. monocytogenes digunakan BHI broth, dan untuk bak-teri penguji lain ditumbuhkan dalam Nutrien broth.
Untuk identifikasi bakteri asam laktat diguna-kan Reagen Nessler, MRS arginin broth, Streptokoki
▸ Baca selengkapnya: yang digunakan sebagai anoda pada aki adalah
(2)arginin broth , agar Leuconostoc, Litmus Milk, Gibson semi padat, dan ·MRS broth.
Untuk menguji aktivitas antimikroba bakteri asam laktat terhadap Alcaligenes sp. digunakan media TSA, P. fluorescens: PA, E. coli: EMBA, L. monocytogenes: TSA, S. aureus: BPA, S. typhimurium: agar McConcey, V. parahaemolyticus: TCBSA.
Untuk menghitung jumlah bakteri asam laktat yang dikontakkan. dengan P. fluorescens dalam media ekstrak ikan rucah digunakan agar MRS, agar MRS-Natrium azida digunakan untuk menghitung bakteri asam laktat yang dikontakkan dengan Alcaligenes sp., agar Nutrien untuk menghitung jumlah P. fluorescens dan Alcaligenes sp. baik yang dikontakkan dengan bakteri asam laktat atau tidak dalam media ekstrak ikan rucah.
Bahan-bahan lain yang digunakan yaitu NaCl seba-gai pengencer, air pepton sebagai media pertumbuhan bakteri asam laktat untuk menghasilkan hidrogen
perok-sida, dan media sintetik asam laktat sebagai media pertumbuhan bakteri asam laktat untuk memproduksi asam. Bahan kimia yang digunakan adalah NaOH, HC1, asam oksalat, KI, KI03 , asam sulfat, natrium sulfat, dan amonium molibdat.
B. METODE PENELITIAN
"1. Isolasi dan Identifikasi Bakteri Asam Laktat"dari Pikel Ketimun Dan Acar
a. Pembuatan Pikel Ketimun
Untuk pembuatan pikel ketimun, dipilih ketimun yang masih muda, dicuci, dipotong-potong agar didapat ukuran yang seragam dan dimasukkan ke dalam stoples yang berisi larutan garam dengan konsentrasi 5% NaCl. Sebanyak 1% glukosa
ditam-bahkan untuk membantu proses fermentasi. Ketimun diusahakan supaya terendam di bawah permukaan larutan garam. ·Toples ditutup rapat. Fermentasi dilakukan pada suhu kamar.
b. Isolasi Bakteri Asam Laktat
Isolasi bakteri asam laktat dari pikel keti-mun dilakukan pada waktu fermentasi 2, 4, 6, 9, 12/ dan 16 hari. Isolasi bakteri asam laktat dari acar yang dibeli dari tukang sate dilakukan sehari setelah pembelian.
Cairan dari pikel ketimun dan acar diencerkan dengan larutan NaCl 0,85% sampai pengenceran 10- 6 . Sebanyak 1 ml contoh dari pengenceran 10- 5 - 10- 6 diambil dan dipindahkan ke dalam cawan petri steril (dilakukan duplo untuk setiap pengenceran).
agar MRS dituang ke dalam cawan petri dan di-goyang secara mendatar. Setelah agar membeku, cawan diinkubasi dalam posisi terbalik pada suhu 37°C selama dua hari.
Cawan dengan kOloni-koloni yang terpisah dipilih, koloni-koloni yang mempunyai warna dan ukuran yang berbeda di~indahkan ke dalam cawan petri yang berisi agar MRS dengan membuat goresan kuadran. Inkubasi dilakukan pada suhu 37°C selama 2 hari. Jika koloni dalam cawan petri belum murni (misalnya besar koloni tidak seragam) maka diambil satu koloni dan dibuat goresan kuadran lagi pada agar MRS sampai diperoleh koloni-koloni dengan ukuran yang seragam.
Isolat-isolat bakteri asam laktat yang telah murni ditumbuhkan dalam MRS broth selama 2 hari. Kultur ini akan digunakan sebagai inokulum untuk identifikasi awal.
c. Identifikasi Bakteri Asam Laktat 1. Identifikasi awal
Identifikasi awal meliputi uj i katalase dan pewarnaan gram.
Uji katalase (Fardiaz, 1987) Satu loop kultur cair disebarkan pada gelas obyek. Larutan H202 3% diteteskan di at as kultur
tersebut. Timbulnya gelembung-gelembung oksigen pada kultur menunjukkan uji positif. Bakteri asam laktat akan menunjukkan uji kata-lase negatif.
Pewarnaan gram (Fardia'z, 1987). Satu loop kultur cair disebarkan pada gelas obyek. Kultur cair dikeringkan di udara dan difiksasi dengan nyala api kecil. Pewarna kristal violet diteteskan di atas film pada gelas obyek selama 1 menit, kemudian dibilas dengan air kran. sisa air yang tertinggal dibuang, dan lapisan film kultur ditetesi dengan larutan Lugol (yodium Gram) selama 1 menit. Setelah dicuci kembali dengan air, kemudian dihilangkan warnanya dengan menggunakan alkohol 95% selama 10 - 20 detik atau sampai warna biru tidak luntur lagi. Setelah dicuci sebentar, kemudian lapisan film kultur diwarnai dengan larutan safran in selama 10 - 20 detik. Setelah dibilas dengan air dan dikeringkan dengan kertas serap,
lapisan film bakteri diperiksa di bawah mikros-kop dengan pembesaran 1000 kali. Bakteri asam laktat merupakan bakteri gram positif ditandai dengan kultur yang berwarna biru-ungu.
Isolat yang menunjukkan uji katalase nega-tif dan hasil pewarnaan gram biru-ungu disimpan di dalam MRS-CaC03 semi padat.
2. Uji Biokimia Bakteri AS~ Laktat (Nuraida, 1988)
Sebagai inokulum untuk identifikasi, diambil satu sampai dua loop isolat dari media MRS-CaC03 semi padat. Ditumbuhkan pada media MRS broth selama 2 hari pada suhu 37°C
Produksi CO2 dari glukosa. Tes ini untuk membedakan bakteri homofermentatif dan
hetero-fermentatif 4engan menggunakan media. Gibson semi padat. Cara pembuatan media Gibson semi padat adalah sebagai berikut 10 ml mangan sulfat dieampur dengan 800 ml susu skim. Ke dalam eampuran tersebut ditambahkan 2,5 gr ekstrak khamir dan 50 gr glukosa. Larutan dipanaskan dalam penangas air. Selagi panas, ditambahkan 200 ml agar nutrien. Media ,didis-tribusikan ke dalam tabung reaksi dengan keda-laman 5-6 em, Sterilisasi dilakukan dengan menggunakan penangas air masing-masing 30 menit
selama 3 hari berturut-turut,
Media Gibson semi padat steril dieairkan dan diturunkan suhunya sampai 45°C. Kira-kira
1 tetes inokulum ditambahkan dengan menggunakan pipet tetes steril, kemudian ditambahkan 1 ml agar cair steril 1,5%. Inkubasi dilakukan pada suhu 37°C selama 2 - 5 hari. Bakteri laktat heterofermentatif akan membentuk gas ditandai dengan pecahnya atau meloncatnya agar.
Produksi amonia dari arginin. Tes ini digunakan untuk membedakan laktobasili hetero-fermentatif dan homohetero-fermentatif. Tes ini juga digunakan untuk membedakan Leuconostoc dengan bakteri asam laktat heterofermentatif lainnya.
Cara pembuatan MRS arginin broth 3 gr L-arginin monohidrat dilarutkan dalam 1 liter MRS broth, sterilisasi dilakukan dengan auto-klaf 121°C selama 15 menit. Streptokoki argi-nin broth: 5 gr tripton, 2,5 gr ekstrak kha-mir, 0,5 gr glukosa, 2 gr K2 2HP0 4 , 3 gr L-arginin monohidrat dilarutkan dalam 1 liter air destilata, sterilisasi dilakukan dengan auto-klaf 121°C, 15 menit.
MRS arginin broth dan streptokoki arginin broth diinokulasi dengan 1 tetes inokulum. Kultur kemudian diinkubasikan selama 2 5 hari pada suhu 37°C. Sebanyak 1 ml kultur dimasukkan ke dalam tabung reaksi, kemudian ditambahkan Reagen Nessler dengan volume yang
sarna. Pembentuk~n amonia ditandai dengan pembentukan warna oranye kecoklatan setelah penambahan Reagen Nessler.
Produksi dekstran dari sukrosa. Tes ini digunakan untuk membedakan 'Leuconostoc tertentu dengan bakteri laktat berbentuk koki lainnya. Cara pembuatan agar Leuconostoc 10 gr trip-ton, 5 gr ekstrak khamir, 5 gr K2HP0 4 , 5 gr triamonium sitrat, 5 gr sukrosa, 15 gr agar bacto dilarutkan dalam 1 liter air destilata, sterilisasi dilakukan dengan autoklaf 121°C selama 15 menit. Kemudian agar cair tersebut dipindahkan' ke dalam cawan petri s t e r i l . Sebagai kontrol digunakan media yang mengandung 0,1 % sukrosa.
Bakteri asam laktat digores secara kuadran pada agar Leuconostoc. Cawan petri diinkubasi pad a suhu 37°C selama 2 - 5 hari. Pembentukan dekstran ditandai dengan pembentukkan koloni mukoid.
Pertumbuhan pada suhu berbeda. Satu tetes inokulum ditambahkan-ke dalam tabung MRS broth (masing-masing duplo). Satu seri tabung diin-kubasi pada suhu 15°C dan seri lainnya pada suhu 45°C selama 5 - 14 hari.
Pertumbuhan pada 6.5% NaCl. MRS broth dengan 6.5% NaCl diinokulasi dengan 1 tetes inokulum. Kultur kemudian diikubasikan pada suhu 37°C selama 5 hari.
Reaksi pada Litmus Milk. Cara pembuatan Litmus Milk 100 gr susu skim dan 0,75 gr litmus dilarutkan dalam 1 liter air destilata, larutan didistribusi ke dalam tabung reaksi, sterilisasi dilakukan dengan autoklaf 121°C, 15 menit.
Satu tetes inokulum diinokulasikan ke dalam Litmus Milk, kemudian diinkubasi pad a suhu 37°C s~lama 2 - 5 hari.
terjadi pad a Litmus Milk diamati
Reaksi yang
a. Pemisahan whey atau penggumpalan susu karena enzim proteolitik tanpa pembentukan asam sehingga warna litmus tetap biru.
b. Pembentukan asam dengan atau tanpa penggum-palan susu yang ditandai dengan perubahan warna litmus menjadi merah muda.
C. Pembentukan gas yang ditandai dengan adanya
gelembung-gelembung.
Diagram isolasi dan identifikasi bakteri asam laktat yang diisolasi dari pikel ketimun dan acar dapat dilihat pada Gambar 1.
Isolasi bakteri asam laktat
Purifikasi
uji katalase ----~.~) Katalase positif
Katalase negatif
Pewarnaan gram ~ Gram negatif
Gram positif
Bakteri asam laktat
Uji biokimia:
- produksi CO 2 dari glukosa - produksi amonia dari arginin - produksi dekstran dari sukrosa - pertumbuhan pad a suhu berbeda - pertumbuhan pada 6.5% NaCl - reaksi pada Litmus Milk
Gambar 1. Isolasi dan identifikasi bakteri asam laktat dari pikel ketimun dan acar
2. SELEKSI ISOLAT BAKTERI ASAM LAKTAT
Seleksi isolat bakteri asam laktat berdasarkan kemampuannya dalam menghambat pertumbuhan mikroba pem-busuk dan patogen dengan uji difus~ sumur seperti yang dilakukan oleh Garriga et al. (1993) dengan beberapa modifikasi.
Ke dalam medium agar steril diinokulasikan 0.2 % bakteri indikator yang telah diinkubasi selama sehari (suhu 37°C). Setelah membeku dibuat lubang/sumur pada medium agar tersebut dan dispotkan sebanyak 50 Ml kultur bakteri asam Iaktat yang telah diinkubasi selama 2 bari pada suhu 37°C. Sebagai kon-trol dispotkan MRS broth yang belum diinokulasi ke da-lam sumur. Setelah diinkubasi selama 2 hari (37°C), areal penghambatan yang terbentuk diukur. Areal peng-hambatan berupa areal bening di tepi lubang/sumur sam-pai tepi dimana terjadi pertumbuhan bakteri penguji, dinyatakan dalam mm. Pengukuran dilakukan di beberapa sisi, kemudian dirata-ratakan.
sebanyak 2-3 ulangan.
3. IDENTIFlKASI SENYAWA ANTIMIKROBA
a. Uji Bakteriosin
Uji ini dilakukan
Untuk melihat kemampuan isolat bakteri asam laktat dalam memproduksi bakteriosin digunakan uji
difusi sumur seperti yang dilakukan oleh Garriga et al. (1993) dengan beberapa modifikasi.
Kultur bakteri asam laktat setelah diinkubasi selama 2 hari, dinetralkan dengan memakai NaOH 0,1 N hingga mencapai pH 7,0. Urituk memisahkan sel, kultur yang telah dinetralkan disaring dengan memakai kertas millipor berukuran steril 0,22 Mm. Tahap selanjutnya sarna dengan metode di atas, ke-cuali yang dispotkan ke dalam sumur adalah filtrat kultur bakteri asam Iaktat dan sebagai bakteri indikator digunakan P. fluorescens dan Alcaligenes sp ..
b. Kemampuan memproduksi asam
Untuk menentukan kemampuan bakteri asam laktat dalam memproduksi asam, digunakan medium sintetik asam Iaktat yang dibuat berdasarkan Buchta (1983) dalam Wirjantaro (1993), yang ter-diri dari 50 gil glukosa, 0.4% urea, 0.1% K2HP04 , 0.05% MgS0 4 , 0.05% KCI, 0.001% FeS0 4 .7H20, dan 0.05% ekstrak khamir.
Dua ose isolat dari MRS-caC0 3 semi padat di-pindahkan ke dalam MRS broth. Setelah inkubasi 2 hari, kultur digunakan sebagai inokulum untuk pro-duksi asam. SepuIuh persen inokulum diinokula-si ke dalam media sintetik asam laktat, kultur
diinkubasi dalam inkubator bergoyang pad a suhu 30°C.
Analisa terhadap asam laktat yang terben-tuk dilakukan setiap hari sampai 4 hari inkubasi. Setiap hari sejumlah media sintetik asam laktat yang telah ditumbuhi oleh bakteri asam laktat diambil secara aseptis. untuk memisahkan sel bakteri asam laktat dari hasil metabolitnya maka kultur disentrifus. Filtrat hasil sentrifus yang akan digunakan untuk analisa asam.
dilakukan dengan cara titrasi.
Analisa asam
Sebelum NaOH digunakan untuk penetapan total asam tertitraii, dilakukan standarisasi NaOH
Filtrat hasil sentrifus diencerkan sampai 50 kali, sebanyak 10 ml filtrat diambil untuk dititrasi dengan NaOH 0.01 N dengan
indikator fenoftalein 1% (Apriyantono et al, 1989). Hasilnya dinyatakan sebagai per sen asam laktat.
ml NaOH x N NaOH x 0.09 x 100
% asam --- x pengenceran ml sampel
c. Pengujian Hidrogen Peroksida (price dan Lee, 1969) Dua ose isolat dari MRS-CaC0 3 semi padat di-pindahkan ke dalam MRS broth. Setelah inkubasi 2
hari. kultur digunakan sebagai inokulum untuk pro-duksi hidrogen peroksida. Sepuluh persen inoku-lum diinokulasi ke dalam air pepton 1%. Inkubasi dilakukan pada suhu 37°C.
Ke da1am 5 ml sampel bebas sel bakteri asam laktat, ditambahkan 0.5 ml KI jenuh, 0.5 ml 0.001 M amonium molibdat dalam 1 N asam sulfat, digoyang selama 1 menit, dan dititrasi dengan 0.001 N Na-tiosulfat sampai warna kuning yang terbentuk hampir hilang. Sejumlah indikator amilum 1% ditambahkan ke da1am sampel dan titrasi dilanjut-kan sampai warna biru mendadak lenyap. Untuk menentukan kon~entrasi H20 2 , digunakan kurva standar hidrogen peroksida.
Sebelum digunakan Na-tiosulfat distandarisasi dengan cara sebagai berikut: ke dalam erlenmeyer ditambahkan 10 ml KI0 3 , .10 ml KI, dan 10 ml HC1. Sampel segera dititrasi dengan Na-tiosulfat sampai warna muda sekali. Sejumlah 2 ml indikator amilum ditambahkan ke dalam sampel, titrasi dilanjutkan sampai warna mend adak lenyap.
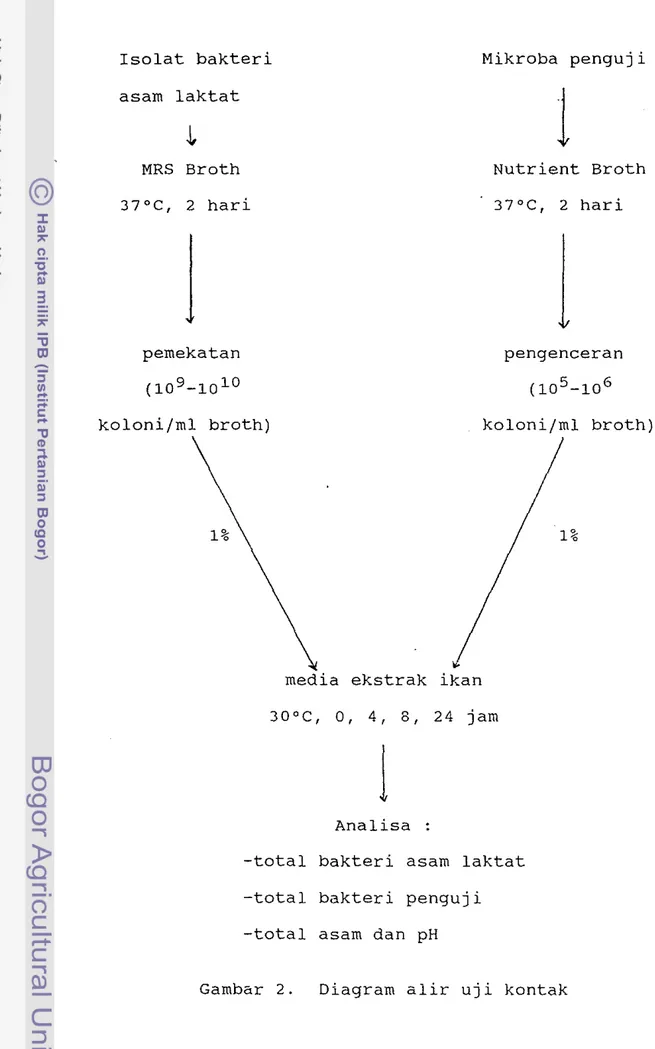
4. PENGARUH WAKTU KONTAK BAKTERI ASAM LAKTAT DENGAN BAKTERI PERUSAK DALAM MEDIA EKSTRAK lKAN RUCAH
Untuk menguji kemampuan bakteri asam laktat dalam menekan pertumbuhan mikroba perusak ikan (Alcaligenes
sp. dan P. fluorescens) dilakukan uji kontak dalam media ekstrak ikan (Gambar 2). Media ekstrak ikan dibuat berdasarkan prosedur Vatana dan Rosario (1983) dalam Olympia et al (1992). Dua belas gram ikan di-blender dengan 50 ml air destilata. Disaring dengan memakai kain saring. Ekstrak ikan kemudian ditepatkan pHnya menjadi 6 dengan HCl 0.1 N. Untuk kontrol, ke dalam media ekstrak ikan hanya ditambahkan bakteri penguji saja. Interval waktu kontak yang digunakan adalah 0, 4, 8, dan 24 jam, suhu inkubasi 30°C.
Untuk mempermudah pembahasan maka dilakukan ana-lisis data dengan menghitung nilai log (Nc/No), dimana Nc adalah jumlah miKroba pad a waktu c dan No adalah jumlah mikroba tepat setelah inokulasi (0 jam). Jika log (Nc/No) sama dengan nol berarti tidak terjadi pertumbuhan mikroba, kalau lebih besar dari nol berar-t i terjadi pertumbuhan, kalau lebih kecil dari nol berarti terjadi kematian. Untuk melihat efek bakteri-sidal atau bakteristatik nilai log (Nc/No) contoh harus dibandingkan dengan nilai log (Nc/No) kontrol. Jika nilai log (Nc/No) contoh berkurang sedangkan nilai log (Nc/No) kontrol bertambah berarti terjadi efek bakterisidal. Jika nilai log (Nc/No) kontrol bertambah dan nilai log (Nc/No) contoh juga bertambah tetapi tidak sebesar pertambahan nilai kontrol berarti terjadi efek bakteristatik.
Isolat bakteri asam laktat
.j,
MRS Broth 37°C, 2 harij
pemekatan (10 9_10 10 koloni/ml broth) 1%media ekstrak ikan
Mikroba penguji
1
Nutrient Broth 37°C, 2 hari pengenceran (10 5 -10 6 koloni/ml broth) 1% 30°C, 0, 4, 8, 24 jam1
Analisa-total bakteri asam laktat -total bakteri penguji -total asam dan pH
5. ANALISIS
a. Total Bakteri Asam Laktat dengan Metode Hitungan Cawan secara Agar Tuang (Fardiaz, 1987)
Dari pengenceran 10- 5 -10- 8 , sebanyak 1 ml ekstrak ikan rucah yang telah diinokulasi dipin-dahkan ke dalam cawan petri. Ke dalam cawan petri dimasukkan agar cair st~ril. Cawan petri segera digoyang secara mendatar. Setelah agar membeku, cawan diinkubasi pada posisi terbalik pada suhu 30°C selama 2-3 hari.
Untuk menghitung total bakteri asam laktat yang dikontakkan dengan P. fluorescens digunakan media agar MRS. Untuk bakteri asam laktat yang dikontakkan dengan Alcaligenes sp. digunakan media agar MRS yang telah ditambah 0.0075% natrium azida. Penambahan natrium azida dimaksudkan untuk menghambat pertumbuhan Alcaligenes sp ..
b. Total Bakteri Penguji dengan Metode ~les and ~s ra Surface Co~ony Count (Miles and Misra, 1969 dalam Harrigan dan Cance, 1976 ).
Pada pemupukan dengan metode ini, agar nu-trien steril terlebih dahulu dituangkan ke dalam cawan petri dan dibiarkan membeku. Setelah membe-ku dengan sempurna, kemudian sebanyak 0.02 ml con-toh yang telah diencerkan (pengenceran 10- 1 -10- 5 )
dipipet pada permukaan agar tersebut. Inkubasi dilakukan pada. suhu kamar selama sehari. Jumlah koloni per cawan yang memenuhi syarat untuk dihi-tung adalah 20 100 koloni per cawan. Jumlah koloni per ml yang sebenarnya didapatkan dengan mengalikan jumlah koloni per cawan dengan faktor
50. Pemupukan dilakukan duplo.
c. Analisa Total Asam dengan Metode Titrasi (Apriyan-tone et aI, 1989)
Ke dalam 5 ml contoh ditambahkan 15 air destilata. Larutan ini dititrasi dengan NaOH 0,01 N, indikator fenolftalein 1 %. Sebelum digunakan, NaOH distandarisasi dengan (COOH)2.2H20. Hasilnya dinyatakan sebagai persen asam laktat.
4. Pengukuran Nilai pH (Apriyantono et aI, 1989). Sebelum digunakan pH-meter dinyalakan terle-bih dahulu selama 15-30 menit. Elektroda kemudian dibilas dengan air
dengan kertas tissue.
destilata dan dikeringkan Setelah itu elektroda dice-lupkan ke dalam media ekstrak ikan, pengukuran pH diset. Elektroda dibiarkan tercelup beberapa saat sampai diperoleh pembacaan yang stabil. Sebelum pengukuran sampel, pH-meter distandarisasi dengan buffer fosfat pH 7. Langkah-langkah yang harus dilakukan dalam standarisasi pH-meter sarna dengan
cara pengukuran sampel, hanya saja setelah pemba-caan pH yang stabil, tombol kalibrasi disesuaikan sampai diperoleh angka pH yang sesuai dengan pH buffer.