Analisis Kandungan Logam Berat Kromium (Cr) Pada
Ikan, Plankton, Kepiting dan Kerang di Muara Tukad
Mati
Made Pande Darmawan
a*a Ilmu Kelautan, Fakultas Kelautan dan Perikanan, Universitas Udayana dan Alamatnya, Kabupaten/Kota, Provinsi-Negara
*Penulis koresponden. Tel.: +62-857-3874-0695 Alamat e-mail: md_pande@yahoo.co.id
Diterima (received) 8 Januari 2016; disetujui (accepted) 29 Juni 2016; tersedia secara online (available online) 4 Juli 2016
Abstract
Heavy metals are generally toxic to living things, although some are required in small quantities. Through various intermediaries, such as air, food, or water contaminated by heavy metals, the metal can be distributed to parts of the human body and some will accumulate. If this situation persists, for a long time it can reach an amount that endangers human health (Diantariani, 2006). Cr metal can enter into all strata of the environment, whether in the strata of water, soil or air (the atmosphere layer). Chromium that enters the strata of the environment can come from a variety of sources. But the sources of Cr metal inputs into the most common and most widely suspected environmental strata are industrial activities, household activities and from the burning and mobility of fuels (Palar, 2008).
By using observational method the researcher wanted to know the heavy metal content of chromium type present in Tukad Mati waters through the organisms living in those waters. Which is then known that the heavy metal content of the largest chromium type found in crabs that contain heavy metals up to 1.01 Mg / Kg.
Keywords:chromium, crab, kerrang, plankton, fish, heavy metal; Tukad Mati
Logam berat umumnya bersifat racun terhadap makhluk hidup, walaupun beberapa diantaranya diperlukan dalam jumlah kecil. Melalui berbagai perantara, seperti udara, makanan, maupun air yang terkontaminasi oleh logam berat, logam tersebut dapat terdistribusi ke bagian tubuh manusia dan sebagian akan terakumulasikan. Jika keadaan ini berlangsung terus menerus, dalam jangka waktu lama dapat mencapai jumlah yang membahayakan kesehatan manusia (Diantariani, 2006). Logam Cr dapat masuk ke dalam semua strata lingkungan, apakah itu pada strata perairan, tanah ataupun udara (lapisan atmosfer). Kromium yang masuk kedalam strata lingkungan dapat datang dari bermacam macam sumber. Tetapi sumber–sumber masukan logam Cr kedalam strata lingkungan yang umum dan diduga paling banyak adalah dari kegiatan-kegiatan perindustrian, kegiatan rumah tangga dan dari pembakaran serta mobilitas bahan-bahan bakar (Palar,2008).
Dengan menggunakan metode observasional peneliti ingin mengetahui kandungan logam berat jenis kromium yang ada dalam perairan Tukad Mati melalui organisme-organisme yang hidup di perairan tersebut. Yang kemudian di ketahui kandungan logam berat jenis kromium paling besar terdapat pada kepiting yang memiliki kandungan logam berat hingga 1.01 Mg/Kg.
Kata Kunci:kromium;kepiting;kerrang;plankton;ikan;logam berat; Tukad Mati
1. Pendahuluan
Logam berat yang ada pada perairan suatu saat akan turun dan mengendap pada dasar perairan, membentuk sedimentasi dan hal
ini akan menyebabkan biota laut yang mencari makan di dasar perairan (udang, kerang, kepiting) akan memiliki peluang yang sangat besar untuk terkontaminasi logam berat tersebut. Wolf et al. (2001)
menunjukkan bahwa logam berat yang terakumulasi pada ekosistem mangrove mengalami bioakumulasi dalam jaringan hewan Gastropoda yang berasosiasi dengan mangrove. Kepiting sering dijadikan sebagai bioindikator perairan karena mampu mengakumulasi logam berat yang cukup tinggi dibandingkan dengan biota lainnya (Bambang et al., 1995). Buangan industri yang mengandung persenyawaan logam berat bukan hanya bersifat toksik terhadap tumbuhan tetapi juga terhadap hewan dan manusia. Hal ini berkaitan dengan sifat-sifat logam berat yang sulit didegradasi, sehingga mudah terakumulasi dalam lingkungan perairan dan keberadaannya secara alami sulit dihilangkan, dapat terakumulasi dalam biota perairan termasuk kerang, ikan dan sedimen, memiliki waktu paruh yang tinggi dalam tubuh biota laut serta memiliki nilai factor konsentrasi yang besar dalam tubuh organisme (Taguge, Ayisman. et al. 2014).
Logam berat masuk ke dalam jaringan tubuh biota laut melalui beberapa jalan, yaitu saluran pernafasan (insang), saluran pencernaan (usus, hati, ginjal), maupun penetrasi melalui kulit (Ma’ruf, 2007). Jika biota laut yang telah terkontaminasi insang dan rantai makanan (Susiati 2008). Secara biologis logam berat akan mengalami penimbunan dalam tubuh biota organisme seperti ikan. Logam berat yang masuk kedalam tubuh ikan tidak dapat dikeluarkan lagi dari tubuh, karena logam berat cenderung menumpuk dalam tubuh ikan. Akibatnya logam berat akan terus ada di sepanjang rantai makanan (Yudo 2006).
Menurut Kementrian Negara
Kependudukan dan Lingkungan Hidup (1990) dalam Marganof (2003) menyatakan bahwa sifat toksisitas logam berat dapat dikelompokan ke dalam 3 kelompok, yaitu bersifat toksisitas tinggi yang terdiri atas unsur-unsur Hg, Cd, Pb, Cu dan Zn. Bersifat toksik sedang terdiri dari unsur-unsur Cr, Ni, dan Co dan yang bersifat toksik rendah
terdiri atas unsur Mn dan Fe. Dalam jumlah yang sangat kecil logam diperlukan oleh makhluk hidup seperti Mn, Fe, Cu, dan Zn.
Krom dialam berada pada valensi 3 (Cr3+) dan valensi 6 (Cr 6+). Cr6+ lebih toksik dibandingkan dengan Cr3+, karena sifatnya yang berdaya larut dan mobilitas tinggi di lingkungan (Rahman et al., 2007). Melalui rantai makanan kromium dapat terdeposit pada bagian tubuh makhluk hidup yang pada suatu ukuran tertentu dapat menyebabkan racun ( Mulyani 2004). Apabila masuk ke dalam sel, dapat menyebabkan kerusakan struktur DNA hingga terjadi mutasi (Larashati 2004). karsinogen (penyebab kanker), teratogen (menghambat pertumbuhan janin) dan mutagen (Schiavon et al., 2008). Akumulasi logam berat kromium (Cr) dapat menyebabkan kerusakan terhadap organ respirasi dan dapat juga menyebabkan timbulnya kanker pada manusia (Suprapti 2008). Sumber utama dari masuknya Cr ke lapisan udara dari suatu strata lingkungan adalah dari pembakaran dan mobilitas batu bara dan minyak bumi. Dari pembakaran yang dilakukan terhadap batu bara, akan dilepaskan Cr ke udara sebesar 10 ppm atau sebesar 1.400 ton Cr dilepas keudara setiap tahunnya. Sementara itu Cr dapat masuk ke badan perairan dengan dua cara, yaitu cara alamiah dan nonalamiah. buangan limbah industri dan rumah tangga ke badan air (Depkes, 2009).
Teluk Benoa berbentuk teluk intertidal yang dilingkari oleh hutan mangrove dan dilindungi dari gelombang air laut yang besar oleh Semenanjung Jimbaran di sebelah barat, serta Tanjung Benoa dan Pulau Serangan di sebelah timur (Sudiarta, 2013).Di daerah Benoa terdapat berbagai aktivitas yang mungkin berakibat menghasilkan sampah dan limbah dalam jumlah yang besar, diantaranya kegiatan jasa kepelabuhan di Pelabuhan Benoa, dampak reklamasi Pulau Serangan, aktivitas Bandara Internasional Ngurah Rai, aktivitas pembangkit listrik PLTD/PLTG Pesanggaran, TPA Suwung, aliran air Tukad Badung dan Tukad Mati, aktivitas perdagangan, bisnis dan transportasi, serta sampah dan limbah domestic masyarakat (Putra, 2010).
Salah satu tukad yang mengalir ke teluk benoa yaitu tukad mati, Tukad Mati merupakan salah satu sungai yang berada di Kabupaten Badung, Bali. Kegiatan Industri tekstil dan rumah tangga di kawasan padat penduduk di hilir sungai di sinyalir menjadi pemicu kandungan logam berat berupa Kromium (Cr) pada perairan di wilayah ini.Tukad mati merukapan aliran pembuangan air yang mengarah menuju teluk benoa, oleh sebab itulah untuk mengetahui pembuangan limbah yang menuju ke teluk benoa dilakukannlah penelitian dengan melihat kandungan logam berat Kromium cr yang di lihat dari trofik level di perairan muara tukad mati
2. Metode Penelitian
2.1 Waktu dan Lokasi
Gambar 1 Peta Lokasi Penelitian
Penelitian ini berlangsung pada bulan Mei 2017 pengambilan sampel dilakukan di muara tukad mati. Kemudian penanganan sampel di Laboratorium Ilmu Kelautan
Fakultas Kelautan dan Perikanan. Sedangkan pengukuran kandungan logam berat dilakukan di Laboratorium Analitik Universitas Udayana.
2.2 Alat dan Bahan
Alat yang digunakan adalah neraca analitik, ICPE-9000, gelas beaker, botol kaca kecil, hot plate, penggaris, plastic wrap, ember, pipet tetes, dissecting set, alat tulis dan label.
Bahan yang digunakan kerang, ikan, kepiting, Asam Sulfat (H2SO4), Asam Nitrat
(HNO3), lugol, dan formalin.
2.3 Prosedur Penelitian
2.3.1 Pengambilan Sampel
Sampel Ikan
Sampel ikan diambil di perairan dekat mangrove, dimana pengambilannya menggunakan pancing dan jaring, kemudian di daerah di perairan muara tukad mati. Sampel yang di dapat diambil daging dan insangnya.
Sampel Kerang dan Kepiting
Sampel kerang dan kepiting diambil di daerah mangrove dan juga perairan disekitarnya, dimana pengambilannya secara manual dengan tangan kemudian diletakkan di ember. Kerang dan kepiting yang diambil sebanyak. Untuk kerang dipisahkan menurut ukurannya dibedakan menjadi tiga, yaitu kecil, sedang dan besar, kemudian diambil dagingnya
Sampel Plankton
Sampel plankton diambil di perairan Teluk Benoa dengan metode tuang. Metode tuang yang digunakan adalah dengan menuangkan air laut ke plankton net sebanyak 100 L, kemudian dimasukkan ke botol. Setelah itu diberikan lugol hingga warna air berubah menjadi kecoklatan dan juga diberi formalin 1-2 tetes dengan pipet tetes.
2.3.2 Preparasi Sampel
Pengujian sampel menggunakan ICPE-9000. Sebelum dilakukan pengujian, sampel harus dipreparasi.
Sampel ditimbang menggunakan neraca analitik dengan berat 1,0 gr setiap sampel dan 50ml untuk sampel Plankton.
Kemudian sampel dipanaskan menggunakan hot plate hingga kering, dan untuk sampel plankton sebelumnya ditambahkan Asam Sulfat (H2SO4)
sebanyak 5ml terlebih dahulu sebelum dipanaskan.
Selanjutnya apabila sampel sudah kering, maka ditambahkan Asam Sulfat (H2SO4) sebanyak 5ml maka sampel akan
berubah warna menjadi berwarna hitam seperti arang
Sampel ditunggu hingga kering dan tidak ada cairan (mengkristal), selanjutnya ditambahkan 2ml Asam Nitart (HNO3)
Ditunggu hingga sampel berwarna bening, jika masih berwarna pekat seperti kuning kemerahan maka ditambahkan lagi 2ml Asam Nitart (HNO3)
Selanjutnya apabila warna sampel telah bening, sampel diencerkan menjadi 25ml dengan aquades untuk kemudian disaring dengan kertas saring dan corong. Diletakkan didalam botol kaca kecil ukuran 25ml
Sampel telah siap dibaca pada ICPE-9000
2.3.3 Pengujian Sampel dengan ICPE-9000
Setelah sampel selesai dipreparasi, selanjutnya sampel diuji menggunakan ICPE-9000.
Sampel yang telah dipreparasi dituang kedalam wadah sampel ICPE-9000 secara berurutan. Yang pertama dimasukkan adalah blanko, kemudian diikuti oleh sampel sesuai urutan pada kode sampel.
Selanjutnya memulai pembacaan dengan memilih start pada program yang ada di komputer
Hasil pembacaan akan keluar dengan satuan mg/L
2.3.4 Penghitungan Hasil
Hasil pembacaan kadar logam berat Chromium oleh ICPE-9000 memiliki satuan mg/L. Dikarenakan sampel awal ada yang
berupa padatan, maka satuan hasil harus dikonversi menjadi mg/Kg. Sehingga diperlukan perhitungan konversi satuan mg/L menjadi mg/Kg.
Konversi mg/L menjadi mg/Kg;
1000
(
Berat Sampel x Pengenceran
)
xHasil
(
mg
/
L
)=
..
mg
/
Kg
3. Hasil dan Pembahasan
Hasil penelitian yang diperoleh yakni sebagai berikut:
3.1 Ikan
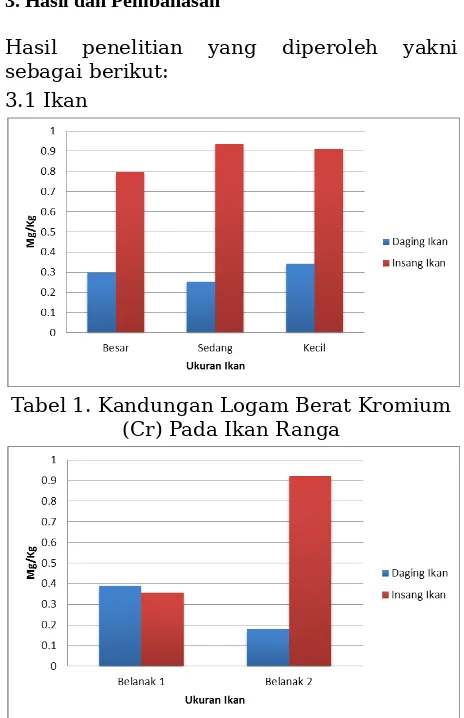
Tabel 1. Kandungan Logam Berat Kromium (Cr) Pada Ikan Ranga
Tabel 2. Kandungan Logam Berat Kromium (Cr) Pada Ikan Belanak
Pada sampel ikan belanak dengan dua sampel yang diperoleh yakni belanak 1 dan belanak 2, diperoleh hasil kandungan logam berat kromium (Cr) pada insang dengan kandungan 0.92 mg/kg pada ikan belanak 2 dan 0.35 mg/kg pada ikan belanak 1. Sedangkan kandungan logam berat kromium (Cr) pada daging belanak 1 sebesar 0.39 mg/kg dan 0.19 mg/kg pada ikan belanak 2.
Tingginya kandungan logam berat kromium pada bagian insang diduga karena fungsi dari insang yang langsung menyaring oksigen pada perairan. Kondisi tersebut juga diduga memungkinkan kontak langsung dengan perairan yang tercemar oleh limbah logam berat kromium (Cr). Dibandingkan pada bagian daging lebih rendah karena proses akumulasi logam berat yang diperoleh melalui makanan akan berlangsung sangat lambat.
3.2 Kepiting
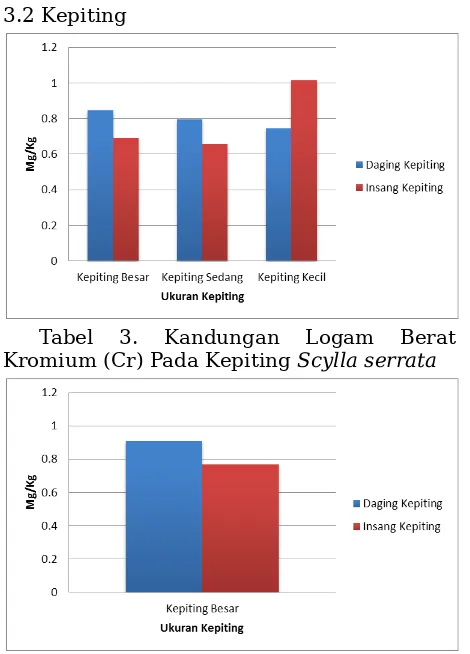
Tabel 3. Kandungan Logam Berat Kromium (Cr) Pada Kepiting Scylla serrata
Tabel 4. Kandungan Logam Berat Kromium (Cr) Pada Kepiting Hitam
Pada tabel 3. dapat dilihat hasil dari pengamatan logam berat kromium (Cr) yang terkandung pada daging dan insang kepiting Syllaserrata. Pada kepiting besar, didapatkan hasil logam berat dengan nilai 0.83 mg/kg, kepiting kecil sebesar 0.8 mg/kg dan pada kepiting kecil sebesar 0.68 mg/kg. Sedangkan kandungan logam berat pada insang, kandungan tertinggi terdapat
pada kepiting kecil dengan kandungan logam berat kromium (Cr) sebesar 1.00 mg/kg, diikuti oleh kepiting besar dengan kandungan sebesar 0.68 mg/kg dan kepiting kecil dengan kandungan sebesar 0.65 mg/kg.
Pada tabel 4. dilihat kandungan logam kromium (Cr) pada kepiting hitam. Pada tabel tersebut terlihat kandungan logam berat pada daging lebih tinggi pada daging dengan 0.87 mg/kg dibandingkan dengan pada bagian insang dengan kandungan logam berat sebesar 0.69 mg/kg.
Bagian daging pada tubuh kepiting menjadi salah satu tempat tersimpan atau terkontaminasinya logam berat kromium (Cr), dari hasil pengmatan tersebut, hal tersebut diduga dipengaruhi dari sistem 3.3 Kerang
Tabel 5. Kandungan Logam Berat Kromium (Cr) Pada Kerang Anadara granosa dan
Polymesoda erosa
Pada tabel 5. dapat dilihat hasil dari pengamatan kandungan logam berat kromium (Cr) pada kerang Anadara granosa dan Polymesoda erosa. Kandungan logam berat kromium (Cr) pada kerang anadara sedang lebih tinggi dengan 0.43 mg/kg dibandingkan dengan kerang berukuran kecil dengan kandungan sebesar 0.4 mg/kg dan kerang besar dengan kandungan 0.37 mg/kg. Sedangkan pada kerang Polymesoda erosa kandungan logam berat kromium (Cr) terdapat pada kerang berukuran besar dengan nilai sebesar 0.45 mg/kg, diikuti oleh kerang sedang dengan kandungan 0.4 mg/kg dan kerang kecil dengan kandungan jauh lebih kecil dari ukuran kerang sebelumnya dengan kandungan logam berat sebesar 0.05 mg/kg.
Kandungan logam berat pada kerang Anadara granosa berukuran sedang memiliki nilai yang paling besar dibandingkan dengan sampel yang lain. Hal tersebut diduga tidak terlepas dari habitat kerang Anadara granosa. Menurut Latifah,
2011, ,kerang darah banyak ditemukan pada substrat yang berlumpur di muara sungai. Kerang darah bersifat infauna yaitu hidup dengan cara membenamkan diri di bawah permukaan lumpur. Habitat tersebut diduga menjadi salah satu faktor utama yang mempengaruhi tingginya kadar logam berat. Karena logam berat akan mengendap di substrat atau lumpur dalam waktu yang lama. Sehingga organisme yang hidup pada substrat tersebut akan terkontaminasi dengan waktu yang lama dan dengan konsentrasi yang tinggi serta mengingkatkan tingginya kandungan logam berat pada organisme tersebut.
3.4 Plankton
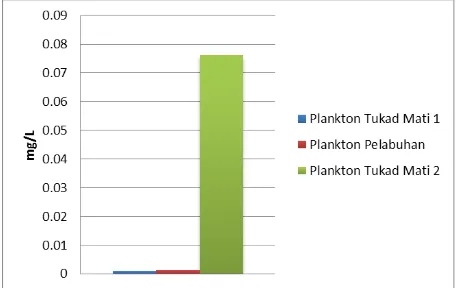
Tabel 6. Kandungan Logam Berat Kromium (Cr) Pada Plankton
Pada tabel 6. dapat dilihat hasil pengamatan logam berat pada tiga titik pengambilan sampel plankton. Kandungan logam berat kromium (Cr) pada tukad mati 2 memiliki kadar paling tinggi dengan nilai sebesar 0.07 mg/kg, sedangkan dua titik yakni, pada tukad mati 1 dan pelabuhan memiliki kadar logam berat masing-masing dibawah 0.01.
Tingginya kandungan logam berat kromium (Cr) pada sampel plankton di titik tukad mati 2 diduga disebabkan karena lokasi tersebut merupakan lokasi utama aliran dari limbah yang berasal dari hulu tukad mati. Dengan kondisi tersebut besar kemungkinan jika plankton yang berada di muara tukad mati terkontaminasi secara langsung oleh limbah logam berat kromium (Cr).
4. Simpulan
Berdasarkan hasil penelitian dapat di ambil kesimpulan:
1. Tingkat kandungan logam berat kromium terbesar terkandung kepada jenis kepiting Scylla serta monitoring terhadap pencemaran di wilayah Tukad Mati agar nantinya Kemudian juga terima kasih kepada seluruh teman-teman Ilmu Kelautan 2017 yang sudah membantu saya dalam penulisan ini. Daftar Pustaka sumber pustaka primer (jurnal) dan juga minimal 85% dari total pustaka yang digunakan adalah institutional environment of financial reporting regulation in ASEAN. The International Journal of Accounting, 35(1), 1– 26.
Buku:
Abbott, M. R., & Letelier, R. M. (1999).