422
Tema 3: Pangan, Gizi dan Kesehatan
PENGARUH PEMBERIAN EKSTRAK ETANOL AKAR
PURWOCENG
(Pimpinella pruatjan Molk.)SECARA AKUT TERHADAP
FUNGSI HEPAR TIKUS PUTIH (RATTUS NORVEGICUS) JANTAN:
UJI TOKSISITAS AKUT
Oleh
Fitranto Arjadi
1, Dhadhang Wahyu Kurniawan
2, Tomi Nugraha
1, Fikriah Rismi
Febrina
1, Emiliza Salman
1, Nafisah Putri Wyangsari
11
Fakultas Kedokteran Universitas Jenderal Soedirman, Purwokerto, Indonesia
2Fakultas Ilmu-ilmu Kesehatan Universitas Jenderal Soedirman, Purwokerto,
Indonesia
Email: f.arjadi@yahoo.com
ABSTRAK
Latar Belakang: Purwoceng (Pimpinella pruatjan Molk.), merupakan tanaman obat tradisional
peningkat vitalitas pria. Senyawa aktif di dalam akar Purwoceng berpotensi toksik terhadap hepar. Tingkat keamaan Purwoceng sebagai obat tradisional belum banyak dipublikasikan sehingga dilakukan uji toksisitas akut.
Tujuan: Menganalisis pengaruh pemberian ekstrak etanol akar Purwoceng (Pimpinella pruatjan
Molk.) secara akut terhadap kerusakan gambaran histologi hepar dan kadar SGOT, SGPT tikus putih (Rattus norvegicus) jantan.
Metode: Penelitian ini bersifat eksperimental dengan pendekatan post-test onlyterhadap lima belas
tikus putih jantan galur Wistar yang dibagi menjadi lima kelompok acak, yaitu kelompok kontrol (A) yang diberi aquades, kelompok perlakuan dengan dosis masing-masing 5 mg/kgBB (B), 50 mg/kgBB (C), 300 mg/kgBB (D), dan 2000 mg/kgBB (E). Kerusakan gambaran histologi hepar dinilai dengan skor Roenigk termodifikasi dan kadar SGOT dan SGPT diukur dengan metode UV test.
Hasil: Analisis kerusakan gambaran histologi hepar dengan Uji Kruskal-Wallis tidak menunjukkan
perbedaan bermakna (p>0.05).UjiOne Way ANOVAterhadap kadar SGOT menunjukkanperbedaan
tidak bermakna (p >0,05), sedangkan terhadap kadar SGPT menunjukkannilaibermakna (p <0,05). Kesimpulan: Pemberian ekstrak etanol akar Purwoceng secara akut berbagai dosis tidak merusak secara bermakna terhadap gambaran histologi hepar, tidak berpengaruh bermakna terhadap kadar
SGOT akan tetapi berpengaruh secara bermakna terhadap kadar SGPT tikus putih (Rattus
norvegicus) jantan.
Kata Kunci: Purwoceng, Uji toksisitas akut, fungsi hepar, Rattus norvegicus
PENDAHULUAN
Purwoceng, terutama akarnya merupakan contoh obat tradisional yang sering digunakan
untuk meningkatkan vitalitas pria.1,2 Tanaman Purwoceng (Pimpinella pruatjan Molk.) tumbuh
endemis di beberapa dataran tinggi di Indonesia. Tanaman ini diduga memiliki efek androgenik dan
anabolik.1,3
Penelitian terdahulu kepada hewan coba membuktikan bahwa kandungan akar Purwoceng
423
dalam testis, meningkatkan jumlah dan motilitas sperma, memilikiefek antioksidan serta
meningkatkan kadar hormon LH dan testosteron.2,3,4Uji fitokomia menunjukkan bahwa akar
Purwoceng mengandung senyawa flavonoid, tanin, kumarin, saponin, sterol, alkaloid,
oligosakarida, eurikomalakton, dan amarolinda.2,5,6
Senyawa aktif hasil uji fitokimia yang terkandung di dalam akar Purwoceng merupakan
senyawa xenobiotik yang akan mengalami biotransformasi dan ekskresi seperti halnya obat pada
umumnya. Sisa hasil biotransformasi obat dapat menjadi racun bagi tubuh manusia.7Hepar sebagai
organ utama biotransformasi obat dan ginjal sebagai organ utama ekskresi obat akan terpapar oleh
sisa metabolik, racun, dan mikroba sehingga rentan mengalami kerusakan.8
Senyawa aktif di dalam akar Purwoceng berpotensi toksik. Senyawa yang bersifat lipofilik
seperti alkaloid, tanin, dan flavonoid dapat menyebabkan kerusakan pada sel tubuh, misalnya
hepatosit dan ginjal. Kerusakan yang terjadi diakibatkan senyawa aktif tersebut lebih mudah
berikatan dengan sel tubuh, dan meningkatkan durasi metabolisme dan ekskresi obat di dalam
tubuh.9,10 Senyawa aktif lain seperti fenol merupakan metabolit sekunder yang dapat menimbulkan
efek toksik dan mengiritasi sel tubuh.11,12
Keamanan obat dapat digambarkan melalui uji toksisitas agar obat dapat dikatakan aman.13
Uji toksisitas adalah langkah awal dari uji toksisitas umum yang dilakukan untuk mengetahui
pengaruh pajanan zat toksik dengan waktu pemberian tertentu terhadap organ sasaran.14 Uji ini
dilakukan untuk mendeteksi efek toksik yang muncul pada organ sasaran dalam waktu singkat
setelah pemberian obat dosis tunggal secara oral atau dosis berulang dalam waktu 24 jam.15
Penelitian uji toksisitas Purwoceng saat ini belum banyak dipublikasikan, sehingga dilakukan
penelitian tentang pengaruh pemberian ekstrak etanol akar purwoceng (Pimpinella pruatjan
Molk.) secara akut terhadap Hepar dan Ginjal.
METODE PENELITIAN
Rancangan Studi
Penelitian ini adalah penelitian eksperimental dengan pendekatanpost-test only dengan
kelompok kontrol. Persetujuan etik didapatkan dari KEPK Fakultas Kedokteran Universitas
Padjadjaran.
Subjek
Hewan coba yang digunakan adalah tikus putih (Rattus norvegicus) jantan galur Wistar
dengan kriteria inklusi: tikus jantan, berusia 8 – 12 minggu, dan memiliki berat badan diantara 150
– 200 gram. Hewan coba dieksklusikan apabila sakit dan mengalami perubahan berat badan 10%
424
dengan metode rancangan acak lengkap ke dalam lima kelompok, yaitu kelompok kontrol (A)
yang diberi aquades, dan pemberian ekstrak etanol akar Purwoceng dosis tunggal 5 mg/kgBB (B),
50 mg/kgBB (C), 300 mg/kgBB (D), dan 2000 mg/kgBB (E).
Tata Urutan Kerja
Ekstrak etanol akar purwoceng dibuat dengan teknik maserasi bertingkat. Aklimatisasi
diberikan selama tujuh hari sebelum perlakuan dalam kandang berukuran 60 x 40 x 35 cm.
Pemberian dosis tunggal ekstrak etanol akar Purwoceng diberikan melalui sonde oral pada hari
pertama setelah proses aklimatisasi selesai. Pengamatan dilakukan selama 4 jam pertama setelah
pemberian dosis untuk melihat tanda toksisitas umum berupa konvulsi, tremor, diare, agitasi, dan
koma. Hewan diobservasi kembali pada waktu 24 jam kemudian dilakukan pengambilan sampel
darah menggunakan pipet hematokrit melalui sinus orbitalis, kemudian dilakukan terminasi hewan
coba dengan cara dislokasi servikal lalu dilakukan pengambilan organ hepar dan ginjal. Organ
kemudian dibilas dengan larutan fisiologis NaCl 0,9% kemudian difiksasidenganlarutanNeutral
Buffered Formaline dan dibuat preparat dengan pewarnaanHematoxylin-Eosin (HE).
Pengambilan Data
Pengambilan data perubahan gambaran histologi hepar dinilai berdasarkan skor Roenigk
termodifikasi terhadap 20 hepatosit setiap lapang pandang. Skor 1 diberikan untuk sel normal, skor
2 untuk sel yang mengalami degenerasi parenkimatosa, skor 3 utuk sel yang mengalami degenerasi
hidropik, skor 4 untuk sel yang mengalami nekrosis. Total skor dijumlahkan hingga pengamatan
dilakukan sampai lima lapang pandang. Pengukuran kadar SGOT dan SGPT menggunakan metode
UV test, kadar ureum menggunakan metode urease-GLDH (λ 340 nm).
Analisis Statistik
Uji validitas dan reliabilitas antarpengamat dilakukan menggunakan uji Kappa. Analisis
univariat terdiri atas mean dan standar deviasi hasil pengamatan per kelompok. Analisis univariat
dilakukan untuk mengetahui nilai rerata dan standar deviasi data. Selanjutnya, dilakukan uji
normalitas dan analisis bivariat sesuai dengan hasil uji normalitas dan jenis data yang didapat untuk
masing-masing variabel penelitian.
HASIL
Gambaran Histologi Hepar
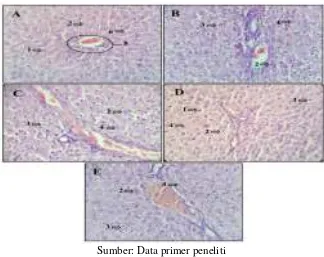
Gambaran histologi hepar pada seluruh kelompok menunjukkan adanya variasi hepatosit
yang beragam seperti terlihat pada Gambar 1. Gambaran histologi hepar normal dapat terlihat lebih
banyak pada kelompok A, karena bentuk dan ukuran sel masih seragam dengan inti sel yang masih
bulat dan di tengah, serta sinusoid terlihat melebar. Degenerasi parenkimatosa dapat terlihat dari
425
adanya penumpukkan protein. Degenerasi hidropik dapat terlihat dari hepatosit yang lebih besar
dari ukuran normal, akan tetapi terdapat vakuola pada sitoplasma yang berwarna jernih. Degenerasi
dapat dilihat pada seluruh kelompok. Nekrosis dapat terlihat dari gambaran inti yang mengalami
perubahan berupa piknotik, karioreksis, dan kariolisis. Piknotik merupakan gambaran intik yang
memadat, karioreksis merupakan gambaran inti yang pecah menjadi fragmen-fragmen, sedangkan
kariolisis merupakan gambaran inti sel yang memudar.
Sumber: Data primer peneliti
Gambar 1. Gambaran histologi hepar tikus pasca perlakuan. (A) Kelompok kontrol, kelompok perlakuan ekstrak etanol akar Purwoceng dosis tunggal (B) 5 mg/kgBB, (C) 50 mg/kgBB, (D) 300
mg/kgBB, dan (E) 2000 mg/kgBB. (1) hepatosit normal; (2) degenerasi parenkimatosa; (3)
degenerasi hidropik; (4) nekrosis; (5) daerah porta; (6) sinusoid. Pewarnaan Hematoxylin-eosin
(HE); Perbesaran 400x.
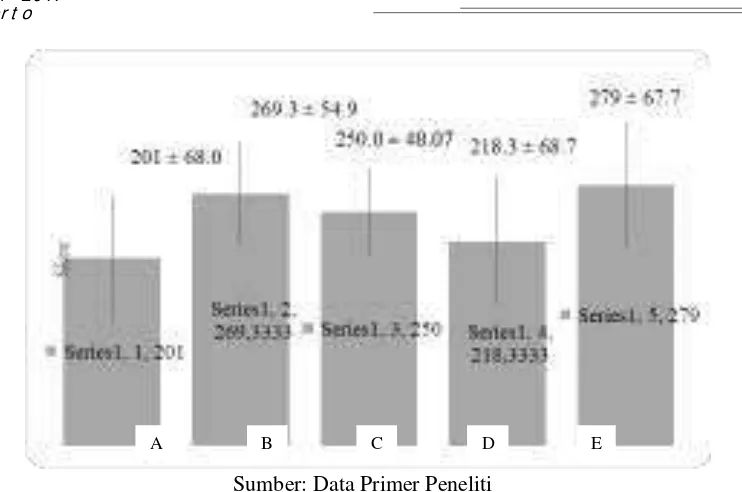
Hasil rerata total skor Roenigk termodidikasi paling tinggi terdapat pada kelompok E, yang
diikuti oleh kelompok B, kelompok C, dan kelompok D seperti terlihat pada Gambar 2. Hasil uji
Kurskal-Wallis didapatkan hasil p=0.363 (p>0.05) yang menunjukkan bahwa tidak terdapat
perbedaan kerusakan gambaran histologi hepar yang bermakna antarkelompok. Analisis data
dilanjutkan dengan uji Mann-Whitney untuk mengetahui perbedaan perubahan antara kelompok D
dengan kelompok yang lain, sedangkan untuk kelompok A, B, C, dan E dilakukan analisis lanjutan
dengan menggunakan uji T-independen. Hasil uji Mann-Whitney dan T independen didapatkan
hasil p>0.05 sehingga perbedaan perubahan gambaran histologi hepar terbukti tidak memiliki
426
Sumber: Data Primer Peneliti
Gambar 2.Rerata total skor Roenigk.KelompokA :Kontrol; Kelompok B : 5 mg/KgBB; Kelompok C : 50 mg/KgBB; Kelompok D : 300 mg/KgBB; Kelompok E : 2000 mg/KgBB.
Kadar SGOT dan SGPT
Uji toksisitas akut bertujuan untuk mengetahui nilai LD50 dan efek toksik pemberian akut
suatu zat.45Selama penelitian berlangsung, tidak terdapat hewan coba yang mati, sehingga belum
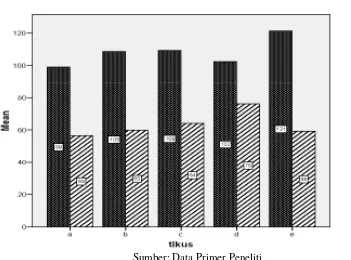
dapat ditentukan kadar LD50 pada ekstrak etanol akar purwoceng. Nilai normal kadar SGOT dan
SGPT dari Laboratorium Penelitian dan Pengujian Terpadu Universitas Gadjah Mada sebesar
72,9-127,9 U/l dan 44,5-74,9 U/l. Terdapat rerata nilai SGPT yang diatas normal pada kelompok D
(76,27±3,27 U/l) Rerata kadar SGOT tertinggi adalah kelompok E (121,53±16,31 U/l), kemudian
kelompok C (109,23±7,95 U/l), kelompok B (108,46±12,41U/l), kelompok D (102,36±7,46 U/l),
dan yang terkecil adalah kelompok A (99,06±8,1U/l). Rerata kadar SGPT tertinggi adalah
kelompok D (76,27±3,27 U/l), dan terendah pada kelompok A (56,5±4,18 U/l). Urutan rerata
SGPT kelompok perlakuan adalah kelompok C (64,1±4,76 U/l) lalu kelompok B (59,87±10,64 U/l)
dan kelompok E (59,13±9,95 U/l) (Gambar 5).
427
Sumber: Data Primer Peneliti
Gambar 5. Rerata Kadar SGOT dan SGPT Tikus Putih Jantan. KelompokA :Kontrol; Kelompok B : 5 mg/KgBB; Kelompok C : 50 mg/KgBB; Kelompok D : 300 mg/KgBB; Kelompok E : 2000 mg/KgBB.
Analisis bivariat menggunakan
One Wa y ANOVAdidapatkan hasil pada SGOT
nilai p=0,604 yang menunjukkan tidak terdapat perbedaan rerata yang bermakna antara
kelompok data SGOT (p>0,05). Analisis
One Way ANOVApada data SGPT didapatkan
nilai p=0,033 (p<0,05), yang berarti terdapat minimal dua kelompok data yang memiliki
perbedaaan rerata yang bermakna. Data bivariat SGPT kemudian dilakukan uji
post hocBonferroni
dan didapatkan terdapat perbedaan rerata yang bermakna antara kelompok A
dan kelompok D.
DISKUSI
Gambaran Histologi Hepar
Rerata total skor Roenigk tertinggi terdapat pada kelompok E (279 ± 67.67), sedangkan yang
terendah terdapat pada kelompok D (218.33 ± 68.71). Kelompok B dan C berada diantara
kelompok E dan D. Skor Kelompok B memiliki rerata 269.33 ± 54.88 yang lebih tinggi jika
dibandingkan dengan kelompok C dengan rata-rata 250 ± 48.07. Hasil analisis total skor Roenigk
dengan uji Kruskal-Wallis, yang dilanjutkan dengan uji Mann Whitney dan uji T-Independen,
menunjukkan nilai p>0.05. Hal ini menunjukkan bahwa tidak terdapat kerusakan gambaran
histologi hepar yang bermakna jika dibandingkan dengan kelompok kontrol pada pemberian dosis
428
Kerusakan gambaran histologi hepar di dalam penelitian ini pada dasarnya diakibatkan oleh
kandungan aktif ekstrak etanol akar purwoceng, seperti alkaloid, flavonoid, tanin, dan fenol yang
memiliki potensi toksik terhadap hepar.9,10,12Kerusakan yang tidak bermakna pada penelitian ini
terjadi karena kandungan senyawa aktif pada akar Purwoceng selain memiliki potensi toksik juga
memiliki sifat hepatoprotektif. Penelitian terhadap mencit yang diberikan karbon tetraklorida
menunjukkan bahwa flavonoid memiliki aktivitas hepatoprotektif.16,17Selain itu, sebuah penelitian
mengenai pemberian obat herbal menunjukkan bahwa kandungan flavonoid memberikan efek
hepatoprotektif yang signifikan.18 Penelitian lain menunjukkan bahwa glikosida, flavonoid,
triterpenoid, dan fenol merupakan senyawa aktif yang memiliki aktivitas hepatoprotektif.19
Purwoceng juga mengandung beberapa senyawa aktif yang bersifat antioksidan seperti
flavonoid, tanin, triterpenoid, vitamin E.5,20 Terdapatnya senyawa antioksidan pada Purwoceng
dapat memberikan mekanisme pertahanan hepar untuk menangkal radikal bebas hidroksil dan
hidrogen peroksida dengan cara melakukan metabolisme peroksida lipid.21 Selain itu, senyawa
antioksidan yang terkandung di dalam Purwoceng dapat menghambat pembentukan Reactive
Oxygen Species dan mencegah menumpuknya lipid peroksidase.22Kelompok D memiliki rerata
total skor Roenigk paling rendah, karena obat herbal yang mengandung tanin dan flavonoid dengan
dosis 200 mg/kgBB dan 500 mg/kgBB memiliki efek hepatoprotektif terhadap kelinci yang
mengalami hepatotoksisitas akibat parasetamol.23
Gambaran histologi hepar pada kelompok kontrol (A) menunjukkan skor Roenigk yang
bervariasi, dan tetap dapat ditemui kerusakan mulai dari degenerasi parenkimatosa hingga terjadi
nekrosis karena beberapa faktor seperti faktor biologis, faktor kimia, faktor hereditas, dan faktor
lingkungan.
Faktor lingkungan telah dikendalikan dengan memberikan kandang dan suasana yang sama.
Suasana tempat penelitian dikendalikan dengan menjaga temperatur, kelembaban, dan sirkulasi
udara, selain itu kandang selalu dibersihkan setiap hari. Asupan makanan yang diberikan juga sama
pada seluruh kelompok, tetapi jumlah pakan, riwayat pakan, dan riwayat minum pada hewan coba
pada penelitian ini tidak diketahui. Jumlah asupan pakan yang kurang selama tiga hari menurut
sebuah penelitian dapat menyebabkan kerusakan ringan pada jaringan hepar24.
Faktor biologis diantaranya adalah adanya mikroorganisme berupa jamur pada pakan yang
diberikan, diduga terdapat kelompok jamur yang hidup di dalam pakan hewan coba dan dapat
menghasilkan aflatoksin25. Kandungan aflatoksin ini merupakan zat yang dapat menimbulkan efek
merusak pada hepar26.
Perlakuan pada penelitian ini dilakukan selama 24 jam dengan pemberian obat dosis tunggal
secara peroral untuk melihat respon organ terhadap dosis obat yang diberikan dalam waktu yang
singkat. Kerusakan hepatosit pada penelitian ini menunjukkan perbedaan yang tidak signifikan
429
pasca reseksi hepar, sehingga hanya dapat diobservasi kerusakan hepatosit yang bersifat
ireversibel27.
Kerusakan sel pada umumnya dapat dibagi menjadi dua kategori, yaitu jejas reversibel dan
jejas ireversibel. Jejas reversibel adalah suatu kondisi dimana sel yang mengalami kerusakan dapat
mengkompensasi rusaknya integritas membran sel, gangguan pembentukan ATP, gangguan sintesis
protein, dan rusaknya integritas apparatus genetik. Jika kompensasi gagal dilakukan, maka akan
timbul jejas ireversibel yang menyebabkan disfungsi mitokondria dan gangguan fungsi membran
yang luas. Degenerasi parenkimatosan dan degenerasi hidropik yang dihitung pada skor Roenigk
merupakan bagian dari jejas reversibel, sedangkan nekrosis dikategorikan sebagai jejas
ireversibel28.
Kadar SGOT dan SGPT
Kandungan ekstrak etanol akar purwoceng diantaranya adalah alkaloid, tanin, flavoniod,
saponin, triterpenoid, fenol, glukosa, dan vitamin C.42,43,44Senyawa lipofilik diantaranya alkaloid,
flavoniod, saponin, dan tanin dapat merusak hepar dengan cara merusak membran sel dan
menyebabkan peningkatan permeabilitas membran sehingga terjadi peningkatan kadar SGOT dan
SGPT.48Selain itu, tanin, vitamin C, flavonoid, saponin, dan fenol juga memiliki efek
hepatoprotektif dengan perannya sebagai antioksidan.46,47
Rerata tertinggi nilai SGOT yaitu kelompok E (2000 mg/kgBB) sebesar 121,53±16,31 U/l.
Peningkatan kadar SGOT dapat terjadi karena kerusakan hepatosit. Peningkatan kadar SGOT juga
bisa terjadi jika terdapat kerusakanjantung, otot, otak, dan ginjal sehingga tidak
spesifik.49Peningkatan kadar SGOT dalam batas normal juga dapat disebabkan karena selain efek
hapatotoksik, ekstrak etanol akar purwoceng juga bersifat hepatoprotektif.Pemberian tanaman lain
yang mengandung alkaloid, flavonoid, triterpenod dan fenol pun menunjukkan hasil SGOT yang
meningkat tetapi masih dalam batas normal.50
Nilai SGPT lebih spesifik menunjukkan kerusakan akut hepatosit, karena sebagian besar enzim
ini terdapat di hepatosit.51Letak enzim SGPT yang terdapat di sitosol hepatosit menyebabkan enzim
ini lebih cepat keluar saat terjadi kerusakan membran hepatosit.52 Rerata kadar SGPT tertinggi
terdapat pada kelompok D (300 mg/kgBB) yaitu sebesar 76,27±3,27 U/l, sedikit meningkat
daripada nilai normal. Peningkatan kadar SGPT menunjukkan disfungsi hepar sebagai akibat dari
biosintesis enzim dan penurunan permeabilitas membran. Kerusakan hepar yang terjadi
kemungkinan karena paparan langsung zat toksik pada saat proses detoksifikasi produk metabolit
dan senyawa xenobiotik.53
Rerata kadar SGPT menurun pada dosis yang lebih tinggi, yaitu pada kelompok E (59,13±9,95
U/l). Hal ini kemungkinan pada dosis yang lebih tinggi ekstrak etanol akar purwoceng lebih
430
menetralkan reaksi residual radikal bebas dan flavonoid yang dapat mengurai reactive oxygen
spesies (ROS) sehingga meningkatkan aktivitas antioksidan di dalam tubuh.46,47 Penelitian
mengenai pemberian ekstrak Dendrobium ovatum yang mengandung flavonoid, alkaloid,
triterpenoid, glikosida, dan steroid menunjukkan kadar SGPT terendah pada kelompok perlakuan
dosis tertinggi (400 mg/kgBB) dibandingkan kelompok dosis yang lebih rendah.47
KESIMPULAN
Pemberian ekstrak etanol akar Purwoceng secara akut berbagai dosis tidak merusak secara
bermakna terhadap gambaran histologi hepar dan ginjal, tidak berpengaruh bermakna terhadap
kadar SGOT, ureum dan kreatinin, akan tetapi berpengaruh secara bermakna terhadap kadar SGPT
tikus putih (Rattus norvegicus) jantan.
REFERENSI
1. Dewoto, H. R. 2007. Pengembangan Obat Tradisional Indonesia Menjadi Fitofarmaka.
Majalah Kedokteran Indonesia. 57(7): 205 – 2011.
2. Juniarto, A. Z. 2004. Perbedaan Pengaruh Pemberian Ekstrak Eurycoma Longifolia dan
Pimpinella Alpina Molk pada Spermatogenesis Tikus Sprague Dawley. Tesis. Universitas Diponegoro. Semarang. (Tidak dipublikasikan)
3. Usmiati, S., &Yuliani, S. 2010. Efek Androgenik dan Anabolik Ekstrak Akar Pimpinella
alpina Molk (Purwoceng) pada Anak Ayam Jantan. Prosiding Seminar Nasional teknologi Peternakan dan Veteriner. 2010: 744 – 755.
4. Taufiqqurrachman. 1999. Pengaruh Ekstrak Pimpinella alpina Molk (Purwoceng) dan Akar
Eurycoma longifolia Jack. (Pasak Bumi) Terhadap Peningkatan Kadar Testosteron, LH, dan
FSH serta Perbedaan Peningkatannya pada Tikus Jantan Sprague Dawley. Tesis. Semarang:
Prodi Ilmu Biomedik Program Pascasarjana Universitas Diponegoro.
5. Pribadi, W. A. 2012. Efektivitas Ekstrak Etanol Purwoceng (Pimpinella alpina) terhadap
Pertambahan Bobot Badan Tikus Betina Bunting pada Umur Kebuntingan 0 – 13 Hari.
Skripsi. Bogor: Institut Pertanian Bogor
6. Darwati, I., & Rostika, I. 2006. Status penelitian Purwoceng di Indonesia. Buletin Plasma Nutfah. 12(1): 9 – 15.
7. Correia, M. A. 2007. Drug Biotransformation dalam Basic & Clinical Pharmacology 10th Ed.
New York: McGraw-Hill Companies.
inhibitors for cytochrome P450 CYP1A and CYP1B1. Toxicology. 144(1-3): 31 – 38.
11. Kunaepah, U. 2008. Pengaruh Lama Fermentasi dan Konsentrasi Glukosa Terhadap Aktivitas
Antibakteri, Polifenol Total dan Mutu Kimia Kefir Susu Kacang Merah. Artikel Ilmiah.
Universitas Diponegoro. Semarang.
12. Kyselova, Z. 2011. Toxicological aspects of the use of phenolic compounds in disease
prevention. Interdisciplinary Toxicology. 4(4): 173 – 183.
13. Spillane, J. J. 2010. Ekonomi Farmasi. Yogyakarta: Grasindo.
14. Lu, F. C. 2006. Toksikologi Dasar: Asas, Organ Sasaran, dan Penilaian Risiko. Edi Nugroho,
431
15. BPOM. 2014. Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia
Nomor 7 Tahun 2014 tentang Pedoman Uji Toksisitas Nonklinik Secara In Vivo.
16. Al-Jumaily, E. F., Raghad, S. A., &Jasim, M. A. 2014. Hepatoprotective Activity of
Flavonoids Purified and Ethanolic Extract from Iraqi Propolis Against Carbon tetrachloride-
Induced Liver Damage In Male Mice. IOSR Journal Of Pharmacy. 4(3): 22 – 27.
17. Sannigrahi, S., Upal, K. M., Dilip, K. P., Arijit, M., & Souvik, R. 2009. Hepatoprotective
Potential of Flavonoid Rich Fraction of Enhydra fluctuans Against CCl4-Induced Oxidative
Damage in Rats. Pharmacologyonline. 2(2009): 575 – 586.
18. Gupta A., Sheth, N. R., Sonia, P., Jitendra, S. Y., & Shrikant V. J. 2015. Screening of flavonoids rich fractions of three Indian medicinal plants used for the management of liver
diseases. Brazilian Journal of Pharmacology. 25(2015): 485 – 490.
19. Adewusi, E. A., &Afolayan, A.J. 2010. A review of natural products with hepatoprotective
activity. Journal of Medicinal Plants Research. 4(13): 1318 – 1334.
20. Achmadi, P. 2011. Kajian Androgenik Ekstrak Etanol Akar Purwoceng (Pimpinela alpina
KDS) Terhadap Kinerja Reproduksi Tikus Putih (Rattus norvegicus) Betina Dara. Skripsi.
Institut Pertanian Bogor. Bogor.
21. Chen, Y., Dong, H., Thompson, D.C., Shertzer, H.G., & Nebert, D.W., et al. 2013.
Glutathione Defense Mechanism in Liver Injury: Insights from Animal Models. Food
Chemical Toxicology. 2013 October ; 60: 38–44.
22. Adewole, S.O, & Ojewole, J.A.O. 2009. Protective Effects of Annona Muricata Linn.
(Annonaceae) Leaf Aqueous Extract on Serum Lipid Profiles and Oxidative Strees in
Hepatocytes of Streptozotocin-Treated Diabetic Rats. African Journal Traditional,
Complementary and Alternatives Medicines. 6(1): 30-41.
23. Rehman, J. U. 2015. Phytochemical Screening and Hepatoprotective Effect of Alhagi
maurorum Boiss (Leguminosae) Against Paracetamol-Induced Hepatotoxicity in Rabbits. Tropical Journal of Pharmaceutical Research. 14(6): 1029 – 1034.
24. Al-Qudah, M. M. 2012. The Histological Examination of Male Albino Rats Liver Which Was
Exposed to Hunger Stress. World Applied Sciences Journal. 16(10): 1427 – 1431.
25. Rachmawati, S., & Hamid, H. 2006. Pengaruh Penggunaan Sambiloto (Andrographis
paniculata Nees) Terhadap Kandungan Residu Aflatoksin dalam Hati Itik dan Hubungannya
dengan Aflatoksikon. Seminar nasional Teknologi Peternakan dan Veteriner.3(1) : 25-30.
26. Onyegeme-Okerenta, B. M., & Enyadike, N. U. 2015. Hepatotoxic Effect of
Aflatoxin-Contaminated Agro Feeds (Groundnut, Maize & Melon Seed) on Wistar Albino Rats. Agricultural and Biological Sciences Journal. 1(5): 190 – 196.
27. Andersen, K. J. 2013. The natural history of liver regeneration in rats: Description of an
animal model for liver regeneration studies. International Journal of Surgery. 11(2013): 903 –
908.
28. Mitchell, R. N. & Cotran, R.S. 2004. Jejas, Adaptasi, dan Kematian Sel dalam Buku Ajar Patologi Robbins, Edisi 7, Volume 1. Jakarta: Penerbit Buku Kedokteran EGC.
29. Suzery, M., Cahyono, B., &Taufiqurrahman. 2005. Produksi Senyawa Afrodisiak dari
Purwoceng (Pimpinella alpina Molk.): Pengembangan Potensi “Natural Resources” Khas
Jawa Tengah. Laporan Kegiatan Hibah Bersaing. Universitas Diponegoro. Semarang.
30. Badan Pengawas Obat dan Makanan (BPOM). 2014. Peraturan Kepala Badan Pengawas Obat
dan Makanan Republik Indonesia Nomor 7 Tahun 2014 tentang Pedoman Uji Toksisitas Nonklinik Secara In Vivo.
31. Davies, N.M. &Yanez, J.A. 2013. Flavonoid Pharmacokinetics: Methods of Analysis,
Preclinical and Clinical Pharmacokinetics, Safety, and Toxicology. New Jersey: John Wiley & Sons Inc.
32. Sudha, Munuswamy, Gnanamani, A., Deepa, G., Sudha, M., Madhavacharyulu, E., Deivanai,
K., & Sadulla, S. 2008. In Vivo Studies on Evaluation of Potential Toxicity of Unspent
Tannins Using Albino Rats (Rattus norvegicus). Food and Chemical Toxicology. 46(6):
432
33. Hsu Y.W., Tsai, C.F., Chen, W.K., Huang, C.F., &YenC.C. 2011. A Subacute Toxicity
Evaluationof Green Tea (Camellia sinensis) Extract inMice. Food and Chemical Toxicology.
49: 2624-2630.
34. Zhang, J., Brown, R.P., Shaw, M., Vaidya, V.S., & Zhou, Y. 2008. Immunolocalization of Kim-1, RPA-1 and RPA-2 in Kidney of Gentamicin-Mercury, or Chromium-treated Rats:
Relationship to Renal Distributions of iNOS and Nitrotyrosine. Journal of ToxicolPathol,
36(3): 397-409.
35. Bayrak, O., Bavbek, N., Karatas, O. F., Bayrak, R., Catal, F., &Cimentepe, E., et al. 2008.
Nigella sativa Protects Against Ischaemia/Reperfusion Injury in Rat Kidneys. Nephrol Dial
Transplant. 23: 2206-2212.
36. Gomes, I.B.S., Porto, M.L., Santos, M.C.L.F.S., Campagnaro, B.P., Pereira, T.M.C.,
Meyrelles, S.S., & Vasquez, E.C. 2014. Renoprotective, Anti-oxidative and Anti-apoptotic
Effects of Oral Low-Dose Quercetin in the C57BL/6J Model of Diabetic Nephropathy. Lipids
in Health and Disease. 13: 184-193.
37. Yousef, M.M., Alhusseini, N.F., Mohamed, H.A., Eldesoky, R., & Zaki, M.M. 2014. Role of
Ginger Extract and N-acetylcysteine in Acute Tubular Necrosis: Histological,
Immunohistochemical, and Gene Expression Study in Rats. Journal of Cell Biology and
Genetics. 4(3): 27-39.
38. Yokozawa, T., Akiko, S., Eun, J.C., Yoshiki, K., danYasumasa, I. 2005. Protective role of CoptidisRhizoma Alkaloids AgaintsPeroxynitrite-induced Damage to Renal Tubular Epithelial
Cells. Journal of Pharmacy and Pharmacology. 57 (3): 367-374.
39. Nasri, H., Nematbakhsh, M., Ghobadi, S., Ansari, R., Shahinfard, N., &Rafieian-kopaei, M. 2013. Preventive and Curative Effects of Ginger Extract AgainstHistopathologic Changes
Gentamicin-Induced Tubular Toxicity in Rats. International Journal of Preventive Medicine.
4(3): 316-321.
40. Vandenberge, V. 2012. Transfer of Cross-Contamination Levels of Coccidiostats, Antibiotics
and Anthelmintics from Feed to Poultry Matrices. Dissertation. Ghent University
41. Eroschenko, V.P.2010. Atlas Histologi di FioreEdisi 11. Jakarta: EGC.
42. Rostiana, O., Haryudin, W., Aisyah, S., & Dadi. 2011. “Observasi Morfologi, Produksi, dan
Mutu Purwoceng.” Laporan Teknis Penelitian Tahun Anggaran 2011 Balai Penelitian Tanaman Rempah dan Obat.
43. Trisilawati, O., &Pitono. 2012. “PengaruhCekamanDefisit Air
TerhadapPembentukanBahanAktifpadaPurwoceng.” Bul. Littro 23(1): 34-47.
44. Dewi, R. M.; Samanhudi; danRahayu, M. 2013.
“ResponPertumbuhandanHasilTanamanPurwoceng (PimpinellapruatjanMolk.)
diBoyolaliTerhadapPemberianPupukOrganikdanCendawanMikorizaArbuskula.” Journal of Agronomy Research 2(4): 52-59.
45. Amiria, F.D. 2008. “Uji Toksisitas Akut Bahan Herbal „X‟ Ditinjau dari Nilai LD 50 Serta
Fungsi Hati dan Ginjal pada Mencit Putih.” Skripsi. Depok: FMIPA Universitas Indonesia.
46. Adriani, L.,Rochana, A.,Yulianti, A.,Mushawwir, A.,&Indrayani, N. 2014. “Profil Serum
Glutamate Oxaloacetat Transaminase (SGOT) and Glutamate Pyruvate Transaminase (SGPT) Level of Broiler that was Given Noni Juice (Morindacitrifolia) and Palm Sugar
(Arengapiata).” LucrariStiintifice-SeriaZootehnie. 62 (1): 101-105.
47. Ganapaty, S., Ramaiah, M., Yasaswini, K., Nuthakki, V. K., & Harikrishnareddy, D. 2013. “
Quantitative Phytochemical Estimation and Evaluation of Hepatoprotective Activity of Methanolic Extract of Dendrobium ovatum (L.) Kraenzl. Whole Plant Against CCl4 Induced
Hepatotoxicity.” Journal of Pharma cognosy and Phytochemistry.2(3):113-118.
48. Praptiwi, Wulansari, D.,&Chairul. 2010. “ Efek Toksisitas Ekstrak Pegagan (Cantella asiatica
Linn.) pada Organ dan Jaringan Mencit (Mus musculus).” Majalah Farmasi Indonesia.21(1):
40-47.
433
Solanum nigrum in Paracetamol Induced Hepatotoxicity in Rats.” Phamacologyonline. 1(5): 757-768
50. Kinjo, J.; Okawa, M.; Udayama, M.; Sohno, Y.; Hirakawa, T.; Shii, Y.; dan Nohara, T. 1999.
“Hepatoprotective and Hepatotoxic Actions of Oleanic Acid-Type Triterpenoidal Glucoronids
on Rat Primary Hepatocyte Cultures.” Chemistry Pharmacy Bull. 42(2): 290-292.
51. Mahanani, A. I. 2015. “Uji Toksisitas Akut Infusa Biji Alpukat (Persea aamericana Mill.)
Terhadap Kadar Serum Glutamic Pyruvic Transaminase dan Serum Glutamic Oxaloacetic
Transaminase Darah pada Tikus Sprague Dawley.” Skripsi. Yogyakarta: Fakultas Farmasi
Universitas Sanata Dharma.
52. Giannini, E.D., Testa, R., &Savarino, V. 2005. Liver Enzyme alteratsion: a guide for
clinicians. CMAJ. 172 (3): 367-79.
53. Abd-Elhady, H. K.; &Abou-Elghar, G. E. 2013. “Abamectin Induced Biochemical and
Histopatological Changes in the Albino Rat, Rattusnorvegicus.Journal of Plant Protection
Research. 53(3):263-270.
54. Ma‟mun, S. S., F. Manoi, B. S., Sembiring, T., Sukmasari, A. G., Tjitjah, F., & Kustiwa, D.
2006. Teknik Pembuatan Simplisia dan Ekstrak Purwoceng. Laporan Pelaksanaan Penelitian
Tanaman Obat dan Aromatik : 314 – 324.
55. Yadav, Y.C., &Srivastava, D.N. 2013. Nephroprotective and Curative Effects
OfFicusReligiosa Latex Extract Against Cisplatin-Induced Acute Renal Failure. Pharmacy
Biology;51(11):1480-5
56. Karami, M., Nokabadi, F.K., Ebrahimzadeh, M.A., & Naghshvar, F. 2014. Nephroprotective
Effects of Feijoa sellowiana Leaves Extract on Renal Injury Induced by Acute Dose of
Ecstasy (MDMA) in Mice. Iranian Journal of Basic Medical Sciences 17(1):69-72
57. Sonkar, N., Ganeshpurkar, A., Yadav, P., Dubey, S., Bansal, D., &Dubey,N.. 2014. An
Experimetal Evaluation Of Nephroprotective Potential Of Buteamonosperma Extract In
Albino Rats. Indian Journal of Pharmacology 46(1): 109-112
58. Achyut, D., & Mulukuri, S. 2014. Flavonoids in Kidney Protection. World Journal of
Pharmacy and Pharmaceutical Sciences;4(3): 362-382
59. Priyanto. 2009. Toksikologi, Mekanisme, Terapi, AntidotumdanPenilaianRisiko. Jakarta :