LAMPIRAN 1
DATA HASIL PENELITIAN
L1.1 DATA PENENTUAN BIOSORBEN YANG DIGUNAKAN UNTUK PENYERAPAN ZAT WARNA
Berikut merupakan data yang diperoleh untuk penentuan biosorben yang digunakan sebagai penyerapan beberapa zat warna seperti pada Tabel L1.1 dibawah ini:
Tabel L1. 1 Bilangan Iodin Adsorben dan Luas Permukaan Biji Pepaya
L1. 2 DATA KALIBRASI KONSENTRASI ZAT WARNA
Tabel L1. 2 Hasil Kalibrasi Zat Warna Methyl Red, Methyl Orange Dan Methyl Violet
L1. 3 DATA ANALISA PENYERAPAN ZAT WARNA
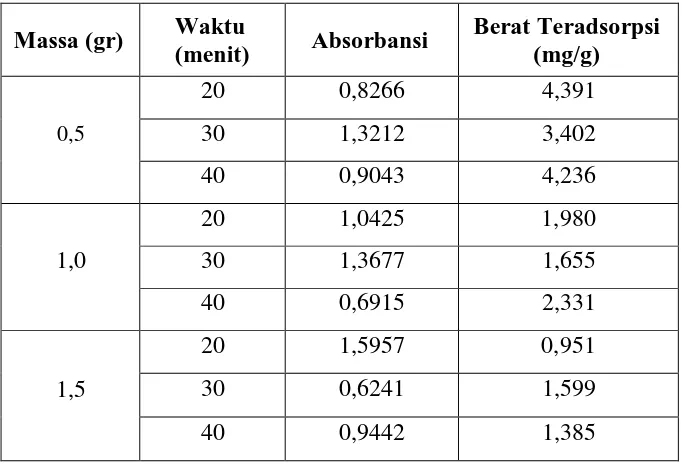
L1.3.1 Data Analisa Penyerapan Zat Warna Methyl Orange
Tabel L1. 3 Hasil Penyerapan Zat Warna Methyl Orange
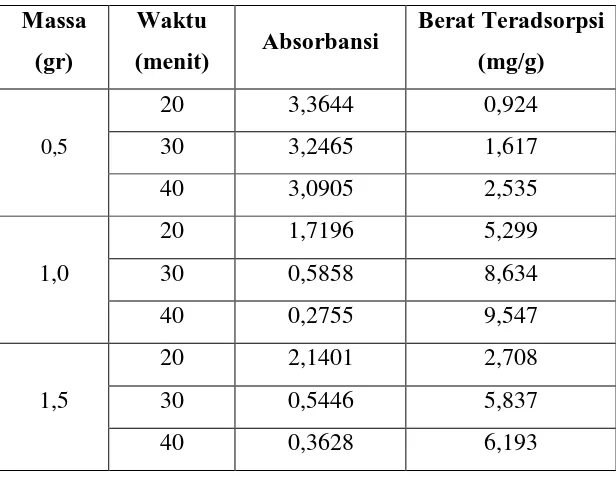
L1.3.2 Data Analisa Penyerapan Zat Warna Methyl Violet
Tabel L1. 4 Hasil Penyerapan Zat Warna Methyl Violet
Massa
L1.3.3 Data Analisa Penyerapan Zat Warna Methyl Red
Tabel L1. 5 Hasil Penyerapan Zat Warna Methyl Red
LAMPIRAN 2
CONTOH HASIL PERHITUNGAN
L2.1 PERHITUNGAN PEMBUATAN LARUTAN STANDAR ZAT WARNA
L2.1.1 Pembuatan Larutan Induk Methyl Orange, Methyl Violet dan Methyl
Dengan perhitungan yang sama digunakan untuk zat warna lain.
L2.1.2 Pembuatan Larutan Standar Methyl Orange, Methyl Violet dan Methyl Red
Larutan standar dibuat dari larutan induk methyl orange 100 ppm sebanyak 20 mL dengan konsentrasi 10, 20, 30, 40, 50, 60, 70, 80, dan 90 ppm.
V1M1 = V2M2
Keterangan: M1 = konsentrasi larutan yang diencerkan (ppm)
V1 = volume larutan yang diencerkan (ml)
M2 = konsentrasi larutan pengenceran (ppm)
V1 = volume larutan pengenceran (ml) a. Larutan standar konsetrasi 10 ppm
100 ppm x V1 = 10 ppm x 20 ml V1 = 2 ml
b. Larutan standar konsentrasi 20 ppm 100 ppm x V1 = 20 ppm x 20 ml
V1 = 4 ml
c. Larutan standar konsentrasi 30 ppm 100 ppm x V1 = 30 ppm x 20 ml
d. Larutan standar konsentrasi 40 ppm 100 ppm x V1 = 40 ppm x 20 ml V1 = 8 ml
e. Larutan standar konsentrasi 50 ppm 100 ppm x V1 = 50 ppm x 20 ml
V1 = 10 ml
f. Larutan standar konsentrasi 60 ppm 100 ppm x V1 = 60 ppm x 20 ml
V1 = 12 ml
g. Larutan standar konsentrasi 70 ppm 100 ppm x V1 = 70 ppm x 20 ml
V1 = 14 ml
h. Larutan standar konsentrasi 80 ppm 100 ppm x V1 = 80 ppm x 20 ml
V1 = 16 ml
i. Larutan standar konsentrasi 90 ml 100 ppm x V1 = 90 ppm x 20 ml
V1 = 18 ml
Dengan perhitungan yang sama digunakan pada zat warna lain.
L2.2 PERHITUNGAN BILANGAN IODINE
Dengan menggunakan persamaan dibawah ini, dapat dihitung bilangan iodin biosorben biji pepaya:
Misalkan perhitungan dari data percobaan 5% dengan waktu pemanasan 30 menit.
DSI = 139,59
Dengan cara yang sama dihitung untuk bilangan iodin dari data lainnya.
L2.3 PERHITUNGAN LUAS PERMUKAAN BIOSORBEN
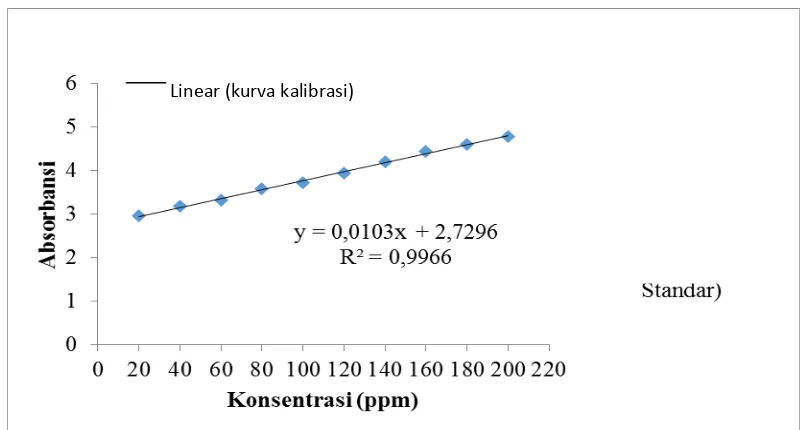
Perhitungan luas permukaan biosorben ditentukan berdasarkan kurva kalibrasi berikut:
Gambar L2.1 Kurva Kalibrasi
Misalkan perhitungan dari data percobaan konsentrasi 10% waktu pemansan 120 menit dengan absorbansi 2,92241. Konsentrasi sisa larutan diperoleh dengan menggunakan persamaa:
y = 0,0103x + 2,729 Dimana: y = absorbansi
x = konsentrasi sisa larutan 2,92241 = 0,0103x + 2,7296 x = 19,341 ppm
Perhitungan berat adsorbat teradsorpsi (Xm): Konsentrasi awal = 200 ppm
Xm = (konsentrasi awal – konsentrasi sisa)ppm x V(L) Massa biosorben (g)
= (200 ppm – 19,341 ppm) x 0,025 L 0,5 g
= 9,034 mg/g = 0,00903 g/g
Perhitungan luas permukaan biosorben (S):
Diketahui: Xm= 0,00903 g/g N = 6,022 x 1023 mol-1
a = 197x10-20 m2
Mr = 320,5 g/mol
Maka: S
=
S = 0,00903 mg/g. 6,022 x 1023 mol-1. 197x10-20 m2 320,5 g/mol
S = 33,43556 m2/g
L2.4 PERHITUNGAN ZAT WARNA TERADSORPSI
Perhitungan zat warna yang terserap ditentukan berdasarkan kurva kalibrasi larutan.
L2.4.1 Zat Warna Methyl Orange
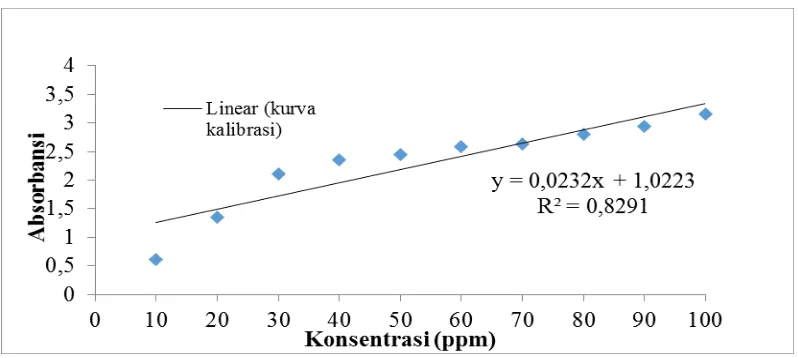
Perhitungan zat warna methyl orange yang teradsorpsi dapat ditentukan berdasarkan kurva kalibrasi dibawah ini:
Gambar L2.2 Kurva Kalibrasi Zat Warna Methyl Orange
Dengan menggunakan persamaan yang diperoleh dari grafik kurva standar, yaitu: y=0,0232x + 1,0223 perhitungan berat adsorbat teradsorpsi (Xm): konsentrasi awal = 100 ppm
Volume larutan = 20 mL = 0,020 L
Xm = (konsentrasi awal – konsentrasi sisa)ppm x V(L) Massa biosorben (g)
Xm = 4,391 mg/g
Berat teradsorpsi zat warna methyl orange pada massa 0,5 gram waktu adsorpsi 20 menit dengan nilai absorbansi 0,8266 adalah sebesar 4,391 mg/g. Dengan perhitungan yang sama dilakukan juga untuk data penelitian yang lainnya.
L2.4.2 Zat Warna Methyl Violet
Perhitungan zat warna methyl violet yang teradsorpsi dapat ditentukan berdasarkan kurva kalibrasi dibawah ini:
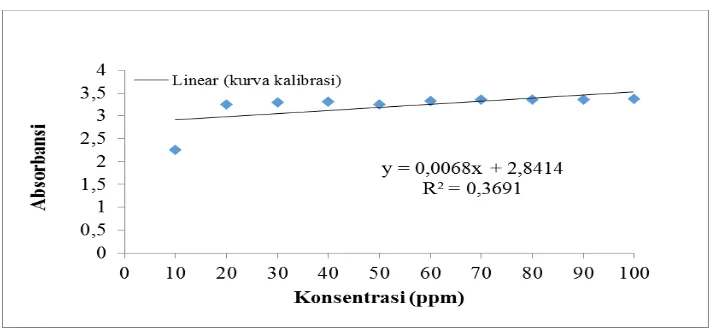
Gambar L2.3 Kurva Kalibrasi Zat warna Methyl Violet
Dengan menggunakan persamaan yang diperoleh dari grafik kurva standar, yaitu: y=0,0068x + 2,8414 perhitungan berat adsorbat teradsorpsi (Xm): konsentrasi awal = 100 ppm
Volume larutan = 20 mL = 0,020 L
Xm = (konsentrasi awal – konsentrasi sisa)ppm x V(L) Massa biosorben (g)
Xm = 0,924 mg/g
Berat teradsorpsi zat warna methyl violet pada massa 0,5 gram waktu adsorpsi 20 menit dengan nilai absorbansi 3,3644 adalah sebesar 0,924 mg/g. Dengan perhitungan yang sama dilakukan juga untuk data penelitian yang lainnya.
L2.4.3 Zat Warna Methyl Red
Perhitungan zat warna methyl red yang teradsorpsi dapat ditentukan berdasarkan kurva kalibrasi dibawah ini:
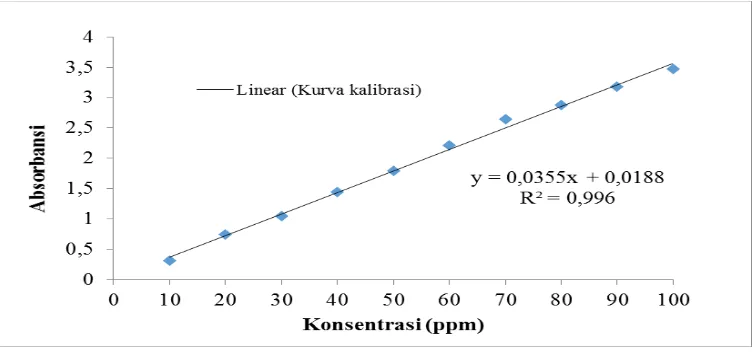
Gambar L2.4 Kurva Kalibrasi Zat warna Methyl Red
Dengan menggunakan persamaan yang diperoleh dari grafik kurva standar, yaitu: y = 0,0355x + 0,0188
Dimana : y = absorbansi
x = konsentrasi sisa larutan methyl orange (ppm)
Misalkan pada massa adsorben 0,5 gram dengan waktu adsorpsi 20 menit didapat nilai absorbansi 0,15741
y = 0,0355x + 0,0188 0,15741 = 0,0355x + 0,0188
x = 4,620 ppm perhitungan berat adsorbat teradsorpsi (Xm): konsentrasi awal = 100 ppm
Volume larutan = 20 mL = 0,020 L
Xm = (100 ppm – (4,620) ppm) x 0,020 L 0,5 g
Xm = 3,815 mg/g
LAMPIRAN 3
FOTO HASIL PENELITIAN
L3.1 FOTO BIOSORBEN YANG DIGUNAKAN UNTUK MENYERAP ZAT
WARNA
Gambar L3.1 Biosorben Biji Pepaya
L3.2 FOTO PEMBUATAN LARUTAN STANDAR ZAT WARNA
L3.3 FOTO PENYERAPAN ZAT WARNA
Gambar L3.3 Penimbangan Biosorben Biji Pepaya
Gambar L3.4 Pengukuran Volume Zat Warna (a) methyl Orange (b) Methyl Violet (c) Methyl Red
Gambar L3.5 Pencampuran Biosorben dan Zat Warna (a) Methyl Orange (b) Methyl Violet (c) Methyl Red
Gambar L3.6 Pengadukan Biosorben dan Zat Warna (a) Methyl Orange (b) Methyl Violet (c) Methyl Red
(a) (b) (c)
Gambar L3.7 Proses Penyaringan (a) Methyl Orange (b) Methyl Violet (c) Methyl Red
Gambar L3.8 Hasil Penyerapan Biosorben Biji Pepaya Terhadap Zat Warna