AANG FEBRIZAL
AUVA NAILA MUTHIK
AZKIA MAULIDA KHANIFAH
DEWI HESTIA SIREGAR
ELSA ALFIANI
MUFIID FATKHURRAHMAN
MUHAMAD FIRMAN RAMDANI
PIERRE MOSES FERNANDO
PRISILIA EKA KUSUMAWATI
RISKA AYU MARETA
ROSALINA
SARA SHELA
PROGRAM KEAHLIAN ANALISIS KIMIA PROGRAM DIPLOMA
INSTITUT PERTANIAN BOGOR BOGOR
DAFTAR ISI
DAFTAR GAMBAR ii
DAFTAR LAMPIRAN iii
1 PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Tujuan 3
2 TINJAUAN PUSTAKA 3
2.1 Air dan Abu pada talas 3
2.2 Kadar Lemak Kasar 3
2.3 Kadar Protein 4
2.4 Kadar Karbohidrat 4
2.5 Penentuan serat kasar 5
3 BAHAN DAN METODE 3
3.1 Alat dan Bahan 3
3.1.1 Kadar Air 3
3.1.2 Kadar Abu 3
3.1.3 Kadar Lemak Kasar 3
3.1.4 Kadar Protein 3 3.1.5 Kadar Karbohidrat 3 3.1.6 Kadar Serat 3 3.2 Metode Percobaan 4 3.2.1 Kadar Air 4 3.2.2 Kadar Abu 4
3.2.3 Kadar Lemak Kasar 4
3.2.4 Kadar Protein 4
3.2.5 Kadar Karbohidrat 5
3.2.6 Kadar Serat 5
4 HASIL DAN PEMBAHASAN 3
5 SIMPULAN 3
6 DAFTAR PUSTAKA 3
DAFTAR GAMBAR
1 Struktur umum lemak 2
2 Reaksi destruksi protein 6
3 Reaksi asam borat dengan protein pada proses destilasi 8
4 Reaksi pada proses destilasi 8
5 Reaksi reduksi iodin 9
6 Reaksi oksidasi iodin 10
7 Reaksi metode Luff-Schoorl 10
8 Struktur Amilosa 11
9 Kurva standar Amilum 12
DAFTAR LAMPIRAN
1 Kadar air pada talas komersil dan homemade 3 2 Hasil kadar abu pada sampel talas komersial dan homemade 3
3 Uji penentuan %N dengan metode Kjeldahl 3
4 Hasil penentuan kadar lemak pada 4
5 Standardisasi Natrium Tiosulfat 4
6 Kadar gula pereduksi dengan metode Luff-Schrool 5
7 Metode pengikatan iodin 5
1 PENDAHULUAN
1.1 Latar BelakangTalas adalah makanan pokok yang banyak berada di daerah tropis dan subtropis di dunia. Polyphenoloxidase (PPO) merupakan reaksi enzimatis untuk mengkatalisis senyawa fenolik khususnya quinon (Duangmal et al 1998). Umbi talas merupakan bahan pangan yang memiliki nilai gizi yang cukup baik. Komponen makronutrien dan mikronutrien yang terkandung di dalam umbi talas meliputi protein, karbohidrat, lemak, serat kasar, fosfor, kalsium, besi, tiamin, riboflavin, niasin, dan vitamin C.
Salah satu penentuan kualitas bahan pangan dan kaitannya dengan kebutuhan obyektif teknologi pengolahan maupun nilai gizi dapat dilakukan melalui analisis
kadar makronutrien dan mikronutrien. Analisis makronutrien dapat dilakukan dengan analisis proksimat yaitu merupakan analisis kasar yang meliputi kadar abu total, air total, lemak total, protein total dan karbohidrat total. Analisis proksimat dilakukan untuk mengetahui komponen utama dari suatu bahan. Komponen utama umumnya terdiri dari kadar air, kadar abu, karbohidrat, protein serta lemak. Analisis ini menjadi perlu untuk dilakukan karena menyediakan data kandungan utama dari suatu bahan makanan. Faktor lain adalah karena analisis proksimat dalam makanan berkenaan dengan kadar gizi dari bahan makanan tersebut. Kadar gizi perlu diketahui karena berhubungan dengan kualitas makanan tersebut. Selain itu, analisis proksimat umumnya tidak mahal dan relatif mudah untuk dilakukan. (Fai et al 2013)
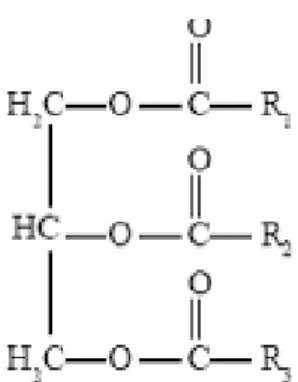
. Kadar air menjadi salah satu karakteristik yang sangat penting dalam bahan pangan, karena air dapat mempengaruhi kenampakan tekstur dan cita rasa pada bahan pangan. Kadar Abu merupakan analisa kadar pada abu bertujuan untuk memisahkan bahan organik dan bahan anorganik suatu bahan pangan. Kandungan abu suatu bahan pangan menggambarkan kandungan mineral pada bahan tersebut. Metode yang digunakan dalam penentuan kadar air dan abu ialah metode gravimetri. Prisnipmya ialah penentuan jumlah zat didasarkan adanya penimbangan. Penimbangan hasil reaksi setelah bahan yang dianalisa direaksikan. Hasil reaksi ini didapatkan yaitu sisa bahan atau suatu gas yang terjadi atau suatu endapan yang dibentuk dari bahan yang dianalisa (Harjadi 2003, hlm. 74 – 76). Minyak/lemak merupakan lipid yang banyak terdapat di alam. Minyak merupakan senyawa turunan ester dari gliserol dan asam lemak. Berbagai makanan terkandung komponen lemak di dalamnya yang memegang peranan penting dalam menentukan karakteristik fisik keseluruhan, seperti aroma, tekstur, rasa dan penampilan. Struktur umum lemak ialah :
Gambar 1 Struktur umum lemak (Poedjiadi 1994)
Gugus R1, R2, R3 ialah gugus alkil mungkin saja sama atau juga beda. Gugus alkil tersebut dibedakan sebagai gugus alkil jenuh (tidak terdapat ikatan rangkap) dan tidak jenuh (terdapat ikan rangkap). Lemak adalah makanan sumber energi yang paling efisien. Setiap gram lemak menyediakan 9 kalori energi,
sedangkan karbohidrat dan protein memberi empat kalori. Penentuan kadar lemak dengan menggunakan metode Soxhletasi, yang mengamati residu dari sampel tepung talas. Penentuan kadar protein dalam tepung talas secara kualitatif ditentukan dengan menggunakan metode Kjeldahl. Prinsip metode Kjeldahl ialah sampel didekstruksi dengan asam sulfat pekat menggunakan katalis selenium oksiklorida atau butiran Zn. Ammonia yang terbentuk kemudian ditampung dengan bantuan indikator. Metode Kjeldahl dapat dibedakan menjadi dua cara yaitu cara makro dan semimikro. Cara makro Kjeldahl digunakan untuk sampel yang sukar dihomogenkan dengan besar 1-3 gram sedangkan semimikro ditujukan untuk sampel yang berukuran kecil, yaitu kurang dari 300 mg dari bahan yang dihomogenkan (Elisabeth 2015).
Sampel didestruksi dengan memanaskan sampel dalam asam sulfat pekat, yang kemudian sampel akan menjadi unsur-unsurnya. Karbon (C) dan hidrogen (H) teroksidasi menjadi CO, CO2 dan H2O. Sedangkan unsur Nitrogennya akan
menjadi (NH4)2SO4. Katalis selenium digunakan untuk mempercepat reaksi yang
berlangsung. Katalis Se akan mempertinggi titik didih asam sulfat sehingga reaksi berjalan lebih cepat. Destruksi dihentikan bila warna larutan menjadi jernih atau tidak berwarna lagi. Selanjutnya pada tahap destilasi ammonium sulfat yang terbentuk dipecah menjadi ammonia dengan penambahan NaOH. Senyawa Ammonia yang dibebaskan ditangkap oleh larutan standar asam borat berlebih. Untuk mengetahui asam borat dalam keadaan berlebih, ditambahkan indikator BCG + MR atau PP. kemudian larutan dititrasi menggunakan HCl. Kadar protein ditentukan dengan perhitungan kadar nitrogen terlebih dahulu (Kumoroa 2014).
Penentuan karbohidrat dilakukan dengan menggunakan metode Luff -Schrool dan metode pengikatan iodium pada tepung talas. Luff-Schrool merupakan salah satu metode yang dapat digunakan dalam penentuan kadar karbohidrat secara kimiawi. Sampel yang digunakan ialah tepung talas yang dibuat sendiri (home made) dan komersil. Prinsipnya berdasarkan proses reduksi dari larutan Luff-Schoorl oleh gula pereduksi (semua monosakarida, laktosa dan maltosa). Hidrolisis karbohidrat menjadi monosakarida yang dapat mereduksikan Cu2+ menjadi Cu+ (Poedjiadi 2007).
Penentuan serat pada talas dilakukan dengan proses pengasaman, pembasaan dan disertai dengan pemanasan untuk menghilangkan senyawa polisakarida non-serat sehingga yang tersisa di akhir hanya serat saja. Serat kasar memberikan dampak positif bagi kesehatan untuk mengurangi resiko penyakit degeneratif diantaranya adalah menurunkan respon insulin dan indeks glikemik bahan pangan, menurunkan kadar kolesterol yang berlebihan dan menurunkan resiko penyakit kanker kolon (Asp et al., 1996; Granfeldt et al., 1992 di dalam Saifullah et al., 2009).
Percobaan bertujuan untuk menganalisis kadar proksimat (kadar air, kadar abu, lemak kasar, protein, karbohidrat, dan kadar serat makanan) dalam sampel tepung ubi talas komersil (buatan pabrik) dan homemade (buatan sendiri).
2 TINJAUAN PUSTAKA
2.1 Air dan Abu pada talasAir merupakan kandungan yang penting dalam bahan pangan. Semua bahan pangan memiliki kandungan air dalam jumlah yang berbeda-beda baik itu bahan pangan hewani maupun nabati. Kadar air menjadi salah satu karakteristik yang sangat penting dalam bahan pangan, karena air dapat mempengaruhi kenampakan tekstur dan cita rasa pada bahan pangan. Untuk menganalisis kadar air harus memilih metode analisis yang tepat dan benar dengan memperhatikan terlebih dahulu sifat dan keadaan bahan pangan yang akan dianalisa. Ada beberapa metode analisis yang digunakan untuk menganalisa kadar air suatu bahan pangan, yaitu metode oven (gravimetri), metode distilasi azeotropik, metode Karl Fischer, metode desikasi kimia, dan metode termogravimetri.
Abu merupakan suatu zat anorganik dari sisa hasil pembakaran bahan – bahan organik. Proses pengabuan suatu sampel bergantung pada sifat sampel tersebut. Menggunakan kadar abu maka akan menunjukkan kadar mineral juga yang terdapat dalam sampel yang diabukan. Terdapat dua garam mineral yaitu garam organic dan garam anorganik.
Menentukan jumlah mineral yang terkandung dalam bahan dapat dengan proses pengabuan. Pengabuan dapat menyebabkan hilangnya bahan-bahan organik dan anorganik pada sampel yang diabukan maka terjadi perubahan radikal organik dan akan terbentuk elemen logam dalam bentuk oksida atau senyawa ion-ion negatif. Proses pengolahan suatu bahan makanan dapat menggunakan metode analisis kadar abu yang dijadikan parameter nilai gizi bahan makanan. Analisis kadar abu juga berguna untuk mengontrol jumlah pencemaran yang terjadi pada sampel dari benda – benda organic seperti tanah, pasir, ataupun yang sering kali terikut dalam sediaan nabati (Azizah dan Salamah 2013, Hlm 28)
2.2 Kadar Lemak Kasar
Minyak/lemak merupakan lipid yang banyak terdapat di alam. Minyak merupakan senyawa turunan ester dari gliserol dan asam lemak. Fungsi lemak bagi tubuh antara lain adalah sebagai komponen dasar dari membran sel, sebagai sumber energi yang lebih efektif dibanding karbohidrat dan protein (9:4). Lipid (dari kata yunani Lipos/ Lemak) merupakan penyusun tumbuhan atau hewan yang dicirikan oleh sifat kelarutannya. Lipid tidak bisa larut dalam air, tetapi larut dalam larutan non polar seperti eter (Hart 2003). Lemak merupakan sekelompok besar molekul alam yang terdiri atas unsur karbon, hidrogen, dan oksigen meliputi asam lemak, malam, sterol, vitamin yang larut di dalam lemak (contohnya A, D, E, dan K), monogliserida, digliserida, fosfolipid, glikolipid, terpenoid (termasuk di dalamnya getah dan steroid) dan lain-lain. Lemak secara khusus menjadi sebutan bagi minyak hewani pada suhu ruang, terlepas dari wujudnya yang padat maupun cair, yang terdapat pada jaringan tubuh yang disebut adiposa (Poedjiadi 1994).
2.3 Kadar Protein
Protein dibuat dari satu atau lebih rantai polipeptida yang terdiri dari banyak asam amino yang dihubungkan oleh rantai peptida. Berat molekul protein bervariasi mulai dari 5000 hingga 1.000.000 atau lebih. Semua protein, tanpa memperhatikan fungsi atau jenis dari sumbernya dibuat dari dua puluh asam amino yang disusun dari rangkaian yang bervariasi (Lehninger 1976). Sumber protein dalam makanan dapat dibedakan atas dua sumber yaitu protein hewani dan protein nabati. Protein nabati dapat diperoleh dari kedelai, gandum, jagung, umbi-umbian dan buah-buahan lainnya, sedangkan protein hewani dapat diperoleh dari daging, telur, susu dan ikan. Protein berfungsi sebagai biokatalis dalam proses kimia di dalam tubuh. Komposisi rata-rata senyawa kimia dalam protein ialah karbon 50%, hidrogen 7%, oksigen 23%, nitrogen 16% belerang 0-3%, dan fosfor 0-3%. Unsur nitrogen dapat ditentukan dengan metode Kjeldahl, yaitu destruksi dengan asam kuat (Elisabeth 2015).
Salah satu protein nabati dapat diperoleh dari umbi-umbian seperti talas. Talas (Colocasia esculenta L.) merupakan umbi-umbian yang dapat mengeluarkan getah berwarna putih seperti susu. Bentuk umbi talas ini ialah lonjong sampai agak bulat dan berdiameter 10 cm. Kulitya berwarna kemerah-merahan dan dagingnya berwarna putih keruh. Umbi talas memiliki kadar air yang tinggi, sehingga umbi talas segar mudah mengalami kerusakan bila disimpan begitu saja. Usaha untuk memperpanjang umur simpannya, umbi talas diolah menjadi tepung talas. Tepung talas merupakan hasil olahan umbi talas yang berbentuk bubuk.
Pengolahan tepung talas memalui proses penyaringan dan pemanasan. Tepung memiliki kadar air yang rendah, sehingga berperan penting terhadap keawetan bahan pangan. Umbi talas dalam bentuk tepung memiliki komposisi nutrisi yang lebih baik dibandingkan beras. Tepung talas memiliki kadar protein yang lebih tinggi dan kadar lemak yang lebih rendah jika dibandingkan dengan beras. Kandungan serat talas juga cukup tinggi dan sangat baik untuk menjaga kesehatan pencernaan (Lanny Lingga 2010).
2.4 Kadar Karbohidrat
Karbohidrat terdiri dari unsur karbon (C), hidrogen (H), dan oksigen (O). Karbohidrat merupakan polihidroksi aldehida atau keton yang akan menghasilkan senyawa bila dihidrolisis. Karbohidrat mengandung gugus fungsi karbonil sebagai aldehida atau keton dan banyak gugus hidroksil. Secara umum terdapat tiga macam karbohidrat yaitu monosakarida, oligosakarida dan polisakarida. Golongan monosakarida merupakan golongan karbohidrat yang terdiri atas satu gugus gula, golongan disakarida merupakan golongan karbohidrat yang terdiri dari dua gugus satuan gula, dan golongan polisakarida merupakan golongan karbohidrat yang terdiri dari banyak satuan gula, contohnya amilum (pati/zat tepung) (Sastrohamidjojo H, 2005). Penentuan karbohidrat yang termasuk polisakarida maupun oligosakarida memerlukan pendahuluan yaitu hidrolisis lebih dahulu sehingga diperoleh monosakarida. Untuk keperluan ini, maka bahan dihidrolisis dengan asam atau enzim pada suatu keadaan tertentu. Salah satu metode yang dapat digunakan adalah Luff-Schoorl (Poedjiadi 2007).
2.5 Penentuan serat kasar
Serat merupakan senyawa karbohidrat yang tidak dapat dicerna, fungsi utamanya untuk mengatur kerja usus. Komponen utama dari serat adalah selulosa, terdapat sebagian besar pada dinding sel kayu . Salah satu contoh dari selulosa murni yaitu kapas . Serat dalam bahan, akhir-akhir ini mendapat perhatian khusus, karena serat antara lain dapat mencegah terjadinya kanker usus. Serat ataupun senyawa-senyawa yang termasuk dalam serat mempunyai sifat kimia yang tidak larut dalam air, asam atau basa meskipun dengan pemanasan atau hidrolisis (Kantasubrata dan Sumartini, 1989). Mutu bahan pangan sangat ditentukan oleh komposisi kimianya. Penentuan komposisi serat merupakan hal yang umum dilakukan disamping penetapan protein, lemak, karbohidrat atau mineral. Kandungan serat dalam contoh ditentukan dengan menghidrolisisnya dalam asam sulfat encer dan amonium hidroksida encer (AOAC, 1995 dan AOAC, 2000).
Mengingat sifat serat yang tidak larut dalam senyawa tersebut, maka komponen yang tersisa setelah tahapan ekstraksi yaitu serat. Contoh yang digunakan untuk penetapan serat biasanya mempunyai batasan kandungan lemak lebih kecil dari 1% (AOAC, 1995) atau contoh yang lemaknya sudah dibebaskan atau dihilangkan terlebih dahulu dengan cara ekstraksi dalam petrolium ether (AOAC, 2000)
3 BAHAN DAN METODE 3.1 Alat dan Bahan 3.1.1 Kadar Air
Alat-alat yang digunakan ialah neraca analitik, oven, desikator, cawan porselen, penjepit, gegep kayu dan sudip.
Bahan yang digunakan ialah talas komersil dan homemade, alumunium foil, dan aquades.
3.1.2 Kadar Abu
Alat –alat yang digunakan ialah cawan porselen, kaki tiga, pinggan porselen, bunsen, oven, desikator, gegep besi, sarung tangan asbes, kassa, dan tanur.
Bahan – bahan yang digunakan ialah sampel talas komersial dan home made.
3.1.3 Kadar Lemak Kasar
Alat –alat yang digunakan ialah bulb, pipa volumetrik, labu bulat, gelas ukur, soxhlet, oven pemanas, neraca analitik, dan desikator.
Bahan-bahan yang digunakan ialah sampel tepung talas komersil dan nonkomersil, serta petroleum eter.
3.1.4 Kadar Protein
Alat-alat yang digunakan ialah labu Kjeldahl 250 mL, labu didih 500 mL, gelas piala, pipet mohr, pipet tetes, sudip, batang pengaduk, corong, buret dan statif, erlenmeyer.
Bahan-bahan yang digunakan ialah tepung talas kering, aquadest, H2SO4,
HCl 0,1 N, NaOH 40%, batu didih, indikator bromkresol-metil merah (BCG-MM), indikator jingga metil, asam borat, kapas, benang, kertas ukuran kecil, vaselin, Na2CO3 anhidrat, dan logam selen (katalis selen).
3.1.5 Kadar Karbohidrat
Alat-alat yang digunakan ialah gelas piala, pipet mohr, bulb merah, bulb hitam, pipet tetes, corong, erlenmeyer, statip, kaca arloji, neraca analitik, alat refluks, alat sokhlet, gelas ukur, sudip, batang pengaduk, labu takar, buret, spektrofotometri UV-VIS dan tabung reaksi.
Bahan-bahan yang digunakan ialah sampel tepung talas HM (Home made) dan tepung talas komersil, air destilata, larutan tiosulfat, pati atau amilum, larutan NaOH, larutan pereaksi Luff-Schrool, larutan HCl, larutan asam sulfat, larutan KI, serbuk KIO3, larutan etanol, larutan asam asetat, dan larutan iodium.
3.1.6 Kadar Serat
Alat-alat yang digunakan ialah labu bulat, kondesor, hotplate, gelas piala 500 mL, 250 mL, 100mL, batang pengaduk, sudip, corong, kaca arloji, corong buchner, vakum, tabung buchner, oven, erlenmeyer.
Bahan-bahan yang digunakan ialah tepung talas komersil, tepung talas
Homemade, H2SO4 0,1 N, NaOH 0,1 N, alkohol 96%, batu didih, akuades, kertas
saring, pH universal, n-heksana
3.2 Metode Percobaan 3.2.1 Kadar Air
Talas homemade dan komersil yang sudah dihaluskan ditimbang masing-masing dua gram, setelah itu disimpan dalam alumunium foil dan dikeringkan dalam oven dengan suhu 130 oC selama 1 jam. Setelah 1 jam, talas didinginkan
dalam desikator selama 15 menit. Ditimbang bobot dari tepung talas ynag sudah dikeringkan. Sampel tepung talas yang sudah ditimbang dimasukkan kembali ke dalam oven dan desikator lalu ditimbang kembali bobotnya hingga bobot tetap. 3.2.2 Kadar Abu
Sampel tepung talas ditimbang sebanyak 5 gram dan dimasukkan ke dalam cawan porselen yang telah diketahui bobot kosongnya pada analisis kadar air. cawan berisi sampel lalu dipanaskan di atas pembakaran gas hingga sampel mengarang (tidak berasap lagi), cawan porselen diputar – putar untuk menjaga agar pemanasan yang dilakukan merata. Setelah itu, sampel diabukan dalam tanur pada suhu 600 C hingga terabukan sempurna sekitar 1 jam pengabuan (abu berwarna putih atau bobot konstan). Sesekali pintu tanur sediit dibuka agar oksigen dapat masuk. Setelah didinginkan dalam desikator selama kira – kira 30 menit (segera setalah mencapai suhu ruang), bobot cawan berisi abu ditimbang. Penimbangan dilakukan sampai bobot abu konstan.
3.2.3 Kadar Lemak Kasar
Labu lemak di oven dan ditimbang, lalu sampel sebanyak 2gr ditimbang dan dimasukkan ke dalam selongsong kertas saring, selongsong dimasukkan ke dalam alat soxhlet ± 2 jam dan labu bulat yang telah diketahui bobotnya di pasang pada alat soxhlet, 50 mL pelarut n-heksan dimasukkan ke dalam alat soxhlet, sampel di ekstrak dengan pelarut n-heksan, labu lemak dikeringkan dalam oven 1050C selama 30 menit, labu bulat dikeringkan dalam oven, setelah kering labu
3.2.4 Kadar Protein
Timbang dengan teliti 0,1 gram tepung talas kering yang telah ditetapkan kadar airnya pada percobaan 1 dan masukkan kedalam labu Kjeldahl 250 mL. Tambahkan kira-kira 1 gram logam selen dan 7,5 mL H2SO4 pekat. Lalu, panaskan
dalam ruang asam, mula-mula dengan nyala api kecil sambil di goyang-goyangkan. Sesudah 5-10 menit, api dibesarkan dan dipanaskan terus sampai cairan berwarna hijau jernih. Biarkan cairan dingin kemudian encerkan dengan 200-250 mL air suling.
Pindahkan larutan hasil pengenceran kedalam labu didih 500 mL yang berisi beberapa butir batu didih. Lalu, kemudian tambahkan 40 mL NaOH 40% dan segera sambungkan labu dengan radas distilasi. Kemudian, suling hingga 2/3 bagian dari cairan tersuling, dan tampung hasil sulingannya dalam Erlenmeyer 250 mL yang telah berisi 25 mL asam borat 2% dan 2-3 tetes indikator hijau bromkresol-metil merah (BCG-MM). Asam borat akan berubah warna dari merah marun menjadi hijau kebiru-biruan, segera setelah kontak dengan amonia yang terbentuk selama penyulingan. Lanjutkan distilasi beberapa menit sampai tetesan distilat tidak menimbulkan perubahan warna lagi.
Hentikan distilasi, bilas pipa pendingin dengan air suling 2-3 kali dan tampung air bilasannya dalam Erlenmeyer yang sama. Titrasilah distilat dan air bilasan dengan HCl 0,01 N sampai warna biru hilang (a mL). Lakukan pula prosedur yang sama untuk penetepan blanko (b mL). Berikut rumus untuk penentuan kadar nitrogen total dalam satuan persen dan penentuan kadar protein dalam satuan persen.
3.2.5 Kadar Karbohidrat
Sampel tepung talas di timbang sebanyak 1 gram yang ditambahkan dengan 100 ml HCL 30 %. Dipindahkan ke dalam labu refluks. Setelah 2 jam, labu didinginkan dan dinetralkan dengan NaOH 40% sampai ph 7. Lalu, diambil 10 ml dipindahkan ke dalam dan ditambahkan 15 ml akuades dan di tambahkan 25 ml larutan Luff Schrool dan dididihkan kembali selama 10 menit. Dan dibiarkan kembali hingga asam, 25 ml asam sulfat 25% dan 25 ml pereaksi Luff Schrool dan dititrasi dengan larutan tiosulfat. Sampel talas ditimbang sebanyak 0.01 gram yang ditambahkan 1 ml etanol dan 9 ml NaOH 1N dipanaskan sampai terbentuk gel. Gel yang terbentuk dimasukkan ke dalam labu takar 100 ml dan seka, tera lalu homogenkan dengan akuades. Pipet 5 ml ke labu takar 100 ml ke 2, ditambahkan 1 ml asam asetat 1N, 2 ml iodin 0.2% , seka, tera lalu homogenkan dengan air akuades. Labu takar didiamkan selama 30 menit dan diukur pada panjang gelombang 620 nm pada spektrofotometri UV-VIS dan catat absrobansi yang didapatkan.
3.2.6 Kadar Serat
Sebanyak 2 gram tepung talas ditimbang kemudian ditambahkan dengan n-heksana sebanyak 30 mL. Larutan diekstrak selama 2 jam kemudian sambil diaduk setiap 15 menit sekali selama 5 menit. Larutan disaring dengan menggunakan corong buchner. Residu dicuci dengan larutan H2SO4 0,1 N
sebanyak 200 mL kemudian larutan direfluks selama 30 menit. Larutan disaring kembali dengan menggunakan corong buchner, sebelumnya kertas saring dibasahi dengan menggunakan air panas, residu dinetralkan dengan penambahan akuades panas dan dicek dengan pH universal. Residu dipindahkan secara kuantitatif dari kertas saring dengan spatula ke dalam erlenmeyer, kertas saring dibilas dengan NaOH 0,1N mendidih sampai seluruh residu masuk ke dalam Erlenmeyer. Refluks dilakukan kembali selama 30 menit sambil sesekali digoyang. Larutan disaring dengan kertas saring whatman 41 yang sudah ditimbang bobot awalya (sebelum ditimbang kertas dimasukkan ke dalam oven pada suhu 105 0C selama 1 jam,
kemudian kertas dimasukkan ke dalam desikator dan ditimbang, bobot a).
Residu yang direfluks untuk kedua kalinya, disaring dan residu dibilas dengan akuades mendidih sampai air bilasan bebas basa, dan kemudian dengan kira-kira 15 mL alkohol 95%. Residu dalam kertas saring dikeringkan ke dalam oven pada suhu 110 0C sampai bobot konstan.
4 HASIL DAN PEMBAHASAN
Analisis proksimat yang dilakukan pada percobaan berupa analisis kadar air, kadar abu, lemak kasar, protein, karbohidrat, dan serat makanan. Sampel yang digunakan pada praktikum ini adalah sampel tepung ubi talas komersil (buatan pabrik) dan homemade (buatan sendiri). Hasil analisis proksimat disajikan dalam table berikut ini:
Tabel 1 Hasil Analisis Proksimat Tepung Talas
Jenis Uji Jenis Talas
Homemade Komersial
Kadar Air 14.65 % 11.81 %
Kadar Abu 0.97 % 0.96%
Kadar Lemak Kasar 0.1647 % 0.1146%
Kadar Protein 0.0034 % 0.0069 %
Kadar Karbohidrat Metode Luff-Schrool
a) % Gula Pereduksi 1.1016 % 0.7430 %
b) % Pati 0.9914 % 0.6687 %
Metode pengikatan iodin
% Gula Pereduksi 22.24 % 39.34 %
Kadar Serat 65.67 % 58.46 %
Penentuan kadar air dapat menggunakan teknik penguapan dengan menggunakan oven. Percobaan yang dilakukan dengan metode pengeringan oven
(AOAC 2005). Kadar air secara berat kering adalah perbandingan antara berat air di dalam bahan tersebut dengan berat keringnya. Bahan kering yaitu berat bahan asal dikurangi dengan berat airnya. Sedangkan kadar air secara berat basah adalah perbandingan antara berat air dalam bahan tersebut dengan berat bahan mentah. Menghilangkan air yang menempel dengan cara dimasukkan ke dalam desikator untuk menyerap air yang tersisa.
Cawan porselen kosong ditimbang bobot kosongnya, kemudian ditimbang kembali contoh dan cawan porselen, timbangan ini dijadikan bobot berat basah. Contoh di oven kembali selama satu jam pada suhu 130 oC sampai didapatkan
berat yang tetap dari masing masing tepung. Suhu 130 oC karena air akan
menguap pada suhu 100 oC sehingga suhu dinaikkan sedikit agar air dapat menguap seluruhnya. Oven yang digunakan dalam percobaan ini ialah oven konveksi, dimana udara panas bersikulasi dengan lambat tanpa bantuan kipas. Perbedaan suhu 10 oC lazim di dalam oven konveksi. Hal ini harus diperhatikan
sehubungan dengan ketepatan dan ketelitian analitis.
Berdasarkan hasil percobaan pada Tabel 1, kadar air rerata yang diperoleh pada contoh talas komersil ialah 11,81% dan contoh talas homemade ialah 14,65%. Kadar air tertinggi terdapat pada contoh homemade. Berdasarkan literatur, kadar air maksimal pada umbi talas ialah 63-85%. Kadar air yang diperoleh pada talas komersil dan homemade ialah <63-85%. Hal ini mengindikasikan bahwa kadar air pada talas tersebut rendah. Perbedaan kadar air pada tepung talas komersil dan homemade dapat disebabkan oleh beberapa faktor, diantaranya proses pembuatan yaitu proses pengeringan dan alat-alat yang digunakan untuk produksi tepung talas.
Pengeringan pada tepung komersil menggunakan alat yang lebih canggih dibandingkan dengan produksi tepung homemade yang masih menggunakan alat-alat konvensional. Perbedaan tersebut dapat dilihat pada hasil percobaan (tabel 1), bahwa kadar air pada tepung talas homemade lebih besar dibandingkan dengan tepung talas komersil. Kadar air yang tinggi pada tepung akan mempengaruhi kualitas tepung, jika melebihi standar (maksimal 63-85%) akan memungkinkan terjadinya penurunan daya simpan tepung karena akan cepat rusak, berjamur, mempermudah penetasan telur kutu dalam tepung, dan kurangnya daya tepung terigu menyerap air (Purnomo 1995).
. Faktor lain yang dapat mempengaruhi bobot berat basah dan berat kering suatu bahan adalah suhu, kadar air, kelembaban udara, kecepatan pengeringan, arah aliran udara, ukuran bahan, ketelitian dalam pengukuran, dan luas permukaan. Air dalam bahan pangan terdapat tiga keadaan air, yaitu air bebas, air teradsorpsi dan air hidrasi. Air bebas ialah air yang berperan sebagai bahan pendispersi untuk koloid, air teradsorpsi ialah air yang tertahan kuat dalam dinding sel dan air hidrasi ialah air yang terikat secara kimia. Kemudahan penyingkiran air dari bahan pangan bergantung pada bagaimana keberadaannya dalam produk bahan pangan tersebut.
Penentuan kadar abu pada sampel talas ini menggunakan prinsip pengabuan kering yang didasarkan pada pembakaran pada suhu di atas 525 C. pemijaran
yang dilakukan pada sampel bertujuan untuk proses membarakan sampel sebelum menjadi abu, setelah sampel semua membara kemudian proses pengabuan dilakukan dengan menggunakan alat tanur. Metode pengabuan ini memiliki kelebihan dan kekurangannya diantaranya yaitu kelebihannya dalah metode mudah digunakan serta aman, tidak memerlukan penambahan pereaksi maupun pengukuran blangko terlebih dahulu, dan proses pemijaran yang dilakukan tidak perlu terus diawasi karena tujuan akhir dari proses tersebut adalah menjadikan sampel menjadi abu dan kekurangannya yaitu lamanya waktu yang diperlukan untuk proses pengabuan serta alat – alat yang digunakan mahal. Syarat – syarat yang harus dipenuhi agar metode gravimetri berhasil yaitu, proses pemisahan ynag dilakukan harus sempurna sehingga hasil kuantitatif didapatkan pada analit yang tak terendapkan secara analitis tak dapat dideteksi dan zat yang ditimbang hendaknya mempunyai susunan yang pasti serta sampel yang digunakan haruslah murni agar tidak diperoleh hasil yang galat (Day dan Underwood 2002, hlm 68).
Berdasarkan hasil tabel 1 didapatkan hasil rerata % abu pada sampel talas komersial sebesar 0.97 % dan pada sampel talas home made sebesar 0.96 %. Hasil yang ditunjukkan tidak jauh berbeda, kemungkinan pada sampel home made
terdapat komposisi yang sama baiknya dengan sampel komersial. Namun, perbedaan hanya berkisar 0.01 %. Metode penentuan kadar abu ini menggunakan oven konveksi karena tahan terhadap suhu lama yang digunakan dalam waktu yang lama. Setelah itu penanuran dilakukan di dalam tanur. Kemudian dimasukkan ke dalam desikator yang menyebabkan sampel yang diabukan cepat kering, terjadinya prose’s penyerapan yang akibat adanya silica yang dapat mengikat uap udara pada sampel. Oleh karena itu penimbangan harus segera dilakukan dan harus selesai dengan cepat, dikhawatirkan uap air kembali diserap oleh sampel karena sampel berada di udara terbuka (Harjadi 1986, hlm 101 – 102).Ketidakpastian menunjukkan rentang nilai yang mungkin dalam pengukuran (Harvey 2000).
Lipid merupakan suatu komponen primer terpenting dalam bahan pangan, salah satunya yaitu terdapat pada talas. Fungsi lemak bagi tubuh antara lain adalah sebagai komponen dasar dari membran sel, sebagai sumber energi yang lebih efektif dibanding karbohidrat dan protein (9:4), menghemat penggunaan protein sebagai sumber energi, lemak khususnya minyak nabati mengandung asam-asam lemak esensial, (seperti linoleat, lenolenat dan arakidonat), berperan sebagai sumber seakligus pelarut/alat angkut bagi vitamin A, D, E dan K, sebagai cadangan energi, keberadaan simpanan lemak dapat sebagai pelindung organ penting, keberadaan lemak bawah kulit melindungi terhadap perubahan suhu luar mendadak & dari kehilangan panas yang tidak terduga. Lemak merupakan zat gizi yang sangat penting bagi tubuh kita. Lemak memiliki banyak fungsi yang sangat penting antara lain sebagai sumber energi, pelumas sendi, memberikan cita rasa pada makanan dan fungsi penting lainnya. Oleh karena itu keberadaan lemak dalam suatu bahan pangan perlu utuk dipertimbangkan kadarnya karena selain memiliki fungsi yang penting bagi tubuh dan fungsi fungsional lainnya, lemak
juga memiliki efek negatif jika berlebihan. Lemak dapat dianalisis dengan berbagai metode.
Beberapa metode analisis lemak diantaranya, yaitu metode Soxhlet, metode Goldgish, dan metode Babcock. Percobaan penetapan kadar lemak pada praktikum dilakukan dengan metode Soxhlet. Hal ini dilakukan karena metode Soxhlet lebih sesuai digunakan untuk menganalisa sampel dalam wujud padat seperti pada sampel yang digunakan, sedangkan metode Babcock lebih sesuai untuk analisis lemak berwujud cair (Sudarmadji 2003).
Metode Soxhlet merupakan metode kuantitatif untuk menentukan kadar lemak dalam bahan pangan. Metode ini dilakukan dengan cara melarutkan sampel dalam pelarut organik yang telah dipanaskan. Keuntungan dari metode soxhlet yaitu metode ini dapat digunakan untuk sampel yang lunak dan yang tidak tahan terhadap pemanasan secara langsung, menggunakan pelarut yang lebih sedikit, dan pemanasan dapat diatur sederhana dan mempunyai ketepatan yang baik (Harper et.al 1979).
Percobaan ini menggunakan sampel tepung talas komersial dan nonkomersial. Analisis proksimat untuk lemak kasar pada tepung talas dilakukan dengan menggunakan metode ekstraksi (soxhlet) dengan menggunakan pelarut organik. Langkah awal dari percobaan kali ini yaitu mengoven atau memanaskan labu lemak pada suhu 105ᵒC, tujuan dari pemanasan tersebut adalah untuk mensterilkan labu lemak. Setelah itu dibuat thimble atau selongsong yang berisi tepung talas yang didalamnya terdapat kapas dan sampel tepung talas, selongsong yang dibuat sebelumnya diukur dengan diameter soxhlet agar dapat masuk ke dalam extraction chamber dan tinggi thimble diukur tidak boleh melebihi siphon arm nya, labu destilasi ditimbang sebagai bobot kosong. Kemudian thimble yang telah dimasukkan ke dalam badan soxhlet diberi pemberat fungsinya agar pada saat proses ekstraksi thimble terendam didalam pelarut dan tidak ikut mengapung karena adanya pelarut. Setelah thimble masuk ke dalam radas soxhlet, radas disambungkan dengan labu destilasi dan pelarut dimasukkan melalui badan soxhlet yang berisi thimble sampai membasahi permukaan thimble. Pelarut yang digunakan adalah n-hexana yang merupakan bagian dari pelarut anhydrous. Pelarut anhydrous adalah pelarut yang benar-benar bebas air. Hal ini bertujuan supaya bahan- bahan yang larut air tidak terekstrak dan terhitung sebagai lemak serta keaktifan pelarut tersebut tidak berkurang (Winarno 1997). Kemudian pelarut dimasukkan kembali dan radas dipasang dengan kondensor, didalam labu destilasi ditambahkan batu didih fungsinya untuk mempercepat laju reaksi sehingga reaksi berjalan sempurna.
Ekstraksi dilakukan selama 3 jam, setelah didapatkan destilatnya yang berisi pelarut dan ekstrak lemak kemudian diuapkan untuk mendapatkan ekstrak lemak yang pekat, setelah didapatkan ekstrak lemak pekat labu destilasi dikeringkan ke dalam oven yang berfungsi untuk menghilangkan sisa-sisa uap dan air yang masih tertinggal didalam labu destilasi sehingga yang bersisa didalam labu destilasi hanya ekstrak lemak yang kemudian ditimbang sebagai bobot labu dengan ekstrak
lemak. Berikut adalah hasil dari penentuan kadar lemak pada sampel tepung talas komersil dan nonkomersil :
Berdasarkan hasil percobaan didapatkan hasil kadar lemak pada tepung talas komersil menghasilkan kadar sebesar 0.146% dan pada tepung talas nonkomersil menghasilkan kadar lemak sebesar 0.1647%. Jika dibandingkan dengan Nutritinon Fact kadar lemak yang dihasilkan sebesar 2.01%. Hasil dari percobaan menunjukkan perbedaan pada kadar lemak yang didapat. Perbedaan hasil yang ditunjukkan tersebut dapat dipengaruhi oleh berbagai faktor yang terdapat selama praktikum berlangsung terutama pada saat metode ekstraksi dilakukan.
Faktor-faktor yang mempengaruhi laju ekstraksi adalah tipe persiapan sampel, waktu ekstraksi, kuantitas pelarut, suhu pelarut, dan tipe pelarut (Muaris 2007). Oleh karena itu perbedaan hasil praktikum dengan Nutrition Fact disebabkan karena beberapa kesalahan. Kesalahan tersebut berupa jumlah sampel yang tidak tepat, waktu penekstraksian yang tidak tepat dan waktu pendinginan yang tidak tepat, serta kemungkinan ada beberapa zat lain yang terekstraksi sebagai lemak sehingga kadar lemak yang diperoleh jauh lebih besar dibandingkan dengan Nutrition Facts.
Penentuan kadar protein dalam tepung talas dilakukan dengan metode Kjeldahl. Metode Kjeldahl merupakan metode yang sering digunakan untuk menentukan kadar nitrogen total, tidak hanya bahan pangan namun bahan non pangan pun dapat menggunakan metode ini. Prinsip dari penentuan kadar protein dengan metode kjedahl adalah penentuan jumlah Nitrogen (N) yang dikandung oleh suatu bahan dengan cara mendegradasi protein bahan organik dengan menggunakan asam sulfat pekat untuk menghasilkan nitrogen sebagai amonia, kemudian menghitung jumlah nitrogen yang terlepas sebagai amonia lalu mengkonversikan ke dalam kadar protein dengan mengalikannya dengan konstanta tertentu.
Sampel di destruksi dengan memanaskan sampel dalam asam sulfat pekat sehingga terjadi penguraian sampel menjadi unsur-unsurnya yaitu unsur-unsur C, H, O, N, S, dan P. Unsur N dalam protein ini dipakai untuk menentukan kandungan protein dalam suatu bahan. Hasil destruksi adalah ion NH4+ yang
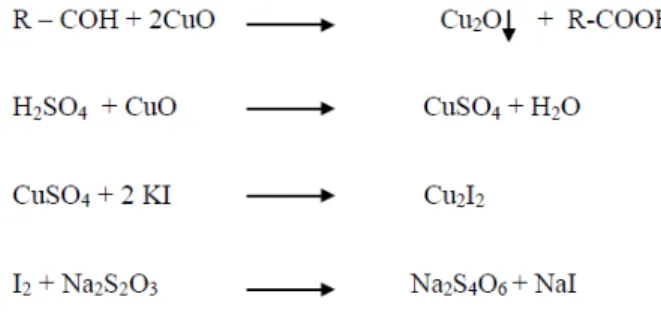
menunjukkan keberadaan protein. Ion ammonium bereaksi dengan ion sulfat dari asam sulfat membentuk ammonium sulfat. Reaksi di katalisis dengan adanya garam Kjeldahl. Selama proses destruksi, terjadi reaksi berikut:
Cu2SO4 + 2H2SO4 2CuSO4 + 2 H2O + SO2
(CHON) + On + H2SO4 CO2 + H2O + (NH4)2SO4
Gambar 2 Reaksi destruksi protein
Proses destruksi di tandai dengan perubahan warna larutan menjadi warna biru dan bening. Setelah itu larutan di dalam labu Kjeldahl didinginkan terlebih dahulu dan kemudian diencerkan dengan penambahan aquades. Pada dasarnya tujuan destilasi adalah memisahkan zat yang diinginkan, yaitu dengan memecah amonium sulfat menjadi amonia (NH3) dengan menambah beberapa mL NaOH
hingga tepat basa, kemudian larutan sampel ini dipanaskan. Prinsip destilasi adalah memisahkan cairan atau larutan berdasarkan perbedaan titik didih. Fungsi penambahan NaOH adalah untuk memberikan suasana basa karena reaksi tidak dapat berlangsung dalam keadaan asam.
Tahap destilasi, ammonium sulfat dipecah menjadi ammonia (NH3) dengan
penambahan NaOH sampai alkalis dan dipanaskan oleh pemanas dalam alat destilasi melalui steam. Selain itu sifat NaOH yang apabila ditambah dengan aquadest menghasilkan panas, meski energinya tidak terlalu besar jika dibandingkan pemanasan dari alat destilasi, ikut memberikan masukan energi pada proses destilasi. Panas tinggi yang dihasilkan alat destilasi juga berasal dari reaksi antara NaOH dengan (NH4)2SO4 yang merupakan reaksi yang sangat
eksoterm sehingga energinya sangat tinggi. Ammonia yang dibebaskan selanjutnya akan ditangkap oleh larutan asam standar. Asam standar yang dipakai dalam percobaan ini adalah asam borat.
Erlenmeyer yang berisi asam borat 2 % + BCG-MR (campuran brom cresol green dan methyl red) ditempatkan di bagian kanan bawah alat destilasi. Erlenmeyer ini digunakan untuk menangkap amoniak hasil reaksi NaOH dengan (NH4)2SO4. BCG-MR merupakan indikator yang bersifat amfoter, yaitu bisa
bereaksi dengan asam maupun basa. Indikator ini digunakan untuk mengetahui asam dalam keadaan berlebih. Selain itu alasan pemilihan indikator ini adalah karena memiliki trayek pH 6-8 (melalui suasana asam dan basa / dapat bekerja pada suasana asam dan basa), yang berarti memiliki rentang trayek kerjanya yang luas (meliputi asam-netral-basa). Pada suasana asam, indikator akan berwarna merah muda, sedang pada suasana basa akan berwarna hijau-biru. Setelah ditambah BCG-MR, larutan akan berwarna merah muda karena berada dalam kondisi asam.
Garam Kjeldahl berfungsi untuk mempercepat proses destruksi dengan menaikkan titik didih asam sulfat saat dilakukan penambahan H2SO4 pekat, serta
mempercepat kenaikan suhu asam sulfat, sehingga destruksi berjalan lebih cepat dan lebih sempurna. Garam Kjeldahl tersebut terdiri dari campuran Na2SO4
anhidrad dan SeSO4. Ion logam Se akan menaikkan titik didih H2SO4 sedangkan
Na2SO4 anhidrat akan menarik air yang terdapat pada sampel. Karena titik didih
menjadi lebih tinggi, maka asam sulfat akan membutuhkan waktu yang lama untuk menguap. Karena hal ini, kontak asam sulfat dengan sampel akan lebih lama sehingga proses destruksi akan berjalan lebih efektif. Asam sulfat yang bersifat oksidator kuat akan mendestruksi sampel menjadi unsur-unsurnya.
Asam borat (H3BO3) berfungsi sebagai penangkap NH3 sebagai destilat
berupa gas yang bersifat basa. Supaya ammonia dapat ditangkap secara maksimal, maka sebaiknya ujung alat destilasi ini tercelup semua ke dalam larutan asam standar sehingga dapat ditentukan jumlah protein sesuai dengan kadar protein bahan. Selama proses destilasi lama-kelamaan larutan asam borat akan berubah warna menjadi hijau kebiruan, hal ini karena larutan menangkap adanya ammonia dalam bahan yang bersifat basa sehingga mengubah warna merah muda menjadi biru. Reaksi yang terjadi yaitu sebagai berikut:
(NH4)2SO4 + NaOH Na2SO4 + 2 NH4OH
2NH4OH 2NH3 + 2H2O
4NH3 + 2H3BO3 2(NH4)2BO3 +H2 (Elisabeth 2015)
Gambar 3 Reaksi asam borat dengan protein pada proses destilasi Reaksi destilasi akan berakhir bila terjadi perubahan warna larutan dalam erlenmeyer menjadi hijau muda akibat reaksi indicator pada suasana basa akibat menangkap ammonia. Ini menunjukkan larutan telah bersifat basa dan distilasi dihentikan. Selain perubahan visual yang terlihat, seharusnya dilakukan pengujian keberadaan ammonia di ujung pipa aliran distilat. Pengujian dilakukan dengan menempelkan lakmus merah ke ujung pipa, bila lakmus merah tidak berubah menjadi biru menunjukkan tidak ada lagi amoniak yang dihasilkan dari destilasi, dengan demikian, destilasi dihentikan. Setelah destilasi selesai larutan sampel berwarna keruh dan larutan asam dalam erlenmeyer berwarna hijau kebiruan karena dalam suasana basa akibat menangkap ammonia. Ammonia yang terbentuk selama destilasi dapat ditangkap sebagai destilat setelah diembunkan (kondensasi) oleh pendingin balik di bagian belakang alat destilasi dan dialirkan ke dalam erlenmeyer (Elisabeth 2015).
Langkah terakhir dalam proses analisis protein adalah titrasi. Titrasi asam-basa digunakan untuk menentukan kadar protein dalam sampel. Karena NH3 yang terbentuk adalah asam lemah, digunakan HCl baku 0,1N untuk menitrasi asam borat yang sudah menangkap ammonia hasil destilasi, titik akhir di tandai dengan perubahan warna menjadi merah muda karena adanya indikator Phenolptalein pada kondisi sedikit basa (mendekati netral). Reaksi yang terjadi yaitu sebagai berikut:
4NH3 + 2H3BO3 2(NH4)2BO3 +4H2 ……….(1)
(NH4)2BO3 + 2 HCl 2 NH4Cl + H2BO3 ……..………(2)
Gambar 4 Reaksi pada proses destilasi
Reaksi 1 adalah reaksi penangkapan ammonia distilat oleh asam borat, dan reaksi (2) adalah reaksi penetralan pada titrasi asam-basa. Dari reaksi di (2) diatas, bahwa 1 mol HCl akan bereaksi dengan 1 mol ammonia (dalam bentuk NH4Cl).
Sehingga banyaknya protein dalam sampel dapat dihitung dari konversi HCl yang digunakan dikali dengan factor konversi nitrogen protein.
Penggunaan normalitas asam klorida yang berbeda bertujuan untuk membandingkan normalitas mana yang menghasilkan kadar protein yang sesuai dengan literature. Apabila membandingkan antara kedua kadar protein tersebut, didapatkan hasil yang rentang perbedaannya sangat jauh. Kadar protein dalam tepung talas komersial hasil praktikum adalah 0.0107 % dan kadar protein dalam tepung talas komersial hasil praktikum adalah 0.0054% sedangkan menurut literatur kadar protein tepung talas adalah 10.6 gram dalam 100 gram talas atau
0.0106% dalam 0.1 gram tepung talas (Lanny Lingga 2010). Hasil analisa kadar protein tepung talas komersil memberikan hasil yang mendekati kadar literature sedangkan tepung talas homemade lebih kecil. Hal ini dikarenakan adanya galat pada pembuatan tepung yang menyebabkan protein terdegradasi menjadi bentuk lain.
Karbohidrat adalah polisakarida, merupakan sumber energi utama pada makanan. Nasi, ketela, jagung adalah beberapa contoh makanan yang mengandung karbohidrat. Penyusun utama karbohidrat adalah karbon, hidrogen, dan oksigen dengan rumus umum (CnH2O)n. Karena inilah maka nama
karbohidrat diberikan. Karbohidrat berasal dari kata ‘karbon’ dan ‘hidrat’, atom karbon yang mengikat air (Lehninger 1982).
Banyak cara yang digunakan untuk menentukan analisis kadar karbohidrat (glukosa) baik secara kimiawi maupun fisik. Namun, dalam percobaan analisis karbohidrat dilakukan dengan menggunakan cara kimiawi yaitu metode Luff-Schrool dan metode pengikatan iodin. Metode Luff-Luff-Schrool ditentukan dengan menentukan kuprioksida dalam larutan sebelum direaksikan dengan gula pereduksi (titrasi blanko) dan sesuda direaksikan dengan sampel gula pereduksi (titrasi sampel). Penentuan titrasi dengan menggunakan larutan Na2S2O3. Oleh
karena itu, sebelum dilakukan analisis kadar glukosa dengan menggunakan metode ini dilakukan standardisasi Na2S2O3 terlebih dahulu. Standardisasi
Na2S2O3 ini dilakukan karena Na2S2O3 dapat dengan mudah diperoleh dalam
keadaan kemurnian yang tinggi, namun selalu ada sedikit kesalahan karena sifat dari Na2S2O3 yang tidak stabil sehingga tidak dapat dijadikan sebagai larutan baku
standar primer.
Standardisasi Na2S2O3 dilakukan dengan menggunakan kalium dikromat
sebagai larutan standar primer. Larutan Na2S2O3 sebelum digunakan sebagai
larutan standar dalam proses iodometri maka distandarkan terlebih dahulu oleh KI 20% yang merupakan standar primer. KI 20% ini ditambahkan dengan HCL 4N yang menyebabkan warna larutan menjadi coklat kehitaman. Fungsi penambahan HCL 4N ini memberikan suasana asan karena larutan KI memiliki keasaman yang rendah. Reaksi yang terjadi adalah sebagai berikut:
IO3- + 5I- + 6H+ 3I2 + 3H2O
Gambar 5 Reaksi reduksi iodin
Indikator yang digunakan dalam proses standardisasi ini adalah amilum (kanji). Penambahan amilum dilakukan saat mendekati titik akhir titrasi. Hal ini dikarenakan agar amilum tidak membungkus iod karena akan menyebabkan amilum sulit dititrasi untuk kembali ke senyawa semula. Proses titrasi harus dilakukan secepat mungkin karena sifat I2 yang mudah menguap. Pada titik akhir
titrasi iod yang terikat juga hilang bereaksi dengan Na2S2O3 sehingga warna biru
tua yang dihasilkan tepat hilang. Penggunaan indikator amilum dapat memperjelas perubahan warna larutan yang terjadi saat titik akhir titrasi. Konsentrasi Na2S2O3
Penentuan kadar glukosa dengan menggunakan metode Luff-Schrool yang dilakukan pertama kali adalah sampel talas yang telah ditimbang ditambahkan dengan HCL 3% dan indikator pp. Penambahan HCL ini untuk menghidrolisis pati menjadi monosakarida yang akan bereaksi dengan pereaksi Luff-Schrool dengan mereduksi ion Cu2+ menjadi Cu+ proses hidrolisis ini dilakukan dengan
cara refluks selama 2,5 jam. Kemudian setelah proses hidrolisis ini, campuran didinginkan dan ditambahkan dengan NaOH 40% untuk menetralkan larutan sampel akibat penambahan HCL sebelum proses hidrolisis. Penetralan ini harus dilakukan karena dalam metode Luff-Schrool pH yang telalu asam akan menimbulkan overestimated pada saat titrasi karena akan menyebabkan terjadinya proses oksidasi ion iodida menjadi I2 dan apabila pH terlalu tinggi (terlalu basa)
maka hasil titrasi akan menjadi lebih rendah daripada sebenarnya, karena pada pH tinggi akan terjadi reaksi I2 terbentuk dengan air (hidrolisis) (Harjadi 1994).
O2 + 4I- + 4H+ 2I2+ 2H2O
Gambar 6 Reaksi oksidasi iodin
Setelah itu, sampel yang telah dinetralkan tersebut diambil 10mL dan dilarutkan dengan akuades serta ditambahkan dengan pereaksi Luff-Schrool. Kemudian ditambahkan dengan H2SO4 yang berfungsi untuk mengikat ion
tembaga yang terbentuk dari proses reduksi monosakarida dengan pereaksi Luff-Schoorl kemudian terbentuk CuSO4. Ditambahkan pula KI 20% yang akan
bereaksi dengan CuSO4 membentuk buih coklat kehitaman (Harjadi 1994).
Langkah teakhir adalah ditirasi dengan Na2S2O3 yang telah di standardisasi. Selisih
titrasi blanko dengan titrasi sampel ekuivalen dengan kuprooksida yang terbntuk dan juga ekuivalen dengan jumlah gula reduksi yang ada dalam bahan/larutan. Reaksi yang terjadi selama penentuan karbohidrat cara ini mula-mula kuprooksida yang ada dalam reagen akan membebaskan iod dari garam kalium iodida. Banyaknya iod yang dibebaskan ekuibalem dengan banyaknya kuprioksida. Banyaknya iod dapat diketahui dengan titrasi dengan menggunakan Na2S2O3.
Mengetahui bahwa titrasi sudah cukup diperlukan indikator amilum yang merubah warna biru tua yang terbentuk menjadi biru tepat hilang. Reaksi yang terjadi adalah sebagai berikut:
Hasil yang diperoleh untuk penentuan karbohidrat dengan metode Luff-Schoorl dapat disajikan pada Tabel 1. Hasil percobaan menunjukka bahwa kadar gula pereduksi pada sampel tepung talas Homemade lebih besar dibandingkan sampel tepung talas pada komersil. Hal ini dapat disebabkan pada proses pembuatan masing-masing tepung talas, seperti hal nya pada pembuatan tepung talas
Homemade kandungan kimia lebih sedikit dibandingan dengan komersil sehingga
karbohidrat yang terdapat pada tepung talas Homemade lebih besar. Kemudia kadar karbohidrat juga dipengaruhi oleh suhu yang menyebabkan kadar karbohidrat pada Homemade lebih besar karna suhu yang digunakan pada saat proses pembuatan tidak terlalu besar sehingga tidak merusak kandungan-kandungan yang terdapat di dalam sampel talas tersebut. Kadar pati yang dihasilkan pun tergantung pada kadar gula pereduksi yang didapatkan, dimana semakin besar kadar gula pereduksi dalam sampel maka komponen pati yang terdapat dalam sampel akan semakin besar. Hal ini dikarenakan pati merupakan komponen utama dari karbohidrat. Namun menurut Onwueme (1978), talas mengandung karbohidrat sekitar 13-29% dengan komponen utama pati sekitar 77.9%. Apabila dibandingkan dengan hasil percobaan, pada percobaan didapatkan kadar gula pereduksi maupun komponen pati yang sangat rendah. Seperti yang telah dijelaskan pada sebelumnya, hal ini bergantung pada proses pembuatan tepung talas dan pengaruh suhu yang dapat mempengaruhi kadar gula pereduksi maupun kadar pati.
Penetapan kadar karbohidrat dapat ditentukan pula dengan menggunakan metode pengikatan iodin. Uji Iod bertujuan untuk mengidentifikasi polisakarida. Reagent yang digunakan adalah larutan iodine yang merupakan I2 terlarut dalam
potassium iodide. Reaksi antara polisakarida dengan iodin membentuk rantai poliiodida. Polisakarida umumnya membentuk rantai heliks (melingkar), sehingga dapat berikatan dengan iodin, sedangkan karbohidrat berantai pendek seperti disakarida dan monosakarida tidak membentuk struktur heliks sehingga tidak dapat berikatan dengan iodine. Bahan-bahan yang diuji pada uji Iod adalah tepung pati, tepung glikogen, tepung gum arab, tepung agar-agar, dan tepung inulin.
Uji iod dilakukan untuk mengidentifikasikan amilosa dalam bahan uji. Amilosa terdiri atas 250-3000 unit D-glukosa. Unit glukosa amilosa dirangkaikan dalam bentuk linier oleh ikatan glikosida α (1-4). Amilosa berat molekulnya bervariasi dari beberapa ratus sampai 150.000. Gambar struktur amilosa dapat dilihat pada gambar 8.
Pereaksi iod yang digunakan dalam pecobaan mengandung iodium. Warna pereaksi tersebut yaitu kuning. Prinsip reaksi uji iod yaitu dalam molekul amilosa terdapat unit-unit glukosa yang membentuk rantai heliks spiral panjang dengan ruang ditengahnya. Bentuk ini menyebabkan pati dapat membentuk kompleks dengan molekul iodium, yang dapat masuk ke dalam spiralnya, sehingga menyebabkan warna biru tua pada kompleks tersebut. Bahan uji iod yaitu tepung talas menujukkan warna biru tua. Pati tersusun dari dua macam karbohidrat, yaitu amilosa dan amilopektin yang komposisi yang berbeda-beda untuk setiap bahan uji.
Hal yang dilakukan pertama kali pada metode ini yaitu, tabung reaksi pertama dimasukkan sampel tepung talas Homemade dan tabung reaksi kedua dimasukkan sampel tepung talas komersil dengan bobot yang sama. Dilakukan penambahan etanol 96% yang berfungsi sebagai pelarut dan etanol berwarna bening sehingga tidak akan mengganggu analisis dan pengukuran. Sampel tersebut kemudian ditambahkan dengan NaOH yang bertujuan memberikan suasana basa pada uji karbohidrat dengan metode pengikatan iodin. Pada pengujian larutan amilum dan iod, NaOH akan menghalangi terjadinya reaksi antara amilum dengan iod, sehingga saat penambahan NaOH pada larutan amilum tidak terjadi perubahan warna. Setelah itu dilakukan adalah pemanasan yang berfungsi untuk mempercepat proses reaksi agar reaksi dapat berjalan sempurna. Sampel dipanaskan pada suhu 100oC selama 30 menit. Hasil yang diperoleh saat
pemanasan adalah larutan berwarna putih. Hal ini disebabkan saat keadaan panas, rantai amilum akan membentuk rantai panjang. Namun, ketika didinginkan maka akan kembali ke warna awal karena amilum kembali terbentuk.
Sampel kemudian ditambahkan dengan CH3COOH yang berfungsi
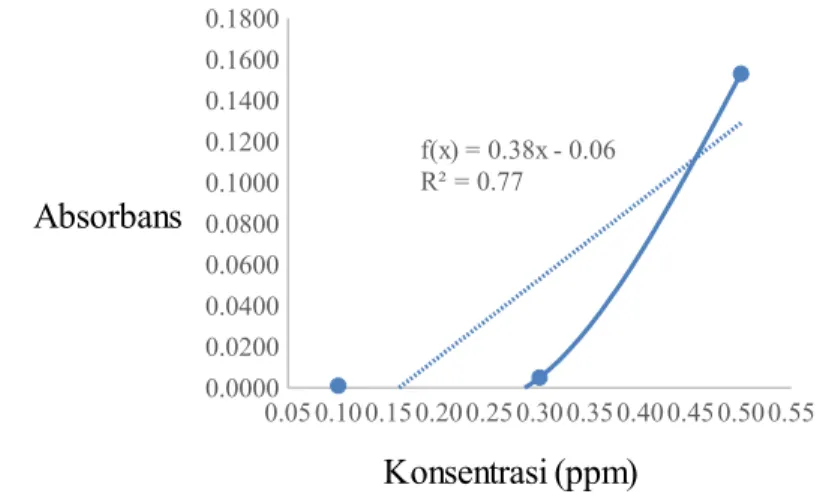
menurunkan pH amilum sehingga menyebabkan larutan bersifat asam dan larutan iodin secara berurutan yang bertujuan agar menyebabkan warna larutan berubah menjadi berwarna biru. Perubahan warna ini disebabkan oleh adanya reaksi antara amilum dengan iod. Pati berada dalam suasana asam sehingga amilum akan terhidrolisis dan mudah berikatan dengan iod membentuk warna biru. Campuran tersebut kemudian didiamkan selama 30 menit agar reaksi antara amilum dengan iod dapat berjalan secara sempurna dan akan terbetuk warna yang dapat menunjukkan jumlah karbohidrat yang terdapat di dalam sampel talas tersebut. Intensitas warna yang terbentuk dibaca serapannya dengan menggunakan instumen spektrofotometer Sinar Tampak pada panjang gelombang 620 nm. Kurva standar amilum yang dihasilkan dapat dilihat pada Gambar 9.
0.05 0.10 0.15 0.20 0.25 0.30 0.35 0.40 0.45 0.50 0.55 0.0000 0.0200 0.0400 0.0600 0.0800 0.1000 0.1200 0.1400 0.1600 0.1800 f(x) = 0.38x - 0.06 R² = 0.77 Konsentrasi (ppm) Absorbans
Gambar 9 Kurva standar Amilum
Kurva standar diatas Berdasarkan data di atas dapat diketahui bahwa persamaan garis yang diperoleh adalah Y = -0.061 + 0.38 x dengan koefisien determinasi (r2) = 0.7697. Persamaan garis yang diperoleh menujukkan kelinieran
yang kurang baik. Hal ini dikarenakan nilai koefisein determinasi yang dihasilkan <0.98. Namun, absorban yang dihasilkan telah sesuai secara teori yaitu semakin tinggi konsentrasi maka absorban yang dihasilkan akan semakin besar. Persamaan garis yang diperoleh berdasarkan percobaan tersebut dapat digunakan untuk menentukan kadar atau konsentrasi karbohidrat dalam sampel talas Homemade
maupun komersil. Jumlah karbohidrat dalam sampel talas pada dilihat pada Tabel 2.
Hasil percobaan yang dilakukan menunjukkan bahwa kadar karbohidrat pada tepung telas komersil 2 tidak menunjukkan hasil yang sesuai berdasarkan teori karena kadarnya melebihi batas maksimum kadar karbohidrat dalam tepung talas. Adanya kesalahan ini dapat disebabkan oleh banyak faktor, misalnya pada larutan deret standar yang dibuat. Secara visual dapat dilihat perbedaan intensitas warna yang terbentuk antara larutan standar dengan larutan sampel. Larutan standar berwarna biru tua, sedangkan larutan sampel berwarna kuning pekat. Warna tersebut akan berpengaruh terhadap serapan yang terukur pada instrument spektrofotometer. Sehingga kemungkinan besar larutan standar yang digunakan terlalu pekat sehingga perlu dilakukan pengenceran kembali agar warna larutan standar yang terbentuk tidak terlalu pekat dan absorbansi sampel dapat masuk ke dalam kisaran serapan larutan standar dan mengurangi kesalahan yang terjadi. Pati yang berikatan dengan (I2) akan menghasilkan warna biru. Sifat ini dapat
digunakan untuk menganalisis adanya pati. Hal ini disebabkan oleh struktur molekul iodin dan terbentuklah warna bitu. Apabila pati dipanaskan, spiral merenggang, molekul-molekul iodin terlepas sehingga warna biru menghilang (Winarno FG 2004). Amilosa dengan iodin akan berwarna biru, amilopektin dengan iodin akan berwarna merah violet, glikogen maupun dekstrin dengan iodin akan berwarna merah coklat (Poedjiadi & Supriyanti 2007). Amilosa merupakan
bahan yang menyusun sekitar 20% dari pati, unit glukosa (50-300) membentuk rantai sinambung, dengan tautan-1,4 (Hart Harold 2003).
Serat kasar (crude fiber) merupakan bagian dari pangan yang tidak dapat dihidrolisis oleh asam atau basa kuat. Serat kasar adalah bahan makanan residu sel tanaman yang tidak dapat dihidrolisis (diuraikan) oleh enzim pencernaan manusia dalam suasana keasaman lambung, serta hasil-hasil fermentasinya tidak dapat digunakan oleh tubuh.
Praktikum yang dilakukan yaitu menentukan kadar serat kasar yang terkandung dalam tepung talas home made dan komersial. Serat kasar merupakan bagian dari pangan yang tidak dapat dihidrolisis oleh bahan-bahan kimia yang di-gunakan untuk menentukan kadar serat kasar yaitu asam sulfat (H2SO4 1.25%)
dan natrium hidroksida (NaOH 1.25%). Serat kasar juga dapat didefinisikan sebagai sisa bahan makanan yang telah mengalami proses pemanasan dengan asam kuat dan basa kuat selama 30 menit yang dilakukan di laboratorium.
Contoh tepung terlebih dahulu diekstrak metode maserasi dengan pelarut n -heksana untuk menghilangkan senyawa nonpolar yang ada dalam tepung. Penambahan larutan H2SO4 1.25% panas untuk mendestruksi senyawa non serat
yang dibantu dengan pemanasan saat refluks. Residu lalu dibilas dengan akuades panas hingga tidak bersifat asam lagi.
Penambahan basa NaOH 1.25% panas untuk menghidrolisis senyawa kimia nonserat yang kemungkinan masih ada setelah perlakuan asam. Penambahan basa panas diikuti dengan perlakuan refluks untuk mendestruksi. Residu dibilas dengan air panas untuk menghindari sifatnya yang masih basa. Residu yang masih tersisa dalam larutan adalah serat makanan yang ada dalam contoh tepung.
Serat kasar mengandung senyawaan selulosa, lignin dan zat lain yang belum dapat diidentifikasi dengan pasti, Kadar serat kasar yang diperoleh dari percobaan sebesar %. Kadar serat kasar tepung Homemade lebih besar bila dibandingkan dengan kadar serat tepung talas komersial. Tepung homemade belum ada perlakuan pengurangan serat makanan dan penambahan zat kimia lain, sementara tepung komersial yang dipasarkan sering telah dikurangi kadar serat kasarnya dan ditambahkan bahan tambahan pangan lain yang menyebabkan kadar serat kasarnya berkurang.
5 SIMPULAN
Hasil percobaan analisa kadar proksimat (kadar air, kadar abu, lemak kasar, protein, karbohidrat, dan kadar serat makanan) sampel tepung ubi talas komersil (buatan pabrik) dan homemade (buatan sendiri), menghasilkan kadar air sebesar 11.81% (Komersial) dan 14.65% (Homemade), kadar abu sebesar 0.96% (Komersial) dan 0.97% (Homemade), kadar lemak kasar sebesar 0.1146% (Komersial) dan 0.1647% (Homemade), kadar protein sebesar 0.0069 % (Komersial) 0.0034% (Homemade), kadar karbohidrat untuk gula pereduksi
sebesar 0.7430% (Komersial cara Luff-Schrool), 39.34% (Komersial cara pengikatan iodin), 1.1016% (Homemade cara Luff-Schrool), 22.24%
(Homemade cara pengikatan iodin), untuk pati sebesar 0.6687 % (Komersial) dan
0.9914% (Homemade), dan kadar serat sebesar 58.46 % (Komersial) dan 65.67 %
(Homemade).
6 DAFTAR PUSTAKA
Day R.A. , Underwood A.L. 2002. Analisi Kimia Kunatitatif. Penerjemah : Dr. Ir. Iis Sopyan, M.Eng. Jakarta (ID) : Erlangga. Terjemahan dari : Quantitative
Analysis. Hlm 68.
Duangmal K, K Richard,Apenten O. 1998. A comparative study of polyphenoloxidases from taro (Colocasia esculenta) and potato (Solanum tuberosum var. Romano). Journal Food Chemistry.
Elisabeth Dian Adi Anggraeni. 2015. Added value improvement of taro and sweet potato commodities by doing snack processing activity. Procedia Food Science. 3(2015) 262 – 273 doi: 10.1016/j.profoo.2015.01.029
Fai F, Danbature WL, Auwal Y, Usman YM. 2013. Proximate and some mineral analysis of pumpkin (Cucurbita maxima ) leaf . Journal of Physical
Sciences and Environmental Safety. 3(1)
Hafes. E. S. E.2000. Metode Analisis Proksimat. Jakarta : Erlangga. Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Gramedia: Jakarta
Hart Harold et al. 2003. Kimia Organik. Suminar Setiati Achmadi, penerjemah; Jakarta (ID): Erlangga. Terjemahan dari: Organic Chemistry.
James E.O. 2013. Chemical Composition and Effect of Processing and Flour Particle Size on Physicochemical and Organoleptic Properties of Cocoyam (Colocasia esculenta var esculenta) Flour. Nigerian Food Journal Official Journal. 31:2, pages 113 – 122
Khopkar S M. 1990. Konsep Dasar Kimia Analitiik. Hal : 27. Penerjemah : A. Saptorahardjo. Jakarta(ID) : UI-Press.
Kumoroa Andri Cahyo. 2014. Kinetics of Calcium Oxalate Reduction in Taro (Colocasia esculenta) Corm Chips during Treatments Using Baking Soda Solution. Procedia Chemistry. 9 ( 2014 ) 102 – 112 doi: 10.1016/j.proche.2014.05.013
Lanny Lingga. 2010. Cerdas Memilih Sayuran; Plus Minus 54 Jenis Sayuran. Agromedia pustaka. Jakarta hal 100-102
Lehninger, L Albert.1982. Dasar-Dasar Biokimia. Surabaya (ID): Erlangga. Onwueme, I.C. 1994. The Tropical Tubers Crops, Yams, Cassava, Sweet Potato,
and Cocoyams. John Wiley and Chisester, New York.
Poedjiadi & Supriyanti. 2007. Dasar-dasar Biokimia. Jakarta (ID): UI Press Purnomo, H. 1995. Aktivitas Air dan Peranannya dalam Pengawetan Pangan.
Jakarta : Universitas Indonesia.
purwati heni. 2007. Membuat Tepung Umbi dan Variasi Olahannya Hal 81-91 AgroMedia. Jakarta
Sastrohamidjo jo. H., 2005. Kimia Organik, Stereokimia, Karbohidrat, Lemak, dan Protein. Gadjah Mada University Press: Yogyakarta.
Soejono M. 1990. Petunjuk Laboratorium Analisis dan Evaluasi Pakan. Yogyakarta: Fakultas Peternakan Universitas Gadjah Mada
Sudarmadji. S. dkk. 2007. Analisis bahan makanan dan pertanian. Yogyakarta : Liberty
Winarno FG. 2004. Kimia Pangan dan Gizi. Jakarta (ID): Gramedia
Adane T, Shimelis A, Negussie R, Tilahun B , GD Haki. 2013. Effect of processing method on the proximate composition, mineral content and antinutritional factors of taro (Colocasia esculenta, l.) grown in Ethiopia.
Journal of Food, Agriculture, Nutrient and Development.13 (2).
Fila, W.A., Itam, E.H. Johnson, J.T., Odey, M.O. Effiong, E.E., Dasofunjo, K., Ambo, E.E. 2013. Comparative proximate compositions of watermelon citrullus lanatus, squash cucurbita pepo’l and rambutan Nephelium lappaceum.
International Journal of Science and Technology. 2 (1).
Sidabutar WDR, Nainggolan JR, Ridwansyah. 2013. Kajian penambahan tepung talas dan tepung kacang hijau terhadap mutu cookies. Jurnal Rekayasa Pangan
dan Pertanian. 1 (4).
7 LAMPIRAN
Lampiran 1 Kadar air pada talas komersil dan homemade
n cawan
kosong (g) cawan+talas(g) akhir (g) contoh (g) kering (g) (%) Talas Komersil 1 39.3028 41.4076 41.1676 2.1048 1.8648 11.40 2 39.6046 41.6843 41.4301 2.0797 1.8255 12.22 Rerata 11.81 Talas Homemad e 1 34.1435 36.1513 35.8300 2.0078 1.6865 19.05 2 40.6051 43.6048 43.3995 1.9997 1.7944 10.26 Rerata 14.65 Contoh Perhitungan:
Talas Komersil Ulangan 1
% air (b/b) = bobot contoh basah-bobot contoh kering (g) x 100% Bobot contoh basah (g)
= 2.1048 g- 1.8648 g x 100% = 11.40 % 2.1048 g
Lampiran 2 Hasil kadar abu pada sampel talas komersial dan homemade
Sampel Ulangan Bobot (gram) % abu Cawan
Kosong Kosong +Cawan Talas
Sampel
Basah Akhir (SampelAbu Kering) Talas Komersial 12 40.988238.8859 45.987843.8867 4.99965.0008 41.1037439.0050 0.11550.1191 0.970.97 Rerata 0.97 Talas HomeMade 1 39.7851 44.7985 5.0134 39.9827 0.1976 0.96 2 41.9616 46.9877 5.0261 42.16405 0.2024 0.96 Rerata 0.96 Contoh Perhitungan:
Talas Komersil ulangan 1
% air (b/b) = Bobot contoh basah-Bobot contoh kering (g) x 100 % Bobot contoh basah (g)
= 4.9996 g - 0.1155 g x 100 % = 0.97 % 4.9996 g
Lampiran 3 Uji penentuan %N dengan metode Kjeldahl
Sampel Bobotsampel Volume HCl (mL) N (%) Protein(%) Awal akhir Terpakai
Komersial 0.1005 1.45 1.55 0.1 0.0107 0.0069
Homemade 0.1015 1.55 1.60 0.05 0.0054 0.0034
Contoh Perhitungan sampel komersial ulangan 1 Kadar N (%) = (b-a) x N HCL x 0.014 x 100 % Bobot Sampel (g) = (0.15-0.1) mL x 0.0077 N x 0.014 x 100% 0.1005 g = 0.0107% Kadar Protein (%) = %N x6.25 = 0.0107 x6.25 = 0.0069
Lampiran 4 Hasil penentuan kadar lemak pada sampel tepung talas komersil dan
Homemade
Jenis Sampel Bobot Sampel (gr) Bobot Labu Kosong (gr) Bobot Labu Kosong + Ekstrak (gr) Kadar Lemak (%) Tepung Talas Komersil 2.0066 73.1881 73.1904 0.1146 Tepung Talas Nonkomersil 2.0028 82.7559 82.7526 0.1647
Contoh Perhitungan % Kadar Lemak :
% Kadar Lemak = b obot labuakhir−b obot labuawal
b obot sampel x 100%
= 73.19042,006−73. 881 x 100% = 0.1146 %
Lampiran 5 Standardisasi Natrium Tiosulfat Ulanga n Volume Titrat (mL) Volume Titran (mL) [Na₂S₂O₃] (N) Awal akhir terpaka
i 1 25.00 5.00 24.7 0 19.70 0.1305 2 25.00 0.00 19.70 19.70 0.1305 3 25.00 13.00 32.70 19.70 0.1305 Rerata 0.1305 Indikator : Amilum
Perubahan warna : Biru tua menjadi biru tepat hilang Contoh Perhitungan :
= 0.1 N x 49 g
mol x 0.1L = 0.4900 gram
Masaa K2Cr2O7 yang ditimbang: 0.5038 gram
[K2Cr2O7] = BE x volume larutangram
=
0. 5038gram 49 g
mol x0.1L
=0.1028N
Lampiran 6 Kadar gula pereduksi dengan metode Luff-Schrool Ulangan Bobot contoh (mg) Volume Titrat (mL)
Volume Titran (mL) pereduksi% Gula % Pati Awal akhir terpakai
Home made 1 1.0217 10 0.00 2.30 2.30 1.0571 0.9514 Home made 2 1.0217 10 7.60 9.60 2.00 1.1461 1.0315 Komersial 1 1.0094 10 11.90 15.30 3.40 0.7133 0.6420 Komersial 2 1.0094 10 15.30 18.50 3.20 0.7727 0.6954 Blanko 0.20 5.90 5.70 Indikator : Amilum
Perubahan warna : Biru tua menjadi biru tepat hilang Contoh Perhitungan :
mL Na2S2O3 yang digunakan ¿(Volume blanko−volume sampel)
0,1 x [Na2S2O3] ¿(5.70−2.30)mL
0. 1 x 0.1305 N = 4.44 mL
Berdasarkan tabel didapatkan bahwa mg Glukosa yaitu 0,0108 mg %Gula pereduksi ¿ mg glukosa x fp
bobot contoh(mg)x100 ¿0. 0108mg x1
1. 0217mg x100 = 1.0571 % % Pati = 0.9 x % gula pereduksi
= 0.9 x 1.0571% = 0.9514%
Lampiran 7 Metode pengikatan iodin Deret Standar
(ppm) Absorbans
Kadar gula Pereduksi (ppm) 0.10 0.0010 (N x V) Na2S2O3 = (N x V) K2Cr2O7 N Na2S2O3 = 0.1028N x25mL 19.70mL =0.1305
0.30 0.0050 0.50 0.1530 Homemade 1 0.0200 21.32 Homemade 2 0.0270 23.16 Komersil 1 0.1700 60.79 Komersil 2 0.0070 17.89 Contoh Perhitungan: Y=-0.061+0.38x r = 0.8773 ; r2 =0.7697 Homemade 1: y = -0.061 +0.38x 0.0200 = -0.061 + 0.38x X = 0.0200+0. 061 0. 38 x100=21. 32