i PENGARUH INTENSITAS CAHAYA TERHADAP KANDUNGAN
KLOROFIL-a DAN -c ZOOXANTHELLAE DARI ISOLAT KARANG LUNAK Zoanthus sp.
(Skripsi) Oleh SUNDARI SAYEKTI FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG BANDAR LAMPUNG 2016
ii ABSTRACT
EFFECT OF LIGHT INTENSITY TOWARD
CHLOROPHYLL-a AND –c CONTENT OF ZOOXANTHELLAE FROM SOFT CORAL Zoanthus sp. ISOLATE
By
Sundari Sayekti
Coral reef is very sensitive toward the natural change, such as the increasing of light intensity. Light intensity will effect chlorophyll-a and –c pigment on simbiont zooxanthellae algae which live in coral tissue, because light intensity has an important role in photosynthesis at zooxanthellae. The research aimed was to determine the effect of light intensity toward chlorophyll-a and –c content at zooxanthellae. The research conducted on July-August 2016, at the Laboratory Departement of Aquaculture, Agriculture Faculty, University of Lampung for 66 hours. The research used 4 treatments and 5 repetitions, that is 3800 lux light intensity treatment (IC1), 6250 lux (IC2), 7980 lux(ICk),and11800 lux (IC3) and
coral sampel used is soft coral Zoanthus sp. from waters Lampung bay. The main parameters were observed of chlorophyll-a dan -c content at zooxanthellae with spektrofotometer and supporting parameters is the water quality. Chlorophyll-a dan –c data is analyzes by using ANOVA and followed by LSD test. The result showed that differences light intensity gave significant effect to chlorophyll-a content at zooxanthellae, but did not significant affect on chlorophyll-c content at zooxanthellae.
Keywords: Zooxanthellae, Chlorophyll-a, Chlorophyll-c, Light Intensity, Zoanthus sp.
iii ABSTRAK
PENGARUH INTENSITAS CAHAYA TERHADAP KANDUNGAN KLOROFIL-a dan -c ZOOXANTHELLAE DARI ISOLAT
KARANG LUNAK Zoanthus sp. Oleh
Sundari Sayekti
Terumbu karang sangat sensitif terhadap perubahan alam, salah satunya seperti peningkatan intensitas cahaya. Intensitas cahaya akan mempengaruhi pigmen klorofil-a dan –c alga simbion zooxanthellae yang hidup di dalam jaringan karang, sebab intensitas cahaya memiliki peranan penting dalam proses fotosintesis pada zooxanthellae. Penelitian bertujuan untuk mengetahui pengaruh intensitas cahaya terhadap kandungan klorofil -a dan -c pada zooxanthellae. Penelitian dilaksanakan pada bulan Juli-Agustus 2016, bertempat di Laboratorium Budidaya Perikanan, Program Studi Budidaya Perairan Fakultas Pertanian, Universitas Lampung selama 66 jam. Penelitian menggunakan 4 perlakuan dan 5 ulangan yaitu perlakuan intensitas cahaya 3800 lux (IC1), 6250 lux (IC2), 7980 lux (ICK),
dan 11800 lux (IC3) dan sampel karang yang digunakan yaitu karang lunak
Zoanthus sp. dari Perairan Teluk Lampung. Parameter utama yang diamati adalah kandungan klorofil-a dan -c pada zooxanthellae dengan menggunakan spektrofotometer dan parameter pendukung yaitu kualitas air. Data klorofil-a dan -c dianalisis dengan analisis ragam (ANOVA) dan dilanjutkan dengan uji BNT. Hasil penelitian menunjukkan bahwa pemberian intensitas cahaya yang berbeda memberikan pengaruh terhadap kandungan klorofil-a pada zooxanthellae, tetapi tidak memberikan pengaruh terhadap kandungan klorofil-c pada zooxanthellae. Kata Kunci: Zooxanthellae, Klorofil-a, Klorofil-c, Intensitas Cahaya, Zoanthus sp.
iv PENGARUH INTENSITAS CAHAYA TERHADAP KANDUNGAN
KLOROFIL-a DAN –c ZOOXANTHELLAE DARI ISOLAT KARANG LUNAK Zoanthus sp.
Oleh
SUNDARI SAYEKTI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA PERIKANAN
Pada
Jurusan Perikanan dan Kelautan Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
BANDAR LAMPUNG 2016
viii RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 10 Januari 1995 sebagai putri pertama dari dua bersaudara, dari pasangan (Alm) Bapak Sunardi dan Ibu Hartati. Penulis memulai pendidikan formal dari Taman Kanak- kanak (TK) Ar-Rusydah I Kedaton, Bandar Lampung pada tahun 1999-2000, dilanjutkan ke Sekolah Dasar Negeri (SDN) 5 Penengahan, Bandar Lampung pada tahun 2000-2006, Sekolah Menengah Pertama Negeri (SMPN) 8 Bandar Lampung pada tahun 2006-2009, dan Sekolah Menengah Atas Negeri (SMAN) 7 Bandar Lampung pada tahun 2009-2012. Penulis kemudian melanjutkan pendidikan kejenjang S1 di Program Studi Budidaya Perairan, Jurusan Perikanan dan Kelautan, Fakultas Pertanian Universitas Lampung melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) pada tahun 2012 dan menyelesaikan studinya pada tahun 2016.
Selama menjadi mahasiswa, penulis pernah menjadi asisten praktikum pada mata kuliah Mikrobiologi Akuatik, Penyakit Parasit Organisme Akuatik (PPOA), Fisiologi Hewan Air (FHA), dan Manajemen Kesehatan Ikan (MKI). Selain itu aktif di organisasi Himpunan Mahasiswa Budidaya Perairan UNILA (HIDRILA) sebagai anggota bidang Kewirausahaan pada tahun 2013/2014.
Penulis telah melakukan kegiatan Kuliah Kerja Nyata (KKN) di Desa Dipasena Mulya, Kecamatan Rawa Jitu Timur, Kabupaten Tulang Bawang selama 40 hari yaitu dari bulan Januari – Maret 2015. Penulis mengikuti Magang Kerja Laboratorium di Loka Perikanan Penyakit Ikan dan Lingkungan Serang (LP2IL) pada bulan Agustus 2014 dan Praktek Umum di Loka Perikanan Penyakit Ikan dan Lingkungan Serang (LP2IL) dengan judul “Pemeriksaan Macrobrachium rosenbergii Nodavirus (MrNV) Pada Udang Galah (Macrobrachium rosenbergii) Dengan Metode Reverse Transcription – Polymerase Chain Reaction (RT – PCR) di Loka Pemeriksaan Penyakit Ikan Dan Lingkungan (LP2IL) Serang” pada bulan Juli-September 2015.
ix Penulis melakukan penelitian akhir pada bulan Juli-Agustus 2016 di Laboratorium Perikanan Jurusan Budidaya Perairan Fakultas Pertanian Universitas Lampung dengan judul “Pengaruh Intensitas Cahaya Terhadap Kandungan Klorofil-a dan –c Zooxanthellae Dari Isolat Karang Lunak Zoanthus sp.”.
x
PERSEMBAHAN
Dengan rasa syukur kepada Allah SWT atas kenikmatan dan
kemudahan yang selalu diberikan untuk semua hambanya.
Kupersembahkan skripsi ini kepada :
kepada kedua orangtuaku (Ibu dan Ayah) yang selalu
mendoakan, mendidik dan memberi semangat yang tiada henti
Adik serta keluarga besar tercinta yang senantiasa
memberikan do’a, semangat dan dukungan selama masa studi.
Sahabat dan seseorang yang selalu menemani,memberikan
semangat dan menambah warna dalam indahnya pelagi
kehidupan selama ini
Teman-Teman Pengejar Toga yang telah memberikan semangat
dan kebersamaannya selama ini
Dan
xi
“Yakinlah ada sesuatu yang menantimuSelepas banyak
kesabaran yang kau jalani yang akan membuatmu terpana
hingga kau lupa Pedihnya rasa sakit”
(Imam Ali bin Abi Thalib )
“Tuntutlah ilmu disaat kau miskin ia akan menjadi hartamu,
dan disaat kamu kaya ia akan menjadi perhiasanmu”
(Lukman Al-Hakim)
“Inginkan sesuatu dengan bakat yang kau miliki, dan jangan
menginginkan sesuatu sesuai dengan nafsu atau seleramu”
(Lukman Al-Hakim)
“Puncak dari kesabaran adalah saat engkau memilih diam,
padahal di hatimu ada luka yang sedang berbicara. Dan
puncak dari kekuatan adalah ketika engkau memilih
tersenyum, padahal di matamu ada selaksa air mata yang
terbendung”
xii SANWACANA
Puji syukur kehadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga penyusun dapat menyelesaikan skripsi yang berjudul “Pengaruh Intensitas Cahaya Terhadap Kandungan Klorofil-a dan –c Zooxanthellae Dari Isolat Karang Lunak Zoanthus sp.” yang merupakan salah satu syarat
untuk memperoleh gelar Sarjana Perikanan di Universitas Lampung.
Dalam kesempatan ini penyusun menyampaikan ucapan terima kasih kepada: 1. Kedua orang tuaku tercinta (Alm) Bapak Sunardi dan Ibu Hartati yang
selalu memberikan kasih sayang, cinta, perhatian, pengorbanan dan dukungan serta do’a demi kelancaran, keselamatan dan kesuksesanku. 2. Adikku Prabowo yang selalu memberikan dukungan dan semangat.
3. Bapak Prof. Dr. Ir. Irwan Sukri Banuwa, M.Si selaku Dekan Fakultas Pertanian Universitas Lampung.
4. Ibu Ir. Siti Hudaidah, M.Sc selaku Ketua Jurusan Perikanan dan Kelautan Fakultas Pertanian Universitas Lampung.
5. Ibu Esti Harpeni, S.T., MAppSc selaku dosen Pembimbing Utama dan Pembimbing Akademik atas kesabarannya untuk memberikan bimbingan, motivasi, nasehat, dukungan dan saran-saran yang membangun kepada penulis.
6. Bapak Moh.Muhaemin, S.Pi., M.Si selaku Dosen Pembimbing Kedua yang atas kesabarannya untuk memberikan bimbingan, motivasi serta saran kepada penulis dalam proses penyusunan skripsi.
7. Ibu Rara Diantari, S.Pi., M.Sc selaku Penguji Utama yang telah memberikan masukan, kritik dan saran yang membangun dalam proses penyusunan skripsi.
8. Tim zooxanthellae Suliswati dan Weni Fitriyani (Sulis dan Mbk Wen) yang telah memberikan semangat, motivasi, dukungan, kerjasamanya dan kesabaran selama penelitian.
xiii 9. Helda Septi Rizawati (Heldong), Ike Yunita Sari (Keke), Ira Septiana (S), Puji Lestari (Abang), Heidy Riana, Dhiah Ambarwati (Tuyul), Dentiana Prabarini (Dentul), Ayu Noviyanti, Triando Kurniawan, Yoga Ipandri, Ranindia Akbar Alamanda (Akbar) yang telah membantu dalam penelitian. 10. Para Pengejar Toga BDPi 2012 Wijayanti, Sulistiyowati,Syohibahttul
(Zonghib), Septi, Doni Nur, Adetya, Fajri, Agi, Eshy, Mita, Ayi, Ayu yp, Anggita (Cebong), Haryanti (Mbk Bro), Doni (Donput), Ajeng, Shara, Atik, Desi Bang Jupri, Septa, Ata, Andhika bayu (Abay), Wirya, Ardian, Khanif, Fajriza (Ojan), Renaldo (Edo), Rukni, Aulian, Tanjung, Elis, Firman, Gom-gom, Rio, Zainal (Zein), Ridho, Tatang, Tari, terimakasih atas kebersamaan, bantuan, dukungandan persaudaraan kita selama ini.
11. Seseorang yang spesial “panda” yang telah memberikan dukungan, semangat serta telah membantu selama penelitian.
12. Mbak Melisha, Mbak Yola, Kak Mustawa dan Abang Adit yang telah membantu dan memberikan semangat selama penelitian.
13. Semua pihak yang tidak dapat disebutkan satu persatu yang telah banyak membantu dalam penyelesaian skripsi ini, terimakasih atas bantuan dan dukungannya.
Penyusun menyadari dalam pembuatan dan penyusunan skripsi ini masih jauh dari kesempurnaan. Oleh karena itu kritik dan saran yang membangun sangat diharapkan untuk kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat bagi kita semua.
Bandar Lampung, 21 Desember 2016 Penyusun
i DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... iii
DAFTAR LAMPIRAN ... iv I. PENDAHULUAN 1.1 Latar Belakang ... 1 1.2 Tujuan Penelitian ... 2 1.3 Manfaat Penelitian ... 2 1.4 Kerangka Pikir ... 2 1.5 Hipotesis ... 5
II. METODE PENELITIAN 2.1 Waktu dan Tempat ... 6
2.2 Alat dan Bahan ... 6
2.3 Prosedur Penelitian 2.3.1 Persiapan Alat dan Bahan ... 7
2.3.2 Persiapan Media Kultur Zooxanthellae ... 7
2.3.3 Kultur Zooxanthellae ... 9
2.4 Rancangan Penelitian ... 9
2.5 Pengukuran Kandungan Klorofil ... 10
2.6 Pengukuran Kualitas Air ... 11
2.7 Analisis Data ... 11
III. HASIL DAN PEMBAHASAN 3.1Pengaruh Intensitas Cahaya Terhadap Kandungan Klorofil-a Zooxanthellae ... 12
3.2Pengaruh Intensitas Cahaya Terhadap Kandungan Klorofil-c Zooxanthellae ... 17
3.3Parameter Kualitas Air ... 22
IV. KESIMPULAN DAN SARAN 4.1Kesimpulan ... 25
4.2Saran ... 25 DAFTAR PUSTAKA
ii DAFTAR TABEL
Tabel Halaman
1. Alat penelitian ... 6
2. Bahan penelitian ... 7
3. Komposisi kimia media kultur zooxanthellae ... 8
4. Komposisi pupuk conwy ... 8
5. Koefisien persamaan regresi antara konsentrasi klorofil-a (Y) terhadap waktu kultur (X) pada intensitas cahaya yang berbeda ... 16
6. Koefisien persamaan regresi antara konsentrasi klorofil-c (Y) terhadap waktu kultur (X) pada intensitas cahaya yang berbeda ... 20
7. Hasil kualitas air selama kultur zooxanthellae ... 22
iii DAFTAR GAMBAR
Gambar Halaman
1. Diagram kerangka pikir penelitian ... 4
2. Tata letak perangkat penelitian ... 10
3. Struktur klorofil-a... 12
4. Konsentrasi klorofil-a pada zooxanthellae ... 13
5. Ilustrasi uji lanjut beda nyata terkecil (BNT) klorofil-a... 17
6. Struktur klorofil-c... 18
iv DAFTAR LAMPIRAN
Lampiran Halaman 1. Rata-rata±STDEV, kisaran konsentrasi (µg) dantotal konsentrasi (µg)
klorofil-a zooxanthellae ... 31
2. Rata-rata±STDEV, kisaran konsentrasi (µg) dantotal konsentrasi (µg) klorofil-c zooxanthellae ... 32
3. Hasil analisis statistik kandungan klorofil-a zooxanthellae ... 33
4. Hasil analisis statistik kandungan klorofil-c zooxanthellae ... 35
5. Perhitungan lux ke watt ... 36
6. Gambar alat dan bahan penelitian ... 37
1
I. PENDAHULUAN
1.1 Latar Belakang
Terumbu karang Indonesia sangat beraneka ragam dan memegang peranan yang sangat penting dalam menjaga keseimbangan lingkungan laut. Indonesia memiliki luas terumbu karang sekitar 16% dari terumbu karang dunia (lebih dari 39.500 km2). Terumbu karang Indonesia memiliki keanekaragaman hayati yang paling banyak di dunia, dengan 590 spesies karang keras yang mewakili lebih dari 95% jumlah spesies yang tercatat di Pusat Segitiga Terumbu Karang (Veron et al., 2009). Selain itu, terdapat populasi ikan dan biota laut lain yang banyak dan beraneka ragam, sedikitnya tercatat 2.200 spesies ikan karang berada di perairan Indonesia (Allen & Erdmann, 2012). Terumbu karang adalah salah satu ekosistem laut yang memiliki manfaat sebagai sumber makanan, habitat berbagai jenis biota komersial, menyokong industri pariwisata, dan sebagai penghalang terjangan ombak dan erosi pantai (Westmacott et al., 2000). Namun, terumbu karang Indonesia sudah banyak mengalami kerusakan, data terbaru menunjukkan hanya 5,32% terumbu karang indonesia tergolong sangat baik, sekitar 27,20% berkondisi baik, 37,42% berkondisi cukup dan 30,07% berada dalam kondisi buruk (LIPI, 2014).
Terumbu karang sangat rentan terhadap perubahan lingkungan yang salah satunya diakibatkan oleh faktor alam seperti pemanasan global. Pemanasan global yang semakin meningkat mengakibatkan perubahan iklim yang ekstrem dan peningkatan intensitas cahaya, sehingga menyebabkan terumbu karang banyak mengalami kerusakan. Kerusakan terumbu karang ditandai dengan perubahan warna karang yang sebelumnya cerah perlahan menjadi memudar bahkan putih (bleaching) (Suharsono, 1998). Peristiwa bleaching merupakan pemutihan karang yang disebabkan keluarnya zooxanthellae dari tubuh hewan karang atau mulai berkurangnya konsentrasi pigmen fotosintesis pada zooxanthellae (Donner et al., 2005). Zooxanthellae merupakan alga simbiotik yang hidup di dalam karang yang berasal dari genus Symbiodinium (Thomas, 1997). Zooxanthellae berada di dalam
2 sel bagian dalam gastrodermis karang dan tersebar di seluruh koloni, serta berwarna kekuningan hingga kecoklatan (Ried et al., 2011).
Pigmen fotosintesis yang ada pada zooxanthellae, salah satunya klorofil. Klorofil pada zooxanthellae ada dua yaitu, klorofil-a dan -c. Salah satu faktor yang mempengaruhi kandungan klorofil pada zooxanthellae adalah cahaya, yang meliputi intensitas cahaya. Intensitas cahaya memiliki peranan penting dalam proses fotosintesis, karena berhubungan dengan jumlah energi yang diterima oleh zooxanthellae untuk melakukan fotosintesis.
Tingginya intensitas cahaya yang diserap pigmen klorofil akan merusak klorofil itu sendiri dan membuat terhambatnya proses fotosintesis (fotoinhibisi) (Pulz, 2001). Sedangkan intensitas cahaya yang terlalu rendah menjadi pembatas bagi proses fotosintesis. Oleh karena itu, perlu dilakukan penelitian tentang pengaruh intensitas cahaya terhadap kandungan klorofil-a dan -c pada zooxanthellae.
1.2 Tujuan Penelitian
Tujuan penelitian yaitu mengetahui pengaruh intensitas cahaya yang berbeda terhadap kandungan klorofil -a dan –c pada zooxanthellae.
1.3 Manfaat Penelitian
Manfaat penelitian yaitu dapat diperoleh informasi mengenai kandungan klorofil-a dan -c zooxanthellae pada intensitas cahaya yang berbeda dan diharapkan zoaxanthellae dapat dikultur dalam skala laboratorium.
1.4 Kerangka Pikir
Ekosistem terumbu karang merupakan ekosistem yang banyak memiliki manfaat untuk keseimbangan perairan laut. Terumbu karang memiliki nilai ekonomis kerena dapat dijadikan hewan pengisi aquarium yang indah sebab karang memiliki warna yang menarik dan bentuk yang unik. Selain itu terumbu karang berfungsi sebagai habitat berbagai jenis biota komersial, menyokong
3 industri pariwisata, dan sebagai penghalang terjangan ombak serta erosi pantai (Westmacott et al., 2000).
Kerusakan terumbu karang dapat disebabkan oleh aktivitas alam yaitu pemanasan global. Pemanasan global dapat menyebabkan perubahan pola iklim dan peningkatan intensitas cahaya. Hal tersebut dapat membuat terumbu karang banyak mengalami bleaching. Jika semakin banyak karang yang mengalami bleaching, maka populasi karang akan semakin berkurang. Sebab bleaching dapat meyebabkan karang menjadi mati. Bleaching terjadi karena pigmen fotosintesis dari zooxanthellae mulai berkurang. Untuk mengurangi ancaman tersebut dapat dilakukan dengan budidaya karang, tetapi terlebih dahulu melakukan kultur alga simbion zooxanthellae. Hal tersebut dilakukan karena kehadiran zooxanthellae sangat berpengaruh besar terhadap kelangsungan hidup dan pertumbuhan dari karang, hampir 90% hasil fotosintesis zooxanthellae dimanfaatkan oleh karang.
Zooxanthellae dapat melakukan fotosintesis karena memiliki pigmen klorofil. Pigmen klorofil pada zooxanthellae ada 2 yaitu klorofil-a dan -c. Kandungan pigmen klorofil, salah satunya dipengaruhi oleh cahaya, yang meliputi intensitas cahaya. Intensitas cahaya yang diterima zooxanthellae harus sesuai dengan kemampuan pigmen klorofil-a dan -c dalam menyerap cahaya, sehingga proses fotosintesis dapat berjalan dengan baik. Intensitas cahaya yang tidak sesuai akan membuat klorofil-a dan –c dalam melakukan fotosintesis menjadi terganggu, yang mengakibatkan suplay makanan untuk karang menjadi terhambat. Berdasarkan hal tersebut, perlu dilakukan penelitian tentang pengaruh intensitas cahaya terhadap kandungan klorofil-a dan –c pada zooxanthellae.
4 Gambar 1. Diagram kerangka pikir penelitian
Kerusakan Terumbu Karang
Perubahan Alam dan Aktivitas Manusia
Pemanasan Global
Perubahan Iklim
Penyinaran Lebih Lama
Peningkatan Intensitas Cahaya
Stres Simbion Zooxanthellae
Penurunan Pigmen Fotosintetik
Kultur zooxanthellae menggunakan Intensitas Cahaya Berbeda
Analisis Kandungan Klorofil –a dan –c Zooxanthellae
IC1(3800 Lux,20 W) IC2 (6250 Lux,40 W) ICK(7980 Lux,45 W)
Perubahan Warna Karang (Bleaching)
5 1.5 Hipotesis
Hipotesis yang akan digunakan dalam penelitian yaitu:
a. Pengaruh intensitas cahaya terhadap kandungan pigmen klorofil-a atau klorofil-c zooxanthellae (Anova)
H0=Intensitas cahaya tidak berpengaruh terhadap kandungan klorofil-a atau
klorofil-c pada zooxanthellae
H1=Intensitas cahaya berpengaruh terhadap kandungan klorofil-a atau
klorofil-c pada zooxanthellae
b. Pengaruh intensitas cahaya terhadap kandungan pigmen klorofil-a atau klorofil-c zooxanthellae (Uji Lanjut)
H0 = Tidak terdapat satu atau lebih intensitas cahaya yang memberikan
pengaruh terhadap kandungan klorofil-a atau klorofil-c pada zooxanthellae
H1 = Ada satu atau lebih intensitas cahaya yang memberikan pengaruh
6 II. METODE PENELITIAN
2.1 Waktu dan Tempat
Penelitian dilaksanakan pada bulan Juli-Agustus 2016, bertempat di Laboratorium Budidaya Perikanan, Program Studi Budidaya Perairan Fakultas Pertanian, Universitas Lampung.
2.2 Alat dan Bahan
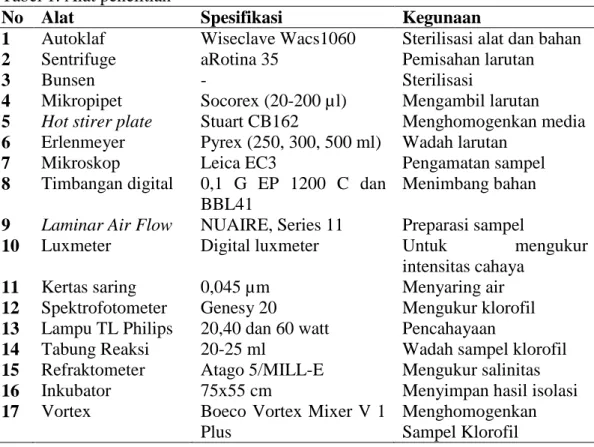
Alat dan bahan yang digunakan dalam penelitian (Tabel 1 dan Tabel 2). Tabel 1. Alat penelitian
No Alat Spesifikasi Kegunaan
1 Autoklaf Wiseclave Wacs1060 Sterilisasi alat dan bahan
2 Sentrifuge aRotina 35 Pemisahan larutan
3 Bunsen - Sterilisasi
4 Mikropipet Socorex (20-200 µl) Mengambil larutan 5 Hot stirer plate Stuart CB162 Menghomogenkan media 6 Erlenmeyer Pyrex (250, 300, 500 ml) Wadah larutan
7 Mikroskop Leica EC3 Pengamatan sampel
8 Timbangan digital 0,1 G EP 1200 C dan BBL41
Menimbang bahan 9 Laminar Air Flow NUAIRE, Series 11 Preparasi sampel
10 Luxmeter Digital luxmeter Untuk mengukur
intensitas cahaya
11 Kertas saring 0,045 µm Menyaring air
12 Spektrofotometer Genesy 20 Mengukur klorofil 13 Lampu TL Philips 20,40 dan 60 watt Pencahayaan
14 Tabung Reaksi 20-25 ml Wadah sampel klorofil
15 Refraktometer Atago 5/MILL-E Mengukur salinitas
16 Inkubator 75x55 cm Menyimpan hasil isolasi
17 Vortex Boeco Vortex Mixer V 1
Plus
Menghomogenkan Sampel Klorofil
7 Tabel 2. Bahan penelitian
No Bahan Kegunaan
1 Air laut steril Pembuatan media
2 Thiamine (B7) Meningkatkan pertumbuhan zooxanthellae 3 Pupuk conwy Sumber nutrien bagi zooxanthellae
4 Biotine (B1) Meningkatkan pertumbuhan zooxanthellae
5 NaNO3 Meningkatkan pertumbuhan zooxanthellae
6 NaH2PO4 Meningkatkan pertumbuhan zooxanthellae
7 Antibiotik (Kanamycin, Amoxsan, Streptomycin)
Penghambat pertumbuhan biokontaminasi 8 Karang Lunak Zoanthus sp. Host zooxanthellae
9 Alkohol 70% Sterilisasi
10 Aquades Pembuatan media
11 Aseton 90% Ekstrak klorofil
2.3 Prosedur Penelitian
2.3.1 Persiapan Alat dan Bahan
Tahap awal dari pembuatan media kultur zooxanthellae dimulai dengan mempersiapkan alat dan bahan yang akan digunakan. Persiapan alat dan bahan yang dilakukan dalam penelitian meliputi sterilisasi basah, fisik, perebusan dan UV. Sterilisasi dengan UV digunakan untuk air laut. Air laut yang digunakan berasal dari PT. Central Proteina Prima (CPP), Lampung Selatan yang terlebih dahulu di UV. Sterilisasi basah yaitu strelisasi dengan menggunakan autoklaf. Botol kultur berukuran 500 ml dan air laut dimasukkan kedalam autoklaf pada suhu 1210C selama 15 menit dengan tekanan 1 atm.
Selanjutnya sterilisasi dengan perebusan yaitu air laut dan selang aerasi. Air laut direbus sampai mendidih dan disaring menggunakan kertas saring, sedangkan selang aerasi direbus kemudian dikeringkan. Sterilisasi fisik dilakukan dengan menggunakan alkohol 70% dan alat-alat yang disterilisasi dengan menggunakan alkohol yaitu pipet tetes, tabung ukur 15 ml, laminar air flow serta dilakukan di ruang steril.
2.3.2 Persiapan Media Kultur Zooxanthellae
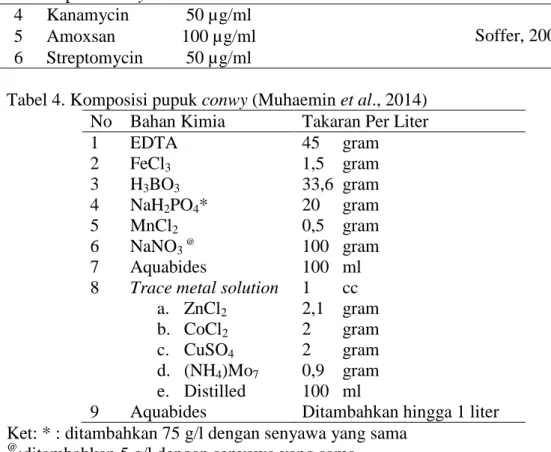
Media kultur merupakan media air laut yang diperkaya dengan pupuk conwy, biotin, thiamine, NaNO3, NaH2PO4 serta penambahan antibiotik
8 kanamycin, amoxsan, dan streptomycin (Tabel 3). Penambahan pupuk conwy digunakan sebagai sumber nutrien untuk pertumbuhan bagi zooxanthellae, karena pupuk conwy terbuat dari beberapa bahan dan trace element (Tabel 4). Penambahan antibiotik juga digunakan untuk membunuh bakteri atau mikroorganisme yang dapat menyebabkan kontaminasi pada saat kultur zooxanthellae. Hal tersebut berdasarkan hasil penelitian Soffer (2009) yang menjelaskan bahwa dengan mencampur ketiga jenis antibiotik kanamycin, amoxsan, dan streptomycin akan menghambat pertumbuhan biokontaminasi. Tabel 3. Komposisi kimia media kultur zooxanthellae
No Jenis Kimia Media (1L) Stok (g/950 ml Air Laut Tersaring)
Literatur
1 Biotin (B1) 10 ml 0,1 gram
Pujiono et al., 2010
2 Thiamine (B7) 200 mg -
3 Pupuk Conwy 1ml - Muhaemin et al.,2014
4 Kanamycin 50 µg/ml
Soffer, 2009
5 Amoxsan 100 µg/ml
6 Streptomycin 50 µg/ml
Tabel 4. Komposisi pupuk conwy (Muhaemin et al., 2014) No Bahan Kimia Takaran Per Liter
1 EDTA 45 gram 2 FeCl3 1,5 gram 3 H3BO3 33,6 gram 4 NaH2PO4* 20 gram 5 MnCl2 0,5 gram 6 NaNO3 @ 100 gram 7 Aquabides 100 ml
8 Trace metal solution 1 cc a. ZnCl2 2,1 gram
b. CoCl2 2 gram
c. CuSO4 2 gram
d. (NH4)Mo7 0,9 gram
e. Distilled 100 ml
9 Aquabides Ditambahkan hingga 1 liter Ket: * : ditambahkan 75 g/l dengan senyawa yang sama
@
:ditambahkan 5 g/l dengan senyawa yang sama
Pembuatan media untuk kultur zooxanthellae dimulai dengan menuang air laut steril kedalam botol kultur dengan salinitas 30 ppt sebanyak 400 ml. Selanjutnya air laut disterilisasi terlebih dahulu menggunakan autoklaf pada suhu
9 1210C selama 15 menit. Kemudian air laut ditambahkan dengan bahan-bahan pengkaya berupa pupuk conwy, biotine, thiamine, NaNO3, NaH2PO4, dan tiga
jenis antibiotik yaitu kanamycin, amoxsan dan streptomycin serta dihomogenkan menggunakan hot stirrer plate selama ±10 menit.
2.3.3 Kultur Zooxanthellae
1. Kultur zooxanthellae dimulai dengan mempersiapkan alat, bahan dan media yang akan digunakan. Selanjutnya dilakukan preparasi dengan menggunakan sampel karang lunak Zoanthus sp. yang diperoleh dari perairan Teluk Lampung. Sampel terlebih dahulu dicuci menggunakan air laut yang telah steril untuk menghilangkan kotoran yang menempel pada sampel karang, kemudian diambil bagian polip dan digerus menggunakan mortar dengan ditambahkan sedikit air laut steril.
2. Selanjutnya sampel yang telah digerus, kemudian disaring dengan menggunakan kertas saring dengan kerapatan 0,045 µm. Cairan yang didapat dari hasil penyaringan diamati dibawah mikroskop untuk mengetahui ada atau tidaknya zooxanthellae.
3. Inokulan zooxanthellae kemudian dimasukan kedalam media cair dan diberi perlakuan intensitas cahaya yaitu IC1 (3800 lux), IC2 (6250 lux), ICK (7980
lux) dan IC3 (11800 lux) sebanyak 5 ulangan selama 3 hari.
4. Selama waktu kultur dilakukan pengukuran klorofil -a dan -c setiap 6 jam dengan menggunakan spektrofotometer.
2.4 Rancangan Penelitian
Penelitian terdiri dari 4 perlakuan intensitas cahaya yang berbeda,yaitu IC1 (3800
lux), IC2 (6250 lux), ICk (7980 lux) dan IC3 (11800 lux) dengan masing-masing
10 (A) Tampak samping
(B)Tampak atas
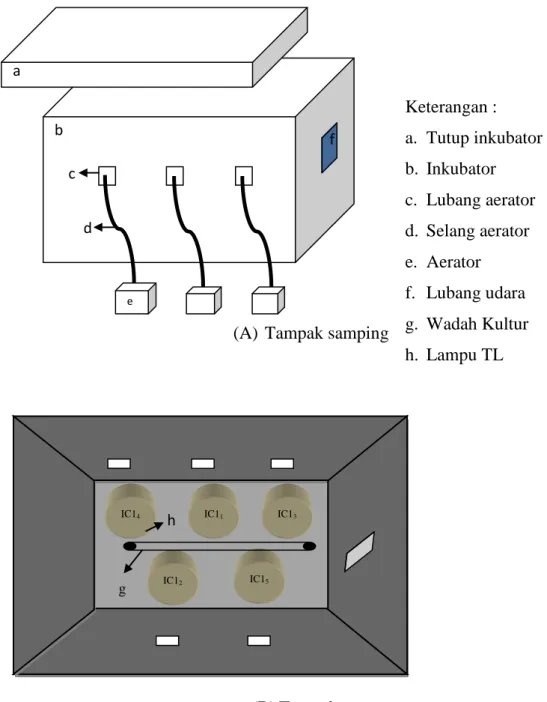
Gambar 2. Tata letak perangkat penelitian 2.5 Pengukuran Kandungan Klorofil
Tahap awal pengukuran klorofil -a dan -c yaitu:
Sebanyak 10 ml sampel kultur diambil, lalu dimasukkan ke dalam botol sampel dan disentrifugasi pada kecepatan 1000 rpm selama 15 menit hingga terbentuk dua lapisan yaitu supernatan dan endapan. Selanjutnya supernatan dibuang, yang tersisa hanya endapan. Endapan yang didapat diekstraksi dengan
b e a f c d Keterangan : a. Tutup inkubator b. Inkubator c. Lubang aerator d. Selang aerator e. Aerator f. Lubang udara g. Wadah Kultur h. Lampu TL IC14 IC15 IC12 IC13 IC11 g h
11 ditambahkan 10 ml aseton 90%, dan dihomogenkan dengan menggunakan vortex selama 1 menit. Sampel klorofil disimpan dalam ruangan gelap pada suhu -4°C minimal 24 jam. Selanjutnya sampel klorofil disentrifugasi pada kecepatan 1000 rpm selama 5 menit. Supernatan yang didapat kemudian diambil dan dimasukkan kedalam cuvet untuk diukur dengan menggunakan spektrofotometer pada panjang gelombang 630, 664 dan 750 nm. Selanjutnya klorofil-a dan –c dihitung dengan menggunakan rumus (Strychar dan Sammarco, 2012):
Klorofil -a = 11,85×(Abs 664 nm-Abs 750 nm) - 0,08×(Abs 630 nm-Abs 750 nm)
Klorofil -c = 24,52×(Abs 630 nm-Abs 750 nm) - 1,67×(Abs 664 nm-Abs 750 nm)
2.6 Pengukuran kualitas air
Parameter kualitas air yang diukur selama kultur zooxanthellae yaitu suhu, salinitas dan pH. Pengukuran kualitas air dilakukan secara bersamaan saat pengamatan sampel yang dilakukan setiap 6 jam sekali sebagai faktor pendukung dalam kultur zooxanthellae.
2.7 Analisis Data
Data klorofil-a dan -c yang didapat kemudian dianalisi dengan menggunakan uji analisis ragam atau Analysis of Variance (Anova) pada selang kepercayaan 95%. Apabila terdapat perbedaan yang nyata, maka analisis data dilanjutkan dengan menggunakan uji beda nyata terkecil (BNT) untuk mengetahui perbedaan antar perlakuan, sedangkan data parameter kualitas air dianalisis secara deskriptif.
25 IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Pemberian intensitas cahaya yang berbeda memberikan pengaruh terhadap kandungan klorofil-a, namun tidak memberikan pengaruh terhadap kandungan klorofil-c pada zooxanthellae. Klorofil-a lebih sensitif terhadap perubahan intensitas cahaya dibandingkan dengan klorofil-c, yang ditandai dengan terjadinya penurunan konsentrasi klorofil-a yang cukup cepat pada saat kultur.
4.2 Saran
Berdasarkan penelitian yang telah dilakukan, penulis menyarankan perlu adanya penelitian lebih lanjut mengenai kandungan karbohidrat, protein, lipid pada zooxanthellae.
26 DAFTAR PUSTAKA
Abu-Rezq, T., Al-Hooti, S., & Jacob, D. (2010). Optimum culture condition required the locally isolated Dunaliella salina. Journal Algal Biomass Utln, 1 (2), 12-19.
Allen, G. R., & Erdmann, M. V. (2012). Reef fishes of the east . (Ikan Karang di Hindia Timur. Jilid I-III). (Vols. 1-3). Perth, Australia: Reef fishes of the East Indies.
Alves, O. C., Oliveira, W. D., Ribeiro, S. M., Stringheta, P. C., & Galvão do Nascimento, A. (2014). Effect of light intensity on the production of pigments in Nostoc SPP. European Journal of Biology and Medical Science Research, 2 (1), 23-36.
Baggot, S. L., Davidson, I., Dore, C., Goodwin, J., Milne, R., Murrels, T. P., Rose, M., Waterson, J. D., & Underwood, B. (2003). Annual report for submission under the framework convention on climate change.UK Greenhouse Gas Inventory.
Brown, B., & Dunne, R. (2008). Solar radiation modulates bleaching and damage protection in a shallow water coral. Marine Ecology Progress Series, 362, 99-107.
Chrismadha, T., Panggabean, L. M., & Mardiati, Y. (2006). Pengaruh konsentrasi nitrogen dan fosfor terhadap pertumbuhan, kandungan protein, karbohidrat dan fikosianin pada kultur Spirulina fusiformis. Berita Biologi, 8 (3), 163-169.
Cole, S.L., & Jokiel, P. L. (1992). Effect of salinity on coral reefs. Pollution in tropical aquatic system. CRC Press Inc, London, 147-166.
Dring, M. J. (1992). The biology of marine plants. Australia: Press Syndicate of the University of Cambridge.
Donner, S. D., Kirving, W. J., Little, C. M., Oppenheimer, M., & Hoegh‐Guldberg, O. V. (2005). Global assessment of coral bleaching and required rates of adaptation under climate change. Global Change Biology, 11 (12), 2251-2265.
Glynn, P., & D'Croz, L. (1990). Experimental evidence for high temperature stress as the cause El Nino-Coincident coral mortality. Coral Reefs, 8, 181-192.
Gunawan. (2012). Pengaruh perbedaan pH pada pertumbuhan mikroalga kelas chlorophyta. Bioscientiae, 9, 62 – 65.
27 Hadikusumah. (2007). Variabilitas musiman temperature dan salinitas di teluk
Jakarta. LIPI , 33-41.
Henriksen, P., Riemann, B., Kaas, H., Sorensen, H. M., & Sorensen, H. L. (2002). Effects of nutrient-limitation and irradiance on marine phytoplankton pigments. Journal Of Plankton Research, 24 (9), 835-858.
Hill, R., E, K., Ulstrup, & Ralph, P. J. (2009). Temperature induced changes in thylakoid membrane thermostability of cultured, freshly isolated, and expelled zooxanthellae from Scleractiniancorals. Bulletin Of Marine Science, 85 (3), 223–244.
Inoue, S., Ejima, K., Iwai, E., Hayashi, H., Appel, J., & Tyystjärvi, E. (2011). Protection by α-tocopherol of the repair of photosystem II during photoinhibition in Synechocystis sp. PCC 6803. Biochim. Biophys. Acta., 1807, 236-241.
Kuczynska, P., Jemiola-Rzeminska, M., & Strzalka, K. (2015). Photosynthetic pigments in diatoms. Marine Drugs, 13, 5847-5881.
Lavens, P., & Sorgeloos, P. (1996). Manual on the production and use of live food for aquaculture. FAO Technical Paper, 361, 10-15.
LIPI. (2014). Kondisi terumbu karang di Indonesia (%) 1184 Lokasi. http://www.Coremap.or.id/Kondisi-TK.
Macintyre, H. L., & Kana, T. M. (2002). Photoacclimation of photosynthesis irradiance response curves and photosynthetic pigments in microalgae and cyanobacteria. J. Phycol, 38, 17-38.
Malensang, J., Komaling, H., & Hatidja, D. (2012). Pengembangan model regresi polinomial berganda pada kasus data pemasaran. Jurnal Ilmiah Sains, 12 (2), 149-152.
Muhaemin, M., Practica, F., Rosi, D. S., & Tri, A. (2014). Starvasi nitrogen dan pengaruhnya terhadap biomassa dan proteintotal Nannochloropsis sp. Maspari Journal, 6 (2), 98-103.
Nixon, P. J., Barker, M., Boehm, M., Vrie, R. d., & Komenda, J. (2005). FtsH-mediated repair of the photosystem II complex in response to light stress. Journal of Experimental Botany, 56 (411), 357–363.
Osinga, R., & Janssen, M. (2008). The role of light in coral physiology and its implications for coral husbandry. Burgers’ Zoo Arnhem the Netherlands, 2, 173-183.
28 Pujiono, W. P., Dedi, S., Neviaty, P. Z., & Harpasis, S. S. (2010). Model kehidupan zooxanthellae dan penumbuhan massalnya pada media binaan. Jurnal Saintek Perikanan, 6 (1), 46-54.
Pulz, O. (2001). Photobioreactors: production systems for phototrophic microorganisms. Applied microbiology and biotechnology, 57 (3), 287-293. Reid, C. S., Marshall, J., Logan, D., & Kleine, D. (2011). Terumbu karang dan
perubahan iklim : Panduan pendidikan dan pembangun kesadartahuan. Australia: CoralWatch, The University of Queensland.
Seepratoomrosh, J., Pokethitiyook, P., Meetam, M., Yokthongwattana, K., Yuan, W., & Pugkaew, W. (2015). The effect of light stress and other culture conditions on photoinhibition and gowth of Dunaliella tertiolecta. Appl Biochem Biotechnol, 178 (2), 396-407.
Shibata, K., & Haxo, F. T. (1969). Light transmission and spectral distribution through epi-and endozoic algal layers in the brain coral, Favia. The Biological Bulletin, 136 (3), 461-468.
Soffer, N. (2009). Practical applications for Symbiodinium grown on solid media: Culturing, Fluorometry and Transformations. University of Miami.
Steen, R., & Muscatine, L. (1987). Low temperature evokes rapid exocytosis of symbiotic algae by a sea anemone. Biol Bull, 172, 246-263.
Strychar, K. B., & Sammarco, P. W. (2012). Effects of heat stress on phytopigments of zooxanthellae (Symbiodinium spp.) symbiotic with the corals Acropora hyacinthus, Porites solida, and Favites complanata. International Journal of Biology, 4 (1), 3.
Suharsono. (1998). Condition of coral reef resource in Indonesia. Jurnal Pesisir dan Lautan, 1 (2), 44-52.
Tandeau, M. N., & Houmard, J. (1993). Adaptation of cyanobacteria to environmental stimuli: new steps toward molecular mechanisms. FEMS Microbiol., 104 (1-2), 119–189.
Thomas, C. R. (1997). Identifying marine phytoplankton. San Diego California: Academic Press.
Venn, A. A., Wilson, M. A., Trapido-rosenthal, H. G., Keely, B. J., & Douglas, A.E. (2006). The impact of coral bleaching on the pigment profile of the symbiotic alga, Symbiodinium. Plant, Cell & Environment, 29, 2133-2142.
29 Veron, J. E. N., Devantier, L. M., Turak, E., Green, A. L., Kininmonth, S., Stafford-Smith, M., & Peterson, N. (2009). Delineating the coral triangle. Galaxea, Journal of Coral Reef Studies, 11 (2), 91-100.
Westmacott, S., Teleki, K., Wells, S., & West, J. (2000). Pengelolaan terumbu karang yang telah memutih dan rusak kritis. Oxford.: Diterjemahkan oleh Jan Hanning Steffen IUCN, Gland, Switzerland and Cambridge, Inggris Information Press.
Wurl, O. (2009). Practical guidelines for the analysis of seawater. Canada: CRC Press.
Zhang, T., Gong, H., Wen, X., & Lu, C. (2010). Salt stress induces a decrease in excitation energy transfer from phycobilisomes to photosystem II but an increase to photosystem I in the cyanobacterium Spirulina platensis. Journal of Plant Physiology, 167, 951-958.