RENCANA PELAKSANAAN PEMBELAJARAN (RPP) RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
Sekolah
Sekolah
:
: SMA
SMA Negeri
Negeri 6
6 Palembang
Palembang
Mata
Mata Pelajaran
Pelajaran
:
: Kimia
Kimia
Kelas/Sem
Kelas/Semester
ester
:
: XI
XI /
/ Ganjil
Ganjil
Materi
Materi Pokok
Pokok
:
: Laju
Laju Reaksi
Reaksi
Alokasi
Alokasi Waktu
Waktu
:
: 12
12 JP
JP x
x 45
45 menit
menit (6
(6 x
x pertemuan)
pertemuan)
A.A. KOMPETENSI INTIKOMPETENSI INTI Kompetensi Sikap :
Kompetensi Sikap :
Menghayati dan mengamalkan ajaran agama yang dianutnya, serta menunjukkan
Menghayati dan mengamalkan ajaran agama yang dianutnya, serta menunjukkan
perilaku
perilaku jujur,
jujur, disiplin,
disiplin, tanggung
tanggung jawab,
jawab, peduli
peduli (gotong
(gotong royong,
royong, kerja
kerja sama,
sama, toleran,
toleran, damai),
damai),
santun,
santun, responsif,
responsif, dan
dan pro-aktif
pro-aktif sebagai
sebagai bagian
bagian dari
dari solusi
solusi atas
atas berbagai
berbagai permas
permasalahan
alahan dalam
dalam
berinteraksi
berinteraksi secara efektif dengan
secara efektif dengan lingkungan sosial
lingkungan sosial dan
dan alam serta
alam serta menem
menempatkan diri
patkan diri sebagai
sebagai
cerminan bangsa dalam pergaulan dunia
cerminan bangsa dalam pergaulan dunia
KI-3KI-3
: Memahami, menerapkan, menganalisis dan mengevaluasi pengetahuan faktual, konseptual,
: Memahami, menerapkan, menganalisis dan mengevaluasi pengetahuan faktual, konseptual,
prosedural,
prosedural, dan
dan metak
metakognitif
ognitif berdasark
berdasarkan
an rasa
rasa ingin
ingin tahunya
tahunya tentang
tentang ilmu
ilmu pengetah
pengetahuan,
uan,
teknologi
teknologi, seni,
, seni, budaya, dan
budaya, dan humaniora dengan
humaniora dengan wawasan kemanusiaan,
wawasan kemanusiaan, kebangsaan,
kebangsaan,
kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan
kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan
pengetahua
pengetahuan
n prosedural
prosedural pada
pada bidang
bidang kajian
kajian yang
yang spesifik
spesifik sesuai
sesuai dengan
dengan bakat
bakat dan
dan minatny
minatnyaa
untuk memecahkan masalah
untuk memecahkan masalah
KI-4:KI-4:
Mengolah, menalar, menyaji, dan mencipta dalam ranah konkret dan ranah abstrak terkait
Mengolah, menalar, menyaji, dan mencipta dalam ranah konkret dan ranah abstrak terkait
dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri serta bertindak secara
dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri serta bertindak secara
efektif dan kreatif, dan mampu menggunakan metoda sesuai kaidah keilmuan
efektif dan kreatif, dan mampu menggunakan metoda sesuai kaidah keilmuan
B.B. KOMPETENSI DASAR DAN INDIKATOR PENCAPAIAN KOMPETENSIKOMPETENSI DASAR DAN INDIKATOR PENCAPAIAN KOMPETENSI
KD3
KD4
KD3
KD4
3.6
3.6 Menjelaskan
Menjelaskan faktor-faktor
faktor-faktor yang
yang memengaruhi
memengaruhi
laju reaksi menggunakan teori tumbukan
laju reaksi menggunakan teori tumbukan
4.6 Menyajikan hasil penelusuran
4.6 Menyajikan hasil penelusuran
informasi cara-cara pengaturan dan
informasi cara-cara pengaturan dan
penyimpana
penyimpanan
n bahan
bahan untuk
untuk menceg
mencegah
ah
perubahan
perubahan fisika
fisika dan
dan kimia
kimia yang
yang tak
tak
terkendali
terkendali
3.7
3.7 Menentukan
Menentukan orde
orde reaksi
reaksi dan
dan tetapan
tetapan laju
laju
reaksi berdasarkan data hasil
reaksi berdasarkan data hasil percobaan
percobaan
4.7
Merancang,
melakukan,
dan
4.7
Merancang,
melakukan,
dan
menyimpulkan serta menyajikan hasil
menyimpulkan serta menyajikan hasil
percobaan
percobaan
faktor-faktor
faktor-faktor
yang
yang
mempengaruhi laju reaksi dan orde
mempengaruhi laju reaksi dan orde
reaksi
reaksi
IPK
IPK
IPK
IPK
3.6.1
3.6.1
Menjelaska
Menjelaskan pengertian laju
n pengertian laju reaksi
reaksi
3.6.2
3.6.2
Menjelaska
Menjelaskan terjadinya r
n terjadinya reaksi kimia
eaksi kimia
berdasarka
berdasarkan teori tumbuk
n teori tumbukan
an
4.6.1
4.6.1
Menyajikan hasil diskusi tentang
Menyajikan hasil diskusi tentang
terjadinya reaksi kimia
terjadinya reaksi kimia
berdasark
berdasarkan teori tumbuk
an teori tumbukan
an
3.7.
Menyebutkan
4
faktor-faktor
yang
3.7.
Menyebutkan
4
faktor-faktor
yang
mempe
mempengaruhi laju
ngaruhi laju reaksi
reaksi
3.7.2
3.7.2
Menentukan orde reaksi
Menentukan orde reaksi
3.7.3
3.7.3
Menentukan konstanta laju dan persamaan
Menentukan konstanta laju dan persamaan
laju reaksi
laju reaksi
4.7.1
4.7.1
Merancang percobaan untuk
Merancang percobaan untuk
menentuka
menentukan
n konsentrasi, luas
konsentrasi, luas
permuka
permukaan bidang sentuh,
an bidang sentuh, dan
dan
suhu terhadap laju reaksi.
suhu terhadap laju reaksi.
4.7.2
4.7.2
Melakukan
Melakukan
percobaan
percobaan
untuk
untuk
menentuka
menentukan
n pengaruh konsentrasi,
pengaruh konsentrasi,
luas permukaan bidang sentuh,
luas permukaan bidang sentuh,
dan suhu terhadap laju reaksi
dan suhu terhadap laju reaksi
Melalui model pembelajaran
Melalui model pembelajaran discovery learning
discovery learning dengan menggali informasi dari berbagai sumber
dengan menggali informasi dari berbagai sumber
belajar, penye
belajar, penyelidikan sederha
lidikan sederhana dan mengolah info
na dan mengolah informasi, diharapkan sisw
rmasi, diharapkan siswa terlibat aktif selam
a terlibat aktif selama proses
a proses
belajar
belajar mengaja
mengajar
r berlangsu
berlangsung,
ng, memiliki
memiliki sikap
sikap ingin
ingin tahu,
tahu, teliti
teliti dalam
dalam melakuka
melakukan
n pengama
pengamatan
tan dan
dan
bertanggung jawab
bertanggung jawab dalam menyampaikan pendapat, menjawab pertanyaan, memberi saran dan kritik,
dalam menyampaikan pendapat, menjawab pertanyaan, memberi saran dan kritik,
dan menganalisis faktor-faktor yang memengaruhi laju reaksi menggunakan teori tumbukan,
dan menganalisis faktor-faktor yang memengaruhi laju reaksi menggunakan teori tumbukan,
menentukan orde reaksi dan tetapan laju reaksi berdasarkan data hasil percobaan, menyajikan hasil
menentukan orde reaksi dan tetapan laju reaksi berdasarkan data hasil percobaan, menyajikan hasil
penelusuran
penelusuran informasi
informasi cara-c
cara-cara
ara pengaturan
pengaturan dan
dan penyimpa
penyimpanan
nan bahan
bahan untuk
untuk menceg
mencegah
ah perubahan
perubahan
fisika dan kimia yang tak terkendali, serta merancang, melakukan, dan menyimpulkan serta
fisika dan kimia yang tak terkendali, serta merancang, melakukan, dan menyimpulkan serta
menyajika
menyajikan hasil
n hasil percobaan faktor-fak
percobaan faktor-faktor yang
tor yang mempe
mempengaruhi laju reaksi
ngaruhi laju reaksi dan orde reaksi.
dan orde reaksi.
D.
D. MATERI MATERI PEMBELAJARAPEMBELAJARANN o
o
Fakta
Fakta
Kemolaran, konsep laju reaksi, faktor-faktor yang mempengaruhi laju reaksi, persamaan
Kemolaran, konsep laju reaksi, faktor-faktor yang mempengaruhi laju reaksi, persamaan
laju reaksi, dan teori tumbukan.
laju reaksi, dan teori tumbukan.
oo
Konsep
Konsep
Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau
Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau
bertambahnya jumlah hasil reaksi untuk setiap satuan
bertambahnya jumlah hasil reaksi untuk setiap satuan waktu.
waktu.
Faktor-faktor yang mempengaruhi laju reaksi adalah luas permukaan, konsentrasi, suhu dan
Faktor-faktor yang mempengaruhi laju reaksi adalah luas permukaan, konsentrasi, suhu dan
katalis.
katalis.
Semakin besar konsentrasi pereaksi, semakin banyak jumlah partikel pereaksi sehingga
Semakin besar konsentrasi pereaksi, semakin banyak jumlah partikel pereaksi sehingga
semakin besar peluang
semakin besar peluang
terjadinya tumbukan.
terjadinya tumbukan.
Semakin luas permukaan, semakin besar
Semakin luas permukaan, semakin besar peluang terjadinya tumbukan antar-pereaksi.
peluang terjadinya tumbukan antar-pereaksi.
Pada suhu tinggi, partikel-partikel yang terdapat dalam suatu zat akan bergerak (bergetar)
Pada suhu tinggi, partikel-partikel yang terdapat dalam suatu zat akan bergerak (bergetar)
lebih cepat daripada suhu rendah.
lebih cepat daripada suhu rendah.
oo
Prinsip
Prinsip
Rumus kemolaran :
Rumus kemolaran :
=
=
dengan
dengan :
:
M
M =
= kemolaran
kemolaran (mol/L)
(mol/L)
n = jumlah zat terlarut (mol)
n = jumlah zat terlarut (mol)
V = volume larutan (L)
V = volume larutan (L)
Rumus kemolaran dengan kadar larutan
Rumus kemolaran dengan kadar larutan
=
=
10
10
dengan
dengan :
:
M
M
=
= kemolaran
kemolaran larutan
larutan (mol/L)
(mol/L)
ρρ
= jumlah zat terlarut (mol)
= jumlah zat terlarut (mol)
kadar
kadar =
= %
% massa
massa
m
m
mm=
= massa
massa molar
molar (g/mol)
(g/mol)
Rumus pengenceran larutan
Rumus pengenceran larutan
V
V
11M
M
11= V
= V
22M
M
22dengan
dengan :
:
V
V
11M
M
11= jumlah
= jumlah mol zat terlarut sebelum pengenceran
mol zat terlarut sebelum pengenceran
V
Rumus laju reaksi
pA + qB → rCv = k [A]
m[B]
ndengan : v
= laju reaksi (mol dm
-3det
-1)
k
= tetapan laju reaksi
m
= orde reaksi terhadap A
n
= orde reaksi terhadap B
[A]
= konsentrasi awal A (mol/dm
3)
[B]
= konsentrasi awal B (mol/dm
3)
o
Prosedur
Langkah-langkah melakukan percobaan sederhana tentang laju reaksi
E. METODE PEMBELAJARAN1. Pendekatan
: Scientific Learning
2. Model
: Discovery learning
3. Metode
: Diskusi , tanya jawab, dan penugasan
F. MEDIA/ALAT/BAHAN1.
White board dan spidol
2.
Laptop
3.
LCD
G. SUMBER BELAJAR
Watoni, AH. 2014. KIMIA untuk SMA/MA Kelas XI Kelompok Peminatan Matematika dan
Ilmu- Ilmu Alam. Bandung : Yrama Widya
Internet
H. LANGKAH-LANGKAH PEMBELAJARAN Pertemuan Pertama
No
Tahap
Kegiatan
Estimasi
Waktu
1
Pendahuluan
Guru mengucapkan salam, melihat kondisi ruang kelas
Salah satu siswa memimpin doa untuk menciptakan
suasana religius di dalam kelas (religius)
Menyanyikan lagu wajib nasional
Guru mengabsen siswa
Guru menanya pelajaran sebelumnya
Guru menyampaikan kompentesi dasar dan tujuan
materi yang akan di pelajari
Guru menyampaikan cakupan materi yang akan di
sampaikan
10’
2
Inti
Stimulus
Peserta didik diberikan rangsangan untuk memusatkan pada materi seperti membaca buku yang berhubungan dengan pengertian laju reaksi (literasi), lalu guru memberikan stimulus berupa tayangan gambar (disiplin)
Waktu
Roti berjamur
Kembang api
Identifikasi masalah
Guru memberikan kesempatan peserta didik untuk
menanyakan tentang gambar yang ditayangkan, dan
menanyakan mana yang termasuk reaksi cepat dan
reaksi lambat (rasa ingin tahu) ,
Pengumpulan data
Guru memberikan kesempatan kepada peserta
didik untuk mengumpulkan informasi yang relevan
dari membaca literatur
(literasi)
tentang
pengertian laju reaksi
Pengolahan data
Dengan membaca literatur/bahan ajar (literasi),
mengerjakan
soal
yang
berkaitan
dengan
pengertian laju reaksi
Pembuktian
Peserta didik melakukan pemeriksaan untuk
membuktikan benar atau tidaknya jawaban
mengenai pengertian laju reaksi (komunikasi)
Menarik Kesimpulan
Peserta didik bersama dengan guru menyimpulkan
tentang pengertian laju reaksi
3
Penutup
Pendidik menanyakan kembali kepada peserta didik
tentang kejelasan materi yang telah dipelajari.
Evaluasi
Pendidik memberikan pesan untuk mempelajari materi
yang akan dipelajari pada pertemuan selanjutnya yaitu
teori tumbukan
Berdoa dan memberi salam
Pertemuan Ke-dua
No
Tahap
Kegiatan
Estimasi
Waktu
1
Pendahuluan
Guru mengucapkan salam, melihat kondisi ruang kelas
Salah satu siswa memimpin doa untuk menciptakan
suasana religius di dalam kelas (religius)
Menyanyikan lagu wajib nasional
Guru mengabsen siswa
Guru menanya pelajaran sebelumnya
Guru menyampaikan kompentesi dasar dan tujuan
materi yang akan di pelajari
Guru menyampaikan cakupan materi yang akan di
sampaikan
10’
2
Inti
Memberi stimulus
Peserta didik diberikan rangsangan untuk memusatkan pada materi seperti membaca buku yang berhubungan dengan teori tumbukan (literasi), lalu guru memberikan stimulus berupa tayangan gambar (disiplin)
Identifikasi masalah
Guru memberikan kesempatan peserta didik untuk
menanyakan tentang gambar yang ditayangkan
(rasa ingin tahu)
Pengumpulan data
Guru memberikan kesempatan kepada peserta didik untuk mengumpulkan informasi yang relevan dari membaca literatur (literasi) tentang teori tumbukan, model teori tumbukan pada reaksi kimia
Pengolahan data
Dengan membaca literatur/bahan ajar (literasi), mengerjakan soal yang berkaitan dengan teori tumbukan, model teori tumbukan pada reaksi kimia
Pembuktian
Peserta didik melakukan pemeriksaan untuk membuktikan benar atau tidaknya jawaban mengenai teori tumbukan, model teori tumbukan pada reaksi kimia
Menarik Kesimpulan
Peserta didik bersama dengan guru menyimpulkan tentang teori tumbukan, model teori tumbukan pada reaksi kimia
60’
3
Penutup
Pendidik menanyakan kembali kepada peserta didik
tentang kejelasan materi yang telah dipelajari.
Evaluasi
Pendidik memberikan pesan untuk mempelajari materi
yang akan dipelajari pada pertemuan selanjutnya yaitu
Waktu
faktor yang mempengaruhi laju reaksi: konsentrasi,
suhu
Berdoa dan memberi salam
Pertemuan Ke-tiga
No
Tahap
Kegiatan
Estimasi
Waktu
1
Pendahuluan
Guru mengucapkan salam, melihat kondisi ruang kelas
Salah satu siswa memimpin doa untuk menciptakan
suasana religius di dalam kelas (religius)
Menyanyikan lagu wajib nasional
Guru mengabsen siswa
Guru menanya pelajaran sebelumnya
Guru menyampaikan kompentesi dasar dan tujuan
materi yang akan di pelajari
Guru menyampaikan cakupan materi yang akan di
sampaikan
10’
2
Inti
Memberi stimulus
Peserta didik diberikan rangsangan untuk memusatkan pada materi seperti membaca buku yang berhubungan dengan
faktor yang mempengaruhi laju reaksi:
konsentrasi, suhu
(literasi), lalu guru memberikan stimulus berupa tayangan gambar (disiplin)
Identifikasi masalah
Guru memberikan kesempatan peserta didik untuk
menanyakan tentang gambar yang ditayangkan
(rasa ingin tahu)
Pengumpulan data
Guru memberikan kesempatan kepada peserta didik untuk mengumpulkan informasi yang relevan dari membaca literatur (literasi) tentang
faktor yang
mempengaruhi laju reaksi: konsentrasi , faktor yang
mempengaruhi laju reaksi: suhu dan energi aktivasi
Pengolahan data
Dengan membaca literatur/bahan ajar (literasi), mengerjakan soal yang berkaitan dengan
faktor yang
mempengaruhi laju reaksi: konsentrasi , faktor yang
mempengaruhi laju reaksi: suhu dan energi aktivasi
Pembuktian
No
Tahap
Kegiatan
Estimasi
Waktu
Peserta didik melakukan pemeriksaan untuk membuktikan benar atau tidaknya jawaban mengenai
faktor yang mempengaruhi laju reaksi: konsentrasi ,
faktor yang mempengaruhi laju reaksi: suhu dan energi
aktivasi
Menarik Kesimpulan
Peserta didik bersama dengan guru menyimpulkantentang
faktor yang mempengaruhi laju
reaksi: konsentrasi dan suhu
3
Penutup
Pendidik menanyakan kembali kepada peserta didik
tentang kejelasan materi yang telah dipelajari.
Evaluasi
Pendidik memberikan pesan untuk mempelajari materi
yang akan dipelajari pada pertemuan selanjutnya yaitu
faktor
yang
mempengaruhi
laju
reaksi:
Luas
permukaan
Berdoa dan memberi salam
20’
Pertemuan Ke-empat
No
Tahap
Kegiatan
Estimasi
Waktu
1
Pendahuluan
Guru mengucapkan salam, melihat kondisi ruang kelas
Salah satu siswa memimpin doa untuk menciptakan
suasana religius di dalam kelas (religius)
Menyanyikan lagu wajib nasional
Guru mengabsen siswa
Guru menanya pelajaran sebelumnya
Guru menyampaikan kompentesi dasar dan tujuan
materi yang akan di pelajari
Guru menyampaikan cakupan materi yang akan di
sampaikan
10’
2
Inti
Memberi stimulus
Peserta didik diberikan rangsangan untuk memusatkan pada materi seperti membaca buku yang berhubungan dengan
faktor yang mempengaruhi laju reaksi: luas
permukaan
(literasi), lalu guru memberikan stimulusberupa tayangan gambar (disiplin)
Identifikasi masalah
Guru memberikan kesempatan peserta didik untuk
menanyakan tentang gambar yang ditayangkan
(rasa ingin tahu)
Pengumpulan data
Waktu
Guru memberikan kesempatan kepada peserta didik untuk mengumpulkan informasi yang relevan dari membaca literatur (literasi) tentang f
aktor yang
mempengaruhi laju reaksi: luas permukaan
Pengolahan data
Dengan membaca literatur/bahan ajar (literasi), mengerjakan soal yang berkaitan dengan
faktor yang
mempengaruhi laju reaksi: luas permukaan
Pembuktian
eserta didik melakukan pemeriksaan untuk membuktikan benar atau tidaknya jawaban mengenai
faktor yang mempengaruhi laju reaksi: luas permukaan
Menarik Kesimpulan
Peserta didik bersama dengan guru menyimpulkan tentang
faktor yang mempengaruhi laju reaksi: luas
permukaan
3
Penutup
Pendidik menanyakan kembali kepada peserta didik
tentang kejelasan materi yang telah dipelajari.
Evaluasi
Pendidik memberikan pesan untuk mempelajari materi
yang akan dipelajari pada pertemuan selanjutnya yaitu
faktor yang mempengaruhi laju reaksi: katalis , aplikasi
di industri
Berdoa dan memberi salam
20’
Pertemuan Ke-lima
No
Tahap
Kegiatan
Estimasi
Waktu
1
Pendahuluan
Guru mengucapkan salam, melihat kondisi ruang kelas
Salah satu siswa memimpin doa untuk menciptakan
suasana religius di dalam kelas (religius)
Menyanyikan lagu wajib nasional
Guru mengabsen siswa
Guru menanya pelajaran sebelumnya
Guru menyampaikan kompentesi dasar dan tujuan
materi yang akan di pelajari
Guru menyampaikan cakupan materi yang akan di
sampaikan
10’
2
Inti
Memberi stimulus
Peserta didik diberikan rangsangan untuk memusatkan pada materi seperti membaca buku yang berhubungan dengan
faktor yang mempengaruhi laju reaksi: katalis ,
aplikasi di industri
(literasi), lalu guru memberikan stimulus berupa tayangan gambar (disiplin)No
Tahap
Kegiatan
Estimasi
Waktu
Identifikasi masalah
Guru memberikan kesempatan peserta didik untuk
menanyakan tentang gambar yang ditayangkan
(rasa ingin tahu)
Pengumpulan data
Guru memberikan kesempatan kepada peserta didik untuk mengumpulkan informasi yang relevan dari membaca literatur (literasi) tentang
faktor yang
mempengaruhi laju reaksi : katalis , aplikasi di industri,
peran katalis dalam reaksi penguraian peroksida, peran
katalis dalam penguraian HCOOH, peran katalis dalam
reaksi adisi etena, peran katalis dalam industri
Pengolahan data
Dengan membaca literatur/bahan ajar (literasi), mengerjakan soal yang berkaitan dengan
faktor yang
mempengaruhi laju reaksi : katalis , aplikasi di industri,
peran katalis dalam reaksi penguraian peroksida, peran
katalis dalam penguraian HCOOH, peran katalis dalam
reaksi adisi etena, peran katalis dalam industri
Pembuktian
Peserta didik melakukan pemeriksaan untuk membuktikan benar atau tidaknya jawaban mengenai
faktor yang mempengaruhi laju reaksi: katalis , aplikasi
di industri
Menarik Kesimpulan
Peserta didik bersama dengan guru menyimpulkan tentang
faktor yang mempengaruhi laju reaksi: katalis ,
aplikasi di industry
3
Penutup
Pendidik menanyakan kembali kepada peserta didik
tentang kejelasan materi yang telah dipelajari.
Evaluasi
Pendidik memberikan pesan untuk mempelajari materi
yang akan dipelajari pada pertemuan selanjutnya yaitu
persamaan laju reaksi dan orde reaksi
Berdoa dan memberi salam
20’
Pertemuan Ke-enam
No
Tahap
Kegiatan
Estimasi
Waktu
1
Pendahuluan
Guru mengucapkan salam, melihat kondisi ruang kelas
Salah satu siswa memimpin doa untuk menciptakan
Waktu
suasana religius di dalam kelas (religius)
Menyanyikan lagu wajib nasional
Guru mengabsen siswa
Guru menanya pelajaran sebelumnya
Guru menyampaikan kompentesi dasar dan tujuan
materi yang akan di pelajari
Guru menyampaikan cakupan materi yang akan di
sampaikan
2
Inti
Memberi stimulus
Peserta didik diberikan rangsangan untuk memusatkan pada materi seperti membaca buku yang berhubungan dengan
persamaan laju reaksi dan orde reaksi
(literasi), lalu guru memberikan stimulus berupa tayangan gambar (disiplin)
Identifikasi masalah
Guru memberikan kesempatan peserta didik untuk
menanyakan tentang gambar yang ditayangkan
(rasa ingin tahu)
Pengumpulan data
Guru memberikan kesempatan kepada peserta didik untuk mengumpulkan informasi yang relevan dari membaca literatur (literasi) tentang
persamaan laju
reaksi dan orde reaksi
Pengolahan data
Dengan membaca literatur/bahan ajar (literasi), mengerjakan soal yang berkaitan dengan
persamaan laju
reaksi dan orde reaksi
Pembuktian
Peserta didik melakukan pemeriksaan untuk membuktikan benar atau tidaknya jawaban mengenai
persamaan laju reaksi dan orde reaksi
Menarik Kesimpulan
Peserta didik bersama dengan guru menyimpulkan tentang
persamaan laju reaksi dan orde reaksi
60’
3
Penutup
Pendidik menanyakan kembali kepada peserta didik
tentang kejelasan materi yang telah dipelajari.
Evaluasi
Pendidik memberikan pesan untuk mempelajari materi
yang akan dipelajari pada pertemuan selanjutnya yaitu
kesetimbangan kimia
Berdoa dan memberi salam
I.
PENILAIAN
1. Teknik Penilaian:
a. Penilaian Sikap
: Observasi/pengamatan/Jurnal
b. Penilaian Pengetahuan
: Tes Tertulis/Lisan/Penugasan
c.
Penilaian Keterampilan
: Praktik/Produk/Portofolio/Projek
2. Bentuk Penilaian:
a. Observasi
: Lembar pengamatan aktivitas peserta didik
b. Tes tertulis
: Uraian dan lembar kerja
c.
Unjuk kerja
: Lembar penilaian presentasi
d. Portofolio
: Penilaian laporan
3. Instrumen Penilaian (terlampir)
4. Remedial
a. Pembelajaran remedial dilakukan bagi peserta didik yang capaian KD nya belum tuntas
b. Tahapan pembelajaran remedial dilaksanakan melalui remidial teaching (klasikal), atau
tutor sebaya, atau tugas dan diakhiri dengan tes.
c.
Tes remedial, dilakukan sebanyak 2 kali (sesuai peraturan akademik sekolah) dan
apabila setelah 2 kali tes remedial belum mencapai ketuntasan, maka remedial dilakukan
dalam bentuk tugas tanpa tes tertulis kembali.
5. Pengayaan
Bagi peserta didik yang sudah mencapai nilai ketuntasan diberikan pembelajaran pengayaan
sebagai berikut:
Siwa yang mencapai nilai
n(ketuntasan )nn(maksimum)diberikan materi masih
dalam cakupan KD dengan pendalaman sebagai pengetahuan tambahan
Siwa yang mencapai nilai
nn(maksimum)diberikan materi melebihi cakupan KD
dengan pendalaman sebagai pengetahuan tambahan.
Palembang, Oktober 2018
Mengetahui,
Kepala Sekolah,
Guru Mata Pelajaran,
Hj. Maryati, S.Pd., M.M.
Sugiarsih, S.Pd
0 10 20 30 40 50 60 70 80 90 0 10 20 30 40 50 J u m l a h m o l e k u l Waktu (detik) mole moleku
BAHAN AJAR
LAJU REAKSI
A. Pengertian Laju Reaksi dan Penentuannya.
1. Pengertian Laju R eaksi
Istilah laju atau kecepatan sering dibicarakan dalam ilmu fisika, pengertian laju dalam reaksi sebenarnya sama dengan laju pada kendaraan yang bergerak, misalnya seseorang mengendarai sepeda motor sejauh 100 km ditempuh dalam waktu 2 jam. Orang tersebut mengendarai sepeda motor dengan kecepatan 50 km/jam. Kecepatan tersebut dapat diartikan bahwa setiap orang tersebut mengendarai kendaraannya selama 1 jam maka jarak yang ditempuh bertambah 50 km. Pernyataan tersebut juga dapat diartikan bahwa setiap orang tersebut mengendarai sepeda motornya selama 1 jam maka jarak yang harus ditempuh berkurang sejauh 50 km. Cara menghitung kecepatan demikian ini menghasilkan kecepatan rata-rata, karena selama mengendarai kendaraan mulai dari berangkat sampai tiba ditujuan tidak selalu mengendarai dengan laju 50 km/jam, tetapi ada kalanya berhenti, dipercepat atau diperlambat. Reaksi kimia menyangkut perubahan dari suatu pereaksi (reaktan) menjadi hasil reaksi atau produk, yang dinyatakan dengan persamaan reaksi :
Reaktan (pereaksi) → produk (hasil reaksi)
Seperti halnya pada contoh di atas, maka laju reaksi dapat dinyatakan sebagai berkurangnya jumlah reaktan untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi untuk setiap satuan waktu. Ukuran jumlah zat dalam reaksi kimia umumnya dinyatakan sebagai konsentrasi molar atau molaritas (M), dengan demikian maka laju reaksi menyatakan berkurangnya konsentrasi pereaksi atau bertambahnya konsentrasi zat hasil reaksi setiap satu satuan waktu (detik) . Satuan laju reaksi umumnya dinyatakan dalam satuan
mol dm
-3det
-1 ataumol/liter detik
. Satuan mol dm-3 atau molaritas( M ), adalah satuan konsentrasi larutan.
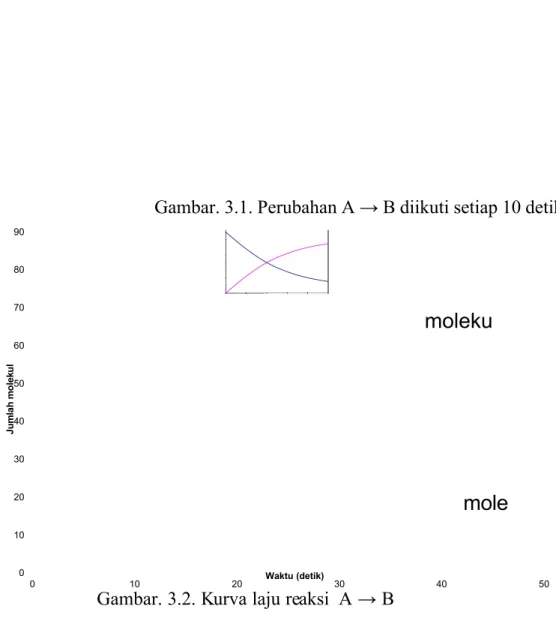
Gambar 3.1. menunjukkan suatu proses sederhana dari reaksi perubahan molekul A menjadi molekul B yang dinyatakan dengan persamaan reaksi :
A → B
Berkurangnya jumlah molekul A dan bertambahnya molekul B diikuti dengan selang waktu 10 detik. Dari gambar 3.1. tersebut tampak bahwa berkurangnya A dalam setiap selang waktu 10 detik mengakibatkan bertambahnya B, dengan demikian laju reaksi dapat dinyatakan :
Laju reaksi =
t A
atau laju reaksi =
t B
Tanda negatif dari A menunjukkan bahwa A berkurang, sedangkan B berharga positip karenma B bertambah.
Gambar. 3.1. Perubahan A → B diikuti setiap 10 detik
2. Stoikiometri L aju Reaksi
Terdapat hubungan stoikiometri antara laju reaksi yang diukur terhadap berkurangnya konsentrasi pereaksi dan bertambahnya konsentrasi hasil reaksi. Untuk reaksi A → B bila laju reaksi dinyatakan sebagai berkurangnya A setiap
satuan waktu - [A]/ t akan sama dengan laju reaksi yang dinyatakan berdasar bertambahnya B setiap satuan waktu [B]/ t sebab setiap sebuah molekul A berkurang maka akan menghasilkan sebuah molekul B.
Untuk reaksi yang memenuhi persamaan reaksi : 2 C → D
berarti setiap 2 molekul C yang berkurang setiap satuan waktu akan menghasilkan sebuah molekul D, dengan demikian laju reaksi yang diukur berdasarkan jumlah D yang dihasilkan akan setara dengan ½ dari laju reaksi yang diukur berdasar berkurangnya C dalam satuan waktu yang sama, atau laju reaksi = - ½ [C]/t = [D]/t
Secara umum untuk reaksi yang dinyatakan dengan persamaan reaksi : a A = bB → cC + dD berlaku, laju reaksi =
t D d 1 t C c 1 t B b 1 t A a 1 3. Penentuan L aju Reaksi.
Penentuan laju reaksi dapat dilakukan dengan cara fiisika atau dengan cara kimia. Dengan cara fisika penentuan konsentrasinya dilakukan secara tidak langsung, yaitu berdasar sifat-sifat fisis campuran yang dipengaruhi oleh konsentrasi campuran, misalnya daya hantar listrik, tekanan (untuk reaksi gas), absorbsi cahaya, dan lain-lainnya. Penentuan secara kimia dilakukan dengan menghentikan reaksi secara tiba-tiba ( reaksi dibekukan ) setelah selang waktu tertentu, kemudian konsentrasinya ditentukan dengan metode analisa kimia.
Berikut ini contoh penentuan laju reaksi dari reaksi antara larutan Br 2 dengan asam formiat pada suhu 25oC yang
ditentukan melalui konsentrasi Br 2 untuk setiap satuan waktu. Konsentrasi Br 2 ditentukan melalui spektrofootometer
berdasarkan perubahan warna Br 2 yang tersisa. Reaksi yang terjadi adalah :
HCOOH (l) + Br 2(aq) 2 Br – (aq) + 2 H+(aq) + CO2(g)
Data yang diperoleh adalah sebagai berikut : Tabel.3.1. Hasil Pengukuran Laju Reaksi
Bromin dengan asam formiat pada 25oC
Waktu (detik) Konsentrasi Br 2 (M) Laju reaksi (M/detik) k =
2Br
laju
(detik -1) 0,0 0,0120 4,2 x 10-5 3,50 x 10-3 50,0 0,0101 3,52 x 10-5 3,49 x 10-3 100,0 0,00846 2,96 x 10-5 3,50 x 10-3 150,0 0,00710 2,49 x 10-5 3,51 x 10-3 200,0 0,00596 2,09 x 10-5 3,51 x 10-3 250,0 0,00500 1,75 x 10-5 3,50 x 10-3 300,0 0,00420 1,48 x 10-5 3,52 x 10-3 350,0 0,00353 1,23 x 10-5 3,48 x 10-3 400,0 0,00296 1,04 x 10-5 3,51 x 10-3Dengan mengikuti perubahan konsentrasi Br 2 dari waktu ke waktu dapat ditentukan laju reaksi rata-rata dalam selang
waktu tertentu dengan perhitungan :
Laju rata-rata =
t Br 2 =
awal akhir mula mula 2 akhir 2t
t
Br
Br
dengan menggunakan data pada tabel 3.1. dapat dihitung laju reaksi rata-rata pada 50 detik pertama sebagai berikut : laju rata-rata =
3
,
8
x
10
M
/
det
ik
ik
det
0
,
50
M
0120
,
0
0101
,
0
5 Dengan cara yang sama maka laju rata-rata pada 100 detik pertama adalah,
laju rata – rata =
3
,
54
x
10
M
/
det
ik
ik
det
0
,
100
M
0120
,
0
00846
,
0
5 setiap saat, yang dikenal dengan laju reaksi sesaat .
Laju reaksi sesaat dapat ditentukan melalui cara grafik, dimana laju reaksi sesaat sebenarnya merupakan gradien dari kurva antara waktu dengan perubahan konsentrasi pada selang waktu tertentu. Oleh karena itu terdapat suatu bilangan tetap yang merupakan angka faktor perkalian terhadap konsnetrasi yang disebut sebagai tetapan laju reaksi (k). Dengan demikian maka laju reaksi sesaat secara umum dapat dinyatakan sebagai ,laju reaksi k [Br 2]
B. Hukum Laju Reaksi
Dari percobaan penentuan laju reaksi menunjukkan bahwa laju reaksi akan menurun dengan bertambahnya waktu, ini berarti ada hubungan antara konsentrasi zat yang tersisa saat itu dengan laju reaksi. Pada percobaan - percobaan menunjukkan bahwa umumnya laju reaksi tergantung pada konsentrasi awal dari zat-zat pereaksi, pernytaan ini dikenal dengan Hukum Laju Reaksi atau Persamaan laju reaksi.
Secara umum untuk reaksi : p A + q B r C
V = k [ A]
m[B ]
ndimana, v = laju reaksi ( mol dm-3 det-1 )
k = tetapan laju reaksi
m = tingkat reaksi (orde reaksi) terhadap A n = tingkat reaksi (orde reaksi) terhadap B [A] = konsentrasi awal A ( mol dm-3)
[B] = konsentrasi awal B (mol dm-3)
Tingkat reaksi total adalah jumlah total dari tingkat reaksi semua pereaksi, tingkat reaksi nol (0) berarti laju reaksi tersebut tidak teropengaruh oleh konsentrasi pereaksi, tetapi hanya tergantung pada harga tetapan laju reaksi (k). Harga k tergantung pada suhu, jika suhunya tetap harga k juga tetap.
Persamaan laju reaksi tidak dapat diturunkan dari persamaan reaksi , tetapi melalui percobaan. Hasil percobaan tabel 12.1. menunjukkan hasil percobaan penentuan laju reaksi antara gas hidrogen dengan nitrogen monoksida yang dilakukan pada suhu 800o C, dengan persamaan reaksi :
2H2(g) + 2 NO(g) 2 H2O(g) + N2(g) Percobaan ke-[ NO ] awal (mol dm-3) [ H2] awal (mol dm-3 )
Laju awal pembentukan N2
(mol dm-3 det-1 ) 1 0,006 0,001 0,0030 2 0,006 0,002 0,0060 3 0,006 0,003 0,0090 4 0,001 0,006 0,0005 5 0,002 0,006 0,0020 6 0,003 0,006 0,0045
Tabel.2.2. Hasil Percobaan Penentuan Persamaan Laju reaksi antara gas NO dan gas H2 pada 800oC.
Percobaan 1 , 2 dan 3, menunjukkan konsentrasi NO dibuat tetap (sebagai variabel kontrol) untuk mengetahui pengaruh konsentrasi gas H2 terhadap laju reaksi (sebagai variabel manipulasi), dan sebaliknya percobaan 4, 5, dan 6 yang
menjadi variabel kontrolnya adalah konsentrasi gas H2 dan sebagai variabel manipulasinya konsentrasi gas NO.
Dengan membandingkan percobaan 4 dan 5, terlihat bahwa jika konsentrasi NO didua-kalikan laju reaksi menjadi 4 kali lebih cepat, dan dari percobaan 4 dan 6 jika konsentrasi NO ditiga-kalikan laju reaksinya menjadi 9 kali lebih cepat, maka v k [NO]2 atau,
n 2 m n 2 m 5 4 H NO H NO k k v v
m
n n m6
00
,
0
002
,
0
006
,
0
001
,
0
k
k
0020
,
0
0005
,
0
m
2
1
4
1
m = 2 maka v = k [NO]2Dari percobaan 1 dan 2 didapat bila konsentrasi gas H2 didua-kalikan laju reaksinya menjadi dua kali lebih cepat, dan jika
konsentrasi gash H2 ditiga-kalikan laju reaksinya mnenjadi tiga kali dari laju semula, maka
v k [H2] atau,
n 2 m n 2 m 2 1 H NO H NO k k v v
m
n n m002
,
0
006
,
0
001
,
0
006
,
0
k
k
006
,
0
003
,
0
n 2 1 2 1
n = 1 maka v = k[H2]Dengan demikian persamaan laju reaksinya,
v = k [NO]2 [H 2]
Harga k pada percobaan tersebut dapat dicari dengan menggunakan persamaan diatas, misalnya diambil data dari percobaan 2,
v = k [NO]2 [H 2]
0,0060 mol dm-3 det-1 = k ( 0,006 mol dm-3 )2 (0,002 mol dm-3)
0,0060 mol dm-3 det-1
k =
(0,006 mol dm-3 )2 ( 0,002 mol dm-3)
= 8,33 x 104 mol-2 dm6 det-1
Satuan harga k dapat berubah tergantung pada tingkat (orde) reaksi totalnya. Bila dibuat kurva antara laju reaksi terhadap konsentrasi maka didapat tipe grafik seperti pada gambar 2.1. Dari kurva tersebut terlih bahwa pada reaksi berorde nol, maka konsentrasi pereaksi tersebut tidak berpengaruh terhadap lajunya reaksi.
C. Faktor – Faktor Yang Mempengaruhi Laju Reaksi 1. Teori Tumbukan
Suatu zat dapat bereaksi dengan zat lain apabila partikel-partikelnya saling bertumbukan. Tumbukan yang terjadi tersebut akan menghasilkan energi untuk memulai terjadinya reaksi. Terjadinya tumbukan antar partikel disebabkan oleh karena partikel (molekul-molekul) zat selalu bergerak dengan arah yang tidak teratur. Tumbukan antara partikel- partikel yang bereaksi tidak selalu menghasilkan energi, hanya tumbukan yang menghasilkan energi yang cukup yang dapat menghasilkan reaksi. Model tumbukan antar partikel dapat digambarkan sebagai bola yang akan menggelinding dari lekukan suatu bukit ke lereng bukit, diperlukan energi supaya bola menggelinding mencapai puncak lekukan ( keadaan transisi), setelah mencapai keadaan transisipun masih diperlukan energi agar bisa terlepas dari puncak lekukan tersebut agar bisa menggelinding ke lereng gunung jika energi tidak cukup maka bola tersebut akan menggelinding kembali ke lekukan itu. (Gb. 2.4)
Energi yang diperlukan agar bola sampai ke puncak bukit dan menggelinding dianalogikan sebagai energi pengaktifan. Dalam reaksi kimia Energi Pengaktifan (Energi Aktivasi) merupakan energi minimum agar suatu reaksi
dapat berlangsung . Tumbukan yang menghasilkan energi yang cukup untuk menghasilkan reaksi disebut dengan tumbukan efektif. Dengan menggunakan teori tumbukan ini dapat dijelaskan bagaimana faktor – faktor yang dapat mempercepat laju reaksi.
2. Konsentrasi
Secara umum konsentrasi pereaksi akan mempengaruhi laju reaksi, pengaruh konsentrasi terhadap laju reaksi untuk adalah khas untuk setiap reaksi. Pada reaksi orde-0 (nol) perubahan konsentrasi pereaksi tidak berpengaruh terhadap laju reaksi.
Reaksi orde-1 (satu) setiap kenaikan konsentrasi dua kali akan mempercepat laju reaksi menjadi dua kali lebih cepat, sedangkan untuk reaksi orde-2 bila konsentrasi dinaikan menjadi dua kali laju reaksi menjadi empat kali lebih cepat. Pengaruh konsentrasi terhadap laju reaksi ini dapat dijelaskan dengan model teori tumbukan. Makin tinggi konsentrasi berarti makin banyak molekul-molekul dalam setiap satuan luas r uangan, dengan demikian tumbukan antar molekul makin sering terjadi, semakin banyak tumbukan yang terjadi berarti kemungkinan untuk menghasilkan tumbukan efektif semakin besar, dan reaksi berlangsung lebih cepat.
3. Luas Permukaan Sentuhan
Untuk reaksi heterogen (fasenya tidak sama), misalnya logam seng dengan larutan asam klorida, laju reaksi selain dipengarhui oleh konsentrasi asam klorida juga dipengaruhi oleh kondisi logam seng. Dalam jumlah (massa) yang sama butiran logam seng akan bereaksi lebih lambat habis daripada serbuk seng. Reaksi terjadi antara molekul - molekul asam klorida dalam larutan dengan atomatom seng yang bersentuhan langsung dengan asam klorida. Pada butiran seng atom -atom seng yang bersentuhan langsung dengan asam klorida lebih sedikit daripada pada serbuk seng, sebab -atom--atom seng yang bersetuhan hanya atom seng yang ada dipermukaan butiran, tetapi bila butiran seng tersebut dipecah menjadi butiran - butiran yang lebih kecil, atau menjadi serbuk, maka atom-atom seng yang semula didalam akan berada dipermukaan dan terdapat lebih banyak atom seng yang secara bersamaan bereaksi dengan larutan asam klorida. Dengan menggunakan teori tumbukan dapat dijelaskan bahwa semakin luas permukaan zat padat semakin banyak tempat terjadinya tumbukan antar partikel zat yang bereaksi.
4. Suhu dan Laju Reaksi
Harga tetapan laju reaksi (k) akan berubah bila suhunya berubah, kenaikan sekitar 10 oC akan menyebabkan harga
tetapan laju reaksi menjadi dua atau tiga kali. Dengan naiknya harga tetapan laju reaksi (k), maka reaksi akan menjadi lebih cepat. Jadi dengan naiknya suhu akan mengakibatkan laju reaksi akan berlangsung makin cepat .
Hal tersebut dapat dijelaskan dengan menggunakan teori tumbukan, yaitu bila terjadi kenaikan suhu maka molekul -molekul yang bereaksi akan bergerak lebih cepat, sehingga energi kinetiknya tinggi. Karena energi kinetiknya tinggi maka energi yang dihasilkan pada tumbukan antar molekul akan menghasilkan energi yang besar dan cukup untuk berlangsungnya reaksi. Dengan demikian semakin tinggi suhu berarti akan kemungkinan terjadinya tumbukan yang
menghasilkan energi juga semakin banyak, dan berakibat reaksi berlangsung lebih cepat. Bila pada setiap kenaikan toC
suatu reaksi berlangsung n kali lebih cepat maka laju reaksi pada t2 (V2) bila dibandingkan laju reaksi pada t1 (V1) dapat
dirumuskan :
t t 2 tn
V
V
1 2 5. KatalisatorBeberapa reaksi kimia yang berlangsung lambat dapat dipercepat dengan menambahkan suatu zat ke dalamnya, tetapi zat tersebut pada waktu reaksi selesai ternyata tidak berubah, misalnya pada peruraian kalium klorat untuk menghasilkan gas oksigen dengan persamaan reaksi :
2 KClO3(s) → 2 KCl(s) + 3 O2(g)
berlangsung pada suhu tinggi dan berjalan lambat, tetapi dengan penambahan kristal MnO2 ke dalamnya ternyata reaksi
akan dapat berlangsung dengan lebih cepat pada suhu yang lebih rendah. Setelah semua KClO3 terurai ternyata MnO2
masih tetap ada (tidak berubah). Dalam reaksi tersebut MnO2 disebut sebagai katalisator. Katalisator adalah suatu zat yang
dapat mempercepat laju reaksi, tanpa dirinya mengalami perubahan yang kekal. Suatu katalisator mungkin dapat terlibat dalam proses reaksi atau mengalami perubahan selama reaksi berlangsung, tetapi setelah reaksi itu selesai maka katalistor akan diperoleh kembali dalam jumlah yang sama. Katalisator mempercepat reaksi dengan cara mengubah jalannya reaksi, dimana jalur reaksi yang ditempu tersebut mempunyai energi aktivasi yang lebih rendah daripada jalur reaksi yang biasanya ditempuh, jadi dapat dikatakan bahwa katalisator berperan di dalam menurunkan energi aktivasi.
Lampiran 2 Penilaian
INSTRUMEN PENILAIAN SIKAP
Nama Satuan pendidikan
: SMA Negeri Palembang
Tahun pelajaran
: 2018/2019
Kelas/Semester
: XI / Semester I
Mata Pelajaran
: Kimia
NO WAKTU NAMA KEJADIAN/
PERILAKU BUTIR SIKAP POS/ NEG TINDAK LANJUT
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Palembang, Oktober 2018
Mengetahui,
Kepala Sekolah,
Guru Mata Pelajaran,
Hj. Maryati, S.Pd., M.M.
Sugiarsih, S.Pd
Tanggal : Nama : Kelas :
1. Jelaskan apa yang dimaksud dengan laju reaksi dan apa satuan dari laju reaksi? 2. Tentukan konsentrasi HCl :
a. 4 gr HCl dalam 50 ml air b. 10 gr HCl dalam 100ml air
c. 15 gr HCl dalam 500 ml air
3. Penentuan laju reaksi: 2A(g) + 3B2(g)→ 2AB3(g), dilakukan dengan mengukur perubahan konsentrasi A setiap 5 detik
sehingga didapat data:
Waktu(detik 0 5 10
[A] (mol/liter) 0.1 0.08 0.065
Tentukanlah:
a. Laju reaksi rata-rata dari gas A pada setiap selang waktu
b. Laju reaksi rata-rata setiap selang waktu berdasarkan gas AB3 yang dihasilkan
Lembar Kerja Peserta Didik
1 Tujuan :
Setelah dilakukan praktikum siswa dapat :
Untuk mengetahui teknik pembuatan larutan.
Untuk mengetahui bagaimana menentukan konsentrasi Molaritas
Untuk mengetahui cara mengencerkan larutan.
2 Alat dan Bahan :
Alat Bahan
Botol semprot aquadest
Gelas ukur NaOH
Gelas kimia H2SO4 18 M
Batang pengaduk Na2SO4
Pipet tetes HCl 12,06 M
Spatula
Botol penyimpan larutan
3 Prosedur untuk membuat larutan adalah sebagai berikut:
a. Hitunglah jumlah bahan kimia yang dibutuhkan untuk membuat larutan.
NaOH 5 M sebanyak 200 mL Na2SO4 2 M sebanyak 200 mL
b. Bahan ditimbang dengan menggunakan gelas kimia pada timbangan digital sesuai dengan jumlah bahan kimia yang telah dihitung sesuai dengan prosedur no 3
c. Bahan yang sudah ditimbang kemudian dimasukkan ke dalam gelas kimia dan ditambahkan dengan aquadest secukupya untuk melarutkan bahan kimia yang digunakan berupa zat padat.
d. diaduk hingga homogen
e. lalu tambahkan aquadest ke gelas kimia sampai tanda batas 200 ml yang terdapat pada gelas kimia f. setelah itu pindahkan larutan ke dalam botol kaca yang telah disediakan.
Hitunglah jumlah bahan kimia yang dibutuhkan untuk membuat larutan. a. Hitunglah jumlah bahan kimia yang dibutuhkan untuk membuat larutan.
H2SO418M menjadi H2SO45 M sebanyak 200 ml HCl 12,06 M menjadi HCl 5 M sebanyak 200 ml NaOH 5 M menjadi NaOH 1 M sebanyak 200 ml H2SO4 5M menjadi H2SO4 1 M sebanyak 200 ml HCl 5 M menjadi HCl 1 M sebanyak 200 ml
b. Bahan diukur dengan menggunakan gelas ukur /pipet tetes sesuai dengan jumlah bahan kimia yang telah dihitung sesuai dengan prosedur no.1
c. Bahan yang sudah ditimbang kemudian dimasu kkan ke dalam labu takar dan ditambahkan dengan aquadest hingga tanda baca 200 ml yang terdapat pada labu ukur.
d. Dikocok hingga homogen lalu masukkan ke dalam botol kaca yang telah disediakan.
4 Analisa Data: ……… ……… ……… ……… ……… ………
Mata Pelajaran : Kimia
Materi : Pembuatan larutan dan pengenceran larutan
Kelompok :
……… ……… ……… ……… ……… ……… ……… ……… ……… 5 Persamaan reaksi : ……… ……… ……… ……… ……… ……… ……… ……… 6 Kesimpulan : ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ………
Lembar Kerja Pesera Didik
1. Tujuan :
Setelah dilakukan praktikum siswa dapat :
Menjelaskan pengaruh suhu terhadap laju reaksi.
Menjelaskan pengaruh luas permukaan terhadap laju reaksi.
2. Alat dan Bahan :
a. Percobaan 1 (Pengaruh suhu terhadap laju reaksi)
Jess cool
Air hangat
Air dingin
Gelas kimia
b. Percobaan 2 (Pengaruh luas permukaan terhadap laju reaksi)
Jess cool
Serbuk jess cool
Air
Gelas kimia
3. Prosedur
a. Percobaan 1
Sediakan 2 buah gelas kimia, jess cool, air hangat, dan air dingin.
Masukkan 100 ml air hangat kedalam gelas kimia yang pertama dan 100 ml air dingin kedalam gelas kimia yang kedua.
Kemudian masukkan jess cool kedalam masing-masing gelas kimia.
Catat waktunya.
b. Percobaan 2
Sediakan 1 keping jess cool dan jess cool padat, air, dan dua buah gelas kimia.
Masukkan 100 ml air kedalam gelas kimia.
Kemudian masukkan 1 keping jess cool kedalam gelas kimia.
Catat waktu sampai jess cool tersebut larut didalam air.
Ulangi langkah tersebut untuk jess cool yang berupa padatan.
4. Hasil Pengamatan
a. Percobaan 1
Gelas Kimia Temperatur Waktu
1 Air hangat
2 Air dingin
b. Percobaan 2
Mata Pelajaran : Kimia
Materi : Faktor-faktor yang mempengaruhi laju reaksi
Kelompok :
1 Keping
2 Serbuk
5. Pertanyaan
a. Bagaimana pengaruh suhu terhadap laju reaksi ?
Jawab :
……… ……… ……… ……….
b. Bagaimana pengaruh luas permukaan terhadap laju reaksi ? Jawab :……… ……… ……… ……… ……….. 6. Kesimpulan :……….. ……… ……….
Kerjakan Soal berikut dengan teliti dan jelas !
1 Tuliskan dan jelaskan apa yang dimaksud dari laju reaksi dan apa saja yang faktor- faktor yang mempengaruhi laju reaksi berdasarkan teori tumbukan ? (Skor 10)
2 Hitunglah :
a. Berapakah kemolaran dari 0,1 mol H2SO4 dalam 500 ml ?
b. Untuk mengubah 40 ml larutan HCl 6 M menjadi HCl 5 M diperlukan tambahan aquadest sebanyak ? (Skor 15)
3 Diketahui data hasil percobaan reaksi, Dari percobaan reaksi:
CaCO3(s)+ 2 HCl(aq)→ CaCl2(aq) + CO2(g) + H2O(g)
diperoleh data data sebagai berikut.
Percobaan Bentuk CaCO3 Konsentrasi 25 mL
HCl (M) Waktu reaksi (det.) Suhu (oC) 1 10 gram serbuk 0,2 4 25 2 10 gram butiran 0,2 6 25 3 10 gram bongkahan 0,2 10 25 4 10 gram butiran 0,4 3 25 5 10 gram butiran 0,2 3 25
Tentukan apa yang mempengaruhi percobaan 1 dan 3? Jelaskan? (skor 10) 4. Diketahui reaksi : 2NO(g) + O2→ 2NO2(g)
Dari hasi percobaan, diperoleh data sebagai berikut .
No [NO] M [O2] M V (m/s)
1 0,1 0,1 20
2 0,2 0,1 40
3 0,1 0,2 80
Tentukan:
a. orde reaksi terhadap NO dan O2
b. orde reaksi total c. persamaan laju reksi
d. Tentukan harga k (Pada data ke-1)
e. Tentukan laju reaksi jika [NO] = 0,4 M dan [O2] = 0,2 (Skor 50)
5 Laju reaksi :
P(aq) + Q (aq) R(s) + S (aq)
Ditentukan dengan mengukur waktu yang diperlukan untuk membentuk endapan R dengan jumlah tertentu. Datanya ialah sebagai berikut.
No P Q Waktu Reaksi (s)
1 0,30 0,25 40
2 0,60 0,25 20
3 0,60 0,50 5
Tentukan :
a. orde reaksi terhadap [P] dan [Q] b. orde reaksi total
c. persamaan laju reksi (Skor 15)
Nama = Kelas =