Mengenal Sifat Material
#2
Bahan Kuliah Terbuka
dalam format pdf tersedia di
www.buku-e.lipi.go.id
dalam format pps beranimasi tersedia di
www.ee-cafe.org
Paparan Teori
ada di Buku-e dalam format pdf
tersedia di
www.buku-e.lipi.go.id
dan
Material
σ
e[siemens]
Perak
6,3
×
10
7Tembaga
5,85
×
10
7Emas
4,25
×
10
7Aluminium
3,5
×
10
7Tungsten
1,82
×
10
7Kuningan
1,56
×
10
7Besi
1,07
×
10
7Nickel
1,03
×
10
7Baja
0,7
×
10
7Stainless steel
0,14
×
10
7Material
σ
e[siemens]
Gelas (kaca)
2
∼
3
×
10
−5Bakelit
1
∼
2
×
10
−11Gelas
(borosilikat)
10
−10∼
10
−15Mika
10
−11∼
10
−15Polyethylene
10
−15∼
10
−17Konduktor
Isolator
[6]Jika pada suatu material konduktor terjadi perbedaan potensial, arus listrik akan mengalir melalui konduktor tersebut
Ε
Ε
J
e e e=
ρ
=
σ
kerapatan arus [ampere/meter2] kuat medan [volt/meter] resistivitas [Ωm] konduktivitas [siemens]Medan listrik E memberikan gaya dan percepatan pada elektron sebesar
E
F
e=
e
em
e
a
=
E
Karena elektron tidak terakselerasi secara tak berhingga, maka dapat
dibayangkan bahwa dalam pergerakannya ia harus kehilangan energi pada waktu menabrak materi pengotor ataupun kerusakan struktur pada zat
padat.
Jika setiap tabrakan membuat elektron kembali berkecepatan nol, dan
waktu antara dua tabrakan berturutan adalah 2
τ
maka kecepatan rata-rataadalah:
e
m
e
0 2τ 4τ 6τ e e
m
e
v
=
τ
E
e maksm
e
v
=
2
τ
E
ke ce p a ta n waktu e em
ne
v
ne
E
τ
J
2=
=
=
σ
eE
e em
ne
τ
σ
=
2 kerapatan elektron bebas benturanJika tak ada medan listrik, elektron bebas bergerak cepat pada arah yang acak sehingga tak ada aliran elektron netto. Medan listrik akan membuat
elektron bergerak pada arah yang sama. kerapatan
arus
Teori Drude-Lorentz
Tentang Metal
1900: Drude mengusulkan bahwa konduktivitas listrik tinggi pada metal dapat dijelaskan sebagai kontribusi dari elektron valensi yang dianggap dapat
bergerak bebas dalam metal, seperti halnya molekul gas bergerak bebas dalam suatu wadah. Gagasan Drude ini dikembangkan lebih lanjut oleh Lorentz.
Elektron dapat bergerak bebas dalam kristal metal pada potensial internal yang konstan. Ada dinding potensial pada permukaan metal, yang menyebabkan elektron tidak dapat meninggalkan metal.
Semua elektron bebas berperilaku seperti molekul gas (mengikuti statistik Maxwell-Boltzmann); elektron ini memiliki distribusi energi yang kontinyu. Gerakan elektron hanya dibatasi oleh tabrakan dengan ion-ion metal.
Medan listrik E memberikan gaya dan percepatan pada elektron sebesar
E
F
e=
e
em
e
a
=
E
Integrasi a terhadap waktu memberikan kecepatan elektron, yang disebut kecepatan drift :
t
m
e
v
e driftE
=
t
m
e
v
e driftE
=
Jika jalan bebas rata-rata elektron adalah L maka waktu rata-rata antara tabrakan dengan tabrakan berikutnya adalah
drift
v
L
t
+
=
µ
Kecepatan drift ini berubah dari 0 sampai
vdrift maks , yaitu kecepatan sesaat sebelum
tabrakan dengan ion metal.
t
m
e
v
v
e drift drift2
2
E
=
=
kecepatan thermal<<
µ
driftv
µ
L
t
≈
µ
L
m
e
t
m
e
v
e e drift2
2
E
E
=
=
Kerapatan arus adalah:
µ
e drift em
L
ne
v
ne
2
2E
J
=
=
ρ
E
=
L
ne
m
e 22
µ
ρ
=
Model Pita Energi
untuk Metal
Pada metal, pita valensi biasanya hanya sebagian terisi
Pita energi paling luar, jika ia hanya sebagian terisi dan padanya terdapat
tingkat Fermi, disebut sebagai
pita konduksi
.kosong celah energi terisi kosong pita valensi EF pita konduksi
Sodium
Pada beberapa metal, pita valensi terisi penuh. Akan tetapi pita ini
overlap
dengan pita di atasnya yang kosong. Pita yang kosong ini memfasilitasi tingkat energi yang dengan mudah dicapai olehelektron yang semula berada di pita valensi.
terisi penuh
kosong
EF
pita valensi
Model Mekanika
Gelombang
Dalam model mekanika gelombang, elektron dipandang sebagai paket gelombang, bukan partikel.
Kecepatan grup dari
paket gelombang adalah
dk
df
v
g=
2
π
f = frekuensi DeBroglie k = bilangan gelombangPercepatan yang dialami elektron adalah
dt
dk
dk
E
d
h
dk
dE
dt
d
h
dt
dv
a
g 2 22
2
π
π
=
=
=
Karena E = hf , maka:dk
dE
h
v
g=
2
π
dt
dk
dk
E
d
h
dk
dE
dt
d
h
dt
dv
a
g 2 22
2
π
π
=
=
=
dt
dk
dE
h
e
dt
v
e
dx
e
dE
=
E
=
E
g=
2
π
E
e
E
h
dt
dk
2
π
=
2 2 2 24
dk
E
d
h
e
a
=
E
π
Percepatan yang dialami elektron adalah
Percepatan ini terjadi karena ada medan listrik E, yang memberikan gaya sebesar eE
Gaya sebesar eE memberikan laju perubahan energi kinetik pada elektron bebas sebesar
2 2 2 2
4
dk
E
d
h
e
a
=
E
π
percepatan elektron:Bandingkan dengan relasi klasik:
F
m
a
e
e
=
Kita definisikan
massa efektif elektron
:1 2 2 2 2
4
*
−
=
dk
E
d
h
m
π
m
*
e
a
=
E
Untuk elektron bebas m* = me .
1 2 2 2 2
4
*
−
=
dk
E
d
h
m
π
menurun
dk
dE
negatif
2 2
dk
E
d
negatif
*
m
meningkat
dk
dE
positif
2 2
dk
E
d
k
E
−
k1 +k1kecil
*
m
celah energi sifat klasikm* = me jika energinya tidak mendekati batas pita energi
dan kurva E terhadap k berbentuk parabolik
Pada kebanyakan metal m* = me karena
pita energi tidak terisi penuh. Pada material yang pita valensinya terisi penuh
Teori Sommerfeld
Tentang Metal
Metal dilihat sebagai benda padat yang kontinyu, homogen, isotropik. Gambaran tentang elektron seperti pada teori Drude-Lorentz; elektron bebasa berada pada potensial internal yang konstan.
Perbedaannya adalah bahwa elektron dalam sumur potensial mengikuti teori kuantum dan bukan mekanika klasik
Berapa statuskah yang tersedia untuk elektron atau dengan kata lain bagaimanakah kerapatan status?
Bagaimana elektron terdistribusi dalam status yang tersedia dan bagaimana mereka berpartisipasi dalam proses fisika?
x
z
y
Lx Ly
Lz
Sumur tiga dimensi
0
2
2 2 2 2 2 2 2=
ψ
+
∂
ψ
∂
+
∂
ψ
∂
+
∂
ψ
∂
E
z
y
x
m
h
)
(
)
(
)
(
)
,
,
(
x
y
z
=
X
x
Y
y
Z
z
ψ
0
)
(
)
(
1
)
(
)
(
1
)
(
)
(
1
2
2 2 2 2 2 2 2=
+
∂
∂
+
∂
∂
+
∂
∂
E
z
z
Z
z
Z
y
y
Y
y
Y
x
x
X
x
X
m
h
E
m
z
z
Z
z
Z
y
y
Y
y
Y
x
x
X
x
X
2 2 2 2 2 2 22
)
(
)
(
1
)
(
)
(
1
)
(
)
(
1
h
−
=
∂
∂
+
∂
∂
+
∂
∂
x E m x x X x X 2 2 2 2 ) ( ) ( 1 h − = ∂ ∂ y E m y y Y y Y 2 2 2 2 ) ( ) ( 1 h − = ∂ ∂ z E m z z Z z Z 2 2 2 2 ) ( ) ( 1 h − = ∂ ∂
0
)
(
2
)
(
2 2 2=
+
∂
∂
x
X
E
m
x
x
X
xh
2x 2 2L
8m
h
n
E
x=
x 2 y 2 2L
8m
h
n
E
y=
y 2 z 2 2L
8m
h
n
E
z=
z x z y Lx Ly LzSumur tiga dimensi
2 x 2 2
L
8m
h
n
E
x=
x 2 y 2 2L
8m
h
n
E
y=
y 2 z 2 2L
8m
h
n
E
z=
z Energi elektron :Energi elektron dinyatakan dalam momentumnya:
m
p
E
x x2
2=
m
p
E
y y2
2=
m
p
E
z z2
2=
sehingga : 2 x 2L
2
=
n
h
p
x x 2 y 2L
2
=
n
h
p
y y 2 z 2L
2
=
n
h
p
z z momentum : iL
2
h
n
p
i=
±
imomentum : i
L
2
h
n
p
i=
±
iTanda ± menunjukkan bahwa arah momentum bisa positif atau negatif. Pernyataan ini menunjukkan bahwa momentum terkuantisasi.
px, py, pz membentuk
ruang momentum
tiga dimensi. Jika ruangmomentum berbentuk kubus, maka satuan sisi kubus adalah
h/2L
Kwadran pertama
ruang momentum (dua dimensi):px py
0
setiap titik menunjukkan status momentum yang diperkenankan
setiap status momentum menempati ruang sebesar
Kwadran pertama
ruang
momentum
(dua dimensi)px py 0 px py 0 p dp
setiap status momentum menempati ruang sebesar
h2/4L2
(
)
3 2L
8
/
8
/
4
)
(
3h
dp
p
dp
p
N
=
π
dimensitiga(
)
3V
4
)
(
2h
dp
p
dp
p
N
=
π
px py 0 p dp tiga dimensi
(
)
3V
4
)
(
2h
dp
p
dp
p
N
=
π
Karenap
=
(
2mE
)
1/2dp
=
2
(
2
mE
)
−1/2dE
maka(
)
(
)
dE
mE
m
mE
h
V
dE
E
N
(
)
4
2
2
1/2 3 −×
×
=
π
(
) ( )
m
E
dE
dN
h
V
dE
E
N
(
)
=
2
×
2
3/2 1/2=
3π
massa elektron di sini adalah massa efektif Inilah kerapatan status. Setiap status mencakup 2 spin
Densitas Status pada 0 K
(
) ( )
dN
dE
E
m
h
V
dE
E
N
(
)
=
2
×
2
3/2 1/2=
3π
Status energi diisi oleh elektron valensi mulai dari tingkat terendah secra berurut ke tingkat yang lebih tinggi sampai seluruh elektron terakomodasi. Elektron pada status energi yang paling tinggi analog dengan elektron pada tingkat energi paling tinggi di sumur potensial.
Elektron ini memerlukan tambahan energi sebesar work function untuk meninggalkan sumur potensial.
Status energi paling tinggi, yaitu tingkat yang paling tinggi yang ditempati oleh
elektron pada 0 K secara tentatif didefinsikan sebagai tingkat Fermi, EF.
(Definisi ini sesungguhnya tidak lengkap, tetapi untuk sementara kita gunakan).
px py
0
p
dp
Jika p adalah jarak dari titik pusat ke momentum paling luar, maka akan diperoleh status yang terisi.
Status yang terisi adalah:
3 3 3 3 3
3
V
8
2L
3
4
h
p
h
p
N
=
π
÷
=
π
Karenap
=
(
2mE
)
1/2( )
3 2 / 3 3/23
V
2m
8
h
E
N
=
π
Energi Fermi: 3 2 / 3 2 / 32
1
V
3
8
1
h
m
N
E
F
=
π
3 / 2 2 2 3 / 2V
3
8
2
1
V
3
4
1
=
=
π
π
N
m
h
h
m
N
E
FN(E)
E EF
∞ E1/2
Densitas & Status terisi pada 0 K
Densitas Status pada 0 K
(
) ( )
m
E
dE
dN
h
V
dE
E
N
(
)
=
2
×
2
3/2 1/2=
3π
Jumlah status yang terisi dihitung dari
jumlah status momentum yang terisi dalam ruang momentum: 3 3 3 3 3 3h V 8 L / ) 3 / 4 ( 2 p h p N = × π = π
Jika elektron pada tingkat energi EF kita pandang secara klasik, relasi energi:
Pada tingkat energi EF sekitar 4 eV, sedang
F B F
k
T
E
=
di mana TF adalah temperatur Fermi
eV
10
6
,
8
×
−5≈
Bk
makaT
F≈
4
,
7
×
10
4K
Jadi suatu elektron klasik berada pada sekitar 50.000 K untuk setara dengan elektron pada tingkat Fermi.
Hasil Perhitungan
elemen
E
F[eV]
T
F[
oK
×
10
-4]
Li
4,7
5,5
Na
3,1
3,7
K
2,1
2,4
Rb
1,8
2,1
Cs
1,5
1,8
Cu
7,0
8,2
Ag
5,5
6,4
Au
5,5
6,4
F B Fk
T
E
=
[1]Menurut mekanika gelombang elektron bebas dalam kristal dapat
bergerak tanpa kehilangan energi. Setiap kelainan pada struktur kristal akan menimbulkan hambatan pada gerakan elektron yang menyebabkan timbulnya resistansi listrik pada material.
Bahkan pada 0o K, adanya resistansi dapat teramati pada material nyata
sebab pengotoran, dislokasi, kekosongan, dan berbagai ketidaksempurnaan kristal hadir dalam material.
Pada metal murni, resistivitas total merupakan jumlah dari dua komponen
yaitu komponen thermal ρT, yang timbul akibat vibrasi kisi-kisi kristal, dan
resistivitas residu ρr yang disebabkan adanya pengotoran dan
ketidaksempurnaan kristal. Relasi Matthiessen: e r T
σ
ρ
ρ
ρ
=
+
=
1
resistivitas totalresistivitas thermal resistivitas residu
Eksperimen menunjukkan: 200 300 oK 100 | | − − −− − − Cu Cu, 1,12% Ni Cu, 2,16% Ni Cu, 3.32% Ni ρ [o h m -m ] × 1 0 8 1 2 3 4 5
6 Di atas temperatur Debye
komponen thermal dari resistivitas hampir linier terhadap temperatur:
frekuensi maks osilasi B D D
k
hf
=
θ
D s Df
c
=
λ
Temperatur Debye: konstanta Boltzmann 1,38×10−23 joule/oK kecepatan rambat suara panjang gelombang minimum osilator [6]( )
x
Ax
r
=
1
−
ρ
konstanta tergantung dari jenis metal dan
pengotoran konsentrasi pengotoran
Relasi Nordheim:
Jika x << 1ρ
r=
Ax
2% 3% 1% | | − −− −ρ
r /ρ
27 3 0,05 0,10 0,15 0,20 4% | In dalam SnPengaruh Jenis Pengotoran pada
Cu
−
−
| | | | 2,0×10−8 2,5×10−8 1,5×10−8 ρ [o h m -m e te r] 0 0,05 0,10 0,15 0,20 ρT (293) Sn Ag Cr Fe P % berat [6]Elektron bebas dalam metal tidak meninggalkan metal, kecuali jika mendapat tambahan energi yang cukup.
+
+
+
+
x
EF E n e rg i Hampa eFemitter collector cahaya A V Sumber tegangan variabel I V −−−−V0 x lumen 2x lumen 3x lumen 0
Pada tegangan ini semua elektron kembali ke katoda (emitter)
Laju keluarnya elektron (arus) tergantung dari intensitas cahaya tetapi energi kinetiknya tidak
tergantung intensitas cahaya
Energi kinetik elektron = e V0
emitter collector cahaya A V Sumber tegangan variabel I V −−−−V01 λ=5000Å (biru) −−−−V02 −−−−V03 λ=5500Å (hijau) λ=6500Å (merah)
Intensitas cahaya konstan tetapi panjang gelombang berubah
Photon dengan energi hf diserap elektron di permukaan metal sehingga elektron tersebut mendapat tambahan energi. Jika pada awalnya elektron menempati tingkat energi tertinggi di pita konduksi dan
bergerak tegak lurus ke arah permukaan, ia akan meninggalkan emitter dengan energi kinetik maksimum
E
k maks= hf
−
e
φ
Energi yang diterima
Energi untuk mengatasi hambatan di permukaan (dinding potensial) emitter collector cahaya A V Sumber tegangan variabel
tingkat energi terisi hf EF eφφφφ Ek maks Ek < Ek maks hf emitter collector cahaya A V Sumber tegangan variabel
Jika V0 (yang menunjukkan energi kinetik) di-plot terhadap frekuensi:
Vo f −φ1 −φ2 Slope = h/e Metal 1 Metal 2 Rumus Einstein:
e
V
0
====
hf
−−−−
e
φ
emitter collector cahaya A V Sumber tegangan variabelPeristiwa Emisi Thermal
Pada temperatur tinggi, sebagian elektron memiliki energi kinetik yang lebih tinggi dari energi rata-rata elektron sehingga dapat melampaui
work function ( eφ ).
A
V
vakum
pemanas
katoda anoda Jika arus cukup tinggi, terjadi saling tolak
antara elektron di ruangan sehingga elektron dengan energi rendah tidak mencapai anoda.
Muatan ruang makin berpengaruh jika arus makin tinggi. Arus akan mencapai
kejenuhan. I
V −V
Makin tinggi temperatur katoda, akan makin tinggi energi elektron yang keluar dari permukaan katoda, dan kejenuhan terjadi pada nilai arus yang lebih tinggi.
I V −V T1 T2 T3
Kejenuhan dapat diatasi dengan menaikkan V I T V1 V2 V3 A V vakum pemanas katoda anoda
Pada tegangan yang sangat tinggi, dimana efek muatan ruang teratasi secara total, semua elektron yang keluar dari katoda akan mencapai anoda.
Persamaan Richardson-Dushman kT e
e
AT
J
=
2 − φ /kerapatan arus konstanta dari material
k = konstanta Boltzman = 1,38×10−23 joule/oK
I T V1 V2 V = ∞ A V vakum pemanas katoda anoda
Nilai φ tergantung dari temperatur :
φ
====
φ
0
++++
α
T
pada 0o KdT
d /
φ
α ====
koefisien temperaturK
eV/
10
−4 o≈
α
e
pada kebanyakan metal murniPersamaan Richardson-Dushman menjadi:
kT
e
k
e
e
e
AT
J
====
2
−−−−
α
/
−−−−
φ
0/
A V vakum pemanas katoda anodaPersamaan Richardson-Dushman
kT
e
k
e
e
e
AT
J
====
2
−−−−
α
/
−−−−
φ
0/
kT e k ee
Ae
AT
J
/ / 2 0 φ α −−−− −−−−====
kT
e
k
e
A
AT
J
0 2ln
ln
====
−−−−
α
−−−−
φ
2 ln AT J T 1 Linier terhadap A V vakum pemanas katoda anodaMaterial
katoda
titik leleh
[
OK]
temp. kerja
[
OK]
work
function
[eV]
A
[10
6amp/m
2 oK
2W
3683
2500
4,5
0,060
Ta
3271
2300
4,1
0,4 – 0,6
Mo
2873
2100
4,2
0,55
Th
2123
1500
3,4
0,60
Ba
983
800
2,5
0,60
Cs
303
290
1,9
1,62
[6]Jika elektron dengan energi tinggi (yang disebut elektron primer)
ditembakkan ke permukaan metal, elektron dapat keluar dari permukaan metal (yang disebut elektron sekunder).
Energi kinetik elektron sekunder tidak harus tergantung dari energi kinetik elektron yang membentur permukaan.
Efisiensi emisi sekunder dinyatakan sebagai rasio jumlah elektron
sekunder, Is terhadap jumlah elektron primer yang membentur permukaan,
Ip. Rasio ini disebut secondary emission yield,
δ
, dan merupakan fungsi darienergi kinetik berkas elektron yang membentur permukaan.
Jika energi kinetik berkas elektron yang membentur permukaan terlalu rendah hanya sedikit dihasilkan emisi sekunder.
Jika energi kinetik berkas elektron yang membentur permukaan terlalu tinggi hanya sedikit juga dihasilkan emisi sekunder. Hal ini disebabkan karena elektron yang membentur permukaan metal sempat masuk (penetrasi) ke dalam metal sebelum terjadi benturan dengan elektron bebas dalam metal.
Elektron bebas yang menerima tambahan energi mengalami tabrakan-tabrakan sebelum mencapai permukaan, dan mereka gagal keluar dari permukaan metal.
Akibatnya adalah δ sebagai
fungsi dari energi berkas elektron, mempunyai nilai maksimum. δ Ek 0 0 δmaks Ek maks
emitter
δ
maksE
k[eV]
Al
0,97
300
Cu
1,35
600
Cs
0,9
400
Mo
1,25
375
Ni
1,3
550
W
1,43
700
gelas
∼
2,5
400
BeO
10,2
500
Al
2O
34,8
1300
[6]Emisi Sekunder
Efek SCHOTTKY
Dalam peristiwa emisi thermal telah disebutkan bahwa
kenaikan medan listrik antara emitter dan anoda akan
mengurangi efek muatan ruang.
I
V1
V2
V3
Medan yang tinggi juga meningkatkan emisi
karena terjadi perubahan dinding potensial di permukaan katoda.
+
+
+
+
x
EF E n e rg i x 0 e∅medan listrik tinggi
V = eEx
e∆∅
Medan E memberikan
potensial −eEx pada
jarak x dari permukaan
nilai maks dinding potensial penurunan work function
Peristiwa Emisi Medan
Hadirnya medan listrik pada permukaan katoda, selain menurunkan
work function juga membuat dinding potensial menjadi lebih tipis.
+
+
+
+
x
EF E n e rg i e∅medan listrik sangat tinggi V = eEx
e∆∅
jarak
tunneling
Dielektrik digunakan pada
kapasitor
dan sebagaibahan isolasi
Permitivitas relatif didefinisikan sebagai rasio permitivitas dielektrik (ε)
dengan permitivitas ruang hampa (ε0)
0
ε
ε
ε
r≡
Jika suatu dielektrik yang memiliki permitivitas relatif εr disisipkan antara
dua pelat kapasitor yang memiliki luas A dan jarak antara kedua pelat adalah d , maka kapasitansi yang semula
0 0
ε
d
A
C
=
berubah menjadi rC
rd
A
d
A
C
=
ε
=
ε
0ε
=
0ε
dielektrik meningkatkan kapasitansi sebesar εr kali
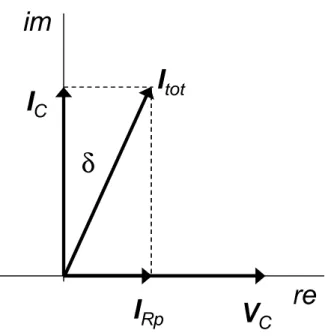
Diagram fasor kapasitor im re IRp IC Itot δ VC
δ
tan
C C Rp CP
=
V
I
=
V
I
Desipasi daya (menjadi panas):
tanδ : faktor desipasi
(loss tangent)
δ
ε
δ
ε
tan
π
2
tan
ω
2 0 0 0 r rC
f
C
P
V
V
V
=
=
εr tanδ : faktor kerugian
Kekuatan Dielektrik
Gradien tegangan maksimum yang masih dapat ditahan oleh dielektrik sebelum terjadi tembus listrik Nilai kekuatan dielektrik secara eksperimen sangat
tergantung dari ukuran spesimen, elektroda, serta prosedur percobaan
Tembus listrik diawali oleh hdirnya sejumlah elektron di pita konduksi. Elektron ini mendapat percepatan oleh adanya medan listrik yang
tinggi sehingga memperoleh energi kinetik yang tinggi. Sebagian energi ini ditransfer ke elektron valensi sehingga elektron valensi naik
ke pita konduksi. Jika jumlah elektron ini cukup banyak maka akan terjadi avalans elektron di pita konduksi. Arus meningkat dengan cepat
sehingga terjadi peleburan lokal, terbakar, atau penguapan.
Elektron awal bisa hadir oleh beberapa sebab: discharge antara elektroda tegangan tinggi dengan permukaan dielektrik yang terkontaminasi,
Jarak elektroda [m] X 10−2 T e g a n g a n t e m b u s [kV ] 100 − 0 200 − 300 − 400 − 500 − 600 − 0 0.51 1.03 1.55 2,13 2,54 udara 1 atm
udara 400 psi SF6 100 psi
SF6 1 atm Porselain Minyak Trafo High Vacuum [6] Kekuatan Dielektrik
0 0 0 0 0 0
/
ε
σ
ε
=
=
=
=
d
d
A
Q
d
C
Q
d
V
E
Tanpa dielektrik :qr
e=
p
E0 + + + − − − dσ
0 + − + − + + + + + + + dσ
E + − + − + − + − + − + − − − − − − − − Dipole listrik :timbul karena terjadi
Polarisasi
r r
d
d
A
Q
d
C
Q
d
V
E
ε
ε
σ
ε
ε
0 0/
=
=
=
=
Dengan dielektrik :(
1
)
0 0 0 0=
−
=
−
−
σ
ε
ε
rE
ε
E
ε
E
ε
rσ
Polarisasi
: total dipole momen listrik per satuan volumeP
=
Molekul di dalam dielektrik mengalami pengaruh medan listrik yang lebih besar dari medan listrik yang diberikan dari luar. Medan listrik yang dialami
oleh molekul ini disebut
medan lokal
.+ − + − + + + + + + +
σ
E + − + − + − + − + − + − − − − − − − − + − + − + − + − + − + − + − + −Induksi momen dipole oleh
medan lokal Elok adalah
lok mol
=
α
E
p
polarisabilitas lokE
N
α
=
P
jumlah molekul per satuan volume
(
1
)
0−
=
=
N
α
E
lokε
E
ε
rP
(
)
E
E
N
lok r 01
ε
α
ε
−
=
4 macam polarisasi
a. polarisasi elektronik :
tak ada medan
ada medan
E
Teramati pada semua dielektrik.
Terjadi karena pergeseran awan elektron pada tiap atom terhadap intinya.
4 macam polarisasi
tak ada medan
ada medan
E
b. polarisasi ionik :
+ − + + + + − − − + − + + + + − − −Terjadi karena pergeseran ion-ion yang berdekatan dan berlawanan muatan.
4 macam polarisasi
tak ada medan
ada medan
E
c. polarisasi orientasi :
+ − + − + − + −Terjadi pada material padat dan cair yang memiliki molekul asimetris yang momen dipole permanennya dapat diarahkan oleh medan listrik.
4 macam polarisasi
tak ada medan
ada medan
E
d. polarisasi muatan ruang :
+ + + + + + + + + + + + + + − − − − − − − − − − − − − − − − + + + + + + + + + + + + + + + − − − − − − − − − − − − − − −
Terjadi pengumpulan muatan di perbatasan dielektrik.
εεεε
r
Tergantung Pada
Dalam medan bolak-baik, polarisasi total
P
, polarisabilitas totalαααα
,dan
εεεε
r, tergantung dari kemudahan dipole untuk mengikuti medanyang selalu berubah arah tersebut.
Dalam proses mengikuti arah medan tersebut, waktu yang
dibutuhkan oleh dipole untuk mencapai orientasi keseimbangan
disebut
waktu relaksasi
.Kebalikan dari
waktu relaksasi
disebutfrekuensi relaksasi
.Jika frekuensi dari medan yang diberikan melebihi frekuensi
relaksasi, dipole tidak cukup cepat untuk mengikutinya, dan proses orientasi berhenti.
Karena frekuensi relaksasi dari empat macam proses polarisasi berbeda-beda, maka kontribusi dari masing-masing proses pada polarisasi keseluruhan dapat diamati.
frekuensi listrik frekuensi optik
frekuensi
power audio radio infra
merah cahaya tampak P;
ε
r absorbsi; loss factor muatan ruang orientasi ionik elektronik orientasi muatan ruang ionik elektronikα
ε
r oC
5×102 cps 104 cps 8×102 cps 5 − 10 − 15 − 20 − 0 0 100 200 300 400 silica glass [6]tanδ : faktor desipasi (loss tangent) Diagram fasor kapasitor
im re IRp IC Itot δ VC
δ
tan
C C Rp CP
=
V
I
=
V
I
Desipasi daya (menjadi panas):
δ
ε
δ
ε
tan
π
2
tan
ω
2 0 0 0 r rC
f
C
P
V
V
V
=
=
εr tanδ : faktor kerugian
Salah satu kriteria dalam pemilihan material untuk keperluan konstruksi adalah kekuatan mekanis-nya
uji tarik (tensile test) uji tekan (compression test)
uji kekerasan (hardness test) uji impak (impact test)
uji kelelahan (fatigue test)
Uji tarik (tensile test) dan uji tekan (compression test) dilakukan untuk mengetahui kemampuan material dalam menahan pembebanan statis. Uji kekerasan untuk mengetahui ketahanan material terhadap perubahan
(deformation) yang permanen.
Uji impak untuk mengetahui ketahanan material terhadap pembebanan mekanis yang tiba-tiba.
Uji kelelahan untuk mengetahui lifetime dibawah pembebanan siklis. Beberapa uji mekanik:
A0
l0
A
l
P
Engineering Stress :
σ
,
didefinisikan sebagai rasio antara beban P pada suatu sampel dengan luas penampang awal dari sampel.0
A
P
=
σ
Engineering Stress : Engineering Strain : 0 0 0l
l
l
l
l
∆
=
−
=
ε
Engineering Strain :
ε
,
didefinisikan sebagai rasio antara perubahan panjang suatu sampel dengan pembebanan terhadap panjang awal-nya.sebelum pembebanan dengan
Stress-Strain Curve : | | | | 0 0.1 0.2 0.3 0.4 0.5 | | | 40 30 20 10 0 strain, ε [in./in.] st re ss , σ [1 0 0 0 p si
] ultimate tensile strength
contoh kurva stress-strain dari Cu polikristal retak
×
| | | 0 0.001 0.002 0.003 | | | 12 9 6 3 0 strain, ε [in./in.] st re ss , σ [1 0 0 0 p si ] daerah elastismulai daerah plastis
E batas elastis di daerah elastis: σ = E
ε
(Hukum Hooke) E = modulus Young yield strength linier| | | | 0 0.05 0.10 0.15 0.20 0.25 | | | 80 60 40 20 0 strain, ε [in./in.] st re ss , σ [1 0 0 0 p si ] baja 1030
upper yield point
lower yield point
×
×
| | | 0 0.001 0.002 0.003 | | | 200 150 100 50 0 strain, ε [in./in.] st re ss , σ [1 0 0 0 p si ] tungsten carbide| | | | 0 0.01 0.02 0.03 0.04 | | | 120 80 40 0 strain: ε [in./in.] st re ss: σ [1 0 0 0 p si ] besi tuang tekan × × tarik
beton
| | | | 0 0.001 0.002 0.003 0.004 | | | 3 2 1 0 strain: ε [in./in.] st re ss: σ [1 0 0 0 p si ] tekan × × tarikspesimen
Uji kekerasan mengukur kekuatan material terhadap suatu indenter ; indenter ini bisa berbentuk bola, piramida, kerucut, yang terbuat dari material yang jauh lebih keras dari material yang diuji.
Uji kekerasan dilakukan dengan memberikan beban secara perlahan, tegaklurus pada permukaan benda uji, dalam jangka waktu tertentu.
D
d
P Salah satu metoda adalah Test Brinell, dengan
indenter bola tungsten carbide, D = 10 mm Hardness Number dihitung dengan formula:
− − π = 2 2 2 BHN d D D D P
spesimen
Uji impak mengukur energi yang diperlukan untuk mematahkan batang material yang diberi lekukan standar, dengan memberikan beban impuls.
Beban impuls diberikan oleh bandul dengan massa tertentu, yang dilepaskan dari
ketinggian tertentu. Bandul akan menabrak spesimen dan mematahkannya, kemudian naik lagi sampai ketinggian tertentu.
ujung bandul
penahan
Dengan mengetahui massa bandul dan selisih ketinggian bandul saat ia dilepaskan dengan ketinggian bandul setelah mematahkan
spesimen, dapat dihitung energi yang diserap dalam terjadinya patahan.
Semua jenis material berubah bentuk, atau berubah volume, atau keduanya, pada waktu mendapat tekanan ataupun perubahan temperatur.
Perubahan tersebut dikatakan elastis jika perubahan bentuk atau volume yang disebabkan oleh perubahan tekanan ataupun temperatur dapat secara sempurna kembali ke keadaan semula jika tekanan atau temperatur kembali ke keadaan awalnya.
Pada material kristal, hubungan antara stress dan strain adalah linier
sedangkan pada material non kristal (dengan rantai molekul panjang) pada umumnya hubungan tersebut tidak linier.
strain, ε elastis st re ss , σ A strain, ε elastis st re ss , σ A
Pada bagian kurva stress-strain yang linier dapat dituliskan hubungan linier strain: ε elastis st re ss: σ A E = modulus Young
ε
=
σ
E
Modulus Young ditentukan dengan cara lain, misalnya melalui formula:
ρ
=
E
v
densitas material kecepatan rambat suara
Ada beberapa konstanta proporsionalitas yang biasa digunakan dalam
menyatakan hubungan linier antara stress dan strain, tergantung dari macam
stress dan strain
1) Modulus Young l l0 2 2 2 0 0 l z l l l ε = − = ∆ strain: εz st re ss: σ z z z E ε σ = σz σz Panjang awal Panjang sesudah ditarik
2). Modulus shear
θ
=
γ
tan
Shear strain, γ S h e a r st re ss , τγ
τ
=
G
δ l0 θ3) Modulus bulk (volume) volume awal V0 hyd x
=
σ
σ
hyd y=
σ
σ
hyd z=
σ
σ
perubahan volume∆V / V 0 h yd ro st a ti c st re ss : σ hy d 0/V
V
K
hyd∆
σ
=
Energi potensial dari dua atom sebagai fungsi jarak antara keduanya
dapat dinyatakan dengan persamaan:
m n r B r A V = − +
V : energi potensial
r : jarak antar atom
A : konstanta proporsionalitas untuk tarik-menarik antar atom
B : konstanta proporsionalitas untuk tolak-menolak antar atom
Gaya dari dua atom sebagai fungsi jarak antara keduanya dapat
diturunkan dari relasi energi potensial:
M N r b r a F = − +
F : gaya antar atom
r : jarak antar atom
a : konstanta proporsionalitas untuk tarik-menarik antar atom
b : konstanta proporsionalitas untuk tolak-menolak antar atom
N dan M : pangkat yang akan memberikan variasi dari F terhadap r
1 1 + + + − = ∂ −∂ = m n r mB r nA r V F maka , 1 dan , 1 , , : Jika nA = a mB = b n + = N m + = M
Kurva energi potensial dan kurva gaya sebagai fungsi jarak antara
atom, disebut kurva Condon-Morse:
d0 tolak-menolak m r B V = tarik-menarik n r A V = − r e n e rg i p o te n si a l, V jumlah tolak-menolak M r b F = tarik-menarik M r a F = − r g a y a , F jumlah d0
Kurva gaya dan garis singgung pada d
0untuk keperluan praktis dapat
dianggap berimpit pada daerah elastis.
d0 r g a y a , F M N r b r a F = − + daerah elastis
Jarak rata-rata antar atom
meningkat dengan peningkatan
temperatur.
E n e rg i P o te n si a ljarak antar atom
d0 T >> 0o K drata2 drmaks drmin
Pengaruh Temperatur
Tercapainya strain maksimum bisa lebih lambat dari tercapainya stress
maksimum yang diberikan. Jadi strain tidak hanya tergantung dari stress yang diberikan tetapi juga tergantung waktu. Hal ini disebut anelastisitas.
Jika material mendapat pembebanan siklis, maka keterlambatan strain terhadap stress menyebabkan terjadinya desipasi energi.
Desipasi energi menyebabkan terjadinya
damping.
Desipasi energi juga terjadi pada pembebanan monotonik isothermal di daerah plastis.
Efek Thermoelastik
Material kristal cenderung turun temperaturnya jika diregangkan (ditarik).
Jika peregangan dilakukan cukup lambat, maka material sempat
menyerap energi thermal dari sekelilingnya sehingga temperaturnya
tak berubah. Dalam hal demikian ini proses peregangan (straining)
terjadi secara isothermik.
ε
σ
O
X M A A’ε
Mε
A adiabatik isothermikσ
Mσ
M Mε
σ
O
XDesipasi energi per siklus tergantung dari frekuensi
ε
σ
Oε
σ
Oε
σ
Oε
σ
Oε
σ
O d e si p a si e n e rg i p e r si kl u s f1 f2 f3 f4 f5 frekuensif
1f
2>f
1f
3>f
2f
4>f
3f
5>f
4Waktu Relaksasi :
ττττ
t ε ε1 t0 ε2 t12
1
2
ε
ε
−
ε
=
a
(
−
− τ)
ε
=
ε
/ 21
ae
t −[
− τ]
ε
=
ε
( )/ 2e
t t1a
Keretakan adalah peristiwa terpisahnya satu kesatuan menjadi dua
atau lebih bagian. Bagaimana keretakan terjadi, berbeda dari satu
material ke material yang lain, dan pada umumnya dipengaruhi oleh
stress yang diberikan, geometris dari sampel, kondisi temperatur dan
laju strain yang terjadi.
Keretakan dibedakan antara keretakan brittle dan ductile.
Keretakan brittle terjadi dengan propagasi yang cepat sesudah sedikit
terjadi deformasi plastis atau bahkan tanpa didahului oleh terjadinya
deformasi plastis.
Keretakan ductile adalah keretakan yang didahului oleh terjadinya
deformasi plastis yang cukup panjang / lama, dan keretakan terjadi
dengan propagasi yang lambat.
Pada material kristal,
keretakan brittle
biasanya menjalar sepanjang
bidang tertentu dari kristal, yang disebut bidang cleavage.
Pada material polikristal keretakan brittle tersebut terjadi antara grain
dengan grain karena terjadi perubahan orientasi bidang clevage ini
dari grain ke grain.
Selain terjadi sepanjang bidang cleavage, keretakan brittle bisa terjadi
sepanjang batas antar grain, dan disebut keretakan intergranular.
Kedua macam keretakan brittle, cleavage dan intergranular, terjadi
tegak lurus pada arah stress yang maksimum.
Kalkulasi teoritis kekuatan material terhadap keretakan adalah sangat
kompleks. Walaupun demikian ada model sederhana, berbasis pada
besaran-besaran sublimasi, gaya antar atom, energi permukaan, yang
dapat digunakan untuk melakukan estimasi. Tidak kita pelajari.
Keretakan ductile
didahului oleh terjadinya deformasi plastis, dan
keretakan terjadi dengan propagasi yang lambat.
Pada material yang digunakan dalam engineering, keretakan ductile
dapat diamati terjadi dalam beberapa tahapan
•terjadinya necking, dan mulai terjadi gelembung retakan di
daerah ini;
•gelembung-gelembung retakan menyatu membentuk
retakan yang menjalar keluar tegaklurus pada arah stress
yang diberikan;
•retakan melebar ke permukaan pada arh 45
oterhadap arah
tegangan yang diberikan.
Mulai awal terjadinya necking, deformasi dan stress terkonsentrasi di
daerah leher ini. Stress di daerah ini tidak lagi sederhana searah
dengan arah gaya dari luar yang diberikan, melainkan terdistribusi
secara kompleks dalam tiga sumbu arah. Keretakan ductile dimulai di
pusat daerah leher, di mana terjadi shear stress maupun tensile stress
lebih tinggi dari bagian lain pada daerah leher. Teori tidak kita pelajari.
Transisi dari ductile ke brittle
Dalam penggunaan material, adanya lekukan, atau temperatur rendah,
atau pada laju strain yang tinggi, bisa terjadi transisi dari keretakan
ductile ke brittle.
Keretakan ductile menyerap banyak energi sebelum patah, sedangkan
keretakan brittle memerlukan sedikit energi.
Hindarkan situasi yang mendorong terjadinya transisi ke kemungkinan
keretakan brittle.
Keretakan karena kelelahan metal
Material ductile dapat mengalami kegagalan fungsi jika mendapat
stress secara siklis, walaupun stress tersebut jauh di bawah nilai yang
bisa ia tahan dalam keadaan statis.
Tingkat stress maksimum sebelum kegagalan fungsi terjadi, disebut
endurance limit.
Endurance limit didefinidikan sebagai stress siklis paling tinggi yang
tidak menyebabkan terjadinya kegagalan fungsi, berapapun frekuensi
siklis-nya.
Endurance limit hampir sebanding dengan ultimate tensile strength
(UTS). Pada alloy besi sekitar ½ dan pada alloy bukan besi sampai
1/3 UTS.
Secara umum diketahui bahwa jika bagian permukaan suatu spesimen
lebih lunak dari bagian dalamnya maka kelelahan metal lebih cepat
terjadi dibandingkan dengan jika bagian permukaan lebih keras. Untuk
meningkatkan umur mengahadapi terjadinya kelelahan metal,
Sifat-sifat thermal yang akan kita bahas
adalah
kapasitas panas panas spesifik pemuaian konduktivitas panasSejumlah energi bisa ditambahkan ke dalam material melalui pemanasan, medan listrik, medan magnit, bahkan gelombang cahaya seperti pada peristwa photo
listrik yang telah kita kenal.
Pada penambahan energi melalui pemanasan tanggapan padatan termanifestasikan dalam gejala-gejala kenaikan temperatur sampai pada emisi thermal tergantung dari besar
energi yang masuk.
Dalam padatan, terdapat dua kemungkinan penyimpanan energi thermal:
1) penyimpanan dalam bentuk vibrasi atom / ion di sekitar posisi keseimbangannya
Kapasitas Panas
(heat capacity)Kapasitas panas pada volume konstan, Cv
v v
dT dE C =
Kapasitas panas pada tekanan konstan, Cp
p p
dT dH C =
E : energi internal padatan yaitu total energi yang ada dalam padatan baik dalam bentuk vibrasi atom maupun energi kinetik elektron-bebas
T : temperatur
H : enthalpi. Pengertian enthalpi dimunculkan dalam thermodinamika karena amat sulit meningkatkan
kandungan energi internal pada tekanan konstan.
energi yang kita masukkan tidak hanya meningkatkan energi internal melainkan juga untuk melakukan kerja pada waktu pemuaian terjadi.
volume PV E H = + tekanan energi internal T V P T E T P V T V P T E T H ∂ ∂ + ∂ ∂ = ∂ ∂ + ∂ ∂ + ∂ ∂ = ∂ ∂ 0 ≈
Jika perubahan volume terhadap
T cukup kecil suku ini bisa
diabaikan sehingga v T E T H ∂ ∂ ≈ ∂ ∂ p v
C
C
≈
Panas Spesifik
Kapasitas panas per satuan massa per derajat K
dituliskan dengan huruf kecil cv dan cp
Perhitungan Klasik
Molekul gas ideal memiliki tiga derajat kebebasan
energi kinetik rata-rata per derajat kebebasan kBT
2 1
energi kinetik rata-rata (3 dimensi): kBT
2 3
energi per mole Ek mole NkBT RT
2 3 2 3 / = = Bilangan Avogadro Konstanta Boltzman
Atom-atom padatan saling terikat
energi rata-rata per derajat kebebasan kBT
RT
Etot/mole padat = 3 cal/mole K cal/mole 96 , 5 3 = o = = R dT dE c v v
Menurut hukum Dulong-Petit (1820), cv
Hampir sama untuk semua material yaitu 6 cal/mole K
Pada umumnya hukum Dulong-Petit cukup teliti untuk temperatur di atas temperatur kamar. Namun beberapa unsur memiliki panas
spesifik pada temperatur kamar yang lebih rendah dari angka Dulong-Petit, misalnya
Be ([He] 2s2), B ([He] 2s2 2p1),
C ([He] 2s2 2p2), Si ([Ne] 3s2 3p2)
Unsur-unsur ini orbital terluarnya tersisi penuh atau membuat ikatan kovalen dengan unsur sesamanya.
Oleh karena itu pada temperatur kamar hampir tidak terdapat elektron bebas dalam material ini. Lebih rendahnya kapasitas panas
yang dimiliki material ini disebabkan oleh tidak adanya kontribusi elektron bebas dalam peningkatan energi internal.
Sebaliknya pada unsur-unsur yang sangat elektropositif seperti
Na ([Ne] 3s1)
kapasitas panas pada temperatur tinggi melebihi prediksi Dulong-Petit karena adanya kontribusi elektron bebas dalam penyimpanan energi
Perhitungan Einstein
Padatan terdiri dari N atom, yang masing-masing bervibrasi (osilator)
secara bebas pada arah tiga dimensi, dengan frekuensi fE
E n nhf E = Frekuensi osilator Konstanta Planck bilangan kuantum, n = 0, 1, 2,....
Jika jumlah osilator tiap status energi adalah Nn dan N0 adalah jumlah
asilator pada status 0, maka menuruti fungsi Boltzmann
) / ( 0 E k T n N e n B N = −
Jumlah energi per status: NnEn
total energi dalam padatan: =
∑
n
n nE
N E
sehingga energi rata-rata osilator