Acid Hydrolysis Pretreatment of Bagasse-Lignocellulosic Material for
Bioethanol Production
Orchidea Rachmaniah, Andi Krishnanta W., and Dedy Ricardo
Department of Chemical Engineering, FTI – ITS Surabaya, Telp. 031-5946240, Fax. 031-5999282 Kampus ITS Keputih, Sukolilo, Surabaya – 60111, Indonesia. Email: orchideaceae@yahoo.com
Abstract
The use of lignocellulosic biomass residues as a feedstock offers good prespectives for large scale production of fuel ethanol at competitive costs. Many physio-chemical structural and compositional factors hinder the digestibility of cellulose present in lignocellulosic biomass. The goal of any pretreatment technology is to alter or remove structural and compositional impediments to hydrolysis in order to improve the rate of hydrolysis and increase yields of fermentable sugars from cellulose or hemicellulose. Furthermore, pretreatment processing conditions must be tailored to the specific chemical and structural composition of the various, and variable, sources of lignocellulosic biomass. This paper objectives are to study the effect of acid concentrations (H2SO4) and acid-hydrolysis time on the yield of glucose. Decreasing of inhibitor coumpounds (formic acid and phenol monomer coumpound) were also investigated by two different types of detoxification methode. It was found that with the use of higher acid concentration, higher glucose yield could be reached. 59,1378% by weight of glucose yield was obtained by 0,75 w/w sulfuric acid concentration within 45 minutes of hydrolysis time. Detoxification methodes were decreased glucose yield in the range 15-25%, formic acid in the range 25-30%, and phenol monomer in the range 20-25%. Both of those methodes did not give any significant result on glucose, formic acid and phenol monomer decreasing yield.
Keywords: bagasse, ethanol, detoxification, acid-hydrolysis
Pendahuluan
Produksi minyak bumi dunia diperkirakan akan
turun hingga 20 billion barrels pada tahun 2050. Ketersediaan sumber energi minyak yang cenderung turun dari tahun ke tahun memicu adanya usaha-usaha untuk mencari sumber energi alternatif yang dapat diperbarui dan ramah lingkungan. Etanol adalah salah satu bentuk energi alternatif yang ditawarkan. Meningkatnya permintaan akan etanol sebagai sumber energi mengancam keseimbangan ketersediaan bahan baku untuk pangan, pakan, dan untuk sumber energi. Sehingga perlu dipikirkan bahan baku yang tepat untuk produksi etanol tanpa mengancam ketersediaan pangan. Bagasse adalah bahan yang tepat yang dapat digunakan untuk memproduksi etanol. Selain berharga murah, belum banyak dimanfaatkan, bagasse
mengandung serat/lignosellulosa yang dapat pecah menjadi gula sederhana yang akhirnya diubah menjadi etanol melalui proses fermentasi. Untuk memecah lignosellulosa menjadi gula sederhana yang siap difermentasi diperlukan metode pretreatment yaitu hidrolisa. Metode hidrolisa asam encer lebih unggul dibandingkan metode lain dan hidrolisa secara enzimatik. Mengingat metode ini tidak memerlukan
recycle dan proses recovery enzim. Dengan
memperhatikan kendala yang dihadapi pada proses hidrolisis asam, terutama konsentrasi asam, suhu dan waktu hidrolisa yang sangat menentukan terbentuknya produk inhibitor. Untuk itu akan dilakukan penelitian dengan mengkombinasikan proses hidrolisa asam dan detoksifikasi/netralisasi dari bagasse, dengan mengubah konsentrasi asam dan waktu hidrolisa serta metode detoksifikasi pada hidrolisat.
Landasan Teori
Kebutuhan energi, untuk beberapa abad ke depan, semakin meningkat seiring dengan pertumbuhan penduduk dunia dan berkembangnya negara-negara maju menuju negara industri. Minyak bumi, hingga saat ini, masih merupakan sumber energi terbesar guna memenuhi peningkatan permintaan kebutuhan energi. Produksi minyak bumi dunia diperkirakan akan turun hingga 20 billion barrels pada tahun 2050 (Sun and Cheng, 2002). Ketersediaan sumber energi minyak yang cenderung turun dari tahun ke tahun memicu adanya usaha-usaha untuk mencari sumber energi alternatif yang dapat diperbarui dan ramah lingkungan.
Salah satu bentuk energi alternatif yang ditawarkan adalah etanol. Tidak seperti bahan bakar minyak, etanol adalah energi terbarukan dengan tingkat emisi rendah. Etanol adalah bahan bakar alternatif yang lebih aman, serta dapat mengurangi peningkatan penggunaan zat aditif metil tersier butil eter (MTBE). MTBE adalah senyawa racun yang ditambahkan pada bahan bakar minyak sehingga pembakaran akan terjadi lebih sempurna. MTBE diketahui dapat mencemari air tanah, oleh karena itu penggunaannya saat ini telah dibatasi (Sun and Cheng, 2002). Meningkatnya permintaan akan etanol sebagai sumber energi akan meningkatkan permintaan bahan baku. Mengingat hingga saat ini teknologi proses pembuatan etanol yang telah mantap berbahan baku tepung jagung (di Amerika) (Sun and Cheng, 2002) maka dikhawatirkan akan terjadi kompetisi antara ketersediaan bahan baku untuk pangan, pakan, dan untuk sumber energi (Anonim, 2008; Anonim, 2007; Sun and Cheng, 2002). Selain itu, untuk menggantikan semua kebutuhan bahan bakar minyak dunia saat ini diperlukan luas tanah, lahan pertanian, hutan, dll. yang tak terbatas. Sehingga pemenuhan energi alternatif dengan menggunakan bahan baku pangan, khususnya, sangat mengkhawatirkan kelangsungan hidup manusia di masa datang (Anonim, 2007). Sumber bahan baku potensial yang ketersediaannya melimpah, berharga murah, belum banyak dimanfaatkan dan mengandung gula sederhana yang dapat diubah menjadi etanol adalah bahan-bahan lignosellulosa (Anonim, 2008; Anonim 2007; Mosier et al., 2005; Sun and Cheng, 2002).Etanol yang dihasilkan dari bahan-bahan lignosellulosa ini merupakan bioetanol generasi kedua (Anonim, 2008; Sun and Cheng, 2002). Bahan-bahan lignosellulosa ini diantaranya: limbah-limbah pertanian (rumput, alang-alang, sekam padi, rice husk,
wheat straw, sisa-sisa hasil panen/crop residues,
tongkol jagung/corn stover etc.), limbah-limbah perternakan (kotoran hewan), limbah-limbah industri (hasil samping industri fermentasi/silage, molasses,
bagasse, potongan-potongan kayu/wood chips,
sisa-sisa produk pengalengan makanan/agri-food wastes etc.), kertas bekas, kardus bekas, koran bekas dll. (Anonim, 2008; Anonim 2007; Campo et al., 2006; Iranmahboob et al., 2002; Lavarack et al., 2002; Sun and Cheng, 2002).
Bagasse hasil samping proses pembuatan gula tebu
(sugarcane) mengandung residu berupa serat, minimal 50% serat bagasse diperlukan sebagai bahan bakar boiler sedangkan 50% sisanya hanya ditimbun sebagai buangan yang memiliki nilai ekonomi rendah (Lavarack et al., 2002). Penimbunan bagasse dalam kurun waktu tertentu akan menimbulkan permasalahan bagi pabrik. Mengingat bahan ini berpotensi mudah terbakar, mengotori lingkungan sekitar, dan menyita lahan yang cukup luas untuk penyimpanannya (Lavarack et al., 2002). Oleh karena itu, alangkah baiknya jika bagasse ini dimanfaatkan sebagai salah satu bahan pembentuk etanol mengingat serat-serat
bagasse umumnya mengandung lignosellulosa (Lavarack et al., 2002).
Pembuatan bahan-bahan lignosellulosa hingga menjadi etanol melalui empat proses utama:
pretreatment/hidrolisa, fermentasi, dan terakhir adalah
pemisahan serta pemurnian produk etanol (Mosier et al., 2005). Bahan-bahan lignosellulosa umumnya terdiri dari sellulosa, hemisellulosa dan lignin. Sellulosa secara alami diikat oleh hemisellulosa dan dilindungi oleh lignin. Adanya senyawa pengikat lignin inilah yang menyebabkan bahan-bahan lignosellulosa sulit untuk dihidrolisa (Iranmahboob et al., 2002). Oleh sebab itu, proses pretreatment dan hidrolisa merupakan tahapan proses yang sangat penting yang dapat mempengaruhi perolehan yield etanol. Proses pretreatment dilakukan untuk mengkondisikan bahan-bahan lignosellulosa baik dari segi struktur dan ukuran. Proses ini adakalanya dilaksanakan bersama-sama dengan proses hidrolisa. Sebagaimana bagan pada Gambar 1, proses pretreatment yang sekaligus proses hidrolisa meliputi: perlakuan secara fisik, fisik-kimiawi, kimiawi dan enzimatik (Mosier et al., 2005; Sun and Cheng, 2002). Proses ini bertujuan memecah ikatan lignin, menghilangkan kandungan lignin dan hemisellulosa, merusak struktur krital dari sellulosa serta meningkatkan porositas bahan (Sun and Cheng, 2002). Rusaknya struktur kristal sellulosa akan mempermudah terurainya sellulosa menjadi glukosa. Selain itu, hemisellulosa turut terurai menjadi senyawa gula sederhana: glukosa, galaktosa, manosa, heksosa, pentosa, xilosa dan arabinosa. Selanjutnya senyawa-senyawa gula sederhana tersebut yang akan difermentasi oleh mikroorganisme menghasilkan etanol (Mosier et al., 2005).
Walaupun terdapat berbagai macam metode hidrolisa untuk bahan-bahan lignosellulosa, hidrolisa asam dan hidrolisa enzimatik merupakan dua metode utama yang banyak digunakan khususnya untuk bahan-bahan lignosellulosa dari limbah pertanian dan potongan-potongan kayu (Mussantto dan Roberto, 2004). Hidrolisa sellulosa secara enzimatik memberi
yield etanol sedilkit lebih tinggi dibandingkan metode
hidrolisa asam (Palmqvist dan Hahn-Hägerdal, 2000). Namun proses enzimatik tersebut merupakan proses yang paling mahal. Proses recycle dan recovery enzim sellulose diperlukan untuk menekan tingginya biaya produksi (Iranmahboob et al., 2002; Szczodrak dan Fiedurek, 1996). Selain itu, proses hidrolisa enzimatik memerlukan pretreatment bahan baku agar struktur sellulosa siap untuk dihirolisa oleh enzim (Palmqvist dan Hahn-Hägerdal, 2000). Mengingat kerumitan proses hidrolisa enzimatik sebagaimana tersebut di atas, hidrolisa enzimatik dengan enzim sellulose mempengaruhi 43,7% biaya total produksi (Szczodrak dan Fiedurek, 1996).
Hemisellulosa mudah dihidrolisa menggunakan asam konsentrasi rendah (encer) pada kondisi reaksi moderat, akan tetapi diperlukan kondisi yang lebih
ekstrim untuk dapat menghidrolisa sellulosa. Keuntungan utama hidrolisa dengan asam encer adalah, tidak diperlukannya recovery asam, dan tidak adanya kehilangan asam dalam proses (Iranmahboob et al., 2002). Umumnya asam yang digunakan adalah H2SO4 atau HCl (Mussatto dan Roberto, 2004) pada
range konsentrasi 2-5% (Iranmahboob et al., 2002;
Sun dan Cheng, 2002), dan suhu reaksi ± 160oC. Konsentrasi asam dan suhu reaksi merupakan variabel penting yang dapat mempengaruhi terbentuknya senyawa-senyawa yang bersifat racun pada proses fermentasi. Diperlukan suhu moderat (<160oC) untuk dapat menghidrolisa hemisellulosa dan menekan dekomposisi gula sedrehana. Suhu yang lebih tinggi akan mempermudah dekomposisi gula sederhana dan senyawa lignin (Mussatto dan Roberto, 2004). Pada suhu dan tekanan tinggi, glukosa dan xylosa akan terdegradasi menjadi furfural dan hidroksimetilfurfural. Jika furfural dan hidroksimetilfurfural terdekomposisi lanjut, akan didapat asam levulinat dan asam formiat (Mussatto dan Roberto, 2004; Palmqvist dan Hahn-Hägerdal, 2000). Degradasi senyawa lignin akan menghasilkan senyawa-senyawa fenol yang sangat berbahaya bagi mikroorganisme khususnya bagi membran dan matrik enzim dalam sel (Palmqvist dan Hahn-Hägerdal, 2000). Oleh karena itu, hidrolisat hasil hidrolisis asam harus dinetralisasi terlebih dahulu untuk meminimalisasi produk inhibitor dan untuk mengkondisikan hidrolisat supaya siap digunakan pada proses selanjutnya (Mussatto dan Roberto, 2004). Mengingat hidrolisa asam encer efektif untuk menghidrolisis hemisellulosa tanpa proses pretreatment terlebih dahulu, proses ini masih tetap digunakan (Iranmahboob et al., 2002). Untuk meminimalisasi terbentuknya produk inhibitor dari degradasi gula-gula sederhana dan degradasi lignin diperlukan penelitian lebih lanjut terhadap parameter-parameter proses hidrolisa asam serta proses detoksifikasi (Mussatto dan Roberto, 2004; Iranmahboob et al., 2002; Palmqvist dan Hahn-Hägerdal, 2000; Szczodrak dan Fiedurek, 1996). Parameter konsentrasi asam, suhu dan waktu hidrolisa merupakan parameter yang sangat krusial pada proses hidrolisa selain metode detoksifikasi yang tepat
sehingga dapat meminimalkan produk inhibitor yang pada akhirnya meningkatkan yield etanol di akhir proses fermentasi (Campo et al., 2006; Mussatto dan Roberto, 2004; Lavarack et al., 2002).
Metodologi
Penelitian ini secara garis besar dilakukan dalam dua tahap: tahap pretreatment dan hidrolisa asam yang dilanjutkan dengan tahap detoksifikasi. Tahap
pretreatment dan hidrolisa asam: bagasse dikeringkan
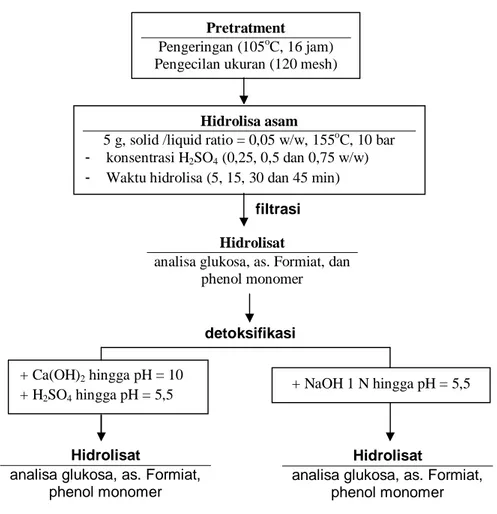
terlebih dahulu pada suhu 105oC selama 16 jam selanjutnya disimpan dalam desikator untuk mempertahankan level moisture (Lavarack et al., 2002). Bagasse yang telah mencapai level moisture yang diinginkan selanjutnya diperkecil ukurannya hingga 120 mesh (Iranmahboob et al., 2002). Selanjutnya dilakukan hidrolisa dengan ditambahkan H2SO4 (0,25, 0,5 dan 0,75 w/w) pada 155oC, 10 bar dan berbagai waktu hidrolisa (5, 15, 30, dan 45 menit). Tahap berikutnya adalah netralisasi /detoksifikasi, yaitu dengan menambahkan kombinasi Ca(OH)2 dan H2SO4 hingga pH hidrolisat mencapai 5,5 (Mussatto dan Roberto, 2004) atau hanya dengan menambahkan NaOH 1 N hingga pH hidrolisat mencapai 5,5 (Iranmahboob et al., 2002). Penelitian ini menggunakan 5 g bagasse dengan solid/liquid ratio 0,05 w/w. Tahapan penelitian dapat dilihat lebih jelas pada Gambar 1.
Analisa bahan baku bagasse dilakukan untuk mengetahui kandungan awal hemisellulosa, sellulosa dan lignin. Analisa lignin dilakukan dengan metode klason, dan analisa selulosa dan hemiselulosa dilakukan dengan metode TAPPI tentative (1931). Sedangkan kandungan glukosa diketahui dengan analisa menggunakan refraktometer, dan kandungan asam formiat dan senyawa phenol monomer menggunakan GC. GC tipe HP 5890 digunakan untuk analisa asam formiat dan phenol monomer dengan kolom OV1 (Fused Silica), 25 m x 0,30 mm x 0,22 µm, detektor FID, gas Nitrogen sebagai carrier dengan laju alir 30 cm3/sec. Suhu injektor dan detektor diset pada 200oC dan 300oC sedangkan oven diatur pada 100oC selama 3 menit hingga mencapai 125oC dengan kenaikan suhu 5oC/min.
Gambar 1. Diagram alir penelitian
Hasil dan Pembahasan
Proses pretreatment dan hidrolisa diperlukan untuk
bahan baku lignosellulosa, mengingat bahan lignosellulose mengandung hemisellulosa, sellulosa dan lignin. Ketiga komponen tersebut saling terikat kuat akibat dari struktur amorphous dan ikatan 1,4’- pada sellulosa serta adanya lignin diantara rantai sellulosa (Mosier et al., 2005). Proses hidrolisa bertujuan untuk memecah ikatan dan menghilangkan kandungan lignin dan hemisellulosa serta merusak struktur kristal sellulosa menjadi senyawa gula sederhana (Sun dan Cheng, 2002). Sun dan Cheng (2002) melakukan proses pretreatment dan hidrolisa terhadap bahan baku bagasse berukuran 80 mesh dalam penelitiannya. Ukuran bahan baku akan mempengaruhi porositas sehingga dapat memaksimalkan kontak antara bahan dengan asam untuk meningkatkan hidrolisis hemisellulosa (Sun dan Cheng, 2002). Semakin kecil ukuran bagasse yang digunakan akan mempermudah terdegradasinya lignin sehingga sellulosa dan hemisellulosa akan terhidrolisa secara optimal. Penelitian ini menggunakan bagasse berukuran 120 mesh.
Hasil analisa terhadap bahan baku bagasse yang digunakan menunjukkan bahwa bahan baku tersebut mengandung lignin 18,54%-berat, hemiselulosa
28,65%-berat dan selulosa 52,81%-berat. Komposisi tersebut menunjukkan bahwa bagasse cukup berpotensi sebagai bahan baku dalam pembuatan glukosa. Kandungan selulosa dan hemiselulosa yang tinggi pada bahan baku dapat menghasilkan glukosa dengan kandungan yang tinggi, sedangkan kandungan lignin akan menyebabkan terbentuknya senyawa turunan phenol. Senyawa tersebut akan bersifat racun dan menghambat proses fermentasi (Palmqvist dan Hahn-Hägerdal, 2000).
Penelitian pendahuluan dilakukan menggunakan alat yang berbeda, yaitu autoclave dan oven. Penelitian pendahuluan dilakukan untuk mengetahui pengaruh variabel (konsentrasi asam, suhu dan waktu hidrolisa) terhadap yield glukosa. Lavarack et.al (2002) mendapatkan kondisi optimum pada temperatur maksimum 160oC, tekanan 2–3 bar dengan waktu hidrolisa 3–4 jam. Hidrolisa menggunakan autoclave dilakukan pada 121–126oC, 1–1,5 bar dan waktu hidrolisa 70, 90, 110, 130 menit, sedangkan pada oven dilakukan pada temperatur 125oC dan tekanan 1 atm selama 180, 200, 220, 240 menit. Penelitian pendahuluan ini menggunakan bagasse dengan solid/liquid ratio 0,05 w/w dan konsentrasi H2SO4 0,25 dan 0,75 w/w.
Pretratment
Pengeringan (105oC, 16 jam) Pengecilan ukuran (120 mesh)
Hidrolisa asam
5 g, solid /liquid ratio = 0,05 w/w, 155oC, 10 bar - konsentrasi H2SO4 (0,25, 0,5 dan 0,75 w/w) - Waktu hidrolisa (5, 15, 30 dan 45 min)
filtrasi Hidrolisat
analisa glukosa, as. Formiat, dan phenol monomer
+ Ca(OH)2 hingga pH = 10 + H2SO4 hingga pH = 5,5
+ NaOH 1 N hingga pH = 5,5
Hidrolisat
analisa glukosa, as. Formiat, phenol monomer
Hidrolisat
analisa glukosa, as. Formiat, phenol monomer
Hasil analisa glukosa menunjukkan bahwa semakin lama hidrolisa dilakukan maka semakin besar perolehan yield glukosa. Namun terdapat beberapa hasil yang menunjukkan adanya penurunan perolehan glukosa (Tabel 1 dan 2). Penurunan tersebut disebabkan tidak homogennya campuran bagasse dengan larutan H2SO4 sehingga luas permukaan kontak antara bagasse dengan larutan H2SO4 tidak optimal. Pernyataan tersebut didukung dengan adanya
bagasse yang terapung dan tidak tercampur dengan
larutan H2SO4 di akhir proses hidrolisa. Perolehan hasil glukosa menunjukkan bahwa kondisi hirolisa 121 – 126 oC dan 1-1,5 bar lebih baik, karena yield glukosa yang diperoleh lebih besar dengan waktu yang lebih singkat, 18,7411% dengan waktu hidrolisa130 menit. Hal ini menunjukkan bahwa tekanan mempengaruhi proses hidrolisa.
Tabel 1. Perolehan yield glukosa (%) pada kondisi hirolisa 121 – 126 oC dan 1-1,5 bar.
Tabel 2. Perolehan yield glukosa (%) pada kondisi hidroliasa 125 oC dan 1 atm
Perolehan yield glukosa dari kedua metode tersebut tidak optimal (maksimal perolehan yield glukosa sebesar 21,4313% dengan waktu hidrolisa 240 menit). Menurut Balat (2007), hidrolisa pada temperatur tinggi 180– 220oC, hemiselulosa dapat terkonversi sebesar 80–95% dan selulosa terkonversi sebesar 50– 55%. Mengingat,
kandungan selulosa dan hemiselulosa dalam bahan baku bagasse yang digunakan lebih besar dari 50% maka seharusnya yield glukosa yang diperoleh dapat lebih besar. Oleh karena itu, penelitian selanjutnya dilakukan pada suhu dan tekanan operasi yang lebih tinggi dan disertai pengadukan.
Selanjutnya, proses hidrolisa dilakukan pada 155oC, 10 bar selama 5, 15, 30, dan 45 menit. Kim et al (2002) melakukan penelitian pada temperatur 200oC dan konsentrasi H2SO4 3%-berat selama 20 menit, dengan perolehan yield glukosa maksimum 34%. Waktu reaksi hidrolisis yang lama akan memicu terbentuknya inhibitor bersifat racun. Glukosa terdegradasi membentuk hydroxymethylfurfural dan bereaksi lebih lanjut membentuk asam formiat. Sedangkan akibat dari degradasi lignin akan terbentuk senyawa-senyawa phenol (Palmqvist and Hahn-Hagerdal, 2000). Ketiga produk tersebut di atas dapat
menghambat pertumbuhan mikroorganisme pada proses fermentasi pembentukan etanol.
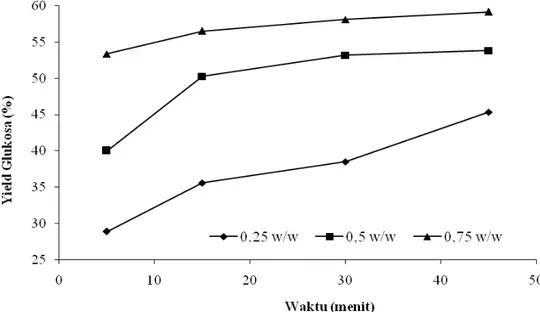
Glukosa dan senyawa gula lainnya merupakan komponen utama dalam pembentukan etanol. Metode hidrolisa asam merupakan salah satu metode untuk memperoleh glukosa yang tinggi dari bahan-bahan lignosellulosa. Konsentrasi asam dan waktu hidrolisa menjadi faktor yang sangat berpengaruh dalam yield pembuatan glukosa. Gambar 2 terlihat bahwa semakin tinggi konsentrasi H2SO4 yang digunakan dan semakin lama waktu hidrolisa menyebabkan perolehan yield glukosa yang semakin besar. Kondisi hidrolisa 155oC, 10 bar memberikan yield glukosa maksimum sebesar 59,1378% pada konsentrasi H2SO4 0,75 (w/w) dan waktu hidrolisa 45 menit (Gambar 2). Konsentrasi asam yang tinggi menyebabkan selulosa dan hemiselulosa lebih mudah terdegradasi menjadi glukosa dan senyawa gula lainnya, terlebih lagi dengan waktu lama, kontak antara bagasse dengan asam juga semakin besar sehingga reaksi hidrolisa berjalan lebih sempurna. Namun, seiring dengan tingginya konsentrasi dan waktu reaksi, inhibitor yang dihasilkan juga semakin besar. Menurut Kim et al (2002), dengan bahan yang sama diperoleh yield glukosa maksimal sebesar 34% pada temperatur 200oC, konsentrasi asam 0,3% selama
No Waktu Konsentrasi H2SO4 (w/w) (menit) 0,25 0,75 1 70 5,4078 13,5463 2 90 5,8407 13,7195 3 110 5,4944 10,0831 4 130 5,2346 18,7411 No Waktu Konsentrasi H2SO4 (w/w) (menit) 0,25 0,75 1 180 6,2736 16,1437 2 200 6,1870 15,2779 3 220 6,3602 19,6069 4 240 6,4468 21,3385
waktu 20 menit. Sedangkan pada penelitian ini yield glukosa maksimal sebesar 59,1378% pada temperatur 155oC, konsentrasi asam 0,75% selama 45 menit. Ini
mengindikasikan bahwa konsentrasi asam dan waktu reaksi yang besar menyebabkan yield glukosa juga
semakin besar.
Gambar 2. Yield glukosa (%) hasil hidrolisa asam pada kondisi 155oC, 10 bar dengan berbagai konsentrasi asam (H2SO4) dan waktu reaksi.
Gambar 3. Yield glukosa (%) sebelum dan setelah proses detoksifikasi (kondisi hidrolisa:155oC, 10 bar, 45 menit waktu hidrolisa dan berbagai konsentrasi asam (H2SO4)).
Detoksifikasi bertujuan agar hidrolisat yang dihasilkan mempunyai kandungan inhibitor yang lebih kecil, selain itu juga mengatur pH agar tidak mengganggu pertumbuhan bakteri pada proses fermentasi pembentukan etanol. Gambar 3 menunjukkan bahwa yield glukosa setelah detoksifikasi mengalami penurunan sebesar 15–25%. Hal ini tampak pada konsentrasi 0,75 w/w sebelum detoksifikasi yield
glukosa sebesar 59,1378%, sedangkan setelah detoksifikasi (menambahkan Ca(OH)2 hingga pH = 10 selanjutnya ditambahkan H2SO4 hingga pH = 5,5) yield glukosa menjadi 46,2489% dan setelah detoksifikasi 2 (menambahkan NaOH 1 N hingga pH = 5,5) menjadi 47,3156%. Penelitian Martin et al., (2002) juga menunjukkan adanya penurunan yield senyawa gula setelah mengalami proses detoksifikasi.
Kedua metode detoksifikasi tersebut di atas, tidak memberikan perbedaan yang signifikan terhadap penurunan yield glukosa ataupun senyawa inhibitor yang dihasilkan (asam formiat dan phenol monomer), yaitu berkisar antara 2–5 %. Hal ini dapat dilihat dari
Gambar 3, pada konsentrasi 0,5 (w/w) dengan
metode detoksifikasi 1 diperoleh yield glukosa sebesar 44,0267 % dan dengan metode detoksifikasi 2 diperoleh yield glukosa 45,8044 %.
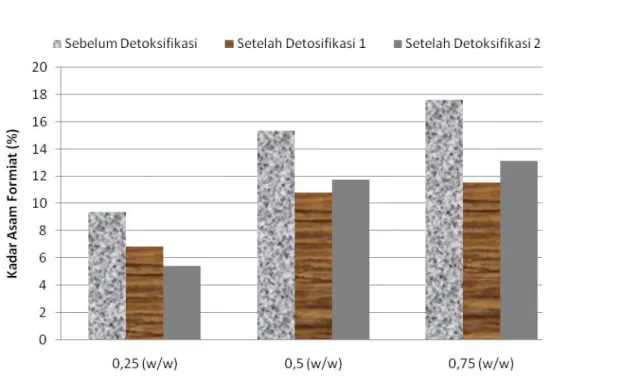
Gambar 4. Kadar asam formiat (%) sebelum dan setelah proses detoksifikasi (kondisi hidrolisa:155oC, 10 bar, 45 menit waktu hidrolisa dan berbagai konsentrasi asam (H2SO4)).
Asam formiat dan senyawa phenol monomer yang terdapat dalam hidrolisat memiliki pengaruh yang sangat besar terhadap proses fermentasi pembentukan etanol, karena sifatnya sebagai inhibitor. Oleh karena itu, dalam hidrolisat diinginkan produk inhibitor seminimal mungkin. Gambar 4 diatas menunjukkan bahwa semakin tinggi konsentrasi H2SO4 maka kadar asam formiat juga semakin besar. Kadar asam formiat terbesar yaitu 17,637% dengan yield glukosa maksimum 59,1378% tercapai pada konsentrasi H2SO4 0,75 w/w. Hal ini mengindikasikan bahwa dengan konsentrasi yang tinggi, glukosa dan senyawa gula lainnya akan lebih banyak terdegradasi membentuk hydroxymethylfurfural dan furfural yang
akhirnya keduanya membentuk asam formiat (Palmqvist and Hahn-Hagerdal, 2000).
Detoksifikasi memberikan pengaruh yang sangat besar terhadap penurunan kadar asam formiat, antara 25–30%. Hal ini terlihat pada Gambar 4, sebelum detoksifikasi kadar asam fomiat pada konsentrasi asam 0,75 w/w sebesar 17,637%, sedangkan dengan menggunakan metode detoksifikasi 1 kadar asam formiat sebesar 11,534 % dan dengan metode detoksifikasi 2 diperoleh kadar 13,139%. Kedua metode detoksifikasi yang dilakukan menunjukkan tidak adanya perbedaan yang signifikan terhadap penurunan kadar asam formiat.
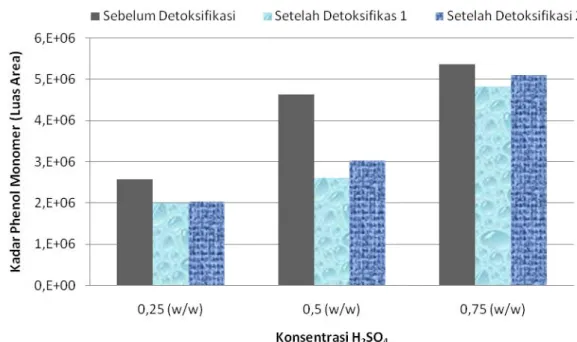
Gambar 5. Kadar Phenol monomer (luas area) sebelum dan setelah proses detoksifikasi (kondisi hidrolisa:155oC, 10 bar, 45 menit waktu hidrolisa dan berbagai konsentrasi asam (H2SO4)).
Kecenderungan hasil yang sama juga terdapat pada kandungan phenol monomer, yang dalam hal ini dideteksi sebagai vanilin (www.valcobond.com). Terlihat pada Gambar 5, sebelum detoksifikasi kadar asam fomiat pada konsentrasi asam 0,25 w/w sebesar 2,57x106 (luas area pada kromatogram), sedangkan pada metode detoksifikasi 1 kadar asam formiat sebesar 1,99x106 (luas area pada kromatogram) dan dengan metode detoksifikasi 2 diperoleh kadar 2,03x106 (luas area pada kromatogram). Data tersebut menunjukkan bahwa proses detoksifikasi memberikan penurunan kadar phenol monomer 20–25%, namun kedua metode detoksifikasi tersebut tidak memberikan perbedaan yang cukup signifikan terhadap penurunan kadar phenol monomer. Hasil penurunan kandungan asam formiat dan senyawa phenol monomer dengan kedua metode detoksifikasi yang dilakukan tidaklah signifikan dimungkinkan karena pH hidrolisat akhir yang diinginkan sama (pH = 5,5).
Kesimpulan
Hasil penelitian memberikan kesimpulan sebagai berikut: semakin tinggi konsentrasi asam (H2SO4) dan waktu hidrolisa maka yield glukosa yang diperoleh akan semakin besar, yield glukosa maksimal sebesar 59,1378% diperoleh pada kondisi 155oC, 10 bar dengan konsentrasi H2SO4 0,75 (w/w) selama 45 menit; tahap detoksifikasi mengakibatkan penurunan kandungan glukosa 15–25 %, asam formiat 25–30% dan senyawa phenol monomer sebesar 20–25 %; dan kedua metode detoksifikasi yang digunakan tidak memberikan hasil yang signifikan (perbedaan yang terjadi berkisar 2–5%) terhadap penurunan kandungan
senyawa inhibitor (asam formiat dan phenol monomer).
Daftar Pustaka
Anonim, 2008. The potential impacts of biofuels on biodiversity. Convention on Biological Diversity. UNEP, UNESCO, Bonn, Germany.
Anonim, 2007. New and emerging issues relating to the conservation and sustainable use of biodiversity. Biodiversity and liquid biofuel production. Convention on Biological Diversity. UNEP, UNESCO, Paris, France.
Balat, M., balat H., Oz C., 2008. Progress in bioethanol processing. Progress in Energy and Combustion Science.
Del Campo, I., Alegria, I., Zazpe, m., Echeverria, M., Echeverria, I., 2006. Diluted acid hydrolysis pretreatment of agri-food wastes for bioethanol production. Industrial Crops and Products, 24:
214 – 221.
Iranmahboob, J., Nadim, F., Monemi, S., 2002. Optimizing acid-hydrlysis: a critical step for production of ethanol from mixed wood chips.
Biomass and Bioenergy, 22: 401 – 404.
Kim, Jun Seok., Hong, Suk In., Lee, Yoon. Y., 2002. Bed-Shrinking Flow-Through Reactor in Dilute Acid Hydrolysis of Cane Bagasse Cellulose. Ind.
Eng. Chem., 8:432 – 436.
Larsson, S., Palmqvist, E., Hahn-Hägerdal, B., Tengborg, B., Stenberg, K., Zacchi, G., Nilvebrant, N.O., 1999. The generation of fermentation inhibitors during dilute acid hydrolysis of softwood. Enzyme Microb. Technol.,
Lavarack, B.P., Griffin, G.J., Rodman, D., 2002. The acid hydrolysis of sugarcane bagasse hemicellulose to produce xylose, arabinose, glucose and other products. Biomass Bioenerg.,
23, 367-380.
Lavarack, B.P., Griffin, G.J., Rodman, D. 2000. Measured kinetics of acid-catalysed hydrolysis of sugar cane bagasse to produce xylose. Catalysis
Today, 63: 257 – 265.
Martin, Carlos., Galbe, Mats., Wahlbom, C. Fredrik., Hahn-Hägerdal, B., Jonsson, Leif J. 2002. Ethanol production from enzymatic hydrolysates of sugar cane bagasse using recombinant xylose-utilising Saccharomyces cerevisiae. Enzyme Microb. Technol., 31, 274-282.
Mosier, N., Wyman, C., Dale, B., Elander, R., Lee, Y.Y., Holtzapple, M., Ladisch, M., 2005. Features of promising technologies for pretreatment of lignocellulosic biomass. Bioresource Technol., 96,
673-686.
Mussatto, S.I., Roberto, I.C., 2004. Alternatives for detoxification of dilute-acid lignocellulosic hydrolyzates for use in fermentative process: a review. Bioresource Technology, 93, 1-10.
Palmqvist, E., Hahn-Hägerdal, B., 2000. Review paper. Fermentation of lignocellulosic hydrolysates. II: inhibitors and mechanisms of inhibition. Bioresource Technology, 74, 25-33.
Papatheofanous,M.G., Billa, E., Koullas, D.P., Monties, B., Koukios, E.G., 1995. Two Stage Acid-Catalyzed Fraction Of Lignocellulosic Biomass In Aqueous Ethanol Systems At Low Temperatures. Bioresource Technology 95: 00152
– 2.
Quintero-Ramirez, R. Hydrolysis of lignocellulosic biomass. Division of Natural Sciences and Engineering. Autonomous Metropolitan University CuajimalpaUnit.
Sassner, Per., Martensson, Carl-Gustav., Galbe, Mats., Zacchi, Guido., 2008. Steam Pretreatment of H2SO4-impregnated Salix for the production of bioethanol. Bioresource Technology, 99, 37 - 145. Sun, Y., Cheng, J., 2002. Hydrolysis of lignocellulosic
materials for ethanol production: a review.
Bioresource Technol., 83, 1-11.
Szczodrak, J., Fiedurek, J., 1996. Technology for conversion of lignocellulosic biomass to ethanol.
Biomass Bioenerg., 10, 367-375.
Verduyn, C., Postma, E., Scheffers, W.A., Dijken, J.P., 1990. Energetics of Saccharomyces cerevisae in anaerobic glucose-limited chemostat cultures. J. Gen. Microbiol. 136, 405 – 412.
www.apta.sp.gov.br/cana/anexos/paper_quintero_Bras il.pdf
www.valcobond.com www.scientificpsychic.com