KARAKTERISTIK DAN KINETIKA ENZIMATIK
β-GALAKTOSIDASE ISOLAT BAKTERI AV-1
PADA SUSU PASTEURISASI
ADYOS BOBBY CHANDRA
G44104005
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2010
KARAKTERISTIK DAN KINETIKA ENZIMATIK
β-GALAKTOSIDASE ISOLAT BAKTERI AV-1
PADA SUSU PASTEURISASI
ADYOS BOBBY CHANDRA
G44104005
Laporan Penelitian
Sebagai Salah Satu Syarat Memperoleh Gelar
Sarjana Sains
Pada Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Judul Skripsi : Karakteristik dan Kinetika Enzimatik β-Galaktosidase Isolat
Bakteri AV-1 pada Susu Pasteurisasi
Nama
: Adyos Bobby Chandra
NIM
: G44104005
Disetujui
Komisi Pembimbing
Dr. Laksmi Ambarsari, MS.
Dr. Ir. Tatik Khusniati, M. App. Sc.
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika, M. App. Sc.
Ketua Departemen Biokimia
PRAKATA
Syukur alhamdulillah penulis haturkan kehadirat Allah SWT atas nikmat
iman dan islam sehingga penulis dapat menyelesaikan Laporan Penelitian dengan
judul Karakteristik dan Kinetika Enzimatik β-Galaktosidase Isolat Bakteri AV-1
pada Susu Pasteurisasi. Kegiatan Penelitian ini dilakukan mulai bulan Agustus
2008 hingga Juni 2009 di Laboratorium Biokimia Mikrob, Bidang Mikrobiologi,
Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), di Jalan
Raya Bogor km 46, Cibinong.
Penulis mengucapkan terima kasih kepada Ibu Dr. Laksmi Ambarsari, MS.
selaku pembimbing dari Program Studi Biokimia dan Ibu Dr. Ir. Tatik Khusniati,
M.App.Sc selaku pembimbing dari institusi LIPI. Penulis juga mengucapkan
terima kasih kepada Mba Hamda dan Teh Neng atas bimbingannya selama di
laboratorium. Terima kasih juga penulis sampaikan kepada ayah, ibu, adik,
keluarga yang telah memberikan doa dan kasih sayangnya.
Penulis menyadari dalam penyusunan laporan penelitian ini masih banyak
kekurangan, untuk itu penulis mengharapkan kritik dan saran membangun ke arah
perbaikan. Semoga laporan penelitian ini dapat bermanfaat bagi kita semua.
Bogor, Februari 2010
ABSTRAK
ADYOS BOBBY CHANDRA. Karakteristik dan Kinetika Enzimatik
β-galaktosidase Isolat Bakteri Terseleksi AV-1 pada Susu Pasteurisasi. Dibimbing
oleh LAKSMI AMBARSARI dan TATIK KHUSNIATI.
Sumber utama karbohidrat pada susu adalah laktosa. Laktosa harus
dipecah menjadi glukosa dan galaktosa oleh enzim β-galaktosidase agar dapat
diserap oleh usus. Penelitian ini bertujuan untuk mengetahui perbedaan
karakteristik dan kinetika enzimatik isolat bakteri terseleksi AV-1 dan
Lactobacillus bulgaricus penghasil β-galaktosidase pada susu pasteurisasi.
Karakteristik dan kinetika enzimatik β-galaktosidase isolat bakteri terseleksi
AV-1 dibandingkan dengan bakteri pembanding, yaitu Lactobacillus bulgaricus.
Kondisi optimum enzim β-galaktosidase isolat bakteri terseleksi AV-1 pada waktu
inkubasi 25 menit, suhu 43 °C, pH 6.5, dengan aktivitas sebesar 0.182 U/ml.
Kondisi optimum enzim β-galaktosidase dari bakteri pembanding Lactobacillus
bulgaricus pada waktu inkubasi 20 menit, suhu 43 °C, pH 6.5, dengan aktivitas
sebesar 0.357 U/ml. Aktivitas β-galaktosidase AV-1 dengan Lactobacillus
bulgaricus secara statistik berbeda nyata (P < 0.05). Enzim β-galaktosidase isolat
bakteri terseleksi AV-1 mempunyai parameter kinetik Vmaks.
0.198 U/ml dan KM
apparent sebesar 1.314 mM, sedangkan enzim β-galaktosidase dari bakteri
pembanding Lactobacillus bulgaricus mempunyai parameter kinetik V
maks.0.385
U/ml dan KM apparent 1.075 mM.
ABSTRACT
ADYOS BOBBY CHANDRA. The Characteristic and Kinetics of
β-galaktosidases Produced by AV-1 Selected Isolate Lactid Acid Bacteria in
Pasteurized Milk. Research was supervised by LAKSMI AMBARSARI and
TATIK KHUSNIATI.
Lactose is not found in natural product except from mammary gland.
Lactose must be hydrolized into glucose and galactose by
β-galaktosidases-enzyme. So that, it is posible to be absorb by intestine. The purpose of this
research was determined differences in characteristic and kinetics of
β-galaktosidases-enzyme produced by AV-1 selected isolate lactid acid bacteria and
Lactobacillus bulgaricus in hydrolyzing pasteurized milk. The optimum condition
of AV-1 isolate β-galaktosidase enzyme was on incubation time 25 minute,
temperature 43 °C, pH 6.5, with activity 0.182 U/ml, while the optimum condition
of Lactobacillus bulgaricus β-galaktosidase enzyme was on incubation time 20
minute, temperature 43 °C, pH 6.5, with activity 0.357 U/ml. The kinetics
parameters (V
maks.and apparent K
M) of isolate AV-1 β-galaktosidase enzyme were
0.198 U/ml and 1.314 mM, while the kinetics parameters (V
maks.and apparent K
M)
of Lactobacillus bulgaricus’ β-galaktosidase enzyme (as control) were 0.385 U/ml
and 1.075 mM. The activity of β-galaktosidase AV-1 isolate statistically was
different from Lactobacillus bulgaricus’ (P < 0.05).
RIWAYAT HIDUP
Penulis dilahirkan di Kepahiang, Bengkulu pada tanggal 14 Mei 1986 dari
ayah Edy Epri, S. Sos dan ibu Yusmaniaharti. Penulis merupakan putra pertama
dari tiga bersaudara.
Tahun 2004 penulis lulus dari SMA Negeri 1 Curup, Bengkulu dan pada
tahun yang sama lulus seleksi masuk IPB melalui Undangan Seleksi Masuk IPB
(USMI). Penulis memilih Program Studi Biokimia, Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah
Pendidikan Agama Islam tahun ajaran 2006/2007. Tahun 2007/2008 penulis
mengikuti lomba Penulisan Ilmiah Mahasiswa Nasional (Pimnas) Bidang Ilmiah
dan Pengabdian Masyarakat. Penulis pernah menjadi Dewan Penasihat
Community of Research and Education in Biochemistry (CREBs) tahun
2005/2006. Penulis aktif di Kesatuan Aksi Mahasiswa Muslim Indonesia
(KAMMI) tahun 2006/2007 sebagai ketua dan pernah menjadi calon ketua Badan
Eksekutif Mahasiswa (BEM) IPB.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ...1
TINJAUAN PUSTAKA
β-Galaktosidase ... 1
Kinetika Enzim ... 2
Bakteri Asam Laktat ... 3
Produk Susu Pasteurisasi Rendah Laktosa ... 4
Laktosa Intoleran ... 4
BAHAN DAN METODE
Bahan dan Alat ...4
Metode ...5
HASIL DAN PEMBAHASAN
Produksi Enzim β-galaktosidase ...6
Penentuan Waktu Inkubasi Optimum ...6
Penentuan Suhu Optimum ...7
Penentuan pH Optimum ...7
Aktivitas β-galaktosidase pada Kondisi Optimum...7
Parameter Kinetik (KM dan Vmaks.) ...8
SIMPULAN DAN SARAN ...9
DAFTAR PUSTAKA ...9
DAFTAR GAMBAR
Halaman
1 Struktur molekul β-galaktosidase ... 1
2 Hidrolisis laktosa oleh β-galaktosidase ... 2
3 Kurva log jumlah pertumbuhan bakteri isolat AV-1 dan L. bulgaricus ... 6
4 Penentuan waktu inkubasi optimum ... 6
5 Pengaruh suhu terhadap aktivitas enzim β-galaktosidase ... 7
6 Pengaruh pH terhadap aktivitas enzim β-galaktosidase ... 7
7 Aktivitas enzim β-galaktosidase sebelum dan sesudah optimasi ... 8
8 Kurva Lineweaver-Burk isolat AV-1 dan L. Bulgaricus ... 8
9 Kurva Michaelis-Menten isolat AV-1 dan L. bulgaricus ... 8
DAFTAR LAMPIRAN
Halaman
1 Kegiatan penelitian ...12
2 Nilai log jumlah pertumbuhan bakteri ...13
3 Absorbansi larutan standar oNP pada 420 nm ...14
4 Aktivitas β-galaktosidase isolat AV-1 pada berbagai waktu inkubasi ...15
5 Aktivitas β-galaktosidase isolat L. bulgaricus pada berbagai waktu inkubasi15
6 Aktivitas β-galaktosidase isolat AV-1 pada berbagai suhu ...15
7 Aktivitas β-galaktosidase isolat L. bulgaricus pada berbagai variasi suhu ....16
8 Aktivitas β-galaktosidase isolat AV-1 pada berbagai pH ...16
9 Aktivitas β-galaktosidase isolat L. bulgaricus pada berbagai variasi pH ...16
10 Aktivitas β-galaktosidase
isolat AV-1 sebelum dan sesudah optimasi ...17
11 Aktivitas β-galaktosidase
Lactobacillus bulgaricus sebelum dan
sesudah optimasi ...18
12 Konversi konsentrasi substrat dari satuan mg/ml menjadi mM dari isolat
AV-1 dan Lactobacillus bulgaricus ...18
13 Data penentuan kinetika enzim isolat AV-1 ...19
14 Data penentuan kinetika enzim Lactobacillus bulgaricus ...19
15 Analisis statistik aktivitas enzim β-galaktosidase ...20
1
PENDAHULUAN
Susu merupakan bahan pangan yang baik bagi manusia karena mengandung zat gizi yang tinggi, yaitu karbohidrat, protein, lemak, vitamin, dan mineral. Susu adalah suatu cairan yang merupakan hasil pemerahan dari sapi atau hewan menyusui lainnya yang dapat digunakan sebagai bahan makanan yang sehat (Hadiwiyoto 1994). Semua jenis susu mempunyai komponen yang sama, tetapi jumlahnya bervariasi tergantung dari spesies, faktor genetik, iklim, dan masa laktasi. Komposisi utama yang terdapat di dalam air susu sapi adalah air 87,25%, lemak 3,80%, laktosa 4,80%, protein 3,50%, dan abu 0,65% (Buckle et al. 1987). Laktosa merupakan karbohidrat utama dengan proporsi 4.7% dari total susu (Chaplin 2004). Keberadaan laktosa dalam susu merupakan salah satu keunikan dari susu itu sendiri karena laktosa tidak terdapat di alam kecuali sebagai produk dari kelenjar susu. Laktosa merupakan zat makanan yang menyediakan energi bagi tubuh. Namun, laktosa ini harus dipecah menjadi glukosa dan galaktosa oleh enzim β-galaktosidase agar dapat diserap oleh usus, masuk ke pembuluh darah, dan kemudian diedarkan ke seluruh tubuh untuk digunakan sebagai bahan bakar.
Laktosa yang tidak dipecah dapat menyebabkan diare akut. Hal ini disebabkan dalam ususnya tidak terkandung enzim pencerna laktosa, sehingga laktosa dicerna oleh mikroba usus besar dan menimbulkan diare. Disamping sebagai sumber karbohidrat (laktosa) susu juga sangat penting sebagai sumber protein, vitamin dan mineral. Produksi enzim β-galaktosidase pada manusia menjadi sangat esensial. Apabila tubuh kekurangan protein untuk produksi enzim β-galaktosidase menyebabkan galaktosialidosis atau sindrom Morquio B (Tossaveinen 2003).
Enzim β-galaktosidase berkerja dengan karakteristik yang spesifik. Karakteristik dan kinetika enzimatik isolat bakteri asam laktat terseleksi dan Lactobacillus bulgaricus penghasil enzim β-galaktosidase telah diketahui (Yuningtias 2008). Namun demikian, karakteristik dan kinetika enzimatik β-galaktosidase dari isolat bakteri asam laktat terseleksi dan Lactobacillus bulgaricus dalam menghidrolisis laktosa pada susu pasteurisasi belum diketahui.
Penelitian ini bertujuan untuk menentukan perbedaan karakteristik dan kinetika enzimatik isolat terseleksi bakteri asam laktat dan Lactobacillus bulgaricus penghasil β-galaktosidase pada susu pasteurisasi.
Karakteristik dan kinetika enzimatik β-galaktosidase isolat bakteri terseleksi dibandingkan dengan bakteri pembanding, yaitu Lactobacillus bulgaricus. Hipotesis penelitian ini adalah karakteristik dan kinetika enzimatik β-galaktosidase isolat bakteri asam laktat terseleksi pada susu pasteurisasi kemungkinan berbeda dibandingkan karakteristik dan kinetika enzimatik pada β-galaktosidase Lactobacillus bulgaricus dalam produk susu yang sama.
Penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai perbedaan karakteristik dan kinetika enzimatik antara isolat bakteri asam laktat terseleksi penghasil β-galaktosidase dan Lactobacillus bulgaricus yang selanjutnya dapat diterapkan dalam proses pembuatan produk susu pasteurisasi rendah laktosa.
TINJAUAN PUSTAKA β-Galaktosidase
Enzim β-galaktosidase (EC. 3.2.1.23) mempunyai nama dagang laktase (Marteu et al. 1990). β-galaktosidase (Gambar 1) adalah enzim penghidrolisis laktosa menjadi glukosa dan galaktosa (Szczodrak 2000). Enzim ini bisa diisolasi dari berbagai mikroorgnisme baik bakteri, jamur, ataupun yeast (Bansal et al.
2008; Sandra et al. 2004). Bakteri penghasil β-galaktosidase
diantaranya adalah Bifidobacterium adolescentis (Ding & Shah 2008; Sandra et al. 2004), β-galaktosidase dari khamir diantaranya adalah Saccharomyces fragilis (Khusniati 2000), dan β-galaktosidase dari jamur diantaranya adalah Aspergillus niger dan Penicillium chrysogenum (Bansal et al. 2008).
Enzim β-galaktosidase dapat digunakan pada berbagai produk susu hewani terutama produk susu rendah atau bebas laktosa. Enzim β-galaktosidase dalam produk susu rendah atau bebas laktosa sangat membantu bagi peminum susu yang menderita ”laktosa intoleran”.
2
Peranan enzim β-galaktosidase dalam membantu penderita laktosa intoleran adalah dalam menhidrolisis laktosa menjadi glukosa dan galaktosa (Gambar 2). Enzim β-galaktosidase juga terdapat pada usus halus manusia (Campbell et al. 2005). Laktosa yang tidak terhidrolisis dalam usus manusia mengakibatkan sakit perut dan diare (Winarno 1999). Hal ini disebabkan karena sifat osmotik yang tinggi pada laktosa yang dapat menarik cairan tubuh ke dalam usus kecil dan merangsang gerakan peristaltik dinding usus semakin cepat, sehingga isi usus kecil berpindah cepat ke dalam usus besar. Bakteri-bakteri dalam usus besar akan memfermentasi laktosa menjadi berbagai asam organik dan gas yang mengakibatkan timbulnya rasa sakit dalam perut dan diare (Winarno 1999).
.
Gambar 2 Hidrolisis laktosa oleh β-galaktosidase.
Kinetika Enzim
Setiap enzim memiliki karakteristik yang berbeda-beda, tergantung dari mana enzim tersebut dihasilkan. Konstanta Michaelis-Menten (KM) dan kecepatan reaksi maksimum (Vmaks.) adalah parameter utama dari karakteristik suatu enzim. Karakteristik β-galaktosidase dari bakteri secara umum sangat dipengaruhi oleh waktu inkubasi, suhu, pH, substrat, aktivator dan inhibitor (Huang et al. 1995; Palmer 1991).
Waktu inkubasi setiap enzim berbeda-beda. Semakin lama waktu inkubasi maka ikatan antara enzim substrat semakin meningkat. Produk yang diperoleh semakin banyak dengan meningkatnya jumlah kompleks enzim substrat. Penambahan substrat pada kondisi tertentu tidak berpengaruh terhadap peningkatan produk karena sudah pada kondisi jenuh.
Setiap enzim mempunyai suhu optimum untuk bekerja. Chakraborti (2000) menjelaskan bahwa, seperti sifat kimia lainnya kenaikan suhu akan mempercepat reaksi enzimatik. Hal ini disebabkan kenaikan suhu dapat meningkatkan energi senyawa yang bereaksi, sehingga mampu melampaui energi aktivasi. Suhu yang meningkat akan menyebabkan aktivitas enzim meningkat. Namun demikian, karena enzim adalah protein yang akan mengalami denaturasi pada suhu tinggi, maka dalam batas suhu tertentu setelah kondisi optimum tercapai terjadi penurunan sifat katalitik enzim. Pemanasan protein dapat menyebabkan rusaknya konformasi protein, dimana lipatan-lipatan rantai peptida akan terbuka (Fernandez et al. 2002).
Pengaruh pH terhadap aktivitas enzim sangat sensitif. Pada pH tertentu kecepatan katalitik enzim akan mencapai maksimum. Kisaran pH optimal β-galaktosidase dari fungi antara 3.5 sampai 4.5, sedangkan pH optimum β-galaktosidase dari bakteri antara 5.0-7.0 (Huang et al. 1995; Palmer 1991). Enzim merupakan molekul yang bersifat amfoter, yang mengandung sejumlah gugus asam dan basa. Jumlah muatan ini akan bervariasi tergantung dari konstanta dissosiasi enzim dan pH lingkungan enzim tersebut berada. Hal ini akan berpengaruh terhadap total muatan enzim dan distribusi muatan pada permukaan enzim, yang akhirnya akan berpengaruh terhadap reaktivitas sisi aktif enzim (Chaplin & Buck 1990).
Enzim menyediakan banyak tempat untuk pengikatan dan pelepasan proton. Hal ini dapat dipahami mengingat pada dasarnya enzim adalah protein yang tersusun oleh asam amino yang dapat mengadakan ionisasi dengan mengikat atau melepaskan proton atau atom hidrogen. Pada gugus asam amino dan gugus fungsional lainnya, jumlah proton yang tersedia dalam larutan enzim dipengaruhi oleh pH larutan. Bentuk konformasi protein yang berkaitan dengan stabilitas enzim dipertahankan oleh ikatan peptida, ikatan hidrogen, interaksi elektrostatik, ikatan disulfida, interaksi hidrofobik, dan interaksi dipole-dipole (Chakraborti et al. 2000). Interaksi ikatan yang terjadi pada protein sangat rentan terhadap perubahan pH. Pada perubahan pH yang ekstrim dapat menyebabkan konformasi protein berubah sehingga protein mengalami denaturasi.
Sifat-sifat enzim juga dapat dilihat dari kecepatan katalitik enzim terhadap substrat. Kecepatan katalitik ini dapat dilihat dengan menentukan konstanta Michaelis-Menten (KM)
3
dan kecepatan maksimum (Vmaks.). Konstanta Michaelis-Menten menunjukkan konsentrasi substrat yang dibutuhkan untuk mencapai setengah kecepatan maksimum, dan Vmaks. menunjukkan kecepatan maksimum yang dapat dicapai oleh enzim pada kondisi yang telah ditentukan. Palmer (1991) menjelaskan reaksi antara enzim dengan substrat sebagai mekanisme reaksi enzimatik dari reaksi enzim (E) dengan reaktan (S) membentuk kompleks (X) kemudian menghasilkan produk (P) dan enzim (E) (Khanafiah 2003). Reaksi kesetimbangan enzimatik apabila diturunkan diperoleh persamaan Michaelis-Menten sebagai berikut:
]
[
]
[
0S
K
S
V
V
M maks
Terlihat bahwa KM tidak dipengaruhi oleh konsentrasi substrat maupun konsentrasi enzim, KM hanya dapat diubah oleh faktor lingkungan. Kecepatan maksimum (Vmaks.) dapat ditingkatkan dengan meningkatkan konsentrasi enzim dan mengubah faktor lingkungan. Persamaan Michaelis-Menten jika dilakukan transformasi linier maka diperoleh persamaan Lineweaver-Burk. Persamaannya sebagai berikut: maks maks M
V
S
V
K
V
1
]
[
1
.
1
0
keterangan: Vo = kecepatan awal Vmaks. = kecepatan maksimum [S] = konsentrasi substrat Km = tetapan Michaelis-MentenPersamaan Lineweaver-Burk jika dipetakan dalam grafik akan diperoleh kemiringan KM/Vmaks. dengan titik potong sumbu y = 1/Vmaks. pada x = 0, dan titik potong sumbu x = - 1/KM pada y = 0. Dengan demikian harga KM dan Vmaks. dapat ditentukan dengan mengukur laju pembentukan produk pada berbagai konsentrasi substrat.
Bakteri Asam Laktat
Berdasarkan aktivitas dan ciri-ciri fisiologis, bakteri asam laktat dikelompokkan menjadi dua bagian, yaitu homofermentatif dan heterfermentatif (Surono 2004). Bakteri asam laktat homofermentatif melibatkan jalur Embden Meyerhof, yaitu glikolisis yang menghasilkan ATP sebanyak 2 mol, asam laktat, dan menghasilkan sel dua kali lebih banyak dari bakteri asam laktat heterofermentatif.
Bakteri asam laktat adalah bakteri yang dapat memfermentasi laktosa menjadi asam laktat. Contoh bakteri asam laktat adalah Lactobacillus, Bifidobacteria, dan Lactic cocci (Streptococcus, Peptococcus, dan Leuconostoc). Spesies ini selain memfermentasi laktosa juga memproduksi hidrogen peroksida (H2O2). Bakteri
Lactobacillus bulgaricus merupakan mikrob penghasil asam laktat yang mengandung zat anti bakteri dan bersifat sebagai penghambat pertumbuhan bakteri psikotrof (Hoover 1993).
Salah satu faktor yang mempengaruhi bakteri asam laktat dalam menekan atau menghambat pertumbuhan mikroorganisme lain adalah keadaan aw (water activity) makanan tersebut, baik selama proses pengolahan atau pada produk akhir (Troller & Stinson 1981). Bakteri asam laktat mempunyai enzim-enzim β-galaktosidase, glikolase, dan laktat dehidrogenase (LDH) yang menghasilkan asam laktat dari laktosa pada proses fermentasi (Surono 2004). Awal abad ke-20, Metchnikoff (1845-1916) melaporkan bahwa asam yang difermentasi oleh bakteri asam laktat dapat menghambat pertumbuhan dan pembentukan racun oleh bakteri pembentuk spora anaerob di dalam usus halus.
Bakteri asam laktat dalam dunia industri dimanfaatkan untuk produksi berbagai produk susu diantaranya yogurt, kefir, dan dadih (Marshall & Tamime 1997). Kemampuan sisi aktif enzim β-galaktosidase mengaktivasi reaksi hidrolisis laktosa menjadi D-glukosa dan D-galaktosa membuat produk susu tersebut rendah laktosa (Fleet 1999; Kilara & Shahani 1975).
Lactobacillus bulgaricus
Peran Lactobacillus bulgaricus dalam berbagai produk susu pasteurisasi adalah menghidrolisa laktosa menjadi glukosa dan galaktosa (Bouzar et al. 1996). L. bulgaricus dalam menghidrolisa laktosa pada susu pasteurisasi dapat menghasilkan produk susu pasteurisasi rendah laktosa (Chabot et al. 2001).
L. bulgaricus adalah bakteri gram positif (+) yang berbentuk batang, medium atau panjang. Bakteri ini tumbuh pada suhu 10 °C sampai 45 °C. Karakteristik lainnya tidak tahan garam 6.5% dan termodurik. L. bulgaricus mempunyai sifat penghambat terhadap mikroflora yang sering terdapat pada makanan yang disimpan pada suhu dingin seperti Pseudomonas fragi, Achromobacter liquefaciens, dan Staphylococcus aureus. Keberadaan mereka tidak diinginkan, dan
4
timbul sebagai akibat kontaminasi dari bahan mentah, proses pengolahan yang kurang baik, atau penanganan yang kurang bersih (Abdel & Harris 1984).
Produk Susu Pasteurisasi Rendah Laktosa
Kultur mikroorganisme yang digunakan dalam pengolahan produk-produk susu terutama terdiri dari bakteri asam laktat, yaitu kelompok bakteri yang dapat memproduksi asam laktat sebagai bagian utama dari produk akhir. Selain itu bakteri asam laktat juga memproduksi asam asetat dalam jumlah kecil, tetapi meskipun jumlahnya kecil asam asetat bersifat toksik terhadap mikroorganisme. Penurunan pH karena pembentukan asam tersebut menyebabkan terhambatnya pertumbuhan mikroorganisme yang tidak diinginkan, terutama tipe putrefaktif (Pseudomonas) dan patogen (Salmonella dan Stapilococcus). Keberhasilan kultur bakteri asam laktat dalam pengolahan pangan dipengaruhi oleh kecepatan pembentukan asam untuk menjamin bahwa mikroorganisme yang tidak diinginkan tidak sempat tumbuh (Fardiaz 1990).
Selain pemecahan karbohidrat, perubahan lain yang terjadi sebagai akibat aktivitas bakteri asam laktat adalah perubahan dalam protein. Kultur bakteri asam laktat akan menghidrolisa protein untuk memperoleh nitrogen yang dibutuhkan untuk pertumbuhan di dalam susu. Pemecahan protein, terutama kasein menyebabkan pembentukan kurd yang diinginkan dan mengakibatkan protein menjadi lebih mudah dicerna. Hasil pemecahan protein bersama-sama dengan hasil pemecahan laktosa dan lipid menyebabkan pembentukan cita rasa spesifik pada produk (Fardiaz 1990).
Produk susu rendah laktosa terdiri dari berbagai macam produk susu baik dari susu pasteurisasi maupun susu UHT dan juga produk susu fermentasi (Kilara & Shahani 1975). Untuk produk susu pasteurisasi rendah laktosa belum diproduksi dan beredar di Indonesia. Namun demikian, di negara-negara maju produk susu pasteurisasi baik rendah maupun bebas laktosa sudah diproduksi dan dikonsumsi oleh masyarakat.
Laktosa Intoleran
Penderita laktosa intoleran (ketidakmampuan mencerna laktosa) adalah orang yang tidak dapat mengkonsumsi susu karena tidak mempunyai enzim pemecah laktosa di dalam sistem pencernaannya. Hasil pengamatan menunjukkan bahwa penderita
laktosa intoleran dapat mengkonsumsi susu yang difermentasi tanpa mengalami sakit (Gilliland 1990). Hal ini disebabkan kultur laktat yang digunakan dalam fermentasi susu mempunyai sistem enzim yang dapat memecah laktosa menjadi gula sederhana, yaitu glukosa dan galaktosa. Kultur tersebut mempunyai enzim pemecah laktosa, yaitu β-galaktosidase (German et al. 1999).
Goodenough dan Kleyn (1976) melaporkan bahwa tikus yang diberi makan yogurt yang mengandung kultur hidup dapat mencerna laktosa lebih efisien dibandingkan dengan tikus yang diberi makanan lainnya, termasuk yogurt yang tidak diberi kultur hidup. Kilara dan Shahani (1975) menyimpulkan bahwa lisis dari sel kultur yogurt, yang terjadi di dalam saluran usus, membebaskan β-galaktosidase dari sel, dan β-β-galaktosidase tersebut dapat mencerna laktosa yang terdapat di dalam produk susu. Oleh karena itu, aktivitas β-galaktosidase perlu dipertahankan di dalam kultur bakteri asam laktat. Adanya enzim β-galaktosidase di dalam kultur bakteri asam laktat yang digunakan untuk fermentasi susu, menyebabkan penderita laktosa intoleran dapat menkonsumsi produk-produk tersebut tanpa mengalami gangguan sakit.
BAHAN DAN METODE Bahan dan Alat
Bahan-bahan yang digunakan adalah isolat terseleksi AV-1 (Yuningtias 2008), Lactobacillus bulgaricus yang berasal dari koleksi biakan bakteri Bidang Mikrobiologi LIPI Cibinong, media MRS steril (24 g pepton, 9.6 yeast ekstrak, 19.2 beef ekstrak, 2.4 ml tween 80, 4.8 Na2HPO4, 12 g CH3COONa. 3H2O, 4.8 g triamoniumsitrat, 0.48 g MgSO4. 7H2O, 0.12 g MnSO4. 4H2O, 1200 ml akuades) + susu pasteurisasi 4 %, nitrofenol (oNP), o-nitrofenil-β-D-galaktopiranosida (oNPGal), buffer fosfat pH 4.5-8, buffer fosfat 0.1 M pH 7, buffer fosfat 0.01 M pH 7, Na2CO3 1 M, dan akuades.
Alat-alat yang digunakan adalah spektrofotometer UV-VIS 1700 Shimadzu, inkubator Isuzu, autoklaf Hiclave, High Speed Refrigerated Centrifuge 6500 KUBOTA, ultra sonic homogenizer UH-150, botol sentrifus, laminar air flow, sonikator Eyela, stopwatch, neraca analitik, pH meter HM-25G TOADKK, termometer, mikropipet, bunsen, penangas air, penangas es, dan alat-alat gelas lainnya.
5
Metode
Perhitungan Total Bakteri Isolat AV-1 dan
Lactobacillus bulgaricus
Sebanyak 0.1 ml isolat bakteri asam laktat dengan kerapatan optik 0.5 ditambahkan ke dalam 0.9 ml akuades steril (penganceran 10-1). Pengenceran dilakukan hingga faktor pengenceran 10-3. Tiap-tiap pengenceran diambil 0.1 ml dan disebar dengan batang kaca pada media MRS agar + susu pasteuriasi pada cawan petri. Media selanjutnya diinkubasi pada suhu 37 °C dan tiap 3 jam dihitung jumlah koloni yang tumbuh hingga jam ke-48. Jumlah koloni yang tumbuh dikalikan dengan faktor pengenceran, kemudian dibuat kurva log pertumbuhan bakteri.
Produksi β-Galaktosidase (Noh & Gilliland modifikasi 1993)
Sebanyak 2% isolat bakteri asam laktat dengan kerapatan optik 0.5 diinokulasikan ke dalam 2400 ml media steril MRS yang telah ditambah susu pasteurisasi sebanyak 1200 ml, lalu diinkubasi pada suhu 37 °C selama 24-27 jam. Setelah inkubasi selesai, cairan disentrifus dengan kecepatan 10000 rpm selama 15 menit pada suhu 4 °C. Peletnya dilakukan pencucian sebanyak dua kali dengan 500 ml buffer fosfat 0.1 M pH 7, kemudian dilakukan pemecahan sel dengan sonikator pada suhu 4 °C selama 10 menit. Supernatan hasil sonikator disentrifus dengan kecepatan 10.000 rpm selama 10 menit. Supernatan yang didapat adalah enzim β-galaktosidase kasar yang akan digunakan untuk uji selanjutnya.
Uji Aktivitas β-Galaktosidase (Marteau et
al. Modifikasi 1990)
Sebanyak 1000 µl buffer fosfat 0.1 M pH 7 dan 100 µl enzim dimasukkan ke dalam tabung reaksi, lalu diinkubasi selama 15 menit pada suhu 37 °C. Setelah inkubasi selesai, selanjutnya ditambahkan 200 µl o-nitrofenil-β-D-galaktopiranosida (oNPGal) 4 mg/ml, lalu diinkubasi selama 15 menit pada suhu 37 °C. Setelah inkubasi ke-2 selesai, ditambahkan 1000 µl Na2CO3 1 M. Larutan dianalisis dengan spektrofotometer UV-VIS pada panjang gelombang 420 nm. Aktivitas enzim (U/ml) adalah jumlah µmol o-nitrofenol (oNP) yang dibentuk per menit per mililiter enzim dalam kondisi percobaan. Aktivitas enzim dirumuskan:
Aktivitas (U/ml) = mikromol oNP V x t keterangan:
mikromol oNP = jumlah oNP saat percobaan
V = Volume enzim yang diuji (0.1 ml)
t = Waktu inkubasi (menit) Karakterisasi β-Galaktosidase
Penentuan Waktu Inkubasi Optimum. Enzim β-galaktosidase diuji pada berbagai variasi waktu yaitu 0, 5, 10, 15, 20, 25, dan 30 menit. Aktivitas tertinggi dari hasil uji aktivitas β-galaktosidase pada berbagai waktu inkubasi merupakan waktu inkubasi optimum enzim β-galaktosidase (Marteu et al. modifikasi 1990).
Penentuan Suhu Optimum. Enzim β-galaktosidase diuji pada berbagai variasi suhu, yaitu 34-49 °C. Pengujian aktivitas dilakukan pada waktu inkubasi optimum. Aktivitas tertinggi dari hasil uji aktivitas β-galaktosidase pada berbagai suhu merupakan suhu optimum enzim β-galaktosidase (Marteu et al. modifikasi 1990).
Penentuan pH Optimum. Enzim β-galaktosidase diuji pada berbagai pH 4.5-8.0. Pengujian aktivitas dilakukan pada suhu dan waktu inkubasi optimum. Aktivitas tertinggi dari hasil uji aktivitas β-galaktosidase pada berbagai pH merupakan pH optimum enzim β-galaktosidase (Marteu et al. modifikasi 1990) . Penentuan Aktivitas Optimum β-Galaktosidase . Penentuan aktivitas optimum β-galaktosidase dilakukan pada saat waktu inkubasi, suhu, dan pH optimum dengan metode Marteu et al. modifikasi (1990).
Penentuan Kinetika Enzim. Analisis KM dan Vmaks melalui uji aktivitas β-galaktosidase (Marteu et al. Modifikasi 1990) dilakukan pada waktu inkubasi, suhu, dan pH optimum dengan berbagai variasi konsentrasi ONPG antara 0-20 mg/ml. Hasil perhitungan dimasukkan ke dalam persamaan Michaelis-Menten dan Lineweaver-Burk.
Persamaan Michaelis-Menten dirumuskan sebagai berikut:
]
[
]
[
0S
K
S
V
V
M maks
sedangkan untuk persamaan Lineweaver-Burk dirumuskan sebagai berikut:
maks maks M
V
S
V
K
V
1
]
[
1
.
1
0
keterangan: Vo = kecepatan awal Vmaks. = kecepatan maksimum [S] = konsentrasi substrat Km = tetapan Michaelis-Menten6
Analisis Statistik
Analisis statistik yang digunakan adalah Rancangan Acak Lengkap (RAL). Penelitian ini dilakukan dengan tiga kali ulangan. Persamaan linier yang digunakan adalah:
Yij = µ + λ+ εij
keterangan:
Yij = aktivitas β-galaktosidase pada isolat ke-i
variasi ke-j.
µ = pengaruh rataan umum
λi = pengaruh aktivitas β-galaktosidase isolat ke-i
εij = pengaruh galat aktivitas β-galaktosidase
ke-i dan ulangan ke-j, j = 1, 2, 3 i = 1 isolat AV-1
j = 2 bakteri pembanding L. bulgaricus data yang diperoleh dianalisis dengan Analysis of Variance (ANOVA) pada tingkat kepercayaan 95% dan taraf 0.05 (Matjik & Sumertajaya 2000).
HASIL DAN PEMBAHASAN Produksi Enzim β-Galaktosidase Produksi enzim β-galaktosidase dilakukan dengan menumbuhkan isolat AV-1 dan bakteri pembanding Lactobacillus bulgaricus pada media MRS agar yang ditambah susu pasteurisasi. Media ini adalah media selektif bagi pertumbuhan bakteri asam laktat. Enzim dipanen pada saat fase eksponensial, yaitu saat sel tumbuh optimum. Pada tahap ini, sel membelah dengan laju konstan dan menghasilkan enzim untuk pertumbuhan (Bergmaier et al. 2005). Jumlah bakteri yang hidup dihitung dengan metode Total Plate Count (TPC). Hubungan antara log jumlah bakteri hidup sebagai ordinat dengan waktu (jam) sebagai aksis isolat AV-1 dan Lactobacillus bulgaricus dibuat untuk menentukan waktu inkubasi optimum.
Hasil penelitian pada kurva log (Gambar 3)
Gambar 3 Kurva log jumlah pertumbuhan bakteri isolat AV-1 dan Lactobacillus bulgaricus.
menunjukkan fase awal (lag) untuk isolat AV-1 dan bakteri pembanding Lactobacillus bulgaricus pada jam ke-0 hingga jam ke-3. Fase eksponensial isolat AV-1 dan Lactobacillus bulgaricus terjadi pada waktu antara 24-27 jam. Pertumbuhan sel isolat AV-1 dan bakteri pembanding Lactobacillus bulgaricus mulai melambat setelah jam ke-27 dan menurun hingga jam ke-48 (Lampiran 2). Tidak ada perbedaan yang signifikan pola pertumbuhan antara kedua isolat AV-1 dan bakteri pembanding Lactobacillus bulgaricus. Log jumlah pertumbuhan bakteri pada fase eksponensial tergantung dari jenis atau spesies bakteri serta komposisi media yang digunakan (Pelczar & Chan 1986; Bergmaier et al. 2005).
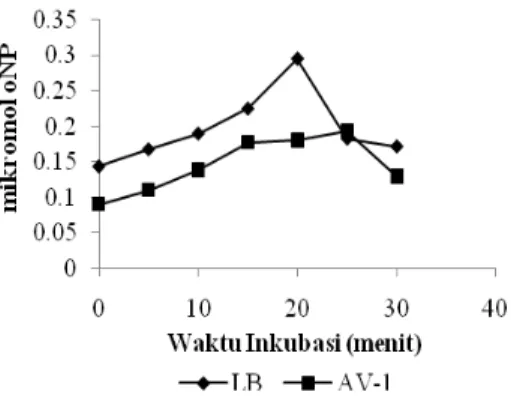
Penentuan Waktu Inkubasi Optimum Tahap ini bertujuan untuk mengetahui pengaruh waktu inkubasi terhadap aktivitas enzim dan menentukan waktu yang tepat dalam penentuan kecepatan awal enzim. Nilai kecepatan awal enzim dibutuhkan dalam penentuan KM dan Vmaks. Data pada Gambar 4 menunjukkan bahwa waktu inkubasi optimum isolat AV-1 selama 25 menit, dengan aktivitas pembentukan oNP sebesar 0.193 µmol, sedangkan waktu inkubasi optimum isolat Lactobacillus bulgaricus selama 20 menit, dengan aktivitas pembentukan oNP sebesar 0.295 µmol. Pengaruh waktu inkubasi terhadap jumlah produk yang dihasilkan berkorelasi positif. Semakin lama waktu reaksi antara enzim dengan substrat menyebabkan jumlah produk semakin meningkat. Jumlah produk yang dihasilkan akan konstan pada kondisi jenuh. Setelah jenuh, lamanya waktu inkubasi tidak berpengaruh terhadap jumlah produk yang dihasilkan. Setelah menit ke-25 hingga ke-30 aktivitas enzim dari kedua isolat turun.
Hasil penelitian ini menunjukkan waktu inkubasi optimum isolat AV-1 dan bakteri pembanding Lactobacillus bulgaricus berbeda.
7
Telah dilaporkan bahwa perbedaan jenis bakteri dan komposisi media menyebabkan perbedaan waktu inkubasi optimum dari sumber bakteri yang berbeda (Noh & Gilliland 1993; Huang et. al. 1995).
Penentuan Suhu Optimum
Aktivitas enzim akan semakin meningkat sejalan dengan kenaikan suhu sampai tingkat optimum, sesudahnya aktivitas enzim akan menurun sehingga kehilangan sebagian aktivitasnya. Aktivitas enzim (U/ml) adalah sejumlah enzim yang dapat menghidrolisis 1 µmol substrat (oNPG) per menit dalam kondisi percobaan (Palmer 1991). Hasil penelitian menunjukkan aktivitas isolat AV-1 dan Lactobacillus bulgaricus meningkat hingga suhu 43 °C. Aktivitas yang diperoleh untuk isolat AV-1 dan L. bulgaricus adalah 0.099 U/ml dan 0.132 U/ml. Peningkatan suhu pada batas optimum menyebabkan naiknya energi kinetik yang mempercepat gerak vibrasi, translasi, serta rotasi enzim dan substrat Kondisi ini akan memperbesar peluang enzim dan substrat untuk bertumbukan. Semakin sering bertumbukan maka reaksi pengikatan kompleks enzim substrat akan meningkat.
Peningkatan suhu setelah kondisi optimum menyebabkan enzim terdenaturasi. Terlihat pada Gambar 5 aktivitas isolat AV-1 dan L. bulgaricus mengalami kenaikan dengan meningkatnya suhu antara 34-43 °C, kemudian aktivitas isolat kedua bakteri tersebut mengalami penurunan dengan meningkatnya suhu antara 43-49 °C.
Gambar 5 Pengaruh suhu terhadap aktivitas enzim β-galaktosidase.
Penentuan pH Optimum
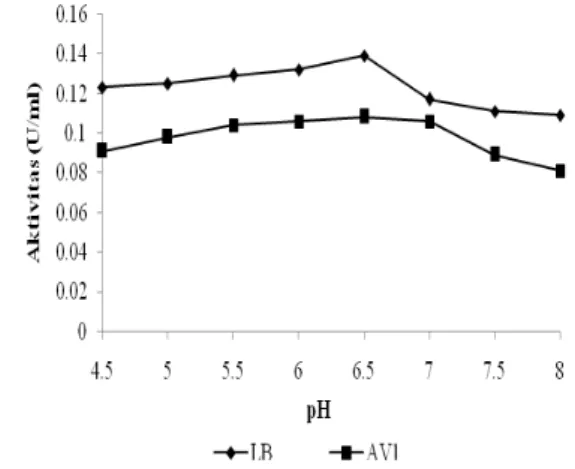
Enzim mempunyai gugus yang dapat terionisasi. Dengan demikian perubahan pH dapat menyebabkan perubahan gugus tersebut yang dapat mengakibatkan perubahan struktur, konformasi, dan sisi aktif enzim (Chakraborti
et. al 2000). Hasil penelitian menunjukkan bahwa mulai dari pH 4.5 sampai pH 6.5 aktivitas enzim β- galaktosidase pada kedua isolat AV-1 dan Lactobacillus bulgaricus mengalami peningkatan (Gambar 6). pH optimum kedua isolat AV-1 dan Lactobacillus bulgaricus dicapai pada pH 6.5 dengan aktivitas tiap-tiap isolat sebesar 0.108 U/ml dan 0.139 U/ml.
Sisi aktif enzim pada pH optimum tersebut seluruhnya sudah berikatan dengan substrat membentuk kompleks enzim substrat. Kerja enzim menurun disebabkan adanya peningkatan pH diatas batas optimum kerja enzim. Hal ini terjadi karena adanya perubahan struktur tiga dimensi molekul enzim atau terjadinya denaturasi enzim.
Aktivitas β-galaktosidase pada AV-1 sedikit menurun sampai pH 7.0 dan terus menurun sampai pH 8.0, sedangkan aktivitas β-galaktosidase pada Lactobacillus bulgaricus terus menurun mulai pH 7.0 sampai pH 8.0. Meskipun kemampuan enzim dalam menghidrolisis substrat mulai menurun, aktivitas enzim isolat AV-1 dan Lactobacillus bulgaricus masih ditemukan sampai pH 8.0.
Hasil penelitian ini menunjukkan pH optimum isloat AV-1 dan bakteri pembanding Lactobacillus bulgaricus tidak berbeda. Telah dilaporkan bahwa pH optimum aktivitas enzim β-galaktosidase dari Lactobacillus berkisar antara 5.2 sampai 6.8 (Fernandez et al. 2002).
Gambar 6 Pengaruh pH terhadap aktivitas enzim β-galaktosidase.
Aktivitas β-Galaktosidase pada Kondisi Optimum
Aktivitas enzim β-galaktosidase dari isolat AV-1 dan bakteri pembanding Lactobacillus bulgaricus memberikan hasil produksi yang berbeda. Aktivitas β-galaktosidase sebelum
8
optimasi untuk isolat AV-1 sebesar 0.118 U/ml dan sesudah optimasi sebesar 0.182 U/ml (Gambar 7). Aktivitas β-galaktosidase Lactobacillus bulgaricus sebelum optimasi sebesar 0.150 U/ml, dan sesudah optimasi sebesar 0.357 U/ml. Kondisi optimum β-galaktosidase isolat AV-1 dicapai pada waktu inkubasi selama 25 menit, suhu 43 °C, dan pH 6.5 dengan aktivitas sebesar 0.182 U/ml. Kondisi optimum β-galaktosidase bakteri pembanding Lactobacillus bulgaricus dicapai pada waktu inkubasi selama 20 menit, suhu 43 °C, pH 6.5 dengan aktivitas sebesar 0.357 U/ml.
Aktivitas β-galaktosidase isolat AV-1 dan Lactobacillus bulgaricus setelah optimasi lebih besar dibandingkan sebelum optimasi. Aktivitas isolat AV-1 setelah optimasi lebih kecil dari bakteri pembanding Lactobacillus bulgaricus, yaitu masing-masing sebesar 0.182 U/ml dan 0.357 U/ml. Berdasarkan uji statistik (Lampiran 15), aktivitas enzim β-galaktosidase isolat AV-1 dan bakteri pembanding Lactobacillus bulgaricus berbeda nyata (P < 0.05).
Gambar 7 Aktivitas enzim β-galaktosidase sebelum dan sesudah optimasi. Parameter Kinetik (KM dan Vmaks)
Parameter-parameter KM dan Vmaks umumnya ditentukan untuk melihat pengaruh dari konsentrasi substrat terhadap kecepatan reaksi enzim. Nilai KM suatu enzim merupakan salah satu ukuran yang mencirikan enzim tersebut. Nilai KM suatu enzim tidak tergantung kepada konsentrasi substrat maupun konsentrasi enzim yang bereaksi. Berbeda dengan KM, nilai Vmaks atau kecepatan reaksi maksimum, tergantung kepada konsentrasi enzim yang bereaksi (Palmer 1991).
Persamaan garis pada kurva Lineweaver-Burk isolat AV-1 dan Lactobacillus bulgaricus dibuat dengan menurunkan persamaan
Gambar 8 Kurva Michaelis-Menten isolat AV-1 dan Lactobacillus bulgaricus.
Gambar 9 Kurva Lineweaver-Burk isolat AV-1 dan Lactobacillus bulgaricus. Michaelis-Menten yang diperoleh dari hasil penentuan kinetika enzim. Namun, tidak semua data pada kurva Michaelis-Menten (Gambar 8) dimasukkan untuk mencari persamaan pada kurva Lineweaver-Burk (Gambar 9). Garis regresi untuk pemetaan Lineweaver-Burk dibuat dengan nilai koefisien korelasi mendekati 1.00. Sehingga hanya ada empat data yang dipetakan pada kurva Lineweaver-Burk. Data tersebut diambil pada saat kecepatan reaksi meningkat hingga mencapai kecepatan maksimum. Berdasarkan hasil penelitian, persamaan garis untuk isolat AV-1 adalah Y = 6.634x + 5.04 dengan nilai koefisien korelasi (r) sebesar 0.997 (Gambar 9). Pada penelitian ini nilai KM dan Vmaks ditentukan dengan cara melakukan transformasi data kecepatan awal reaksi enzim
9
dan konsentrasi substrat dari persamaan Michaelis-Menten. Berdasarkan hasil pengujian, aktivitas β-galaktosidase isolat AV-1 mempunyai kecepatan maksimal sebesar 0.198 U/ml dan nilai KM apparent sebesar 1.314 mM. Karakteristik enzim yang didapat untuk isolat AV-1 dibandingkan dengan karakteristik enzim dari bakteri Lactobacillus bulgaricus. Persamaan Lineweaver-Burk untuk bakteri pembanding Lactobacillus bulgaricus adalah Y = 2.793x + 2.597 dengan nilai koefisien korelasi (r) sebesar 0.994 (Gambar 9). Aktivitas β-galaktosidase Lactobacillus bulgaricus mempunyai kecepatan maksimal sebesar 0.385 U/ml dan nilai KM apparent sebesar 1.075 mM. Perbandingan kurva Michaelis-Menten untuk isolat AV-1 dan Lactobacillus bulgaricus dapat dilihat pada gambar 9. Gambar 9 menunjukkan dengan jelas aktivitas enzim β-galaktosidase dari isolat AV-1 dan bakteri pembanding Lactobacillus bulgaricus yang berbeda.
Telah dilaporkan bahwa kecepatan reaksi suatu enzim pada setiap konsentrasi substrat dapat dihitung dengan mengetahui nilai KM dan Vmaks. Semakin kuat ikatan enzim dan substrat semakin rendah nilai KM. Kuat tidaknya enzim berikatan dengan substrat dapat diketahui dengan menghitung nilai KM dan Vmaks (Winarno 1999). Berdasarkan nilai-nilai pada persamaan Lineweaver-Burk antara isolat AV-1 dan Lactobacillus bulgaricus, nilai KM AV-1 lebih besar dibandingkan nilai KM
Lactobacillus bulgaricus. Nilai KM yang besar pada isolat AV-1 menyebabkan ikatan substrat dengan enzim β-galaktosidase lebih lemah dari ikatan substrat pada bakteri pembanding L. bulgaricus. Nilai KM dan Vmaks. dalam penelitian ini ditentukan dari ekstrak enzim kasar. Data yang diperoleh pada penelitian ini selanjutnya digunakan sebagai acuan untuk penentuan parameter kinetik setelah enzim dimurnikan.
SIMPULAN DAN SARAN Simpulan
Kondisi optimum enzim β-galaktosidase isolat AV-1 pada waktu inkubasi 25 menit, suhu 43 °C, pH 6.5, dengan aktivitas sebesar 0.182 U/ml. Kondisi optimum enzim β-galaktosidase dari bakteri pembanding Lactobacillus bulgaricus pada waktu inkubasi 20 menit, suhu 43 °C, pH 6.5, dengan aktivitas sebesar 0.357 U/ml. Aktivitas β-galaktosidase AV-1 dengan Lactobacillus bulgaricus secara statistik berbeda nyata (P < 0.05). Enzim
β-galaktosidase isolat AV-1 mempunyai parameter kinetik Vmaks. 0.198 U/ml dan KM
apparent sebesar 1.314 mM. Enzim β-galaktosidase dari bakteri pembanding Lactobacillus bulgaricus mempunyai parameter kinetik Vmaks. 0.385 U/ml dan KM
apparent 1.075 mM. Saran
Untuk peningkatan aktivitas enzim β-galaktosidase, maka isolat AV-1 dan bakteri pembanding Lactobacillus bulgaricus perlu dilakukan pemurnian enzim. Selain itu, perlu dilakukan identifikasi bakteri untuk mengetahui spesies bakteri isolat AV-1. Perlu juga dilakukan penelitian lebih lanjut pengaruh β-galaktosidase terhadap berbagai jenis susu lainnya.
DAFTAR PUSTAKA
Abdel BNM, Haris ND. 1984. Inhibitory Effect of Lactobacillus bulgaricus on Psychotropic Bacteria in Associative Cultures in Refrigerated Foods. Journal of Food Protection. 47(1):61.
Bansal S, Harinder SO, Gurpreet SD, Patill RT. 2008. Production of β-galactosidase by Kluveromyces marxianus MTCC 1388 using whey and effect of four different methods of enzyme extraction on β-galactosidase activity. Indian Journal Microbiology 48:3.
Bergmaier D, Champagne CP, Lacroix C. 2005. Growth and Exopolysaccharide Production During Free and Immobilized Cell Chemostat Culture of Lactobacillus rhamnosus RW-9595M. Journal of Applied Microbiology. 98:272-284.
Bouzar F, Cerning J, Desmazeaud M. 1996. Exopolysaccaryde production in milk by Lactobacillus delbrueckii ssp. bulgaricus CNRZ 1187. Journal of Dairy Science 79:205-211.
Buchanan RE, Gibbons. 1975. Bergey’s Manual of Determinative Bacteriology 8th ed. Baltimore: Woverly.
Buckle KA, Edwards RA, Fleet GH, Wootton M. 1987. Ilmu Pangan. Purnomo Λ, Aqdiono, Penerjemah. Jakarta: UI Press. Terjemahan dari: Food Science.
10
Campbell et al. 2005. The Molecular Basic of Lactose Intolerant. Science Pregress Vol 88: 157-202.
Caplin MF, Buck C. 1990. Enzyme Technology. Cambridge: Cambridge University Pr.
Cesca et al. 1984. β-D-Galactosidase of Lactobacillus sp. J. Microbiol., 29: 288-294.
Chaplin. 2004. The Uses of Lactases in the Dairy Industry. London: Faculty of Engineering, Science and The Built Environment.
Chabot S, Yu HL, De LL, Cloutier D, Van CMR, Lessard M, Roy D, Lacroix M, Oth D. 2001. Exopolysaccarides from Lactobacillus rhamnosus RW-9595M stimulate TNF, IL-6, and IL-12 in human and mouse culture immunocompetent cells, and IFN-γ in mouse splenocytes. Lait 81:683-697.
Chakraborti S, Sani RK, Banerjee UC, Sobti RC. 2000. Purification and characterization of a novel β-galactosidase from Bacillus sp. MTCC-3088. Journal of Industrial Microbiology and Biotechnology 24:58-63.
Ding WK, Shah NP. 2008. Survival of free and microencapsulated probitic bacteria in orange and apple juices. Internatinal Food Research Journal 15:219-232.
Fardiaz. 1990. Mikrobiologi Pengolahan Pangan Lanjut. Bogor: Laboratorium Mikrobiologi Pangan Pusat Antar Universitas Pangan dan Gizi IPB.
Fernandez S, Geneke B, Delgado O, Coleman J, Hatti KR. 2002. β-galactosidase from a cold-adapted bacterium: purification, characterization and application for lactose hydrolysis. Appl. Microbiol. Biotechnol 58:313-321.
Fleet GH. 1999. Microorganism in food ecosystems. International Journal of Food Microbiology 50:101-117.
German B, Schiffrin EJ, Reniero R, Mollet B, Pfeifer A, Neeser JR. 1999. The development of functional foods: lessons from the gut. Trends in Biotechnology 17:492-499.
Gilliland SE. 1990. Health and nutritional benefits from lactid acid bacteria. FEMS Microbiology Reviews 87:175-188.
Hadiwiyoto S. 1994. Teori dan Prosedur Pengujian Mutu Susu dan Hasil Olahannya. Yogyakarta: Liberty.
Hoover. 1993. Bifidobacteria: Research and Development in Japan. Food Technology 47(6):126-135.
Huang DQ, Prevost H, Divies C, 1995. Principal characteristics of β-galactosidase from Leuconostoc spp., J. Int. Dairy. 5:29-43.
Khanafiah D. 2003. Menengok Kembali Jaringan Autokatalisis Kolektif. Bandung: Bandung Fe Institute.
Kilara A, Shahani KM. 1975. Lactase activity of cultured and acidified dairy product. J. Dairy Science 59:2031-2035.
Khusniati T. 2000. Studies on bacteriological enzymatic and chemical spoilage characteristic of pasteurized skim and whole milk [tesis]. School of Land and Food Australia: The University of Queensland.
Marteau et al. 1990. Effect of the microbial lactase (EC 3.2.1.23) activity in yoghurt on the intestinal absorption of lactose: an in vivo study in lactase-deficient humans. British Journal of Nutrition 64: 71-79.
Noh DO, Gilliland SE. 1993. Influence of bile on cellular integrity and β-galactosidase activity of Lactobacillus acidophilus. J. Dairy Sci. 76:1253-1259.
Palmer T. 1991. Understanding Enzymes. England: Ellis horwood.
Pelczar MJJr, Chan ECS. 1986. Dasar-Dasar Mikrobiologi. Volume ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI-Press. Terjemahan dari: Element of Microbiology.
Sandra WA Hinz, Lambertus AM van den Broek, Gerrit Beldman, Jean Paul Vincken, Alphons GJ Voragen. 2004. β-galactosidase from Bifidobacterium
11
adolescentis DSM20083 prefers β(1,4)-galactosides over lactose. J. Appl Microbiol Biotechnol 66:276-284.
Surono IS. 2004. Probiotik: Susu Fermentasi dan Kesehatan. Jakarta: Tri Cipta Karya.
Szczodrak J. 2000. Hydrolysis of lactose in whey permeate by immobilized β-galactosidase from Kluyveromyces fragilis. J. Molecular cat. 10:631-637.
Tossaveinen O. 2003. Losing the lactose. Dairy Industries International 68: 23.
Troller IA, Stinson JV. 1981. Moisture Requirenments for Growth and Metabolite Production by Lactic Acid Bacteria. Appl. And Microbial Bacteria. 42:682.
Winarno FG. 1999. Enzim Pangan. Jakarta: Gramedia Pustaka Utama.
Yuningtias S. 2008. Isolasi dan Karakterisasi β-galaktosidase Bakteri Asam Laktat dari Makanan Hasil Fernentasi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lampiran 1 Kegiatan penelitian
Isolat terseleksi
Kurva pertumbuhan total bakteri
Produksi enzim β-galaktosidase
Uji aktivitas enzim β-galaktosidase
Karakterisasi enzim β-galaktosidase
Lampiran 2 Nilai log jumlah pertumbuhan bakteri
Waktu (Jam Ke-)
LB
AV-1
0
5.6021
5.4771
3
6.2041
6.1139
6
7.301
7.1761
9
7.7782
7.699
12
7.9542
7.8751
15
8
7.9542
18
8.1614
8
21
8.1903
8.0607
24
8.2041
8.0792
27
8.2041
8.097
30
8.1987
8.0934
33
8.1875
8.0792
36
8.1761
8.0414
39
8.1614
8.0374
42
8.1584
8.0334
45
8.1523
8.0253
48
8.1139
8
Lampiran 3 Absorbansi larutan standar oNP pada panjang gelombang 420 nm
Konsentrasi (µM)
A µmol oNP0 0.001 0 2.5 0.003 0.0058 5 0.008 0.0115 7.5 0.012 0.0173 10 0.019 0.023 100 0.13 0.23 200 0.352 0.46 300 0.512 0.69 400 0.692 0.92 500 0.931 1.15 1000 1.813 2.3
(Yuningtias 2008)
Kurva standar oNP
Lampiran 4 Aktivitas β-galaktosidase isolat AV-1 pada berbagai waktu inkubasi
Waktu Inkubasi
Absorbans
A
rerataµmol ONP
Ulangan 1 Ulangan 2 Ulangan 3
0
0.056
0.060
0.064
0.060
0.090
5
0.078
0.076
0.074
0.076
0.110
10
0.097
0.097
0.100
0.098
0.138
15
0.130
0.127
0.130
0.129
0.177
20
0.130
0.129
0.134
0.131
0.180
25
0.141
0.142
0.143
0.142
0.193
30
0.094
0.092
0.087
0.091
0.129
Lampiran 5 Aktivitas β-galaktosidase isolat Lactobacillus bulgaricus pada berbagai
waktu inkubasi
Waktu Inkubasi
Absorbans
A
rerataµmol ONP
Ulangan 1 Ulangan 2 Ulangan 3
0
0.102
0.106
0.101
0.103
0.144
5
0.119
0.116
0.132
0.122
0.168
10
0.117
0.102
0.199
0.139
0.190
15
0.163
0.170
0.168
0.167
0.225
20
0.253
0.122
0.290
0.222
0.295
25
0.141
0.126
0.135
0.134
0.183
30
0.130
0.113
0.132
0.125
0.172
Lampiran 6 Aktivitas β-galaktosidase isolat AV-1 pada berbagai suhu
Suhu
(°C)
Absorbans
A
rerataµmol
ONP
Aktivitas
(U/mL)
Ulangan
1
Ulangan
2
Ulangan
3
34
0.101
0.103
0.102
0.102
0.143
0.057
37
0.137
0.138
0.137
0.137
0.187
0.075
40
0.165
0.164
0.169
0.166
0.224
0.090
43
0.184
0.183
0.185
0.184
0.247
0.099
46
0.145
0.146
0.144
0.145
0.197
0.079
49
0.093
0.097
0.089
0.093
0.131
0.053
Contoh perhitungan isolat AV-1 pada waktu inkubasi optimum (25 menit)
dari persamaan linear kurva standar oNP:
y = 0.791x – 0.011
0.791x = 0.011 + 0.142
x = 0.193
Lampiran 7 Aktivitas β-galaktosidase isolat Lactobacillus bulgaricus pada berbagai
variasi suhu
Suhu
(°C)
Absorbans
A
rerataµmol
ONP
Aktivitas
(U/mL)
Ulangan
1
Ulangan
2
Ulangan
3
34
0.102
0.098
0.094
0.098
0.138
0.069
37
0.135
0.124
0.122
0.127
0.174
0.087
40
0.189
0.142
0.173
0.168
0.226
0.113
43
0.209
0.209
0.177
0.198
0.264
0.132
46
0.155
0.130
0.133
0.139
0.190
0.095
49
0.105
0.116
0.107
0.109
0.152
0.076
Lampiran 8 Aktivitas β-galaktosidase isolat AV-1 pada berbagai pH
pH
Absorbans
A
rerataµmol
ONP
Aktivitas
(U/mL)
Ulangan 1 Ulangan 2
Ulangan 3
4.5
0.169
0.169
0.168
0.169
0.228
0.091
5
0.184
0.186
0.179
0.183
0.245
0.098
5.5
0.195
0.195
0.195
0.195
0.260
0.104
6
0.198
0.198
0.197
0.198
0.264
0.106
6.5
0.203
0.204
0.203
0.203
0.271
0.108
7
0.199
0.198
0.199
0.199
0.265
0.106
7.5
0.161
0.165
0.169
0.165
0.223
0.089
8
0.150
0.153
0.147
0.150
0.204
0.081
Lampiran 9 Aktivitas β-galaktosidase isolat Lactobacillus bulgaricus pada berbagai
variasi pH
pH
Absorbans
A
rerataµmol
ONP
Aktivitas
(U/mL)
Ulangan 1
Ulangan 2 Ulangan 3
4.5
0.185
0.183
0.182
0.183
0.245
0.123
5
0.184
0.191
0.182
0.186
0.249
0.125
5.5
0.196
0.189
0.194
0.193
0.258
0.129
6
0.201
0.197
0.196
0.198
0.264
0.132
6.5
0.210
0.210
0.207
0.209
0.278
0.139
7
0.164
0.177
0.178
0.174
0.234
0.117
7.5
0.161
0.166
0.168
0.165
0.223
0.111
8
0.164
0.157
0.162
0.161
0.217
0.109
Contoh perhitungan aktivitas isolat Lactobacillus bulgaricus pada pH optimum
Aktivitas = µmol oNP
Aktivitas = 0.278
Aktivitas = 0.139 U/ml
Lampiran 10 Aktivitas β-galaktosidase isolat AV-1 sebelum dan sesudah optimasi
Kondisi Optimasi
Absorban
[S] (µmol)
Aktivitas (U/ml)
Sebelum Optimasi
Ulangan 1
0.13
0.178
0.119
Ulangan 2
0.127
0.174
0.116
Ulangan 3
0.13
0.178
0.119
Rerata
0.129
0.177
0.118
Sesudah Optimasi
Ulangan 1
0.349
0.455
0.182
Ulangan 2
0.349
0.455
0.182
Ulangan 3
0.35
0.456
0.183
Rerata
0.349
0.456
0.182
Contoh perhitungan sebelum optimasi isolat AV-1
Rerata absorban 0.129, dengan persamaan linier kurva standar oNP:
y = 0.791x – 0.011 diperoleh nilai [S] dalam µmol.
0.791x = 0.011 + 0.129
x = 0.177 µmol
Aktivitas = µmol [S]
Aktivitas = 0.177 µmol
Aktivitas = 0.118 U/ml
V x t
0.1 x 15
Contoh perhitungan setelah optimasi isolat AV-1
Aktivitas enzim β-galaktosidase sesudah optimasi dihitung dari [S] 4 mg/ml (Marteu
et. al modifikasi 1990) dengan rerata absorban 0.349 dan waktu inkubasi optimum 25
menit
Aktivitas = µmol [S]
Aktivitas = 0.456 µmol
Aktivitas = 0.182 U/ml
V x t
0.1 x 25
Lampiran 11 Aktivitas β-galaktosidase Lactobacillus bulgaricus sebelum dan sesudah
optimasi
Kondisi Optimasi
Absorban
[S] (µmol)
Aktivitas (U/ml)
Sebelum Optimasi
Ulangan 1
0.163
0.22
0.147
Ulangan 2
0.17
0.229
0.153
Ulangan 3
0.168
0.226
0.151
Rerata
0.167
0.225
0.15
Sesudah Optimasi
Ulangan 1
0.554
0.714
0.357
Ulangan 2
0.552
0.712
0.356
Ulangan 3
0.555
0.716
0.358
Rerata
0.554
0.714
0.357
Lampiran 12 Konversi konsentrasi substrat dari satuan mg/ml menjadi mM dari isolat
AV-1 dan Lactobacillus bulgaricus
[S] (mg/ml)
[S] (mM)
Isolat AV-1 Lactobacillus bulgaricus
0.1
0.332
0.332
0.5
1.659
1.659
1
3.318
3.318
2
6.637
6.637
4
13.273
13.273
6
19.91
19.91
8
26.546
26.546
10
33.183
33.183
15
49.774
49.774
20
66.366
66.366
Perhitungan konversi konsentrasi substrat dari satuan mg/ml menjadi mM
Contoh: [Substrat] = 20 mg/ml
M = g
x 1000 = 0.02 g x 1000 = 66.366x10
-3M = 66.366 mM
BM oNPGal. ml 301.36 g/mol 1 ml
Lampiran 13 Data penentuan kinetika enzim isolat AV-1
[S] (mM) Absorbans A rerata µmol ONP Aktivitas (U/mL) 1/v 1/SUlangan 1 Ulangan 2 Ulangan 3
0.332 0.179 0.178 0.174 0.177 0.238 0.095 10.519 3.012 1.659 0.226 0.228 0.233 0.229 0.303 0.121 8.240 0.603 3.318 0.270 0.271 0.268 0.270 0.355 0.142 7.046 0.301 6.637 0.304 0.304 0.304 0.304 0.398 0.159 6.278 0.151 13.273 0.349 0.349 0.350 0.349 0.456 0.182 5.488 0.075 19.91 0.358 0.359 0.357 0.358 0.466 0.187 5.359 0.050 26.546 0.363 0.364 0.359 0.362 0.472 0.189 5.302 0.038 33.183 0.362 0.362 0.364 0.363 0.472 0.189 5.292 0.030 49.774 0.401 0.399 0.400 0.400 0.520 0.208 4.811 0.020 66.366 0.429 0.429 0.429 0.429 0.556 0.223 4.494 0.015
Nilai K
Mdan V
maks.dihitung dengan persamaan Lineweaver-Burk. Persamaan
Lineweaver-Burk:
maks maks MV
S
V
K
V
1
]
[
1
.
1
0
dimana 1/V
0= y dan 1/[S] = x
perhitungan isolat AV-1 dengan persamaan linier, y = 6.634x + 5.04
1/V
maks.= 5.04
V
maks.= 0.198 U/ml; K
M/ V
maks.= 6.634
K
M= 1.314 mM
perhitungan isolat Lactobacillus bulgaricus dengan persamaan y = 2.793x + 2.597
1/V
maks.= 2.596
V
maks.= 0.385 U/ml
K
M/ V
maks.= 2.793
K
M= 1.075 mM
Lampiran 14 Data penentuan kinetika enzim Lactobacillus bulgaricus
[S] (mM) Absorbans A rerata µmol
ONP
Aktivitas
(U/mL) 1/v 1/S
Ulangan 1 Ulangan 2 Ulangan 3
0.332 0.233 0.237 0.242 0.237 0.314 0.157 6.379 3.012 1.659 0.287 0.289 0.289 0.288 0.378 0.189 5.285 0.603 3.318 0.450 0.451 0.447 0.449 0.582 0.291 3.437 0.301 6.637 0.551 0.549 0.554 0.551 0.711 0.355 2.813 0.151 13.273 0.554 0.552 0.555 0.554 0.714 0.357 2.802 0.075 19.91 0.559 0.561 0.559 0.560 0.721 0.361 2.772 0.050 26.546 0.570 0.582 0.579 0.577 0.743 0.372 2.690 0.038 33.183 0.582 0.585 0.588 0.585 0.753 0.377 2.654 0.030 49.774 0.616 0.617 0.615 0.616 0.793 0.396 2.523 0.020 66.366 0.624 0.627 0.621 0.624 0.803 0.401 2.491 0.015
Lampiran 15 Analisis statistik aktivitas enzim β-galaktosidase
ANOVA
Aktivitas
Sum of
Squares df Mean Square F Sig.
Between Groups .122 1 .122 27.022 .000
Within Groups .081 18 .005
Total .203 19