14
A. Kajian Teori 1. Skizofrenia
Skizofrenia menurut Eugen Bleuler adalah suatu gambaran jiwa yang terpecah belah, adanya keretakan atau ketidakharmonisan antara proses berpikir, perasaan dan perilaku (Maramis, 2009). Skizofrenia termasuk kelompok gangguan psikotik. Gangguan ini di karakteristikkan dengan simptom positif atau negatif dan sering dihubungkan dengan kemunduran penderita dalam menjalankan fungsinya sehari-hari (Goldner EM, et al, 2002).
Skizofrenia merupakan gangguan mental dengan hendaya dalam neurokognisi dan sosial-kognisi. Karakteristik skizofrenia yaitu adanya abnormalitas dalam neurodevelopmental dan behavioral (Nieto, Kukuljan dan Silva, 2013).
Skizofrenia adalah gangguan jiwa yang biasanya dimulai di usia dewasa awal, antara usia 15 dan 25 tahun. Pria cenderung menderita skizofrenia sedikit lebih awal daripada perempuan, usia puncak onset pada pria 15-25 tahun, sedangkan wanita 25-35 tahun. Insidensi skizofrenia pada pria sedikit lebih besar dibandingkan pada wanita. Insiden pada wanita lebih tinggi setelah usia 30 tahun. Rata-rata usia onset adalah 18 pada pria dan 25 tahun pada wanita. Onset skizofrenia cukup langka untuk orang di bawah usia 10 tahun, atau lebih dari 40 tahun. Terdapat insidensi skizofrenia yang lebih besar di daerah urban
dibandingkan rural. Derajat keparahan skizofrenia lebih besar di negara maju, dibandingkan negara sedang berkembang (Sadock et al, 2010).
Psikopatologi pada skizofrenia dapat digolongkan menjadi tiga, yaitu gejala positif, gejala negatif, dan disorganisasi. Gejala positif meliputi halusinasi, waham, gaduh gelisah, dan perilaku aneh atau bermusuhan. Gejala negatif meliputi afek tumpul, datar, menarik diri, motivasi turun, miskin kontak sosial (pendiam, sulit diajak bicara), pasif, apatis dan sulit berpikir abstrak. Gejala disorganisasi meliputi disorganisasi pembicaraan, disorganisasi tingkah laku, gangguan pemusatan perhatian, dan gangguan pengolahan informasi (Sadock,2010).
Untuk membedakan secara singkat berbagai gejala yang ditunjukkan penderita skizofrenia dapat digunakan instrumen PANSS (the positive and negative symptom scale). Skala penilaian terhadap gejala positif dan negatif pada skizofrenia bermula dari dijumpainya heterogenitas hasil penelitian yang tidak konsisten, yang diduga disebabkan karena metode pengukuran yang kurang dapat dipercaya (Kusumawardhani, 1994).
Obat-obat yang digunakan untuk mengobati skizofrenia adalah antipsikotik. Obat ini membantu mengendalikan halusinasi, waham, dan masalah-masalah pikiran yang terkait dengan gangguan. Obat antipsikotik di kelompokkan menjadi dua bagian yaitu anti psikotik generasi pertama (APG I)/ tipikal dan anti psikotik generasi kedua (APG ll)/ atipikal (Jones HM dan Pilowsky LS, 2002).
Antipsikotik tipikal disebut juga sebagai antipsikotik generasi pertama (APG I) mempunyai cara kerja dengan memblok reseptor D2 (Stahl, et al, 2008).
Antipsikotik atipikal sering disebut juga sebagai Serotonin Dopamin Antagonis (SDA) atau antipsikotik tipikal. APG II mempunyai mekanisme kerja melalui interaksi antara serotonin dan dopamin pada ke-4 jalur dopamin di otak (Jones HM dan Pilowsky LS, 2002; Stahl, et al, 2008). Perbedaan antara APG I dengan APG II adalah APG I hanya memblok reseptor D2 sedangkan APG II memblok secara bersamaan reseptor serotonin (5HT2A) dan reseptor Dopamin (D2)(Stahl, et al, 2008). Pasien skizofrenia umumnya memiliki respon yang baik terhadap pengobatan antipsikotik, hal ini terbukti dari perbaikan simptom positif pada 30-40% penderita setelah 1 atau 2 bulan pengobatan (Healy D, 2002).
Pasien skizofrenia dengan simptom positif yang menonjol APG I dapat ditambahkan pada pasien yang mendapat APG II. Onset kerja APG I lebih cepat. Kerja cepat tersebut diperlukan pada fase akut untuk dapat mengatasi simptom positif. Beberapa penelitian alasan menggunakan kombinasi antipsikotik tipikal dan atipikal efektif untuk pasien dengan riwayat putus obat (Buchanan, et al, 2010), atau diperlukan mekanisme kerja antipsikotik yang berbeda dan untuk meningkatkan kerja antipsikotik (Rajiv T et al, 2009).
Penatalaksanaan skizofrenia membutuhkan waktu yang panjang dan kepatuhan yang baik. Namun hal tersebut sulit dilaksanakan oleh pasien maupun keluarga sebagai pendukung, sehingga sangat mempengaruhi kesembuhan pasien skizofrenia. Angka kesembuhan skizofrenia berdasarkan Riset Kesehatan Dasar (Riskedas) Depkes RI tahun 2013 menunjukkan sekitar 80% pasien yang di rawat di RSJ dengan skizofrenia 25% dapat sembuh, 25% dapat mandiri, 25% membutuhkan bantuan, dan 25% jatuh kedalam kondisi berat (Riskedas, 2013).
Strategi terapi tambahan untuk meningkatkan angka perbaikan gejala skizofrenia sudah menjadi studi yang banyak dilakukan. Tidak semua penderita skizofrenia mempunyai kesamaan patofisiologis. Ada banyak teori yang menjelaskan patofisiologinya. Patofisiologi yang berbeda ini juga menunjukkan respon yang berbeda pada pemberian antipsikotik. Keefektifan antipsikotik telah terbukti menurunkan gejala skizofrenia, namun menyisakan gejala residual atau pun hendaya kognitif. Strategi pemberian terapi tambahan untuk mengatasi salah satu atau lebih patofisiologi, juga berperan mengoptimalkan terapi utama (Fenton, et al, 2001)
2. Proses Stress Oksidatif Pada Skizofrenia
Salah satu hipotesis terjadinya skizofrenia berkaitan erat dengan stress oksidatif sebagai pemicu proses neuropatologi pada skizofrenia (Zhang M, et al, 2009; Gonzalez, et al, 2014). Pada penderita skizofrenia, baik yang mendapat terapi antipsikotik maupun tidak mendapat terapi tetap mempunyai kemungkinan peningkatan kerusakan sel oksidatif (Boskovic dan Vovk T, 2008).
Faktor lingkungan, genetik, infeksi prenatal, malnutrisi, buruknya pola hidup menjadi pemicu mekanisme biologi stres oksidatif pada penderita skizofrenia. Dari suatu studi melaporkan bahwa indikator stres oksidatif yaitu nitric oxide (NO) ditemukan meningkat pada penderita skizofrenia (Gonzalez, et al, 2014).
Pemberian antipsikotik tipikal ataupun atipikal pada pasien skizofrenia mempunyai perbedaan afinitas reseptor neurotransmitter, perbedaan efikasi dan
efek samping. Juga didapatkan bukti bahwa antipsikotik tipikal menginduksi terjadinya stres oksidatif lebih kuat dibanding antipsikotik atipikal. Antipsikotik menginduksi terjadinya stres oksidatif melalui penekanan enzym antioksidan sehingga terjadi kerusakan sel oksidatif. Setelah pemberian antipsikotik, konsentrasi enzym antioksidan menjadi rendah, dan konsentrasi lipid peroxidation marker, malondialdehyde meningkat. Sehingga disimpulkan bahwa kerusakan sel oksidatif adalah salah satu toksisitas antipsikotik. Antipsikotik tipikal menginduksi menginduksi terjadinya stres oksidatif juga melalui penghambatan rantai transpor elektron di mitokondria oleh antiapsikotik sehingga terjadi stres oksidatif akibat ketidak seimbangan antara antioksidan dan pro-oksidan (Boskovick dan Vovk T, 2008).
3. Proses Inflamasi Pada Skizofrenia
Suatu hubungan antara inflamasi abnormal dan skizofrenia telah ditemukan. Tanda respon inflamasi perifer pada skizofrenia dibuktikan dengan adanya peningkatan kadar faktor proinflamasi spesifik, termasuk prostaglandin E2 (PGE2), C-Reactive protein (CRP), dan berbagai macam sitokin proinflamasi seperti IL-1β, IL-6, IL-8, dan TNF-α. Inflamasi masa prenatal sebagai faktor resiko terjadinya skizofrenia sudah menjadi bahasan ahli saat ini. Sejumlah studi melaporkan bahwa penderita skizofrenia memiliki tingkat konsentrasi sitokin inflamasi yang lebih tinggi didalam darahnya dibandingkan kontrol. Ternyata tingginya tingkat konsentrasi sitokin inflamasi berhubungan erat dengan status mental penderita. Saat konsentrasi sitokin inflamasi tinggi, berhubungan dengan
kekambuhan gejala psokosis pasien skizofrenia. Pada saat penderita stabil, tidak ada perbedaan konsentrasi sitokin inflamasi dengan kontrol (Miller B dan Kirkpatrick B, 2013).
Inflamasi kronis merupakan salah satu yang memainkan peranan atas patofisiologi skizofrenia. Paparan infeksi atau disfungsi sistem imun pada awal kehidupan dapat menginduksi sensitisasi atau preconditioning effects. Paparan imunologis saat prenatal seperti kelahiran preterm, preeklamsi atau saat neonatal seperti asfiksia menyebabkan reaksi eksaserbasi yang menurunkan kondisi imunologis atau non-imunologis dikemudian hari. Hal ini tidak hanya mengganggu kekebalan, namun juga menjadi faktor resiko munculnya psikosis atau skizofrenia (Miller B dan Kirkpatrick B, 2013; Brown,2006).
Inflamasi dan stress oksidatif memainkan peranan dari rendahnya kadar polyunsaturated fatty acid PUFA dalam darah dan CNS penderita skizofrenia (Miller B dan Kirkpatrick B, 2013).
4. Efek Imunomodulator Obat antipsikotik dan Strategi Terapi Omega-3 pada Pasien Skizofrenia
4.1 Efek sitokin obat antipsikotik
Obat antipsikotik atipikal memiliki efek sebagai preparat imunomodulator, dengan meningkatkan aktivitas anti-inflamasi dan berkurangnya marker pro-inflamasi. Efek imunomodulator ini didapat pada pengobatan jangka panjang. Antipsikotik atipikal menekan proses induksi
sitokin pro-inflamasi yang berhubungan dengan neuroinflamasi (MacDowell KS, et al, 2011; Nasrallah dan Henry A, 2013).
4.2 Strategi pengobatan adjuvant dengan omega-3
Berbagai proses terjadinya skizofrenia, diantaranya proses inflamasi dan stres oksidatif, penggunaan preparat anti-oksidan dalam farmakoterapi skizofrenia semakin mendapat perhatian. Studi oleh Jamilian M, et al, penambahan anti-oksidan berupa omega-3 pada terapi skizofrenia meningkatkan efikasi terapi antipsikotik dalam memperbaiki gejala skizofrenia (Jamilian M, et al, 2014).
5. Omega-3
Asam lemak omega-3 adalah suatu asam lemak esensial. Omega 3 diperlukan untuk kesehatan manusia, tetapi tubuh tidak dapat membuatnya. Omega-3 didapatkan melalui makanan. Asam lemak omega-3 yang ditemukan pada ikan, seperti salmon, tuna, dan makanan laut lainnya termasuk dan minyak kacang. Omega-3 dikenal sebagai asam lemak tak jenuh ganda, asam lemak omega-3 memainkan peran penting dalam fungsi otak, serta pertumbuhan dan perkembangan normal (Ehrlich, 2013).
Asam lemak tidak tersaturasi terbagi dua yaitu asam lemak monounsatutared dan polyunsaturated. Polyunsaturated fatty acids(PUFA) berdasarkan struktur kimianya dibagi menjadi dua grup yaitu asam lemak omega-3 atau n-3 polyunsaturated fatty acids (PUFA) dan omega 6 atau n-6 polyunsaturated fatty acids (PUFA) (Schachter H, et al, 2004).
Gambar 1. Omega-3 menyusun sel saraf.
Docosahexaenoic acid (DHA) adalah asam lemak rantai panjang yang ditemukan pada ikan, kuning telur, dan ganggang laut, dan merupakan sumber omega-3 utama asam lemak di jaringan otak. Kebutuhan otak akan asam lemak tergantung pada asam lemak makanan, penurunan DHA pada diet dapat berkontribusi untuk perubahan degeneratif pada sistem saraf. Keseimbangan elektrolit juga mengontrol aktivitas listrik di dalam otak. Untuk alasan ini, studi sebelumnya disebutkan perkembangan otak berkaitan dengan gizi, beban beracun, dan stres memiliki relevansi ketika mencoba untuk lebih memahami secara optimal fungsi otak (Goldberg dan Katz, 2007).
Asam lemak tak jenuh ganda omega-3 merupakan nutrisi penting yang meningkatkan kualitas hidup dan menurunkan risiko kematian dini sel saraf. Omega-3 berfungsi secara eksklusif terhadap membran sel saraf, yang terbukti penting untuk pra dan perkembangan otak postnatal, juga lebih berpengaruh pada perilaku dan mood (Kidd, 2007).
Omega-3 banyak terdapat pada sayur hijau seperti brokoli, berbagai kacang-kacangan, dan semua jenis ikan atau makanan laut. Ketersediaan berbagai jenis makanan yang mengandung omega-3 dibutuhkan pada menu harian seseorang untuk memenuhi kebutuhannya. Sejumlah studi menjelaskan ketidakseimbangan makanan memunculkan epidemi gangguan mental dimasyarakat, salah satunya ketidaksediaan omega-3 pada asupan. Omega-3 banyak tersedia diberbagai makanan dengan harga terjangkau memungkinkan masyarakat mudah mendapatkannya (Black Alexis, 2006).
5.1 Struktur Omega-3
Istilah n-3 menunjukan keterangan struktural pada n-3 polyunsaturated fatty acids (PUFA). n-3 menjelaskan posisi ikatan ganda yang terdekat dengan ujung metil dari rantai asil (Schachter H et al., 2004 & Calder PC, 2010). Penamaan n-3 dijelaskan oleh nomenklatur singkatan berdasarkan jumlah karbon atom dalam rantai asil, jumlah ikatan ganda, dan posisi pertama ganda obligasi relatif terhadap karbon metil. Omega-3 adalah keluarga asam lemak biologis aktif. Anggota paling sederhana dari keluarga ini, a-linolenic acid, dapat dikonversi menjadi biologis aktif rantai sangat panjang (n-3) PUFA, EPA dan DHA. Proses ini terjadi dengan seri desaturasi dan elongasi reaksi, dengan asam stearidonic menjadi perantara di jalur tersebut (Calder PC, 2012).
Struktur Omega-3
Gambar 2. Struktur Omega-3 Keterangan : Kanan : EPA (20:5n-3) terdiri dari 20 atom karbon dan 5 ikatan ganda atau bagian unsaturated, kiri : DHA (22:6n-3) terdiri dari 22 atom karbon dan 6 ikatan dobel atau bagian unsaturated(Calder PC, 2012).
Omega-3 merupakan asam lemak tak jenuh ganda mulai atom karbon ke 18-22 dalam rantai panjang. Rantai panjang pertama dari banyak ikatan ganda dimulai pada karbon ketiga setelah menghitung dari ujung metil struktur asam lemak. n-3 PUFA terdiri dari DHA yang memiliki 22 atom karbon serta terdapat 6 ikatan ganda dan EPA yang memiliki 20 atom karbon serta terdapat 5 ikatan ganda (Calder PC, 2012).
Gambar 3.
Metabolisme omega-3 (Calder PC, 2012)
Derivat omega-3 mempunyai mekanisme efek kerja fisiologis yang bermacam-macam, yaitu sebagai anti inflamasi, antioksidan, anti agregasi dan anti aritmia.
Gambar 4.
5.2 Tinjauan Peran dan Manfaat Omega-3
Asam lemak omega-3 telah terbukti memiliki berbagai peran fisiologis. Peran ini terkait dengan manfaat kesehatan atau klinis tertentu. Omega-3 telah terbukti memodifikasi sejumlah faktor risiko penyakit kardiovaskular, dengan mempengaruhi faktor risiko termasuk tekanan darah, reaktivitas platelet, trombosis, konsentrasi plasma, fungsi pembuluh darah, aritmia jantung, dan peradangan. Selain itu, omega-3 berperan pada penyakit non kardiovaskuler. Asam lemak omega-3 menunjukkan bahwa meningkatkan asupan omega-3 bisa mengurangi risiko (yaitu, melindungi terhadap) sejumlah kondisi dan bahkan dapat digunakan sebagai pengobatan. Sebagai contoh, omega-3 telah berhasil digunakan dalam rheumatoid arthritis, penyakit radang usus, asma. PUFA, EPA dan DHA memiliki struktur penting yang berperan dalam perkembangan mata dan otak. Peran omega-3 terhadap otak berkontribusi mempengaruhi perkembangan mental, mempengaruhi kemampuan belajar, mempengaruhi perilaku dan memperbaiki gangguan mental pada orang dewasa (Calder PC, 2012).
Asam lemak tak jenuh ganda omega-3 menunjukkan sifat terhadap sel saraf yang potensial untuk berbagai gangguan neurodegeneratif dan neurologis. Fosfolipid materi abu-abu otak mengandung proporsi DHAyang tinggi. Proporsi DHA yang tinggi ini menunjukkan mereka penting untuk fungsi sistem saraf pusat. Menipisnya DHA dalam otak dapat mengakibatkan defisit belajar. Perubahan DHA dalam isi membran sel neuron bisa mengubah fungsi saluran ion atau reseptor membran-terkait, serta ketersediaan
neurotransmiter. Bukti untuk efek unik eicosapentaenoic acid (EPA), docosahexaenoic acid (DHA) sebagai contoh, efek yang menguntungkan dalam memperbaiki gangguan mood telah lebih konsisten dilaporkan dalam uji klinis menggunakan EPA, sedangkan, dengan kondisi neurodegeneratif seperti penyakit Alzheimer, fokus di DHA. Rendahnya tingkat DHA berhubungan dengan peningkatan risiko kehilangan memori. Suatu studi telah menunjukkan sebuah studi 1997 menunjukkan bahwa tingkat darah DHA dan PUFA rendah merupakan faktor risiko penting untuk penyakit Alzheimer (Goldberg, 2008; Simon C.D,2010).
DHA adalah jenis omega-3 paling banyak di otak, dan akibatnya paling banyak dipelajari. Saat ini banyak bukti yang menunjukkan kedua independen dan efek dari EPA, dan DHA bersama. Dengan pemahaman yang lebih baik tentang peran omega-3 dalam kesehatan otak dan perbaikan dibidang neuropsikiatrik diharapkan rekomendasi asupan dan intervensi terapeutik bisa lebih bertarget (Simon C.D,2010).
Peran penting omega-3 juga mengoptimalkan banyak aspek fungsi otak, mood, kognisi, dan memori untuk kesehatan mental. Penelitian terbaru telah membuka cakrawala baru dalam pemahaman kita tentang kemampuan mendalam omega-3 untuk menghentikan penurunan kemampuan otak terkait usia, penyusutan otak dan sel saraf mati progresif dan ireversibel. Omega-3 telah terbukti memiliki sifat antidepresan dan saraf. Satu studi terbaru menemukan manusia yang mengkonsumsi lebih omega-3 meningkatkan
volume materi abu-abu otak dan bahwa pembangunan jaringan baru, di area bagian otak yang berhubungan dengan mood (Goepp, 2010).
Omega-3 mempunyai pengaruh penting, bahkan sejak manusia dalam kandungan. Selama trimester terakhir dari kehidupan janin dan pertama dua tahun dari masa kanak-kanak, otak mengalami periode pertumbuhan yang cepat. Neuron terus membentuk akson dan ekstensi dendritic dengan disertai pertumbuhan membran sel. Omega-3 adalah elemen utama untuk fluidisasi di membran sel saraf. Bahkan sinapsis utama unit fungsional dari sirkuit otak dibuat dari membran istimewa diperkaya dari asupan omega-3. Bayi lahir prematur berada dalam risiko untuk mengalami insufisiensi omega-3 insufisiensi karena mereka mungkin tidak mendapat keuntungan dari trimester akhir penuh asupan dari ibu. Bayi prematur memiliki kemampuan yang sangat terbatas memetabolisme asupan makanan (Kidd,2007).
5.3 Mekanisme Aksi Omega-3
Omega-3 memiliki beberapa aksi mekanisme. Ada 4 aksi mekanisme omega-3 mempengaruhi perilaku sel. Aksi tersebut adalah mempengaruhi konsentrasi hormon yang akan mempengaruhi tingkah laku sel atau jaringan, mempengaruhi stres oksidatif dengan peran antioksidannya, efek langsung melalui permukaan intraseluler dan mempengaruhi perilaku sel dimediasi melalui perubahan komposisi fosfolipid membran sel (Calder PC, 2012).
5.4 Peran Omega-3 Pada Fungsi Otak
Mengetahui peran omega-3 pada gangguan neuropsikiatri berbasis lipid akan memerlukan pemahaman bagaimana peran omega-3 di otak.
- Omega-3 dan peningkatan BDNF: pemberian omega-3 dikaitkan dengan peningkatan tingkat BDNF (faktor neurotropik). Dengan menambah asupan asam lemak omega-3, tingkat BDNF dapat meningkat, sehingga meningkatkan neurotransmisi dan perlindungan sel saraf
- Omega-3 memodulasi banyak mekanisme transduksi sinyal di membran neuronal dan sinapsis. Reseptor serotonin, dopamin, β-adrenergik digabungkan ke sistem cAMP messenger. Omega-3 mempengaruhi semua itu dengan meningkatkan adenilat siklase dan aktivitas protein kinase. Suatu studi menunjukkan defisiensi omega-3 berefek pada sistem dopaminergik, yaitu pada reseptor D2, D2 reseptor mRNA dan vesikel dopaminergik presinaptik. Omega-3 juga menurunkan aktivitas dari MAO-B (monoamine oxidase) - enzim tertentu yang mempengaruhi dopamin. Sehingga memperbaiki regulasi dopamin
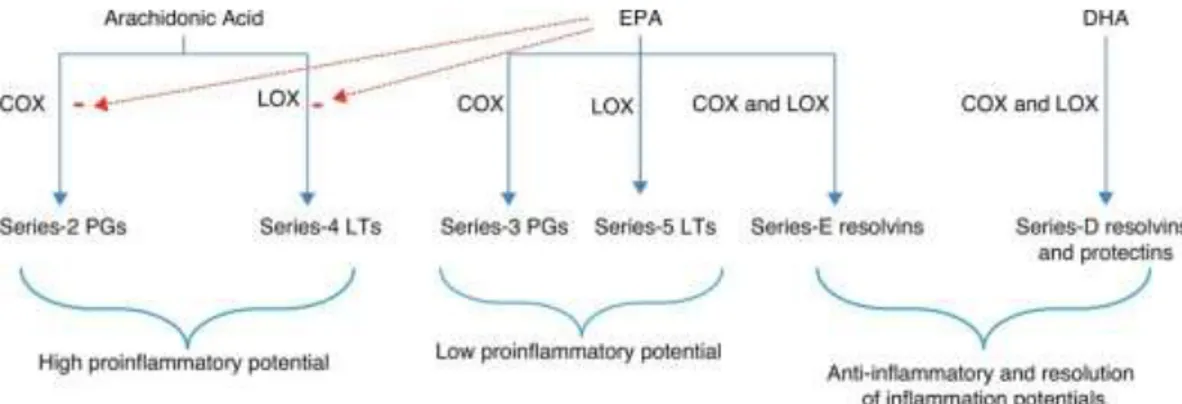
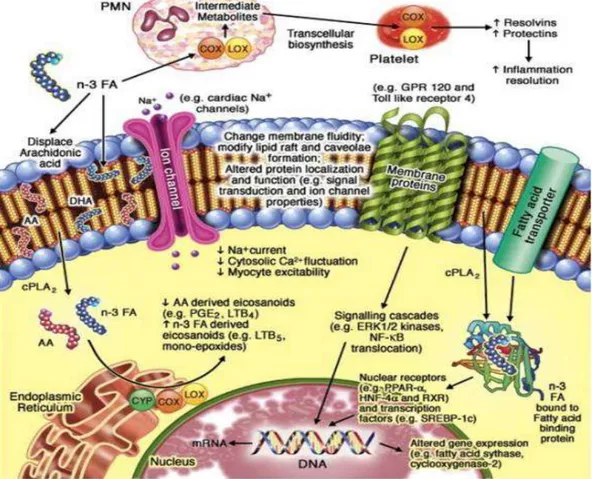
- Omega-3 mempengaruhi regulasi neuroinflamasi dari aksi DHA sebagai derivat 3 dengan beraksi sebagai antiinflamasi. Konsumsi omega-3 EPA menggantikan sebagian arachnoid acid(AA) di membran sel inflamasi, memberikan efek anti-inflamasi serta menggantikan sebagian arachnoid acid(AA) membran sel inflamasi (Schubert R et al., 2009). Eicosapentaenoic acid dan DHA berkompetitif menghambat metabolisme arachnoid acid(AA) omega 6 sehingga menekan generasi
proinflamasi. EPA bertanggung jawab untuk mengurangi metabolisme asam arakidonat dan memproduksi eikosanoid yang sehat. Tingginya kadar asam arakidonat terkait dengan gangguan mental, skizofrenia (Joanne J, et al, 2015).
Gambar 5. Metabolisme diet asam lemak pada aktivitas inflamasi.Keterangan:COX=cyclooxygenase;LOX=lypooxygenase; LT=leukotriene; PG=prostaglandin
(Joanne J, et al, 2015).
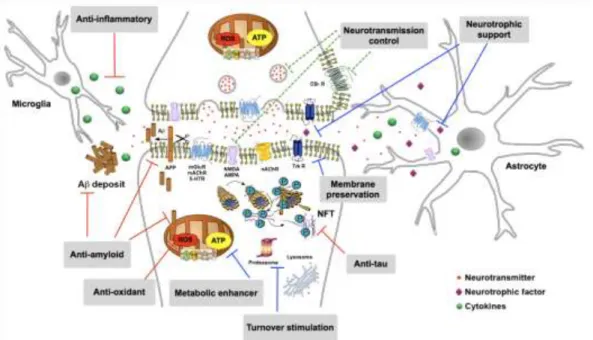
- Omega-3 sebagai struktur utama pelindung neuron. Lipid yang menyusun membran sel, terutama sel saraf. Lipid di otak mengandung 35% omega-3. Hal ini menunjukkan relevansi terjadinya gangguan neuropsikiatri jika terjadi defisiensi omega-3.
- Omega-3 sebagai regulator enegi otak. Omega-3 mempunya mekanisme aksi glucose-uptake dan berperan pada pembentukan glucose transporter-1(GLUT-1) di korteks cerebral (Joanne J, et al, 2015).
Gambar 6. Aksi omega-3 di otak (Joanne J, et al, 2015).
5.5 Omega-3 dan Kesehatan Mental
Ketergantungan otak terhadap omega-3 terus sepanjang hidup dewasa. Plastisitas otak manusia tinggi dan mempunyai adaptabilitas yang baik. Pengamatan klinis terhadap otak manusia menunjukkan kemampuan luar biasa pada pemulihan otak yang berhubungan untuk tingkat sinaptik. Peran omega-3 terus dibutuhkan otak manusia yang dinamis (Kidd,2007).
Sekitar 8% dari berat otak terdiri dari asam lemak omega-3, yang berperan membangun sekitar 100 miliar neuron. Docosahexaenoic acid (DHA) dan eicosapentaenoic acid (EPA) memainkan sejumlah peran penting dalam struktur dan fungsi saraf. Melindungi sel saraf dari kerusakan oksidatif, inflamasi, dan penghancuran kumulatif. Omega-3 tertanam dalam membran neuronal kaya protein dan molekul kompleks yang diperlukan untuk transmisi dan penerimaan sinyal. Elektrokimia tersebut menunjukkan bahwa
keseimbangan yang tepat dari asam lemak dalam sel-sel otak membantu menentukan apakah sebuah sel saraf tertentu akan terlindungi terhadap cedera atau mengalami peradangan (Goepp, 2010).
Suatu studi RCT oleh Fontani,2005, dengan memodifikasi penambahan omega-3, melaporkan bahwa suplementasi omega-3 bisa meningkatkan fungsi otak yang lebih tinggi, meningkatkan rasa kesejahteraan (semangat), reaktivitas, perhatian, kinerja kognitif, dan suasana hati (mood) (Fontani, et al, 2005).
Pentingnya asam lemak ini menjadi yang paling jelas ketika asupan kurang. Orang yang tidak mendapatkan cukup omega-3 dalam diet mereka akan menghadapi peningkatan risiko mengalami gangguan mental seperti demensia, depresi, gangguan perhatian, disleksia dan skizofrenia (Stephanie Watson, 2007). Temuan terbaru menunjukkan bahwa kadar serum rendah omega-3 berhubungan dengan perilaku kriminal dan agresif. Terkait dengan kadar serum omega-3 yang menurun berhubungan dengan altruisme, kejujuran, dan kemampuan disiplin. Efek ini mungkin berhubungan dengan perubahan serotonin, yang mengontrol impulsif dan perilaku agresi-permusuhan. Omega-3 menumpuk di otak manusia selama perkembangan janin. Jumlah omega-3 DHA telah terikat erat dengan kecerdasan dan kinerja kognitif pada masa bayi dan masa kanak-kanak. Tapi omega-3 yang berperan membentuk membran sel otak terlibat dalam bidang pengolahan memori. Jika berkurangnya omega-3 karena bertambahnya usia dan pada gangguan
otak kronis tertentu berhubungan dengan penurunan kognitif yang berkaitan dengan usia yang khas seperti yang terlihat pada Alzheimer (Goepp, 2010).
Kunci omega-3 yang berpengaruh pada otak diduga terletak pada sinapsis, yaitu celah kecil yang memungkinkan impuls saraf terkoneksi dari satu neuron ke yang lain. Agar impuls mencapai neuron penerima, mereka harus melewati dinding, atau membran, yang mengelilingi neuron. Sel membran yang terbuat hampir sepenuhnya dari lemak, termasuk asam lemak omega-3. Omega-3 membantu menjaga membran lebih elastis, meningkatkan aliran impuls listrik. Omega-3 juga membantu meningkatkan aliran darah di otak, dengan memperbaiki adhesi endothelial, sehingga memperbaiki kemampuan relaksasi endothelial (Stephanie Watson, 2007; Brown dan Hu, 2001).
5.6 Khasiat Omega-3 Memperbaiki Gejala Skizofrenia
Beberapa studi menunjukkan bahwa penambahan omega-3 pada terapi skizofrenia efektif meningkatkan efikasi antipsikotik, sehingga memperbaiki gejala skizofrenia (Jamilian M, et al,2004; Balasubramanian, 2013).
Peran omega-3 sebagai anti-inflamasi asam lemak esensial berfungsi memperkaya membran sel otak dengan menjaga lembaran myelin. Hal tersebut membantu memperbaiki kerusakan sel saraf di otak dengan mempromosikan pertumbuhan sel saraf di otak. Di area PFC (PreFrontal Cortex) otak, asam lemak omega-3 meredam neurotransmisi dopamin, sehingga berkontribusi memperbaiki gejala neurokognitif skizofrenia. Di sistem limbik, asam lemak omega-3 juga mempengaruhi overactivity
neurotransmisi dopamin, sehingga memperbaiki gejala positif skizofrenia. Omega-3 diserap baik kepembuluh darah, kemudian tersebar kedalam sel target, dan memberikan perbaikan setelah tiga minggu pemberian (Balasubramanian, 2013).
Gambar 7. Keterangan : aksi omega-3 di otak.
5.7 Sediaan Omega-3
Formulasi omega-3 bervariasi dalam bentuk oral antara lain pil, gel, kapsul, sirup,suspense, sublingual, permen dan tablet chewable. Sebagian besar formula omega-3 dalam bentuk satu unit oral untuk penderita dewasa bervariasi dari 400mg hingga 1000mg (Mirajkar, RN et al., 2011). Intake
adekwat omega 3 berdasarkan rerata intake perhari yang dikonsumsi individu sehat adalah 1,1 gram untuk dewasa (IOM, 2005).
5.7.1 Farmakokinetik dan farmakodinamik Omega-3
Omega 3 diabsorbsi dengan baik dari pemberian per oral bersama makanan. Omega 3 dimetabolisme di hati, dengan dimetabolisme menjadi eicosanoid, leukotriens dan prostaglandin (Patterson, 2008). Ketika dikonsumsi maka asam lemak omega 3 masuk ke dalam sel disemua jaringan tubuh (King MW, 2014). Formula dan bentuk dosis omega-3 dapat digunakan sendiri atau kombinasi satu atau dua agen yang lainnya yang dapat menunjukkan efek peningkatan dan penurunan. Agen lainnya dapat diberikan bersama dengan omega-3 dalam bentuk dosis tunggal atau diberikan secara terpisah. Pemberian omega-3 lebih dari 3 gram perhari meningkatkan resiko stroke perdarahan, yang berpotensial fatal karena pecah atau rupturnya arteri di otak (Mirajkar RN et al., 2011).
5.7.2 Indikasi Omega-3
Omega 3 diindikasikan untuk pencegahan penyakit kardiovaskuler dan sebagai terapi adjuvant untuk depresi mayor, skizofrenia dan gangguan bipolar (Patterson, 2008).
5.7.3 Kontraindikasi Omega-3
Pasien dengan riwayat hipersensitif terhadap omega 3, atau sumber omega 3 (Patterson, 2008).
5.7.4 Efek Samping
Efek samping jarang terjadi. Adapun efek samping yang pernah dilaporkan mual, muntah, back-pain, dan rash di kulit. Dosis 3 gram sehari atau lebih asam lemak omega-3 dari kapsul dapat meningkatan risiko pendarahan (Patterson, 2008).
6. Instrumen The Positive and negative Symptom Scale (PANSS)
Skala penilaian terhadap gejala positif dan negatif pada skizofrenia bermula dari dijumpainya heterogenitas hasil penelitian yang tidak konsisten, yang diduga disebabkan karena metode pengukuran yang kurang dapat dipercaya (Kusumawardhani, 1994).
Berbagai instrumen dan kuisioner dikembangkan untuk memeriksa kedua macam tipe skizofrenia berdasarkan gejala yang mendominasinya, antara lain: The Positive And Negative Symptoms Scale (PANSS). PANSS pertama kali disusun oleh Stanley Kay, Lewis Opler dan Abraham Fizbein pada tahun 1987 yang disusun berdasarkan instrumen Brief Psychiatric Rating Scale (BPRS)dan Psychopathology Rating Scale yang sudah ada terlebih dahulu.
Untuk dapat dipakai pada pasien skizofrenia di Indonesia, telah dilakukan uji reliabilitas, validasi dan sensitivitas oleh A.Kusumawardhani dan tim dari FKUI pada tahun 1994 (Kusumawardhani, 1994).
PANSS terdiri dari 33 butir pertanyaan yang masing-masing dinilai dalam 7 skala poin. Tujuh butir dikelompokkan dalam skala positif, tujuh butir dalam
skala negatif, enam belas butir dalam skala psikopatologi umum, dan tiga butir skala untuk menilai resiko agresi.
6.1 Skor PANSS
Masing-masing item dinilai sebagai berikut: 1 = tidak ada 2 = minimal 3 = ringan 4 = sedang 5 = agak berat 6 = berat 7 = sangat berat
6.2. Presentase perubahan total Skor PANSS
Untuk mengetahui adanya manfaat terapi yang diberikan, dilakukan pengukuran sebelum dan sesudah terapi dilakukan. Presentase perubahan total skor PANSS dianggap mempunyai makna klinis apabila memenuhi kriteria berikut:
- Minimal improved = penurunan skor ± 19%-28% - Much improved = penurunan skor ± 40%-53% - Very much improved = penurunan skor ± 71%-83%
Selain itu, penilaian perbaikan klinis dapat diketahui dari perubahan skor PANSS total (Nurmiati, 2008)
7. Interrater
Uji interrater reliability merupakan jenis uji yang digunakan untuk menyamakan persepsi dalam hal ini antara penulis dan penguji interrater (dokter spesialis kedokteran jiwa) yang ditunjuk. Alat yang digunakan untuk uji ini adalah uji statistik kappa. Bila nilai koefisien kappa > 0,6 atau nilai p dan alpha (0,05), maka persepsi antara penulis dengan penguji adalah sama. Bila nilai koefisien kappa < 0,6 atau nilai p dan alpha (0,05), maka persepsi antara penulis dengan penguji terjadi perbedaan.
B. KERANGKA PIKIR
C. HIPOTESIS
Pemberian terapi tambahan omega-3 1000mg/hari pada pasien skizofrenia kronis efektif untuk memperbaiki skor PANSS di RSJD dr.Arif Zainudin Surakarta.
Infeksi/aktivasi imun, hipoksia,toksin,malnutrisi
Stres sosial/isolasi sosial, life style, intakeburuk
Prenatal/perinatal masa kanak remaja dewasa
Gejala Skizofrenia inflamasi Stres oksidatif Kerusakan otak Pro-inflamasi Pro-oksidan
Perbaikan Gejala Skizofrenia
Antipsikotik O M E G A - 3 Mengisi lembar myelin Perkuat myelin Perbaikan sel saraf
Perbaikan interkoneksi
Menekan hiperaktivitas dopamin Resolvin, PG,
leukotrien neuroprotectin,
BAB III
METODOLOGI PENELITIAN
A. Jenis Penelitian
Penelitian ini bersifat randomized double-blind controlled pre-post study.
B. Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di unit rawat inap Rumah Sakit Jiwa Daerah Surakarta pada bulan Februari-Maret 2016.
C. Subjek Penelitian
Populasi target dari penelitian ini adalah semua penderita skizofrenia kronik yang berusia 25-50 tahun dan menjalani rawat inap pada periode bulan Februari-Maret 2015 di RSJD Surakarta dan memenuhi kriteria inklusi. Adapun kriteria inklusi pada studi ini :
a) Pasien skizofrenia kronis yang telah mengalami gangguan minimal selama 2 tahun.
b) Pasien skizofrenia yang menjalani menjalani rawat inap pada periode bulan Februari-Maret 2016 di RSJD Surakarta.
c) Pasien yang hanya mendapat pengobatan antipsikotik risperidon dan chlorpromazine.
d) Berusia 25 - 50 tahun (Non pediatri dan non geriatri)
Kriteria eksklusinya :
a) Pasien skizofrenia simplek dan skizofrenia hebefrenik (karena skizofrenia simplek dan skizofrenia hebefrenik adalah jenis skizofrenia yang resisten (Ortiz, et al, 2013)).
b) Pasien skizofrenia resisten yang mendapat pengobatan clozapine sebagai terapi pada skizofrenia resisten obat (multidrug resistance schizophrenia yang mendapat terapi clozapine).
D. Teknik Penetapan Subyek
Perekrutan subyek menggunakan tehnik purposive random sampling.
E. Besar Subyek
Pengambilan besar sampel dihitung berdasarkan rumus
n = 2 (Zα+ Zβ).S 2 ( X1- X2 ) (Sudigdo, 2002).
n = besar sample, sampel dua kelompok sama besar (n1=n2).
Zα = batas nilai konversi pada distribusi normal kemaknaan 0,05 adalah 1,96)
Zβ = batas bawah nilai konversi pada distribusi normal untuk batas kemaknaan 0,05 adalah 1,64.
S = standar deviasi perkiraan perbedaan, sebesar 10,90 X1- X2 = mean deviasi perbedaan, diperkirakan sebesar 10
Sehingga dapat dihitung sebagai berikut
n = 2 (1,96+ 1,64).10,90 2 ( 10)
n = 30,42 dibulatkan menjadi 30 sampel.
Berdasarkan rumus tersebut, maka didapatkan besarnya sampel penelitian pada masing-masing kelompok dibulatkan menjadi 30 sampel.
F. Identifikasi Variabel
a) Variabel bebas : omega-3 b) Variabel terikat : skor PANSS
G. Definisi Operasional Variabel Penelitian
a) Skizofrenia kronik : pasien dengan diagnosa skizofrenia dan telah mengalami gangguan tersebut selama lebih dari 2 tahun.
b) Antipsikotik kombinasi : dalam studi ini ditentukan penggunaan antipsikotik kombinasi risperidon-chlorpromazine (terapi berdasar protap RSJD-AZ).
c) Omega 3 : digunakan omega-3 dengan pemberian sekali sehari 1000mg pada pagi hari selama enam minggu.
d) PANNS : pada studi ini dilakukan penilaian pada skor PANSS pre dan post perlakuan di minggu ke-4 dan ke-6.
H. Instrumen Penelitian
1. Informed consent
2. Data identitas subyek penelitian 3. Rekam medis pasien
4. Lembar penilaian PANSS
I. Interrater
Studi ini menggunakan instrumen PANSS. Agar data yang dihasilkan valid, maka harus ada persamaan persepsi antara penulis yang mengambil data PANSS dan ahli. Alat yang digunakan untuk uji ini adalah uji statistik kappa.
J. Prosedur Penelitian
1. Pasien skizofrenia kronis yang memenuhi kriteria inklusi dan eksklusi dimotivasi untuk mengikuti penelitian dan menandatangani persetujuan penelitian.
2. Pasien mendapat terapi yang sama untuk kelompok kontrol maupun kelompok perlakuan
3. Dilakukan penilaian skor PANSS (pre test) pada seluruh subyek penelitian
4. Dilakukan pemberian terapi tambahan omega-3 1000mg/hari selama 6 minggu.
5. Dilakukan penilaian skor PANSS setelah pemberian omega-3 minggu ke-4 dan minggu ke-6 (post test). Dilakukan penilaian di minggu ke-ke-4 dan
ke-6 karena secara teori perbaikan dimulai diminggu ke-3 pemberian omega-3.
6. Dilakukan analisa hasil secara statistik.
J. Alur Prosedur Penelitian
Pasien skizofrenia rawat inap
RSJ Daerah Surakarta
K. Teknik Analisis Data
Data yang terkumpul akan diolah dan dianalisa dengan uji t, dengan menggunakan program SPSS 17.0. Untuk signifikansi hubungan variabel dengan tingkat kemaknaan 5%.
Memenuhi kriteria inklusi
Pemberian terapi tambahan omega-3 1000mg/hari selama 6 minggu
Penilaian skor PANSS dinilai di minggu ke-4 dan ke-6
Analisis data Penilaian skor PANSS
Kelompok Perlakuan n=30
Kelompok Kontrol n=30
Penilaian skor PANSS
Pemberian placebo selama 6 minggu
Penilaian skor PANSS dinilai di minggu ke-4 dan ke-6
L. Jadwal Pelaksanaan Kegiatan Kegiatan Jan 2016 Feb 2016 April 2016 Mei 2016 Persiapan Penelitian Pengumpulan Data
Input dan Pengolahan Data Pemaparan Hasil Penelitian
BAB IV
HASIL PENELITIAN
Telah dilakukan penelitian untuk mengetahui keefektifan pemberian terapi tambahan omega-3 untuk memperbaiki skor PANSS pada pasien skizofrenia kronis di unit rawat inap RSJD dr.Arif Zainudin Surakarta, pada bulan Februari-Maret 2016. Besar sampel pada penelitian ini adalah sebanyak 60 subyek, yang telah memenuhi kriteria inklusi dan eksklusi. Kemudian dari seluruh jumlah tersebut, secara acak dibagi menjadi dua kelompok yaitu kelompok perlakuan dan kelompok kontrol. Pada kelompok perlakuan terdiri dari 30 subyek, mendapat terapi tambahan omega-3 1000mg/hari selama 6 minggu, selain terapi antipsikotik standar. Pada kelompok kontrol terdiri dari 30 subyek dan mendapat terapi antipsikotik standar.
Karakteristik demografi subyek penelitian kedua kelompok dapat dilihat pada tabel 1.
Tabel 1. Karakteristik Demografi Subyek Penelitian
Variabel Kelompok p Intervensi n=30 Kontrol n=30 Jenis Kelamin*** Laki-laki Perempuan Umur (th)* 15 (50%) 15 (50%) 37.03+ 6.66 15 (50%) 15 (50%) 36.43+ 7.40 1,000 0,742 Pendidikan** 0.962 Tidak Sekolah 2 (6.7%) 0 (0.0%) SD 8 (26.7%) 11 (36.7%) SMP 13 (43.3%) 12 (40.0%)
SMA/SMK 7 (23.3%) 6 (20.0%) PT 0 (0.0%) 1 (3.3%) Pekerjaan*** 0.075 Buruh 19 (63.3%) 12 (40.0%) IRT 3 (10.0%) 1 (3.3%) Karyawan 0 (0.0%) 2 (6.7%) Sales 1(3.3%) 0(0.0%) Tidak Bekerja 7 (23.3%) 15 (50.0%) Diagnostik*** 0.693 skizofrenia katatonik 1 (3.3%) 0 (0 .0%) skizofrenia paranoid 15 (50.0%) 13(43.3%) skizofrenia lainnya 1 (3.3%) 1 (3.3%) skizofrenia tak terinci 13 (43.3%) 16 (53.3%)
Status***
0.598
Kawin 13 (43.3%) 11 (36.7%)
Tidak Kawin 17 (56.7%) 19 (63.3%)
Ket : * Data Numerik Berdistribusi Normal; Mean + SD Uji Independent Sampel T Test ** Data Kategorik Rasio; Jumlah (Prosentase); Uji Mann Whitney
** *Data Kategorik Nominal; Jumlah (Prosentase); Uji Chi Square
Berdasarkan tabel 1, dapat dilihat bahwa karakteristik demografik kedua kelompok dilakukan uji komparatif. Dengan uji tersebut didapatkan tidak ada perbedaan yang bermakna antara kelompok intervensi dan kelompok kontrol pada jenis kelamin (p=1,000), umur (p=0,742), diagnostik (p=0,693) dan status perkawinan (p=0,593). Sedangkan menurut pendidikan, terdapat distribusi data yang tidak normal, sehingga dilakukan uji normalitas Mann Whitney. Uji ini dilakukan agar data yang didapat memenuhi syarat untuk dilakukan uji statistik selanjutnya.
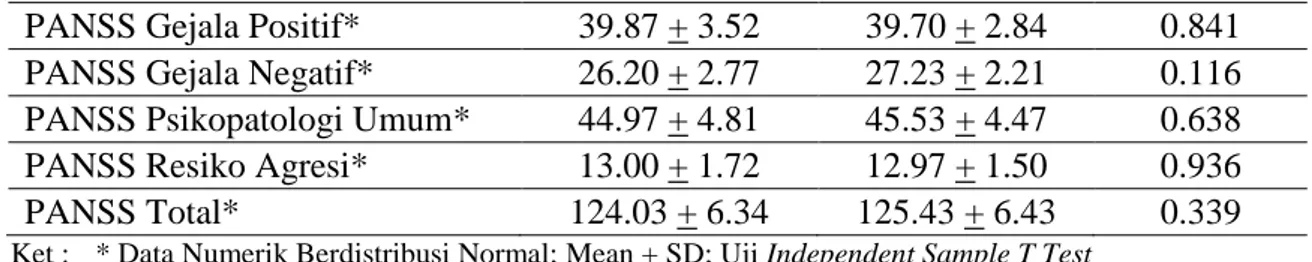
Tabel 2. Uji Beda Skor PANSS Pre-test Variabel Kelompok P Intervensi n=30 Kontrol n=30
PANSS Gejala Positif* 39.87 + 3.52 39.70 + 2.84 0.841 PANSS Gejala Negatif* 26.20 + 2.77 27.23 + 2.21 0.116 PANSS Psikopatologi Umum* 44.97 + 4.81 45.53 + 4.47 0.638 PANSS Resiko Agresi* 13.00 + 1.72 12.97 + 1.50 0.936
PANSS Total* 124.03 + 6.34 125.43 + 6.43 0.339
Ket : * Data Numerik Berdistribusi Normal; Mean + SD; Uji Independent Sample T Test ** Data Numerik Tidak Berdistribusi Normal; Median (min-max), Uji Mann Whitney
Data dari tabel 2, didapatkan hasil skor PANSS pre-tes pada kelompok intervensi dan kelompok kontrol tidak ada perbedaan yang signifikan pada: skor PANSS positif (p=0,841) skor PANSS negatif (p=0,116),
skor PANSS negatif (p=0,116), skor PANSS psikopatologi umum (p=0,638),
skor PANSS resiko agresi (p=0,936) dan pada skor PANSS total (p=0,339).
Dengan demikian dapat dikatakan bahwa tidak ada perbedaan skor PANSS pre-tes pada kelompok intervensi dan kelompok kontrol, sehingga kedua kelompok adalah setara. Dapat dikatakan bahwa terdapat kesetaraan awal skor PANSS pada kelompok intervensi dan kelompok kontrol.
Tabel 3. Uji Beda Skor PANSS Post-test I (post test di minggu ke-4)
Variabel Kelompok p Intervensi n=30 Kontrol n=30
PANSS Gejala Positif* 11.90 + 2.71 19.53 + 2.18 0.000
PANSS Gejala Negatif* 11.43 + 1.94 13.03 + 1.85 0.002
PANSS Psikopatologi Umum* 23.30 + 2.22 27.80 + 2.68 0.000 PANSS Resiko agresi** 5.00 (3.00- 7.00) 5.00 (3.00- 7.00) 0.056 PANSS Total** 46.50 (38.00- 59.00) 61.50 (53.00- 67.00) 0.000 Ket : * Data Numerik Berdistribusi Normal; Mean + SD; Uji Independent Sample T Test
** Data Numerik Tidak Berdistribusi Normal; Median (min-max), Uji Mann Whitney
Dari tabel 3. Uji beda skor PANSS post-tes terlihat bahwa terdapat perbedaan yang signifikan:
skor PANSS gejala positif p=0,000, skor PANSS gejala negatif p=0,002,
skor PANSS psikopatologi umum dan skor PANSS total p=0,000.
Namun p=0,056 untuk skor PANSS resiko agresi, untuk skor PANSS resiko agresi menunjukkan penurunan yang setara antara kelompok intervensi dan kelompok perlakuan.
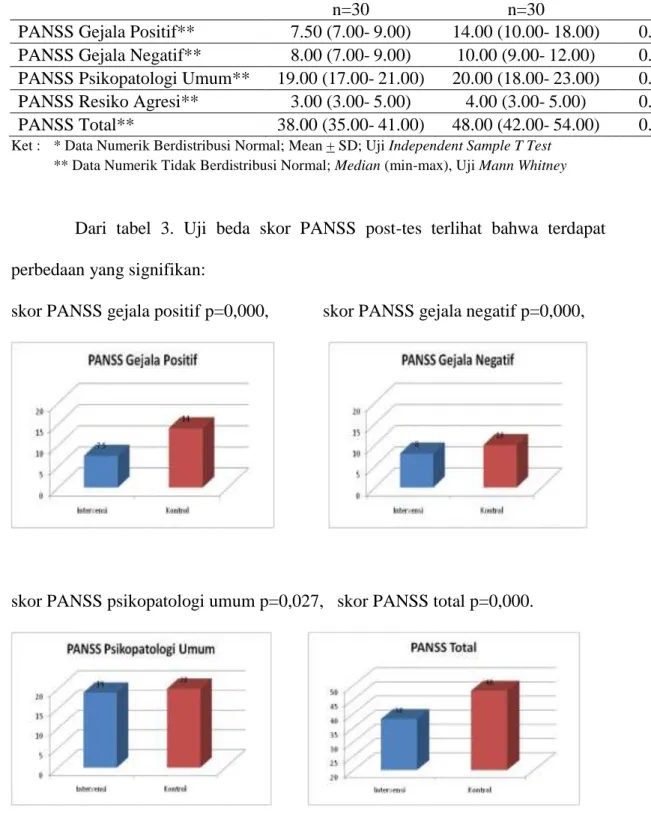
Tabel 4. Uji Beda Skor PANSS Post-test II (post test di minggu ke-6) Variabel Kelompok p Intervensi n=30 Kontrol n=30
PANSS Gejala Positif** 7.50 (7.00- 9.00) 14.00 (10.00- 18.00) 0.000 PANSS Gejala Negatif** 8.00 (7.00- 9.00) 10.00 (9.00- 12.00) 0.000 PANSS Psikopatologi Umum** 19.00 (17.00- 21.00) 20.00 (18.00- 23.00) 0.027 PANSS Resiko Agresi** 3.00 (3.00- 5.00) 4.00 (3.00- 5.00) 0.111 PANSS Total** 38.00 (35.00- 41.00) 48.00 (42.00- 54.00) 0.000 Ket : * Data Numerik Berdistribusi Normal; Mean + SD; Uji Independent Sample T Test
** Data Numerik Tidak Berdistribusi Normal; Median (min-max), Uji Mann Whitney
Dari tabel 3. Uji beda skor PANSS post-tes terlihat bahwa terdapat perbedaan yang signifikan:
skor PANSS gejala positif p=0,000, skor PANSS gejala negatif p=0,000,
skor PANSS psikopatologi umum p=0,027, skor PANSS total p=0,000.
Namun p=0,111 untuk skor PANSS resiko agresi, menunjukkan penurunan yang setara antara kelompok intervensi dan kelompok perlakuan.
Dapat dilihat dalam sajian grafik dibawah ini, terdapat perbaikan gejala yang lebih cepat pada kelompok intervensi dibandingkan kelompok kontrol.
Gambar 8. Grafik Penurunan Skor PANSS Positif 0 5 10 15 20 25 30 35 40 45 P1 P2 P3 Intervensi Kontrol PANSSResiko agresi
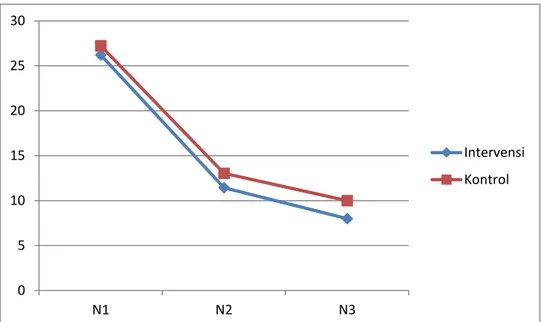
Gambar 9. Grafik Penurunan Skor PANSS Negatif
Gambar 10. Grafik Penurunan Skor PANSS Psikopatologi Umum 0 5 10 15 20 25 30 N1 N2 N3 Intervensi Kontrol 0 5 10 15 20 25 30 35 40 45 50 G1 G2 G3 Intervensi Kontrol
Gambar 11. Grafik Penurunan Skor PANSS Resiko agresi
Gambar 12. Grafik Penurunan Skor PANSS Total 0 2 4 6 8 10 12 14 S1 S2 S3 Intervensi Kontrol 0 20 40 60 80 100 120 140
Tot 1 Tot 2 Tot 3
Intervensi Kontrol
Tabel 5. Uji Beda Kecepatan Penurunan Skor PANSS (/Hari) Variabel Kelompok p Intervensi n=30 Kontrol n=30 Penurunan PANSS Gejala
Positif (/hari) ** 0.80 (0,60- 0,90) 0.60 (0,40- 0,80) 0.000 PANSS Gejala Negatif (/hari)**
0.45 (0.30- 0.60) 0.40 (0.30- 0.50) 0.062 PANSS Psikopatologi Umum
(/hari)** 0.60 (0.30- 0,80) 0.60 (0.40- 0,80) 0.355 PANSS S(/hari)**
0.20 (0.10- 0.30) 0.20 (0.10- 0.30) 0.283 PANSS Total(/hari) *
2.10 (1.70-2.30) 1,80 (1.60-2.10) 0.000 Ket : * Data Numerik Berdistribusi Normal; Mean + SD; Uji Independent Sample T Test
** Data Numerik Tidak Berdistribusi Normal; Median (min-max), Uji Mann Whitney
Gambar 13. Diagram Batang Perbandingan kecepatan penurunan skor PANSS antara Kelompok Intervensi dan Kelompok Kontrol
Dari diagram diatas didapatkan rata-rata kecepatan penurunan skor PANSS kelompok intervensi untuk gejala positif sebesar 0,80 point perhari (rata-rata penurunan skor PANSS gejala positif sebesar 50%), penurunan skor PANSS 0,00 0,50 1,00 1,50 2,00 2,50 Intervensi Kontrol 0,80 0,60 0,45 0,40 0,60 0,60 0,20 0,20 2,10 1,80 Penurunan_P Penurunan_N Penurunan_G Penurunan_S Penurunan_Panss
gejala negatif sebesar 0,45 point perhari (rata-rata penurunan skor PANSS gejala negatif sebesar 45%), penurunan skor PANSS gejala psikopatologi umum sebesar 0,60 point perhari (rata-rata penurunan skor PANSS psikopatologi umum sebesar 32%), penurunan skor PANSS resiko agresi sebesar 0,20 point perhari perhari (rata-rata penurunan skor PANSS resiko agresi sebesar 43%) , dan penurunan skor PANSS total sebesar 2,10 point perhari (rata-rata penurunan skor PANSS total sebesar 45%).
Dari diagram diatas didapatkan rata-rata kecepatan penurunan skor PANSS kelompok kontrol untuk gejala positif sebesar 0,60 point perhari (rata-rata penurunan skor PANSS gejala positif sebesar 40%), penurunan skor PANSS gejala negatif sebesar 0,40 point perhari (rata-rata penurunan skor PANSS gejala negatif sebesar 38%), penurunan skor PANSS gejala psikopatologi umum sebesar 0,60 point perhari (rata-rata penurunan skor PANSS psikopatologi umum sebesar 32%), penurunan skor PANSS resiko agresi sebesar 0,20 point perhari perhari (rata-rata penurunan skor PANSS resiko agresi sebesar 40%) , dan penurunan skor PANSS total sebesar 1,80 point perhari (rata-rata penurunan skor PANSS total sebesar 38%).
BAB V PEMBAHASAN
A. Pembahasan
Telah dilakukan studi untuk mengetahui keefektifan penambahan terapi omega-3 pasien skizofrenia kronis untuk memperbaiki skor PANSS di RSJD dr.Arif Zainudin Surakarta, pada bulan Februari-Maret 2016. Pada studi ini digunakan desain studi randomized control trial(RCT). Penelitian randomized control trial(RCT) merupakan studi yang menggunakan subyek pasien sesungguhnya yang kemudian dibagi atas dua grup yaitu grup kontrol dan grup yang diberi perlakuan (intervensi). Penggolongan pasien masuk ke grup kontrol atau perlakuan dilakukan secara acak (random) dan juga dengan cara blinding untuk mengurangi kemungkinan subyektivitas. Biasanya digunakan untuk studi terapi. Dari 60 pasien, baik dari kelompok kontrol ataupun kelompok intervensi menunjukkan gejala skizofrenia baik gejala positif, gejala negatif, psikopatologi umum, hal ini sesuai teori bahwa gejala skizofrenia meliputi gejala positif, gejala negatif dan disorganized tingkah laku, kognitif, perhatian (Sadock, 2010)
Penilaian data dimulai dengan penilaian demografi yang terdiri dari deskripsi, penilaian distribusi data atau uji normalitas. Dari data yang diperoleh didapatkan hasil bahwa subyek memiliki distribusi normal. Dengan demikian data memenuhi syarat untuk dilakukan uji statistik. Data pre-tes didapatkan kesetaraan antara kelompok intervensi dan kelompok kontrol.
Kelompok intervensi dan kelompok kontrol pada studi ini menunjukkan setara dalam hal demografi mencakup jenis kelamin, umur, status perkawinan, dan tingkat pendidikan yang ditunjukkan pada tabel 1. Kesetaraan juga ditunjukan pada skor PANSS awal, kedua kelompok menunjukkan tidak ada perbedaan yang bermakna diantara keduanya. Sehingga dapat dikatakan bahwa subyek pada studi ini adalah homogen.
Dari akhir studi ini, yakni skor PANSS setelah perlakuan maupun kontrol diuji dengan uji-t tidak berpasangan (independent t-test), yang mensyaratkan hal-hal berikut (Sopiyudin, 2008):
1. Distribusi data harus normal
2. Varians data boleh sama, boleh juga tidak sama. 3. Jika memenuhi syarat, dipilih uji t tidak berpasangan.
4. Jika tidak memenuhi syarat dilakukan transformasi data terlebih dahulu.
5. Jika variabel baru hasil transformasi tidak berdistribusi normal, maka dipilih uji Mann-Whitney.
Studi ini melibatkan 60 orang pasien skizofrenia kronis yang masuk kriteria inklusi dan bersedia mengikuti studi, dibagi menjadi dua kelompok, masing-masing 30 orang kelompok intervensi dan kelompok kontrol yang dipilih secara acak. Penulis dibantu dokter bangsal dan penulis hanya melakukan penilaian skor PANSS pretes dan postes minggu 4 dan minggu 6 terhadap seluruh subyek tanpa mengetahui tiap subyek masuk kedalam kelompok tertentu.
Dari studi ini didapatkan hasil bahwa pada kedua kelompok, baik kelompok intervensi maupun kelompok kontrol keduanya mengalami penurunan skor PANSS pada pengukuran di minggu ke-4 dan ke-6. Dapat diketahui penurunan kelompok intervensi lebih cepat dibandingkan kelompok kontrol. Perbaikan gejala terus berlangsung sampai minggu ke-6. Setelah dilakukan analisa dengan perhitungan statistik terdapat perbedaan yang bermakna pada penurunan skor tersebut.
Hasil studi ini sesuai dengan studi yang dilakukan di Iran oleh Jamilian, et al, 2014, terjadi perbaikan skor PANSS pada pasien skizofrenia yang mendapat terapi tambahan omega-3 (Jamilian, et al, 2014).
Hasil studi ini sesuai dengan teori bahwa pengaruh polyunsaturated fatty acid (PUFA) dapat membantu perbaikan penderita skizofrenia (Joanne J, et al, 2015).
Dari perbandingan kecepatan penurunan skor PANSS antara kelompok intervensi dan Kelompok kontrol didapatkan kelompok intervensi secara bermakna mencapai kecepatan penurunan skor PANSS lebih tinggi dibandingkan kelompok kontrol. Rata-rata penurunan skor PANSS dicapai dikisaran much improved = penurunan skor ± 40%-53% untuk kelompok intervensi dan kelompok kontrol dibawah kisaran much improved. Hal ini menurut teori bahwa kecukupan intake yang mengandung omega-3 membantu memperbaiki gejala skizofrenia (Jamilian, et al, 2014).
Selama studi ini dilakukan tidak ada laporan efek samping akibat pemberian terapi tambahan omega-3, karena pemberian dosis omega-3
1000mg perhari masih dalam dosis anjuran dan tidak melebihi dosis yang pernah dilaporkan menimbulkan efek samping. Adapun dari teori, efek samping yang pernah dilaporkan mual, muntah, back-pain, dan rash di kulit. Dosis 3 gram sehari atau lebih asam lemak omega-3 dari kapsul dapat meningkatan risiko pendarahan (Patterson, 2008).
B. Keterbatasan Penelitian
1. Waktu studi yang relatif pendek sehingga tidak diketahui efek perlakuan dalam jangka panjang.
2. Banyak variabel yang mempengaruhi skizofrenia yang tidak dikendalikan dalam studi ini seperti ekonomi, ciri kepribadian, dukungan keluarga, gaya hidup, status gizi, serta faktor biologis seperti faktor genetik dan struktur di otak, seperti misalnya pasien dengan atrofi cerebri, tentu akan lebih resisten terhadap pengobatan, sehingga akan mempengaruhi bias pada hasil akhir studi.
3. Target organ omega-3 tidak spesifik.
4. Omega-3 berperan untuk perbaikan berbagai gangguan mental, namun primernya untuk gangguan mood.
5. Belum diketahui dosis pasti omega-3 yang tepat untuk memperbaiki gangguan mental, khususnya skizofrenia.
6. Banyak variabel yang mempengaruhi saat penilaian skor PANSS, seperti ruangan yang tidak terpisah, waktu penilaian yang tidak sama.
7. Keefektifan dinyatakan sebagai perbaikan nilai secara statistik, bukan secara klinis, begitu juga dalam penghitungan besar sampel, sehingga akan mempengaruhi bias pada akhir penelitian.
8. Studi dilakukan di kota Surakarta, tentu banyak perbedaan budaya, budaya berkehidupan, ataupun budaya pola konsumsi makan akan berbeda dengan daerah lain di Indonesia, yang dapat memberikan perbedaan pada hasil studi.
9. Studi ini tidak bisa mewakili pulau Jawa, apalagi dunia, dikarenakan banyak perbedaan, seperti perbedaan kebudayaan, perbedaan gender, perbedaan status gizi, sehingga tentu menghasilkan hasil akhir studi yang berbeda.
BAB VI
SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil analisis data studi dapat diambil simpulan sebagai berikut:
1. Terdapat penurunan skor PANSS pada kelompok intervensi dan kelompok kontrol.
2. Terdapat perbedaan yang signifikan pada penurunan skor PANSS pada kelompok intervensi dan kelompok kontrol. Kelompok intervensi mengalami penurunan skor PANSS yang lebih cepat dan nyata.
3. Penurunan skor PANSS atau perbaikan gejala lebih nyata terlihat dari pengukuran pre-test dan post-test di minggu ke-4. Penurunan skor atau perbaikan gejala tetap berlangsung sampai post-test minggu ke-6.
4. Dengan demikian dapat disimpulkan bahwa penambahan omega-3 efektif untuk menurunkan skor PANSS pada pasien skizofrenia kronis (hipotesis diterima).
B. Implikasi
Penambahan omega-3 efektif untuk menurunkan skor PANSS lebih cepat pada pasien skizofrenia kronis. Penambahan omega-3 dapat menjadi terapi tambahan standar untuk pengelolaan pasien skizofrenia kronis di RSJD dr.Arif Zainudin Surakarta khususnya. Dengan demikian studi ini diharapkan
dapat diaplikasikan dan dapat menjadi pertimbangan untuk dilakukannya studi lanjutan, sehingga dapat menambah manfaat pada penatalaksanaan pasien skizofrenia kronis pada masa yang akan datang.
C. Saran
Diperlukan adanya penelitian lanjutan dengan desain penelitian yang lebih sesuai dan dengan jumlah subyek penelitian yang lebih representatif, dengan memperhatikan keterbatasan- keterbatasan yang ada, sehingga mendapat hasil yang lebih baik pada penelitian penambahan terapi omega-3 pada pasien skizofrenia.
DAFTAR PUSTAKA
Abhisek Ghosh, Kaustav Chakraborty dan Surendra Kumar, 2011. Newer Molecules in The Treatment of Schizophrenia: A Clinical Update. Indian J Pharmacol. Apr; 43(2): 105–112. doi: 10.4103/0253-7613.77334
Alan S. Brown dan Ezra S.Susser. 2008. Prenatal Nutritional Deficiency and Risk of Adult Schizophrenia. Schizophrenia Bulletin vol. 34 no. 6 pp. 1054– 1063
Allison Brown dan Frank B Hu, 2001. Dietary modulation of endothelial
function: implications for cardiovascular disease. The American Journal of Clinical Nutrition.
Aravindakshan, Ghate M, RanjekarP, Evan dan Mahadik. 2006. Antioxidant Improves The outcome of Schizophrenia.
www.vetmed.helsinki.fi/abs/dokumentit/
Bazinet R dan Sophia Laye. 2014. Polyunsaturated Fatty Acids and Their
Metabolites in Brain Function and Disease. Nature Reviews Neuroscience 15,771–785
Black Alexis, 2006. Brain Health Dramatically Improved by intake of Omega-3 Fatty Acid and Fish Oils. : http://www.naturalnews.com/016353_omega-3_fatty_acids_mental_health.html#ixzz3wKFJiTwe
Boskovic M, Tomaa Vovk. 2008. Can supplementation with vitamin E or C and omega-3 or -6 fatty acids improve the outcome of schizophrenia?. Faculty of Pharmacy.Ljubljana.Slovenia
Brown AS. Prenatal Infections As a Risk Factor For Schizophrenia. Schizophrenia Bull 2006;32(2):200-2
Buchanan RW, Kreyenbuhl J, Kelly DL, et al, 2010. The 2009 Schizophrenia PORT psychopharmacological treatment recommendations and summary statements. Schizophr. Bull. 2010; 36: 71-93
Calder, PC, Kremmyda, LS, Vlachava, M, Noakes, PS& Miles EA 2010, ‘Early programming of the immune system and the role of nutrition Is there a role for fatty acids in early life programming of the immune system?.’ Proceed Nutrit Soc, vol. 69, pp. 373-80.
Cristina Gonzalez-Liencres, Cumhur Tas, Elliot C Brown, Soner Erdin, Ece Onur, Zeynep Cubukcoglu, Omer Aydemir, Aysen Esen-Danaci and Martin Brune.2014. Oxidative stress in schizophrenia: a case–control study on the
effects on social cognition and neurocognition.BMC Psychiatry 2014,14:268. http://www.biomedcentral.com/1471-244X.14/268. (14
November 2015).
De Hert M., Schreurs V., Vancampfort D. and Van Winkel R. 2011. Metabolic syndrome in people with schizophrenia: a review World Psychiatry; 8(1): 15–22.
Depkes RI. 2014. Riset Kesehatan Dasar (RISKESDAS) 2013. Jakarta : Departemen Kesehatan RI
Fontani, Corradeschi F, Felici, Alfatti. 2005. Cognitive And Physiological Effects Of omega-3 Polyunsaturated Fatty Acid. University of Siena, Siena, Italy. Fenton, Dickerson, John Boronow dan Michael K, 2001. A Placebo-Controlled
Trial of Omega-3 Fatty Acid(Ethyl Eicosapentaenoic Acid) Supplementation for Residual Symptoms and Cognitive Impairment. Am J Psychiatry 2001; 158:2071–2074.
Goepp J. 2010. Omega-3 Fatty Acids Increase Brain Volume.
Goldberg dan Katz, 2007. Omega-3 Fatty acid in Brain and Neurological health. Journal of Neuroscience Research 86(8):1812-1822.
Goldner EM, Hsu L, Waraich, Somers JM, 2002. Prevalence and incidence studies of schizophrenic disorders: a systematic review of the literature.Canadian Journal of Psychiatri, 47(9),833-43.
Gonzalez, Tas Cumhur, Soner E, Omer A, 2014. Oxidative Stress in Schizophrenia: A case Control Study on The Effects on Social Cognition and Neurocognition. Bmcpsychiatry. Biomed journals.
Healy D, 2002. The Creation of Psychopharmacology. Cambridge, MA: Harvard University Press. ISBN 0674006194.
Huffman J dan Stern TA, 2003. QTc Prolongation and The Use of antipsychotic: A Case Discussion. The Psychiatric Consultation Service. University of Massachusetts.
IOM (Institute of Medicine). 2005. ‘Dietary Reference Intakes for energy, carbohydrate, fiber, fat, fatty acids,cholesterol, protein, and amino acids (macronutrients)’. Washington, DC: The National Academies Press. Jamilian H, Solhi H, Jamilian M. 2014. Randomized, placebo-controlled clinical
trial of omega-3 as supplemental treatment in schizophrenia.; Glob J Health Sci - January 1,(7 Spec No); 103-8
Janneke van Beek, et al, 2012. The Factor Structure of the Brief Psychiatric Rating Scale (Expanded Version) in a Sample of Forensic Psychiatric Patients. Department of Clinical Neuropsychology, VU University Amsterdam, Van der Boechorststraat 1, room 1F-65, 1081 BT Amsterdam, Netherlands. Janneke van Beek, Department of Clinical Neuropsychology, VU University Amsterdam, Van der Boechorststraat 1, room 1F-65, 1081 BT Amsterdam, Netherlands.
Jeff C. Huffman dan Theodore A. Stern. 2003. QTc Prolongation and the Use of Antipsychotics: A Case Discussion. Primary Care Companion J Clin Psychiatry 2003;5(6)
Joanne J, Pnina Green, J.John Mann, Stanley I, dan Elizabeth Sublette. 2015. Pathways of Polyunsaturated Fatty Acid Utilization: Implications for Brain Function in Neuropsychiatric Health and Disease. Brain Res. 2015 February 9; 0: 220–246. doi:10.1016/j.brainres.2014.11.059.
Jones HM dan Pilowsky LS, 2002. Dopamine and Antipsychotic Drug Action Revisited. British Journal of Psychiatry, 181, 271-275.
Joy CB, Mumby CR, Joy LA. 2006. Polyunsaturated fatty acid supplementation for schizophrenia. Cochrane Database Syst Rev.
Kaplan HI, Sadock BJ, Grebb JA. 2010. Kaplan-Sadock Sinopsis Psikiatri Ilmu Pengetahuan Perilaku Psikiatri Klinis. Binarupa Aksara: Jakarta. Hal : 699-744
Kee-Hong Choi,Til Wykes, Matthew M. Kurtz. 2013. Adjunctive pharmacotherapy for cognitive deficits in schizophrenia: meta-analytical investigation of efficacy. The British Journal of Psychiatry 203, 172–178. doi: 10.1192/bjp.bp.111.107359
Keller R, Lionel M, Heidi J.wehring, Maju Mathew Koola, Robert W Buchanan.2013. A Review of Anti-Inflammatory Agents for Symptoms of Schizophrenia.Maryland Psychiatric Research, University of Maryland School of medicine, Baltimore. J Psychopharmacol.2013 April;27(4):337-342.
Kidd. 2007. Omega-3, DHA and EPA for Cognition. Minneapolis, Minnesota. King, MW .2014. ‘Omega-3 and -6 Polyunsaturated Fatty Acids (PUFAs)’, the
medical biochemistry. page[Electronic], Available:
http://themedicalbiochemistrypage.org/omegafats.php(15November 2015).
Kinney,et al. (2009). A unifying hypothesis of schizophrenia: abnormal immune systemdevelopment may help explain roles of prenatal hazards, post-pubertal onset, stress, genes, climate, infections, and brain dysfunction. Med Hypothesis, doi:10.1016/j.mehy.2009.09.040
Kusumawardhani A, dkk. 1994. Pedoman Definisi PANSS. FKUI.
Maramis WF, Maramis AA. 2010. Skizofrenia. Catatan Ilmu Kedokteran Jiwa Edisi 2. Surabaya : Airlangga University Press. Halaman 259 – 282
MacDowell KS,Bueno BG,Madrigal J, Parellada M.2011. Risperidone Normalizes Increased Inflammatory Parameters and Restores anti-inflammatory Pathways in a model of Neuroinflammation. Department of Pharmacology, Faculty of Medicine, University of Cadiz, Spain.
Mercer NJ.2013.New Treatment Approaches for Schizophrenia.Division of Schizophrenia Research University of Medicine and Dentistry of New Jersey. NAMI. Feb. 19.2013 7:30
Miller B, Kirkpatrick B, 2013. Inflammation and Schizophrenia.
Department of Psychiatry and Behavioral Sciences, University of Nevada School of Medicine, Reno, NV; Department of Psychiatry
and Health Behavior, Georgia Regents University, Augusta, GA
Mirajkar, RN, Jamadar, SA, Patil, AV & Mirajkar, NS 2011, Omega 3 Fatty Acids- Clinical Implications, International Journal of ChemTech Research, Vol. 3, No.2, pp 724-732.
Muller N, ElifWeidinger, BiankaLeitner and MarkusJ.Schwarz.2015. The role of inflammation in schizophrenia. Department of Laboratory Medicine, DepartmentofPsychiatryandPsychotherapy,LudwigMaximilianUniversity, Munich,Germany,LudwigMaximilianUniversity,Munich,Germany.
Nasrallah, Henry A.2013.Beyond Dopamine: The Other Effects of Antipsychotics Exert Anti-immuno-Inflammatory, Antioxidative, and Neuroplasticity Effects.
Nieto, Kukuljan dan Silva, 2013. BDNF and Schizophrenia: From Neurodevelopmental to Neuronal Plasticity, Learning, and Memory. Frontiers in Psychiatry. http://dx.doi.org/10.3389/fpsy.2013.00045
Nobre M, Brito B.2013. Eicosapentaenoic acid and docosahexaenoic acid exert anti-inflammatory and antinociceptive effects.Research Gate. at:
http://www.researchgate.net/publication/236918862. (13 November 2015)
Nurmiati Amir. 2008. Pengenalan Instrumen PANSS. FKUI Jakarta. Ortiz B, et al, 2013. Is disorganized schizophrenia a predictor of treatment
resistance? Evidence from an observational study. Revista Brasileira de Psiquiatria. 2013;35:432–434
Osborn L.2009. Recovery in Schizophrenia: The Viability of Recovery and Can Psychoanalysis
Play a Role? International Journal of Psychosocial Rehabilitation. Vol
14(1). 112-118
Pajar Hatma Indra Jaya. 2012. Dinamika Pola Pikir Orang Jawa Di Tengah Arus Modernisasi. Humaniora Jogjakarta.
Patterson Brandon J, 2008. Omega-3 Acid Ethyl Esters. Pharmacy Volunteer Austin State Hospital.
Sadock BJ, Sadock VA.2010. Schizophrenia. Synopsis of Psychiatry Behavioral Sciences/Clinical Psychiatry 10th edition. New York: Lippincott William & Wilkins. Page 467 – 497
Schachter, H, Reisman, J, Tran, K, Dales, B, Kourad, K, Barnes, D& et al 2004, Health effects of omega-3 fatty acids’, Evidence report/technology assessment, vol. 91, pp. 1-201.
Scuchdart, Meyer, Neubronner, Hahn. 2011. Krill Oil: Uses, Side Effects, Interaction and Warning. www.m.webmd.com
Shmuel Bar. 2004. Iran: Cultural Values, Self images and Negotiation Behavior. The Interdisciplinary Center Herzliya Lauder School of Government, Diplomacy and Strategy Institute for Policy and Strategy
Simon C. Dyall. 2010. Long-Chain Omega-3 Fatty Acids and The Brain: A Review of The Independent and Shared Effects of EPA, DPA and DHA. Bournemouth University, Bournemouth, UK.
Smith M dan Segal. 2015. Schizophrenia Treatment and Recovery. Practice Guidelines for the Treatment of Patients with Schizophrenia – Comprehensive look at current expert recommendations for both the acute and maintenance phase of schizophrenia treatment. (American Psychiatric Association)
Sopiyudin M, 2008. Statistik Untuk Kedokteran dan Kesehatan. Salemba Medika, cetakan kedua.
Stahl, et al.2008. Essential Psychopharmacology Neuroscientific Basic and Practical Applications. Third Edition. University of California at San diego Cambridge University Press.
Stephanie Watson. 2007. Omega-3 And Mental Health. Benefits of Omega-3, Science Daily, UK.
Stephen Goldberg. 2008. Omega-3s Can Aid Mental and Emotional Disorders. :
http://www.naturalnews.com/016353_omega 3_fatty_acids_mental_health.html#ixzz3uWx7qlOX
Steven Ehrlich. 2013. Overview Omega-3 Fatty Acid. University of Maryland. Stohs SJ. 2005. The role of free radicals in toxicity and disease. J Basic
Physiology Pharmacology 6:205–28.
Sudigdo dan Sofyan, 2002. Dasar-Dasar Metodologi Penelitian Klinis. Edisi kedua, CV.sagung Seto, Jakarta.
Rajiv T, Christoph UC,2009. Antipsychotic Polypharmacy: State of the Science and Guidelines for Practice
Riskesdas. 2013. Prevalensi Gangguan Jiwa di Indonesia. Departemen Kesehatan RI
Riskedas. 2014. Riset Kesehatan Dasar : Gangguan Jiwa Berat . Departemen Kesehatan RI.
WHO.2012. Statistical Profile Of Burden Disease.
WHO.1998. Schizophrenia and Public Health. Nations for Mental Health.
Widodo, J 2013, Dirjen: Konsumsi Ikan Penduduk Indonesia Masih Rendah, Antara Jateng.com, Available: http://www.antarajateng.com/detail/dirjen-konsumsi-ikan-penduduk-indonesia-masih-rendah.html, [29 November 2015]
Young G, Conquer J.2004. Omega-3 Fatty Acid and Nuropsychiatric Disorder. Human biology and nutritional sciences, University of Guelph, Ontario, Canada.reprod.Nutr.Dev.45 (2005)1-28
Zhang M, Tsung-Ung W, W Woo.(2009). Oxidative Stress in Schizophrenia: An Integrated Approach. Neuroscience and biobehavioral reviews. HHS Public:2-4.
Lampiran 1. PENJELASAN PENELITIAN
PENJELASAN TENTANG PENELITIAN
Judul penelitan: KEEFEKTIFAN PENAMBAHAN TERAPI OMEGA-3 PASIEN SKIZOFRENIA KRONIS UNTUK MEMPERBAIKI SKOR PANSS DI RSJD
dr.ARIF ZAINUDIN SURAKARTA
Penulis : dr.Nonny Putri Intansari No.Telp : 082225849734
Saya dr.Nonny Putri Intansari (Mahasiswa Program Pendidikan Dokter Spesialis Kedokteran Jiwa FK UNS) bermaksud mengadakan penelitian
“KEEFEKTIFAN PENAMBAHAN TERAPI OMEGA-3 PASIEN
SKIZOFRENIA KRONIS UNTUK MEMPERBAIKI SKOR PANSS DI RSJD dr.ARIF ZAINUDIN SURAKARTA”
Penulis menjamin bahwa penelitian ini tidak akan menimbulkan dampak negatif bagi siapapun. Penulis berjanjiakan menjunjung tinggi hak-hak subyek dengan cara:
a. Menjaga kerahasiaan data yang diperoleh, baik dalam proses pengumpulan data, dan penyajian hasil penelitian.
b. Menghargai keinginan subyek untuk berpartisipasi dalam penelitian ini. Dalam penelitian ini, subyek/keluarga akan diminta mengisi kuisioner untuk data demografi dan dilakukan wawancara dan observasi oleh penulis.
Melalui penjelasan singkat ini, penulis mengharapkan partisipasi saudara untuk menjadi partisipan atau subyek penelitian ini. Terima kasih atas kesediaan dan partisipasinya.
Lampiran 2.
PERSETUJUAN PENELITIAN
No. Penelitian :
PERSETUJUAN PENELITIAN
( Informed Consent )Saya yang bertanda tangan di bawah ini : Nama
Tempat / tanggal lahir/jenis kelamin Pendidikan terakhir
Pekerjaan Alamat Telp
Hubungan dengan pasien
: : : : : : :
Setelah diberi penjelasan mengenai penelitian, maka dengan ini saya menyatakan :
Nama
Tempat / tanggal lahir Jenis kelamin Status perkawinan Pendidikan terakhir Pekerjaan Alamat : : : L / P : : : :
Bersedia sebagai peserta penelitian dengan judul ” KEEFEKTIFAN PENAMBAHAN TERAPI OMEGA-3 PASIEN SKIZOFRENIA KRONIS
UNTUK MEMPERBAIKI SKOR PANSS DI RSJD ARIF ZAINUDIN SURAKARTA”
Surakarta, …-……- 2015 Saya yang membuat pernyataan