BAB II
TINJAUAN PUSTAKA
2.1 PENDAHULUAN
Pada bab ini akan menjelaskan tentang hujan asam dan dampak yang ditimbulkan dari hujan asam yang terjadi akibat letusan gunung Sinabung. Korosi merupakan suatu proses perusakan material oleh suatu aksi kimia atau elektrokimia. Hal tersebut terjadi sebagai akibat interaksi antara seng dengan lingkungan sekelilingnya yang bersifat korosif. Maksudnya, secara termodinamika, umumnya antara seng dan lingkungannya (air maupun udara) tidak berada dalam satu kesetimbangan atau dengan kata lain, seng akan cenderung membentuk senyawa kimia.
Salah satunya korosi yang terjadi pada logam Zn. Pada bab ini juga menjelaskan tentang logam Zn yang berkaitan dengan sejarah karakteristik, teori dasar korosi serta jenis jenis korosi. Contoh dari hal di atas dapat kita lihat pada seng yang terkena dampak hujan asam dan dibiarkan terekspose di alam terbuka. Seng yang tidak terproteksi dan dibiarkan terekspose di alam terbuka akan mengalami reaksi korosi.
2.2 GUNUNG SINABUNG
Gunung Sinabung adalah gunung api di dataran tinggi karo, kabupaten Karo, Sumatera Utara, Indonesia. Frekuensi erupsi Gunung Sinabung di Kabupaten Karo, meningkat sejak bulan februari lalu. Jika sebelumnya erupsi terjadi berkisar empat hingga enam kali sehari, kini meningkat menjadi delapan kali dalam sehari. Namun, status Awas Sinabung telah berlangsung selama 20 bulan terhitung sejak 2 Juni 2015
belum ditingkatkan lagi. Pengamat Gunung Api Sinabung, Deri Al Hidayat, mengatakan, luncuran awan panas tidak terjadi saat erupsi berlangsung. Sementara volume kubah lava belum menumpuk. Pengukuran pada pertengahan Januari lalu menunjukkan volume kubah lava mencapai 1,3 juta meter kubik. Kubah lava Sinabung sebelumnya pernah mencapai 2,6 juta meter kubik. Erupsi meningkat karena aktivitas magma dan gas yang diproduksi cukup tinggi (Kompas,2017)
Abu vulkanik tersebut beterbangan menutup atap seng rumah penduduk, perkantoran camat dan desa, serta kendaraan milik warga yang diparkir di luar rumah Jika abu vulkanik itu tidak secepatnya dibersihkan maka mobil dan atap seng rumah penduduk akan mudah berkarat karena material letusan gunung itu mengandung asam (Antara News, 2014)
Gambar 2.1 Gunung Sinabung
2.3 LOGAM Zn
Seng (bahasa Belanda: zink), zink, atau timah sari adalah unsur kimia dengan lambang kimia Zn, bernomor atom 30, dan massa atom relatif 65,39. Ia merupakan unsur pertama golongan 12 pada tabel periodik. Beberapa sifat kimia seng mirip dengan magnesium (Mg). Hal ini dikarenakan ion kedua unsur ini berukuran hampir sama. Selain itu, keduanya juga memiliki keadaan oksidasi +2. Seng merupakan unsur paling melimpah ke-24 di kerak bumi dan memiliki lima isotop stabil. Bijih seng yang paling banyak ditambang adalah sfalerit (seng sulfida).
Kuningan, yang merupakan aloi tembaga dan seng, telah lama digunakan paling tidak sejak abad ke-10 SM. Logam seng tak murni mulai diproduksi secara besar-besaran pada abad ke-13 di India, manakala logam ini masih belum di kenal oleh bangsa Eropa sampai dengan akhir abad ke-16. Para alkimiawan membakar seng untuk menghasilkan apa yang mereka sebut sebagai "salju putih" ataupun "wol filsuf". Kimiawan Jerman Andreas Sigismund Marggraf umumnya dianggap sebagai penemu logam seng murni pada tahun 1746. Karya Luigi Galvani dan Alessandro Volta berhasil menyingkap sifat-sifat elektrokimia seng pada tahun 1800. Pelapisan seng pada baja untuk mencegah perkaratan merupakan aplikasi utama seng. Aplikasi-aplikasi lainnya meliputi penggunaannya pada baterai dan aloi. Terdapat berbagai jenis senyawa seng yang dapat ditemukan, seperti seng karbonat dan seng glukonat (suplemen makanan), seng klorida (pada deodoran), seng pirition (pada sampo anti ketombe), seng sulfida (pada cat berpendar), dan seng metil ataupun seng dietil di laboratorium organik.
Seng merupakan zat mineral esensial yang sangat penting bagi tubuh. Terdapat sekitar dua miliar orang di negara-negara berkembang yang kekurangan asupan seng. Defisiensi ini juga dapat menyebabkan banyak penyakit. Pada anak-anak, defisiensi ini menyebabkan gangguan pertumbuhan, memengaruhi pematangan seksual, mudah terkena infeksi, diare, dan setiap tahunnya menyebabkan kematian sekitar 800.000 anak-anak di seluruh dunia. Konsumsi seng yang berlebihan dapat menyebabkan ataksia, lemah lesu, dan defisiensi tembaga. Dalam bahasa sehari-hari, seng juga dimaksudkan sebagai pelat seng yang digunakan sebagai bahan bangunan. (Wikipedia, 2016)
a. Karakteristik Umum
Seng diambil dari bahasa Belanda yaitu zink adalah unsur kimia dengan lambang kimia Zn, nomor atom 30, dan massa atom relatif 65,39. Ia merupakan unsur pertama golongan 12 pada tabel periodik. Beberapa aspek kimiawi seng mirip dengan magnesium. Hal ini dikarenakan ion kedua unsur ini berukuran hampir sama. Selain itu, keduanya juga memiliki keadaan oksidasi +2. Seng merupakan unsur paling
melimpah ke-24 di kerak Bumi dan memiliki lima isotop stabil. Bijih seng yang paling banyak ditambang adalah sfalerit (seng sulfida).
b. Sifat Kimia
Reaktivitas seng memiliki konfigurasi elektron [Ar]3d104s2 dan merupakan unsur golongan 12 tabel periodik. Seng cukup reaktif dan merupakan reduktor kuat.. Permukaan logam seng murni akan dengan cepat mengusam, membentuk lapisan seng karbonat, Zn5(OH)6CO3, seketika berkontak dengan karbon dioksida. Lapisan ini membantu mencegah reaksi lebih lanjut dengan udara dan air.
Seng yang dibakar akan menghasilkan lidah api berwarna hijau kebiruan dan mengeluarkan asap seng oksida. Seng bereaksi dengan asam, basa, dan non-logam lainnya seng yang sangat murni hanya akan bereaksi secara lambat dengan asam pada suhu kamar. Asam kuat seperti asam klorida maupun asam sulfat dapat menghilangkan lapisan pelindung seng karbonat dan reaksi seng dengan air yang ada akan melepaskan gas hidrogen.
Seng secara umum memiliki keadaan oksidasi +2. Ketika senyawa dengan keadaan oksidasi +2 terbentuk, elektron pada kelopak elektron terluar seakan terlepas, dan ion seng yang terbentuk akan memiliki konfigurasi [Ar]3d10. Hal ini mengijinkan pembentukan empat ikatan kovalen dengan menerima empat pasangan elektron dan mematuhi kaidah oktet. Stereo kimia senyawa yang dibentuk ini adalah tetrahedral dan ikatan yang terbentuk dapat dikatakan sebagai sp3. Pada larutan akuatik, kompleks oktaherdal, [Zn(H2O)6]2+, merupakan spesi yang dominan.
Penguapan seng yang dikombinasikan dengan seng klorida pada temperatur di atas 285 °C mengindikasikan adanya Zn2Cl2 yang terbentuk, yakni senyawa seng yang berkeadaan oksidasi +1. Tiada senyawa seng berkeadaan oksidasi selain +1 dan +2 yang diketahui. Perhitungan teoritis mengindikasikan bahwa senyawa seng dengan keadaan oksidasi +4 sangatlah tidak memungkinkan terbentuk.
Sifat kimiawi seng mirip dengan logam-logam transisi periode pertama seperti nikel dan tembaga. Ia bersifat diamagnetik dan hampir tak berwarna. Jari-jari ion seng dan magnesium juga hampir identik. Oleh karenanya, garam kedua senyawa ini akan memiliki struktur kristal yang sama. Pada kasus di mana jari-jari ion merupakan faktor
penentu, sifat-sifat kimiawi keduanya akan sangat mirip. Seng cenderung membentuk ikatan kovalen berderajat tinggi. Ia juga akan membentuk senyawa kompleks dengan pendonor N- dan S-. Senyawa kompleks seng kebanyakan berkoordinasi 4 ataupun 6 walaupun koordinasi 5 juga diketahui ada (Sony, 2009).
c. Sifat Fisik
Seng merupakan logam yang berwarna putih kebiruan, berkilau, dan bersifat diamagnetik. Walau demikian, kebanyakan seng mutu komersial tidak berkilau. Seng sedikit kurang padat daripada besi dan berstruktur kristal heksagonal. Lehto 1968, p. 826 Logam ini keras dan rapuh pada kebanyakan suhu, namun menjadi dapat ditempa antara 100 sampai dengan 150 °C. Di atas 210 °C, logam ini kembali menjadi rapuh dan dapat dihancurkan menjadi bubuk dengan memukul-mukulnya. Seng juga mampu menghantarkan listrik. Dibandingkan dengan logam-logam lainnya, seng memiliki titik lebur (420 °C) dan tidik didih (900 °C) yang relatif rendah. Dan sebenarnya pun, titik lebur seng merupakan yang terendah di antara semua logam-logam transisi selain raksa dan kadmium.
Terdapat banyak sekali aloi yang mengandung seng. Salah satu contohnya adalah kuningan (aloi seng dan tembaga). Logam-logam lainnya yang juga diketahui dapat membentuk aloi dengan seng adalah aluminium, antimon, bismut, emas, besi, timbal, raksa, perak, timah, magnesium, kobalt, nikel, telurium, dan natrium. Walaupun seng maupun zirkonium tidak bersifat feromagnetik, alloy ZrZn2 memperlihatkan feromagnetisme di bawah suhu 35 K.
Tabel 2.1 Klasifikasi sifat zink (Sumber: Sony, 2009)
2.4 KOROSI
Korosi adalah teroksidasinya suatu logam. Korosi adalah kerusakan atau degradasi logam akibat reaksi dengan lingkungan yang korosif. Korosi dapat juga diartikan sebagai serangan yang merusak logam karena logam bereaksi secara kimia atau elektrokimia dengan lingkungan. Dalam kehidupan sehari - hari, besi yang teroksidasi disebut dengan karat (Hasannudin, 2015).
Faktor-faktor seperti temperature, kelembaban dan kandungan bahan kimia dalam udara sangat menentukan laju korosi (Fontana, 1986; Agung, 2004). Sementara itu, komposisi logam, struktur metalurgi, dan proses pembuatan logam juga mempercepat timbulnya korosi.
Gambar 2.2 Korosi atap rumah warga gunung sinabung
2.4.1 Jenis-jenis Korosi
Korosi memiliki berbagai macam bentuk. Setiap bentuk korosi memiliki karakteristik dan mekanisme yang berbeda-beda. Jenis-jenis korosi adalah sebagai berikut (Deky Martanto, 2014):
a. Korosi Merata (Uniform Corrosion)
Korosi merata adalah bentuk korosi yang pada umumnya sering terjadi. Hal ini biasanya ditandai dengan adanya reaksi kimia atau elektrokimia yang terjadi pada permukaan yang bereaksi. Logam menjadi tipis dan akhirnya terjadi kegagalan pada logam tersebut. Korosi merata dapat dilakukan pencegahan dengan cara pelapisan, inhibitor dan proteksi katodik.
b. Korosi Galvanik (Galvanic Corrosion)
Perbedaan potensial biasanya terjadi diantara dua logam yang berbeda, ketika keduanya di celupkan ke dalam larutan korosif. Ketika logam tersebut berkontak, dengan adanya perbedaan potensial akan menghasilkan aliran elektron. Elektron mengalir dari logam yang kurang mulia (anodik) menuju ke metal yang lebih mulia (katodik). Akibatnya metal yang kurang mulia berubah menjadi ionion positif karena kehilangan elektron. Ion-ion positif metal bereaksi dengan ionion negatif yang berada di dalam elektrolit menjadi garam metal. Karena peristiwa tersebut permukaan anoda kehilangan metal.
c. Korosi Celah (Crevice Corrosion)
Merupakan bentuk korosi dimana korosi terjadi ketika terdapat celah akibat penggabungan atau penyatuan dua logam yang sama memiliki kadar oksigen berbeda dengan area luarnya. Jenis korosi ini biasanya disebabkan oleh lubang yang kecil, dan celah-celah di bawah kepala baut dan paku keling.
d. Korosi Sumuran (Pitting Corrosion)
Korosi sumuran adalah bentuk serangan korosi yang sangat lokal (menyerang pada daerah tertentu saja) yang mengakibatkan lubang dalam logam. Lubang ini mungkin memiliki diameter yang kecil atau besar, namun dalam banyak kasus lubang tersebut relatif kecil. Korosi sumuran adalah salah satu bentuk korosi yang paling merusak dan berbahaya. Hal itu menyebabkan peralatan menjadi gagal karena dengan penurunan massa yang sedikit saja akibat adanya lubang, maka kegagalan dapat terjadi dengan mudah.
e. Korosi Erosi (Erosion Corrosion)
Korosi erosi adalah percepatan tingkat kerusakan atau serangan pada logam karena gerakan relatif antara cairan korosif dan permukaan logam. Umumnya gerakan ini cukup cepat, dan berkaitan dengan abrasi. Logam yang berada di permukaan akan berubah menjadi ion terlarut atau menjadi bentuk produk korosi yang padat. Bentuk
fisik dari korosi erosi ditandai dalam penampilan berupa alur, parit, gelombang, lubang bulat, lembah-lembah, dan biasanya menunjukan pola arah.
f. Korosi Tegangan (Stress Corrosion)
Gaya-gaya mekanis seperti tarikan atau kompresi berpengaruh sangat kecil pada proses pengkaratan pada bagian metal yang sama jika ditinjau dari laju pengkaratan dalam mils pertahun. Namun demikian apabila itu merupakan kombinasi antara tensile stress dan lingkungan yang korosif, maka kondisi ini merupakan salah satu dari penyebab utama kegagalan material. Kegagalan ini berupa retakan yang lazim disebut korosi tegangan.
2.4.2 Laju Korosi (Corrotion Rate)
Laju korosi adalah kecepatan rambatan atau kecepatan penurunan kualitas bahan terhadap waktu. Kecepatan korosi dapat dihitung dengan pertarnbahan berat persatuan waktu persatuan luas dapat juga dihitung dengan tebalnya oksidasi yang terbentuk persatuan waktu (Suhartanti, 2005). Sering pula penunjukkan korosi dibuat dengan grafik penambahan atau pengurangan berat sebagai fungsi dari waktu. Menurut (Agung, 2004) apabila data yang mempengaruhi tingkat korosivitas lingkungan atmosfir tidak tersedia maka dapat diprediksi dengan model matematik hubungan laju korosi dengan faktor iklim dan polutan. Cara menghitung laju korosi pada umumnya menggunakan 2 cara yaitu:
1. Metode Kehilangan Berat
Metode kehilangan berat adalah perhitungan laju korosi dengan mengukur kekurangan berat akibat korosi yang terjadi. Metode ini menggunakan jangka waktu penelitian hingga mendapatkan jumlah kehilangan akibat korosi yang terjadi (Furqon, 2013). 2. Metode Elektrokimia
Metode elektro kimia adalah metode mengukur laju korosi dengan mengukur beda potensial objek hingga di dapat laju korosi yang terjadi, metode ini mengukur laju korosi pada saat diukur saja dimana memperkirakan laju tersebut dengan waktu yang panjang (memperkirakan walau pun hasil yang terjadi antara satu waktu dengan waktu
lainya berbeda). Kelemahan metode ini adalah tidak dapat menggambarkan secara pasti laju korosi hanya pada waktu tertentu saja, hingga secara umur pemakaian maupun kondisi untuk dapat di treatmen tidak dapat diketahui. Kelebihan dari metode ini adalah kita bisa langsung mengetahui laju korosi pada saat di ukur, hingga waktu pengukuran tidak memakan waktu yang lama (Furqon, 2013) dan salah satu contoh alat dari metode elektro kimia sekaligus yang dipakai untuk penelitian ini adalah amperometri.
2.4.3 Dampak Korosi
Karatan (korosi) adalah istilah yang diberikan masyarakat terhadap logam yang mengalami kerusakan berbentuk keropos. Sedangkan bagian logam yang rusak dan berwarna hitam kecoklatan pada baja disebut Karat. Secara teoritis karat adalah istilah yang diberikan terhadap satu jenis logam saja yaitu seng, sedangkan secara umum istilah karat lebih tepat disebut korosi. Korosi didefenisikan sebagai degradasi material (khususnya logam dan paduannya) atau sifatnya akibat berinteraksi dengan lingkungannya. Korosi merupakan proses atau reaksi elektrokimia yang bersifat alamiah dan berlangsung dengan sendirinya, oleh karena itu korosi tidak dapat dicegah atau dihentikan sama sekali. Korosi hanya bisa dikendalikan atau diperlambat lajunya sehingga memperlambat proses perusakannya.
Dilihat dari aspek elektrokimia, korosi merupakan proses terjadinya transfer elektron dari logam ke lingkungannya. Logam berlaku sebagai sel yang memberikan elektron (anoda) dan lingkungannya sebagai penerima electron (katoda). Reaksi yang terjadi pada logam yang mengalami korosi adalah reaksi oksidasi, dimana atom-atom logam larut kelingkungannya menjadi ion-ion dengan melepaskan elektron pada logam tersebut. Sedangkan dari katoda terjadi reaksi, dimana ion-ion dari lingkungan mendekati logam dan menangkap elektron-elektron yang tertinggal pada logam. Dampak yang ditimbulkan korosi sungguh luar biasa ( Luffy, 2016).
Dengan mengetahui penyebab terjadinya suatu korosi pada material, dapat dilakukan beberapa perlakuan untuk mencegah berlangsungnya reaksi korosi tersebut. Namun dalam hal ini, peneliti melakukan perlakuan satu pengendalian korosi yang mudah dan murah yaitu dengan memberikan pelapis pada cat.
Pelapisan biasanya dimaksudkan untuk memberi suatu lapisan padat dan merata sebagai bahan isolator atau penghambat korosi berlebih dalam jangka waktu yang lama di seluruh permukaan seng yang dilindungi. Fungsi dari lapisan tersebut adalah untuk mencegah seng terkena dampak langsung dari adanya hujan asam (Sanjaya, 2012).
Inhibitor adalah suatu bahan kimia yang jika ditambahkan dalam jumlah yang kecil saja kepada lingkungan media yang korosif, akan menurunkan kecepatan korosi. Inhibitor bekerja menghambat laju korosi. Belum banyak diketahui bagaimana cara kerja inhibitor dalam menghambat korosi. Banyak macam dan rumusan atau resep-resep bahan inhibitor. Kebanyakan mereka ini ditemukan berdasarkan hasil pengamatan atau penelitian empiris saja tanpa diketahui mekanisme kerjanya. Walaupun demikian, inhibitor dapat diklasifikasikan berdasarkan mekanisme penghambatannya maupun berdasarkan sifat senyawanya.
Berdasarkan mekanisme penghambatannya, maka inhibitor dapat diklasifikasikan kedalam 3 (tiga) kategori :
1. Inhibitor anodik bekerja dengan membentuk lapisan pelindung yang pasif dipermukaan logam akibat reaksi logam dengan inhibitor tersebut (sama dengan reaksi korosi logam dengan inhibitor). Inhibitor semacam ini menaikkan potensial korosi bebas logam sampai dicapai potensial pasifasi. Efek inhibitor ini bergantung pada konsentrasi yang digunakan. Konsentrasi inhibitor dalam media harus dipertahankan pada level tertentu.
2. Inhibitor katodik pada suasana netral, bekerja dengan membentuk lapisan ataupun endapan pada permukaaan logam. Lapisan atau endapan tersebut akan menghambat akses oksigen kepermukaan logam, sehingga akan menghambat reaksi katodik. Inhibitor jenis ini menurunkan potensial korosi bebas logam. Agar efek inhibitor maksimal, diperlukan konsentrasi minimal yang harus ada
dalam media elektrolik. Beberapa inhibitor katodik malah menunjukkan efek negatif pada konsentrasi yang tinggi, sehingga konsentrasi inhibitor tidak boleh terlalu tinggi.
3. Inhibitor jenis campuran tidak memberikan efek perubahan potensial korosi bebas yang berarti pada logam. Kemungkinan inhibitor jenis ini bekerja dengan membentuk lapis pelindung yang berasal dari corrosion product dipermukaan logam dan sekaligus juga mengendapkan bahan yang lebih kompleks diatasnya.
Berdasarkan sifat senyawanya, inhibitor bisa dikategorikan sebagai tipe: 1. Organik
2. Anorganik,
3. Fasa uap atau volatil, 4. Adsorbsi,
5. Oksidator, dan lain-lain.
Inhibitor tipe organik biasanya adalah tipe mengendap pada situs anoda dan katoda sehingga menghambat berlangsungnya reaksi anodik dan katodik secara serentak. Dalam banyak kasus efeknya terhadap proses-proses anodik dan katodik tidak sama besar. Contoh jenis ini adalah senyawa amina organik.
Inhibitor tipe anorganik antara lain adalah ammonia dan nitrit. Ammonia digunakan untuk menetralisir pH di kondensor,sedangkan nitrit dipakai sebagai pengikat oksigen terlarut selain sodium sulfit dan hidrazin.
Inhibitor fasa uap atau yang volatil dapat diletakkan didekat logam yang akan diproteksi. Jenis inhibitor ini tidak perlu dikontakkan langsung dengan logam sasaran. Inhibitor akan tersublimasi di udara dan terkondensasi di permukaan logam yang dilindungi. Jenis inhibitor ini tidak cocok untuk ruang yang terbuka. Ia hanya efektif untuk ruang yang tertutup, misalnya dikontainer untuk mengangkut peralatan yang terbuat dari logam inhibitor akan memproteksi logam dalam perjalanan selama menuju lokasi pengiriman. Ia bisa digunakan untuk melindungi bagian internal alat yang tertutup.
Inhibitor tipe adsorpsi membentuk lapisan adsorpsi yang sampurna pada permukaan logam yang bersih dalam lingkungan sam ataupun lingkungan non aqueous. Inhibitor jenis ini juga ada yang membentuk lapisan adsorpsi yang non uniform pada permukaan logam yang tidak bersih, seperti permukaan baja karbon dalam air biasa. Contoh inhibitor tipe ini adalah amina dan surfaktan. Lapisan film terdiri dari rantai hidrokarbon dengan “kepala” menempel dipermukaan logam dan lapisan “ekor” di atasnya.
Inhibitor tipe oksidator adalah inhibitor yang bekerja berdasarkan pembentukan lapisan oksida logam yang protektif di permukaan logam. Inhibitor ini bekerja mula-mula dengan “memangsa logam” sehingga membentuk corrosion product berupa oksida logam. Selanjutnya lapisan oksida logam ini yang menahan ekspos logam ke lingkungan korosifnya, sehingga logam menjadi aman dari serangan korosif selanjutnya. Karena sifatnya yang mampu mempasifkan logam, ia disebut sebagai pasifator. Contoh inhibitor jenis ini adalah garam-garam nitrat, kromat, dan feri. Hanya logam-logam yang membentuk lapisan pasif saja yang memanfaatkan inhibitor jenis ini ( Just share, 2015 ).
2.6 PELAPISAN CAT
Cat (coating) atau lapis lindung adalah suatu material tipis yang diaplikasikan baik dalam bentuk cair atau serbuk, yang kemudian kering dan membentuk lapisan yang padat, kuat dan merata di seluruh permukaan seng. Untuk dapat melindungi seng terhadap korosi dalam jangka waktu yang panjang, lapisan harus memiliki sifat-sifat seperti fleksibilitas yang baik, tahan terhadap impak, tahan terhadap zat kimia, tahan terhadap penyerangan uap air, serta tahan terhadap dampak hujan asam dan lain sebagainya (Handoyo, 2000).
2.6.1 Cat dan Komponen-Komponennya
Pada umumnya cat merupakan suatu campuran antara partikel-partikel pigmen yang tersebar dalam media pengikat (resin) yang kemudian mengalami pengeringan karena oksidasi, polimerisasi atau penguapan. Untuk memperoleh hasil perlindungan yang
baik, cat harus mengandung pigmen anti korosi di dalam media pengikat yang sesuai dengan lingkungannya. Biasanya cat tidak hanya mengandung satu jenis komponen, tetapi mengandung campuran beberapa komponen. Komponen-komponen utama pada cat adalah:
1. Pigmen
Pigmen atau zat pewarna pada cat umumnya berbentuk padat (serbuk) yang berasal dari senyawa anorganik dan tersebar di dalam media pengikat cat (resin). Sebagai lapisan cat dasar, pigmen berfungsi untuk melindungi seng dari serangan korosi sedangkan pada cat akhir (lapisan akhir) pigmen berfungsi sebagai pewarna (dekoratif).
2. Resin (Binder)
Resin atau media pengikat merupakan komponen penting biasanya resin atau minyak tetapi bisa menjadi senyawa anorganik seperti silikat larut. Pengikat merupakan komponen pembentukan lapisan pada permukaan logam (Otsah, 2013 ) sehingga dapat mengurangi laju korosi pada logam. yang menentukan sifat-sifat fisik dan kimia cat, bahkan pembagian jenis cat dapat jug ditentukan oleh jenis resinnya. Komponen ini setelah mengalami pengeringan akan menjadi suatu lapisan yang kompak dan bersama pigmen yang tersebar di dalamnya akan terikat pada permukaan benda kerja. Resin (binder) dan pigmen ini akan menentukan sifat-sifat daya adhesi, elastisitas, tahan cuaca, tahan air, tahan senyawa kimia, dan lain-lain. Beberapa jenis resin yang umum dipakai antara lain resin alkyd, resin epoxy, resin nitro collulosa, kelebihan cat menggunakan resin alkyd, menurut hasil penelitian (Ezeagba, dkk, 2014) karna terbuat dari reaksi asam polybasic dan poly hidrat alcohol dengan penambahan minyak (Fatty acid) sifatnya memiliki tahan sinar matahari, tidak mudah retak dan tahan air, sehingga pilihan terbaik untuk dasar pembuatan cat. Berdasarkan hal tersebut, maka resin alkyd memiliki sifat lebih baik dibandingkan dengan cat epoxy resin dan nitro cellullosa.
3. Pelarut
Pelarut atau solvent ditambahkan pada cat terutama adalah untuk dapat mengatur kekentalan (viscosity) cat. Selain itu pelarut juga harus mampu mengatur waktu
pengeringan, kilap dan sebagainya. Pelarut ini tidak berperan dalam sifat-sifat yang dihasilkan cat, karena pelarut akan hilang saat proses pengeringan. Beberapa jenis pelarut adalah senyawa-senyawa hidrokarbon aromatik dan alifatik, mineral, alkohol, eter dan keton.
4. Additive
Additive adalah bahan yang paling jarang terdapat pada produk cat. Namun komponen cat ini memiliki fungsi amat vital. Additive biasanya bertanggung jawab pada kualitas tampilan hasil pengecatan. Tingkat glossy hingga kehalusan permukaan lapisan cat sangat dipengaruhi oleh additive yang digunakan (Inspirasi cat, 2015).
2.6.2 Sistem Pengecatan
Keberhasilan sistem perlindungan korosi dengan menggunakan metode pengecetan antara lain ditentukan dengan:
Cat kuas Cat spray Celup
Persiapan permukaan yang memadai Permukaan yang bersih
2.7 METODE KEHILANGAN BERAT
Metode kehilangan berat adalah perhitungan laju korosi dengan mengukur kekurangan berat akibat korosi yang terjadi. Metode ini menggunakan jangka waktu penelitian hingga mendapatkan jumlah kehilangan akibat korosi yang terjadi. Perhitungan laju korosi atas dasar kehilangan berat selama pengujian bisa dilihat seperti pada persamaan di bawah ini:
Keterangan:
CR = laju korosi (mpy) K = konstanta laju korosi W = massa yang hilang (mg) T = waktu perendaman (jam) A = luas permukaan specimen (in2) D = densitas spesimeng (g/cm3)
Satuan dari pada laju korosi adalah mpy (mil/tahun) dan mmpy (millimeter/tahun), apabila satuannya mpy, maka konstanta yang digunakan adalah K = 534 (dimana1 mil = 0.001 in) dan luar areanya menggunakan satuan inch. Untuk mmpy atau millimeter pertahun, satuan surface areanya menggunakan cm (centimeter) dan nilai konstantanya adalah K = 876 (Fontana, 1987). Metode ini meupakan cara untuk mengetahui corrosion rate (mpy) pada sampel uji. cara untuk mengetahui corrosion rate (mpy) juga dapat menggunakan alat elektrokimia. (Fontana, 1986)
2.8 METODE ELEKTROKIMIA
Metode elektrokimia adalah metode mengukur laju korosi dengan mengukur beda potensial objek hingga didapat laju korosi yang terjadi, metode ini mengukur laju korosi pada saat diukur saja dimana memperkirakan laju tersebut dengan waktu yang panjang (memperkirakan walaupun hasil yang terjadi antara satu waktu dengan
waktu lainya berbeda). Kelemahan metode ini adalah tidak dapat menggambarkan secara pasti laju korosi hanya pada waktu tertentu saja, hingga secara umur pemakaian maupun kondisi untuk dapat di treatmen tidak dapat diketahui. Kelebihan dari metode ini adalah kita bisa langsung mengetahui laju korosi pada saat di ukur, hingga waktu pengukuran tidak memakan waktu yang lama dan salah satu contoh alat dari metode elektrokimia sekaligus yang dipakai untuk penelitian ini adalah potensiostat.
2.8.1 Potensiostat
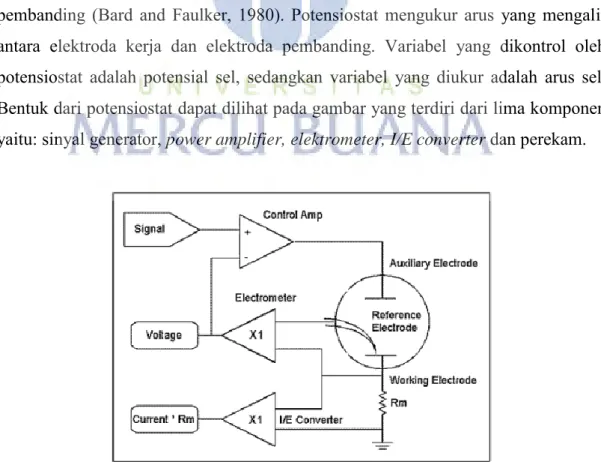
Potensiostat adalah Teknik elektrokimia untuk keperluan analisis kuantitatif instrumental membutuhkan pengetahuan dan alat-alat tambahan untuk pengolahan data . Hal ini berkenaan dengan kenyataan bahwa pembangkit sinyal analitik yang dihasilkan dalam komponen instrument memerlukan pengolahan agar dapat memberikan data yang mudah dibaca dan diolah untuk bahan informasi (Suharman dan Mulja, 1995). Potensiostat merupakan instrumen yang dapat digunakan untuk mengukur arus yang melewati pasangan elektroda kerja dan elektroda counter dan selalu menjaga keseimbangan beda potensial antara elektroda kerja dan elektroda pembanding (Bard and Faulker, 1980). Potensiostat mengukur arus yang mengalir antara elektroda kerja dan elektroda pembanding. Variabel yang dikontrol oleh potensiostat adalah potensial sel, sedangkan variabel yang diukur adalah arus sel. Bentuk dari potensiostat dapat dilihat pada gambar yang terdiri dari lima komponen yaitu: sinyal generator, power amplifier, elektrometer, I/E converter dan perekam.
a. Signal Generator (Pembangkit Sinyal) Pembangkit sinyal ini menghasilkan perbedaan potensial antara elektroda kerja dengan elektroda pembanding. Perbedaan potensial dibentuk dari potensial tunggal atau potensial yang dikontrol oleh komputer. Output digital ke analog (D/A) mengubah bilangan yang dihasilkan komputer kedalam potensial. Pemilihan yang tepat dari urutan bilangan memungkinkan computer menghasilkan potensial yang konstan, potensial yang linier dan gelombang sinus datar (sinusoidal). Bilangan dari eksitasi potensial menghasilkan variasi yang berbeda dari voltammetri.
b. Elektro meter rangkaian elektro meter mengukur beda potensial antara elektroda kerja dengan elektroda pembanding. Output memiliki dua fungsi yaitu feedback signal pada rangkaian potensiostat dan sinyal diukur sewaktu-waktu potensial sel dibutuhkan. Elektrometer yang ideal memiliki arus input nol dan memiliki impedansi input yang tidak terbatas.
c. The I/E conventer (pengubah arus kepotensial) Pengubah arus kepotensial merupakan rangkaian pengikut arus untuk mengukur arus sel dan menampilkan sebagai potensil. Potensial output, out diperoleh dari arussel X resistor feedback.
d. The Power Amplifier (Daya Amplifier) Daya amplifier atau pengontrol amplifier dari potensiostat berfungsi mengatur potensial pada elektroda–elektroda kerja untuk mencapai selisih yang tepat pada elektroda pembanding-elektroda kerja. Pengontrol amplifier membandingkan potensial sel yang diukur dengan potensial yang diharapkan dan mengendalikan arus yang masuk kedalam sel untuk memaksa potensialnya menjadi sama. Potensial yang diukur adalah input yang masuk kedalam input negative dari pengontrol amplifier. Perekam Data/ The Recorder Merupakan peralatan sederhana untuk menampilkan dan merekam potensiostat dalam bentuk chart recorder output atau volt meter digital.