PATOGENISITAS BAKTERI Vibrio harveyi YANG DIISOLASI DARI LOKASI BERBEDA
Ince Ayu Khairana Kadriah, Endang Susianingsih, dan Koko KurniawanBalai Penelitian dan Pengembangan Budidaya Air Payau Jl. Makmur Dg. Sitakka No. 129, Maros 90512, Sulawesi Selatan
E-mail: [email protected]
ABSTRAK
Penelitian dengan tujuan untuk mengetahui tingkat patogenisitas bakteri Vibrio harveyi yang diisolasi dari lokasi berbeda telah dilakukan di Laboratorium Basah Balai Penelitian dan Pengembangan Budidaya Air Payau (BPPBAP). Penelitian ini menggunakan rancangan acak lengkap (RAL) pola faktorial masing-masing dengan perlakuan: tiga isolat bakteri Vibrio harveyi yang diisolasi dari tiga lokasi yang berbeda yaitu dari Banyuwangi dengan kode isolat-1; dari Negara, Bali dengan kode isolat-2; dan dari Gondol, Bali dengan kode isolat-3. Hewan uji yang digunakan berupa post larva udang windu PL-14 yang ditempatkan dalam stoples volume 2 L dengan kepadatan 20 ekor/L. Konsentrasi bakteri yang dinfeksikan adalah 107 CFU/mL, 105 CFU/mL, dan 103 CFU/mL. Tingkat patogenisitas masing-masing isolat bakteri diketahui dengan melakukan pengamatan terhadap sintasan (SR) udang uji pada masing-masing perlakuan selama 6, 12, 18, 24, 36, 60, 84, dan 90 jam yang hasilnya dianalisis secara statistik. Hasil penelitian memperlihatkan: pada jam ke-6 bakteri dengan kode isolat-1 yang diisolasi dari Banyuwangi dengan kepadatan 107 CFU/mL memberikan tingkat patogenisitas yang tertinggi dan berbeda nyata pada taraf perlakuan 5% (P<0,05) dibandingkan dengan isolat-2, dan isolat-3, serta kontrol, sedangkan untuk jam ke–12 hingga jam ke-90 tidak ada perlakuan yang berbeda nyata dengan kontrol yang diberikan. Populasi bakteri yang diisolasi dari media air pemeliharaan cenderung mengalami penurunan selama pengamatan.
KATA KUNCI: patogenisitas, Vibrio harveyi, udang windu, lokasi berbeda PENDAHULUAN
Di antara beberapa bakteri patogen, spesies Vibrio sudah dikenal sebagai penyebab penyakit Vibriosis pada udang penaeid. Bakteri Vibrio adalah salah satu penyebab penyakit yang cukup banyak menyerang hewan budidaya seperti udang windu (Karunasagar et al., 1994), beberapa spesies ikan dan kekerangan (Austin, 2006) bahkan juga karang (Ben-Haim et al., 2003). Beberapa spesies Vibrio berpendar seperti Vibrio cholerae (biotype albensis), V. fischeri, V. harveyi, V. logei, V. splendidus, V. mediterranei (Farmer & Hickman-Brenner, 1992), V. orientalis (Yang et al., 1983), Photobacterium leiognathi dan P. Phosphoreum diketahui berhubungan erat dengan beberapa kejadian penyakit pada lingkungan pembenihan dan pembesaran hewan budidaya.
Penyakit yang cukup berbahaya ini diketahui menyerang baik larva Penaeus monodon yang dipelihara di hatcheri maupun yuwana udang yang dipelihara pada tambak-tambak pembesaran serta udang dewasa (Lavilla-Pitogo et al., 1998). Pada umumnya penyakit Vibriosis disebabkan oleh V. anguillarum, V. alginolyticus, V. parahaemolyticus, V. harveyi, V. penaeicida, & V. campbellii. Agen bakteri Vibrio ini dapat menjadi penyebab penyakit yang utama dan pertama ditandai dengan meningkatnya populasi bakteri Vibrio pada air tambak (Vandenberghe et al., 2003; Saulnier et al., 2000a). Salah satu spesies dari genus Vibrio tersebut yang kemudian diketahui mendominasi penyebab penyakit Vibriosis tersebut adalah Vibrio harveyi.
Vibrio harveyi merupakan bakteri yang membutuhkan sodium klorida untuk hidupnya, berbentuk curve-rod dan termasuk dalam kelompok bakteri gram negatif yang banyak ditemukan pada lingkungan perairan (Farmer et al., 2005), serta dapat memendarkan cahaya sendiri pada kondisi tertentu. Spesies bakteri ini terdistribusi secara luas pada lingkungan akuatik dan diketahui menjadi penyebab utama penyakit kunang-kunang pada organisme laut maupun payau. Selain sebagai penyebab utama, sering kali juga bertindak sebagai agen oportunistik pada infeksi sekunder (Saulnier et al., 2000b).
Berdasarkan hal tersebut, patogenisitas Vibrio harveyi utamanya yang diisolasi dari udang windu dari lokasi budidaya berbeda perlu dikaji. Hal ini ke depannya diharapkan dapat dijadikan acuan untuk upaya pencegahan penyakit Vibriosis.
BAHAN DAN METODE
Penelitian ini terdiri atas tiga tahap:
1. Pembuatan bakteri resisten dari masing-masing isolat
2. Uji pertumbuhan bakteri resisten masing-masing isolat bakteri 3. Uji patogenisitas masing-masing isolat bakteri
Pembuatan Bakteri Resisten Rifampicin
Pembuatan resisten dari masing-masing isolat dimaksudkan untuk merubah sifat bakteri tersebut dari sensitif terhadap suatu antibiotik menjadi resisten. Hal ini bertujuan untuk memberikan penanda pada bakteri agar mudah dikenali pada saat isolasi ulang bakteri tersebut pada prosedur postulat Koch.
Proses pembuatan resisten tersebut dilakukan dengan cara:
Isolat bakteri yang akan diuji (isolat 1, 2, dan 3) masing-masing diinokulasi ke dalam media tumbuh nutrient broth (NB), yang dibuat dengan cara melarutkan sebanyak 8 g NB ke dalam 1 L aquades steril dan diberi penambahan NaCl sebanyak 1,5%; dihomogenkan dan kemudian dibagi ke dalam 6 tabung reaksi masing-masing sebanyak 10 mL. Sterilisasi terhadap media tersebut dilakukan dengan menggunakan autoclave pada suhu 121°C tekanan 1 atm selama 15 menit. Setelah steril dan suhunya telah sesuai dengan suhu ruang, inokulasi masing-masing bakteri uji dilakukan dengan memasukkan sebanyak 1 ose bakteri ke dalam media NB tersebut. Penumbuhan dan homogenisasi dilakukan menggunakan shaker pada 150 rpm selama 4 jam.
Setelah 4 jam (penentuan 4 jam berdasarkan uji tumbuh yang dilakukan pada isolat bakteri yang
WT/wild type) bakteri tersebut ditanam (diinokulasi) ke dalam media TCBS (Thiosulfat Ctrate Bile Sucrose Agar). Media TCBSA dibuat dengan cara menimbang sebanyak 89 g TCBSA dan dilarutkan ke dalam 1.000 mL aquades steril. Larutan ini kemudian dimasak hingga mendidih dan disterilkan menggunakan autoclave. Setelah steril dan suhunya telah sesuai dengan suhu ruang kemudian dituang ke plate (petri dish) steril masing-masing sebanyak 20 mL/plate. Inokulasi bakteri pada media TCBSA dilakukan dengan cara mengambil sebanyak 100 mikron (0,1 mL) biakan bakteri dalam NB dan disebarkan secara merata ke media TCBSA tersebut.
Untuk mengetahui sensitivitas bakteri terhadap antibiotik rifampicin, maka dilakukan uji hambatan menggunakan rifampisin 5, 10, 50, dan 100 mg/L, dengan cara merendam papper disk ke dalam masing-masing konsentrasi rimfampisin kemudian diletakkan (ditempatkan) pada media TCBSA sesuai penomoran yang telah diberikan (Gambar 1). Sebelumnya dilakukan penanaman bakteri Vibrio dengan metode sebar pada media TCBS yang akan dijadikan media uji hambat.
Gambar 1. Penempatan papper disk yang telah mengalami perendaman rifampisin pada konsentrasi 50 dan 100 mg/L
Uji resistensi bakteri Vibrio sp. dilakukan dengan menanambiakan bakteri yang telah dipadatkan melalui proses sentrifugasi pada media TCBS yang telah ditambahkan antibiotik rifampicin 50 dan 100 mg/L. Koloni bakteri Vibrio sp. yang berhasil tumbuh pada media TCBSA + Rif 50 mg/L selanjutnya ditumbuhkan lagi pada media TCBSA + Rif 100 mg/L. Koloni bakteri yang tumbuh pada media TCBSA + Rif 100 mg/L selanjutnya diisolasi dan merupakan isolat bakteri Vibrio sp. resisten rifampicin.
Setelah bakteri resisten terhadap rifampisin diperoleh maka selanjutnya dilakukan uji tumbuh untuk masing-masing isolat bakteri tersebut.
Uji Pertumbuhan Masing-Masing Isolat Bakteri Resisten Rifampicin
Uji tumbuh ini dimaksudkan untuk melihat kemampuan tumbuh dari masing-masing isolat sehingga dapat diketahui pada saat kapan bakteri tersebut berada pada puncak pertumbuhannya.
Uji tumbuh dilakukan dengan cara menginokulasi bakteri uji ke dalam media tumbuh NB yang kemudian dihomogenkan dengan menggunakan inkubator bergoyang secara terus-menerus pada kecepatan 150 rpm. Pengamatan pertumbuhan dilakukan dengan cara menginokulasi bakteri pada media NB ke dalam media TCBSA yang telah diberi penambahan rifampisin masing-masing pada konsentrasi 50 dan 100 mg/L. Pengambilan sampel untuk pengamatan pertumbuhan dilakukan dengan interval setiap 2 jam selama 24 jam. Sampel bakteri yang diinokulasi pada media TCBSA penanamannya dilakukan dengan menggunakan larutan fisiologis saline solutin (0,85% NaCl) secara berseri (pengenceran) mengikuti prosedur penanaman bakteri (Austin, 1993). Bakteri-bakteri yang telah ditanam pada media TCBSA tersebut pertumbuhannya kemudian dihitung setelah diinkubasi selama 24 jam untuk setiap waktu pengamatan. Penghitungan dilakukan dengan cara menghitung setiap koloni bakteri yang tumbuh pada setiap pengenceran yang diberikan berdasarkan rumus:
Uji Patogenisitas Masing-Masing Isolat Bakteri
Uji patogenisitas dimaksudkan untuk mengetahui patogenisitas masing-masing isolat tersebut terhadap benur udang windu. Uji ini dilakukan dengan metode perendaman (Hameed, 1995) menggunakan tiga isolat dari tiga lokasi yang berbeda: isolat Banyuwangi dengan kode isolat-1; dari Negara, Bali dengan kode isolat-2; dan dari Gondol, Bali dengan kode isolat-3, dengan tiga konsentrasi 107 CFU/mL, 105 CFU/mL, dan 103 CFU/mL, dan kontrol (tanpa pemberian bakteri) yang masing-masing diulang sebanyak tiga kali. Benur yang digunakan benur udang windu PL-14 yang diinfeksi dengan teknik perendaman. Pengamatan sintasan dan pengambilan sampel bakteri pada media pemeliharaan dilakukan dengan interval waktu 6 jam pada 12 jam pertama, 24 jam, 36 jam, 84 jam, dan 90 jam. Penanaman sampel dilakukan pada media TCBSA yang telah diberi rifampisin 100 mg/L dan penghitungan koloni bakteri dilakukan 24 jam setelah inkubasi.
Rancangan Penelitian
Penelitian ini menggunakan rancangan acak lengkap pola faktorial dengan perlakuan tiga jenis isolat bakteri, tiga konsentrasi bakteri, dan kontrol yang masing-masing diulang sebanyak tiga kali.
Gambar 3. Proses infeksi pada uji patogenisitas
Data sintasan dianalisis secara statistik menggunakan ANOVA dengan uji lanjut jika terdapat perbedaan di antara perlakuan yang dicobakan. Sedangkan data populasi bakteri dianalisis secara deskriptif sebagai bahan pembanding.
HASIL DAN BAHASAN
Pembuatan Resisten dari Masing-Masing Isolat Bakteri Uji
Hasil pembuatan resisten terhadap isolat-isolat bakteri yang akan digunakan menunjukkan bahwa semua isolat tersebut resisten terhadap rifampisin baik pada konsentrasi 50 maupun 100 mg/L. Hal ini ditandai dengan adanya zona hambatan yang ditimbulkan oleh bakteri akibat pemberian antibiotik rifampisin. Untuk selanjutnya rifampisin yang digunakan pada konsentrasi 100 mg/L. Hal ini dikarenakan rifampisin yang digunakan adalah rifampisin dengan dosis 600 mg/tablet. Di samping metode uji hambat dengan paper dish, dilakukan juga uji resisten dengan metode sebar.
Isolat Banyuwangi Isolat Negara Isolat Gondol
Gambar 4. Hasil uji hambat dengan menggunakan paper dish
Rif 100 ppm Rif 50 ppm Kontrol
Gambar 5. Hasil uji bakteri resistensi asal Banyuwangi
Rif 100 ppm Rif 50 ppm Kontrol
Uji Pertumbuhan Masing-Masing Isolat Bakteri Resisten Rifampicin
Hasil uji pertumbuhan untuk masing-masing isolat dengan interval waktu pengamatan setiap dua jam pada media NB (Nutrien Broth) dapat dilihat pada Gambar 8.
Dari Gambar 8 terlihat bahwa untuk isolat 1 dan 2 puncak pertumbuhannya diperoleh pada jam ke-4 kemudian mengalami penurunan, sedangkan isolat-3 mengalami puncak pertumbuhan pada jam ke-6.
Uji Patogenisitas Masing-Masing Isolat Bakteri Uji
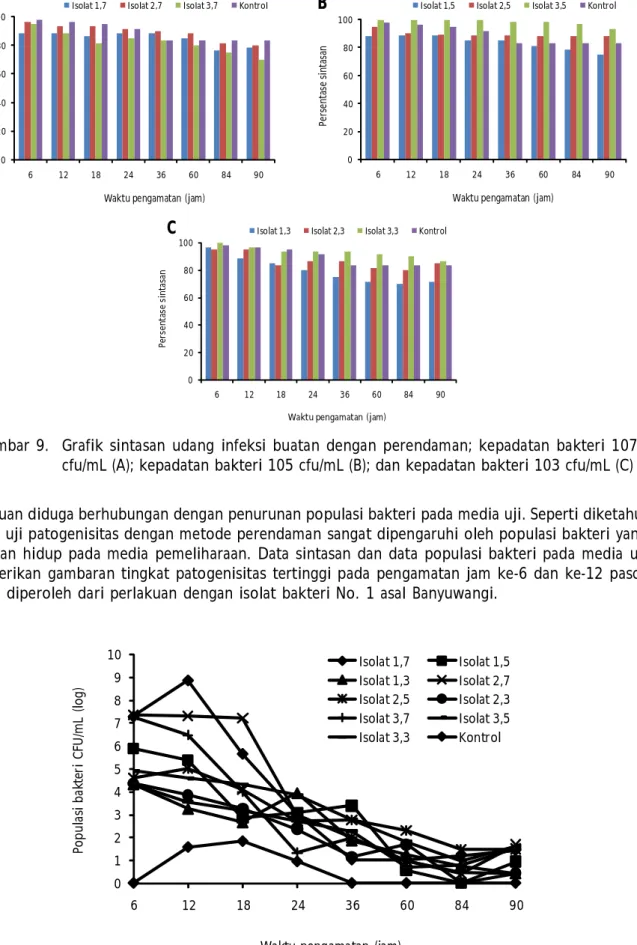
Pada pengamatan enam jam pertama dapat terlihat sintasan terendah pada perlakuan 1,7 dan 1,5. Hasil yang hampir sama juga terlihat pada pengamatan 12 jam setelah infeksi. Secara statistik dapat dibuktikan bahwa perlakuan dengan isolate-1 (konsentrasi 107 dan 105 CFU/mL) berbeda nyata dengan kontrol dan perlakuan lainnya pada pengamatan 6 jam pertama setelah infeksi. Namun pada pengamatan selanjutnya tidak terdapat perbedaan yang signifikan pada sintasan benur udang antara perlakuan dengan kontrol.
Hal ini dapat dijelaskan dengan melihat data populasi bakteri yang diisolasi dari media uji. Populasi bakteri tertinggi pada pengamatan 6 dan 12 jam setelah infeksi diperoleh dari perlakuan isolate-1 dengan konsentrasi 107 CFU/mL. Secara umum populasi bakteri terlihat menurun setelah 6 jam pasca infeksi pada semua perlakuan. Menurunnya tingkat patogenisitas bakteri setelah 12 jam
Gambar 7. Hasil uji resistensi bakteri asal Gondol, Bali
Rif 100 ppm Rif 50 ppm Kontrol
Gambar 8. Grafik pertumbuhan isolat bakteri dalam media NB
0 1 2 3 4 5 6 7 8 9 10 2 4 6 8 10 12 14 16 18 20 22 24 Po pu la si b ak te ri (l o g C F /m L)
Waktu pengamatan (interval waktu 2 jam)
perlakuan diduga berhubungan dengan penurunan populasi bakteri pada media uji. Seperti diketahui bahwa uji patogenisitas dengan metode perendaman sangat dipengaruhi oleh populasi bakteri yang bertahan hidup pada media pemeliharaan. Data sintasan dan data populasi bakteri pada media uji memberikan gambaran tingkat patogenisitas tertinggi pada pengamatan jam ke-6 dan ke-12 pasca infeksi diperoleh dari perlakuan dengan isolat bakteri No. 1 asal Banyuwangi.
0 20 40 60 80 100 6 12 18 24 36 60 84 90 P e rs e n ta se s in ta sa n
Waktu pengamatan (jam)
Isolat 1,7 Isolat 2,7 Isolat 3,7 Kontrol
0 20 40 60 80 100 6 12 18 24 36 60 84 90 P e rs e n ta se s in ta sa n
Waktu pengamatan (jam)
Isolat 1,5 Isolat 2,5 Isolat 3,5 Kontrol
0 20 40 60 80 100 6 12 18 24 36 60 84 90 Per sen ta se si nta sa n
Waktu pengamatan (jam)
Isolat 1,3 Isolat 2,3 Isolat 3,3 Kontrol
A
B
Gambar 9. Grafik sintasan udang infeksi buatan dengan perendaman; kepadatan bakteri 107 cfu/mL (A); kepadatan bakteri 105 cfu/mL (B); dan kepadatan bakteri 103 cfu/mL (C)
C
Gambar 10. Kurva pertumbuhan bakteri pada air media pemeliharaan udang 0 1 2 3 4 5 6 7 8 9 10 6 12 18 24 36 60 84 90 Po p u la si b ak te ri C FU /m L (lo g )
Waktu pengamatan (jam)
Isolat 1,7 Isolat 1,5
Isolat 1,3 Isolat 2,7
Isolat 2,5 Isolat 2,3
Isolat 3,7 Isolat 3,5
KESIMPULAN
Berdasarkan hasil pengamatan pertumbuhan bakteri pada media NB diketahui bahwa puncak pertumbuhan terjadi pada jam ke-4 dan ke-6. Dari tiga isolat yang diuji patogenisitasnya diketahui bahwa isolate-1 asal Banyuwangi memiliki tingkat patogenisitas lebih tinggi dibandingkan dua isolat lainnya.
DAFTAR ACUAN
Austin, B. & Zhang, X.-H. 2006. Vibrio harveyi: a significant pathogen of marine vertebrates and invertebrates. Lett. Appl. Microbiol., 43: 119-124.
Ben Haim, Y., Thompson, F.L., Thompson, C.C., Cnockaert, M.C., Hoste, B., Swings, J., & Rosenberg, E. 2003. Vibrio coralliilyticus sp. nov., a temperature-dependent pathogen of the coral Pocillopora damicornis. Int. J. Syst. Evol. Microbiol., 53: 309–315.
Farmer, J.J. & Hickman-Brenner, F.W. 1992. The genera Vibrio and Photobacterium. In The Prokaryotes – a Handbook on the Biology of Bacteria: Ecophysiology, Isolation, Identification, Applications. Edited by A. Balows. New York. Springer, p. 2,952–3,011.
Hameed, A.S.S. 1995. Susceptibility of three Penaeus sp. to a Vibrio campbelli-like bacterium. J. World Aqua. Soc., 26(3): 315-319.
Lavilla-Pitogo, C.R., Leano, E.M., & Paner, M.G. 1998. Mortalities of pond-cultured juvenile shrimp, Penaeus monodon, associated with dominance of luminescent Vibrios in the rearing environment. Aquaculture, 164: 337–349.
Saulnier, D., Haffner, P., Goarant, C., Levy, P., & Ansquer, D. 2000a. Experimental infection models for shrimp Vibriosis studies: a review. Aquaculture, 191: 133–144.
Saulnier, D., Avarre, J.C., Le Moullac, G., Ansquer, D., Levy, P., & Vonau, V. 2000b. Rapid and sensitive PCR detection of Vibrio penaeicida, the putative etiological agent of Syndrome 93 in New Caledonia. Dis. Aquat. Org., 40: 109–115.
Vandenberghe, J., Thompson, F.L., Gomez-Gil, B., & Swings, J. 2003. Phenotypic diversity among Vibrio isolats from marine aquaculture systems. Aquaculture, 219: 9–20.
Yang, Y.K., Yeh, L.P., Cao, Y.H., Baumann, L., Baumann, P., Tang, J.E. & Beaman, B. 1983. Characterization of marine luminous bacteria isolatd off the coast of China and description of Vibrio orientalis sp. nov. Curr Microbiol., 8: 95–100. http://mic.sgmjournals.org 1777 Molecular identification of V. harveyi-related isolats.