II. TINJAUAN PUSTAKA
Botani Tanaman Jahe (Zingiber officinale Rosc)
Deskripsi tanaman jahe (Zingiber officinale Rosc.) menurut Lawrence (1951) dan Jansen (1981) dapat diklasifikasikan sebagai berikut :
Kingdom : Plantae
Divisi : Angiospermae
Kelas : Monokotiledoneae
Bangsa : Zingiberales
Suku : Zingiberaceae
Sub suku : Zingiberoideae
Marga : Zingiber
Jenis : Zingiber officinale Rosc.
Jahe merupakan tanaman herba tahunan yang tumbuh pada lahan dataran rendah sampai menengah (300 - 900 m dpl). Di Indonesia dikenal tiga jenis jahe yaitu ; Jahe putih besar, jahe putih kecil dan jahe merah. Jahe putih besar mempunyai rimpang yang tumbuh bergerombol pada pangkal batangnya, berdaging dan berukuran tebal serta bercabang tidak beraturan tetap secara normal hanya pada arah vertikal. Ukuran panjang dan lebar rimpang berkisar antara 15,83 - 32,75 cm dan 6,20 - 11,30 cm. Jahe putih besar mempunyai aroma dan rasanya kurang tajam dibandingkan jenis yang lainnya. Jahe putih kecil ukuran rimpangnya relatif lebih kecil 6,13 - 31,70 cm dan 6,38 - 11,10 cm sedangkan jehe merah 12,33 - 12,60 dan 5,26 - 10,40 cm (Rostiana et al. 1991). Dari ketiga jenis jahe tersebut jahe putih besar lebih banyak dibudidayakan karena lebih menguntungkan dibandingkan jenis lainnya.
Tanaman jahe mempunyai batang semu (pseudostems) yang berbentuk bulat (teres). Tinggi tanamaan ini rata-rata 68,63 ± 12,5 cm, tegak, tidak bercabang, berwarna hijau muda, sering kemerahan pada bagian dasar. Setiap batang umumnya terdiri atas 8 - 12 helai daun (Rostiana et al. 1991 ; Jansen 1981). Keragaan tanaman dan rimpang jahe diperlihatkan pada Gambar 2.
Gambar 2. Keragaan Tanaman Jahe (Zingiber officinale Rosc). A. Tanaman Jahe
umur 6 bulan B. Rimpang Jahe
Akar jahe berbentuk bulat, ramping, dan berserat. Panjang akar jahe 12,93 - 21,52 cm dengan diameter 4,5 - 6,3 mm, berwarna putih sampai kecoklatan. Akar jahe keluar dari garis lingkaran sisik rimpang (Rostiana et al. 1991). Jahe mempunyai jumlah kromosom 2n = 22 (Ajijah et al. 1997).
Daun tanaman jahe terdiri atas upih dan helaian. Upih daun melekat membungkus batang dengan helaian daun yang tersusun berseling (folia disticha). Pada setiap buku terdapat dua daun. Helaian daun tipis, berbentuk bagun garis (linearis) sampai lanset (lanceolatus), berwarna hijau gelap pada bagian atas dan lebih pucat pada bagian bawah, panjang berkisar antar 5 - 25 cm dan lebar berkisar antara 1 - 3 cm. Tulang (urat) daun tampak jelas bersusun sejajar, pada bagian permukaan atas terdapat bulu- bulu putih. Ujung daun meruncing (acumilatus) dan tumpul (obtusus) dan membulat (rounded/rotundus) pada bagian pangkal (Ajijah et al. 1997).
Bunga jahe jarang terlihat, tetapi pada beberapa pertanaman jahe bunga mekar pada siang hari sekitar jam 1300 - 1600 WIB, kemudian gugur keesokan harinya (Bermawie & Martono 1994). Bunga muncul langsung dari rimpangnya, tersusun dalam rangkaian bulir berbentuk seperti jagung. Setiap bunga dilindungi oleh daun pelindung berwarna hijau, berbentuk bulat telur atau jorong (elliptic). Pada setiap daun pelindung terdapat satu bunga yang muncul pada bagian tengah (Purseglove et al. 1981).
Tanaman jahe sangat jarang dapat membentuk buah. Hal ini karena kesuburan serbuk sari yang rendah dan adanya faktor inkompatibilitas sendiri. Fertilitas polen jahe sangat rendah (< 30%), karena stuktur bunga yang memiliki bulu sehingga tepung sari sulit untuk menempel dan berkecambah pada kepala putik. Inkompatibilitas adalah fenomena yang terjadi pada tanaman normal dimana polen dan ovulnya fertil tidak dapat menghasilkan biji karena faktor ketidaksesuaian dari cara berpasangan gen atau adanya reaksi penolakan antara gen yang sama yang diekspresikan di dalam pollen dan stigma yang menghambat pembuahan. Sistem inkompatibilitas ada dua yaitu; sporophytik dan gametophytik. Inkompatibilitas sporophytik dibagi lagi atas dua bagian ; heteromorphik dan homomorphik. Sistem inkompatibilitas homomorphik adalah jika bentuk atau stuktur bunga, stigma atau anter tanaman sama. Sedangkan sistem inkompatibilitas heteromorphik jika tanaman mempunyai bentuk atau stuktur bunga, stigma atau anter yang berbeda. Pada jahe inkompatibilitas terjadi secara sporophytik heteromorofik karena kepala putik berada di atas kepala sari sehingga peluang untuk terjadinya penyerbukan sendiri sangat kecil (Syahid & Rostiana 2007 ; Roy 2000 ; Berwawie & Martono 1994).
Kultur in vitro Jahe (Zingiber officinale Rosc.)
Kultur in vitro tanaman merupakan tehnik untuk menumbuhkan organ, jaringan, dan sel tanaman. Jaringan dapat dikulturkan pada medium padat, semi padat, maupun cair. Beberapa peneliti menyatakan bahwa kultur in vitro adalah suatu metode mengisolasi bagian tanaman seperti protoplas, sel, jaringan atau organ, serta menumbuhkannya dalam kondisi aseptik, sehinggga bagian-bagian tanaman tersebut dapat tumbuh dan memperbanyak diri serta beregenerasi menjadi tanaman lengkap (Gunawan, 1992).
Kelebihan menggunakan tehnik kultur in vitro antara lain; Tanaman dapat diperbanyak setiap saat tanpa tergantung musim, daya multifikasinya tinggi, tanaman yang dihasilkan lebih seragam, dan bebas penyakit (bakteri, cendawan, dan virus), memproduksi senyawa metabolit sekunder, perbaikan tanaman dan plasma nutfah tanaman (pemuliaan tanaman) (Wattimena et al. 1922).
Perbanyakan tanaman jahe umumnya dilakukan secara vegetatif, yaitu dengan menggunakan rimpang berukuran 2,5 - 5 cm, dengan bobot 25 - 60 gram. Perbanyakan vegetatif pada tanaman jahe menyebabkan keragaman genetik jahe sangat rendah. Pengembangan tanaman jahe diarahkan untuk mendapatkan rimpang yang besar, berwarna cerah, aroma kurang tajam, sedikit serat dan tahan terhadap hama serta penyakit (Rostiana et al. 2004).
Penyediaan benih melalui kultur in vitro dapat dilakukan baik melalui induksi tunas langsung maupun fase kalus dengan menggunakan sumber eksplan vegetatif (Mariska & Syahid 1992), tetapi menghasilkan tanaman baru yang berimpang kecil bahkan pada tanaman generasi kedua (Syahid & Hobir 1996). Hal ini diduga telah terjadi perubahan genetik selama proses inisiasi dan regenerasi tanaman secara in vitro, atau terjadi perubahan epigenetik yang disebabkan oleh tekanan fisiologis akibat kondisi kultur yang bersifat sementara. Oleh karena itu, untuk mengeliminasi perubahan genetik selama proses in vitro, perlu memperhatikan sumber eksplan dan tingkat ploidi dari tanaman yang akan digunakan, serta model regenerasi tanaman (Chowdhury et al. 1994; Karp 1985; 1991; Peschke & Phillips 1992; Veilleux & Johnson 1998).
Regenerasi tanaman melalui kultur in vitro dapat dilakukan melalui 2 jalur, yaitu jalur organogenesis dan jalur embriogenesis somatik. Untuk produksi bibit melalui kultur jaringan, pembentukan benih somatik dari embrio somatik dapat menghasilkan bibit yang jauh lebih banyak dari pada hasil regenerasi melalui organogenesis. Di samping itu, dalam perbaikan tanaman melalui kultur in vitro, regenerasi melalui jalur embriogenesis somatik lebih disukai karena dapat berasal dari satu sel sehingga kepastian hasil perbaikan sifat genetik lebih tinggi. Secara umum dinyatakan bahwa tanaman yang dihasilkan melalui proses embriogenesis somatik merupakan klon yang identik dengan induknya (Evans & Sharp 1986; Jimenez 2001), meskipun beberapa perbedaan akan ditemukan tergantung dari jenis tanamannya.
Keberhasilan menginduksi embriogenesis somatik dipengaruhi oleh banyak faktor, antara lain sumber eksplan, jenis tanaman, formulasi media tumbuh, dan
lingkungan tumbuh. Jaringan meristematik seperti mata tunas, antera/polen dan epi/hipokotil memberikan tingkat keberhasilan lebih tinggi untuk pembentukan sel-sel embriogenik (Mariska 1997). Di samping itu, penggunaan eksplan meristem dapat mengurangi jumlah kultur yang terkontaminasi dan memberikan peluang untuk mendapatkan tanaman normal yang lebih tinggi (Sherwood, 1964).
Meristem merupakan jaringan yang bersifat embrionik dalam tanaman dan merupakan asal dari jaringan permanen. Jaringan meristem apikal dan akar berdiameter sekitar 0,1 mm dengan panjang sekitar 0,25 mm. Jaringan tersebut tersusun dari sel - sel yang membelah secara aktif dan tidak berdifferensiasi, serta tidak mempunyai sistem vaskula (Slack and Tufford 1995).
Penggunaan sumber eksplan daun aseptik, antera dan meristem dari jahe putih besar var. Cimanggu-1, menunjukkan bahwa eksplan asal meristem memberikan potensi regenerasi lebih baik dari daun aseptik dan antera pada media tumbuh yang diaplikasikan untuk menginduksi embriogenesis somatik (Syahid & Rostiana 2007 ; Rostiana et al. 2002). Peluang untuk memperoleh ukuran rimpang normal melalui sistem regenerasi ini cukup tinggi (Rostiana & Syahid 2008), sehingga metode tersebut potensial untuk dikembangkan guna memperoleh benih jahe sehat bebas penyakit serta diaplikasikan untuk memperoleh varietas jahe tahan penyakit melalui seleksi in vitro dan transformasi gen (rekayasa genetik).
Menurut Gray (2005), ada beberapa hal yang perlu diperhatikan dalam menginduksi sel menjadi sel embriogenik, di antaranya adalah ; mengatur konsentrasi zat pengatur tumbuh khususnya auksin dan sitokinin, mengatur nisbah dari N tereduksi dan N teroksidasi, mengatur konsentrasi sumber energi, dan mengatur konsentrasi asam amino.
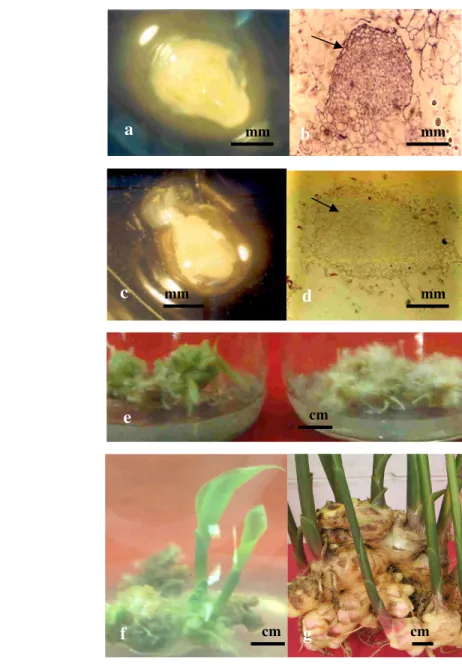
Proses embriogenesis somatik pada jahe berlangsung melalui beberapa tahapan, yaitu ; induksi kalus embriogenik, proliferasi, pendewasaan, regenerasi dan pertumbuhan planlet (Gambar 3) (Rostiana & Syahid 2008).
Gambar 3.Proses pertumbuhan embriogenesis somatik kultur meristem jahe.
a. Bentuk embrio globular jahe (4 minggu setelah disubkultur ke media proliferasi). b. Sayatan embrio globular (2 minggu di media proliferasi) Tanda panah memperlihatkan lapisan protroderm mulai berdeferensiasi. c. Bentuk embrio torpedo jahe (18 hari setelah disubkultur ke media pendewasaan). d. Sayatan embrio tropedo (18 hari setelah disubkultur ke media pendewasaan embrio). Tanda panah memperlihatkan deferensiasi procambium. e. Perkecambahan embrio somatik pada media MS + BA 1
mgl-1 (kiri) dan pertumbuhan akar embrio somatik pada media MS
(kanan), 30 hari setelah sub kultur (skala 1 : 1,4). f. Planlet jahe, 8 minggu setelah disubkultur ke media MS (skala 1: 1,3). g. Tanaman jahe asal kultur meristem menghasilkan rimpang berukuran normal (Rostiana & Syahid 2008). a b c d e f g mm mm mm mm cm cm cm
Induksi Keragaman Somaklonal
Keragaman somaklonal didefenisikan sebagai keragaman dari tanaman yang dihasilkan oleh sel somatik tanaman yang ditumbuhkan secara in vitro (Larkin & Scrowcrot 1981). Keragaman somaklonal merupakan fenomena umum dalam sistem perbanyakan tanaman, yang melibatkan fase pembentukan kalus.
Media kultur jaringan dapat menginduksi perubahan genetik karena pada kondisi in vitro terjadi pembelahan sel sangat cepat sehingga memungkinkan terjadinya kesalahan pada pembelahan mitosis. Induksi mutasi sangat mungkin terjadi karena perbanyakan secara vegetatif melalui kultur in vitro sebagai akibat penggunaan bahan kimia atau lingkungan terkendali yang berlangsung secara terus menerus. Terjadinya perubahan ini justru memberi keuntungan kerena meningkatkan keragaman sifat yang disebut variasi somaklonal (Larkin & Scrowcrot 1981 ; Wattimena et al. 1992)
Keragaman somaklonal dapat berasal dari keragaman genetik yang telah ada sebelumnya (pre-existing) pada eksplan dan keragaman terinduksi selama fase kultur jaringan. Keragaman somaklonal terdiri dari dua tipe yaitu: heritabel dan epigenetik. Keragaman heritabel adalah keragaman yang stabil dan diwariskan melalui siklus seksual maupun propagasi akseksual yang berulang, sementara keragaman epigenetik bersifat tidak stabil (Skirvin et al. 1994).
Keragaman yang timbul akibat induksi pada kultur in vitro lebih sering terjadi dan mudah diamati, karena varian diperoleh dari tempat yang terbatas dan dalam waktu singkat. Keragaman somaklonal dapat berupa defisiensi klorofil, mutasi gen tunggal, poliploidi, perubahan kromosom, modifikasi hasil, kualitas, ketahanan penyakit, atau kadang-kadang muncul keragaman yang sebelumnya tidak pernah ada di alam (Ahloowalia 1986).
Pada era tahun 1980-an sampai 1990-an, berbagai keberhasilan dalam peningkatan kualitas tanaman budidaya melalui induksi keragaman somaklonal sudah banyak dilaporkan (Veilleux & Johnson 1998). Berbagai perubahan dapat terjadi selama kultur in vitro, mulai dari penampilan morfologi, sifat genetik atau epigenetik,
kariotik, fisiologis, biokimia dan perubahan pada tingkat molekular lainnya (Bajaj 1992).
Timbulnya keragaman genetik selama proses kultur in vitro dipengaruhi oleh faktor internal maupun eksternal (Karp 1991). Faktor internal yang berpengaruh antara lain genotipa tanaman, sumber eksplan yang digunakan, dan tingkat ploidi (Karp 1991; Peschke & Phillips 1992; Chowdhury et al. 1994). Semakin rendah tingkat ploidi, semakin stabil suatu genotip tanaman selama proses kultur in vitro. Sedangkan faktor eksternal adalah komposisi media, zat pengatur tumbuh (ZPT) serta proses regenerasi seperti fase kalus dan periode kultur terutama dalam fase kalus (Karp 1991; Veilleux & Johnson 1998). Pada umumnya tahapan regenerasi melalui proses pembentukan kalus akan menginduksi variasi genetik. Penggunaan auksin kuat yang menginduksi kalus seperti 2,4-D dan Dicamba, pada konsentrasi tinggi dan periode kultur yang panjang terbukti menimbulkan keragaman somaklonal yang relatif signifikan (Veilleux & Johnson 1998).
Keragaman somaklonal yang ditunjukkan dengan sifat fenotif akibat proses in vitro kultur jaringan, melibatkan perubahan genetik seperti aberasi kromosom, gen amplifikasi dan deamplifikasi, mutasi gen tunggal, ekspresi multi gen famili, mobilisasi elemen trasposisi, dan metilasi DNA (Peschke & Phillips 1992). Induksi keragaman somaklonal pada tingkat morfologi dan beberapa karakter kuantitatif terbukti dapat memperbaiki sifat agronomis penting pada beberapa tanaman budidaya seperti bunga matahari, Cyclamen, gandum, kentang, krisan, padi dan tomat (Van den Bulk et al. 1990; Wattanasiri & Walton 1993; Antonetti & Pinon 1993; Kawata et al. 1995; Symillides et al. 1995; Dillen et al. 1996; Wallner et al. 1996).
Penyakit Layu Bakteri (Ralstonia solanacearum)
Penyakit layu bakteri disebabkan oleh Ralstonia solanacearum yang dahulu dikenal sebagai Pseudomonas solanacearum merupakan salah satu kendala utama dalam budidaya jahe. Serangan penyakit layu bakteri pada suatu areal pertanaman jahe dapat menyebabkan semua tanaman di areal tersebut terinfeksi dengan cepat dapat mengakibatkan kegagalan panen.
Bakteri Ralstonia solanacearum berbentuk batang, mempunyai satu atau beberapa flagel poler (lofotrik), koloni putih atau kuning. Membentuk pigmen yang larut dalam air, berwarna hijau kebiru-biruan atau hijau kekuning-kuningan. Tidak membentuk spora, bereaksi gram negatif dengan kandungan DNA (G + C ) 58-70 mol % (Semangun 1996).
Suhu optimum untuk perkembangan bakteri R. solanacearum berkisar antara 270C - 370C, sedangkan pada suhu 150 C bakteri ini kurang berkembang. Selain faktor suhu udara, faktor yang tidak kalah pentingnya adalah kelembaban tanah dan suhu tanah. Akiew (1985) diacu dalam Yusriadi (1988) menyatakan bahwa populasi R. solanacearum akan menurun tajam dengan meningkatnya suhu temperatur tanah dan menurunnya kelambaban tanah. Sebaliknya, pada kelembaban tanah yang tinggi dan suhu yang rendah, bakteri ini menunjukkan kemampuan bertahan hidup untuk jangka waktu yang lama.
Bakteri ini menyerang lebih dari 200 spesies tanaman, khususnya famili tanaman yang tumbuh di wilayah tropik dan subtropik. Tanaman yang rentan terhadap serangan potogen ini antara lain ; jahe, kentang, tomat, tembakau, terong, cabai, pisang dan kacang tanah.
Tanaman inang bakteri R solanacearum antara lain temumangga, temuputih, tomat, terung, nilam, tembakau, kacang tanah, kacang hijau, kedelai, kacang asu, tapak dara, kenaf, rosella, hortensia, kembang biru, ubi kayu, kemuning, tomat, cabai, kentang, kacang panjang, kembang kertas, wijen, turi, takokak, Beberapa jenis gulma antara lain babadotan, meniran, ceplukan, Commelina sp., Spigelia anthelmia, Erechtites sp., dan krokot (Supriadi 1997).
Penyakit layu bakteri dilaporkan telah menimbulkan kerugian pada pertanaman jahe di India, Amerika Serikat (Hawai), Australia, Afrika, Mauritius, Filipina, Thailand, Malaysia dan Indonesia. Di Indonesia serangan bakteri R. solanacearum dapat menimbulkan kerugian hasil lebih dari 90%. Penyakit ini pertama kali ditemukan di Kuningan Jawa Barat pada tahun 1971. Saat ini telah menyebar ke daerah sentra produksi jahe antara lain Sumatera Utara, Bengkulu, Jambi, Lampung,
Jawa Barat dan Jawa Tengah (Harmono 2005 ; Supriadi et al. 2000 ; Sitepu 1991; Asman & Hadad 1989).
Tanaman jahe biasanya mulai menunjukkan gejala layu bakteri pada umur 3 bulan. Gejala pertama adalah daun menguning dan menggulung, dimulai dari daun yang lebih tua kemudian diikuti daun yang lebih muda, selanjutnya sampai semua helai daun kuning dan mati. Gejala menguning pada daun biasanya dimulai dari pinggir daun kemudian menyebar ke seluruh helai daun. Pada bagian pangkal batang terlihat gejala cekung basah dan garis-garis hitam atau abu-abu sepanjang batang. Pada tahap perkembangan gejala demikian, batang mudah dicabut dari bagian rimpang. Kalau potongan pangkal batang atau rimpang dipijit dengan tangan akan keluar eksudat bakteri berwarna putih susu. Kerusakan yang ditimbulkan bervariasi antara ringan sampai berat, tergantung dari beberapa hal seperti : umur tanaman terserang, curah hujan, mutu benih rimpang, dan tingkat pencemaran tanah.
Bakteri R. solanacearum memiliki banyak strain. Pendekatan yang dilakukan untuk mendeteksi strain ini dilakukan dengan dua cara: 1) pendekatan berdasarkan inang utama disebut ras, dan 2) pendekatan kedua berdasarkan kemampuan mengoksidasi beberapa jenis sumber karbon, disebut biovar. Menurut Persley et al. (1985), R. solanacearum terbagi atas lima Ras, yakni Ras 1 (Solanaceous strain) menyerang tanaman famili solanaceae dan Leguminoceae, Ras 2 (Musaceous strain), hanya menyerang pisang, Ras 3 (potato Strain) menyerang tanaman kentang, Ras 4 (Gingger strain) yang menyerang tanaman jahe dan Ras 5 (Mulberry strain) yang menyerang tanaman mulberry.
Pengendalian terhadap penyakit layu bakteri pada jahe terbukti sangat sulit untuk dilakukan. Pengendalian secara kimia kurang efektif dan mahal. Cara yang mungkin dilakukan adalah dengan merotasi tanaman dan tidak menanam jahe pada lahan yang sama.
Aplikasi Tehnik In Vitro Untuk Sifat Ketahanan Tanaman
Seleksi in vitro merupakan salah satu metode menginduksi variasi somaklonal. Teknik ini lebih efektif dan efisien karena perubahan sifat lebih terarah kepada sifat yang diinginkan, seperti memberikan tekanan seleksi dalam media kultur atau dengan memberikan kondisi tertentu agar diperoleh somaklon-somaklon dengan sifat yang diiginkan. Pada berbagai tanaman, seleksi in vitro telah terbukti dapat menghasilkan varietas baru yang tahan penyakit dan sifat tersebut diwariskan pada turunannya (Van den Bulk, 1991).
Seleksi tanaman secara in vitro memiliki beberapa kelebihan yaitu; waktu yang relatif lebih singkat, biaya lebih murah, tidak memerlukan lahan yang luas, tidak menimbulkan masalah pada lingkungan, dapat dilakukan pada populasi sel, kalus dan tunas yang banyak dalam waktu yang relatif lebih singkat dan seleksi dilakukan pada kondisi yang terkontrol (Samanhudi 2001; Wattimena et al. 2001).
Kesulitan utama yang sering dihadapi pada seleksi galur sel untuk menghasilkan tanaman yang resisten adalah ketidak stabilan akibat perubahan genetik yang singkat atau adaptasi epigenetik. Untuk itu perlu dilakukan seleksi bertingkat dalam waktu tertentu sampai diperoleh galur sel yang stabil (Gonzales & Widholm 1991). Dengan seleksi bertingkat diharapkan sel atau jaringan akan lebih meningkat sifat ketahanannya dibandingkan seleksi satu tahap. Disamping itu dengan adanya pengulangan seleksi, sel atau jaringan normal yang lolos pada seleksi tahap pertama dapat dihambat perkembangannya pada seleksi tahap kedua. Hal ini akan meningkatkan efektifitas seleksi dan akan menurunkan kemungkinan adanya kesalahan dalam mengidentifikasi.
Hemon (2006) menyatakan seleksi berulang mempunyai potensi lebih besar untuk menghadirkan perubahan genetik dibandingkan seleksi yang hanya dilakukan dalam jangka pendek. Selain itu, seleksi in vitro berulang menyebabkan hilangnya beberapa karakter varian karena adanya tekanan seleksi in vitro. Sehingga diharapkan varian yang muncul akan lebih sesuai dengan tekanan seleksi yang diinginkan.
Dalam dua puluh tahun terakhir, lebih dari 100 publikasi tentang peningkatan ketahanan terhadap 40 patogen melalui seleksi in vitro pada 30 spesies tanaman
sudah dilakukan (Svabova & Labuda 2005). Induksi variasi somaklonal dan seleksi in vitro telah digunakan untuk menghasilkan galur tanaman yang resisten terhadap penyakit (Borras et al. 2001).
Pada tanaman seledri, induksi keragaman somaklonal melalui kultur kalus in vitro dengan penambahan filtrat jamur Septoria apiicola selama 7 - 10 hari periode kultur, menghasilkan varian baru (somaklon) yang tahan terhadap patogen tersebut (Evenor et al. 1994). Hasil yang sama juga ditunjukkan pada seleksi in vitro pada tanaman tahunan Populus sp. dengan menggunakan medium selektif filtrat S. musiva (Ostry & Skilling 1988). Induksi ketahanan terhadap patogen pada kultur kalus geranium in vitro dengan mengaplikasikan 4% - 20% filtrat jamur patogen (Altenaria alternata) juga memberikan hasil yang cukup signifikan dalam upaya memperoleh kultivar geranium baru tahan terhadap patogen tersebut (Saxena et al. 2007).
Purwati (2007), berhasil mendapatkan tanaman abaka yang imun, tahan, dan agak tahan terhadap F.oxysporium dengan menyeleksi secara in vitro dengan menggunakan filtrat kultur sebagai agens penyeleksi. Sementara Yusnita (2005) berhasil mendapatkan beberapa galur kacang tanah (Arachis hypogea L.) yang resisten terhadap penyakit busuk batang (Sclerotium rolfsii Sacc.) melalui seleksi in vitro.
Meskipun filtrat atau toksin bakteri R. solanacearum belum pernah diaplikasikan sebagai medium selektif untuk seleksi in vitro, pada jenis bakteri lain seperti Clavibacter michiganensis dan Pseudomonas syringae, seleksi in vitro dengan menggunakan toksin maupun filtrat sebagai agen seleksi, terbukti menghasilkan somaklon tomat dan protoklon tembakau yang tahan terhadap patogen tersebut (Svabova & Labuda 2005).
Asam Salisilat
Sejak 1933, telah banyak publikasi yang menyatakan bahwa tanaman akan memberikan perlindungan terhadap infeksi sekunder. Namun baru tahun 1960 Ross melakukan penelitian yang hasilnya memperlihatkan adanya infeksi lokal tanaman tembakau pada Tobacco Mosaic Virus (TMV), yang disebutnya sebagai Response systemic acquired resistence (SAR) (Delaney 2004).
Salah satu senyawa yang dibutuhkan dalam jalur signal transduksi untuk induksi SAR (Systemic Acquired Resistence) dalam mekanisme ketahanan penyakit adalah asam salisilat. Asam salisilat pertama kali ditemukan oleh White pada tahun 1979 yang melakukan penelitian pada tanaman tembakau. Hasilnya memperlihatkan aspirin (acetylsalycilic acid) dapat menginduksi ketahanan pada tembakau (Delaney 2004).
Tumbuhan akan mengembangkan serangkaian respon terhadap sejumlah signal dari lingkungan, serangan patogen maupun signal dari lingkungan agar dapat mengendalikan pertumbuhan dan perkembangan tanaman. Beberapa penelitian terdahulu memperlihatkan bahwa sejumlah tanaman ketika melawan serangan mikroba, fungi, patogen dan herbivora, memproduksi lebih banyak senyawa kimia pelindung seperti ; asam salisilat, 2,6-dicloroisonocotinic acid, benzo (1,2,3)-thiadiazole-7-carbothioic acid s-methyl ester, mercuric choride (Van 1999 ; Vernooij et al. 1994 ; Gorlach et al. ; Moris et al. 1998 ; De Tapia et al. 1986 Diacu dalam Fernandes et al. 2006).
Asam salisilat merupakan salah satu senyawa yang mengindikasikan respon pertahanan tanaman yang telah dibuktikan dengan baik oleh Gaffney et al. (1993). Mereka menggunakan tanaman transgenik tembakau yang dapat mengekspresikan gen Nah, yang berfungsi mengkode enzim hidroksilase yang diisolasi dari Pseudomonas putida yang dapat mengkonversi asam salisilat menjadi kotekol. Akibatnya tanaman transgenik tersebut tidak mampu mengakumulasi asam salisilat dan menghambat pembentukan PR-protein (Patogenitas related protein) yang bisa digunakan untuk melawan infeksi patogen.
Di dalam tanaman, asam salisilat tersedia dalam bentuk asam bebas dan metabolit terkonjugasi melalui metilasi, hidroksilasi, dan glukosilasi. Asam salisilat yang disintesis pada tembakau setelah diinokulasi TMV akan terglukosilasi dan termetilasi. Konjugat asam salisilat terglukosilasi memiliki bentuk 2- 0 –β-D-glukosida (SAG) dan glukosil salisilat (GS), dan metil asam salisilat (MSA) yang bersifat votil. Pembentukan senyawa asam salisilat terkonjugasi, asam salisilat dan SAG, dirangsang oleh adanya infeksi patogen dan aplikasi asam salisilat eksogen (Enyeni et al 1992; Lee & Raskin 1999 di dalam Purwanto 2007).
Hidrogen peroksidase (H2O2) diduga merupakan signal bagi sintesis asam
salisilat. Pengaruh oksidatif yang cepat akan terjadi akibat invasi patogen sehingga terjadi peningkatan konsentrasi H2O2 dan senyawa oksigen reaktif lainnya yang menginduksi respon hipersensitif (HR). Kondisi ini berpengaruh pada konsentrasi Asam benzoate (BA) bebas dan aktivitas Asam benzoat 2- hidroksilase (BA2H). Sebagai konsekuensinya konsentrasi asam salisilat akan meningkat (Leon et al 1995; Klessig et al 2000 didalam purwanto 2007).
Beberapa penelitian memperlihatkan bahwa asam salisilat merupakan senyawa yang dibutuhkan dalam proses pensignalan SAR. Hal ini dibuktikan dengan adanya peningkatan konsentrasi asam salisilat pada tanaman tembakau dan ketimun setelah diinfeksi patogen. Penelitian Kubota & Nishi (2005) menunjukkan bahwa pada tanaman ketimun (Cucumis sativus) kandungan asam salisilat pada hipokotil dan akar meningkat secara nyata setelah dinduksi dengan patogen antracnose (Colletotrichum lagenarium). Sementara pada penelitian Palva et al. (1994) pada tanaman tembakau menunjukkan bahwa tembakau berumur 2 - 3 minggu yang diperlakukan dengan asam salisilat 1mM pada medium kultur tanaman, menjadi tahan terhadap inokulasi patogen Erwinia carotovora subsp. carotovora. Dari beberapa penelitian terdahulu dapat dinyatakan bahwa ada korelasi antara konsentrasi asam salisilat dengan peningkatan ketahanan tanaman terhadap penyakit.