Waktu dan Tempat Penelitian
Penelitian ini berlangsung dari bulan Januari 2010 sampai dengan Januari 2011. Penelitian ini dilakukan di Laboratorium Embriologi Departemen Anatomi Fisiologi dan Farmakologi dan UPT Hewan Laboratorium Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Bahan Penelitian
Penelitian ini menggunakan mencit putih (Mus musculus albinus) betina sebanyak 43 ekor dan jantan sebanyak 7 ekor (strain DDY, Biofarma, Bandung) berumur 8-10 minggu yang berasal dari koloni bebas penyakit.
Metode Penelitian
Penelitian ini melibatkan beberapa prosedur kerja, yaitu meliputi: a. Superovulasi
b. Koleksi zigot
c. Vitrifikasi Menggunakan Wadah Hemi-straw
d. Penghangatan (warming) Embrio e. Kultur In Vitro
f. Evaluasi Viabilitas g. Pewarnaan Vital
Superovulasi
Mencit betina dirangsang folikulogenesis ovariumnya dengan menyuntikkan hormon pregnant mare’s serum gonadotropine (PMSG) (Folligon®, Intervet, Boxmeer, Holland) 5 IU secara intraperitoneum. Setelah 48 jam penyuntikan PMSG, dilakukan penyuntikan hormon human chorionic gonadotropine (hCG) (Chorulon®, Intervet, Boxmeer, Holland) 5 IU secara intraperitoneum untuk menggertak ovulasi. Selanjutnya setiap mencit betina tersebut dikawinkan dengan mencit jantan dengan perbandingan satu ekor jantan : satu ekor betina (single mating). Pemeriksaan sumbat vagina (vaginal/copulation plug) dilakukan pagi hari berikutnya untuk memastikan mencit tersebut telah kawin.
Koleksi Zigot
Mencit betina yang memperlihatkan sumbat vagina dipisahkan dari mencit jantan ke dalam kandang individu. Hari terlihat adanya vaginal plug, ditandai sebagai hari kebuntingan pertama. Koleksi zigot dilakukan 16 – 18 jam setelah penyuntikan hormon hCG. Mencit betina bunting dimatikan dengan cara dislokasio cervicalis. Bagian oviduk atau tuba Falopii diisolasi dan ditempatkan pada medium dulbecco’sphosphate buffered saline (DPBS, Gibco, BRL, USA) yang telah diberi fetal bovine serum (FBS) 2% dan gentamisin 50µg/ml, yang selanjutnya disebut modified phosphate buffered saline (mPBS).
Bagian oviduk yang menggembung disayat dengan menggunakan jarum suntik 26G. Sambil diamati di bawah mikroskop stereo, zigot yang masih dikelilingi oleh sel-sel kumulus ooforus selanjutnya diinkubasi di dalam medium yang mengandung enzim hyaluronidase 0.3 mg/ml untuk memutus ikatan antara sel-sel kumulus ooforus sehingga zigot dapat dikoleksi dan dievaluasi. Kemudian, zigot tersebut dibilas dengan cara merendamnya berturut-turut 2-3 kali di dalam medium mPBS. Zigot dengan sitoplasma utuh dan homogen (viable) dikoleksi dan dihitung jumlahnya.
Vitrifikasi Menggunakan Wadah Hemi-straw
Vitrifikasi tunggal dilakukan masing-masing pada embrio tahap zigot (VZ) dan embrio tahap blastosis (VB), sedangkan vitrifikasi ganda (VZB) dilakukan pada embrio yang sama, yaitu tahap zigot, kemudian di kultur in vitro sampai mencapai tahap blastosis dan divitrifikasi kembali (ganda) selanjutnya di kultur in vitro sampai mencapai tahap blastosis hatched. Proses vitrifikasi meliputi: (a) ekuilibrasi, yaitu proses pergantian cairan sitoplasma dengan larutan krioprotektan melalui proses difusi ke dalam sel sehingga ruang perivitelin terlihat tampak lebih longgar, (b) pembekuan, tahapan pada saat embrio dan larutan berada dalam nitrogen cair (-196°C), (c) penghangatan yaitu tahap terjadinya perubahan kembali bentuk padatan menjadi cair, serta (d) rehidrasi, yaitu proses masuknya kembali air ke dalam sel untuk menggantikan kedudukan krioprotektan.
Hemi-straw yang digunakan untuk melakukan vitrifikasi berupa straw
0.25 ml (EcoPaillette®, Minitüb GmbH, Tiefenbach, Germany) yang digunakan pada proses pembuatan semen beku. Ujung straw disayat
sepanjang 1 cm untuk meletakkan embrio dalam droplet kecil yang berukuran <1.0 µl di atas permukaan straw tersebut. Hemi-straw sebagai wadah embrio tersebut merupakan modifikasi hemi-straw seperti yang digunakan oleh Vandervorst et al. (2001).
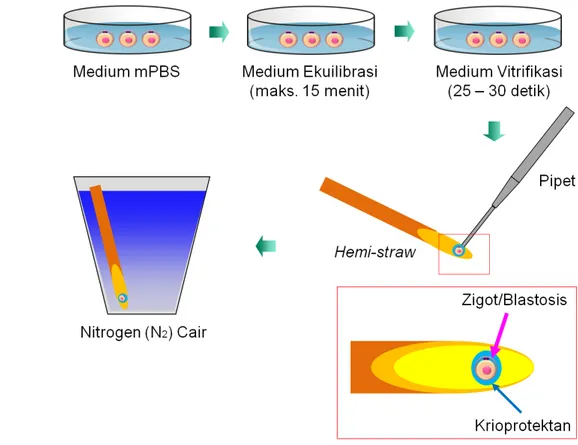
Medium dan metode vitrifikasi serta penghangatan (warming) yang digunakan dalam penelitian ini berdasarkan metode yang telah dilaporkan oleh Boediono (2005) (Gambar 1). Embrio tersebut ditempatkan pada medium ekuilibrasi yang mengandung etilen glikol (EG) 10% (Sigma, St Louis, USA) dengan PBS yang ditambahkan fetal bovine serum (FBS) 20%, maksimal 15 menit, atau hingga embrio kembali ke bentuk semula (re-ekspansi). Embrio kemudian dipindahkan dalam medium vitrifikasi yang mengandung dimetilsulfoksida (DMSO) 15% (Sigma, St Louis, USA), EG 15%, sukrosa 0.5M dan FBS 20%.
Gambar 1 Prosedur vitrifikasi menggunakan wadah hemi-straw (Boediono 2005).
Proses perlakuan embrio pada medium vitrifikasi tidak lebih dari 25-30 detik, waktu tersebut terhitung sejak awal pemaparan sampai penyimpanan pada ujung straw. Sebanyak 1-2 embrio diteteskan pada ujung straw 0.25 ml yang telah disayat. Embrio yang terdapat pada hemi-straw diuapi dengan
nitrogen cair selama 10 detik dan langsung dimasukkan ke dalam nitrogen cair yang bersuhu -196°C dengan posisi vertikal sehingga diperoleh derajat pendinginan yang cukup tinggi.
Penghangatan (warming) Embrio
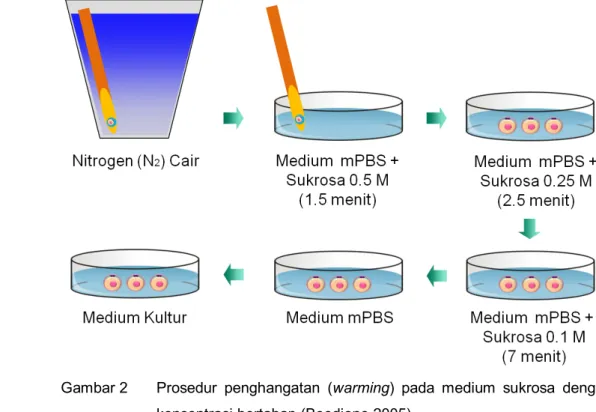
Hemi-straw berisi embrio yang telah divitrifikasi dikeluarkan dari nitrogen cair dan didiamkan dalam uap nitrogen cair selama 5-10 detik, kemudian dilakukan proses penghangatan pada suhu kamar. Proses ini dilakukan dengan mencelupkan hemi-straw tersebut ke dalam medium mPBS yang mengandung FBS 20% dan larutan sukrosa 0.5M selama 1.5 menit. Embrio akan segera jatuh dari hemi-straw ke larutan tersebut. Embrio tersebut dipindahkan ke medium mPBS yang mengandung sukrosa 0.25M, kemudian 0.1M, masing-masing selama 2.5 menit dan 7 menit. Selanjutnya embrio dicuci 2-3 kali dalam medium mPBS dan medium kultur (Gambar 2).
Gambar 2 Prosedur penghangatan (warming) pada medium sukrosa dengan
Kultur In Vitro
Embrio yang telah dilakukan penghangatan selanjutnya dikultur untuk mengetahui viabilitas setelah divitrifikasi. Medium kultur yang digunakan pada penelitian ini adalah medium kultur sekuensial ISM1TM (Origio, Jyllinge, Denmark) yang berfungsi memberikan nutrisi pada embrio tahap zigot sampai 8 sel dan medium kultur ISM2TM (Origio, Jyllinge, Denmark) untuk perkembangan embrio tahap 8 sel sampai blastosis hatched. Sebanyak 3-5 embrio ditempatkan pada cawan petri (NuncTM, Roskilde, Denmark) yang berisi tetesan-tetesan (drops) dalam 10µl medium kultur yang telah ditutupi dengan minyak mineral (Mineral Oil, Sigma, St Louis, USA) untuk mencegah penguapan medium dan kontaminasi selama kultur. Kemudian, dikultur dalam inkubator CO2 5% pada suhu 37°C.
Evaluasi Viabilitas
Pengamatan terhadap viabilitas embrio dilakukan setelah divitrifikasi. Penilaian kelangsungan hidup (survival rate) didasarkan pada keadaan morfologis embrio setelah dua jam penghangatan (warming) dan pengeluaran krioprotektan (Liebermann & Tucker 2002). Daya tahan hidup embrio secara umum dinilai berdasarkan keutuhan morfologi, re-ekspansi dan perkembangan embrio ke tahap lebih lanjut (Takahashi et al. 2005). Pewarnaan Vital
Sebagian kecil dari embrio yang telah divitrifikasi tersebut dipilih secara acak untuk diwarnai dengan Hoechst (Bisbenzimide H 33342, Sigma, St Louis, USA) dan propidium iodide (Wako, Osaka, Japan) (Saha et al. 1996), guna melihat sel-sel embrio yang mati dan yang hidup setelah vitrifikasi. Embrio diinkubasi di dalam larutan DPBS yang mengandung
Hoechst (10 µg/ml) dan propidium iodide (PI, 10 µg/ml) selama 10 menit dalam suasana gelap. Selanjutnya, embrio dicuci pada larutan DPBS yang disuplementasi FBS 20%. dan diteteskan ke atas gelas objek dan ditutup dengan gelas penutup. Pemeriksaan dilakukan di bawah mikroskop fluoresens (Nikon Eclipse E600, Japan) dengan panjang gelombang 330- 380 nm. Inti sel yang berwarna biru (positif Hoechst) menunjukkan sel dalam keadaan hidup, sedangkan yang berwarna merah (positif PI) menunjukkan sel yang mati.
Rancangan Percobaan
Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (complete random design). Penelitian ini terdiri atas kelompok kontrol (kontrol negatif), kelompok vitrifikasi tunggal (kontrol positif) dan kelompok vitrifikasi ganda. Kelompok kontrol adalah kelompok embrio yang dikultur pada tahap zigot sampai blastosis hatched tanpa divitrifikasi. Kelompok vitrifikasi tunggal adalah vitrifikasi embrio yang hanya dilakukan satu kali, masing-masing pada tahap zigot (VZ) dan tahap blastosis (VB). Kelompok vitrifikasi ganda (VZB) adalah vitrifikasi embrio yang dilakukan dua kali, yaitu pada tahap zigot dan dilanjutkan pada tahap blastosis. Vitrifikasi ganda hanya dilakukan pada zigot yang mampu berkembang menjadi blastosis setelah kultur in vitro.
Respon yang diamati adalah viabilitas embrio tahap zigot dan blastosis setelah vitrifikasi, baik vitrifikasi tunggal maupun vitrifikasi ganda. Viabilitas embrio meliputi kelangsungan hidup (survival rate) dan keberhasilan perkembangan setiap tahapan embrio (development rate). Penilaian kelangsungan hidup (survival rate) didasarkan pada keadaan morfologis embrio setelah dua jam penghangatan (warming) dan pengeluaran krioprotektan (Liebermann & Tucker 2002). Selain itu, viabilitas embrio dapat diketahui dengan pewarnaan vital, guna melihat sel-sel embrio yang mati dan yang hidup setelah vitrifikasi (Saha et al. 1996).
Penilaian kemampuan perkembangan embrio (developmental rate) didasarkan pada kemampuan embrio berkembang ke tahapan selanjutnya, baik setelah penghangatan maupun yang tidak dihangatkan (kontrol). Pengamatan perkembangan setiap tahapan embrio dilakukan pada jam ke 24, 48, 72, 96 dan 120 dengan menggunakan mikroskop inverted (Olympus IX70 Japan) setelah kultur in vitro. Perkembangan embrio yang diamati adalah mulai dari tahap zigot,
cleavage (2 sel, 4 sel dan 8 sel), morula, blastosis dan blastosis hatching dan blastosis hatched (embrio telah keluar dari zona pelusida).
Analisis Data
Data disajikan dalam bentuk persentase dan dianalisis dengan sidik ragam (Anova). Perbedaan antarperlakuan diuji dengan uji perbandingan berganda Duncan (DMRT, Duncan Multiple Range Test) (Mattjik & Sumertajaya 2006). Semua perhitungan statistik dilakukan menggunakan perangkat lunak SPSS ver. 17.0.